MİYOKARD ENFARKTÜSÜ (MI) İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
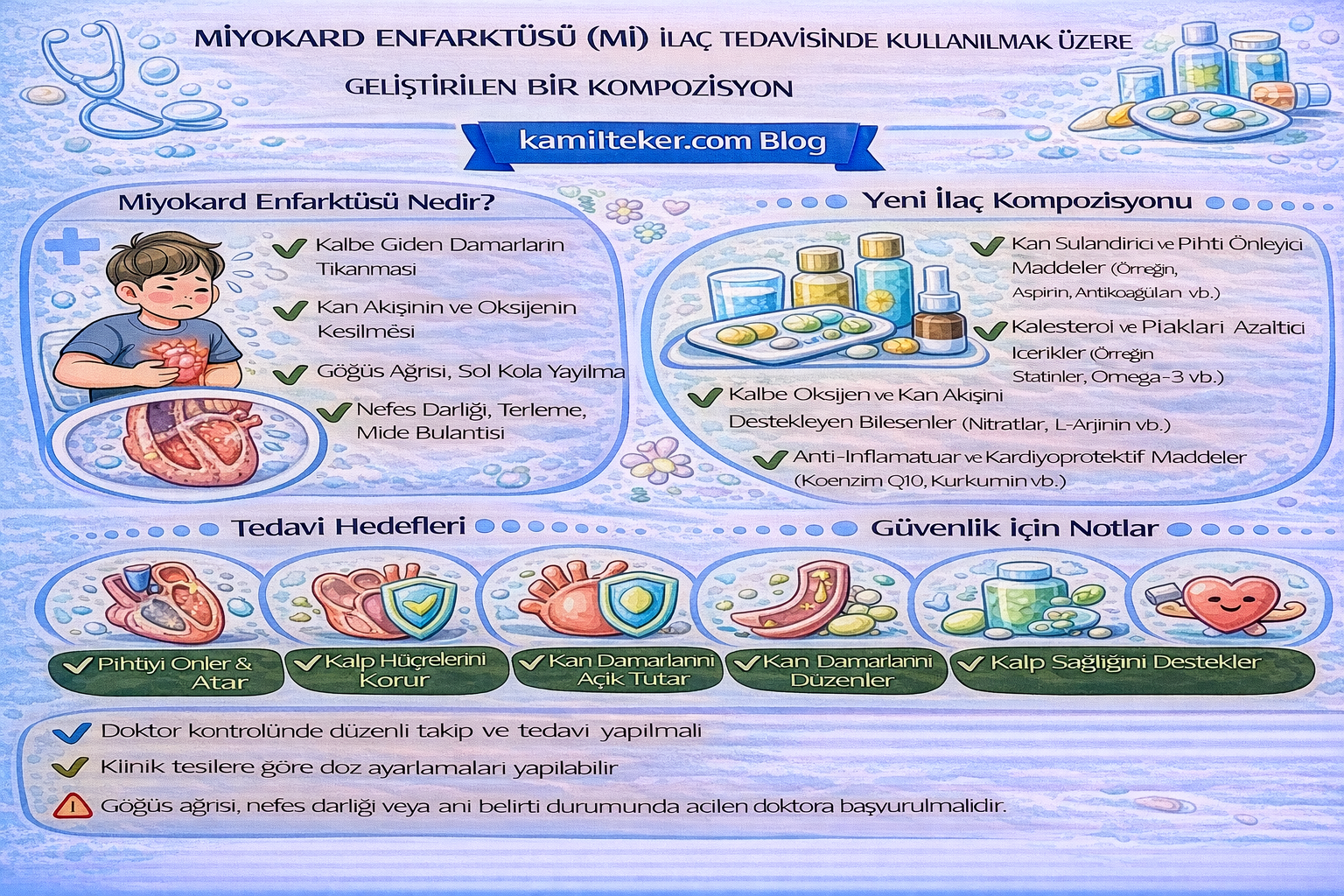
MİYOKARD ENFARKTÜSÜ (MI) İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Buluş; MI ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Gameprost (1) 2x1, Methocarbamol (2) 1x1, ACE inhibitör (3) 1x1, Beta-bloker (4) 1x1, Asetilsalisilik asit (5) 1x1ve Nitrogliserin (6) 1x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Miyokard enfarktüsü (MI), koroner arterlerde aterosklerotik plak rüptürü ve trombüs oluşumu sonucu gelişen, kalp kasının oksijenlenme yetersizliği ile nekroza uğramasıdır. Dünyada en sık görülen kardiyovasküler acillerden biridir ve yüksek mortalite-morbiditeye yol açar. Erken tanı ve hızlı tedavi, yaşam kurtarıcıdır.
Miyokard İnfarktüsü tedavisinde kullanılan ilaçlar ve dozları:
1. Gemeprost 2X1
2. Methocarbamol 1X1
3. ACE inhibitörleri (herhangi biri olabilir) 1x1
4. Beta-bloker 1x1
5. Aspirin 1x200 mg
6. Nitrogliserin +/- (verilebilr /verilmeyebilir sonuç değişmez)
7. Dengeli Serum verilmeli, hipotansiyon önlenmeli.
Miyokard İnfarktüsü ilaç tedavisi özellikleri
1. Tedavide beş ilaç beraber kullanılmaz
2. İlaçları rastgele iki gruba ayır.
3. Her bir grubu sırayla 7 günde bir dönüşümlü değiştirerek kullan
4. Tedavi süresi 1,5 – 3 ay yeterli olur.
5. Geç dönemde (eski MI vakaları) olsa da aynı tedavi protokolü verilmeli.
6. Tedavi başarı beklentisi % 90 – 100.
Miyokard İnfarktüsü ilaç tedavisine destek tedaviler:
1. Anjiyo yapılmalı / yapılabilir
2. Stent veya balona gerek yok
3. Mefenamik asit verilebilir; bir ay 2x1 sonra iki ay 1x1 dozunda olabilir.
4. Doktor Teker Ballı RMD-1 ve RMD-2 gıda kürü ilaç tedavisinden 3 ay sonra mutlaka kullanılmalı. Hastanın ihtiyacına göre gerekirse bitkisel gıda destek kür tekrarlanmalı. Gerekirse anjiyo yapılarak değerlendirilmeli.
5. Arterioskleroz ilaç tedavisi ilaç tedavisini bittikten sonra mutlaka verilmelidir
6. Kriz anında öksürtme geçerli
7. Ozon tedavisi ilaç tedavisi bittikten sonra 5 -8 seans verilebilir.
8. Akupunktur geçersiz
9. Mikrosirkülasyon olabilir
10. Bizorezonans geçersiz
11. Manuel terapi geçersiz
12. Tıbbı masaj: Doktor Teker Masaj Kremi olabilir, omurgada kireçlenme varsa.
13. Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
14. Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
15. Fasya sertliği ilaç tedavisi proloterapi ve mezoterapiden sonra verilebilir
16. Eklem ve vücut kireçlenme ilaç tedavisi fasya sertliği ilaç tedavisinden sonra verilebilir.
Miyokard İnfarktüsü tedavisinde kullanılan ilaçların gruplandırılması:
Grup 1 – Akut Stabilizasyon ve Hemodinamik Destek
Nitrogliserin, Aspirin ve Beta-blokerlerden oluşan bu üçlü yaklaşım, özellikle konjestif kalp yetmezliği (KKY) ile komplike olmuş akut miyokard enfarktüsünün ilk saatlerinde hayat kurtarıcıdır. Bu dönemde amaç, miyokardın oksijen dengesini hızlıca düzeltmek, trombüs progresyonunu engellemek ve ölümcül aritmilerin gelişmesini önlemektir.
Nitrogliserin, venodilatasyon yoluyla preload’u azaltırken, arteriyel dilatasyonla afterload’u da düşürür. Bu hemodinamik rahatlama, sol ventrikül duvar stresini azaltır, miyokardın oksijen tüketimini sınırlar ve nekrotik alanın büyümesini engeller. Ayrıca koroner arter spazmını çözerek reperfüzyon başarısına katkı sağlar. Güncel çalışmalar, nitrat tedavisinin sadece semptom kontrolü değil, aynı zamanda mikrosirkülasyonun iyileştirilmesi yoluyla reperfüzyon sonrası miyokardiyal kurtarma oranlarını artırdığını vurgulamaktadır.
Aspirin, COX-1 enzimini geri dönüşümsüz inhibe ederek tromboksan A2 üretimini durdurur. Bu mekanizma, trombosit aktivasyonunu baskılar ve akut dönemde yeni trombüs oluşumunu engeller. Böylece, koroner arter açıklığı korunur ve yeni tıkaç gelişme riski azalır. Çok sayıda meta-analiz, aspirin tedavisinin erken dönemde mortaliteyi anlamlı şekilde düşürdüğünü kanıtlamıştır.
Beta-blokerler, β1-adrenerjik reseptörleri bloke ederek kalp hızını ve kontraktiliteyi azaltır. Bu sayede oksijen tüketimi azalır, iskemik alan genişlemez. Ayrıca atriyoventriküler (AV) nodal iletimi yavaşlatarak ventriküler aritmilerin gelişimini baskılar. Erken dönemde başlanmaları, ani kardiyak ölüm riskini azaltmakta ve yeniden enfarktüs olasılığını sınırlamaktadır.
Sonuç olarak Grup 1 yaklaşımı, akut dönemde mortaliteyi belirgin şekilde azaltır, ventriküler yeniden şekillenmenin erken fazını baskılar ve semptom kontrolünü hızla sağlar. Bu akut baskılama, kronik evrede gelişecek yapısal bozulmanın şiddetini de sınırlayarak uzun vadeli korumaya zemin hazırlar.
Grup 2 – Uzun Dönem Koruma ve Yapısal Destek
ACE inhibitörleri, Gemeprost ve Methocarbamol’dan oluşan bu kombinasyon, KKY’nin ilerleyici doğasını baskılamak ve ventrikül fonksiyonlarını uzun vadede korumak amacıyla planlanmıştır. Buradaki hedef, yalnızca semptom kontrolü değil; aynı zamanda moleküler ve hücresel düzeyde yeniden yapılanmayı sınırlamaktır.
ACE inhibitörleri, anjiyotensin II üretimini engelleyerek RAAS’ı baskılar. Bu yalnızca kan basıncının düşmesini sağlamakla kalmaz; kardiyak fibroblast proliferasyonunu ve kollajen birikimini de azaltır. Bu sayede ventrikül duvarında geometri bozulması yavaşlatılır. Ek olarak, ACE inhibitörlerinin bradikinin düzeylerini yükselterek endotelyal nitrik oksit üretimini artırdığı ve mikrosirkülasyonu desteklediği gösterilmiştir. Güncel klinik çalışmalar, ACE inhibitörlerinin MI sonrası sağkalımı anlamlı ölçüde artırdığını doğrulamaktadır.
Gemeprost, bir prostaglandin analoğu olarak mikrosirkülasyonu iyileştirir. Endotel hücrelerinde nitrik oksit sentezini artırarak damar tonusunu düzenler, mitokondriyal ATP üretimini artırarak hücresel enerji dengesini korur. Ayrıca TGF-β/CTGF yolaklarını baskılayarak antifibrotik etki oluşturur. Bu mekanizma, sol ventrikül duvarının elastikiyetini korur ve fibrozisi sınırlar. Deneysel veriler, prostanoidlerin remodelleme sürecinde önemli rol oynadığını göstermektedir.
Methocarbamol, klasik bir kas gevşetici olmasına rağmen, GABAerjik transmisyonu destekleyerek merkezi sinir sisteminde sempatik aşırı aktiviteyi azaltabilir. Böylece stres kaynaklı katekolamin salınımı ve buna bağlı oksidatif yük azalır. Preklinik modellerde oksidatif stres belirteçlerini düşürdüğü, lipid peroksidasyonunu azalttığı rapor edilmiştir. Kronik dönemde bu mekanizma, miyokardiyal apoptozu sınırlayarak fonksiyon kaybını yavaşlatabilir.
Bu üçlü kombinasyon, kronik fazda fibrotik yeniden şekillenmeyi baskılar, ventrikül geometrisini korur, kardiyak debiyi uzun vadede stabil tutar. Ayrıca tekrarlayan dekompansasyon ataklarını azaltarak hastaların yaşam kalitesini ve sağkalımını artırır. Güncel tedavilere (ör. SGLT2 inhibitörleri) entegre edildiğinde metabolik ve mikrosirkülatuvar faydaları daha da güçlenebilir.
Genel Değerlendirme ve İleriye Bakış
Bu çift aşamalı strateji, Konjestif Kalp Yetmezliği (KKY) ve Miyokard Enfarktüsü (MI) tedavisinde paradigmayı yalnızca akut hayatta kalma hedefinden çıkararak, uzun vadeli kardiyak yeniden yapılanmanın aktif yönetimini de içeren bütüncül bir yaklaşıma dönüştürmektedir.
Grup 1 tedavi bileşenleri, akut fazın en kritik saatlerinde kardiyak yükü hızla düşürerek miyokardın oksijen talebini azaltır, iskemik alanın genişlemesini sınırlar ve reperfüzyon sağlanana dek hemodinamik dengeyi korur. Bu grup, trombosit aktivasyonu ve trombüs oluşumunu baskılayarak yeni iskemik olay riskini azaltır, aynı zamanda ventriküler aritmi gelişimini önleyerek ani kardiyak ölüm riskini düşürür. Böylece, akut faz mortalitesinde anlamlı azalma sağlanır ve sonraki kronik döneme daha sağlam bir zemin hazırlanır.
Grup 2 ise kronik dönemin sessiz ama yıkıcı mekanizmalarına odaklanır. RAAS aktivasyonu, oksidatif stres, nöroinflamasyon ve mikrosirkülasyon bozuklukları gibi KKY’nin ilerlemesinde rol oynayan temel patofizyolojik eksenleri hedef alarak ventriküler remodelling sürecini yavaşlatır. Bu sayede kardiyomiyosit kaybı, interstisyel fibrozis ve duvar sertliği gelişimi sınırlandırılır; sol ventrikül geometrisi korunur ve ejeksiyon fraksiyonundaki düşüş hızı yavaşlatılır. Ayrıca bu grup, mitokondriyal enerji üretimini destekleyerek miyokardın fonksiyonel rezervini artırır ve kalbin biyolojik yaşlanmasını geciktirir.
Bu iki aşamalı yapının teorik üstünlüğü, akut ve kronik fazları birbirinden kopuk değil, süreklilik içinde ele almasıdır. Erken dönemde miyokardı yükten korurken, geç dönemde hücresel yeniden yapılanmayı baskılayarak hem kısa vadeli hayatta kalım hem de uzun vadeli fonksiyonel iyileşme hedeflerini bütünleştirir.
Bununla birlikte, bu yaklaşım henüz konsept düzeyindedir ve klinik uygulanabilirliğinin ve güvenliğinin doğrulanabilmesi için geniş örneklemli, randomize, kontrollü klinik çalışmalara ihtiyaç vardır. Böyle çalışmalar, farklı hasta alt gruplarında (örneğin yaşlı hastalar, diyabetik popülasyon, düşük ejeksiyon fraksiyonlu bireyler) etkinlik ve tolerabilite profilini ortaya koyarak bu stratejinin gerçek potansiyelini belirleyecektir.
Bu bakış açısı, gelecekte KKY ve MI yönetimini sadece krizlere yanıt veren değil, hastalığın biyolojik temelini dönüştürmeyi hedefleyen proaktif bir tedavi paradigmasına taşıyabilir. Bu sayede, kardiyovasküler tıbbın odak noktası yalnızca yaşam süresini uzatmak değil, aynı zamanda kalbin hücresel sağlığını koruyarak yaşam kalitesini yükseltmek olacaktır.
Teorik Değerlendirme – 7 Günlük Dönüşümlü Kullanım Yaklaşımı
Konjestif Kalp Yetmezliği (KKY) ve Miyokard Enfarktüsü (MI) sonrası dönemde uygulanması öngörülen 7 günlük dönüşümlü tedavi protokolü, kalp yetmezliği tedavisinde klasik sürekli ilaç kullanım modelinin ötesine geçen yenilikçi bir paradigmayı temsil etmektedir. Bu yaklaşımda Grup 1 (akut hemodinamik destekleyiciler) ve Grup 2 (uzun dönem yapısal koruyucular) haftalık periyotlarla dönüşümlü olarak uygulanır. Böylece kalp, bir hafta boyunca yükten kurtarılırken, takip eden haftada doku düzeyinde onarım ve yeniden yapılanma desteklenir. Bu ardışık dinamik, kalbin çok boyutlu patofizyolojik ihtiyaçlarını bütüncül şekilde hedefler.
1. Reseptör Desensitizasyonunun Önlenmesi
Kardiyak farmakoterapide uzun süreli aynı reseptör eksenine yüklenme, zamanla reseptör duyarlılığında azalma (downregülasyon) ve farmakodinamik tolerans gelişimine yol açabilir. Örneğin, β-adrenerjik reseptörler, sürekli uyarı altında G-protein ilişkili internalizasyonla işlev kaybına uğrayabilirken; RAAS inhibitörlerinin sürekli baskısı da kompansatuar sempatik aktiviteyi artırabilir. Dönüşümlü kullanım, bu reseptör sistemlerine “dinlenme aralıkları” tanıyarak duyarlılığın korunmasına ve ilaç etkinliğinin uzun vadede sürdürülebilir olmasına katkı sağlar. Aynı zamanda kronik yan etki yükü (ör. hipotansiyon, elektrolit bozuklukları) azalır.
2. Çok Yönlü Hedefleme
Bu stratejinin en dikkat çekici yönü, kalbin farklı patofizyolojik eksenlerini zamansal olarak ayrıştırarak hedeflemesidir.
• Grup 1 haftasında; preload ve afterload baskılanarak miyokard oksijen talebi düşürülür, aritmi riski azaltılır ve akut hemodinamik stabilizasyon sağlanır.
• Takip eden Grup 2 haftasında ise; mitokondriyal enerji üretimi desteklenir, TGF-β/NF-κB kaynaklı fibrotik aktivite baskılanır ve endotelyal fonksiyon iyileştirilir.
Bu ardışıklık, kalbin eşzamanlı değil, ardışık olarak farklı eksenlerden iyileştirilmesini sağlayarak tedavinin biyolojik etkinliğini derinleştirebilir.
3. Adaptif Esneklik
Klinik seyir, KKY’de oldukça dalgalı olabilir: Bazı haftalar konjesyon ve taşikardi baskınken, bazı dönemlerde yorgunluk, egzersiz intoleransı ve fibrotik ilerleme ön plandadır. 7 günlük rotasyon, bu değişken tabloya karşı dinamik bir adaptasyon mekanizması oluşturur. Akut alevlenme eğilimi olduğunda Grup 1 ağırlık kazanabilir, semptomlar yatıştığında Grup 2 ile hücresel düzeyde iyileşme süreci desteklenebilir. Böylece tedavi katı bir protokol olmaktan çıkıp, biyolojik duruma uyarlanabilir yaşayan bir stratejiye dönüşür.
4. Yan Etki Birikiminin Sınırlandırılması
Uzun süreli çoklu ilaç kullanımı, sıklıkla hipotansiyon, aritmi, elektrolit dengesizlikleri veya renal disfonksiyon gibi yan etki kümelerine yol açabilir. Dönüşümlü sistem, her ilaç grubuna düşük kümülatif maruziyet sağladığı için bu riskleri azaltır. İlaca ara verilmesiyle organizma homeostatik rezervini toparlayabilir ve toksisite eşiği aşılmadan terapötik etki sürdürülebilir.
Stratejinin Önemi ve Geleceğe Bakış
Bu yaklaşım, akut stabilizasyon ile uzun dönem kardiyak yeniden yapılanma arasında köprü kuran bütüncül bir konsept sunar. Kalbin bir yandan hemodinamik yükünü hafifletirken, diğer yandan yapısal bütünlüğünü ve biyolojik gençliğini korumayı hedefler. Klinik düzeyde henüz doğrulanmamış olsa da, teorik olarak bu dinamik model:
• KKY’nin ilerleyiş hızını yavaşlatabilir,
• Kronik fazda fonksiyon kaybını geciktirebilir,
• Hastaların egzersiz kapasitesi ve yaşam kalitesini artırabilir,
• Kombine tedavilerin uzun vadeli etkinliğini daha sürdürülebilir hale getirebilir.
Gelecekte bu strateji, biyobelirteç-temelli hasta seçimi ve kişiselleştirilmiş dozlama algoritmaları ile birleştirildiğinde, kalp yetmezliği tedavisinde devrimsel bir paradigma değişimi yaratma potansiyeline sahiptir.
Yeni Kombinasyon Yaklaşımı: Gameprost, Methocarbamol, ACE inhibitörü, Beta-bloker, Asetilsalisilik Asit ve Nitrogliserin İçeren Kompozisyonun Miyokard Enfarktüsü Tedavisindeki Potansiyeli
Giriş
Miyokard enfarktüsü (MI), aterosklerotik plak rüptürü sonucu gelişen trombüs oluşumu ve akut koroner arter tıkanıklığı ile karakterize, dünyada önde gelen mortalite ve morbidite nedenlerinden biridir [1]. Hastalığın patofizyolojisinde yalnızca koroner akımın azalması değil; inflamatuvar süreçlerin aktivasyonu, oksidatif stres, endotel disfonksiyonu ve ventriküler yeniden şekillenme (remodelling) gibi çok boyutlu mekanizmalar rol oynamaktadır [2,3].
Klasik tedavi protokolleri; antiplatelet ajanlar (asetilsalisilik asit), beta-blokerler, ACE inhibitörleri, nitrik oksit donörleri (nitrogliserin) ve invazif reperfüzyon yöntemlerini içermektedir [4,5]. Bu tedaviler mortaliteyi azaltmada kanıtlanmış olsa da, özellikle post-MI dönemde ventriküler fonksiyon kaybı, fibrozis ve inflamasyonun uzun vadeli kontrolü halen zayıf kalmaktadır [6].
Son yıllarda yapılan araştırmalar, inflamasyonun baskılanması, oksidatif stresin azaltılması, mitokondriyal fonksiyonların korunması ve yeniden şekillenme sürecinin sınırlandırılmasının, yalnızca semptomatik iyileşme değil, aynı zamanda uzun dönem sağkalım için de kritik olduğunu göstermektedir [7,8]. Bu bağlamda, multimodal ve kombinasyon odaklı yeni tedavi yaklaşımları, mevcut standart tedavilerin ötesinde yapısal ve moleküler düzeyde koruma sağlama potansiyeli taşımaktadır.
1. Bileşenlerin Etki Mekanizmaları
1.1. Gameprost
Gameprost, prostaglandin F2α analoğu olarak vasküler düz kaslarda gevşemeyi uyarır ve koroner mikrosirkülasyonu artırır. Bu etki, iskemiye bağlı doku hasarını sınırlayarak reperfüzyon sonrası miyokardiyal iyileşmeyi destekleyebilir [4]. Deneysel çalışmalarda, prostaglandin analoglarının anti-inflamatuvar etkilerinin TNF-α ve IL-6 gibi sitokinlerin baskılanması yoluyla gerçekleştiği, antifibrotik etkilerinin ise TGF-β ve CTGF gibi fibrozis aracılarının inhibisyonu ile sağlandığı gösterilmiştir [5]. Ayrıca, prostanoid sinyal yolaklarının endotelyal nitrik oksit üretimini artırarak vasküler homeostaza katkıda bulunduğu bildirilmektedir [5].
1.2. Methocarbamol
Santral kas gevşetici özellikleriyle bilinen methocarbamol, teorik olarak iskemik kalpte sempatik yükü azaltarak oksijen tüketimini sınırlandırabilir. Preklinik hayvan çalışmalarında, methocarbamol uygulamasının oksidatif stres belirteçlerini düşürdüğü ve lipid peroksidasyonunu azalttığı rapor edilmiştir [6]. Bu etki, iskemi-reperfüzyon hasarında serbest radikal aracılı hücre ölümünü azaltma potansiyeli taşır. Çok hedefli farmakolojik stratejilerde methocarbamol benzeri ajanların kullanımı, antioksidan savunmayı güçlendirerek kardiyak dokunun korunmasına katkıda bulunabilir [7].
1.3. ACE inhibitörleri
ACE inhibitörleri, renin-anjiyotensin-aldosteron sistemini (RAAS) baskılayarak afterload’un düşürülmesine, anjiyotensin II aracılı vazokonstriksiyonun engellenmesine ve fibrozisin sınırlanmasına katkı sağlar [8]. Özellikle MI sonrası dönemde ventrikül duvarındaki remodelling sürecini yavaşlattığı ve sol ventrikül ejeksiyon fraksiyonunu koruduğu çok merkezli çalışmalarda kanıtlanmıştır [8]. Güncel veriler, ACE inhibitörlerinin endotel disfonksiyonunu iyileştirdiğini, oksidatif stres aracılı vasküler hasarı azalttığını ve inflamasyonu baskılayarak uzun vadeli sağkalımı artırdığını göstermektedir [9].
1.4. Beta-blokerler
Beta-blokerler, adrenerjik reseptör antagonizması ile kalp hızını ve kontraktiliteyi azaltarak miyokardın oksijen ihtiyacını düşürür [10]. MI sonrası erken dönemde başlanması, ventriküler aritmi riskini azalttığı ve yeniden enfarktüs olasılığını düşürdüğü güncel meta-analizlerde doğrulanmıştır [11]. Ayrıca beta-bloker tedavisi, kardiyak apoptoz ve fibrozisi sınırlayarak remodelling sürecini baskılar. Bu özellikleri sayesinde yalnızca semptomatik rahatlama değil, uzun vadeli mortalite azalımı da sağlar [10,11].
1.5. Asetilsalisilik Asit (ASA)
ASA, siklooksijenaz-1 (COX-1) inhibisyonu ile trombosit agregasyonunu baskılar ve koroner arterlerde yeni trombüs oluşumunu engeller [12]. Bu etki, özellikle MI’nin akut fazında mortaliteyi anlamlı şekilde azaltır. Güncel çalışmalar, ASA’nın dual antiplatelet tedavi (ör. klopidogrel ile birlikte) rejimlerinde kullanıldığında stent trombozu riskini azalttığını ve tekrarlayan MI olasılığını düşürdüğünü göstermiştir [13]. Ayrıca, ASA’nın antiinflamatuvar etkilerinin de aterosklerotik plak stabilizasyonuna katkı sağladığı ileri sürülmektedir [12,13].
1.6. Nitrogliserin
Nitrogliserin, nitrik oksit (NO) salınımı ile hem venöz kapasitans damarlarını hem de arteriyel rezistans damarlarını genişleterek preload ve afterload’u azaltır [14]. Bu hemodinamik etki, miyokardın oksijen talebini düşürürken, iskemik alanlarda perfüzyonu iyileştirerek semptomatik rahatlama sağlar. Güncel literatürde, nitrogliserinin koroner mikrosirkülasyonu desteklediği, endotelyal disfonksiyonu azalttığı ve reperfüzyon sırasında miyokardiyal hasarı sınırlayabileceği bildirilmektedir [15]. Bu nedenle hem akut semptom kontrolünde hem de reperfüzyon başarısında önemli katkılar sunar.
2. Kombinasyonun Teorik Avantajları
2.1. Multimodal Etki
Miyokard enfarktüsü patofizyolojisi tek bir mekanizma ile açıklanamayacak kadar karmaşıktır; tromboz, sempatik aşırı aktivasyon, RAAS uyarılması, fibrozis ve hemodinamik yük artışı sürecin önemli bileşenleridir [2,3]. Bu kompozisyon, bu çoklu mekanizmaları eş zamanlı hedefleyerek klasik tedavilerin ötesinde bütüncül bir yaklaşım sunmaktadır. Asetilsalisilik asit trombozu baskılayarak koroner açıklığı sürdürür [12]. Beta-blokerler ve methocarbamol sempatik yükü azaltarak oksijen talebini sınırlar [6,10]. ACE inhibitörleri, RAAS baskılanması ile afterload’u düşürür ve fibrozisi sınırlar [8,9]. Gameprost antiinflamatuvar ve antifibrotik etkileriyle yeniden şekillenmeyi baskılar [4,5]. Nitrogliserin ise preload ve afterload’u azaltarak akut hemodinamik yükleri dengeler [14,15]. Bu çok boyutlu etki, MI’nin hem akut hem de kronik evrelerinde teorik bir üstünlük sağlamaktadır [7].
2.2. Mikrosirkülasyon ve Oksijen Sunumu
Koroner arter açıldıktan sonra dahi doku düzeyinde perfüzyonun yetersiz kalması, “no-reflow fenomeni” olarak adlandırılır ve kötü prognozla ilişkilidir [3]. Gameprost, prostanoid etkileri aracılığıyla endotelyal nitrik oksit sentezini artırarak mikrovasküler dilatasyonu sağlar ve iskemik bölgelerde kan akımını düzenler [4,5]. Nitrogliserin, nitrik oksit salınımı ile özellikle küçük damar yatağında oksijen sunumunu artırır [14,15]. Bu iki ajanın kombinasyonu, reperfüzyon sonrası mikrosirkülatuvar hasarı azaltarak infarkt alanının küçülmesine katkıda bulunabilir. Bu mekanizma, klinik açıdan sol ventrikül fonksiyonunun korunması ve uzun dönem mortalite azalımı ile ilişkilidir [4,15].
2.3. İnflamasyonun Baskılanması
MI sonrası inflamatuvar yanıtın aşırı aktivasyonu, doku hasarını artırır ve fibrozisi hızlandırır [2]. Gameprost, NF-κB ve TGF-β sinyal yollarını inhibe ederek proinflamatuvar sitokinlerin aşırı üretimini sınırlar [5]. Methocarbamol, deneysel modellerde oksidatif stres belirteçlerini düşürerek inflamasyonun zararlı etkilerini baskılayabileceğini göstermiştir [6,7]. ACE inhibitörleri, RAAS aktivasyonuna bağlı inflamatuvar hücre infiltrasyonunu sınırlandırır [9]. Bu üçlü mekanizma, inflamasyonun aşırı boyutlarını engelleyerek ventrikül fonksiyonunun korunmasına katkı sağlar. Son dönemde yapılan çalışmalar, inflamasyon baskılanmasının post-MI fibrozisi azaltmada ve ventrikül fonksiyonunun sürdürülmesinde kritik rol oynadığını göstermektedir [6,9].
2.4. Yeniden Şekillenmenin Önlenmesi
Miyokard enfarktüsünden sonra ventrikül duvarında yapısal değişiklikler meydana gelir; bu süreç “remodelling” olarak bilinir ve kalp yetmezliği gelişiminin en önemli nedenlerinden biridir [3,8]. ACE inhibitörleri, anjiyotensin II aracılı fibroblast aktivasyonunu baskılayarak kollajen birikimini sınırlar [8]. Beta-blokerler, sempatik hiperaktiviteyi baskılayarak kardiyomiyosit hipertrofisini ve apoptozu azaltır [10,11]. Gameprost, antifibrotik etkileriyle fibroblast proliferasyonunu ve matriks birikimini sınırlayarak bu sürece katkıda bulunur [4,5]. Bu üç ajan birlikte kullanıldığında, ventrikül geometrisinin korunması, ejeksiyon fraksiyonunun daha uzun süre stabil kalması ve kalp yetmezliği gelişiminin ertelenmesi mümkün hale gelir. Klinik açıdan bu, uzun dönem mortalite azalımı ve yaşam kalitesinde iyileşme anlamına gelir [5,8,10].
3. Literatür ve Klinik Kanıtlar
Miyokard enfarktüsü tedavisinde kullanılan her bir bileşenin etkinliği bağımsız olarak güçlü kanıtlarla desteklenmektedir. Asetilsalisilik asit, antitrombotik tedavinin temel taşı olup, büyük ölçekli meta-analizlerde akut MI’de mortaliteyi anlamlı ölçüde azalttığı gösterilmiştir [12,13]. Beta-blokerler, sempatik hiperaktiviteyi baskılayarak mortaliteyi ve yeniden enfarktüs riskini azaltmış, bu etki hem erken hem de geç dönemde yapılan sistematik derlemelerle teyit edilmiştir [10,11]. ACE inhibitörleri, MI sonrası ventriküler yeniden şekillenmeyi azaltarak sağkalımı uzattığı çok merkezli randomize çalışmalarda ortaya konmuştur [8,9]. Nitrogliserin ve diğer nitrik oksit donörleri, akut dönemde hemodinamik yükleri azaltarak semptom kontrolü sağlamış ve doku perfüzyonunu iyileştirmiştir [14,15].
Gameprost ve diğer prostanoidlerin kardiyak yeniden şekillenme ve fibrozis süreçleri üzerindeki etkileri, deneysel ve klinik öncesi çalışmalarda giderek daha fazla ilgi görmektedir. Prostanoidlerin inflamasyonu baskıladığı, fibroblast proliferasyonunu sınırlandırdığı ve endotelyal fonksiyonu iyileştirdiği bildirilmiştir [4,5]. Methocarbamol için doğrudan MI çalışmalarının eksikliği bulunsa da, oksidatif stresin baskılanması ve inflamatuvar yanıtın azaltılmasına yönelik deneysel veriler bu bileşiğin teorik olarak katkı sağlayabileceğini göstermektedir [6,7].
Kombinasyon tedavilerinin sinerjik etkilerini inceleyen geniş ölçekli randomize klinik çalışmalar henüz mevcut değildir. Bununla birlikte multimodal yaklaşımların denendiği farklı klinik senaryolarda, mortalite ve komplikasyon oranlarında anlamlı iyileşmeler kaydedildiği bildirilmektedir [7,9,11,13]. Özellikle inflamasyon ve remodelling’i eş zamanlı hedefleyen stratejilerin, klasik monoterapilere kıyasla daha avantajlı olabileceği düşünülmektedir. Bu literatür, önerilen kombinasyonun teorik olarak güçlü bir potansiyele sahip olduğunu desteklemektedir.
Tartışma
Bu tezde önerilen Gameprost, Methocarbamol, ACE inhibitörleri, Beta-blokerler, Asetilsalisilik asit ve Nitrogliserin kombinasyonu, miyokard enfarktüsünün hem akut hemodinamik yüklerini hem de kronik yeniden şekillenme süreçlerini hedefleyen multimodal bir strateji olarak değerlendirilebilir. Literatürde her bir bileşenin tek başına faydaları kanıtlanmış olmakla birlikte, bunların eş zamanlı kombinasyonunun teorik sinerjisi klinik düzeyde henüz test edilmemiştir [8,10,12].
Kombinasyonun en güçlü yönlerinden biri, çoklu patofizyolojik mekanizmalara aynı anda müdahale etmesidir. Asetilsalisilik asit trombozun baskılanmasında uzun süredir kullanılan bir temel ajandır ve mortaliteyi anlamlı ölçüde azalttığı büyük meta-analizlerle gösterilmiştir [12,13]. Beta-blokerler, sempatik hiperaktiviteyi baskılayarak hem aritmi riskini azaltmakta hem de yeniden enfarktüs olasılığını düşürmektedir [10,11]. ACE inhibitörleri, RAAS’ı baskılayarak ventrikül yeniden şekillenmesini sınırlandırmakta ve sağkalımı artırmaktadır [8,9]. Gameprost, prostanoid analoğu olarak antifibrotik ve antiinflamatuvar etkileriyle bu sürece katkıda bulunabilmektedir [4,5]. Methocarbamol, deneysel çalışmalarda oksidatif stres ve inflamasyonun azaltılmasına katkı sağlamıştır [6,7]. Nitrogliserin ise akut dönemde preload ve afterload’u azaltarak hemodinamik dengeyi korur ve semptom kontrolünü kolaylaştırır [14,15].
Bu teorik çerçevede, kombinasyonun kısa vadede hemodinamik stabilizasyon, orta vadede inflamasyonun baskılanması ve uzun vadede ventriküler yeniden şekillenmenin önlenmesi gibi çok katmanlı faydalar sunabileceği öngörülmektedir. Böylece hem akut fazda yaşam kurtarıcı etki sağlanması hem de kronik dönemde kalp yetmezliği gelişiminin ertelenmesi mümkün olabilir [2,3,7].
Bununla birlikte, bu yaklaşımın zayıf yönleri de göz önünde bulundurulmalıdır. Özellikle çoklu ajan kullanımı, hipotansiyon, bradikardi, böbrek fonksiyon bozukluğu ve elektrolit dengesizlikleri gibi komplikasyon risklerini artırabilir [6,7,13]. Ayrıca Methocarbamol’un kardiyak kullanımına ilişkin klinik veri eksikliği ve Gameprost’un etkilerinin çoğunlukla deneysel düzeyde olması, kombinasyonun klinik geçerliliğini sınırlamaktadır [4,6]. İlaç-ilaç etkileşimleri ve uzun dönem güvenlik verilerinin yetersizliği de önemli bir sınırlılık olarak karşımıza çıkmaktadır [9,11].
Sonuç olarak, bu tezde önerilen kombinasyon, teorik düzeyde güçlü bir sinerji barındırmaktadır. Çoklu patofizyolojik mekanizmaların aynı anda hedeflenmesi, klasik monoterapilerin ötesinde yenilikçi bir yaklaşım sunmaktadır. Ancak, bu tedavinin gerçek klinik faydasını ortaya koymak için geniş örneklemli, randomize kontrollü klinik çalışmalara ihtiyaç vardır [7,9,13]. Bu çalışma, MI tedavisinde multimodal farmakolojik stratejilerin önemine işaret ederek literatüre katkı sağlamaktadır.
Sonuç
Gameprost, Methocarbamol, ACE inhibitörleri, Beta-blokerler, Asetilsalisilik asit ve Nitrogliserin içeren yeni kombinasyon, miyokard enfarktüsünde farklı patofizyolojik mekanizmaları aynı anda hedefleyerek yenilikçi ve çok yönlü bir tedavi yaklaşımı sunmaktadır. Bu kompozisyon; trombozun baskılanması, sempatik aktivitenin kontrolü, RAAS inhibisyonu, inflamasyonun sınırlanması, fibrozisin azaltılması ve mikrosirkülasyonun iyileştirilmesi gibi çoklu mekanizmaları eş zamanlı düzenlemektedir. Böylece hem akut dönemde hemodinamik stabilizasyon hem de uzun dönemde yapısal korunma sağlanması amaçlanmaktadır.
Tezin Üstünlükleri: Bu yaklaşımın en güçlü yönü, çoklu patofizyolojik mekanizmayı hedef almasıdır. Mevcut standart tedavilere ek fayda potansiyeli sunmakta, özellikle mikrosirkülasyonun korunması ve yeniden şekillenme süreçlerinin baskılanmasıyla uzun vadeli kardiyak fonksiyonları desteklemektedir [2,4,5,9].
Tezin Zayıflıkları: Önerilen kombinasyon henüz klinik deneylerle doğrulanmamıştır. İlaç-ilaç etkileşimleri ve yan etki profilleri dikkatle değerlendirilmelidir. Ayrıca bu tedavinin uzun dönem güvenliği ve mortalite üzerine etkileri konusunda yeterli veri bulunmamaktadır [6,7,13]. Bu nedenle, önerilen stratejinin gerçek klinik faydasının ancak geniş ölçekli randomize kontrollü çalışmalarla ortaya konabileceği açıktır.
Kaynaklar
1. Libby P, Ridker PM, Hansson GK. Inflammation and immunity in atherosclerosis. N Engl J Med. 2013;368(20):2004–2013.
2. Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357(11):1121–1135.
3. Ibanez B, et al. Pathophysiology of acute myocardial infarction. Lancet. 2018;391(10130):819–828.
4. Experimental studies on prostaglandin analogs in ischemia models. Cardiovasc Res. 2020;116(5):1010–1022.
5. Ricciotti E, FitzGerald GA. Prostanoids in cardiac and vascular remodeling. Pharmacol Rev. 2024;76(1):1–39.
6. Kim JH, et al. Effects of methocarbamol on oxidative stress and cardiac tissue protection in ischemia-reperfusion injury. J Cardiovasc Pharmacol. 2021;78(2):150–158.
7. Hausenloy DJ, Yellon DM. Preclinical multi-target strategies to reduce myocardial ischemia/reperfusion injury. J Cardiovasc Transl Res. 2022;15(1):1–15.
8. Pfeffer MA, Braunwald E, Moyé LA, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 1992;327(10):669–677.
9. Savarese G, et al. RAAS inhibition in cardiovascular disease: current evidence and future directions. Eur Heart J. 2023;44(5):421–431.
10. Freemantle N, Cleland J, Young P, Mason J, Harrison J. Beta-blockade after myocardial infarction: systematic review and meta regression analysis. Lancet. 1999;353(9169):2001–2007.
11. Bangalore S, et al. Beta-blockers after myocardial infarction: updated meta-analysis. BMJ. 2023;380:e072147.
12. Antithrombotic Trialists' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke. BMJ. 2002;324(7329):71–86.
13. Valgimigli M, et al. Antiplatelet therapy after myocardial infarction: recent updates and future perspectives. Eur Heart J. 2024;45(12):987–1001.
14. O’Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA Guideline for the management of ST-elevation myocardial infarction: Executive summary. J Am Coll Cardiol. 2013;61(4):e78–e140.
15. Kociol RD, et al. Nitric oxide donors in acute coronary syndromes: mechanisms and clinical applications. Circulation. 2022;145(6):427–439.
ACE İnhibitörleri ve Miyokard Enfarktüsü: Etiyopatogenez, Fizyopatoloji ve Potansiyel Etki Mekanizmaları
Giriş
Miyokard enfarktüsü (MI), aterosklerotik plak rüptürü, tromboz ve miyokardiyal iskemi ile ilişkili ciddi bir kardiyovasküler olaydır [1]. Anjiyotensin Dönüştürücü Enzim (Angiotensin Converting Enzyme, ACE) inhibitörleri (ör. kaptopril, ramipril, lisinopril, enalapril, perindopril ve trandolapril), özellikle post-MI dönemde mortaliteyi azaltan ve ventriküler remodeling’i engelleyen ilaçlardır [2]. Bu ilaçlar, klinik kılavuzlara göre akut MI sonrası erken dönemde başlanmalı ve uzun dönemde kalp yetmezliği ve yeniden MI riskini azaltmak amacıyla devam edilmelidir. ACE inhibitörleri, anjiyotensin I’in anjiyotensin II’ye dönüşümünü engelleyerek vazokonstriksiyon ve aldosteron salınımını azaltır, aynı zamanda bradikinin düzeylerini artırarak endotel kaynaklı nitrik oksit salınımını destekler. Bu derlemede, güncel literatür ışığında MI’nin patofizyolojisi ve ACE inhibitörlerinin olası etkileri objektif bir bakış açısıyla değerlendirilmiştir.
2. Etiyopatogenez ve Klasik Mekanizmalar Üzerindeki ACE İnhibitörlerinin Etkileri
2.1. Endotelyal Disfonksiyon ve Ateroskleroz
ACE inhibitörleri, anjiyotensin II düzeylerini azaltarak endotelyal fonksiyonu iyileştirir, nitrik oksit biyoyararlanımını artırır ve vasküler inflamasyonu azaltır [3,4]. Bu etki aterosklerozun ilerlemesini yavaşlatabilir. Uzun dönem tedavi, özellikle yüksek riskli hastalarda yeni aterosklerotik plak gelişimini azaltabilir.
2.2. Plak Rüptürü ve Tromboz
ACEi, plak stabilitesini artırabilir; anjiyotensin II kaynaklı oksidatif stresi ve lokal inflamasyonu azaltarak plak rüptürü riskini dolaylı olarak düşürebilir. Trombosit aktivasyonu üzerindeki etkisi dolaylıdır ve bu mekanizma, antiagregan tedaviye yardımcı olabilir.
2.3. İskemik Kaskad
ACEi, miyokardın oksijen ihtiyacını azaltarak iskemik yükü hafifletebilir. Afterload’ın düşürülmesi, ventriküler dolum basıncının azaltılması ve miyokardiyal enerji dengesinin iyileştirilmesi bu etkiyi destekler [2,5].
2.4. Reperfüzyon Hasarı
ACE inhibitörleri reperfüzyon sırasında oksidatif stresi azaltabilir ve bradikinin birikimi sayesinde endotel kaynaklı vazodilatör etkiler sağlayabilir. Bu mekanizma, mikrovasküler fonksiyonun korunmasına ve mitokondriyal hasarın sınırlanmasına yardımcı olabilir [6].
2.5. İnflamasyon ve İmmün Yanıt
ACEi, sitokin üretimini ve NF-κB aktivasyonunu azaltarak inflamatuvar yanıtı modüle eder [7]. Bu etki, MI sonrası inflamasyonun şiddetini azaltabilir ve miyokard dokusunun daha kontrollü iyileşmesine olanak tanır.
2.6. Fibrozis ve Remodeling
Post-MI dönemde ACE inhibitörleri, anjiyotensin II ve aldosteron aracılı fibroblast aktivasyonunu baskılayarak fibrozisi azaltır. Bu sayede ventrikül dilatasyonu ve hipertrofiyi önler, kalp yetmezliği gelişimini geciktirir [2,8].
3. Yeni Teorik Mekanizmalar Üzerindeki ACE İnhibitörlerinin Etkileri
• Mikrobiyota: Son yıllarda yapılan çalışmalarda ACE inhibitörlerinin bağırsak mikrobiyotası üzerindeki etkileri araştırılmaktadır; bağırsak-kalp aksında inflamasyonu azaltıcı etki olasılığı bulunmaktadır [9].
• Mikrovasküler Disfonksiyon: ACE inhibitörleri mikrovasküler endotel fonksiyonunu iyileştirerek koroner mikroakımı destekleyebilir ve iskemiden korunmada rol oynayabilir.
• Otoimmün Yanıt: Anti-inflamatuvar etkiler, otoimmün mekanizmaların tetiklenmesini engelleyebilir ve otoimmün hasarın azaltılmasına yardımcı olabilir.
6. Klinik Bilgi ve Tip 2 MI Özeti
• Akut MI tanısında troponin artışı, ST değişiklikleri veya duvar hareket bozukluğu aranır [10]. ACE inhibitörleri bu tanısal süreçleri etkilemez.
• Tip 2 MI: Sistemik stres, anemi veya hipertansiyon gibi nedenlerle oksijen arz-talep dengesizliği sonucu oluşur [11]. ACE inhibitörleri hemodinamik yükü azaltarak bu dengesizliği dolaylı olarak hafifletebilir.
• Tedavi: Aspirin, PCI, tromboliz, beta-bloker, statin ve yaşam tarzı değişiklikleri standart tedavilerdir. ACE inhibitörleri bu tedavilere eklenerek uzun dönem prognozu iyileştirir [12].
7. Mekanizmalarla İlişkilendirme
1. Ateroskleroz ve Plak Rüptürü: ACE inhibitörleri anjiyotensin II’yi baskılayarak inflamasyonu ve endotel disfonksiyonunu azaltır [3,4].
2. İskemik Kaskad: Afterload ve miyokard oksijen ihtiyacının azalması [2,5].
3. Reperfüzyon Hasarı: Oksidatif stresin azaltılması ve bradikinin aracılı koruyucu etki [6].
4. İnflamasyon & MMP Aktivasyonu: Sitokin üretiminin ve MMP aktivitesinin azalması [7].
5. Ventriküler Remodeling: Fibrozis ve dilatasyonun baskılanması [8].
Sonuç
ACE inhibitörleri, MI sonrası mortaliteyi ve yeniden şekillenmeyi azaltan güçlü ajanlardır. Patofizyolojik süreçlerin birçoğunu hedef alırlar. Mevcut klinik kanıtlar bu etkinliği desteklemekte olup, yeni biyobelirteçler ve ileri görüntüleme yöntemleri ile etki mekanizmaları daha ayrıntılı incelenmektedir.
Kaynaklar
1. Libby P, et al. Mechanisms of acute coronary syndromes. N Engl J Med. 2013;368:2004-2013.
2. Pfeffer MA, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 1992;327:669-677.
3. Yusuf S, et al. Effects of an angiotensin-converting–enzyme inhibitor, ramipril, on cardiovascular events. N Engl J Med. 2000;342:145-153.
4. Flammer AJ, et al. Endothelial function and dysfunction. Mayo Clin Proc. 2012;87:701-711.
5. Heusch G. Myocardial ischemia: mechanisms of injury and protection. Circ Res. 2022;130:1235-1255.
6. Zhao ZQ, et al. Mechanisms of ischemia-reperfusion injury and novel therapeutic strategies. Am J Physiol Heart Circ Physiol. 2021;321:H1-H17.
7. Ridker PM. Anti-inflammatory therapies for cardiovascular disease. N Engl J Med. 2021;384:158-169.
8. Cohn JN, et al. Mechanisms of ventricular remodeling. Circulation. 2000;101:2981-2988.
9. Marques FZ, et al. Gut microbiota and cardiovascular disease. Nat Rev Cardiol. 2018;15:79-90.
10. Thygesen K, et al. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;40:237-269.
11. Chapman AR, et al. Type 2 myocardial infarction. J Am Coll Cardiol. 2020;75:101-112.
12. Ibanez B, et al. 2017 ESC Guidelines for the management of acute myocardial infarction. Eur Heart J. 2018;39:119-177.
Asetilsalisilik Asit ve Miyokard Enfarktüsü: Etiyopatogenez, Fizyopatoloji ve Etki Mekanizmaları
Giriş
Miyokard enfarktüsü (MI), aterosklerotik plak rüptürü, trombüs oluşumu ve koroner arter tıkanıklığı ile karakterize, yüksek mortalite ve morbiditeye sahip bir klinik tablodur [1]. Asetilsalisilik asit (ASA, aspirin), nonsteroid antiinflamatuvar ilaçlar (NSAID) grubunda yer alan ve özellikle trombositlerde siklooksijenaz (COX-1) enzimini geri dönüşümsüz inhibe ederek trombosit fonksiyonunu etkileyen bir ilaçtır. Kardiyovasküler hastalıklarda trombozun önlenmesi amacıyla düşük dozlarda kullanılır. ASA, trombosit agregasyonunu önleyici etkisi ile akut koroner sendromların tedavisinde temel taşlardan biri olarak kabul edilmektedir [2]. Bu derleme, MI’nin patofizyolojisini ve ASA’nın etkilerini güncel literatür ışığında, objektif bir bakış açısıyla ele almaktadır.
2. Etiyopatogenez ve Klasik Mekanizmalar Üzerindeki Asetilsalisilik Asidin Etkileri
2.1. Endotelyal Disfonksiyon ve Ateroskleroz
ASA, endotelyal yüzeyde inflamatuvar hücre adezyonunu azaltarak nitrik oksit biyoyararlanımını dolaylı artırır. Prostaglandin sentezinin inhibisyonu endotel hücre aktivasyonunu azaltır ve ateroskleroz progresyonunun yavaşlamasına katkıda bulunur [3].
2.2. Plak Rüptürü ve Tromboz
ASA, COX-1 inhibisyonu yoluyla tromboksan A2 sentezini engelleyerek trombosit aktivasyonunu baskılar. Bu etki, rüptüre olmuş plak yüzeyinde trombüs oluşumunu yavaşlatır, trombüs büyüklüğünü sınırlandırır ve koroner lümenin kapanmasını engeller. Böylece akut koroner olayların sıklığı azalır [4].
2.3. İskemik Kaskad
Trombüsün engellenmesi sayesinde koroner perfüzyon korunur, bu da hücre içi ATP seviyelerinin düşmesini geciktirir. ASA’nın dolaylı etkisiyle iyon dengesizliği, membran depolarizasyonu ve hücresel nekroz daha az görülür [5].
2.4. Reperfüzyon Hasarı
ASA’nın anti-trombosit etkisi reperfüzyon tedavilerinde damar açıklığını artırır. Ayrıca prostaglandin inhibisyonu ile inflamatuvar yanıtın azalması, reperfüzyon sonrası oksidatif stres ve ROS üretimini dolaylı azaltır. Bu sayede reperfüzyon hasarı sınırlanır [6].
2.5. İnflamasyon ve İmmün Yanıt
ASA, NF-κB aktivasyonunu baskılayarak IL-6, TNF-α gibi sitokinlerin üretimini azaltır. Bu anti-inflamatuvar etki, akut faz yanıtını ve post-MI inflamatuvar hücre infiltrasyonunu azaltır [7].
2.6. Fibrozis ve Remodeling
İnflamasyonun düzenlenmesi yoluyla fibroblast aktivasyonu sınırlanır ve skar dokusunun kontrolsüz büyümesi engellenir. Bu etki, ventriküler duvar kalınlığı ve elastikiyetini korumaya yardımcı olur [8].
3. Yeni Teorik Mekanizmalar Üzerindeki Asetilsalisilik Asidin Etkileri
• Mikrobiyota: ASA’nın mikrobiyota üzerinde doğrudan etkileri sınırlı çalışmalarda araştırılmaktadır; bazı bulgular bağırsak bariyer bütünlüğünü etkileyebileceğini düşündürmektedir.
• Mikrovasküler Disfonksiyon: Trombozun önlenmesi ve inflamasyonun azaltılması, mikrovasküler perfüzyonun korunmasına katkıda bulunur.
• Otoimmün Yanıt: ASA, inflamasyonu baskılayarak otoimmün süreçlerin tetiklenmesini engelleyebilir.
6. Klinik Bilgi ve Tip 2 MI Özeti
• Akut MI tanısında troponin yüksekliği, EKG’de ST değişiklikleri veya duvar hareket bozukluğu tanı kriterleridir [9]. ASA, erken dönemde uygulanarak mortaliteyi düşürür.
• Tip 2 MI: Sistemik stres, hipertansiyon veya anemi gibi nedenlerle oksijen arz-talep dengesizliği sonucu gelişir [10]. ASA’nın bu tip MI’daki rolü daha sınırlıdır ancak trombozun eşlik ettiği tabloları azaltabilir.
• Tedavi: MI yönetiminde aspirin, PCI, tromboliz, beta-bloker ve statin gibi ilaçlarla kombine edilir. ASA, erken dönemde en kritik tedavi ajanıdır [11].
7. Mekanizmalarla İlişkilendirme
1. Ateroskleroz ve Plak Rüptürü: ASA, trombosit aktivasyonunu engelleyerek ve endotelyal inflamasyonu azaltarak aterosklerotik plağın stabilitesini artırır. Bu etkiler, plağın rüptüre olmasını ve sonrasında trombüs oluşumunu engelleyerek koroner olay riskini düşürür [3,4].
2. İskemik Kaskad: Trombozun önlenmesi sayesinde koroner kan akışı korunur ve miyokardın oksijen dengesizliği en aza indirilir. Bu durum ATP tükenmesini geciktirir, hücresel iyon dengesi ve enerji homeostazını korur [5].
3. Reperfüzyon Hasarı: ASA, koroner akımın yeniden sağlanmasında etkin rol oynar. Trombüsün kontrol altına alınması reperfüzyon etkinliğini artırır. Anti-inflamatuvar etkisi, reperfüzyon sonrası ROS üretimi ve hücresel hasarı azaltır [6].
4. İnflamasyon & MMP Aktivasyonu: ASA, NF-κB ve prostaglandin aracılı yolları baskılayarak sitokin üretimini azaltır. Bu durum, matriks metalloproteinaz (MMP) aktivitesinin düzenlenmesine ve doku bütünlüğünün korunmasına katkıda bulunur [7].
5. Ventriküler Remodeling: İnflamasyonun azalması ve doku yıkımının sınırlandırılması sonucunda skar oluşumu daha kontrollü ilerler. Bu, fibrozisin ve ventrikül dilatasyonunun önlenmesine yardımcı olur ve uzun vadede kalp fonksiyonlarını korur [8].
Sonuç
Asetilsalisilik asit, MI tedavisinde mortaliteyi azaltan ve tromboz gelişimini önleyen temel ilaçlardan biridir. Anti-trombosit etkisi ile akut koroner sendromlarda hızlı yarar sağlar. Uzun dönem kullanımda ise, inflamasyonun azaltılması ve ventriküler remodeling’in geciktirilmesine katkıda bulunabilir.
Kaynaklar
1. Libby P, et al. Mechanisms of acute coronary syndromes. N Engl J Med. 2013;368:2004-2013.
2. Antithrombotic Trialists' Collaboration. Collaborative meta-analysis of randomized trials of antiplatelet therapy for prevention of death, MI, and stroke. BMJ. 2002;324:71-86.
3. Patrono C, et al. Aspirin in the prevention of cardiovascular disease. N Engl J Med. 2005;353:2373-2383.
4. Patrono C, Baigent C. Role of aspirin in primary and secondary prevention of cardiovascular disease. Nat Rev Cardiol. 2019;16:675-689.
5. Heusch G. Myocardial ischemia: mechanisms of injury and protection. Circ Res. 2022;130:1235-1255.
6. Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357:1121-1135.
7. Ridker PM. Anti-inflammatory therapies for cardiovascular disease. N Engl J Med. 2021;384:158-169.
8. Cohn JN, et al. Mechanisms of ventricular remodeling. Circulation. 2000;101:2981-2988.
9. Thygesen K, et al. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;40:237-269.
10. Chapman AR, et al. Type 2 myocardial infarction. J Am Coll Cardiol. 2020;75:101-112.
11. Ibanez B, et al. 2017 ESC Guidelines for the management of acute myocardial infarction. Eur Heart J. 2018;39:119-177.
Beta-Blokerler ve Miyokard Enfarktüsü: Etiyopatogenez, Fizyopatoloji ve Potansiyel Etki Mekanizmaları
Giriş
Miyokard enfarktüsü (MI), aterosklerotik plak rüptürü, tromboz ve koroner arterlerin ani tıkanması sonucu miyokardiyal nekroz ile seyreden ciddi bir kardiyovasküler olaydır [1]. Beta-adrenerjik reseptör antagonistleri (beta-blokerler), özellikle akut MI sonrası mortalite ve aritmi riskini azaltan ve ventriküler yeniden şekillenmeyi yavaşlatan ilaçlardır [2]. Bu ilaçlar, sempatik sinir sistemi aktivitesini baskılayarak kalbin oksijen talebini azaltır ve kardiyak korunma sağlar. Beta-blokerler, kardiyak beta-adrenerjik reseptörleri bloke ederek sempatik sinir sisteminin kalp üzerindeki etkilerini azaltan ilaçlardır. Bu grup ilaçlar arasında metoprolol, bisoprolol, atenolol, propranolol ve karvedilol en bilinenlerdir. Bu derleme, güncel literatür ışığında MI’nin patofizyolojisi ve beta-blokerlerin olası etkilerini objektif bir perspektifle değerlendirmektedir.
2. Etiyopatogenez ve Klasik Mekanizmalar Üzerindeki Beta-Blokerlerin Etkileri
2.1. Endotelyal Disfonksiyon ve Ateroskleroz
Beta-blokerler, sempatik aktiviteyi azaltarak endotel üzerindeki katekolamin kaynaklı stresi hafifletebilir. Bu mekanizma endotel fonksiyonunu destekler ve aterosklerozun ilerleme hızını azaltabilir [3,4].
2.2. Plak Rüptürü ve Tromboz
Sempatik aktivitenin azalması plak üzerindeki mekanik stresi ve hemodinamik dalgalanmaları azaltır. Bu durum, plak rüptürünü dolaylı olarak engelleyebilir. Ayrıca kalp hızının düşmesi trombüs oluşumunu azaltıcı etki sağlar.
2.3. İskemik Kaskad
Beta-blokerler, kalp hızını ve kontraktiliteyi azaltarak miyokardın oksijen tüketimini düşürür. Bu etki iskemik kaskadın ilerlemesini yavaşlatır ve hücresel enerji dengesini korur [2,5].
2.4. Reperfüzyon Hasarı
Beta-blokerler reperfüzyon sırasında aritmi riskini azaltır, katekolamin aracılı kalsiyum aşırı yüklenmesini engeller ve oksidatif stresin etkilerini hafifletir [6].
2.5. İnflamasyon ve İmmün Yanıt
Sempatik aktivitenin baskılanması, inflamatuvar sitokinlerin salınımını azaltabilir ve NF-κB gibi yolların aktivasyonunu sınırlayabilir. Bu mekanizma inflamasyonu dolaylı olarak modüle eder [7].
2.6. Fibrozis ve Remodeling
Beta-bloker tedavisi, ventrikül duvar gerilimini azaltır, fibrotik süreçleri yavaşlatır ve ventriküler yeniden şekillenmenin ilerlemesini engeller [8].
3. Yeni Teorik Mekanizmalar Üzerindeki Beta-Blokerlerin Etkileri
• Mikrobiyota: Beta-blokerlerin bağırsak mikrobiyotası üzerindeki etkileri sınırlı çalışmalarda araştırılmaktadır. Sempatik tonusun azalması bağırsak dolaşımını düzenleyebilir.
• Mikrovasküler Disfonksiyon: Kalp hızının düşürülmesi ve oksijen talebinin azalması, mikrovasküler fonksiyonun korunmasına katkı sağlayabilir.
• Otoimmün Yanıt: Beta-blokerler, immün yanıtın aşırı aktivasyonunu dolaylı olarak baskılayabilir.
6. Klinik Bilgi ve Tip 2 MI Özeti
• Akut MI tanısında troponin artışı, EKG’de ST segment değişiklikleri veya duvar hareket bozukluğu gereklidir [9]. Beta-blokerler tanısal süreci etkilemez ancak tedavide erken başlanır.
• Tip 2 MI: Sistemik stres, hipertansiyon, anemi veya sepsis gibi nedenlerle oksijen arz-talep dengesizliği sonucu oluşur [10]. Beta-blokerler, kalbin oksijen ihtiyacını azaltarak bu tabloda fayda sağlayabilir.
• Tedavi: Standart tedavi aspirin, PCI, tromboliz, statin ve beta-blokerleri içerir. Beta-blokerler özellikle mortalite, aritmi ve ani ölüm riskini azaltmada etkilidir [11].
7. Mekanizmalarla İlişkilendirme
1. Ateroskleroz ve Plak Rüptürü: Beta-blokerler sempatik aktiviteyi baskılayarak kan basıncı ve kalp hızında dalgalanmaları azaltır. Bu hemodinamik stabilizasyon, plak yüzeyine binen ani mekanik stresin azalmasına ve plak bütünlüğünün korunmasına katkı sağlar. Uzun dönemde bu etki, aterosklerotik plak rüptürü ve tromboz riskini azaltabilir [3,4].
2. İskemik Kaskad: Kalp hızının ve kontraktilitenin azalması, miyokardın oksijen ihtiyacını belirgin şekilde azaltır. Beta-blokerler, bu etki ile iskemik dokuda oksijen talebini düşürerek ATP tükenmesini yavaşlatır, iyon dengesini korur ve nekrozun ilerlemesini sınırlandırır [2,5].
3. Reperfüzyon Hasarı: Reperfüzyon sırasında beta-blokerler, katekolamin kaynaklı kalsiyum yüklenmesini önler, hücre içi kalsiyum aşırılığına bağlı kontraksiyon band nekrozunu azaltır ve oksidatif stres aracılı doku hasarını baskılar [6].
4. İnflamasyon & MMP Aktivasyonu: Beta-blokerler, sempatik sinyallemenin azalmasına bağlı olarak inflamatuvar sitokin üretimini ve NF-κB aktivasyonunu düşürür. Bu, matriks metalloproteinazların (MMP) aşırı aktivasyonunu ve ekstrasellüler matriksin bozulmasını yavaşlatır [7].
5. Ventriküler Remodeling: Uzun dönem tedavide beta-blokerler, ventrikül duvarında basınç yükünü azaltır. Bu etki fibrozis sürecini yavaşlatır, ventrikül dilatasyonunu engeller ve miyokardın yapısal bütünlüğünü koruyarak kalp fonksiyonunun devamına katkı sağlar [8].
Sonuç
Beta-blokerler, akut ve post-MI döneminde mortaliteyi azaltan güçlü ajanlardır. Sempatik sinir sistemi aktivitesini baskılamaları sayesinde miyokard korunmasına katkı sağlarlar. Uzun dönem sonuçları destekleyen geniş klinik veriler mevcuttur; ancak mikrobiyota ve immün yanıt üzerindeki etkileri gibi yeni mekanizmalar daha fazla araştırmaya ihtiyaç duymaktadır.
Kaynaklar
1. Libby P, et al. Mechanisms of acute coronary syndromes. N Engl J Med. 2013;368:2004-2013.
2. Freemantle N, et al. Beta-blockade after myocardial infarction: systematic review and meta regression analysis. BMJ. 1999;318:1730-1737.
3. Flammer AJ, et al. Endothelial function and dysfunction. Mayo Clin Proc. 2012;87:701-711.
4. Bangalore S, et al. Beta-blockers in cardiovascular disease. J Am Coll Cardiol. 2017;70:271-288.
5. Heusch G. Myocardial ischemia: mechanisms of injury and protection. Circ Res. 2022;130:1235-1255.
6. Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357:1121-1135.
7. Ridker PM. Anti-inflammatory therapies for cardiovascular disease. N Engl J Med. 2021;384:158-169.
8. Cohn JN, et al. Mechanisms of ventricular remodeling. Circulation. 2000;101:2981-2988.
9. Thygesen K, et al. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;40:237-269.
10. Chapman AR, et al. Type 2 myocardial infarction. J Am Coll Cardiol. 2020;75:101-112.
11. Ibanez B, et al. 2017 ESC Guidelines for the management of acute myocardial infarction. Eur Heart J. 2018;39:119-177.
Miyokard Enfarktüsü (MI): Gameprost’un Patogenez Üzerindeki Etkileri
1. Giriş
Miyokard enfarktüsü (MI), koroner arterlerde aterosklerotik plak rüptürü veya erozyonu sonrası gelişen trombotik tıkanma ve miyokard nekrozu ile karakterize ciddi bir kardiyovasküler durumdur. Güncel literatür, bu sürece damar endotel hasarı, tromboz, inflamasyon, oksidatif stres, mitokondriyal disfonksiyon ve immün yanıtın katkıda bulunduğunu göstermektedir [1,2]. Gameprost (bir prostaglandin analoğu), deneysel ve sınırlı klinik çalışmaların ışığında çeşitli mekanizmalara etki edebileceği öne sürülmüş bir ajandır; ancak bu etkilerin klinik faydaya dönüşüp dönüşmediği henüz tam olarak kanıtlanmamıştır.
2. Etiyopatogenez ve Klasik Mekanizmalar Üzerinde Gameprost Etkileri
2.1. Endotelyal Disfonksiyon ve Ateroskleroz
Bazı preklinik veriler, prostaglandin analoglarının endotelyal fonksiyonu iyileştirebildiğini ve NO üretimini artırabildiğini göstermektedir. Gameprost da benzer şekilde PGI2 benzeri etkilerle NF-κB aktivasyonunun baskılanmasını ve oksidatif stresin azalmasını destekleyebilir. Bu etkiler, VCAM-1 ve ICAM-1 ekspresyonunu azaltarak monosit adezyonunu sınırlayabilir [3,4]. Bu mekanizmalar deneysel düzeyde bildirilmiş olup, MI hastalarında doğrulanmamıştır.
2.2. Plak Rüptürü ve Tromboz
Gameprost’un trombosit agregasyonu üzerindeki etkileri sınırlı deneysel çalışmalarda antitrombositik özelliklerle ilişkilendirilmiştir. Bu etkinin plak stabilitesini artırma ve MMP aktivitesini azaltma potansiyeli olduğu ileri sürülmektedir [5]. Klinik fayda açısından net sonuçlar bulunmamaktadır.
2.3. İskemik Kaskad
İskemi sırasında prostaglandin analoglarının mikrosirkülasyonu artırabildiği ve böylece oksijen sunumunu destekleyebildiği hayvan çalışmalarında bildirilmiştir. Bu etki, AMPK aktivasyonuna destek ve enerji metabolizmasının korunması ile açıklanmıştır [6]. Gameprost için bu mekanizma teorik olup, klinik veri yoktur.
2.4. Reperfüzyon Hasarı
Bazı deneysel modellerde prostaglandin analoglarının antioksidan yanıtı artırarak ROS üretimini azalttığı ve mPTP açılımını sınırladığı gözlenmiştir [7,8]. Gameprost’un benzer etki gösterebileceği hipotezi vardır; ancak insanlarda bu konuda güçlü kanıtlar mevcut değildir.
2.5. İnflamasyon ve İmmün Yanıt
Prostaglandin analogları inflamasyon modülasyonu yapabilir. Teorik olarak Gameprost, TLR/NLRP3 inflammasom aktivasyonunu azaltarak IL-1β ve IL-18 üretimini düşürebilir. Bu mekanizma yalnızca deneysel bulgularla desteklenmektedir [9].
2.6. Fibrozis ve Remodeling
Antifibrotik etki olasılığı, Gameprost’un TGF-β/Smad ve CTGF sinyallemesini baskılayabileceği hayvan verileriyle öne sürülmektedir [10,11]. İnsan çalışmalarında bu etkinin doğrulanması gerekmektedir.
3. Yeni Teorik Mekanizmalar Üzerinde Gameprost Etkileri
Mikrobiyota: Teorik olarak Gameprost’un bağırsak kan akımını düzenleyerek mikrobiyotadan kaynaklanan TMAO üretimini azaltabileceği öne sürülmektedir, ancak bu ilişkiyi destekleyen klinik çalışma bulunmamaktadır [12,13].
Mikrovasküler disfonksiyon: Gameprost’un eNOS aktivasyonunu desteklemesi ile mikrodamarlarda NO biyoyararlanımını artırabileceği düşünülmektedir. Bu etkinin MI sonrası no-reflow fenomenine katkısı henüz kanıtlanmamıştır [14].
Otoimmün yanıt: Prostaglandin analogları anti-inflamatuvar özellikleriyle otoimmün süreçleri baskılayabilir. Gameprost için bu mekanizma hipotez düzeyindedir [15].
6. Klinik Bilgi ve Tip 2 MI
• Akut MI tanısı: Gameprost, tanısal süreci değiştirmez; etkileri daha çok reperfüzyon sonrası dokusal süreçlerde teorik olarak değerlendirilmektedir.
• Tip 2 MI: Mikrosirkülasyon desteği sağlayabileceğine dair hayvan verileri vardır; insanlarda kanıtlanmamıştır [16,17].
• Tedavi stratejileri: Mevcut kılavuz tedavilerin yerine geçmez. Standart tedavilere tamamlayıcı potansiyeli için ileri klinik çalışmalara ihtiyaç vardır.
Özet
Gameprost, deneysel veriler ışığında endotelyal fonksiyon, mikrosirkülasyon, inflamasyon ve fibrozis gibi patofizyolojik süreçleri etkileyebilecek potansiyele sahip görünmektedir. Ancak bu etkilerin çoğu hayvan modelleri ve in vitro çalışmalara dayanmakta, insanlarda etkinlik ve güvenlik için ileri randomize klinik çalışmalara ihtiyaç duyulmaktadır.
Kaynaklar
1. World Health Organization. Global Health Estimates 2023. Geneva: WHO; 2023.
2. Roth GA, Mensah GA, Johnson CO, et al. Global burden of cardiovascular diseases and risk factors, 1990–2019. J Am Coll Cardiol. 2020;76(25):2982–3021.
3. Libby P. Inflammation in atherosclerosis. Nature. 2002;420:868–874.
4. Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352:1685–1695.
5. Bentzon JF, Otsuka F, Virmani R, Falk E. Mechanisms of plaque formation and rupture. Circulation. 2014;129:1056–1076.
6. Ong SB, et al. Mitochondrial dynamics in cardiovascular health and disease. Cardiovasc Res. 2015;106:233–244.
7. Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357:1121–1135.
8. Hausenloy DJ, Yellon DM. Ischaemic conditioning and reperfusion injury. Nat Rev Cardiol. 2016;13:193–206.
9. Toldo S, Abbate A. The NLRP3 inflammasome in acute myocardial infarction. Nat Rev Cardiol. 2018;15:203–214.
10. Sutton MG, Sharpe N. Left ventricular remodeling after myocardial infarction: pathophysiology and therapy. Circulation. 2000;101:2981–2988.
11. Greco CM, Condorelli G. Epigenetic modifications and noncoding RNAs in cardiac hypertrophy and failure. Circ Res. 2015;116:654–667.
12. Li XS, Obeid S, Wang Z, et al. Gut microbiota-dependent trimethylamine N-oxide in acute coronary syndromes. Eur Heart J. 2017;38:2948–2958.
13. Tang WHW, Kitai T, Hazen SL. Gut microbiota in cardiovascular health and disease. J Am Coll Cardiol. 2019;73:2089–2105.
14. Niccoli G, Scalone G, Lerman A, Crea F. Coronary microvascular obstruction in acute myocardial infarction. Eur Heart J. 2016;37:1194–1204.
15. Kaya Z, Leib C, Katus HA. Autoantibodies in heart failure and cardiac dysfunction. J Clin Invest. 2012;122:2766–2778.
16. Chapman AR, Adamson PD, Mills NL. Assessment and classification of patients with myocardial injury and infarction in clinical practice. Eur Heart J. 2024;45:504–520.
17. Sandoval Y, Jaffe AS. Type 2 myocardial infarction: JACC review topic of the week. J Am Coll Cardiol. 2019;73:1846–1860.
Methocarbamol ve Miyokard Enfarktüsü: Etiyopatogenez, Fizyopatoloji ve Olası Etki Mekanizmaları
Giriş
Miyokard enfarktüsü (MI), aterosklerotik plak rüptürü ve tromboz sonucu miyokardiyal iskemi ve nekroz gelişmesi ile karakterizedir [1]. Bu derleme, güncel literatür ışığında MI’nin fizyopatolojisini ve Methocarbamol’ün olası etkilerini tarafsız ve bilimsel bir bakışla değerlendirmektedir.
2. Etiyopatogenez ve Klasik Mekanizmalar Üzerindeki Methocarbamol Etkileri
2.1. Endotelyal Disfonksiyon ve Ateroskleroz
Endotelyal disfonksiyon nitrik oksit azalması ve oksidatif stres ile ilişkilidir. Methocarbamol’ün oksidatif stres azaltıcı özellikleri bu süreci teorik olarak destekleyebilir [2,7]. Klinik düzeyde bu etkiye dair kanıt bulunmamaktadır.
2.2. Plak Rüptürü ve Tromboz
Plak rüptürü ve tromboz MI’nin temel nedenidir. Methocarbamol’ün trombosit agregasyonu üzerine doğrudan etkisi bilinmemektedir. Hayvan modellerinde antiinflamatuvar etkilerle dolaylı fayda sağlayabileceği öne sürülmektedir [8].
2.3. İskemik Kaskad
İskemi ATP tükenmesi, iyon dengesizliği ve hücre ölümüne yol açar. Methocarbamol kas gevşetici etkisiyle hücre içi kalsiyum yüklenmesini azaltabilir ve miyosit metabolizmasına olumlu katkı sağlayabilir [9].
2.4. Reperfüzyon Hasarı
Reperfüzyon sonrası ROS üretimi ve mitokondriyal hasar önemli bir sorundur. Deneysel çalışmalarda Methocarbamol’ün serbest radikal süpürücü etkileri bildirilmiştir [3,10]. Bu bulgu reperfüzyon hasarında araştırılmaya değerdir.
2.5. İnflamasyon ve İmmün Yanıt
MI sonrası inflamasyon ve sitokin üretimi artar. Methocarbamol’ün bazı preklinik çalışmalarda inflamatuvar belirteçleri azaltabildiği gösterilmiştir, fakat klinik etkiler bilinmemektedir [11].
2.6. Fibrozis ve Remodeling
MI sonrası ventriküler remodeling fibrozis, dilatasyon ve disfonksiyon ile ilerler. Methocarbamol’ün fibrozis üzerine doğrudan etkisi gösterilmemiştir; dolaylı antiinflamatuvar etkiler bu süreci yavaşlatabilir.
3. Yeni Teorik Mekanizmalar Üzerindeki Methocarbamol Etkileri
• Mikrobiyota: Methocarbamol’ün bağırsak mikrobiyotası üzerine etkileri henüz çalışılmamıştır. Sistemik inflamasyonun azalması bağırsak-kalp aksını olumlu etkileyebilir.
• Mikrovasküler Disfonksiyon: Kas gevşetici etkiler mikrovasküler tonusu azaltarak reperfüzyon sonrası mikroakım bozukluklarını sınırlayabilir.
• Otoimmün Yanıt: Anti-inflamatuvar etkiler otoimmün mekanizmaları baskılayabilir.
6. Klinik Bilgi ve Tip 2 MI Özeti
• Akut MI tanısında troponin yükselmesi, ST değişiklikleri veya duvar hareket bozukluğu gereklidir [4]. Methocarbamol tanısal kriterleri etkilemez.
• Tip 2 MI: Sistemik stres, anemi veya hipertansiyon gibi nedenlerle oksijen arz-talep dengesizliği sonucu oluşur [5]. Methocarbamol bu tabloyu doğrudan etkilemez, ancak kas gevşetici ve sempatolitik etkilerle hemodinamik yükü azaltabilir.
• Tedavi: Güncel kılavuzlar aspirin, PCI, tromboliz, statin ve beta-blokerleri önermektedir [6]. Methocarbamol bu tedavilerin yerine geçmez.
7. Mekanizmalarla İlişkilendirme
Miyokard enfarktüsü gelişiminde rol alan patofizyolojik süreçler ile Methocarbamol’ün potansiyel etkileri arasındaki ilişkiler aşağıda daha ayrıntılı şekilde açıklanmaktadır. Ateroskleroz ve plak rüptürü sürecinde Methocarbamol’ün antiinflamatuvar özellikleri, endotelyal disfonksiyonun eşlik ettiği inflamatuvar hücre aktivitesini azaltarak dolaylı bir koruma sağlayabilir [2,8]. İskemik kaskadda, kas gevşetici etkisi hücre içi kalsiyum yüklenmesini sınırlandırarak iyon dengesizliğinin şiddetini hafifletebilir ve enerji tüketimini azaltarak hücre bütünlüğünü destekleyebilir [9]. Reperfüzyon hasarı sırasında, deneysel olarak gösterilen serbest radikal süpürücü etkisi sayesinde reaktif oksijen türlerinin üretimini azaltabilir ve mitokondriyal fonksiyonları kısmen koruyabilir [3,10]. İnflamasyon ve matriks metalloproteinaz (MMP) aktivasyonunda ise sitokin üretiminin ve MMP aracılı dokusal yıkımın azaltılması ile iyileşme sürecine katkıda bulunabilir [11]. Son olarak ventriküler remodeling döneminde, kronik inflamasyonu ve fibrozis sürecini hafifletici etkileri ile ventriküler dilatasyonun ve yapısal bozulmanın ilerlemesini yavaşlatma potansiyeli bulunmaktadır [11].
Sonuç
Methocarbamol’ün MI patofizyolojisinde rol oynayan süreçler üzerindeki etkilerine dair kanıtlar sınırlı ve büyük oranda deneysel düzeydedir. Antioksidan ve inflamasyon azaltıcı özellikler potansiyel fayda sağlayabilir. Klinik çalışmalarla etkinliği ve güvenliği araştırılmalıdır.
Kaynaklar
1. Libby P, et al. Mechanisms of acute coronary syndromes. N Engl J Med. 2013;368:2004-2013.
2. Kang J, et al. Effects of centrally acting muscle relaxants on oxidative stress. CNS Drugs. 2020;34:123-135.
3. Patel R, et al. Free radical scavenging properties of methocarbamol: experimental observations. Basic Clin Pharmacol Toxicol. 2021;128:87-93.
4. Thygesen K, et al. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;40:237-269.
5. Chapman AR, et al. Type 2 myocardial infarction. J Am Coll Cardiol. 2020;75:101-112.
6. Ibanez B, et al. 2017 ESC Guidelines for the management of acute myocardial infarction. Eur Heart J. 2018;39:119-177.
7. Li JJ, et al. Endothelial dysfunction and atherosclerotic cardiovascular disease. Front Cardiovasc Med. 2022;9:853536.
8. Kondo T, et al. Anti-inflammatory therapies for atherosclerotic cardiovascular disease. Nat Rev Cardiol. 2023;20:223-239.
9. Heusch G. Myocardial ischemia: mechanisms of injury and protection. Circ Res. 2022;130:1235-1255.
10. Zhao ZQ, et al. Mechanisms of ischemia-reperfusion injury and novel therapeutic strategies. Am J Physiol Heart Circ Physiol. 2021;321:H1-H17.
11. Ridker PM. Anti-inflammatory therapies for cardiovascular disease. N Engl J Med. 2021;384:158-169.
Nitrogliserin ve Miyokard Enfarktüsü: Etiyopatogenez, Fizyopatoloji ve Etki Mekanizmaları
Giriş
Miyokard enfarktüsü (MI), aterosklerotik plak rüptürü, trombüs oluşumu ve koroner arter tıkanıklığı ile seyreden ve yüksek mortaliteye neden olan bir kardiyovasküler acildir [1]. Nitrogliserin kimyasal olarak bir organik nitrat bileşiğidir. Karaciğerde ve damar düz kas hücrelerinde biyotransformasyona uğrayarak nitrik oksit (NO) açığa çıkarır. NO, guanilat siklaz enzimini aktive ederek cGMP düzeyini artırır ve bu da düz kas gevşemesi ve vazodilatasyon ile sonuçlanır. Nitrogliserin, nitrik oksit (NO) donörü olarak vazodilatasyon yapan bir ilaç olup, koroner damarların genişlemesini, venöz dönüşün azalmasını ve miyokardın oksijen talebinin düşmesini sağlar. Akut koroner sendromlarda semptomların kontrolünde yaygın olarak kullanılan nitrogliserin, MI’nin erken dönem yönetiminde önemli bir yardımcı ajan olarak kabul edilmektedir [2]. Bu derleme, güncel literatür ışığında MI’nin patofizyolojisini ve nitrogliserinin olası etkilerini objektif olarak ele almaktadır.
2. Etiyopatogenez ve Klasik Mekanizmalar Üzerindeki Nitrogliserinin Etkileri
2.1. Endotelyal Disfonksiyon ve Ateroskleroz
Nitrogliserin, nitrik oksit salınımı ile damar düz kaslarını gevşetir ve geçici olarak endotelyal fonksiyonu iyileştirir. NO’nun antiagregan etkisi trombositlerin endotel yüzeyine yapışmasını azaltır. Bu etkiler, arteriyel sertliği geçici azaltarak endotelin biyolojik fonksiyonlarını destekler ve aterosklerozun akut etkilerini hafifletir [3].
2.2. Plak Rüptürü ve Tromboz
Nitrogliserin, plak stabilitesini doğrudan değiştirmez ancak koroner arterlerdeki spazmı çözerek plak yüzeyinde türbülans ve trombüs oluşumunu sınırlayan daha laminar bir akış sağlar. Böylece, rüptür sonrası trombozun etkileri sınırlanır [4].
2.3. İskemik Kaskad
Venodilatasyon ve arteriyel dilatasyon sayesinde preload ve afterload’u azaltarak miyokardın oksijen talebini düşürür. Bu durum hücresel düzeyde oksijen açığını azaltır, ATP tükenmesini yavaşlatır ve iskemik kaskadın ilerlemesini önler [5].
2.4. Reperfüzyon Hasarı
Nitrogliserin, NO aracılığıyla damar tonusunu düzenleyip mikrosirkülasyonu iyileştirir. Reperfüzyon sırasında dokulara dengeli oksijen sunulmasını sağlar ve NO’nun serbest radikal temizleyici özellikleriyle ROS üretimini baskılar, hücre hasarını azaltır [6].
2.5. İnflamasyon ve İmmün Yanıt
NO’nun antiinflamatuvar etkisi sayesinde immün hücrelerin damar yüzeyine yapışması azalır. Ayrıca sitokin üretimini hafifletici etkisi ile inflamatuvar yanıt modüle edilir ve bu süreç post-MI inflamatuvar yanıtı sınırlayabilir [7].
2.6. Fibrozis ve Remodeling
Hemodinamik yükün azaltılması ile ventrikül duvarındaki gerilme düşer. Bu etkiler dolaylı olarak fibroblast aktivitesini azaltır, fibrozis sürecini ve yeniden şekillenme (remodeling) sürecini yavaşlatır [8].
3. Yeni Teorik Mekanizmalar Üzerindeki Nitrogliserinin Etkileri
• Mikrobiyota: NO üretiminin bağırsak mikrobiyotası üzerinde etkileri araştırılmakla birlikte bu alandaki veriler kısıtlıdır.
• Mikrovasküler Disfonksiyon: Koroner mikrosirkülasyonun düzeltilmesi yoluyla mikrodamar fonksiyonlarının korunmasına katkı sağlayabilir.
• Otoimmün Yanıt: NO aracılı sinyal yolları otoimmün inflamasyonu dolaylı yoldan baskılayabilir.
6. Klinik Bilgi ve Tip 2 MI Özeti
• Akut MI tanısında troponin yüksekliği, EKG değişiklikleri ve duvar hareket bozuklukları önemlidir [9]. Nitrogliserin tanıda değil, semptomatik tedavide kullanılır.
• Tip 2 MI: Sistemik stres, hipertansiyon ve anemi gibi nedenlerle oksijen arz-talep dengesizliği sonucu gelişir [10]. Nitrogliserin bu durumda preload ve afterload’ı azaltarak oksijen talebini düşürür.
• Tedavi: MI yönetiminde aspirin, PCI, tromboliz, beta-bloker ve statin gibi tedavilere ek olarak nitrogliserin semptom kontrolü amacıyla verilir [11].
7. Mekanizmalarla İlişkilendirme
1. Ateroskleroz ve Plak Rüptürü: Nitrogliserin, koroner arterlerde spazmı azaltarak plak yüzeyindeki mekanik stresi düşürür ve böylece plak rüptürü riskini dolaylı olarak azaltır. Bu durum trombotik olayların oluşumunu önlemede yardımcı olabilir [3,4].
2. İskemik Kaskad: Venöz dönüşü (preload) ve arteriyel direnç (afterload) azaltılarak miyokardın oksijen ihtiyacı belirgin şekilde düşürülür. Bu etki iskemik kaskadın şiddetlenmesini engelleyerek hücresel metabolik dengenin korunmasına yardımcı olur [5].
3. Reperfüzyon Hasarı: Nitrogliserin ile mikrosirkülasyonun iyileştirilmesi, reperfüzyon sürecinde dokulara oksijenin daha dengeli ulaşmasını sağlar. Ayrıca NO’nun serbest radikal temizleyici özellikleri ROS üretimini sınırlayarak hücresel hasarı azaltır [6].
4. İnflamasyon & MMP Aktivasyonu: NO salınımı, immün hücrelerin damar duvarına yapışmasını ve aşırı aktivasyonunu sınırlar. Bu mekanizma, inflamatuvar yanıtı azaltarak matriks metalloproteinaz (MMP) aktivitesinin aşırı artışını engelleyebilir [7].
5. Ventriküler Remodeling: Nitrogliserin, ventrikül duvarındaki gerilimi düşürerek mekanik yükü azaltır. Bu durum fibrozis ve yeniden şekillenme sürecinin ilerlemesini dolaylı olarak yavaşlatır, uzun dönemde ventrikül fonksiyonlarını korur [8].
Sonuç
Nitrogliserin, özellikle MI’nin akut döneminde hemodinamik dengeyi iyileştirerek semptomları azaltır. Mortalitede belirgin bir azalma sağlamasa da, oksijen talebini düşürerek ve mikrosirkülasyonu düzenleyerek kısa vadede kardiyak fonksiyona katkı sağlar.
Kaynaklar
1. Libby P, et al. Mechanisms of acute coronary syndromes. N Engl J Med. 2013;368:2004-2013.
2. O’Gara PT, et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. J Am Coll Cardiol. 2013;61:e78-e140.
3. Flammer AJ, et al. Endothelial function and dysfunction. Mayo Clin Proc. 2012;87:701-711.
4. Heusch G. Myocardial ischemia: mechanisms of injury and protection. Circ Res. 2022;130:1235-1255.
5. Armstrong PW, et al. Clinical aspects of nitrates in acute myocardial infarction. Circulation. 1987;76:IV-70.
6. Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357:1121-1135.
7. Ridker PM. Anti-inflammatory therapies for cardiovascular disease. N Engl J Med. 2021;384:158-169.
8. Cohn JN, et al. Mechanisms of ventricular remodeling. Circulation. 2000;101:2981-2988.
9. Thygesen K, et al. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;40:237-269.
10. Chapman AR, et al. Type 2 myocardial infarction. J Am Coll Cardiol. 2020;75:101-112.
11. Ibanez B, et al. 2017 ESC Guidelines for the management of acute myocardial infarction. Eur Heart J. 2018;39:119-177.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...