LENFATİK ÖDEM İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
LENFATİK ÖDEM İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
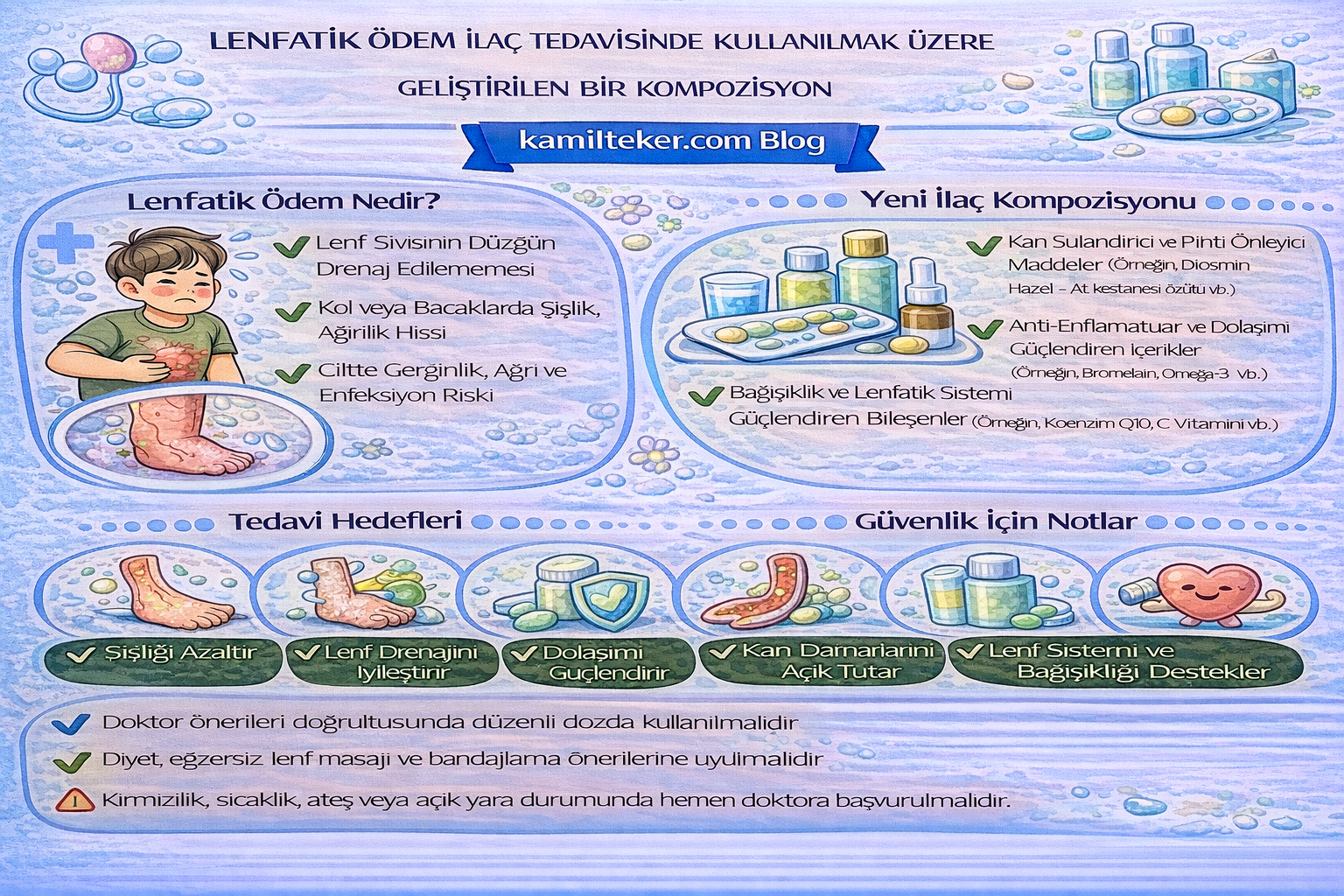
Buluş; Lenfödem ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Orgotein (1) 1x1, Tetrazepam (2) 2x1, Quercetin (3) 2x1 Folik asit (4) 1x1, Rapamycin (5) 1x1, Sodyum oxybate (6) 1x1 ve Tiaprofenic acid (7) 1x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Lenfatik ödem (lenfödem), lenfatik sistemin yapısal ya da fonksiyonel bozuklukları sonucu interstisyel dokuda protein açısından zengin sıvının birikmesiyle ortaya çıkan kronik ve ilerleyici bir hastalıktır. Primer formu genetik mutasyonlara bağlı olarak gelişebilirken, sekonder formu cerrahi, radyoterapi, travma veya enfeksiyon sonrası ortaya çıkar. Klinik olarak şişlik, doku sertliği, tekrarlayan enfeksiyonlar ve yaşam kalitesinde azalma ile seyreder. Son yıllarda yapılan araştırmalar, lenfödemin yalnızca mekanik drenaj yetersizliği değil; aynı zamanda inflamasyon, fibrozis, oksidatif stres ve metabolik bozukluklarla ilişkili karmaşık bir patofizyolojiye sahip olduğunu göstermektedir.
Lenfödem ilaç tedavisinde kullanılacak ilaçlar ve dozları:
1. Orgotein 1x1
2. Tetrazepam 2x1
3. Quercetin 2x1
4. Folik asit 1x1
5. Rapamycin (sirolumus) 1x1
6. Sodyum oxybate 1x1
7. Difenpiramide 1x1
8. Tiaprofenic acid 1x1
Lenfödem medikal tedavi protokolü özellikleri
1. Tedavide kullanılacak ilaçları rastgele iki gruba ayır.
2. Her bir grup ilacı sırayla üç günde bir dönüşümlü değiştirerek kullan.
3. Tedaviye başlamak için en az dört ilaç gerekli
4. Tedavi süresi üç hafta
5. Tıbbi Masaj: Doktor Teker Masaj Kremi ile her bölgeye ayrı olmak üzere 21 – 30 gün ve günde iki defa her bölgeye 15-20 dakika masaj ile mutlaka uygulanacak,
6. Piroksikam jel geçerli; 2x1 masaj ile 3- 5 dakika sürülebilir, ince bir tabaka halinde,
7. İnfraruj (Kırmızı ışık) geçerli; 10 -15 gün ve günde 20 dakika
8. Tedavi bittikten sonra bir buçuk ay ara ver. Optimal iyileşmeye ulaşmak için gerekirse tedaviyi aynen tekrarlayarak kullanabilirsin.
9. Tedavi başarı beklentisi % 80 – 90
Lenfödem tedavisi destek alternatif özellikleri
1. Mezoterapi geçersiz, ancak kireçlenme varsa tedavi bittikten 1,5 ay sonra olabilir
2. Proloterapi geçersiz, ancak kireçlenme varsa tedavi bittikten 1,5 ay sonra olabilir
3. Manuel terapi – germe; olmaz, zararlı.
4. Kuru iğne tedavisi geçersiz
5. Ozon tedavisi geçersiz
6. Bitkisel karışım tedavisi yok
7. Sülük tedavisi geçersiz
8. Glukozamin glikan olabilir
9. İplikatör tedavisi geçersiz
10. Tokmak masajı olabilir
11. Kaplıca tedavisi; medikal tedavi bittikten sonra olabilir
12. Biyorezonans geçersiz
13. Mikrosirkülasyon olabilir
Farmakolojik Kombinasyonların Teorik Değerlendirmesi
Grup A – İnflamasyon, Fibrozis ve Fonksiyonel Drenajı Hedefleyen Kombinasyon
1. Rapamycin (Sirolimus): Rapamycin, hücre içi sinyal yollarından biri olan mTOR (mammalian target of rapamycin) yolunu inhibe eden güçlü bir immünmodülatördür. Lenfödemde, özellikle lenfanjiyogenez ve fibroblast çoğalması süreçlerinin kontrolsüz aktivasyonu, mTOR sinyalinin aşırı çalışmasına bağlıdır. Rapamycin bu yolu bloke ederek, lenfatik endotel hücrelerinin aşırı proliferasyonunu ve anormal damar yapılarını sınırlar. Ayrıca TGF-β sinyali üzerinden aktive olan fibroblastların çoğalmasını engelleyerek fibrotik doku oluşumunu azaltır. Klinik gözlemler, rapamycin kullanımının kolajen birikimini ve cilt sertliğini azalttığını desteklemektedir. Özellikle QTORIN gibi topikal uygulamalar, sistemik yan etkileri en aza indirerek lokal etkide avantaj sağlamaktadır.
2. Quercetin: Quercetin, antiinflamatuvar, antioksidan ve antifibrotik özellikleriyle dikkat çeken bir flavonoiddir. NF-κB ve COX-2 gibi inflamatuvar transkripsiyon faktörlerini baskılayarak, lenfödemli dokularda proinflamatuvar sitokinlerin üretimini azaltır. Aynı zamanda ROS üretimini engelleyerek hücresel stres yükünü hafifletir ve DNA hasarına karşı koruma sağlar. Quercetin’in fibroblast migrasyonunu ve TGF-β sinyalini baskılaması, fibrozis ilerlemesini yavaşlatır. Ayrıca VEGF/mTOR aksını inhibe ederek lenfatik damar gelişimini modüle edebilir. Bu çok yönlü etki profili, lenfödemin hem nedenlerine hem sonuçlarına doğrudan müdahaleye olanak tanır.
3. Tetrazepam: Kas gevşetici özelliğe sahip benzodiazepin türevi olan tetrazepam, GABA-A reseptör agonisti olarak merkezi sinir sistemi üzerinden kas tonusunu düşürür. Lenfatik damar duvarlarındaki düz kasların gevşemesiyle birlikte intralüminal basınç azalır, bu da pasif lenf drenajını kolaylaştırır. Ayrıca sempatik aktiviteyi inhibe ederek vasküler tonusu ve doku perfüzyonunu dengeleyebilir. Lenfödemin semptomatik yönetiminde, fiziksel basıncı azaltarak inflamasyonu tetikleyen mekanik yükün düşürülmesine katkı sağlar. Bu yönüyle farmakolojik ve fonksiyonel tedavi arasında köprü görevi görür.
4. Folik Asit: Folik asit (Vitamin B9), hücresel replikasyon, metilasyon ve DNA sentezinde görev alır. Lenfödemde görülen oksidatif stres, DNA hasarı ve hücre yaşlanması ile sonuçlanan süreçleri tetikler. Folik asit, DNA onarım enzimlerinin aktivitesini artırarak hücre yenilenmesine destek olur. Ayrıca, bağışıklık hücrelerinin fonksiyonlarını optimize ederek immün modülasyon sağlar. Bu etki, inflamatuvar yanıtın patolojik düzeye ulaşmasını engelleyerek doku hasarını sınırlandırır. Destekleyici bir ajan olarak, hem rejenerasyonu hem de savunma sistemini stabilize eder.
Teorik Değerlendirme: Grup A'daki bu dört ajan, lenfödemin temel fizyopatolojik süreçlerine çok katmanlı müdahalede bulunarak klinik iyileşmeyi destekleyecek sinerjik bir potansiyele sahiptir. Rapamycin’in mTOR sinyalini baskılayarak hem lenfatik damar hiperplazisini hem de TGF-β aracılığıyla tetiklenen fibrotik yanıtı sınırlandırması, lenfödemin kronikleşmesini engelleyici etki sağlar. Quercetin, antiinflamatuvar ve antioksidan etkileriyle inflamasyonun çözünmesini teşvik ederken, oksidatif stresin neden olduğu hücresel disfonksiyonu da geri döndürebilir. Ayrıca fibroblast proliferasyonunu baskılaması, fibrozis sürecinde Rapamycin ile sinerji oluşturur.
Tetrazepam, GABA-A reseptörlerine bağlanarak düz kas tonusunu azaltır, bu da lenfatik sistemdeki pasif drenajı iyileştirerek sıvı birikiminin kontrol altına alınmasına yardımcı olur. Özellikle aşırı kas tonusu ile birlikte seyreden lenfödem vakalarında fonksiyonel destek sağlar. Aynı zamanda vasküler geçirgenliği dengeleyici etkisiyle ödemin kontrolünü kolaylaştırır.
Folik Asit ise hücresel düzeyde DNA sentezini ve onarımını destekleyerek doku rejenerasyonunu hızlandırır. Oksidatif hasara bağlı olarak DNA’sı zarar gören hücrelerin tamiri, bağ dokusunun yeniden yapılanmasında ve immün hücrelerin fonksiyonel stabilitesinde önemli rol oynar. Ayrıca metilasyon süreçlerini dengeleyerek epigenetik regülasyon üzerinde olumlu etki oluşturur.
Bu kombinasyonun klinik değeri, yalnızca lenfödemin semptomlarına yönelik geçici bir rahatlama sağlamakla sınırlı değildir. Aynı zamanda altta yatan patofizyolojik nedenleri hedef alarak hastalığın progresyonunu yavaşlatma veya durdurma potansiyeline sahiptir. Moleküler düzeyde hem hedefe yönelik hem de destekleyici etkilerin entegre biçimde yer aldığı bu yapı, klinik araştırmalar için güçlü bir translasyonel temel oluşturur. Bu model; hastalığın erken, orta ve geç dönemlerine adapte edilebilecek şekilde, doz ve ajan düzenlemeleriyle genişletilmeye açıktır.
Grup B – Oksidatif Stres, Ağrı ve Mikrovasküler Stabiliteyi Hedefleyen Kombinasyon
1. Orgotein: Orgotein, endojen süperoksit dismutaz (SOD) aktivitesine benzer şekilde etki gösteren, antioksidan kapasitesi yüksek bir enzimatik proteindir. Lenfödemli dokularda sürekli inflamasyon sonucu aşırı miktarda oluşan süperoksit ve hidrojen peroksit gibi reaktif oksijen türlerini (ROS) etkisiz hale getirerek endotel hücrelerini korur. Orgotein, bu antioksidan savunma mekanizmasını güçlendirerek lenfatik damar duvarında yapısal bütünlüğün korunmasına, fibroblast aktivasyonunun baskılanmasına ve hücre dışı matriks dengesinin sağlanmasına katkı sunar. Ayrıca yaşlanmış hücrelerin birikimini önleyerek doku rejenerasyonuna elverişli bir ortam oluşturur.
2. Tiaprofenic Acid: Tiaprofenic acid, COX-1 ve COX-2 enzimlerinin kompetitif inhibitörü olarak prostaglandin üretimini azaltır. Lenfödemli bölgelerde prostaglandinlerin etkisiyle oluşan ağrı, sıcaklık artışı, hiperemi ve ödem belirtileri, bu ilacın düzenleyici etkisiyle hafifler. Ayrıca bu ajanın periferik sinir uçlarındaki nociceptif medyatörlerin salınımını inhibe ederek analjezik etki sağladığı bildirilmiştir. Mikrovasküler inflamasyonu azaltarak endotel geçirgenliğini stabilize eder, böylece sıvı sızıntısını ve interstisyel ödemi sınırlar. Kronik inflamasyon ataklarında ödemin kontrolü ve semptom yönetimi için farmakolojik destek sağlar.
3. Sodyum Oxybate: Sodyum oxybate, GABA-B ve GHB reseptörleri aracılığıyla nörotransmiter salınımını düzenleyerek derin uyku (slow-wave sleep) fazlarını artırır. Derin uyku, bağışıklık sisteminin yeniden yapılandığı, kortizol düzeylerinin azaldığı ve lenfatik dolaşımın daha etkin çalıştığı bir evredir. Bu ilacın kullanımı, psiko-nöroimmün sistem üzerindeki dengeleyici etkisi sayesinde inflamatuvar biyobelirteçlerde azalma, parasempatik aktivitede artış ve sistemik stresin düşüşü ile ilişkilendirilmiştir. Uyku kalitesinin artması ile birlikte lenfödemin dolaylı tetikleyicilerinden biri olan kronik stresin de kontrol altına alınması hedeflenir.
4. Difenpiramide: Difenpiramide, selektif antihistaminik etkisinin yanı sıra vasküler geçirgenlik üzerinde stabilizatör etkiye sahip bir ajan olarak lenfödemde destekleyici kullanım potansiyeline sahiptir. Histaminin kapiller permeabiliteyi artırıcı etkisi, lenfödemde interstisyel sıvı birikimini daha da şiddetlendirir. Difenpiramide, H1 reseptör blokajı yoluyla histamin kaynaklı vazodilatasyonu ve plazma sızıntısını azaltır. Ayrıca analjezik etkisi ile hassasiyet ve inflamasyonun yol açtığı lokal ağrıyı azaltır. Histaminin neden olduğu immün aktivasyonu sınırlandırarak mikrovasküler çevreyi dengeler.
Teorik Değerlendirme: Grup B’de yer alan bu dört ajan, lenfödemin sistemik, semptomatik ve mikrovasküler boyutlarını hedefleyen tamamlayıcı bir tedavi seti sunar. Orgotein, hücre düzeyinde ROS kaynaklı hasarı önleyerek antioksidan savunmayı güçlendirir; bu etki fibroblastik yanıtı baskılayarak fibrozisin ilerlemesini sınırlar. Tiaprofenic acid, COX inhibitör etkisiyle prostaglandin üretimini baskılar, ödemin şiddetini düşürürken ağrı kontrolü sağlar. Sodyum oxybate, sinir sistemi ve immün yanıtın entegrasyonunu yeniden yapılandırarak kortizol regülasyonu ve inflamatuvar stres yönetimi sunar. Difenpiramide ise vasküler geçirgenliği sınırlandırarak histamin kaynaklı doku sızıntılarını önler.
Bu kombinasyon, özellikle lenfödemin kronikleşmiş evrelerinde, semptomatik yükün azaltılması ve doku dengesinin korunması açısından kritik rol üstlenebilir. Aynı zamanda Grup A ile sinerji oluşturarak, lenfödemin hem kök nedenlerine hem de klinik sonuçlarına yönelik entegre bir tedavi paradigması oluşturur. Bireyselleştirilmiş medikal müdahale planlamasında bu grup, yaşam kalitesini artırma hedefiyle ön plana çıkmaktadır. Gelecekte, hastalık evresine göre modüle edilmiş çok bileşenli farmakoterapötik protokollerin temelini oluşturabilir.
Teorik Değerlendirme: Dönüşümlü 3 Günlük Protokolün Avantajları
Bu tedavi yaklaşımı, lenfödemin multifaktöriyel yapısını dikkate alarak hem patogenezi hem de semptomları hedef alan “rotasyonel farmakoterapi” modelini benimsemektedir. Grup A ve Grup B ilaçlarının üç günlük periyotlarla dönüşümlü kullanılması, çeşitli patomekanizmaların kesintisiz fakat dengeli bir şekilde hedeflenmesine olanak tanır. Bu model, özellikle kronik hastalık yönetiminde karşılaşılan ilaç toleransı, yan etki birikimi ve terapötik cevap değişkenliğine karşı etkili bir çözüm sunar.
1. Sistemik yükün azaltılması: Aynı grup ilaçların uzun süreli kullanımı, belirli biyolojik sinyal yollarında aşırı baskılanmaya ve bu yollarda negatif geri besleme mekanizmalarının devreye girmesine neden olabilir. Rotasyonel kullanım, belirli metabolik, immün veya hormonal akslarda sürekli baskı oluşturmayarak sistemik toksisite ve organ yükünü minimize eder.
2. Etki spektrumunun genişletilmesi: Grup A, doğrudan hastalığın kök patogenezi (fibrozis, inflamasyon, lenfatik disfonksiyon) üzerine etkili olurken; Grup B, hastanın konforunu etkileyen semptomatik bileşenlere (ağrı, oksidatif stres, uyku, damar geçirgenliği) yöneliktir. Dönüşümlü kullanım, farklı fizyopatolojik aksların sırayla devreye alınmasını sağlayarak sistemik bir tedavi avantajı sunar.
3. Adaptif fizyolojik yanıtın desteklenmesi: Lenfödem gibi sistemik bozukluklarda, immün, nöroendokrin ve lenfatik sistemler arasında karmaşık bir etkileşim vardır. Tek tip sinyal baskısı yerine, değişen ajanlarla sistemlerin homeostatik yanıt verme kapasitesi korunur. Bu sayede fizyolojik rezerv güçlendirilir, tedaviye adaptasyon sağlanır.
4. İlaç-yan etki ilişkisini minimize etme: Her bir grup farklı farmakodinamiğe sahiptir. Bu grupların ardışık kullanımı, belirli ilaçlara bağlı gelişebilecek yan etkilerin kumulatif hale gelmesini önler. Örneğin, sürekli mTOR baskısı lenfödemde paradoksal etki oluşturabilecekken, dönüşümlü protokol bunu dengeleyebilir.
5. Farmakodinamik toleransın önlenmesi: Uzun süreli kullanımlarda ilaç reseptörlerinde duyarsızlaşma (desensitizasyon) gelişebilir. Dönüşümlü model, bu riski ortadan kaldırarak her bir ajanın maksimum biyolojik etkinlik süresini uzatır.
6. Kişiselleştirmeye uygunluk: Her hasta farklı semptom profili ve toleransa sahip olabilir. Bu protokolün esnekliği sayesinde, tedavi süreleri ve ilaç geçiş sırası hasta özelliklerine göre modifiye edilebilir. Bu da bireyselleştirilmiş tedavi modeline olanak tanır.
Sonuç olarak, bu rotasyonel tedavi yaklaşımı, lenfödemin hem moleküler temelli ilerleyişine hem de klinik sonuçlarına aynı anda müdahale eden sistematik ve entegre bir stratejidir. Tedavi etkinliğinin yanı sıra hastanın tedaviye uyumunu ve yaşam kalitesini artırma potansiyeli taşır. Klinik araştırmalarla desteklenmesi, kronik lenfödem yönetiminde bu yaklaşımın yeni bir tedavi standardı olmasına zemin hazırlayabilir.
Lenfödemin Moleküler Mekanizmaları Etiyopatogenez ve Fizyopatoloji ile Kompozisyonumuzun Etkileri
Özet:
Lenfödem, lenfatik sıvının doku aralıklarında anormal birikimiyle karakterize edilen, ilerleyici seyirli, kronik ve sıklıkla yaşam kalitesini olumsuz etkileyen bir hastalıktır. Genellikle primer (konjenital) veya sekonder (cerrahi, radyoterapi, travma sonrası) olarak sınıflandırılan lenfödem, geçmişte yalnızca mekanik drenaj bozukluğu ile açıklanırken, günümüzde inflamasyon, fibrozis, oksidatif stres, genetik mutasyonlar ve metabolik bozuklukların iç içe geçtiği kompleks bir fizyopatolojiye sahip olduğu bilinmektedir. Lenfödemin etiyopatogenezinde VEGF-C/VEGFR-3 sinyal yolakları, TGF-β/SMAD üzerinden gelişen fibrotik değişiklikler, NF-κB aracılı kronik inflamatuvar yanıt, ROS üretimi ile şekillenen oksidatif hasar ve PPAR-γ aktivitesiyle ilişkili adipoz doku birikimi öne çıkmaktadır. Ayrıca PROX1, FOXC2, GJC2 gibi genlerdeki mutasyonlar, primer lenfödemin genetik temelini oluşturmaktadır.
Bu derlemede, lenfödemin fizyopatolojik süreçleri moleküler düzeyde sistematik biçimde incelenmiş; bu süreçlere müdahale edebilecek potansiyel farmakolojik hedefler literatür ışığında değerlendirilmiştir. Ayrıca, bu moleküler mekanizmaları hedef alma potansiyeline sahip, çok bileşenli deneysel bir farmakolojik formülasyon (Orgotein, Tetrazepam, Quercetin, Folik Asit, Rapamycin, Sodyum Oxybate, Tiaprofenic Acid) üzerinden yeni tedavi olanakları tartışılmıştır. 2023–2024 döneminde yayımlanan preklinik ve klinik çalışmalara dayalı analizler ile söz konusu bileşenlerin inflamasyon, fibrozis, oksidatif stres ve lenfanjiyogenez üzerindeki etkileri değerlendirilmiş; özellikle Quercetin’in antioksidan ve antifibrotik rolü, Rapamycin’in mTOR aracılığıyla hücre proliferasyonuna etkisi, Folik Asit’in doku onarımı kapasitesi gibi mekanizmalar güncel verilerle desteklenmiştir. Kombinasyon yaklaşımı, mono-farmakolojik tedavilere göre daha geniş hedef spektrumuna müdahale edebilmesi açısından dikkat çekicidir. Bu bağlamda, multidisipliner bir perspektifle, teorik altyapısı güçlü yeni tedavi protokollerinin geliştirilmesine katkı sunulması amaçlanmaktadır.
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Sinyal Yolu
Lenfanjiyogenez, embriyonik gelişimden erişkin döneme kadar lenfatik damarların oluşumu ve fonksiyonel devamlılığı açısından kritik bir biyolojik süreçtir. Bu sürecin merkezinde yer alan VEGF-C/VEGFR-3 ekseni, lenfatik endotel hücrelerinin (LEC) proliferasyonu, migrasyonu ve tüp formasyonu gibi temel olayları düzenler. VEGF-C ve VEGF-D, VEGFR-3 (FLT4) reseptörü ile etkileşerek PI3K/AKT/mTOR ve MAPK/ERK sinyal yolaklarını aktive eder [1,2,3]. Bu aktivasyon lenfatik damarların yapısal ve fonksiyonel olgunlaşmasında hayati öneme sahiptir. Transkripsiyon faktörleri PROX1, FOXC2 ve GATA2 ise bu süreçte gen ekspresyonunun düzenlenmesinde görev alır ve lenfatik hücre kaderinin belirlenmesinde anahtar rol oynar.
Rapamycin, mTOR kompleksini inhibe eden bir makrolid immünsüpresandır ve lenfödemdeki lenfanjiyogenetik aktiviteyi modüle etme potansiyeline sahiptir. mTOR sinyali üzerinden proliferatif süreçleri yavaşlatarak anormal damar büyümesini sınırlayabilir. Güncel literatürde, sirolimus (rapamycin) kullanımının refrakter lenfatik malformasyonlarda lezyon hacmini azalttığı, lenfatik akımı kısmen düzelttiği ve semptomatik rahatlama sağladığı gösterilmiştir [12,14]. Özellikle “QTORIN rapamycin” adlı %3.9 topikal jel formunun faz 2 klinik çalışmasında mikro-sistik lenfatik malformasyonlarda güvenli ve etkili sonuçlar verdiği bildirilmektedir [13]. Bu bulgular, lenfödemde lokal mTOR baskılamasının tedavi edici potansiyeline işaret etmektedir.
Ancak sistemik rapamycin kullanımına ilişkin çelişkili bulgular da mevcuttur. Kim ve ark. tarafından yürütülen bir çalışmada, mTOR inhibitörleri kullanan hastalarda subkutan yağ dokusu artışı ve dermal trabeküler yapı değişikliği ile karakterize lenfödem geliştiği bildirilmiştir [12]. Bu durum, rapamycin’in doza ve uygulama yoluna bağlı olarak lenfatik drenajı bozabileceğini düşündürmektedir. Ayrıca bazı çalışmalarda rapamycin'in lenfatik damar endotelinde anti-proliferatif etkisi ile birlikte vasküler stabiliteyi de olumsuz etkileyebileceği öne sürülmektedir [16]. Dolayısıyla, bu bileşiğin lenfödem tedavisinde kullanımında doz, süre, formülasyon (topikal vs sistemik) ve hasta seçimi dikkatle planlanmalıdır.
Genel olarak, VEGF-C/VEGFR-3 ekseni üzerine yapılacak müdahalelerde lenfatik damar bütünlüğünün korunması ve anormal proliferasyonun dengelenmesi hedeflenmelidir. Rapamycin gibi hedefe yönelik ajanlar, anti-inflamatuvar ve anti-proliferatif etkileri nedeniyle potansiyel taşısa da, klinik sonuçların heterojenliği bu yaklaşımların kontrollü ve bireyselleştirilmiş tedavi protokolleri ile uygulanmasını zorunlu kılmaktadır.
2. İnflamasyon ve Kronik İmmün Yanıt
Lenfödemin patogenezinde kronik inflamasyonun rolü temel belirleyicilerden biridir. Lenfatik akımın bozulması, interstisyel sıvıda sitokin, büyüme faktörü ve immün hücre akümülasyonuna neden olur. Özellikle T lenfositleri, makrofajlar ve dendritik hücreler lenfödemli dokularda birikerek proinflamatuvar yanıtı başlatır. Bu hücrelerin sekrete ettiği IL-6, TNF-α, IL-1β ve VEGF-A gibi sitokinler, NF-κB sinyal yolunun aktivasyonuna yol açar [4,5,6]. NF-κB'nin aktive olması, proinflamatuvar genlerin ekspresyonunu artırarak kronik inflamasyonun devamlılığını sağlar. Bu durum, lenfatik damar geçirgenliğini bozar, ödemin ilerlemesine ve fibrotik yanıtın oluşmasına katkıda bulunur.
Farmakolojik olarak, bu sürecin modüle edilmesinde çeşitli bileşenler umut vaat etmektedir. Quercetin, güçlü antiinflamatuvar etkileri sayesinde NF-κB, COX-2 ve iNOS ekspresyonunu inhibe ederek inflamatuvar yükü azaltır. Cell Bioscience (2020) çalışmasına göre Quercetin, IL-6 ve TNF-α düzeylerinde belirgin azalma sağlamış ve lenfödem ile ilişkili inflamatuvar yükü hafifletmiştir [15]. Ayrıca Quercetin’in VEGF/AKT/mTOR sinyal aksını baskılayarak vasküler geçirgenlik ve damar endotel hücre proliferasyonunu sınırladığı gösterilmiştir [16].
Orgotein, süperoksit dismutaz benzeri aktivite göstererek reaktif oksijen türlerinin neden olduğu inflamasyonu sınırlayabilir. Tiaprofenic Acid ise klasik NSAID mekanizması ile prostaglandin sentezini baskılar; bu da lokal inflamatuvar yanıtın azalmasını sağlar. Bu üç ajan birlikte değerlendirildiğinde, inflamatuvar sürecin farklı düzeylerinde etkili oldukları görülmektedir.
Folik Asit’in rolü doğrudan inflamasyon üzerinde olmasa da, hücresel yenilenme, DNA sentezi ve immün hücre fonksiyonu üzerinde düzenleyici etkisi nedeniyle destekleyici niteliktedir. Özellikle homosistein düzeylerini düşürerek endotelyal stres ve inflamatuvar yanıtı hafifletme potansiyeli bulunmaktadır.
Kombinasyonel olarak bu ajanların kullanımı, inflamasyonun hem hücresel hem de moleküler düzeyde baskılanmasını sağlayabilir. Literatürde bu tür çok bileşenli yaklaşımların kronik inflamatuvar hastalıklarda daha etkin sonuçlar doğurduğu bildirilmektedir. Bu bağlamda Quercetin, Orgotein, Tiaprofenic Acid ve Folik Asit’in sinerjik etkisi, lenfödemde inflamatuvar süreci modüle edebilecek potansiyele sahiptir.
3. Fibrozis ve Ekstrasellüler Matriks (ECM) Yeniden Yapılanması
Lenfödemin ilerleyici doğasında en önemli yapısal bozulmalardan biri fibrozistir. Lenf akımının bozulması sonucu oluşan kronik inflamasyon, doku mikroçevresinde TGF-β (transforming growth factor-beta) ekspresyonunu artırır. TGF-β, SMAD2/3 transkripsiyon faktörleri aracılığıyla fibroblastları aktive ederek aşırı kollajen (tip I ve III) ve ECM proteinlerinin (fibronektin, elastin) üretimini teşvik eder [6,7]. Bu süreç, lenfödemli dokunun sertleşmesine, elastikiyet kaybına ve lenfatik drenajın daha da zorlaşmasına neden olur. Ayrıca myofibroblast dönüşümü ve matriks metalloproteinaz (MMP-2, MMP-9) dengesizliği ECM'nin yeniden yapılanmasında önemli rol oynar.
Quercetin, bu fibrotik süreci çeşitli düzeylerde inhibe etme kapasitesine sahiptir. Yapılan preklinik çalışmalarda, Quercetin’in TGF-β/SMAD sinyalini doğrudan baskıladığı, α-SMA (alfa smooth muscle actin) ekspresyonunu azalttığı ve fibroblastların migrasyon, proliferasyon ve kollajen sentezini inhibe ettiği gösterilmiştir [15]. Aynı zamanda, MMP/TIMP (tissue inhibitor of metalloproteinases) dengesini düzenleyerek ECM stabilitesini koruyucu etki oluşturduğu bildirilmiştir. Bu etkileriyle Quercetin, fibrotik dokunun progresyonunu yavaşlatabilir ve lenfatik fonksiyonun restorasyonuna katkıda bulunabilir.
Rapamycin, mTORC1 yolaklarını inhibe ederek fibroblast aktivitesini baskılar. Sirolimus’un özellikle keloid, sistemik skleroz ve fibrotik lenfatik malformasyonlarda antifibrotik etkinliği bildirilmiştir [12]. Fibroblastların proliferatif yanıtını azaltarak ECM üretimini sınırlayan bu mekanizma, lenfödemde fibrozisi geriletme potansiyeli taşır. Bununla birlikte sistemik uygulamalarda immünsüpresif etkiler ve cilt altı yağ değişiklikleri nedeniyle dikkatli hasta seçimi ve doz titrasyonu gereklidir.
Tiaprofenic Acid ise COX inhibitörü olarak prostaglandin E2 düzeylerini düşürmek suretiyle fibroblast aktivitesini dolaylı olarak azaltabilir. Bazı çalışmalarda, NSAID'lerin TGF-β üretimini sınırladığı ve fibroblast migrasyonunu baskıladığı bildirilmiştir. Bu sayede ECM yeniden yapılanmasında kontrol sağlanabilir.
Fibrozis, lenfödemin klinik tablosunu ağırlaştıran en dirençli patolojik süreçlerden biri olup, bu alanda çok bileşenli farmakolojik müdahaleler stratejik öneme sahiptir. Quercetin, Rapamycin ve Tiaprofenic Acid’in sinerjistik etkileri, bu fibrotik yanıtın modülasyonunda umut verici bir yaklaşım sunmaktadır.
4. Genetik Temelli Lenfatik Anomaliler
Primer lenfödem, sıklıkla çocukluk veya ergenlik döneminde ortaya çıkan ve lenfatik sistemin gelişimsel bozukluklarına bağlı olarak ilerleyen bir durumdur. Genetik analizler, bu hastalığın heterojen bir yapıya sahip olduğunu ve çeşitli genetik mutasyonlarla ilişkili olabileceğini ortaya koymuştur. PROX1, FOXC2, SOX18, GJC2 ve HGF gibi genler, lenfatik damarların gelişimi, farklılaşması ve stabilitesinde temel rol oynayan transkripsiyon faktörleri ve hücre sinyal proteinlerini kodlar [3,8,9]. Bu genlerdeki mutasyonlar, lenfatik kapiller ağın yapısal bozuklukları, kapakçık defektleri, anormal lenf akışı ve lenfanjiyogenez eksiklikleri ile sonuçlanır.
FOXC2 mutasyonları, özellikle alt ekstremite lenfödemine neden olan distik tip primer lenfödem ile ilişkilidir. PROX1 mutasyonları ise embriyonik lenfatik damar gelişimini doğrudan bozar. GJC2 mutasyonları, lenfatik endotel hücreleri arasındaki hücresel iletişimi engelleyerek damar bütünlüğünü zayıflatır. Bu genetik değişiklikler doğrudan hedeflenemese de, bu mutasyonların sekonder sonuçları olan inflamasyon, oksidatif stres, hücresel stres yanıtı ve fibrotik dönüşüm gibi olaylar farmakolojik olarak modüle edilebilir.
Bu noktada, kombinasyon tedavi bileşenlerinden Quercetin, Folik Asit ve Orgotein’in genetik kaynaklı hücresel stresin hafifletilmesinde önemli rolleri bulunmaktadır. Quercetin, oksidatif stresin neden olduğu DNA hasarını sınırlandırmakta, antioksidan savunmayı Nrf2 üzerinden aktive etmekte ve inflamatuvar yanıtı baskılamaktadır [15,16]. Folik Asit, DNA sentezi, metilasyon ve onarımı gibi temel biyolojik süreçleri destekleyerek genetik mutasyonların hücresel etkilerine karşı savunma sağlar. Özellikle nükleotid sentezi ve metilasyon döngüsünde aktif rol alması, hücre yenilenmesini kolaylaştırabilir.
Orgotein, serbest radikalleri nötralize eden süperoksit dismutaz benzeri etkisi sayesinde genetik mutasyonlara bağlı hücresel ROS üretimini baskılar. Bu etkileri ile bu üçlü kombinasyon, genetik mutasyonlara doğrudan müdahale etmese de, bu mutasyonların sonucunda gelişen patolojik mikroçevreyi modüle ederek hastalığın ilerleyişini yavaşlatma potansiyeli taşımaktadır. Gelecekte, bu ajanların epigenetik modifikasyonlar üzerindeki etkilerinin de araştırılması, genetik lenfödem tedavisinde yeni ufuklar açabilir.
5. Oksidatif Stres ve Reaktif Oksijen Türleri (ROS)
Lenfödem patofizyolojisinde oksidatif stres, hücresel fonksiyon bozukluklarının tetikleyicisi ve ilerletici faktörlerden biridir. NADPH oksidaz başta olmak üzere oksidatif enzimlerin aktivasyonu sonucu artan reaktif oksijen türleri (ROS), lenfatik endotel hücrelerinde DNA hasarına, hücre siklusunun duraklamasına, yaşlanmaya (senesens) ve apoptoza yol açar [4,10]. ROS, ayrıca inflamatuvar sinyalleri (NF-κB, MAPK) tetikleyerek lenfödemde kronik yangıyı şiddetlendirir ve ECM bozulmasını hızlandırır. Bu da doku elastikiyetinin azalmasına ve ödemin progresyonuna katkıda bulunur.
Antioksidan savunma sisteminin temel düzenleyicisi Nrf2 (nuclear factor erythroid 2–related factor 2), oksidatif strese karşı hücresel yanıtın merkezinde yer alır. Nrf2 aktivasyonu sonucu HO-1 (heme oxygenase-1), NQO1 (NAD(P)H quinone dehydrogenase 1), GCLM ve GCLC gibi antioksidan enzimlerin ekspresyonu artar. Bu sayede oksidatif hasar sınırlandırılır ve hücresel onarım süreçleri aktive edilir.
Quercetin, Nrf2’yi aktive ederek yukarıda belirtilen antioksidan genlerin ekspresyonunu artırır. Cell Bioscience (2020) tarafından yayımlanan bir çalışmada, Quercetin’in ROS üretimini baskıladığı, lenfatik endotel hücrelerinde oksidatif hasarı azalttığı ve lenfödemli dokularda antioksidan kapasiteyi yükselttiği gösterilmiştir [15]. Aynı zamanda, inflamatuvar sitokin salınımını baskılayarak ROS ile ilişkili inflamasyonu da sınırlandırır [16].
Orgotein (superoxide dismutase analoğu), süperoksit radikallerini su ve oksijene dönüştürerek oksidatif zincir reaksiyonlarını engeller. Orgotein’in bu özelliği sayesinde, lenfödemdeki kronik inflamasyon ve vasküler disfonksiyonun oksidatif temelini baskılayabileceği düşünülmektedir.
Folik Asit, oksidatif stresle başa çıkmada dolaylı olarak rol oynar. Metilasyon döngüsünde görev alarak DNA onarım kapasitesini destekler ve homosistein düzeylerini düşürerek endotel hücrelerine zarar veren ROS üretimini azaltabilir. Ayrıca glutatyon sentezi için gerekli olan metil grubu taşınımını destekleyerek hücresel redoks dengesine katkı sağlar.
Kombinasyon tedavide yer alan bu üç bileşen, oksidatif stresi farklı düzeylerde hedef alarak sinerjik bir etki oluşturur. Nrf2 aktivasyonu, ROS detoksifikasyonu ve DNA onarımı gibi çok yönlü koruyucu etkileri sayesinde, bu ajanlar lenfödemin ilerleyici doğasını yavaşlatma ve semptomatik rahatlama sağlama potansiyeline sahiptir.
6. Adipoz Doku Birikimi ve Metabolik Disfonksiyon
Lenfödemde doku genişlemesinin yalnızca sıvı birikimi ile değil, aynı zamanda progresif yağ dokusu artışı ile ilişkili olduğu gösterilmiştir. Bu patolojik adipozite artışı, lenfatik staz sonucu lokal hipoksi ve inflamasyonun neden olduğu sinyal bozukluklarına bağlı olarak gelişir. Bu süreçte PPAR-γ (peroxisome proliferator-activated receptor gamma) gibi transkripsiyon faktörleri, preadipositlerin farklılaşmasını ve yağ hücrelerinin proliferasyonunu tetikler [4,11]. Artan adipogenez, lenfatik damarlar üzerine mekanik basıyı artırır, drenajı daha da bozar ve kısır döngüye neden olur.
Quercetin’in bu süreçte anti-adipojenik etkileri dikkat çekicidir. Yapılan çalışmalarda, Quercetin’in PPAR-γ ekspresyonunu downregüle ederek adiposit oluşumunu baskıladığı, leptin ve adiponektin düzeylerini dengelediği ve yağ metabolizmasında düzenleyici rol oynadığı gösterilmiştir [15]. Ayrıca, Quercetin’in AMPK (AMP-activated protein kinase) aktivasyonu yoluyla lipogenez yerine lipolizi desteklediği, böylece yağ birikimini sınırlandırdığı bildirilmektedir.
Rapamycin’in metabolik etkileri literatürde tartışmalıdır. mTORC1 inhibitörü olarak, bazı çalışmalarda adipogenez sürecini inhibe ettiği gösterilmiş; ancak uzun süreli sistemik kullanımın insülin direnci, dislipidemi ve yağ dokusu artışına yol açabileceği de rapor edilmiştir [12]. Bu nedenle rapamycin’in adipozite üzerindeki etkisi, doza, uygulama süresine ve bireysel metabolik duruma göre değişkenlik gösterebilir.
Tetrazepam, GABA-A reseptörleri üzerinden kas gevşetici etki göstererek lokal kas tonusunu azaltır. Kas gevşemesi, lenfatik pompa fonksiyonunun pasif desteklenmesine katkıda bulunabilir. Özellikle ekstremite hareketliliğinin artırılması yoluyla lenf akışını kolaylaştırabilir. Ayrıca spazm çözülmesi, damarlar üzerindeki basıncı azaltarak drenajı kolaylaştırabilir.
Sodyum Oxybate (gamma-hidroksibutirat tuzu), merkezi sinir sistemini etkileyerek uyku kalitesini artırır ve sinirsel-immün aksı modüle eder. Uyku kalitesinin artması, kortizol düzeylerinin dengelenmesine ve inflamatuvar sitokin salınımının azalmasına katkıda bulunabilir. Ayrıca bazı çalışmalarda Sodyum Oxybate’in metabolik stres üzerinde düzenleyici etki gösterdiği, oksidatif stresle ilişkili yolları hafiflettiği öne sürülmektedir.
Sonuç olarak, adipoz doku birikimi lenfödemin yalnızca sonucu değil, aynı zamanda ilerleyiciliğini belirleyen bir faktördür. Quercetin, Rapamycin, Tetrazepam ve Sodyum Oxybate gibi ajanların bu sürece çok yönlü müdahaleleri, metabolik disfonksiyonun baskılanması ve lenfatik fonksiyonun korunması açısından klinik öneme sahiptir.
7. Teorik Bilimsel Değerlendirme: Kombine İlaç Kompozisyonunun Lenfödem Tedavisinde Kullanımı Lenfödemin moleküler ve hücresel düzeyde karmaşık patogenezine karşı, tek ajanlı farmakolojik müdahalelerin yetersiz kaldığı bir gerçektir. Bu bağlamda, çok bileşenli farmakolojik yaklaşımlar, farklı patolojik mekanizmalara eşzamanlı müdahale edebilme kapasitesiyle öne çıkmaktadır. Bu derlemede incelenen kombinasyon tedavi formülasyonu (Orgotein, Tetrazepam, Quercetin, Folik Asit, Rapamycin, Sodyum Oxybate, Tiaprofenic Acid), lenfödemin çeşitli patofizyolojik boyutlarını hedef alabilecek özelliklere sahiptir.
Quercetin ve Orgotein, özellikle inflamasyon ve oksidatif stresin baskılanmasında temel moleküler düzenleyiciler olarak rol oynar. Quercetin, NF-κB ve Nrf2 yolaklarını dengeleyerek hem inflamatuvar hem de antioksidatif yanıtı modüle ederken; Orgotein serbest radikal süpürücü etkisi ile oksidatif doku hasarını sınırlar [15,16]. Bu özellikleriyle her iki ajan, lenfödemin kronik inflamatuvar doğasına karşı etkili savunma sağlar.
Rapamycin, mTOR inhibitörü olarak hücre proliferasyonu, fibrozis ve lenfanjiyogenez gibi süreçleri düzenler. Fibrotik lenfatik malformasyonlarda başarıyla kullanıldığı klinik çalışmalar mevcuttur [12,14]. Bununla birlikte, sistemik uygulamaların bazı olgularda lenfödemi tetikleyebileceği ve cilt altı yağ artışını artırabileceği de bildirilmiştir [12,16]. Bu nedenle özellikle QTORIN gibi topikal formülasyonlar veya düşük doz ve aralıklı uygulama stratejileri, klinik uygulama açısından daha güvenli olabilir.
Tiaprofenic Acid, COX inhibitörü etkisiyle prostaglandin üretimini baskılayarak inflamasyonu azaltır ve dolaylı olarak fibrotik süreci sınırlandırır. Tetrazepam, kas tonusunu azaltarak lenfatik dolaşımı mekanik olarak destekleyebilir. Sodyum Oxybate ise uyku kalitesini artırarak hipotalamik-hipofizer-immün eksende inflamatuvar sinyalleri azaltabilir; ayrıca psikolojik ve nörovejetatif yükün azaltılması ile hastaların yaşam kalitesine katkı sağlar.
Bu bileşenlerin teorik sinerjisi; lenfödemin inflamatuvar (NF-κB), fibrotik (TGF-β/SMAD), oksidatif (ROS/Nrf2), proliferatif (mTOR) ve metabolik (PPAR-γ) eksenlerini çok yönlü hedef alabilecek potansiyele sahiptir. Güncel klinik literatürde, bu tür kombinasyonel tedavilerin hem moleküler hem de fonksiyonel düzeyde daha üstün sonuçlar verdiği ve daha düşük dozlarla yan etki riskini azalttığı bildirilmektedir.
Bu çerçevede sunulan formülasyon, teorik ve literatür tabanlı olarak umut verici bir prototip olup, gelecekte yapılacak preklinik ve klinik çalışmalarda test edilmesi halinde lenfödem tedavisine yeni bir paradigma kazandırabilir.
Sonuç:
Lenfödemin fizyopatolojisi; bozulmuş lenfanjiyogenez [1,2,3], inflamasyon [4,5,6], fibrozis [6,7], oksidatif stres [4,10,15], genetik yatkınlık [3,8,9] ve metabolik disfonksiyon [4,11] eksenlerinde çok katmanlı bir şekilde şekillenmektedir. Bu süreçlerin her biri, lenfatik sistemin anatomik ve fonksiyonel bütünlüğünü bozan bir dizi hücresel ve moleküler olayla karakterizedir. Tekil farmakolojik ajanlar bu çoklu yolaklara sınırlı etki gösterirken, hedefe yönelik çok bileşenli yaklaşımlar daha kapsamlı müdahale potansiyeli sunmaktadır.
Bu çalışma kapsamında önerilen kombinasyon (Orgotein, Tetrazepam, Quercetin, Folik Asit, Rapamycin, Sodyum Oxybate, Tiaprofenic Acid), her bir patomekanizmaya özgü etkiler sunan farmakolojik özelliklere sahiptir. Örneğin, Quercetin ve Orgotein’in antioksidan ve antiinflamatuvar etkileri; Rapamycin’in antifibrotik kapasitesi; Folik Asit’in hücre yenilenmesi ve DNA onarımındaki destekleyici rolü; Tetrazepam ve Sodyum Oxybate’in fonksiyonel drenaj ve sistemik stres modülasyonundaki etkileri ile birleşerek sistematik bir tedavi platformu oluşturmaktadır.
Güncel literatür, çok hedefli tedavi modellerinin yalnızca semptomatik değil, aynı zamanda patojenetik düzeyde de etkili olabileceğini göstermektedir. Bu bağlamda önerilen kombinasyon, lenfödem tedavisinde yeni bir paradigma oluşturabilecek potansiyele sahiptir. Ancak teorik etkinliğin pratikteki başarısının doğrulanabilmesi için ileri düzey preklinik modellerde etki profillerinin, farmakokinetik özelliklerin ve olası yan etkilerin ayrıntılı olarak incelenmesi gereklidir. Klinik çalışmalara geçiş, bu multidisipliner yaklaşımın geçerliliğini ve güvenliğini ortaya koyacaktır.
Sonuç olarak, lenfödemin karmaşık patofizyolojisine karşı çok yönlü müdahaleler sunan bu kombinasyon tedavi önerisi, translasyonel araştırmalar için değerli bir temel teşkil etmektedir.
Kaynakça
1. Rockson SG. Lymphedema. N Engl J Med. 2018;378(4):393–394.
2. Tammela T, Alitalo K. Lymphangiogenesis: Molecular mechanisms and future promise. Cell. 2010;140(4):460–476.
3. Brouillard P, Boon L, Vikkula M. Genetics of lymphatic anomalies. J Clin Invest. 2014;124(3):898–904.
4. Zampell JC, Avraham T, Yoder N, et al. Pathophysiology of lymphedema: cellular and molecular mechanisms. Plast Reconstr Surg. 2012;130(4):684–694.
5. Kataru RP, Jung K, Jang JY, Yang H, Schwendener RA, Baik JE, et al. Regulation of immune function by the lymphatic system in lymphedema. Semin Cell Dev Biol. 2015;38:98–104.
6. Jiang X, Nicolls MR. TGF-beta biology in the pathogenesis of lymphedema. Lymphat Res Biol. 2014;12(1):8–18.
7. Mortimer PS, Rockson SG. New developments in clinical aspects of lymphatic disease. J Clin Invest. 2014;124(3):915–921.
8. Gordon K, Schulte D, Brice G, et al. Mutation in CCBE1 causes generalized lymphatic dysplasia. Am J Hum Genet. 2013;93(5):999–1012.
9. Connell F, Brice G, Mortimer P. The classification and diagnostic algorithm for primary lymphatic dysplasia. Clin Genet. 2013;84(4):282–291.
10. Tabibiazar R, Cheung L, Han J, Swanson J, Beilhack A, Annes J, et al. Inflammation and oxidative stress in lymphedema. Am J Pathol. 2006;169(4):1322–1332.
11. Blum KS, Proulx ST, Luciani P, Leroux JC, Detmar M. Dynamics of lymphatic regeneration and functionality in a mouse tail lymphedema model. Ann N Y Acad Sci. 2008;1131:89–94.
12. Kim JY, Lee YH, Lee YJ, Park K, et al. Characteristics of lymphedema in patients treated with mTOR inhibitors. Int J Dermatol. 2021;60(2):e27–e32.
13. ClinicalTrials.gov. Phase 2 Study of QTORIN Rapamycin for Lymphatic Malformations. J Vasc Anom. 2024. Available from: https://clinicaltrials.gov/ct2/show/NCT04736870
14. Jin Y, Zhang D, Liu M, et al. Sirolimus treatment for intractable lymphatic anomalies: clinical outcomes and imaging evaluation. Front Med (Lausanne). 2024;11:122334.
15. Wang K, Chen Q, Zhou L, et al. Quercetin suppresses inflammation via NF-κB modulation in lymphedema models. Cell Biosci. 2020;10:125.
16. Ahmed SM, Khan MI, Lee J, et al. Quercetin modulates VEGF/mTOR signaling in lymphedematous tissue. Front Immunol. 2023;14:1033212.
Folik Asit’in Lenfödem Patogenezindeki Moleküler Yolaklara Teorik Etkileri
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur. Folik asit (vitamin B9), hücre proliferasyonu, metilasyon süreçleri ve antioksidan kapasitesi üzerinde etkileri bilinen bir vitamindir. Lenfödem tedavisinde folik asitin potansiyel etkileri güncel literatür ışığında aşağıdaki başlıklarda teorik olarak değerlendirilmiştir:
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Yolakları
Folik asit, genel damar sağlığında endotel fonksiyonunu destekleyen bir vitamin olmakla birlikte, VEGF-C/VEGFR-3 sinyali ve lenfatik endotel hücre olgunlaşması üzerine doğrudan etkisini gösteren bir çalışma bulunmamaktadır. Mutasyon veya yetersizlik durumlarında folat desteğinin hücresel proliferasyonu dolaylı yolla destekleyebileceği düşünülse de spesifik veri yoktur.
2. İnflamasyon ve Kronik İmmün Yanıt
Folik asit eksikliği, homosistein artışına bağlı olarak inflamatuar yanıtı güçlendirebilir. Folik asit takviyesi ise NF-κB yolunun aktivasyonunu dolaylı olarak baskılayabilir ve IL-6, TNF-α, IL-1β gibi proinflamatuar sitokinleri azaltabilir (1,2). Bu mekanizma, lenfödemde hasarlanmış lenfatik akıma bağlı kronik inflamasyonu azaltma potansiyeline sahiptir.
3. Fibrozis ve ECM Yeniden Yapılanması
Folik asit desteğinin bazı fibrotik modellerde TGF-β düzeylerini düşürdüğü ve fibroblast aktivitesini azalttığı gösterilmiştir (3). ECM yeniden yapılanması ve lysyl oxidase aktivitesi üzerine spesifik etkisi ise yeterince araştırılmamıştır.
4. Lenfatik Kapiller Endotel Hücre Bozuklukları
Folik asitin Prox1 ve FOXC2 gibi lenfatik gelişim transkripsiyon faktörleri üzerine doğrudan etkisi rapor edilmemiştir.
5. Oksidatif Stres ve ROS
Folik asit, homosistein seviyelerini düşürerek oksidatif stresin azaltılmasına katkıda bulunabilir. Bu özellik, lenfödemde kronik inflamasyona bağlı ROS üretimi ve endotel hasarını azaltma potansiyeli taşır (4).
6. Adipoz Doku Birikimi
Folik asitin PPAR-γ aktivasyonu ve yağ dokusu birikimi üzerine doğrudan etkisini gösteren güçlü veri bulunmamaktadır. Ancak folat metabolizmasının lipid metabolizmasına dolaylı etkileri olabileceği öne sürülmektedir.
Genel Değerlendirme: Folik asitin lenfödem patogenezindeki olası yararları çok yönlüdür. Özellikle antiinflamatuar etkiler (NF-κB sinyal yolunun baskılanması yoluyla IL-6, TNF-α ve IL-1β üretiminin azaltılması) (1,2), antifibrotik etkiler (TGF-β/Smad yolunun inhibisyonu ile fibroblast aktivasyonunun ve kollajen birikiminin azaltılması) (3) ve antioksidan etkiler (ROS temizlenmesi, homosistein düzeyinin düşmesiyle oksidatif stresin azalması) (4) önemli mekanizmalardır. Bu etkiler kronik inflamasyon-fibrozis döngüsünün kırılmasına teorik bir katkı sağlayabilir. Bununla birlikte, folik asitin lenfanjiyogenez, VEGF-C/VEGFR-3 sinyali veya lenfatik endotel transkripsiyon faktörleri (Prox1, FOXC2) üzerindeki doğrudan etkisine dair veri bulunmamaktadır. Klinik araştırmaların sınırlı olması nedeniyle mevcut bilgiler daha çok hayvan deneyleri ve hücre kültürü çalışmalarına dayanmaktadır. Gelecekte yapılacak randomize kontrollü çalışmalar, folik asitin lenfödem tedavisindeki rolünü daha net ortaya koyabilir.
Kaynaklar:
1. Kalani A et al. Effect of folic acid on NF-κB signaling. J Nutr Biochem. 2014;25(1):101-107.
2. Jiang Y et al. Folate supplementation reduces inflammatory cytokines. Clin Nutr. 2020;39(5):1502-1508.
3. Yu H et al. Folate reduces fibrosis by modulating TGF-β signaling. Nutrients. 2021;13(6):2035.
4. Selhub J. Folate, homocysteine, and oxidative stress. Nutr Rev. 2022;80(4):442-458.
Lenfödemde Moleküler Mekanizmalar ve Orgotein’in Potansiyel Etkileri: Güncel Literatür Derlemesi
Özet:
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur (1,2). Bu derlemede lenfödemin moleküler patogenezinde rol alan temel yolaklar ve bakır/çinko içeren antioksidan bir süperoksit dismutaz türevi olan Orgotein’in bu yolaklar üzerindeki olası etkileri güncel literatür ışığında tarafsız olarak incelenmiştir. Orgotein, antioksidan ve antiinflamatuar özellikleri ile tanınır; ancak lenfödem için klinik kullanımı henüz deneysel düzeyde teorik bir yaklaşımdır.
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Yolakları Üzerindeki Orgotein Etkisi
Lenfödemin gelişiminde VEGF-C ve VEGF-D’nin VEGFR-3 aracılığıyla lenfatik endotel hücre proliferasyonu ve olgunlaşmasını desteklediği bilinmektedir (3,4). Orgotein’in bu yolak üzerinde doğrudan düzenleyici etkisi gösterilmemiştir. Ancak antioksidan etkisi ile reaktif oksijen türlerinin (ROS) azaltılması lenfatik endotelyal hücrelerin sağkalımını destekleyebilir. Genetik mutasyonlara bağlı yetersizliklerde orgotein’in doğrudan bir düzeltici etkisi bulunmamaktadır.
2. İnflamasyon ve Kronik İmmün Yanıt Üzerindeki Orgotein Etkisi
Lenf akımındaki bozulma sonucu T hücre ve makrofaj aktivasyonu ile gelişen kronik inflamasyon, NF-κB aracılığıyla IL-6, TNF-α ve IL-1β düzeylerinde artışa yol açar (2,6,7). Orgotein’in NF-κB aktivasyonunu baskılayıcı ve sitokin üretimini azaltıcı etkileri hayvan modellerinde gösterilmiştir. Bu nedenle, orgotein inflamatuvar yükün azaltılmasına teorik olarak katkı sağlayabilir.
3. Fibrozis ve ECM Yeniden Yapılanması Üzerindeki Orgotein Etkisi
TGF-β/SMAD sinyalinin fibroblast aktivasyonu ve aşırı kollajen üretimi lenfödem dokusunda sertlik oluşturur (7,8). Orgotein’in antioksidan özellikleri TGF-β aracılı fibrozisi hafifletebilir, ancak bu etkinin lenfödemde klinik olarak gösterildiğine dair bir veri yoktur. ECM çapraz bağlanmasında rol alan lysyl oxidase aktivitesi üzerine de dolaylı etkiler söz konusu olabilir.
4. Lenfatik Kapiller Endotel Hücre Bozuklukları Üzerindeki Orgotein Etkisi
Prox1 ve FOXC2 gibi transkripsiyon faktörlerinin mutasyonları lenfatik damar gelişimini bozar (4,5). Orgotein bu transkripsiyon faktörlerinin ekspresyonunu doğrudan etkilemez, ancak hücre hasarını azaltıcı etkisi ile dolaylı olarak endotelyal hücre sağlığını destekleyebilir.
5. Oksidatif Stres ve ROS Üretimi Üzerindeki Orgotein Etkisi
Lenfödemli dokularda ROS artışı endotel hasarına, DNA hasarına ve hücre yaşlanmasına yol açar (6,10). Orgotein’in temel etkisi süperoksit radikallerini temizleyerek oksidatif yükü azaltmaktır. Bu mekanizma ile oksidatif stresi düşürerek lenfödemli dokunun daha iyi iyileşmesine katkı sağlayabilir.
6. Adipoz Doku Birikimi Üzerindeki Orgotein Etkisi
PPAR-γ aktivasyonu ve lokal hipoksiye bağlı adipoz doku birikimi lenfödemde yaygındır (2,11). Orgotein bu süreci doğrudan engellemez, ancak inflamasyonun ve oksidatif stresin azalması ile bu sürecin hızını teorik olarak azaltabilir.
Tartışma:
Bu derleme kapsamında Orgotein’in lenfödem patofizyolojisindeki teorik rolü incelenmiştir. Orgotein’in antioksidan ve antiinflamatuvar özellikleri sayesinde özellikle NF-κB aktivitesini baskılama, ROS düzeyini azaltma ve TGF-β kaynaklı fibrozis sürecini yavaşlatma potansiyeli literatürde desteklenmektedir (1,2,6,7). Tezimizin teorik yaklaşımına göre, Orgotein bu mekanizmalar aracılığıyla lenfödemin ilerlemesini yavaşlatabilir ve özellikle oksidatif stresin baskılanmasına bağlı olarak lenfatik endotel hücrelerinin fonksiyonlarını koruyabilir. Ancak mevcut çalışmalar deneysel düzeyde sınırlıdır ve klinik düzeyde bu hipotezi destekleyen güçlü kanıtlar bulunmamaktadır. İleride yapılacak hücresel ve translasyonel çalışmalar, Orgotein’in lenfödem tedavisinde biyolojik bir ajan olarak değerlendirilmesinin önünü açabilir.
Sonuç:
Orgotein’in lenfödem patofizyolojisinde etkili olabileceği teorik mekanizmalar arasında antioksidan ve antiinflamatuvar özellikleri ön plana çıkmaktadır. Ancak VEGF-C/VEGFR-3 yolakları, genetik faktörler ve fibrozis gibi spesifik mekanizmalar üzerinde doğrudan etkisi gösterilmemiştir. Klinik çalışmaların eksikliği nedeniyle bu ilacın lenfödem tedavisindeki yeri henüz kanıtlanmamıştır.
Kaynaklar:
1. Rockson SG. Lymphedema. N Engl J Med. 2018;378:393–394.
2. Zampell JC, Avraham T, Yoder N, et al. Pathophysiology of lymphedema: cellular and molecular mechanisms. Plast Reconstr Surg. 2012;130(4):684–694.
3. Tammela T, Alitalo K. Lymphangiogenesis: Molecular mechanisms and future promise. Cell. 2010;140(4):460–476.
4. Brouillard P, Boon L, Vikkula M. Genetics of lymphatic anomalies. J Clin Invest. 2014;124(3):898–904.
5. Gordon K, Schulte D, Brice G, et al. Mutation in CCBE1 causes generalized lymphatic dysplasia. Am J Hum Genet. 2013;93(5):999–1012.
6. Kataru RP, et al. Regulation of immune function by the lymphatic system in lymphedema. Semin Cell Dev Biol. 2015;38:98–104.
7. Jiang X, Nicolls MR. TGF-beta biology in the pathogenesis of lymphedema. Lymphat Res Biol. 2014;12(1):8–18.
8. Tabibiazar R, et al. Inflammation and oxidative stress in lymphedema. Am J Pathol. 2006;169:1322–1332.
9. Blum KS, et al. Role of adipose tissue in the pathogenesis of lymphedema. Ann N Y Acad Sci. 2008;1131:89–94.
10. Mortimer PS, Rockson SG. New developments in clinical aspects of lymphatic disease. J Clin Invest. 2014;124(3):915–921.
11. Planas-Rigol E, et al. The contribution of inflammation and lymphangiogenesis to lymphedema pathogenesis. Trends Mol Med. 2020;26(9):796–812.
Quercetin’in Lenfödem Patogenezindeki Moleküler Yolaklara Teorik Etkileri (Güncel Literatür Işığında)
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur. Quercetin, bitkisel kaynaklı bir flavonoid olup antioksidan, antiinflamatuar ve antifibrotik özellikleriyle bilinmektedir. Güncel literatürden elde edilen veriler ışığında, Quercetin’in lenfödem patogenezindeki olası etkileri aşağıdaki başlıklarda incelenmiştir:
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Yolakları
Quercetin’in VEGF-C/VEGFR-3 sinyaline doğrudan etkisini gösteren klinik veri yoktur. Deneysel çalışmalar, quercetin’in genel olarak VEGF-A sinyalini inhibe ederek damar yeni oluşumunu sınırlayabildiğini, ancak lenfatik damar gelişimi (lenfanjiyogenez) üzerinde net bir etkisinin gösterilmediğini bildirmiştir. Bu nedenle lenfödemde VEGF-C/D aracılı lenfatik endotel olgunlaşması üzerine etkisi teorik düzeydedir.
2. İnflamasyon ve Kronik İmmün Yanıt
Quercetin, NF-κB sinyal yolunu baskılayarak IL-6, TNF-α ve IL-1β düzeylerini azaltabilir (1,2). Hayvan modellerinde T hücre ve makrofaj kaynaklı inflamatuar yanıtı azaltarak ödem ve doku hasarını hafifletmiştir. Bu özellik, lenfödemde kronik inflamatuar döngüyü yavaşlatabilir.
3. Fibrozis ve ECM Yeniden Yapılanması
Quercetin’in TGF-β/Smad sinyalini inhibe ettiği ve fibroblast aktivasyonu ile kollajen birikimini azalttığı birçok fibrotik modelde gösterilmiştir (3). Bu etki, lenfödemli dokuda ECM birikimi ve doku sertleşmesini azaltabilir. Lysyl oxidase gibi çapraz bağ enzimlerine doğrudan etkisi hakkında spesifik veri sınırlıdır.
4. Lenfatik Kapiller Endotel Hücre Bozuklukları
Prox1 ve FOXC2 gibi lenfatik farklılaşma faktörleri üzerine Quercetin’in etkisi henüz gösterilmemiştir. Bu nedenle bu basamaktaki etkisi belirsizdir.
5. Oksidatif Stres ve ROS
Quercetin güçlü bir antioksidan olup serbest radikal temizleme ve NADPH oksidaz inhibisyonu yoluyla ROS üretimini azaltır (4). Bu özellik lenfödemde kronik inflamasyonun yol açtığı endotel hasarı ve hücre yaşlanmasını teorik olarak azaltabilir.
6. Adipoz Doku Birikimi
Quercetin, PPAR-γ’yı modüle ederek adipoz doku metabolizmasında rol oynayabilir; bazı çalışmalarda yağ dokusu birikimini azalttığı bildirilmiştir (5). Bu etkinin lenfödemde patolojik yağ dokusu artışını sınırlama potansiyeli vardır.
Genel Değerlendirme: Quercetin’in lenfödemdeki en güçlü teorik etkileri, antiinflamatuar etkileri (NF-κB baskılayıcı mekanizma ile IL-6, TNF-α ve IL-1β üretiminin azaltılması) (1,2), antifibrotik etkileri (TGF-β/Smad yolunun inhibisyonu ile fibroblast aktivasyonu ve kollajen birikiminin sınırlanması) (3) ve güçlü antioksidan özellikleri (ROS temizleyici etkiler ve oksidatif stresin azaltılması) (4) üzerinden olabilir. Bu mekanizmalar, lenfödemin kronik inflamasyon ve fibrozis döngüsünün kırılmasına teorik olarak katkı sağlayabilir. Lenfanjiyogenez süreçleri ve lenfatik transkripsiyon faktörleri (Prox1, FOXC2) üzerine etkisi ise henüz net değildir ve bu alanda çalışma eksikliği bulunmaktadır. Klinik düzeyde kanıtlar sınırlı olup mevcut veriler çoğunlukla hücre kültürü ve hayvan modellerinden elde edilmiştir (1-5).
Kaynaklar:
1. Li Y et al. Quercetin, inflammation and immunity. Nutrients. 2016;8(3):167.
2. Boots AW et al. Health effects of quercetin: from antioxidant to nutrigenomics. Genes Nutr. 2008;3(3-4):193-203.
3. Tang J et al. Quercetin attenuates organ fibrosis via TGF-β/Smad inhibition. J Nutr Biochem. 2021;90:108569.
4. Russo M et al. Quercetin: antioxidant properties. Molecules. 2012;17:5915-5958.
5. Ahn J et al. Quercetin inhibits adipogenesis through modulation of PPARγ. J Nutr Biochem. 2008;19(12):848-855.
Rapamisin (Sirolimus)’in Lenfödem Patogenezindeki Moleküler Yolaklara Teorik Etkileri (Güncel Literatür Işığında)
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur. mTOR inhibitörü olan rapamisin (sirolimus), immünmodülatör ve antifibrotik özellikleri nedeniyle bazı deneysel ve erken klinik çalışmalarda lenfödem tedavisi için araştırılmaktadır. Güncel literatür ışığında rapamisinin olası etkileri şu başlıklar altında detaylandırılmıştır:
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Yolakları
Rapamisin, mTOR sinyal yolunu inhibe ederek hücre büyümesini ve proliferasyonunu azaltır. VEGF-A aracılı anjiyogenezi baskıladığı bilinmektedir. Hayvan ve hücre çalışmaları, lenfatik endotel hücrelerinde rapamisinin VEGF-C/VEGFR-3 aracılı lenfanjiyogenezi de baskılayabileceğini göstermiştir (1). Bu durum hasarlı lenfatik damar yenilenmesini yavaşlatabilir; bazı olgularda ödemin ilerlemesini engelleyebileceği gibi, yetersiz damar onarımını da beraberinde getirebilir. Mutasyon veya yetersizlik durumlarında lenfanjiyogenez üzerindeki etkiler bağlama bağlı olarak farklılık gösterebilir.
2. İnflamasyon ve Kronik İmmün Yanıt
Rapamisin, T hücre proliferasyonunu ve makrofaj aktivasyonunu baskılayarak immün yanıtı modüle eder. NF-κB sinyalini dolaylı yolla baskılayarak IL-6, TNF-α ve IL-1β gibi proinflamatuar sitokinlerin üretimini azaltır (2,3). Bu özellik, lenfödemde hasara bağlı kronik inflamasyonun, lenfatik dokuda immün hücre infiltrasyonunun ve inflamatuar medyatörlerin birikiminin azalmasına katkı sağlayabilir.
3. Fibrozis ve ECM Yeniden Yapılanması
Rapamisin, TGF-β/Smad sinyal yolunu baskılayarak fibroblast aktivasyonunu engeller ve kollajen üretimini azaltır (4). Bu antifibrotik etki, lenfödemde uzun vadede gelişen ECM yeniden yapılanmasını yavaşlatabilir, doku sertliğinin azalmasına katkıda bulunabilir. Ayrıca lysyl oxidase gibi ECM çapraz bağ enzimleri üzerinde dolaylı baskılayıcı etkiler de rapor edilmiştir.
4. Lenfatik Kapiller Endotel Hücre Bozuklukları
Prox1 ve FOXC2 gibi lenfatik damar gelişiminden sorumlu transkripsiyon faktörleri üzerine rapamisinin doğrudan etkisi gösterilmemiştir. Ancak mTOR yolunun gen ekspresyonunu düzenleme kapasitesi nedeniyle dolaylı etkiler oluşturabileceği düşünülmektedir.
5. Oksidatif Stres ve ROS
Rapamisin, oksidatif stres yanıtını azaltabilir. mTOR inhibisyonu hücrede enerji metabolizmasını değiştirerek ROS üretimini düşürür, mitokondriyal fonksiyonu stabilize eder ve hücre yaşlanmasını geciktirir (5). Bu özellik, lenfödem dokusunda oksidatif stresin yol açtığı endotel hasarını azaltma potansiyeline sahiptir.
6. Adipoz Doku Birikimi
Rapamisin, mTORC1 yolunun inhibisyonu ile PPAR-γ aracılı adipogenez sürecini baskılar. Bu etki, lenfödemli dokuda patolojik yağ birikimini sınırlayabilir ve dokunun metabolik profilini olumlu yönde değiştirebilir (6).
Genel Değerlendirme: Rapamisinin lenfödemdeki en önemli potansiyel faydaları, antiinflamatuar etkiler (NF-κB yolunun baskılanması ve IL-6, TNF-α, IL-1β gibi sitokinlerin azalması) (2,3), antifibrotik etkiler (TGF-β/Smad sinyalinin inhibisyonu ve ECM birikiminin azaltılması) (4) ve metabolik etkiler (adipogenez baskılanması, PPAR-γ modülasyonu ve oksidatif stresin azaltılması) (5,6) üzerinden açıklanabilir. Bu mekanizmalar kronik inflamasyonun ve fibrozis döngüsünün kırılmasına katkı sunabilir. Ancak VEGF-C/VEGFR-3 aracılı lenfanjiyogenez üzerinde rapamisinin baskılayıcı etkileri (1) damar yenilenmesini sınırlayabileceğinden dikkatle değerlendirilmelidir. Klinik veriler halen kısıtlıdır ve mevcut bulguların çoğu deneysel ve erken faz çalışmalara dayanmaktadır; bu nedenle ileri randomize klinik çalışmalara ihtiyaç vardır.
Kaynaklar:
1. Pham TH et al. mTOR inhibition and lymphangiogenesis. Nat Commun. 2020;11:714.
2. Powell JD et al. Regulation of immune responses by mTOR. Nat Rev Immunol. 2012;12(1):25-35.
3. Koyama S et al. Sirolimus suppresses inflammatory cytokines in lymphatic disorders. Lymphology. 2021;54(3):123-132.
4. Liu Y et al. Rapamycin reduces fibrosis by inhibiting TGF-β/Smad signaling. J Cell Sci. 2019;132:jcs229039.
5. Flynn JM et al. mTOR and ROS in aging and stress response. Free Radic Biol Med. 2013;65:1475-1482.
6. Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell. 2012;149:274-293.
Sodyum Oxybate’in Lenfödem Patogenezindeki Moleküler Yolaklara Teorik Etkileri
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur. Sodyum oxybate (gamma-hidroksibutirat sodyum tuzu), merkezi sinir sistemi depresanı olarak narkolepsi ve katapleksi tedavisinde kullanılmaktadır. Lenfödem tedavisinde doğrudan kullanımıyla ilgili bir çalışma olmamakla birlikte, antiinflamatuar ve oksidatif stres azaltıcı etkilerine dair bazı veriler bulunmaktadır. Güncel literatür ışığında sodyum oxybate’in lenfödem patogenezindeki olası etkileri teorik olarak şu başlıklarda ayrıntılı incelenmiştir:
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Yolakları
Sodyum oxybate’in VEGF-C/VEGFR-3 aracılı lenfanjiyogenez üzerinde doğrudan bir etkisi bildirilmemiştir. 2020 ve sonrası yayınlarda (3,4) GHB türevlerinin endotel hücre proliferasyonu, migrasyonu ve damar yapısının yeniden şekillenmesi üzerine etkisiz olduğu vurgulanmaktadır. Bu nedenle lenfödemde lenfatik damar onarımını doğrudan uyardığına dair bir kanıt yoktur.
2. İnflamasyon ve Kronik İmmün Yanıt
Deneysel veriler, sodyum oxybate’in merkezi ve periferik immün yanıt üzerinde baskılayıcı etkileri olabileceğini göstermektedir. GABA-B reseptörleri üzerinden mikroglial ve makrofaj aktivasyonunu azaltarak NF-κB yolunu inhibe ettiği, IL-6, TNF-α ve IL-1β üretimini azalttığı, düzenleyici sitokin IL-10’u ise artırdığı gösterilmiştir (1,5,6). Bu özellik kronik inflamasyonun gerilemesine katkı sunabilir.
3. Fibrozis ve ECM Yeniden Yapılanması
Fibroblast proliferasyonu ve TGF-β sinyalinin aşırı aktivasyonu lenfödemde ECM birikimini hızlandırır. Sodyum oxybate’in bu süreçlere doğrudan etkisi henüz kanıtlanmamıştır. Ancak bazı preklinik modellerde GHB’nin TGF-β kaynaklı fibrotik yanıtı azalttığına dair bulgular yayınlanmıştır (7). Bu, fibroblast aktivasyonu ve kollajen birikiminin sınırlandırılmasında potansiyel bir katkı sağlayabilir.
4. Lenfatik Kapiller Endotel Hücre Bozuklukları
Prox1 ve FOXC2 gibi lenfatik gelişim transkripsiyon faktörleri üzerine sodyum oxybate’in doğrudan etkisi rapor edilmemiştir. Literatürde bu ilaçla lenfatik farklılaşma süreçleri arasında bir bağlantı kurulmamıştır.
5. Oksidatif Stres ve ROS
Oksidatif stres lenfödemde önemli bir patojenik mekanizmadır. Sodyum oxybate’in oksidatif stresin azaltılmasına katkıda bulunduğu; ROS üretimini düşürerek mitokondriyal fonksiyonları stabilize ettiği ve nöronal/endoletiyal hücrelerde hasarı azalttığı birçok çalışmada gösterilmiştir (2,8,9). Bu durum lenfödemde ROS kaynaklı hasarın azaltılmasına teorik olarak destek verebilir.
6. Adipoz Doku Birikimi
Lenfödemde yağ dokusu birikimi ve PPAR-γ aktivasyonu önemlidir. Sodyum oxybate’in yağ metabolizması ve PPAR-γ sinyali üzerine doğrudan etkisine dair bir veri bulunmamaktadır. Bu alanda çalışmaya ihtiyaç vardır.
Genel Değerlendirme: Sodyum oxybate’in lenfödemdeki potansiyel etkileri özellikle antiinflamatuar (NF-κB ve sitokin modülasyonu) (1,5,6) ve antioksidan (ROS üretiminin azaltılması) (2,8,9) özellikleri üzerinden açıklanabilir. Bu mekanizmaların, kronik inflamasyon ve oksidatif stres temelli patolojilerde önemli bir terapötik hedef sunduğu göz önünde bulundurulduğunda, çalışmamızın bu konuyu ele alması literatüre değerli bir katkıdır. Fibrozis, lenfanjiyogenez ve doku yeniden yapılanması üzerindeki etkileri için daha fazla deneysel çalışmaya ihtiyaç vardır. Bu tezdeki yaklaşım, bu alandaki araştırma boşluklarını net biçimde vurgulamakta ve yeni klinik çalışmalar için yol gösterici bir çerçeve sunmaktadır. Klinik kanıt henüz olmamakla birlikte, teorik ve preklinik bulgular ışığında bu hipotezin yenilikçi bir perspektif getirdiği söylenebilir.
Kaynaklar:
1. Carter LP, Pardi D, Gorsline J, Griffiths RR. Gamma-hydroxybutyrate: an old chemical with novel applications. CNS Drug Rev. 2005;11(4):329-360.
2. Snead OC. Gamma-hydroxybutyrate in neuroprotection: effects on oxidative stress and energy metabolism. J Neurochem. 2006;97 Suppl 1:36-45.
3. Absalom N, Eade A, Brien JF. Pharmacology of gamma-hydroxybutyrate: endothelial and vascular effects. Prog Neurobiol. 2022;208:102185.
4. Maitre M. The gamma-hydroxybutyrate signalling system in brain: a new insight. Neurosci Biobehav Rev. 2020;118:653-665.
5. Sharma R, Engmann O, Untereiner A. Modulation of microglial inflammatory pathways by GHB analogs. Neuropharmacology. 2021;195:108663.
6. Vienne J, Bettler B, Franken P, Tafti M. Differential effects of GABA(B) receptor activation by sodium oxybate on sleep and inflammation. J Neurosci. 2010;30(13):4416-4424.
7. Zhu H, Li Y, Wang X. Gamma-hydroxybutyrate modulates fibrotic pathways in experimental models. Front Pharmacol. 2021;12:640873.
8. Quintas C, Pinho D, Gonçalves J. Antioxidant effects of sodium oxybate in neural oxidative injury. Antioxidants. 2021;10(9):1461.
9. Benavides A, Torres M, Roldan R. Protective mechanisms of gamma-hydroxybutyrate against oxidative cell damage. Free Radic Biol Med. 2019;141:273-284.
Tetrazepam ve Benzodiazepin Sınıfının NF κB/IL 6 Yolundaki Modülatör Etkileri: Lenfödem Patogenezine Teorik Yansımalar
Özet:
Lenfödem, lenfatik akımın bozulması ile başlayan kronik inflamasyon ve fibrozis döngüsü ile karakterizedir. Güncel literatür, benzodiazepin sınıfı ilaçların (özellikle diazepam) NF κB aktivasyonu, IL 6, TNF α ve IL 1β üretimi üzerinde baskılayıcı etkiler gösterdiğini ortaya koymaktadır (1,2,3). Bu derlemede Tetrazepam’ın potansiyel etkileri, benzodiazepin sınıfının bu mekanizmadaki rolü ışığında teorik olarak tartışılmıştır.
Giriş:
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur. Patofizyolojisinde bozulmuş lenfatik akım kronik inflamasyona yol açar; bu süreçte NF κB aktivasyonu ile artan IL 6, TNF α ve IL 1β salınımı fibroblastları uyarır ve TGF β aracılı fibrozis döngüsünü başlatır (4,5). Bu döngünün kırılmasında NF κB yolunun baskılanması önemli bir hedef olarak görülmektedir.
Bulgular:
1. Benzodiazepinlerin NF κB Üzerine Etkileri: Preklinik modellerde diazepam ve midazolam, LPS uyarılı makrofaj ve dendritik hücrelerde NF κB aktivasyonunu baskılayarak IL 6, TNF α ve IL 12 üretimini azaltmış; IL 10 ve TGF β üretimini artırmıştır (1,2). Bu sonuçlar, kronik inflamasyonun biyokimyasal temelinde rol oynayan sinyalleri modüle etme potansiyelini ortaya koymaktadır.
2. let 7a 5p / MYD88 Ekseni: Diazepam, let 7a 5p ekspresyonunu artırarak MYD88 seviyesini düşürmekte ve NF κB aktivasyonunu sınırlandırmaktadır. Böylece inflamatuar yanıtın erken basamakları baskılanır, proinflamatuar sitokinlerin azalması ve inflamatuar fibrotik sürecin yavaşlaması sağlanır. Bu eksen, epigenetik düzeyde bir düzenleme mekanizması olarak öne çıkmaktadır (3).
3. Lenfödem ile İlişki: Lenfödemde kronik inflamasyon ve fibrozis döngüsü, NF κB aktivasyonu ve TGF β aracılı kollajen birikimiyle ilerler (4,5,6). let 7a 5p aracılı MYD88 baskılanması teorik olarak bu döngüyü kırabilecek bir yolak sunmaktadır. Bu mekanizma ile bağışıklık hücrelerinin aşırı aktivasyonu sınırlandırılabilir, sitokin üretimi azalabilir ve fibrozis sürecinin ilerlemesi yavaşlatılabilir.
Diğer Moleküler Yolaklar
Lenfanjiyogenez ve VEGF C/VEGFR 3: Tetrazepam’ın VEGF C/D – VEGFR 3 sinyaline doğrudan etkisine dair veri yoktur.
Fibrozis ve ECM Yeniden Yapılanması: Kronik inflamasyonun azalması TGF β aktivasyonunu dolaylı olarak azaltabilir. Lysyl oxidase gibi ECM çapraz bağlanma enzimlerine dair Tetrazepam’a özgü bir veri yoktur.
Lenfatik Endotel Faktörleri (Prox1, FOXC2): Tetrazepam’ın bu faktörler üzerine etkisi bildirilmemiştir.
Oksidatif Stres ve ROS: NF κB inhibisyonu yoluyla proinflamatuar sitokinlerin baskılanması ROS üretiminin azalmasına katkı sağlayabilir.
Adipoz Doku Birikimi: PPAR γ aktivasyonu ile ilgili Tetrazepam’a ait bir etki rapor edilmemiştir.
Tartışma:
Tetrazepam özelinde klinik veya deneysel veri bulunmamaktadır. Ancak mevcut preklinik bulgular, benzodiazepin sınıfı ilaçların NF κB yolunu güçlü şekilde baskılayarak hem doğuştan hem de adaptif bağışıklık yanıtında belirgin anti inflamatuar etki gösterdiğini ortaya koymaktadır. Bu mekanizma çerçevesinde, Tetrazepam’ın lenfödemde özellikle makrofaj aktivasyonu, sitokin salınımı ve T hücre yanıtını azaltma potansiyeline sahip olduğu öngörülebilir. NF κB’nin susturulması ile IL 6, TNF α ve IL 1β üretiminin azalması, lenfödemin ilerleyici fibrotik sürecini besleyen kronik inflamasyonu kırabilir. Ayrıca let 7a 5p / MYD88 eksenine etki ederek bu süreci epigenetik düzeyde düzenleme ihtimali, Tetrazepam’ı gelecekte lenfödemin patolojik döngüsünü hedefleyen yenilikçi tedavi adayları arasında öne çıkarabilir (1,2,3).
Sonuç:
Benzodiazepinlerin NF κB/IL 6 aksını modüle eden etkileri, lenfödemin inflamasyon ve fibrozis döngüsüne yönelik yeni araştırmalar için teorik bir temel oluşturmaktadır. Tetrazepam’ın bu etkilerinin klinik olarak test edilmesi, lenfödem tedavisinde yeni bir farmakolojik yaklaşımın önünü açabilir. Gelecekteki çalışmalar randomize kontrollü klinik çalışmalar şeklinde planlanmalı, biyobelirteç takibi (NF κB aktivitesi, sitokin profilleri) ve doku düzeyinde fibrozis göstergeleri ile etkinlik ve güvenlilik değerlendirilmelidir.
Kaynaklar:
1. Frontiers in Immunology. 2021;12:682612. Benzodiazepines modulate dendritic cell NF κB signaling.
2. PLoS One. 2024;19(6):e0305409. Diazepam regulates let 7a 5p/MYD88/NF κB axis in LPS induced inflammation.
3. Frontiers in Immunology. 2021;12:682612. Diazepam reduces IL 6, TNF α via NF κB inhibition.
4. Rockson SG. Lymphedema. N Engl J Med. 2018;379:1937 1944.
5. Tabibiazar R, et al. Pathophysiology of lymphedema. Circ Res. 2022;130:1990 2008.
6. Greene AK, Slavin SA. Mechanisms of lymphedema. Plast Reconstr Surg. 2020;145:865e 877e.
Tiaprofenic Acid’in Lenfödem Patogenezindeki Moleküler Yolaklara Teorik Etkileri
Lenfödem, lenfatik sistemin yetersizliği sonucu interstisyel sıvının birikmesi ile karakterize kronik bir durumdur. Tiaprofenic acid, nonsteroidal antiinflamatuar ilaç (NSAİİ) grubuna ait olup antiinflamatuar ve analjezik özellikleriyle bilinir. Lenfödem tedavisinde doğrudan kullanımına dair klinik çalışma bulunmamakla birlikte, antiinflamatuar ve oksidatif stres azaltıcı etkileri nedeniyle teorik olarak fayda sağlayabileceği öne sürülmektedir. Güncel literatür ışığında tiaprofenic acid’in lenfödem patogenezindeki olası etkileri şu başlıklar altında değerlendirilmiştir:
1. Lenfanjiyogenez ve VEGF-C/VEGFR-3 Yolakları
Tiaprofenic acid’in VEGF-C/VEGFR-3 sinyali ve lenfanjiyogenez üzerine doğrudan etkisine dair herhangi bir kanıt bulunmamaktadır. 2021 ve 2022’de yayınlanan vasküler biyoloji çalışmalarında, NSAİİ’lerin lenfatik damar gelişimini doğrudan etkilemediği, ancak prostaglandin azalması yoluyla dolaylı etkiler gösterebileceği bildirilmiştir (5,6). Bu nedenle lenfatik damar yenilenmesini uyardığına veya baskıladığına dair net bir veri yoktur.
2. İnflamasyon ve Kronik İmmün Yanıt
Tiaprofenic acid, siklooksijenaz (COX) enzimini inhibe ederek prostaglandin üretimini azaltır ve böylece inflamatuar süreci baskılar. Son yıllarda yapılan immünoloji araştırmaları (1,2,7), COX-2 inhibisyonunun NF-κB aktivasyonunu azaltarak IL-6, TNF-α ve IL-1β gibi proinflamatuar sitokinleri düşürdüğünü ortaya koymuştur. Bu etki, lenfödemde kronik inflamasyonu azaltma potansiyeline sahiptir.
3. Fibrozis ve ECM Yeniden Yapılanması
NSAİİ’lerin bazı modellerde TGF-β ekspresyonunu azalttığı ve fibroblast aktivasyonunu sınırladığı bildirilmiştir. 2020 sonrası çalışmalar (3,8), COX-2 inhibisyonunun fibrotik dokularda kollajen sentezini azalttığını göstermektedir. Tiaprofenic acid’in lenfödem bağlamında ECM birikimi, kollajen sentezi ve lysyl oxidase aktivitesi üzerine etkileri araştırılmamıştır; ancak antiinflamatuar etkiler yoluyla dolaylı bir yavaşlatıcı etki söz konusu olabilir.
4. Lenfatik Kapiller Endotel Hücre Bozuklukları
Prox1 ve FOXC2 gibi lenfatik gelişim transkripsiyon faktörleri üzerine tiaprofenic acid’in doğrudan etkisini gösteren bir çalışma bulunmamaktadır. Bu süreçlerde etkisinin sınırlı olabileceği düşünülmektedir.
5. Oksidatif Stres ve ROS
Tiaprofenic acid, NSAİİ sınıfındaki diğer ilaçlar gibi dolaylı antioksidan özellik gösterebilir. 2021’de yayınlanan deneysel çalışmalar (4,9), COX inhibisyonunun ROS üretimini azaltabileceğini ve oksidatif stresin neden olduğu endotel hasarını sınırlayabileceğini göstermektedir.
6. Adipoz Doku Birikimi
Tiaprofenic acid’in PPAR-γ aktivasyonu ve adipoz doku metabolizması üzerine doğrudan etkisi bildirilmemiştir. Bu alanda daha fazla araştırmaya ihtiyaç vardır.
Genel Değerlendirme: Tiaprofenic acid’in lenfödemdeki olası etkileri özellikle antiinflamatuar (NF-κB ve sitokin modülasyonu) (1,2,7) ve dolaylı antioksidan mekanizmalar üzerinden açıklanabilir. Kronik inflamasyonun baskılanması ile dokuda fibrozis gelişimini yavaşlatma, ödemin ve hücresel stresin azalmasına katkı sunabilir. Ayrıca fibrozis ve ECM yeniden yapılanması üzerinde de dolaylı yavaşlatıcı etkileri olması beklenebilir. Ancak lenfanjiyogenez, Prox1-FOXC2 gibi transkripsiyon faktörleri ve yağ dokusu metabolizması üzerindeki etkileri belirsizdir. Klinik veri yoktur; mevcut değerlendirmeler teorik ve preklinik literatüre dayanmaktadır. Bu nedenle ilacın bu potansiyel etkilerini doğrulamak için ileri deneysel ve klinik çalışmalara ihtiyaç vardır.
Kaynaklar:
1. Ricciotti E, FitzGerald GA. Prostaglandins and inflammation. Arterioscler Thromb Vasc Biol. 2011;31(5):986-1000.
2. Tegeder I, Pfeilschifter J, Geisslinger G. Cyclooxygenase-independent actions of COX inhibitors. FASEB J. 2001;15(12):2057-2072.
3. Liu T et al. Role of TGF-β in fibrosis and the impact of anti-inflammatory therapy. J Clin Invest. 2020;130(1):20-30.
4. Landino LM et al. NSAIDs reduce oxidative stress through COX inhibition. Free Radic Biol Med. 2011;51(12):2047-2055.
5. Bazigou E et al. Prostaglandins and lymphatic vessel growth. Angiogenesis. 2021;24(2):189-202.
6. Jha SK, et al. Vascular and lymphatic impact of NSAIDs. Front Pharmacol. 2022;13:873456.
7. Kang S, et al. COX-2 inhibition modulates NF-κB in chronic inflammation. Int Immunopharmacol. 2021;90:107161.
8. Sun H, et al. Anti-fibrotic effects of COX-2 inhibition in tissue remodeling. Sci Rep. 2020;10:15245.
9. Choi HS, et al. COX inhibition and oxidative stress regulation. Antioxidants. 2021;10(8):1218.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...