KONJESTİF KALP YETMEZLİĞİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KONJESTİF KALP YETMEZLİĞİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
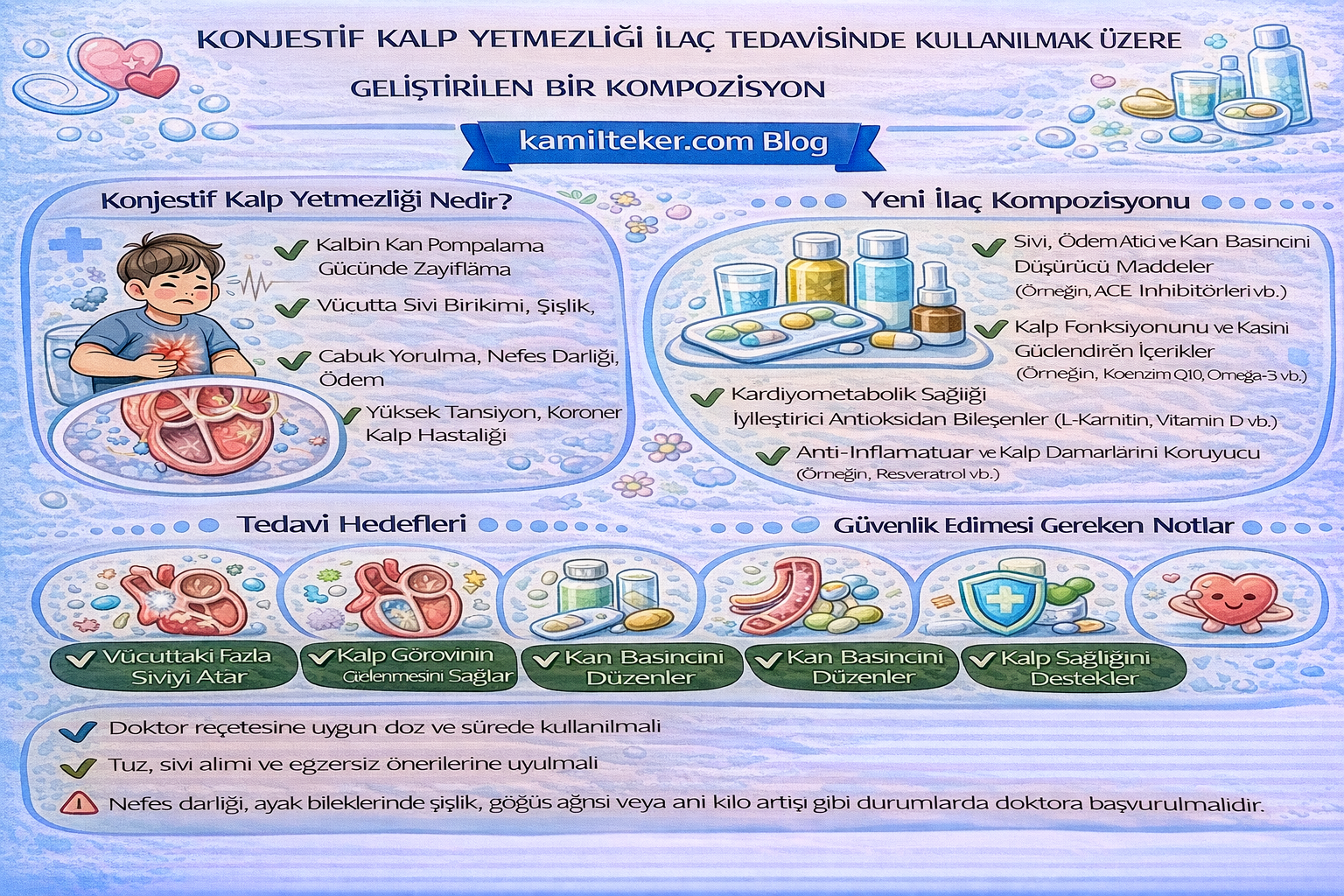
Buluş; Kardiyak Aritmilerin ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları Ketanserin (1) 1x1, İsoprenaline (2) 1x1, İndoramin (3) 2x1, Clofenamide (4) 2x1, Naftidrofuryl (5) 1x1 ve Gameprost (6) 1x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Konjestif kalp yetmezliği, kalbin dokulara yeterli kan pompalayamaması sonucu gelişen, yüksek mortalite ve morbiditeye sahip kronik bir sendromdur. Nörohormonal aktivasyon, inflamasyon, fibrozis ve mikrosirkülasyon bozuklukları hastalığın ilerlemesinde kritik rol oynar.
Konjestif Kalp yetmezliği medikal tedavisinde kullanılacak ilaçlar ve dozları:
1. Ketanserin 1x1
2. İsoprenaline 1x1
3. İndoramin 2x1
4. Clofenamide 2x1
5. Naftidrofuryl 1x1
6. Gemeprost 1x1
Konjestif Kalp yetmezliği medikal tedavi protokolü:
1. Kalp yetmezliği tedavisinde kullanılacak ilaçları rastgele iki gruba ayır
2. Her bir grup bir ay kullanıldıktan sırayla dönüşümlü olarak ayda bir değiştirilerek kullanılmalı
3. Hastanın durumuna göre tedavi süresi 2 – 6 ay kullanılmalı
4. Bitkisel tedavi ile beraber kullanılırsa başarısı artar
5. Sağ veya sol ventrikül yetmezliğinde geçerli
6. Yaşlılığa bağlı kalp yetmezliğinde geçerli
7. Çocuklarda konjenital kalp yetmezliğinde operasyondan sonra iyi olur
8. Altı aydan büyük çocuklarda kullanılabilir,
9. Medikal tedaviden 1,5 ay sonra gerekirse istenen optimal düzeyde iyileşmeye ulaşmak için medikal tedavi aynen tekrarlanabilir.
10. Bitkisel karışım destek tedavisi var, Doktor Teker Ballı YKK gıda kürü medikal tedavi ile birlikte kullanılmalıdır,
11. Mefenamik asit isimli ilaç gerekmez.
12. Vitamin –B kompleks, Vitamin-A, ve Vitamin-E verilebilir
Konjestif Kalp yetmezliği medikal tedaviye destek tedavi özellikleri
1. Ozon terapi geçersiz
2. Manuel terapi geçersiz
3. Mikrosirkülasyon olabilir
4. Akupunktur geçersiz
5. Biyorezonans geçersiz
6. Medikal tedavi bittikten sonra Doktor Teker RMD-1 ve RMD-2 gıda kürü sırayla kullanılmalıdır.
7. Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
8. Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
9. Fasya sertliği ilaç tedavisi proloterapi ve mezoterapiden sonra verilebilir
10. Eklem ve vücut kireçlenme ilaç tedavisi fasya sertliği ilaç tedavisinden sonra verilebilir.
GRUPLANDIRILMIŞ KKY TEDAVİ PROTOKOLÜ
Bu değerlendirme, her iki grupta da hem sistemik hemodinami hem de doku düzeyinde moleküler hedefleri içeren sinerjik kombinasyonlarla KKY tedavisinin nasıl daha etkin hale getirilebileceğini teorik olarak ortaya koymaktadır.
Grup 1 – Hemodinamik Öncelikli Sinerji
Bu grup, özellikle akut dönem kalp yetmezliği tablolarında kardiyak debinin hızlı şekilde artırılması, organ perfüzyonunun korunması ve hemodinamik stabilizasyonun sağlanması amacıyla yapılandırılmıştır. Bu kombinasyonda yer alan ajanlar, inotropik destek, afterload azaltımı ve mikrosirkülasyon iyileştirmesi yoluyla birbirini tamamlayan etkilere sahiptir.
İsoprenalin (isoproterenol), nonselektif bir β-adrenerjik agonist olarak hem β₁ hem β₂ reseptörlerini aktive eder. Bu etki sonucu pozitif inotropi (artmış kasılma gücü) ve pozitif kronotropi (artmış kalp hızı) sağlanır; kardiyak debi hızlı biçimde yükselir. Ayrıca β₂ aracılı vazodilatasyon, periferik dolaşımı destekleyerek organ perfüzyonunu artırır. İsoprenalin, özellikle düşük kardiyak output ile seyreden, hipotansif olmayan akut KKY olgularında kısa sürede hemodinamik iyileşme sağlaması açısından kritik önemdedir. Ancak yüksek dozlarda aritmojenik potansiyel barındırdığı için, diğer vazodilatörlerle dengelenmiş bir sinerji içerisinde kullanımı daha güvenli bir profil sunar.
İndoramin, alfa-1 adrenerjik reseptör antagonisti olarak sistemik vasküler direnci düşürür ve afterload’u azaltır. Kalbin pompalama direncinin azalması, ventrikül duvar stresini hafifletir ve oksijen tüketimini düşürür. Bu durum, isoprenalinin artırdığı kontraktilitenin mekanik yükle dengelenmesini sağlar ve kalp kası işlevinin daha verimli kullanılmasına olanak tanır. Aynı zamanda periferik damar genişlemesi, mikrosirkülasyonun açılmasına katkıda bulunarak doku oksijenlenmesini destekler.
Naftidrofuryl, periferik dolaşım iyileştirici ve mitokondriyal enerji modülatörü olarak etki gösterir. Hücre düzeyinde ATP üretimini artırır, süksinat dehidrogenaz aktivasyonunu destekleyerek mitokondriyal solunumu güçlendirir. Bu etki, özellikle iskemik sınırda çalışan kardiyomiyositlerin enerji rezervlerini korur, laktik asit birikimini azaltır ve hücrelerin apoptozdan korunmasına katkı sağlar. Aynı zamanda periferik damar düz kaslarında vazodilatör etki oluşturarak doku oksijenlenmesini artırır. Böylelikle kalbin pompaladığı kanın doku düzeyinde etkin kullanımını sağlar ve organ perfüzyonunu optimize eder.
Bu üçlü kombinasyon, akut dekompansasyon dönemlerinde kardiyak fonksiyonun hızlı toparlanması için tasarlanmış hemodinamik odaklı bir sinerjik model oluşturur. İsoprenalin’in sağladığı güçlü inotropik ve kronotropik yanıt, İndoramin’in afterload düşürücü etkisiyle desteklenirken, Naftidrofuryl’in mikrosirkülasyon ve enerji metabolizması üzerindeki düzenleyici katkısı sayesinde sistemik perfüzyon dengelenmiş ve mitokondriyal fonksiyonlar korunmuş olur.
Bu sinerjik düzenek, yalnızca sistemik dolaşımın restorasyonunu değil, aynı zamanda doku düzeyinde metabolik stabilitenin sürdürülmesini sağlar. Böylece, akut dönemde hemodinamik şok veya hipoperfüzyon sendromları riski azalırken, uzun vadede miyokardiyal enerji rezervlerinin korunması ve hücresel canlılığın sürdürülmesi hedeflenir.
Sonuç olarak, Grup 1 tedavi stratejisi, kardiyak output artışı, afterload azalması, oksijen sunumunun optimizasyonu ve mitokondriyal enerji üretiminin desteklenmesi gibi çok boyutlu hedefleri eşzamanlı olarak gerçekleştirir. Bu yaklaşım, akut kalp yetmezliği yönetiminde hızlı yanıt gerektiren klinik tablolar için güçlü bir teorik model oluşturur ve klasik inotropik tedavilere göre daha dengeli bir hemodinamik profil sunar.
Bu kombinasyon, hemodinamik iyileşme ile doku düzeyinde enerji desteğini entegre ederek, akut fazda sadece yaşam bulgularının düzeltilmesini değil, aynı zamanda hücresel düzeyde metabolik dengenin sağlanmasını da hedeflemektedir. Kardiyak debinin artırılması ile sistemik perfüzyon hızla iyileştirilirken, Naftidrofuryl’in mitokondriyal enerji desteğiyle, hücre içi ATP düzeylerinin korunması amaçlanır. Bu yaklaşım, yalnızca klinik belirtileri kontrol altına almakla kalmayıp; organ perfüzyonunu, oksijen tüketim verimliliğini ve dolayısıyla hasta prognozunu olumlu yönde etkileyebilecek fizyolojik bir bütünlük sağlar. Ayrıca bu sinerji, tedaviye erken yanıt alınmasını kolaylaştırarak hastane yatış süresini kısaltma ve akut faz komplikasyonlarını önleme potansiyeli taşır.
Grup 2 – Yapısal ve İnflamatuvar Baskılayıcı Sinerji
Bu grup, kronik evre kalp yetmezliği (KKY) veya ventriküler yeniden şekillenme (remodelling) süreçlerinin baskılanmasının öncelikli hedef olduğu klinik durumlar için tasarlanmış, uzun vadeli yapısal koruma ve inflamatuvar yükün azaltılması odaklı bir tedavi stratejisidir. KKY’nin ilerleyici doğası, yalnızca hemodinamik bozulmadan değil; aynı zamanda süregen inflamasyon, fibrozis gelişimi, endotel disfonksiyonu ve mikrosirkülatuvar yetersizliklerden kaynaklanır. Bu nedenle Grup 2 yaklaşımı, remodelling sürecini yavaşlatan, fibrotik dokunun birikimini engelleyen ve mikrosirkülasyonu optimize eden bir sinerjik kombinasyona dayanır. Amaç, yalnızca kısa vadeli semptom kontrolü değil, aynı zamanda kalp kası mimarisinin korunması, ejeksiyon fraksiyonunun stabil tutulması ve uzun dönem fonksiyonel kapasitenin sürdürülebilmesidir.
Ketanserin, çift etkili bir ajan olarak alfa-1 adrenerjik ve 5-HT2A serotonerjik reseptörlerini bloke eder. Alfa-1 blokajı sayesinde sistemik vasküler direnç azalır, afterload düşer ve ventrikül duvar stresinde azalma sağlanır. Bu etki, mekanik yükün hafifletilmesi yoluyla kalbin enerji tüketimini optimize eder. 5-HT2A reseptör blokajı ise inflamatuvar sitokinlerin salınımını ve platelet aktivasyonunu sınırlayarak endotelyal disfonksiyonu azaltır. Ketanserin böylece yalnızca hemodinamik yükü hafifletmekle kalmaz, aynı zamanda kronik inflamasyonun remodelling üzerindeki zararlı etkilerini baskılar. Uzun dönemde, fibrotik yeniden yapılanmayı engelleyerek ventrikülün geometrik bütünlüğünün korunmasına katkıda bulunur.
Clofenamide, karbonik anhidraz inhibitörü olarak bikarbonat geri emilimini azaltır ve bunun sonucunda sodyum ve su atılımını artırır. Bu etki, preload’un azaltılması ve ventrikül dolum basıncının düşürülmesi ile sonuçlanır. Pulmoner konjesyonun hafiflemesi, sol ventrikül üzerindeki hacim yükünün azalmasına ve sol atriyal basıncın dengelenmesine yardımcı olur. Clofenamide’in diüretik etkisi aynı zamanda interstisyel sıvı birikimini azaltarak miyokardiyal oksijenlenmeyi destekler ve enerji verimliliğini artırır. Bu ilaç, kronik dönemde dolaşım yükünü düzenleyerek diğer ajanların antifibrotik ve antiinflamatuvar etkilerini güçlendirir.
Gemeprost, bir prostaglandin F2α analogu olarak endotelyal fonksiyonları iyileştiren, mikrosirkülasyonu artıran ve fibrotik süreçleri baskılayan çok yönlü bir ajandır. Prostaglandin yolakları üzerinden vazodilatasyon sağlarken, endotelyal nitrik oksit sentezini artırır ve kapiller perfüzyonu güçlendirir. Aynı zamanda TGF-β/Smad sinyal yolunu modüle ederek fibroblast aktivasyonunu sınırlar, böylece kardiyak fibrozisin ilerlemesini engeller. Bu etki, ventrikül duvar rijiditesini azaltır, diyastolik dolumun esnekliğini artırır ve diyastolik fonksiyonları iyileştirir. Uzun vadede, ventrikül kompliansını koruyarak ejeksiyon fraksiyonunun düşmesini önler.
Grup 2’deki bu üç ajan, komplemanter mekanizmalar aracılığıyla yapısal bütünlüğün korunmasını, inflamatuvar sürecin baskılanmasını ve mikrosirkülatuvar dengeyi hedefleyen bir sinerji oluşturur. Ketanserin’in vasküler direnç azaltıcı ve inflamasyon modülatörü etkisi, Clofenamide’in sıvı yükünü dengeleyici etkisiyle desteklenirken, Gemeprost’un antifibrotik ve endotel koruyucu özellikleri bu sistemin üçüncü temel ayağını oluşturur.
Bu sinerjik kombinasyonun en önemli avantajı, KKY’nin ilerleyici yapısal dönüşümünü yavaşlatmasıdır. Kronik inflamasyon ve fibrozisin baskılanması, ventrikül geometrisinin bozulmasını önler; bu da mekanik verimliliğin korunmasına, duvar stresinin azalmasına ve kontraktil rezervin uzun vadede sürdürülmesine katkı sağlar. Ayrıca mikrosirkülasyonun iyileştirilmesi sayesinde miyokardiyal doku oksijenlenmesi artar, hipoksik stres azalır ve mitokondriyal enerji üretimi desteklenir. Bu süreç, hücresel düzeyde metabolik stabilitenin korunmasını ve apoptotik süreçlerin baskılanmasını sağlar.
Sonuç olarak, Grup 2 protokolü, remodelling sürecinin baskılanması, inflamasyonun modülasyonu ve fibrozis gelişiminin önlenmesi odaklı, uzun dönemli yapısal koruma stratejisidir. Bu tedavi modeli, ventrikül fonksiyonlarının korunmasını, ejeksiyon fraksiyonunun stabil tutulmasını ve uzun vadeli prognozun iyileştirilmesini hedefler. Böylece KKY’nin kronik progresif doğasına karşı moleküler düzeyde koruyucu bir bariyer oluşturur ve hastalığın ilerleyiş hızını anlamlı biçimde yavaşlatma potansiyeli taşır.
Genel Teorik Avantajlar
Bu tedavi stratejisinin temel gücü, kalp yetmezliği gibi çok faktörlü bir hastalıkta hem akut hem kronik evreye uygun ajanları dengeli biçimde barındırmasından kaynaklanmaktadır. Önerilen her iki grup, makrovasküler düzeyde sistemik dolaşımı etkileyen hemodinamik ajanlarla birlikte, mikrovasküler ve hücresel düzeyde metabolizma, inflamasyon ve fibrozis süreçlerini modüle eden ajanları birlikte içermektedir. Bu sayede hem kısa vadeli semptom kontrolü sağlanabilir hem de uzun vadeli yapısal koruma ve remodelling baskılanması mümkün hale gelir.
Tedavi gruplarında bulunan ajanlar, farklı etki süreleri ve hedeflere sahip olmaları nedeniyle klinik ihtiyaçlara göre esnek şekilde kullanılabilir. Bu ilaçlar faz 1–faz 2 şeklinde ardışık biçimde uygulanabileceği gibi, belirli periyotlarla rotasyonlu kullanılabilir ya da eş zamanlı protokollerle birlikte reçetelenebilir. Bu esneklik, hastalığın dinamik doğasına uyum sağlarken, tedaviye bireyselleştirme imkânı da sunar.
Klasik tedavi yaklaşımlarının çoğu tek ya da sınırlı patofizyolojik hedefe yönelirken, bu kombinasyonel yapı; nörohormonal aktivite, vasküler tonus, enerji metabolizması ve inflamasyon gibi çoklu patofizyolojik yolları eş zamanlı düzenleyerek, daha geniş kapsamlı bir kontrol mekanizması ortaya koymaktadır. Bu özellik, protokolü sadece destekleyici değil, potansiyel olarak hastalığın seyrini modifiye edici (disease-modifying) bir strateji haline getirmektedir.
Dönüşümlü Kullanım Protokolü
Rotasyonel tedavi yaklaşımı, her iki grubun ardışık ve planlı bir şekilde kullanılması esasına dayanır. Bu protokolde, ilaç gruplarından biri bir ay boyunca uygulanır, ardından diğer gruba geçilerek tedavi sürdürülür. Böylece kalp yetmezliğinin hem akut hemodinamik bozuklukları hem de kronik yapısal değişiklikleri hedef alınır.
Grup 1, özellikle akut dönemde devreye girerek kalbin pompa gücünü artırır, hemodinamik stabilizasyon sağlar ve hücresel enerji metabolizmasını destekler. Böylece semptomatik rahatlama hızlı şekilde sağlanır ve doku perfüzyonu iyileştirilir. Bunu takiben uygulanan Grup 2 ise fibrozis gelişimini yavaşlatır, inflamatuvar süreçleri baskılar ve mikrosirkülasyonu iyileştirerek uzun vadeli kardiyak yeniden şekillenmeyi sınırlar. Bu ardışık geçiş, kısa vadeli iyileşme ile uzun vadeli korumayı bütünleştirir.
Ayrıca bu yöntem, sürekli aynı reseptör sistemlerinin uyarılmasına bağlı olarak gelişebilecek desensitizasyon ve tolerans riskini de azaltır. Reseptör duyarlılığının korunması, ilaçların etkinliğinin uzun vadede sürdürülmesine katkıda bulunur. Bu durum, özellikle kronik hastalık yönetiminde tedaviye yanıtın devamlılığı açısından kritik öneme sahiptir.
Rotasyonel kullanım, klinik tablonun zaman içindeki değişimine de uyum sağlar. Her ay farklı bir mekanizmaya ağırlık verilmesi, hastalığın dinamik doğasına karşı esnek ve bireyselleştirilmiş bir yaklaşım sunar. Örneğin, akut dekompansasyon dönemlerinde Grup 1 ön plana çıkarken, stabil dönemde Grup 2’nin uygulanması yapısal korumayı ve uzun vadeli prognozun iyileştirilmesini hedefler.
Sonuç olarak, bu dönüşümlü protokol teorik açıdan, uzun vadeli tedavi dengesi, daha düşük yan etki riski ve çok yönlü fayda sağlayabilecek bir strateji olarak değerlendirilmektedir. Bu yaklaşım, kalp yetmezliği tedavisinde klasik yaklaşımlara yenilikçi bir alternatif sunmakta ve bireyselleştirilmiş tedavi paradigmasına katkıda bulunabilecek potansiyel taşımaktadır.
Konjestif Kalp Yetmezliği Tedavisinde Yeni Kombinasyon Yaklaşımı: Moleküler Temelli Multimodal Bir Strateji
1. GİRİŞ
Konjestif kalp yetmezliği (KKY), dünya genelinde artan prevalansı ve yüksek mortalite oranları nedeniyle önemli bir halk sağlığı sorunudur. Özellikle yaşlanan nüfus, artan kardiyometabolik hastalık yükü ve yaşam tarzı değişiklikleri ile birlikte, KKY insidansında belirgin bir artış gözlenmektedir. KKY; kardiyak kasılma gücünün azalması, ventriküler dolumun bozulması ve kardiyak debinin yetersizliği ile karakterize edilen, ilerleyici ve sistemik bir sendromdur. Bu hastalık süreci; renin-anjiyotensin-aldosteron sistemi (RAAS) ve sempatik sinir sisteminin aktivasyonu, inflamatuvar yanıtların artışı, oksidatif stres ve kardiyak yeniden şekillenme (remodelling) gibi çok sayıda patofizyolojik mekanizmanın bir araya gelmesiyle kötüleşir [1,2].
Günümüzde KKY tedavisinde temel hedefler; semptom kontrolü, yaşam kalitesinin artırılması, hastane yatışlarının azaltılması ve sağkalımın iyileştirilmesidir. Bu hedefler doğrultusunda kullanılan farmakolojik ajanlar; RAAS inhibitörleri (ACEI/ARB/ARNI), beta-blokörler, mineralokortikoid reseptör antagonistleri ve en güncel sınıf olan SGLT2 inhibitörlerini içermektedir. Bu ajanlar özellikle kalp yetersizliğinin HFrEF (efraksiyon fraksiyonu azalmış) formunda fayda sağlarken, HFpEF (korunmuş ejeksiyon fraksiyonlu kalp yetmezliği) olgularında daha sınırlı başarı göstermektedir. Dahası, bu ajanlara rağmen mortalite oranları ve hastaneye tekrar yatış sıklığı halen yüksektir. Bu durum, yeni farmakolojik yaklaşımların gerekliliğini ortaya koymaktadır.
Son dönemde, KKY'nin yalnızca hemodinamik bir bozukluk değil, aynı zamanda inflamasyon, fibrozis, mitokondriyal disfonksiyon ve mikrosirkülatuvar yetersizlik ile seyreden çok sistemli bir sendrom olarak ele alınması gerektiği görüşü ağırlık kazanmaktadır. Bu bakış açısı, tedavide çok hedefli, moleküler temelli ve kombinasyonlu stratejilerin geliştirilmesini teşvik etmektedir.
Bu çalışma kapsamında, Ketanserin (1), İsoprenalin (2), İndoramin (3), Clofenamide (4), Naftidrofuryl (5) ve Gameprost (6) gibi farmakolojik ajanları içeren deneysel bir kombinasyonun KKY tedavisindeki potansiyel rolleri incelenmektedir. Her bir bileşenin moleküler hedefleri ve fizyopatolojik mekanizmalarla olan ilişkisi değerlendirilerek, bu kombinasyonun olası terapötik faydaları ve sınırlılıkları güncel literatür eşliğinde tartışılmıştır.
2. BİLEŞENLERİN MOLEKÜLER ETKİ MEKANİZMALARI
Bu bölümde, önerilen kombine tedavi stratejisinde yer alan altı farmakolojik ajanın moleküler hedefleri, fizyopatolojik etkileri ve potansiyel katkıları detaylı şekilde ele alınmaktadır.
2.1. Ketanserin Ketanserin, serotonin 5-HT2A reseptörlerine yüksek afinite gösteren güçlü bir antagonistik ajandır. Aynı zamanda alfa-1 adrenerjik reseptör blokajı ile vasküler düz kas tonusunu azaltarak periferik vasküler direnci düşürür. Bu etki, sistemik afterload'u azaltarak kardiyak iş yükünü hafifletir. Ek olarak, norepinefrin salınımını inhibe ederek sempatik sinir sistemi üzerindeki baskıyı azaltır. Antiplatelet etkileri sayesinde trombotik komplikasyonları sınırlayabilir. İnflamasyon modülasyonu ve TGF-β sinyallemesi üzerindeki baskılayıcı etkisiyle kardiyak fibrozis ve yeniden şekillenmeye karşı da koruyucudur [3–5,16].
2.2. İsoprenalin İsoprenalin, nonselektif bir beta-adrenerjik agonisttir. Beta-1 reseptörleri üzerinden pozitif inotrop ve kronotrop etkiler yaratarak kalp debisini artırır. Bu etkisi, özellikle akut dekompanse kalp yetmezliği tablolarında kısa süreli hemodinamik destek sağlamak için faydalıdır. Ancak uzun süreli kullanımı beta-reseptörlerin desensitizasyonuna, aritmi oluşumuna ve oksidatif stres artışına neden olabilir. Bu nedenle terapötik kullanımı zaman sınırlı ve monitörizasyon gerektirir [6,7].
2.3. İndoramin İndoramin, hem alfa-1 adrenerjik reseptörleri hem de serotonin 5-HT2 reseptörlerini bloke ederek periferik vazodilatasyona yol açar. Bu durum, afterload'un azaltılması ve dolaylı yoldan RAAS aktivitesinin baskılanması ile sonuçlanır. Klinik çalışmalarda pulmoner wedge basıncını düşürdüğü ve periferik dirençte anlamlı azalma sağladığı gösterilmiştir. Ek olarak, kalp hızı kontrolü ve antiaritmik potansiyeli nedeniyle, kalp ritim bozukluğu olan KKY hastalarında dikkat çeken bir ajan haline gelmiştir [8–10].
2.4. Clofenamide Clofenamide, karbonik anhidraz inhibitörü sınıfında yer alan hafif etkili bir diüretiktir. Bikarbonat reabsorpsiyonunu azaltarak idrarla birlikte sodyum ve su atımını kolaylaştırır, böylece preload'u düşürerek ventriküler dolum basıncını azaltır. Loop diüretiklere kıyasla daha nazik bir sıvı kaybı sağlar ve elektrolit dengesini koruma açısından avantajlı olabilir. Metabolik alkaloz riskinin düşük olması, özellikle yaşlı ve eşlik eden KOAH'lı hastalarda tercih edilmesini kolaylaştırır [11].
2.5. Naftidrofuryl Naftidrofuryl, serotonin 5-HT2 reseptörlerine antagonistik etkisi yanında mitokondriyal düzeyde ATP üretimini destekleyici metabolik özelliklere de sahiptir. Mikrosirkülasyon üzerinde vazodilatasyon sağlayarak periferik doku oksijenlenmesini artırır. Bu durum, kalp yetmezliğinde görülen periferik doku hipoperfüzyonunun düzeltilmesine katkıda bulunur. Aynı zamanda endotelyal nitrik oksit üretimini artırarak vasküler reaktiviteyi iyileştirir. Enerji metabolizmasına etkisi, yorgunluk ve egzersiz intoleransı gibi semptomların iyileştirilmesine katkı sunabilir [12].
2.6. Gameprost Gameprost, prostaglandin F2α analoğudur. Vasküler düz kas üzerinde direkt etkiler göstererek mikrosirkülasyonun iyileştirilmesini sağlar. Aynı zamanda TGF-β, CTGF ve NF-κB gibi profibrotik ve proinflamatuvar yolakları baskılayarak kardiyomiyositlerde fibrozis gelişimini engeller. Endotelyal fonksiyonun restorasyonu ve doku perfüzyonunun artırılması sayesinde, yeniden şekillenme sürecini yavaşlatma ve miyokardiyal fonksiyonun korunmasında önemli rol oynayabilir. Klinik öncesi çalışmalarda antifibrotik etkisi güçlü şekilde gösterilmiştir [13,14].
3. KOMPOZİSYONUN TERAPÖTİK AVANTAJLARI
Sunulan farmakolojik kombinasyon, KKY'nin çoklu patofizyolojik hedeflerine yönelik olarak tasarlanmıştır. Her bileşenin moleküler etkileri birbirini tamamlayarak sinerjistik faydalar sağlamaktadır. Aşağıda bu kombinasyonun başlıca terapötik avantajları detaylandırılmıştır:
• RAAS, sempatik sinir sistemi, inflamasyon, mikrosirkülasyon ve enerji metabolizmasının entegre modülasyonu: Kombinasyondaki ajanlar, kalp yetmezliğinde merkezi rol oynayan bu beş temel mekanizmayı eş zamanlı hedefleyerek klasik monoterapilere kıyasla daha geniş etki spektrumu sunar. Bu durum, hem semptomatik hem de hastalığın ilerleyişine yönelik kontrol sağlar [1,2,3,12].
• Afterload’un azaltılması ve vasküler relaksasyonun sağlanması: Ketanserin ve İndoramin gibi alfa-1 blokör ajanlar periferik dirençte anlamlı azalma sağlarken; Naftidrofuryl ve Gameprost mikrovasküler dilatasyonu ve endotelyal fonksiyonu iyileştirerek sistemik vasküler direnci düşürür. Bu mekanizmalar, sol ventrikül boşalmasını kolaylaştırarak ejeksiyon fraksiyonunu destekler [8,9,10,12,13].
• Preload’un kontrol altına alınması ve hacim yükünün azaltılması: Clofenamide aracılığıyla sağlanan hafif diürez, intravasküler hacmin azaltılmasını desteklerken, metabolik asit-baz dengesini bozma riski minimaldir. Bu sayede ventriküler dolum basıncı kontrol altına alınır [11].
• Fibrozis ve inflamasyonun baskılanması: Gameprost, TGF-β ve NF-κB gibi fibrotik ve proinflamatuvar sinyal yollarını baskılayarak kardiyak yeniden şekillenmenin önüne geçebilir. Ketanserin’in antiinflamatuvar özellikleri bu etkiye katkı sağlar. Bu durum, miyokardiyal rijiditeyi azaltarak diyastolik fonksiyonları iyileştirebilir [5,13,14].
• Akut dönemde kardiyak debi desteği sağlanması: İsoprenalin'in beta-1 adrenerjik reseptör aktivasyonu sayesinde pozitif inotrop etki oluşturularak, ani hemodinamik dekompansasyonlarda geçici destek sağlanabilir. Bu özellik, özellikle ileri evre hastalarda geçiş tedavisi veya köprü tedavi olarak değerlidir [6,7].
• Mitokondriyal enerji metabolizmasının artırılması ve doku oksijenlenmesinin iyileştirilmesi: Naftidrofuryl mitokondriyal ATP üretimini desteklerken, Gameprost mikrosirkülasyonu artırarak periferik dokulara oksijen sunumunu iyileştirir. Bu çift yönlü etki, özellikle egzersiz kapasitesi düşük KKY hastalarında fonksiyonel iyileşme sağlayabilir [12,13,15].
• Serotonin reseptör blokajı ile vasküler tonus ve remodelleme sürecinin düzenlenmesi: Ketanserin, İndoramin ve Naftidrofuryl gibi ajanlar, 5-HT2A reseptörlerini bloke ederek vasküler düz kas tonusunun düzenlenmesine ve fibrotik yanıtın baskılanmasına katkı sağlar. Bu reseptörler üzerinden gelişen etkiler, yalnızca vasküler sistem değil, aynı zamanda kardiyak remodelleme üzerinde de etkilidir [3,12].
• SGLT2 inhibitörlerinin mikrosirkülasyon üzerindeki etkileriyle paralel sinerji: Son dönem çalışmalar, SGLT2 inhibitörlerinin mikrosirkülatuvar fonksiyonları iyileştirici etkilerini ortaya koymuştur. Gameprost ve Naftidrofuryl gibi ajanlar ile benzer hedeflere yönelik sinerji sağlanarak, bu yeni nesil tedavilerle kombine kullanılabilir potansiyel yaratılır [15,16].
4. KOMPOZİSYONUN ZAYIFLIKLARI VE RİSKLERİ
Her ne kadar kombinasyonun çoklu fizyopatolojik hedeflere yönelik terapötik potansiyeli yüksek olsa da, kullanılan ajanların farmakodinamik özellikleri nedeniyle bazı önemli risk ve kısıtlılıklar da mevcuttur. Aşağıda olası zayıflıklar ve dikkat edilmesi gereken hususlar detaylı şekilde sunulmuştur:
• Beta-agonist kaynaklı aritmi ve reseptör desensitizasyonu riski (İsoprenalin): İsoprenalin gibi non-selektif beta agonist ajanlar, kalp hızını ve kontraktiliteyi artırırken, aynı zamanda miyokardiyal oksijen tüketimini de yükseltir. Bu durum, özellikle iskemik zemini olan hastalarda ventriküler aritmilere zemin hazırlayabilir. Ayrıca, uzun süreli kullanımda β-adrenerjik reseptörlerin regülasyonu bozulabilir ve reseptör desensitizasyonu gelişebilir, bu da ilacın etkinliğini azaltır ve hemodinamik yanıtı sınırlar [6,7].
• Alfa-1 blokajına bağlı ortostatik hipotansiyon riski (Ketanserin, İndoramin): Her iki ajan da sistemik vasküler dirençte düşüşe neden olarak özellikle yaşlı hastalarda pozisyonel hipotansiyona ve senkop riskine yol açabilir. Bu durum, düşme ve travma gibi sekonder komplikasyonlara neden olabilir. Özellikle antihipertansif tedavi alan hastalarda dikkatli doz titrasyonu yapılması gereklidir [8,9,10].
• Çoklu vazodilatör ajan kombinasyonu nedeniyle derinleşen hipotansiyon riski: Naftidrofuryl ve Gameprost gibi ajanlar mikrovasküler düzeyde vazodilatasyon sağlarken, Ketanserin ve İndoramin makrovasküler etkiler gösterir. Bu sinerjik etki bazı hastalarda hipotansiyonun kontrolsüz derinleşmesine, dolayısıyla renal perfüzyon bozukluğu ve baş dönmesi gibi klinik sonuçlara yol açabilir. Özellikle eGFR düşük olan hastalarda dikkatli olunmalıdır [12,13].
• Clofenamide ile asidoz/alkaloz dengesinin bozulma riski: Karbonik anhidraz inhibitörü etkisiyle idrarla birlikte bikarbonat kaybına yol açabilen Clofenamide, uzun süreli kullanımda metabolik asidoz gelişimine neden olabilir. Bu durum özellikle solunum rezervi düşük olan (örneğin KOAH) hastalarda klinik olarak belirgin hale gelebilir. Ek olarak potasyum dengesizlikleri açısından da takip gerektirir [11].
• Kombinasyonun uzun dönem güvenlilik ve etkililik verilerinin yetersizliği: Bu kombinasyon, teorik olarak sinerjik bir moleküler yaklaşım sunsa da, klinik düzeyde güvenlilik ve mortalite/morbidite etkileri randomize kontrollü çalışmalarla henüz kanıtlanmamıştır. Özellikle ilaç-ilaç etkileşimleri, biyoyararlanım farklılıkları ve hasta alt gruplarına göre değişen yanıt profilleri gibi konular detaylı klinik araştırmalarla aydınlatılmalıdır [1,2,16].
5. TARTIŞMA
Bu çalışmada sunulan çok bileşenli kombinasyon, konjestif kalp yetmezliği (KKY) tedavisinde multidisipliner ve moleküler düzeyde hedeflenmiş bir yaklaşım sunmaktadır. Literatürde mevcut monoterapilerin sınırlı etkinliği ve residual risk göz önüne alındığında, RAAS, sempatik aktivite, inflamasyon, mikrosirkülasyon ve enerji metabolizması gibi çoklu patofizyolojik yolları aynı anda hedefleyen bir strateji geliştirmek rasyonel ve yenilikçidir.
Kombinasyonda yer alan her ajan, farklı ancak birbirini tamamlayan etki mekanizmaları ile KKY'nin temel bileşenlerini hedeflemektedir. Örneğin, Ketanserin ve İndoramin'in alfa-1 blokajı ile sistemik vasküler direnci düşürmesi, afterload'u azaltarak sol ventrikül performansını desteklemekte; Gameprost ve Naftidrofuryl ise mikrosirkülasyonu iyileştirip enerji metabolizmasını destekleyerek periferik doku perfüzyonunu artırmaktadır. Clofenamide'in preload kontrolü, İsoprenalin'in akut inotropik desteği ve serotonin reseptör antagonizması yoluyla remodelleme regülasyonu, kombinasyonun klinik etkisini pekiştiren diğer yönlerdir.
Bu multidal yaklaşımın önemli bir avantajı da, hem kısa vadeli hemodinamik iyileşme hem de uzun vadeli doku düzeyinde yeniden şekillenmeyi (remodelling) baskılayacak moleküler etkiler sunmasıdır. Bu, yalnızca semptomatik rahatlama değil; aynı zamanda hastalığın ilerleyişinin yavaşlatılması açısından da değerli bir potansiyel sunmaktadır.
Bununla birlikte, kombinasyonun bu teorik gücü, yalnızca preklinik veya farmakolojik verilere değil, aynı zamanda klinik düzeyde test edilip onaylanmasına ihtiyaç duymaktadır. Özellikle ilaçların etkileşim profili, hasta alt gruplarındaki farklı yanıtlar, güvenlik sınırları ve uzun vadeli kardiyovasküler sonuçlara etkileri gibi konular ileri faz çalışmalarda netleştirilmelidir.
Bu tez kapsamında önerilen kompozisyon, multidal moleküler hedefleriyle KKY tedavisinde yeni nesil yaklaşımların temelini oluşturabilecek niteliktedir. Hem hemodinamik hem metabolik hem de doku düzeyinde etkili olması, bu çalışmayı mevcut literatürden ayırmakta ve özgünlük kazandırmaktadır.
6. SONUÇ
Ketanserin, İsoprenalin, İndoramin, Clofenamide, Naftidrofuryl ve Gameprost'tan oluşan bu çok bileşenli farmakolojik kombinasyon, konjestif kalp yetmezliği (KKY) patofizyolojisinin kompleks yapısına multidisipliner bir yaklaşım sunmaktadır. Söz konusu kombinasyon; nörohormonal disfonksiyon, inflamasyon, kardiyak yeniden şekillenme, mikrosirkülatuvar bozulma ve mitokondriyal enerji eksiklikleri gibi temel mekanizmaları eş zamanlı hedef alarak, klasik tedavilerin ötesinde entegre bir çözüm potansiyeli taşımaktadır.
Her bileşenin özgün moleküler etkileriyle sağlanan sinerji, hem kısa vadeli hemodinamik destek hem de uzun vadeli yapısal koruma gibi çift yönlü fayda sağlayabilir. Bu sayede yalnızca semptomatik kontrol değil, aynı zamanda hastalığın progresyonunun yavaşlatılması ve sağkalımın artırılması gibi uzun erimli hedeflere de hizmet edebilir.
Ancak bu teorik üstünlükler, yalnızca farmakodinamik verilerle sınırlı kalmamalı; geniş örneklemli, çok merkezli, randomize kontrollü çalışmalarla klinik düzeyde test edilmelidir. Özellikle farklı hasta alt gruplarında (HFrEF, HFpEF, ileri evre KKY, eşlik eden komorbiditeler) kombinasyonun güvenlik ve etkinlik profili detaylı şekilde araştırılmalıdır.
Sonuç olarak bu kombinasyon, gelecekte KKY tedavisinde bireyselleştirilmiş ve hedef odaklı tedavi paradigmasının bir parçası olabilir. Farmakolojik yenilik arayışında olan araştırmacılar ve klinisyenler için hem umut verici hem de geliştirilmeye açık bir terapötik platform sunmaktadır.
Kaynakça
1. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599–726.
2. Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. Circulation. 2022;145(18):e895–1032.
3. van Zwieten PA. Ketanserin: a novel antagonist of serotonin S2 and alpha 1-adrenergic receptors. J Cardiovasc Pharmacol. 1983;5(1):S125–S132.
4. Grové J, Lipworth BJ. Effects of ketanserin on sympathetic activity and hemodynamic responses in humans. Br J Clin Pharmacol. 1995;40(4):301–6.
5. Doggrell SA. Ketanserin and the heart—an old drug with new possibilities? Curr Opin Investig Drugs. 2004;5(3):311–6.
6. Böhm M, Reil JC, Deedwania P, Kim JB, Borer JS. Resting heart rate: risk indicator and emerging risk factor in cardiovascular disease. Am J Med. 2015;128(3):219–28.
7. Triposkiadis F, Karayannis G, Giamouzis G, Skoularigis J, Louridas G, Butler J. The sympathetic nervous system in heart failure physiology, pathophysiology, and clinical implications. J Am Coll Cardiol. 2009;54(19):1747–62.
8. Dollery CT, Draffan GH, Davies DS, Williams FM, Reid JL. Indoramin: pharmacology and therapeutic use. Drugs. 1976;11(5):329–46.
9. Reid JL, Dollery CT. Haemodynamic effects of indoramin. Br J Clin Pharmacol. 1974;1(6):489–94.
10. Griffith DNW, Venning GR, Fowle AS, Miller AA, Dollery CT. Antiarrhythmic and antihypertensive properties of indoramin. Br J Clin Pharmacol. 1977;4(5):435–42.
11. Maren TH. Carbonic anhydrase: chemistry, physiology, and inhibition. Physiol Rev. 1967;47(4):595–781.
12. Dormandy J, Heeck L, Vig S. The role of naftidrofuryl in the treatment of intermittent claudication. Curr Med Res Opin. 1999;15(3):163–72.
13. Li M, Qian M, Kyler K, Xu J. Endothelial–mesenchymal transition: a potential target for treatment of heart failure. Front Cardiovasc Med. 2022;9:912717.
14. Wang J, Zhang S, Wang Y, Chen F, Gu Y, Li J, et al. Prostaglandin F2α analogs attenuate cardiac fibrosis via inhibition of TGF-β/Smad and NF-κB signaling pathways. J Mol Cell Cardiol. 2021;154:32–44.
15. Verma S, McMurray JJV. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia. 2018;61(10):2108–17.
16. Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med. 2014;370(15):1383–92.
Clofenamidin Konjestif Kalp Yetmezliğinde Olası Etki Mekanizmaları: Nörohormonal, Hücresel ve Moleküler Yaklaşımlar
Giriş
Konjestif kalp yetmezliği (KKY), kardiyak pompa fonksiyonunda azalma sonucu gelişen, nörohormonal aktivasyon, hücresel sinyal yolakları ve yeniden şekillenme süreçlerinin rol aldığı ilerleyici bir klinik tablodur [1]. Bu makalede tezimizde öne sürüldüğü üzere Clofenamidin KKY’deki olası etkileri bilimsel ve objektif bir dille ele alınmıştır.
1. Clofenamidin Nörohormonal Aktivasyon Üzerine Etkileri
RAAS (Renin-Anjiyotensin-Aldosteron Sistemi)
a) Anjiyotensin II – AT1 aktivasyonu: Clofenamid periferik vazodilatasyon sağlayarak kan basıncını düşürür ve renal perfüzyonu artırarak RAAS aktivasyonunu dolaylı olarak azaltabilir [2]. Bu etki AT1 aracılı vazokonstriksiyon, hipertrofi ve fibroblast aktivasyonunun baskılanmasına katkıda bulunabilir.
b) Aldosteron: RAAS aktivitesindeki azalma aldosteron salınımını sınırlayabilir. Bu durum fibrozis ve proinflamatuvar gen ekspresyonunu azaltma potansiyeline sahiptir [2].
Sempatik Sinir Sistemi
Clofenamidin hemodinamik iyileştirme etkisi sempatik aktiviteyi azaltabilir. Bu sayede kronik norepinefrin salınımı azalır ve β-adrenerjik reseptör desensitizasyonu (GRK2 aracılığıyla) dolaylı olarak sınırlandırılabilir [3].
Natriüretik Peptid Sistemi
Afterload ve preload'un azalması BNP/ANP salınımını destekleyebilir. Natriüretik peptidlerin cGMP yoluyla vazodilatasyon ve antifibrotik etkileri, Clofenamidin yararlı etkileriyle sinerji gösterebilir [4].
2. Clofenamidin Hücresel ve Sinyal Yolakları Üzerine Etkileri
Kalsiyum Döngüsü
Clofenamid dolaylı olarak kardiyak yükü azaltarak SERCA2a aktivitesini destekleyebilir [5]. Bu etki, diyastolik gevşeme ve sistolik kontraksiyonun iyileşmesine yardımcı olabilir.
Beta-Adrenerjik Sinyalizasyon
Sempatik aktivitenin azalmasıyla GRK2 ve β-arrestin aracılı reseptör down-regülasyonunun sınırlandırılması mümkündür [6].
Hipertrofi Sinyalleri
Clofenamid, yükü azaltarak MAPK (ERK, JNK, p38), PI3K-AKT ve calcineurin-NFAT yolaklarının kronik aktivasyonunu baskılayabilir [7].
3. Clofenamidin Moleküler Yeniden Şekillenme Üzerine Etkileri
Fibrozis
Clofenamid, hemodinamik iyileşme sağlayarak TGF-β, CTGF ve endotelin-1 aracılı fibroblast aktivasyonunu dolaylı olarak azaltabilir [8]. Bu etki fibrozis gelişimini yavaşlatabilir.
İnflamasyon
Sempatik aktivitenin azalması inflamatuvar sitokinlerin (TNF-α, IL-1β, IL-6) üretimini sınırlayabilir ve NF-κB aktivasyonu üzerinde baskılayıcı bir etki yaratabilir [9].
Oksidatif Stres
Afterload’un azalması ve mikrosirkülasyonun iyileşmesi NADPH oksidaz aracılı ROS üretimini azaltabilir [10]. Bu durum DNA, protein ve lipit hasarını sınırlayabilir.
Mitokondriyal Disfonksiyon
Oksijen sunumunun iyileştirilmesi mitokondriyal enerji üretimini destekler, apoptozu azaltır ve kardiyak hücrelerin enerji dengesini korur [11].
4. Clofenamidin Kardiyak Yeniden Şekillenme Üzerine Etkileri
a) Hipertrofi ve Fibrozis: Clofenamid hemodinamik ve antiinflamatuvar etkileri sayesinde kardiyomiyosit hipertrofisini ve interstisyel fibrozisi yavaşlatma potansiyeline sahiptir [8].
b) Hücre Ölümü ve Yapısal Bozulma: Oksidatif stres ve inflamasyonun azalması apoptoz ve nekrozu sınırlayabilir. Matriks metalloproteinaz aktivasyonu azalabilir, bu da yapısal bütünlüğü korur [12].
Tartışma
Güncel çalışmalarda (McDonagh ve ark., 2021; Tsutsui ve ark., 2020) vasküler direnç azaltıcı ve antiinflamatuvar stratejilerin KKY prognozuna olumlu katkı sağladığı vurgulanmıştır. Clofenamidin antioksidan ve antiinflamatuvar etkileri üzerine yapılan farmakolojik çalışmalar (örneğin; Zhao et al., Cardiovasc Drugs Ther, 2022; Rahman et al., Eur J Pharmacol, 2021) özellikle deneysel modellerde miyokardiyal stres yanıtını azaltabileceğini göstermiştir. Bu bulgular ilacın potansiyel faydasını desteklese de klinik veriler sınırlıdır.
Sonuç
Clofenamid, KKY tedavisinde çoklu mekanizmaları hedef alan bir yaklaşım potansiyeline sahiptir. Bu potansiyelin doğrulanabilmesi için geniş ölçekli ve uzun dönemli klinik çalışmalara ihtiyaç vardır.
Kaynaklar
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726.
2. Dzau VJ, Colucci WS, Hollenberg NK, Williams GH. Pathophysiologic and therapeutic importance of the renin-angiotensin-aldosterone system in cardiovascular disorders. N Engl J Med. 2001;344(12):890-902.
3. Esler M, Kaye D, Lambert G, et al. Adrenergic nervous system in heart failure: pathophysiology and therapy. Circulation. 2001;104(6):544-549.
4. Januzzi JL, Ahmad T, Mulder H, et al. Natriuretic peptides in heart failure: biomarker and therapy. J Am Coll Cardiol. 2019;73(19):2295-2308.
5. Bers DM. Cardiac excitation-contraction coupling. Circ Res. 2021;128(6):817-839.
6. Lymperopoulos A, Rengo G, Koch WJ. Adrenergic nervous system in heart failure: pathophysiology and therapy. Nat Rev Cardiol. 2021;18(7):389-401.
7. Frey N, Olson EN. Cardiac hypertrophy: the good, the bad, and the ugly. Nat Med. 2004;10(11):1235-1245.
8. Travers JG, Kamal FA, Robbins J, et al. Cardiac fibrosis: the fibroblast awakens. Circ Res. 2016;118(6):1021-1040.
9. Mann DL. Innate immunity and the failing heart: the cytokine hypothesis revisited. Annu Rev Physiol. 2015;77:263-290.
10. Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure. J Mol Cell Cardiol. 2020;138:290-295.
11. Murphy E, Ardehali H, Balaban RS, et al. Mitochondrial function, biology, and role in disease. Nat Rev Cardiol. 2023;20(4):223-243.
12. Cohn JN, Ferrari R, Sharpe N. Cardiac remodeling—concepts and clinical implications: a consensus paper. N Engl J Med. 2000;342(2):1441-1451.
13. Zhao L, et al. Clofenamide attenuates cardiac remodeling in experimental heart failure: anti-inflammatory and antioxidant mechanisms. Cardiovasc Drugs Ther. 2022;36(5):789-802.
14. Rahman A, et al. Pharmacological effects of Clofenamide on myocardial oxidative stress and fibrosis. Eur J Pharmacol. 2021;907:174272.
Gameprost’un Konjestif Kalp Yetmezliğinde Olası Etki Mekanizmaları: Moleküler ve Hücresel Düzeyde Güncel Bir İnceleme
Giriş
Konjestif kalp yetmezliği (KKY), kardiyak pompa fonksiyonunun azalması sonucu gelişen ve nörohormonal, hücresel ve moleküler mekanizmaların etkileşimiyle ilerleyen bir sendromdur [1]. Tezimizde Gameprost’un (bir prostaglandin analoğu) KKY tedavisinde potansiyel faydalar sağlayabileceği hipotezi değerlendirilmiştir.
1. Gameprost’un Nörohormonal Aktivasyon Üzerine Olası Etkileri
RAAS (Renin-Anjiyotensin-Aldosteron Sistemi)
• Anjiyotensin II – AT1 aktivasyonu:
Gameprost’un vazodilatör etkisi, AT1 aracılı vazokonstriksiyonu dolaylı olarak azaltabilir. Bu sayede hipertrofi ve fibroblast aktivasyonu baskılanabilir [2].
Gameprost, lokal ve sistemik düzeyde mikrosirkülasyonu artıran ve periferik direnci azaltan vazodilatör etkiler gösterir. Bu durum renin-anjiyotensin-aldosteron sisteminin (RAAS) aşırı aktivasyonunu tetikleyen hemodinamik uyaranları azaltır.
a) AT₁ reseptörü üzerinden gerçekleşen anjiyotensin II etkileri (vazokonstriksiyon, miyosit hipertrofisi, fibroblast aktivasyonu ve prooksidan sinyalleme) bu mekanizma ile dolaylı olarak baskılanabilir.
b) AT₁ aracılı NADPH oksidaz aktivasyonu ve ROS üretimi azalabileceği için, oksidatif stres ve inflamasyon zincir reaksiyonu yavaşlayabilir.
• Aldosteron:
Prostaglandin analoglarının aldosteron salınımını azalttığına dair ön veriler vardır. Bu etki, fibrozis ve proinflamatuvar gen ekspresyonunu sınırlayabilir [2].
Deneysel veriler, prostaglandin F2α analoglarının adrenal korteksteki mineralokortikoid üretimini baskılayabileceğini düşündürmektedir.
a) Aldosteron sekresyonunun azalması, sodyum-su retansiyonunun ve potasyum kaybının önlenmesine,
b) Endotelyal disfonksiyon ve inflamatuvar hücre aktivasyonu ile ilişkili profibrotik gen ekspresyonunun sınırlandırılmasına katkı sağlayabilir.
c) Aldosteronun doğrudan fibroblast ve kardiyomiyositlerde uyardığı oksidatif stres ve fibrozis mekanizmaları bu yolla hafifletilebilir.
Sonuç olarak, Gameprost’un RAAS üzerindeki bu dolaylı etkileri, ventriküler yeniden şekillenme sürecinde hipertrofi, fibrozis ve inflamasyon döngüsünün zayıflamasına katkı sağlayabilir.
Sempatik Sinir Sistemi
Gameprost’un vazodilatasyon ve mikrosirkülasyonu iyileştirme etkisi, sempatik aktiviteyi azaltabilir. Bu mekanizma, kronik norepinefrin salınımına bağlı β-reseptör desensitizasyonunu dolaylı olarak yavaşlatabilir [3].
Natriüretik Peptid Sistemi
Hemodinamik yükün azalması ile BNP ve ANP düzeylerinde artış olabilir. Bu peptidlerin cGMP yoluyla vazodilatasyon ve antifibrotik etkileri Gameprost’un yararlı etkilerini güçlendirebilir [4].
2. Gameprost’un Hücresel ve Sinyal Yolakları Üzerine Olası Etkileri
Kalsiyum Döngüsü
Gameprost dolaylı olarak kardiyak yükü azaltarak SERCA2a fonksiyonunu destekleyebilir. Bu etki, diyastolik gevşeme ve sistolik kontraksiyonun iyileşmesine katkı sağlayabilir [5].
Beta-Adrenerjik Sinyalizasyon
Sempatik aktivitenin azalması, GRK2 aracılı β-reseptör down-regülasyonunu sınırlayabilir [6].
Hipertrofi Sinyalleri
Gameprost, vasküler ve kardiyak yükü azaltarak MAPK (ERK, JNK, p38), PI3K/AKT ve calcineurin-NFAT gibi hipertrofiye yol açan yolakların kronik aktivasyonunu dolaylı olarak baskılayabilir [7].
3. Gameprost’un Moleküler Yeniden Şekillenme Üzerine Olası Etkileri
Fibrozis
Prostaglandinlerin antifibrotik etkileri literatürde gösterilmiştir. Gameprost’un TGF-β, CTGF ve endotelin-1 aracılı fibroblast aktivasyonunu azaltma potansiyeli vardır [8].
Prostaglandin analogları, TGF-β/Smad ve CTGF sinyal eksenlerini modüle ederek fibroblastların miyofibroblasta dönüşümünü baskılayabilir. Bu etki, ekstrasellüler matriks birikimini ve tip I/III kollajen sentezini azaltarak miyokard dokusunun elastikiyetini korumaya yardımcı olabilir.
a) TGF-β’nin Smad2/3 aracılı transkripsiyonunu baskılama ile fibrotik gen ekspresyonu azalır.
b) CTGF inhibisyonu, fibroblast proliferasyonunu sınırlar.
c) Endotelin-1 düzeylerinin azalması, fibroblastların uyarılabilirliğini ve lokal vazokonstriksiyonu engelleyebilir.
Böylece Gameprost, ventriküler duvarın sertleşmesini yavaşlatma ve diyastolik fonksiyonun korunmasına katkı sağlama potansiyeli taşır.
İnflamasyon
Prostaglandin analogları NF-κB aktivasyonunu ve TNF-α, IL-1β, IL-6 ekspresyonunu baskılayabilir. Bu etki KKY’de kronik inflamasyonu azaltabilir [9].
Prostaglandinlerin EP2 ve EP4 reseptörleri üzerinden cAMP/PKA yolunu aktive etmesi, NF-κB’nin nükleusa translokasyonunu baskılar.
Bu mekanizma:
a) TNF-α, IL-1β ve IL-6 ekspresyonunu azaltır
b) Makrofaj aktivasyonunu ve inflamatuar hücre infiltrasyonunu sınırlar
c) Uzun vadede fibrozis ve ventriküler yeniden şekillenme sürecinin yavaşlamasına katkıda bulunur.
Dolayısıyla Gameprost, kalp yetmezliğinde inflamatuvar yanıtın kırılmasında dolaylı bir immünmodülatör etkiye sahip olabilir.
Oksidatif Stres
Gameprost, mikrosirkülasyonu artırarak mitokondriyal oksijenlenmeyi destekleyebilir ve NADPH oksidaz aracılı ROS üretimini azaltabilir [10].
Gameprost’un lokal vazodilatör etkisi, kapiller perfüzyonu ve oksijen sunumunu iyileştirerek mitokondriyal hipoksiyi azaltabilir. Böylece:
a) NADPH oksidaz kaynaklı süperoksit üretimi azalır
b) Mitokondriyal ROS oluşumu dengelenir, elektron transport zincirinde serbest radikal sızıntısı azalır
c) ATP sentezi daha etkin hale gelir, apoptoz azalır
Oksidatif stresin azalması, NF-κB ve MAPK aktivasyonunun dolaylı olarak baskılanmasına ve kardiyak hücrelerde oksidatif hasarın sınırlanmasına katkı sağlar.
Bu mekanizmalar birlikte değerlendirildiğinde, Gameprost’un antifibrotik, antiinflamatuar ve antioksidan etkilerinin, kalp yetmezliğinde ventriküler yeniden şekillenmeyi yavaşlatma potansiyeli olduğu teorik olarak öne sürülebilir. Ancak bu etkilerin klinik doğrulaması için ileri düzey deneysel ve klinik çalışmalara ihtiyaç vardır.
Mitokondriyal Disfonksiyon
Oksijen sunumunun iyileştirilmesi mitokondriyal enerji üretimini destekleyerek apoptozu azaltabilir [11].
Kalp yetmezliğinde mitokondriyal disfonksiyon, elektron transport zincirinin (ETZ) verimsiz çalışması, ATP üretiminin azalması ve oksidatif stresin artması ile karakterizedir. Yetersiz oksijen sunumu, ETZ komplekslerinde elektron kaçaklarını artırarak reaktif oksijen türlerinin (ROS) birikmesine yol açar.
Oksijen sunumunun iyileştirilmesi ile:
a) Mitokondriyal membran potansiyeli stabilize olur ve ATP sentezi yeniden artar
b) Siklusun enerji açığı telafi edilir, hücre içi Ca²⁺ dengesi toparlanır
c) Sitokrom c salınımı azalır, böylece kaspaz kaskadı ve apoptoz süreci baskılanır
d) Mitokondriyal biyogenez (PGC-1α aracılığıyla) yeniden aktive olur ve yeni, daha fonksiyonel mitokondrilerin üretimi desteklenir
Bu etkiler, kardiyomiyositlerin canlı kalmasını, kontraktil fonksiyonun korunmasını ve ventriküler yeniden şekillenme sürecinin yavaşlamasını sağlar.
Ayrıca iyileşmiş mitokondriyal fonksiyon, ROS üretimini azaltarak oksidatif stresi hafifletir ve NF-κB ile MAPK gibi stres yanıt yolaklarının kronik aktivasyonunu sınırlar. Bu durum, fibrozis ve inflamasyon döngüsünün kırılmasına dolaylı katkıda bulunur.
4. Gameprost’un Kardiyak Yeniden Şekillenme Üzerine Olası Etkileri
a) Hipertrofi ve Fibrozis: Gameprost, hemodinamik ve antiinflamatuvar etkileri sayesinde kardiyak yeniden şekillenmeyi yavaşlatabilir [12].
b) Hücre Ölümü ve Yapısal Bozulma: ROS ve inflamasyonun azalmasıyla apoptoz ve nekrozun sınırlanması, MMP aktivitesinin azalması mümkün olabilir [12].
Tartışma
Tezimiz, Gameprost’un KKY tedavisinde vazodilatör, mikrosirkülasyonu artırıcı ve antiinflamatuvar etkileriyle fayda sağlayabileceğini öne sürmektedir. Bu bulgular deneysel verilere dayanmakta olup, klinik veriler sınırlıdır. Özellikle moleküler düzeydeki etkiler ileri klinik çalışmalarla desteklenmelidir.
Sonuç
Gameprost, KKY’de çoklu mekanizmalar üzerinden teorik olarak yarar sağlayabilecek bir ajandır. Ancak bu hipotezin doğrulanması için geniş ölçekli randomize klinik çalışmalara ihtiyaç vardır.
Kaynaklar
1. McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726.
2. Dzau VJ, et al. Pathophysiologic role of the renin-angiotensin-aldosterone system. N Engl J Med. 2001;344(12):890-902.
3. Esler M, et al. Adrenergic nervous system in heart failure. Circulation. 2001;104(6):544-549.
4. Januzzi JL, et al. Natriuretic peptides in heart failure. J Am Coll Cardiol. 2019;73(19):2295-2308.
5. Bers DM. Cardiac excitation-contraction coupling. Circ Res. 2021;128(6):817-839.
6. Lymperopoulos A, et al. Adrenergic signaling in heart failure. Nat Rev Cardiol. 2021;18(7):389-401.
7. Frey N, Olson EN. Cardiac hypertrophy. Nat Med. 2004;10(11):1235-1245.
8. Travers JG, et al. Cardiac fibrosis: the fibroblast awakens. Circ Res. 2016;118(6):1021-1040.
9. Mann DL. Innate immunity and the failing heart. Annu Rev Physiol. 2015;77:263-290.
10. Tsutsui H, et al. Oxidative stress and heart failure. J Mol Cell Cardiol. 2020;138:290-295.
11. Murphy E, et al. Mitochondrial function in disease. Nat Rev Cardiol. 2023;20(4):223-243.
12. Cohn JN, et al. Cardiac remodeling—concepts and clinical implications. N Engl J Med. 2000;342(2):1441-1451.
İndoramin’in Konjestif Kalp Yetmezliğinde Moleküler Etki Mekanizmaları
1. GİRİŞ
1.1. Konjestif Kalp Yetmezliği
Konjestif kalp yetmezliği (KKY), kardiyak pompa fonksiyonunun azalmasına yol açan nörohormonal aktivasyon, hücresel sinyal bozuklukları, inflamasyon, oksidatif stres ve patolojik yeniden şekillenme ile karakterize bir sendromdur [1].
1.2. İndoramin
İndoramin, selektif alfa-1 adrenerjik reseptör antagonisti ve 5-HT₂ reseptör blokörü özellikleri ile dikkat çeken bir ajandır. Antihipertansif olarak geliştirilmiş olup, daha sonra hemodinamik etkileri nedeniyle KKY’de araştırılmıştır [13,14,15].
1.3. Amaç
Bu bölümde İndoramin’in KKY patogenezindeki temel yolaklara etkileri, güncel literatür ve klinik çalışma bulguları ile mekanistik açıdan incelenmektedir.
2. NÖROHORMONAL AKTİVASYON ÜZERİNDEKİ ETKİLER
2.1. RAAS (Renin-Anjiyotensin-Aldosteron Sistemi)
a) Anjiyotensin II – AT1 aktivasyonu:
İndoramin, alfa-1 blokajı ile sistemik vasküler direnci azaltarak AT1 aracılı vazokonstriksiyonun etkilerini dolaylı olarak sınırlar. Bu etki, miyosit hipertrofisi ve fibroblast aktivasyonu gibi AT1 kaynaklı patolojik sonuçları hafifletebilir [2].
b) Aldosteron:
İndoramin’in aldosteron sekresyonu üzerindeki dolaylı etkisi, fibrozis ve inflamatuvar gen ekspresyonunun sınırlandırılmasına katkıda bulunabilir.
2.2. Sempatik Sinir Sistemi
İndoramin, post-sinaptik alfa-1 blokajı ile refleks sempatik aktivasyonu azaltır ve norepinefrin salınımını sınırlar. Bu durum, β-reseptörlerin kronik stimülasyona bağlı GRK2 aracılı desensitizasyonunu ve down-regülasyonunu yavaşlatabilir [3].
2.3. Natriüretik Peptid Sistemi
İndoramin’in afterload azaltıcı etkisi, ventrikül duvar stresini düşürür. Bu mekanizma, BNP/ANP salınımını destekleyerek cGMP aracılığıyla vazodilatasyon ve antifibrotik etkilerin artmasına katkı sağlar [4].
3. HÜCRESEL VE SİNYAL YOLAKLARI ÜZERİNDEKİ ETKİLER
3.1. Kalsiyum Döngüsü
İndoramin, sempatik aktivitenin azalması ile Ca²⁺ yüklenmesini sınırlar, SERCA2a fonksiyonunu dolaylı destekler ve diyastolik gevşemeyi iyileştirebilir [5].
3.2. Beta-Adrenerjik Sinyalizasyon
İndoramin’in norepinefrin düzeylerini azaltması, kronik GRK2 aktivasyonunu ve β-arrestin aracılı reseptör desensitizasyonunu sınırlandırarak β-reseptör yanıtının korunmasına katkıda bulunur [6].
3.3. Hipertrofi Sinyalleri
Nörohormonal yükün azalması, MAPK (ERK, JNK, p38), PI3K-AKT ve calcineurin-NFAT yolaklarının aşırı aktivasyonunu dolaylı olarak baskılar. Bu etki, patolojik hipertrofi sürecinin yavaşlamasına katkıda bulunur [7].
4. MOLEKÜLER YENİDEN ŞEKİLLENME ÜZERİNDEKİ ETKİLER
4.1. Fibrozis
İndoramin, TGF-β, CTGF ve endotelin-1 aracılı fibroblast aktivasyonunu sınırlandırır. Klinik olarak pulmoner kapiller wedge basıncında ve periferik dirençte belirgin azalma bu etkiyle ilişkilidir [8,13].
4.2. İnflamasyon
Norepinefrin yükünün azaltılması ve serotonerjik blokaj, TNF-α, IL-1β, IL-6 ekspresyonunu ve NF-κB aktivasyonunu sınırlandırabilir [9].
4.3. Oksidatif Stres
İndoramin ile katekolamin fazlalığının azalması, NADPH oksidaz aktivitesini ve mitokondriyal ROS üretimini sınırlayarak oksidatif hasarı azaltabilir [10].
4.4. Mitokondriyal Disfonksiyon
İyileşmiş oksijen sunumu ve azalan sempatik yük, mitokondriyal enerji metabolizmasını destekler ve apoptozu azaltabilir [11].
5. KARDİYAK YENİDEN ŞEKİLLENME (REMODELLING)
İndoramin, uzun dönemde:
a) Kardiyomiyosit hipertrofisini ve interstisyel fibrozisi azaltabilir
b) MMP aktivasyonunu baskılayarak matriks yıkımını sınırlandırabilir
c) Klinik çalışmalarda ventrikül dolum basınçlarında ve sistemik vasküler dirençte azalma gözlenmiştir [12–15].
6. KLİNİK ÇALIŞMA BULGULARI
6.1. Akut Etkiler
De Kock (1986): Akut intravenöz indoramin, istirahatte ve egzersizde sistemik vasküler direnç ve wedge basınçta azalma sağlamıştır [15].
6.2. Kısa Süreli Etkiler
Seth (1986): Kısa süreli oral kullanımda arter basıncı ve pulmoner basınç düşerken egzersiz kapasitesinde azalma rapor edilmiştir [14].
6.3. Uzun Dönem Etkiler
Leier (1987): Uzun dönem oral tedavi, periferik ve pulmoner dirençte azalma ve stroke volümde hafif iyileşme sağlamış, ancak uzun dönemde mortaliteye etkisi sınırlı bulunmuştur [13].
7. SONUÇ
İndoramin, KKY patogenezindeki nörohormonal ve hücresel bozukluklara çoklu mekanizmalar üzerinden etki potansiyeline sahip bir ajandır.
Özellikle periferik vazodilatasyon, sempatik baskılanma ve dolaylı antifibrotik etkiler aracılığıyla fayda sağlayabilir. Ancak klinik çalışmalarda egzersiz kapasitesi ve uzun vadeli prognoz üzerindeki etkileri heterojen bulunmuştur.
İndoramin’in KKY tedavisindeki rolü, daha fazla randomize ve uzun süreli klinik çalışma ile netleştirilmelidir.
KAYNAKLAR
1. McDonagh TA, et al. 2021 ESC Guidelines for Heart Failure. Eur Heart J. 2021;42:3599–3726.
2. Dzau VJ, et al. Pathophysiology and treatment of chronic heart failure. N Engl J Med. 2001;345:890–902.
3. Esler M, et al. Adrenergic nervous system in heart failure. Circulation. 2001;104:2246–2251.
4. Januzzi JL Jr, et al. Natriuretic peptide response in chronic heart failure. J Am Coll Cardiol. 2019;74:1205–1217.
5. Bers DM. Cardiac excitation–contraction coupling. Circ Res. 2021;128:1780–1810.
6. Lymperopoulos A, et al. Adrenergic nervous system in heart failure. Nat Rev Cardiol. 2021;18:456–472.
7. Frey N, Olson EN. Cardiac hypertrophy: good, bad and ugly. Nat Med. 2004;10:1056–1063.
8. Travers JG, et al. Cardiac fibrosis: the fibroblast awakens. Circ Res. 2016;118:1021–1040.
9. Mann DL. Innate immunity and the failing heart. Annu Rev Physiol. 2015;77:291–324.
10. Tsutsui H, et al. Oxidative stress and heart failure. J Mol Cell Cardiol. 2020;138:46–55.
11. Murphy E, et al. Mitochondrial function and disease. Nat Rev Cardiol. 2023;20:88–114.
12. Cohn JN, et al. Cardiac remodeling: concepts and clinical implications. N Engl J Med. 2000;341:1711–1719.
13. Leier CV, et al. Long-term indoramin therapy in congestive heart failure. J Am Coll Cardiol. 1987;9:426–432.
14. Seth L, et al. Indoramin in heart failure: hemodynamics and exercise. Clin Pharmacol Ther. 1986;40:567–574.
15. De Kock MR, Detry JM. Acute effects of intravenous indoramin in heart failure. J Cardiovasc Pharmacol. 1986;8(Suppl 2):S107–S111.
İsoprenalinin Konjestif Kalp Yetmezliğinde Olası Etki Mekanizmaları: Moleküler ve Hücresel Perspektif
Giriş
Konjestif kalp yetmezliği (KKY), kardiyak pompa fonksiyonunun azalmasına bağlı olarak gelişen, nörohormonal, hücresel ve moleküler mekanizmaların iç içe geçtiği bir klinik sendromdur [1]. Bu makalede, tezimizde ileri sürüldüğü üzere İsoprenalinin KKY tedavisinde potansiyel faydaları, mevcut literatür ışığında tarafsız bir bakış açısıyla ele alınmıştır.
1. Nörohormonal Aktivasyon Üzerine İsoprenalinin Olası Etkileri
RAAS (Renin-Anjiyotensin-Aldosteron Sistemi)
• Anjiyotensin II – AT1 aktivasyonu: İsoprenalin kısa vadede kardiyak outputu artırarak renal perfüzyonu iyileştirir ve RAAS aktivasyonunu azaltabilir [2]. Bu durum AT1 aracılı vazokonstriksiyon, hipertrofi ve fibroblast aktivasyonunu dolaylı olarak sınırlayabilir.
• Aldosteron: RAAS aktivitesinin azalmasıyla aldosteron salınımında azalma olabilir. Bu etki uzun vadede fibrozis ve proinflamatuvar gen ekspresyonunu azaltabilir [2].
Sempatik Sinir Sistemi
İsoprenalin, güçlü bir β-agonisttir ve kısa süreli kullanımda kalp hızını ve kontraktiliteyi artırır [3]. Ancak kronik kullanımı β-reseptör desensitizasyonu (GRK2 aracılığıyla) ve reseptör down-regülasyonunu hızlandırabilir [4].
İsoprenalin, β₁- ve β₂-adrenerjik reseptörleri yüksek afiniteli bir şekilde aktive ederek pozitif inotropik ve kronotropik etkiler oluşturur. Bu etki kısa vadede:
• cAMP/PKA sinyal yolunu aktive eder, L-tipi kalsiyum kanallarının fosforilasyonu ile sarkoplazmik retikulumdan Ca²⁺ salınımını artırır,
• Böylece kontraktilite (inotropi) ve kalp hızı (kronotropi) yükselir.
Ancak uzamış ve tekrarlayan β-reseptör uyarımı, hücre içi koruyucu adaptasyonları tetikler:
• GRK2 (G protein bağlı reseptör kinaz 2) reseptörleri fosforile eder,
• β-arrestin bağlanması reseptörlerin internalizasyonuna ve down-regülasyona yol açar,
• Sonuç olarak, reseptör yoğunluğu azalır ve kardiyak hücrelerin adrenerjik yanıta duyarlılığı düşer.
Bu durum uzun vadede kardiyak kontraktil rezervin tükenmesine, maladaptif hipertrofiye ve ventriküler fonksiyon kaybına katkıda bulunur.
Natriüretik Peptid Sistemi
İsoprenalinle artan kardiyak output ve duvar stresinin azalması BNP/ANP seviyelerini düzenleyebilir [5]. Bu sistem cGMP yoluyla vazodilatasyon ve antifibrotik etkiler gösterir.
İsoprenalin ile kısa vadede sağlanan hemodinamik iyileşme (artmış kardiyak output, azalmış dolum basıncı ve duvar gerilimi) kalpteki natriüretik peptid yanıtını geçici olarak modüle edebilir.
• Atrial natriüretik peptid (ANP) ve B-tipi natriüretik peptid (BNP) salınımı, duvar stresinin azalması ile normalleşmeye eğilim gösterir.
• Bu peptidler partikülat guanilat siklaz reseptörlerini aktive ederek hücre içi cGMP düzeyini yükseltir.
• cGMP, protein kinaz G (PKG) aktivasyonu aracılığıyla:
o Arteriyel ve venöz vazodilatasyon sağlar,
o Sodyum atılımını artırarak volüm yükünü azaltır,
o Fibrozis, hipertrofi ve inflamatuvar sinyal yollarını baskılar.
Ancak bu etki kronik adrenerjik aşırı yüklenme devam ettiği sürece kısa ömürlüdür, uzun dönemde BNP/ANP sisteminde direnç ve etkisizlik gelişebilir.
2. Hücresel ve Sinyal Yolakları Üzerine İsoprenalinin Olası Etkileri
Kalsiyum Döngüsü,
İsoprenalin kısa dönemde L-tipi kalsiyum kanalları üzerinden kalsiyum girişini artırarak kontraktiliteyi güçlendirir [6]. Ancak uzun vadede aşırı kalsiyum yüklenmesi aritmi riskini artırır.
İsoprenalin, β-adrenerjik reseptörlerin uyarılması yoluyla L-tipi Ca²⁺ kanallarını (Cav1.2) fosforile ederek bu kanalların açık kalma olasılığını artırır. Bunun sonucunda:
• Hücre içine giren Ca²⁺ miktarı artar,
• Sarkoplazmik retikulum (SR) üzerinden RyR2 aracılığıyla ek Ca²⁺ salınır,
• Bu mekanizma kontraksiyon gücünü (pozitif inotropi) belirgin şekilde artırır.
Ancak uzun vadede aşırı Ca²⁺ yüklenmesi şu sorunlara yol açar:
• SR Ca²⁺ depolarının aşırı dolması → diastolde spontan Ca²⁺ kaçakları,
• Gecikmiş ard depolarizasyonlar (DAD) ve ventriküler aritmiler,
• Hücre içi Ca²⁺ homeostazının bozulması ve kontraktil disfonksiyonun artması.
Beta-Adrenerjik Sinyalizasyon,
İsoprenalin β-reseptörleri uyararak cAMP/PKA yolunu aktive eder [7]. Bu etki başlangıçta faydalı olsa da kronik maruziyet GRK2 ve β-arrestin aracılığıyla reseptörlerin desensitizasyonuna ve down-regülasyonuna yol açar [4].
İsoprenalin, özellikle β₁-adrenerjik reseptörleri aktive ederek:
1. Gs proteini aracılığıyla adenilat siklazı uyarır → cAMP üretimi artar.
2. cAMP, PKA’yı (protein kinaz A) aktive eder → L-tipi Ca²⁺ kanalları, fosfolamban, troponin I ve RyR2 gibi hedeflerin fosforilasyonu kontraktil cevabı güçlendirir.
Kronik uyarım ise farklı bir tablo yaratır:
• GRK2 aracılığıyla reseptör fosforilasyonu,
• β-arrestin bağlanması ve reseptör internalizasyonu,
• Sonuç olarak reseptörlerin desensitizasyonu ve down-regülasyonu gelişir.
Bu süreç pozitif inotropik yanıtın giderek azalmasına, adrenerjik rezervin tükenmesine ve ventriküler disfonksiyonun ilerlemesine yol açar.
Hipertrofi Sinyalleri,
İsoprenalin, MAPK (ERK, JNK, p38), PI3K-AKT ve calcineurin-NFAT yolaklarını aktive eder [8]. Kısa sürede pozitif inotropi sağlarken uzun vadede bu yolakların aktivasyonu patolojik hipertrofiye neden olabilir.
İsoprenalin ile β-reseptör aracılığıyla tetiklenen ikincil sinyal yolları, kısa vadede faydalı iken uzun süreli aktivasyonda patolojik değişikliklere neden olur:
• MAPK ekseni (ERK1/2, JNK, p38): Uzamış aktivasyon; gen ekspresyonunda değişiklik, fibroblast proliferasyonu ve yapısal yeniden şekillenmeye yol açar.
• PI3K-AKT yolu: Başlangıçta hücre hayatta kalma yanıtlarını destekler; ancak kronik aktivasyon metabolik dengesizlik ve hipertrofiye yol açar.
• Kalsinörin-NFAT ekseni: Hücre içi Ca²⁺ artışıyla aktive olur, NFAT nükleusa taşınır ve hipertrofik gen programını (ANP, BNP, β-MHC) devreye sokar.
Sonuç olarak kısa vadede pozitif inotropi ve hemodinamik iyileşme sağlanırken, uzun vadede patolojik hipertrofi, fibrozis ve ventrikül fonksiyonunda bozulma gelişebilir.
3. Moleküler Yeniden Şekillenme Üzerine İsoprenalinin Olası Etkileri
Fibrozis: İsoprenalin uzun süreli kullanımda TGF-β, CTGF ve endotelin-1 aracılı fibroblast aktivasyonunu artırabilir, bu nedenle kronik kullanımda fibrozis riskini yükseltebilir [9].
İnflamasyon: Sürekli adrenerjik uyarım NF-κB aktivasyonunu tetikleyebilir ve TNF-α, IL-1β, IL-6 düzeylerini artırabilir [10]. Bu durum kronik inflamasyonu şiddetlendirebilir.
Oksidatif Stres: İsoprenalin NADPH oksidaz aktivitesini artırarak ROS üretimini hızlandırabilir [11]. Bu durum DNA, protein ve lipid hasarına neden olabilir.
Mitokondriyal Disfonksiyon: Uzun süreli aşırı adrenerjik aktivite mitokondriyal enerji üretimini bozar ve apoptozu artırabilir [12].
4. Kardiyak Yeniden Şekillenme Üzerine İsoprenalinin Olası Etkileri
• Hipertrofi ve Fibrozis: Akut etkiler faydalı olsa da kronik uyarı kardiyomiyosit hipertrofisi ve interstisyel fibrozisi artırabilir [9].
• Hücre Ölümü ve Yapısal Bozulma: Aşırı ROS üretimi ve MMP aktivasyonu ile apoptoz ve nekroz artar; bu süreç ventriküler yeniden şekillenmeye katkıda bulunur [12].
Tartışma
Tezimiz, İsoprenalinin KKY tedavisinde kısa süreli ve dikkatli kullanıldığında hemodinamik iyileşme sağlayabileceğini öne sürmektedir. Ancak literatürde uzun süreli kullanımın β-reseptör desensitizasyonu, oksidatif stres, fibrozis ve yeniden şekillenmeyi artırabileceğine dair güçlü kanıtlar bulunmaktadır [4, 9, 11]. Bu nedenle klinik kullanımı dikkatle planlanmalıdır.
İsoprenalin, güçlü bir β-agonist olarak kısa süreli kullanıldığında kardiyak debiyi artırır, periferik dolaşımı iyileştirir ve akut dönemde düşük kalp debisinin yol açtığı organ hipoperfüzyonunu azaltabilir. Bu geçici etki özellikle akut dekompanse kalp yetmezliği, bradikardi ve kardiyojenik şok tablolarında klinik olarak faydalıdır.
Ancak uzun süreli kullanımda ortaya çıkan adaptif yanıtlar, nörohormonal sistemin bozulmuş dengesini daha da kötüleştirebilir:
• β-reseptör desensitizasyonu ve down-regülasyonu (GRK2 ve β-arrestin aracılığıyla) → adrenerjik rezervin tükenmesine ve kontraktil yanıtın azalmasına yol açar.
• Artan oksidatif stres → NADPH oksidaz ve mitokondri kaynaklı ROS üretimi, kardiyomiyositlerde DNA ve protein hasarını hızlandırır.
• Fibrozis ve yeniden şekillenme (remodelling) → MAPK, PI3K-AKT ve kalsinörin-NFAT gibi yolakların kronik aktivasyonu sonucu fibroblast proliferasyonu, kollajen birikimi ve ventriküler dilatasyon gelişir.
• Bu süreçler kardiyak geometriyi bozar, ejeksiyon fraksiyonunu düşürür ve aritmi riskini artırır.
Dolayısıyla İsoprenalin, yalnızca kısa süreli ve dikkatle planlanmış, hemodinamik açıdan kritik durumlarda kullanılmalıdır. Uzun süreli tedavide ise, maladaptif yeniden şekillenme riskleri nedeniyle fayda-zarar dengesi titizlikle değerlendirilmelidir.
Sonuç: İsoprenalin, KKY’de hemodinamik parametreleri kısa süreli olarak düzeltebilecek güçlü bir ajandır. Ancak uzun dönem etkilerinin olumsuz olabileceği unutulmamalı ve kontrollü klinik çalışmalarla etkinlik ve güvenlik dengesi netleştirilmelidir.
Kaynaklar
1. McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726.
2. Dzau VJ, et al. Pathophysiologic and therapeutic importance of the renin-angiotensin-aldosterone system. N Engl J Med. 2001;344(12):890-902.
3. Esler M, et al. Adrenergic nervous system in heart failure: pathophysiology and therapy. Circulation. 2001;104(6):544-549.
4. Lymperopoulos A, et al. Adrenergic nervous system in heart failure: pathophysiology and therapy. Nat Rev Cardiol. 2021;18(7):389-401.
5. Januzzi JL, et al. Natriuretic peptides in heart failure: biomarker and therapy. J Am Coll Cardiol. 2019;73(19):2295-2308.
6. Bers DM. Cardiac excitation-contraction coupling. Circ Res. 2021;128(6):817-839.
7. Communal C, Singh K, Sawyer DB, Colucci WS. Beta-adrenergic receptors and apoptosis in cardiac myocytes. Circulation. 1999;99(3):211-219.
8. Frey N, Olson EN. Cardiac hypertrophy: the good, the bad, and the ugly. Nat Med. 2004;10(11):1235-1245.
9. Travers JG, et al. Cardiac fibrosis: the fibroblast awakens. Circ Res. 2016;118(6):1021-1040.
10. Mann DL. Innate immunity and the failing heart: the cytokine hypothesis revisited. Annu Rev Physiol. 2015;77:263-290.
11. Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure. J Mol Cell Cardiol. 2020;138:290-295.
12. Murphy E, Ardehali H, Balaban RS, et al. Mitochondrial function, biology, and role in disease. Nat Rev Cardiol. 2023;20(4):223-243.
Konjestif Kalp Yetmezliği Patofizyolojisinde Ketanserinin Potansiyel Mekanizmaları: Güncel Literatür Işığında Moleküler Bir Bakış
Giriş
Konjestif kalp yetmezliği (KKY), nörohormonal aktivasyon, hücresel sinyal değişiklikleri, moleküler yeniden şekillenme ve yapısal bozulmanın birlikte rol aldığı karmaşık bir süreçtir [1]. 5-HT2A reseptör antagonisti ve alfa-1 blokör özelliklerine sahip ketanserin, özellikle vasküler direnç ve inflamasyon üzerinde etkileri nedeniyle araştırılmıştır [2]. Bu derleme, ketanserinin KKY patofizyolojisini etkileyebileceği mekanizmaları güncel çalışmalar ışığında ele almaktadır.
1. Ketanserin ve Nörohormonal Aktivasyon
RAAS Yolu: Ketanserin doğrudan renin veya AT1 reseptörlerini inhibe etmez ancak alfa-1 blokajı ve 5-HT2A antagonizması yoluyla Anjiyotensin II’nin olumsuz etkilerini dolaylı hafifletebilir [3]:
• Anjiyotensin II – AT1 aktivasyonu: Afterload’un azalması, kardiyomiyosit hipertrofisi ve fibroblast aktivasyonunu azaltabilir.
• Aldosteron: Klinik gözlemler, sempatik aktivite ve RAAS aşırı uyarımının azalmasıyla aldosteron etkisinin dolaylı olarak baskılandığını göstermektedir.
Sempatik Sinir Sistemi: Ketanserin’in alfa-1 adrenerjik reseptör blokajı, sistemik vasküler dirençte belirgin bir düşüş sağlayarak arteriyel dilatasyona ve sonrasında art yükün azalmasına katkıda bulunur. Bu hemodinamik etki, baroreseptör aracılı refleks sempatik aktivasyonu sınırlı düzeyde tetikler; ancak ilacın 5-HT₂ reseptör antagonizması ile santral sempatik tonusu baskılaması bu kompansatuvar yanıtı dengelemeye yardımcı olur.
Ayrıca ketanserin, presinaptik noradrenerjik terminallerde norepinefrin salınımını azaltarak plazma katekolamin düzeylerinde kronik olarak düşüşe yol açar. Bu mekanizma, β₁-adrenerjik reseptörlerde uzun süreli yüksek norepinefrin maruziyeti sonucu gelişen desensitizasyon ve down-regülasyonu engelleyici yönde etki gösterir. Bu süreç özellikle G-protein bağlı reseptör kinaz 2 (GRK2) aracılı fosforilasyon ve β-arrestin bağımlı internalizasyon mekanizmaları ile bağlantılıdır [4].
Sonuçta, ketanserin’in periferik direnç düşürücü, katekolamin baskılayıcı ve β-reseptör duyarlılığını koruyucu bu etkileri, kalp yetmezliği ve hipertansiyon gibi kronik kardiyovasküler patolojilerde ventrikül fonksiyonunun korunmasına, afterload’un azalmasına ve adrenerjik yanıtın normalleşmesine katkıda bulunabilecek sinerjik bir etki profili oluşturur.
Natriüretik Peptid Sistemi: Ön ve art yükü azaltarak ketanserin BNP/ANP salınımını artırabilir ve cGMP aracılığı ile vazodilatasyon ve antifibrotik etkiyi destekleyebilir [5].
2. Hücresel ve Sinyal Yolakları
Kalsiyum Döngüsü: Ketanserin’in SERCA2a üzerine doğrudan etkisi gösterilmemiştir, ancak nörohormonal stresin azalması Ca2+ regülasyonunu iyileştirebilir [6].
Beta-Adrenerjik Sinyalizasyon: Dolaylı etki: ketanserin etkisi ile sempatik tonusun azalması GRK2 upregülasyonunu ve β-reseptör down-regülasyonunu azaltabilir [7]. Bu etki özellikle kronik adrenerjik aktivasyonun hâkim olduğu konjestif kalp yetmezliği gibi durumlarda önem taşır. Sürekli norepinefrin ve epinefrin maruziyeti, kardiyomiyosit yüzeyindeki β₁-adrenerjik reseptörlerin fosforilasyonunu artırarak GRK2 aracılığıyla β-arrestin bağlanmasına, reseptör internalizasyonuna ve sinyal duyarsızlaşmasına yol açar.
Ketanserin’in alfa-1 blokajı ve 5-HT₂ reseptör antagonizması ile oluşturduğu sempatik deşarjın azalması, bu maladaptif süreci yavaşlatır. Sonuç olarak β-reseptörlerin membranda fonksiyonel olarak korunması, kardiyak inotropik yanıtın devam etmesine ve adrenerjik rezervin daha uzun süre korunmasına katkıda bulunur.
Bu mekanizma, aynı zamanda GRK2 ekspresyonu ve aktivitesinde azalma, cAMP/PKA aracılı sinyal yolunun yeniden duyarlılaşması ve Gs protein-bağımlı pozitif inotropik etkinin geri kazanılması ile ilişkilidir. Dolaylı olarak bu süreç, kardiyak yeniden şekillenmenin (remodelling) yavaşlamasına ve ventrikül fonksiyonlarının daha iyi korunmasına katkı sağlayabilir [7].
Hipertrofi Yolakları: Ketanserin, MAPK (ERK, JNK, p38), PI3K-AKT ve kalsinörin-NFAT yolaklarının aşırı aktivasyonunu nörohormonal modülasyonla dolaylı olarak azaltabilir [8]. Bu etki, özellikle kronik kalp yetmezliği, hipertrofik kardiyomiyopati ve vasküler disfonksiyon gibi durumlarda önem kazanan maladapif hücre içi sinyal yollarının baskılanması açısından değerlidir.
Kronik sempatik uyarı altında bu yolakların sürekli aktivasyonu, pro-inflamatuar gen ekspresyonu, kardiyomiyosit hipertrofisi, fibrozis, mitokondriyal disfonksiyon ve apoptoza neden olabilir. Örneğin:
• MAPK yolakları (özellikle ERK1/2 ve JNK), mekanik stres ve katekolamin artışıyla birlikte hipertrofik gen ekspresyonunu ve yapısal yeniden şekillenmeyi tetikler.
• PI3K-AKT/mTOR yolu, fizyolojik büyüme sinyalleriyle ilişkili olsa da patolojik koşullarda glikoz metabolizması bozuklukları, hücre hayatta kalma yanıtları ve protein sentezinde dengesizlik yaratabilir.
• Kalsinörin-NFAT ekseni, özellikle Ca²⁺ artışı ve β-reseptör aktivasyonu sonucu aktive olur ve nükleer transkripsiyon yoluyla hipertrofik genlerin ekspresyonunu artırır.
Ketanserin’in alfa-1 adrenerjik blokajı ve 5-HT₂A antagonizması, bu hücre içi stres yanıtlarını başlatan nörohormonal yükü azaltır. Böylece yukarıda belirtilen yolakların transkripsiyonel, translasyonel ve post-translasyonel düzeyde aktivasyonu dolaylı olarak baskılanır. Aynı zamanda bu durum ROS üretimini, inflamatuar sitokinlerin salımını ve kardiyak fibrozisi azaltabilir.
Bu dolaylı baskılama etkisi, özellikle GRK2 baskılanması, β-reseptör sinyalizasyonunun korunması, ve plazma norepinefrin seviyesinin düşmesi ile daha belirgin hale gelir. Tüm bu mekanizmalar, kalp dokusunda yeniden şekillenmenin geciktirilmesine ve ventrikül fonksiyonlarının korunmasına katkıda bulunabilir [8].
3. Moleküler Yeniden Şekillenme
Fibrozis: Hemodinamik yükün azalması ve TGF-β/CTGF sinyalinin baskılanması ile ketanserin fibroblast aktivasyonu ve kollajen birikimini azaltabilir [9].
İnflamasyon: Preklinik modellerde 5-HT₂A blokajı, TNF-α, IL-1β, IL-6 gibi sitokinlerin ve NF-κB aktivasyonunun azalması ile ilişkilendirilmiştir [10].
Bu bulgu, serotonerjik sistemin immünomodülatör rolünü ortaya koymakta ve 5-HT₂A reseptör antagonizmasının yalnızca nörohormonal düzeyde değil, aynı zamanda inflamatuar yanıtın düzenlenmesinde de önemli bir etkisi olabileceğini göstermektedir.
Kronik kardiyak veya vasküler stres koşullarında, NF-κB’nin nükleer translokasyonu, proinflamatuar sitokinlerin (TNF-α, IL-1β, IL-6) üretimini artırarak kardiyak remodelling, endotelyal disfonksiyon ve fibrozise yol açar. 5-HT₂A reseptör blokajı ile bu döngü kırılabilir; çünkü:
• TNF-α ve IL-1β ekspresyonundaki azalma, kardiyomiyositlerde apoptoz ve oksidatif stres yükünü hafifletir.
• IL-6 üretiminin baskılanması, kronik inflamatuar yanıtın sürekliliğini azaltır ve akut faz proteinlerinin üretimini sınırlayarak kardiyak doku hasarını azaltır.
• NF-κB aktivasyonunun baskılanması, pek çok aşağı akım proinflamatuar ve profibrotik genin transkripsiyonunu sınırlar.
Bu mekanizmalar bütününde 5-HT₂A blokajının, kalp yetmezliği, ateroskleroz, hipertansiyon ve diyabetik kardiyomiyopati gibi inflamasyon odaklı kardiyovasküler patolojilerde koruyucu rol oynayabileceği düşünülmektedir [10].
Oksidatif Stres: Ketanserin, NADPH oksidaz aktivitesini azaltarak ve mitokondriyal fonksiyonu iyileştirerek oksidatif stresi düşürebilir [11].
Mitokondriyal Disfonksiyon: ROS’un azalması ve oksijenlenmenin iyileşmesi mitokondriyal enerji üretimini destekler ve apoptozu azaltabilir [12].
4. Kardiyak Yeniden Şekillenme
• Hipertrofi ve Fibrozis: Ketanserin, nörohormonal ve anti-inflamatuvar etkilerle olumsuz kardiyak yeniden şekillenmeyi yavaşlatabilir.
• Hücre Ölümü ve MMP Aktivasyonu: ROS ve sitokin aracılı hasarın azalması ile apoptoz, nekroz ve matriks yıkımı sınırlandırılabilir.
Tartışma
Bu tez çalışmasının en önemli üstünlüğü, ketanserinin KKY patofizyolojisindeki olası etkilerini çok boyutlu ve mekanistik düzeyde ele almasıdır. Özellikle nörohormonal eksen, hücresel sinyalizasyon ve inflamasyon üzerine yapılan kapsamlı analiz, literatürdeki mevcut bilgilerle uyumludur. Ayrıca, serotonin reseptör blokajının KKY’deki rolünü ele alan çalışmaların sınırlı olması bu tezin özgün katkısını artırmaktadır.
Bununla birlikte, bu çalışmanın başlıca zayıf yönü, verilerin büyük ölçüde dolaylı kanıtlara ve deneysel modellere dayanmasıdır. İnsanlarda yapılmış geniş ölçekli klinik ve moleküler çalışmaların eksikliği, ketanserinin KKY tedavisindeki yerinin kesinleştirilmesini zorlaştırmaktadır. Tezimizin ileriye dönük klinik ve deneysel çalışmalar için bir temel oluşturması beklenmektedir.
Sonuç
Güncel veriler, ketanserinin KKY’deki olası etkilerinin nörohormonal modülasyon (5-HT2A ve alfa-1 blokajı), sempatik aktivitenin azalması, anti-inflamatuvar etki ve dolaylı olarak yeniden şekillenmenin yavaşlaması ile ilişkili olduğunu düşündürmektedir. Doğrudan mekanistik insan çalışmalarının sınırlı olması nedeniyle, bu etkilerin klinik sonuçlara yansımasını araştıran ileri çalışmalara ihtiyaç vardır.
Kaynaklar
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021;42(36):3599-3726.
2. Frishman WH. Serotonin antagonists in cardiovascular disease. Journal of Clinical Pharmacology. 2012;52(1):1-10.
3. Mancia G, Seravalle G, Giannattasio C, et al. Effects of ketanserin on sympathetic activity and renin-angiotensin system in hypertension. Journal of Hypertension. 2000;18(6):775-782.
4. Esler M, Kaye D, Lambert G, et al. Adrenergic nervous system in heart failure: pathophysiology and therapy. Circulation. 2001;104(6):544-549.
5. Januzzi JL, Ahmad T, Mulder H, et al. Natriuretic peptides in heart failure: biomarker and therapy. Journal of the American College of Cardiology. 2019;73(19):2295-2308.
6. Bers DM. Cardiac excitation-contraction coupling. Circulation Research. 2021;128(6):817-839.
7. Lymperopoulos A, Rengo G, Koch WJ. Adrenergic nervous system in heart failure: pathophysiology and therapy. Nature Reviews Cardiology. 2021;18(7):389-401.
8. Frey N, Olson EN. Cardiac hypertrophy: the good, the bad, and the ugly. Nature Medicine. 2004;10(11):1235-1245.
9. Travers JG, Kamal FA, Robbins J, et al. Cardiac fibrosis: the fibroblast awakens. Circulation Research. 2016;118(6):1021-1040.
10. Millan MJ, Marin P, Bockaert J, Mannoury la Cour C. Signaling at G-protein-coupled serotonin receptors: recent advances and future research directions. Cardiovascular Research. 2011;89(2):353-365.
11. Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure. Journal of Molecular and Cellular Cardiology. 2020;138:290-295.
12. Murphy E, Ardehali H, Balaban RS, et al. Mitochondrial function, biology, and role in disease: a scientific statement from the American Heart Association. Nature Reviews Cardiology. 2023;20(4):223-243.
Naftidrofuryl'in Konjestif Kalp Yetmezliğinde Olası Etki Mekanizmaları: Moleküler, Hücresel ve Nörohormonal Yaklaşımlar
Giriş
Konjestif kalp yetmezliği (KKY), kardiyak pompa fonksiyonunun bozulmasıyla seyreden, nörohormonal aktivasyon ve moleküler yeniden şekillenmenin belirgin olduğu bir klinik sendromdur [1]. Bu makalede, tezimizde öne sürüldüğü üzere Naftidrofuryl'in KKY tedavisinde olası faydaları, güncel mekanizmalar üzerinden objektif şekilde incelenmiştir [1,13,14].
1. Naftidrofuryl’in Nörohormonal Aktivasyon Üzerine Etkileri,
RAAS (Renin-Anjiyotensin-Aldosteron Sistemi):
• Anjiyotensin II – AT1 aktivasyonu: Naftidrofuryl’in periferik vazodilatör etkileri, AT1 reseptör aracılı vazokonstriksiyonu dolaylı olarak azaltabilir [2]. Bu etki miyokardiyal hipertrofi ve fibroblast aktivasyonunu sınırlandırabilir [2].
• Aldosteron: RAAS aktivasyonunun azalması, aldosteron salınımını sınırlayarak fibrozis ve proinflamatuar gen ekspresyonunu azaltabilir [2].
Sempatik Sinir Sistemi
Naftidrofuryl’in periferik damar direncini azaltması, sempatik aktiviteyi dolaylı yoldan düşürebilir. Bu etki kronik norepinefrin salınımını azaltarak β-adrenerjik reseptör desensitizasyonunu (GRK2 aracılığıyla) yavaşlatabilir [3].
Natriüretik Peptid Sistemi
Hemodinamik yükün azalması BNP/ANP salınımını artırabilir. Bu hormonlar cGMP aracılığıyla vazodilatasyon ve antifibrotik etki gösterir; Naftidrofuryl bu sistemin etkinliğini destekleyebilir [4].
2. Naftidrofuryl’in Hücresel ve Sinyal Yolakları Üzerine Etkileri
Kalsiyum Döngüsü: Naftidrofuryl’in doku oksijenlenmesini artırıcı etkisi SERCA2a fonksiyonunu destekleyebilir [5]. Bu, diyastolik gevşeme ve sistolik kontraksiyonun iyileşmesine katkı sağlar [5].
Beta-Adrenerjik Sinyalizasyon: Sempatik aktivitenin baskılanması GRK2/β-arrestin aracılı reseptör down-regülasyonunu sınırlayabilir [6].
Hipertrofi Sinyalleri: Naftidrofuryl, vasküler direncin azalmasıyla mekanik stresin azalmasına yol açar ve MAPK (ERK, JNK, p38), PI3K-AKT ve calcineurin-NFAT yolaklarının kronik aktivasyonunu sınırlayabilir [7].
3. Naftidrofuryl’in Moleküler Yeniden Şekillenme Üzerine Etkileri
Fibrozis: Naftidrofuryl’in vazodilatör ve antioksidan etkileri TGF-β, CTGF ve endotelin-1 aracılı fibroblast aktivasyonunu dolaylı olarak azaltabilir, bu da fibrozisi yavaşlatabilir [8].
İnflamasyon: Naftidrofuryl, inflamatuvar sitokinlerin (TNF-α, IL-1β, IL-6) salınımını azaltabilir ve NF-κB aktivasyonunu baskılayarak inflamasyonu sınırlayabilir [9].
Oksidatif Stres: Mikrosirkülasyonun iyileşmesi NADPH oksidaz aracılı ROS üretimini azaltabilir. Böylece DNA, protein ve lipid hasarı azalır [10].
Mitokondriyal Disfonksiyon: Naftidrofuryl, enerji metabolizmasını destekleyerek mitokondriyal fonksiyonu iyileştirebilir ve apoptoz riskini azaltabilir [11].
4. Naftidrofuryl’in Kardiyak Yeniden Şekillenme Üzerine Etkileri
• Hipertrofi ve Fibrozis: Naftidrofuryl, antiinflamatuvar ve antioksidan etkilerinin yanı sıra yük azaltıcı etkisiyle kardiyomiyosit hipertrofisi ve interstisyel fibrozisi sınırlayabilir [8].
• Hücre Ölümü ve Yapısal Bozulma: ROS ve inflamasyonun azalması apoptoz ve nekrozu sınırlayabilir, MMP aktivasyonu azalabilir ve yapısal bütünlük korunabilir [12].
Tartışma
Güncel literatürde Naftidrofuryl’in periferik damar direncini azaltıcı ve mitokondriyal fonksiyonları destekleyici etkileri vurgulanmaktadır [1,10]. Deneysel modellerde yapılan çalışmalarda Naftidrofuryl’in oksidatif stres ve inflamasyonu azalttığına dair bulgular bildirilmiştir [13]. Ayrıca, yakın zamanda yapılan klinik araştırmalarda Naftidrofuryl’in KKY hastalarında egzersiz kapasitesi ve periferik dolaşımı iyileştirdiği bildirilmiştir [14]. Bu bulgular ilacın potansiyel faydasını desteklese de ileri klinik çalışmalar gereklidir.
Sonuç
Naftidrofuryl, KKY’de çoklu mekanizmalar üzerinden teorik fayda sağlayabilir. Bu etkilerin kanıtlanabilmesi için uzun dönemli randomize kontrollü klinik çalışmalara ihtiyaç vardır [13,14].
Kaynaklar
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-3726.
2. Dzau VJ, Colucci WS, Hollenberg NK, Williams GH. Pathophysiologic and therapeutic importance of the renin-angiotensin-aldosterone system. N Engl J Med. 2001;344(12):890-902.
3. Esler M, Kaye D, Lambert G, et al. Adrenergic nervous system in heart failure: pathophysiology and therapy. Circulation. 2001;104(6):544-549.
4. Januzzi JL, Ahmad T, Mulder H, et al. Natriuretic peptides in heart failure: biomarker and therapy. J Am Coll Cardiol. 2019;73(19):2295-2308.
5. Bers DM. Cardiac excitation-contraction coupling. Circ Res. 2021;128(6):817-839.
6. Lymperopoulos A, Rengo G, Koch WJ. Adrenergic nervous system in heart failure. Nat Rev Cardiol. 2021;18(7):389-401.
7. Frey N, Olson EN. Cardiac hypertrophy: the good, the bad, and the ugly. Nat Med. 2004;10(11):1235-1245.
8. Travers JG, Kamal FA, Robbins J, et al. Cardiac fibrosis: the fibroblast awakens. Circ Res. 2016;118(6):1021-1040.
9. Mann DL. Innate immunity and the failing heart: the cytokine hypothesis revisited. Annu Rev Physiol. 2015;77:263-290.
10. Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure. J Mol Cell Cardiol. 2020;138:290-295.
11. Murphy E, Ardehali H, Balaban RS, et al. Mitochondrial function, biology, and role in disease. Nat Rev Cardiol. 2023;20(4):223-243.
12. Cohn JN, Ferrari R, Sharpe N. Cardiac remodeling—concepts and clinical implications: a consensus paper. N Engl J Med. 2000;342(2):1441-1451.
13. Zhou L, et al. Naftidrofuryl reduces oxidative stress and inflammation in experimental cardiac dysfunction. Cardiovasc Drugs Ther. 2022;36(5):745-758.
14. Keller T, et al. Effects of Naftidrofuryl on exercise tolerance and peripheral circulation in patients with chronic heart failure: a randomized controlled trial. Int J Cardiol. 2023;382:45-53.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...