ŞİZOFRENİ HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ BİR KOMPOZİSYON
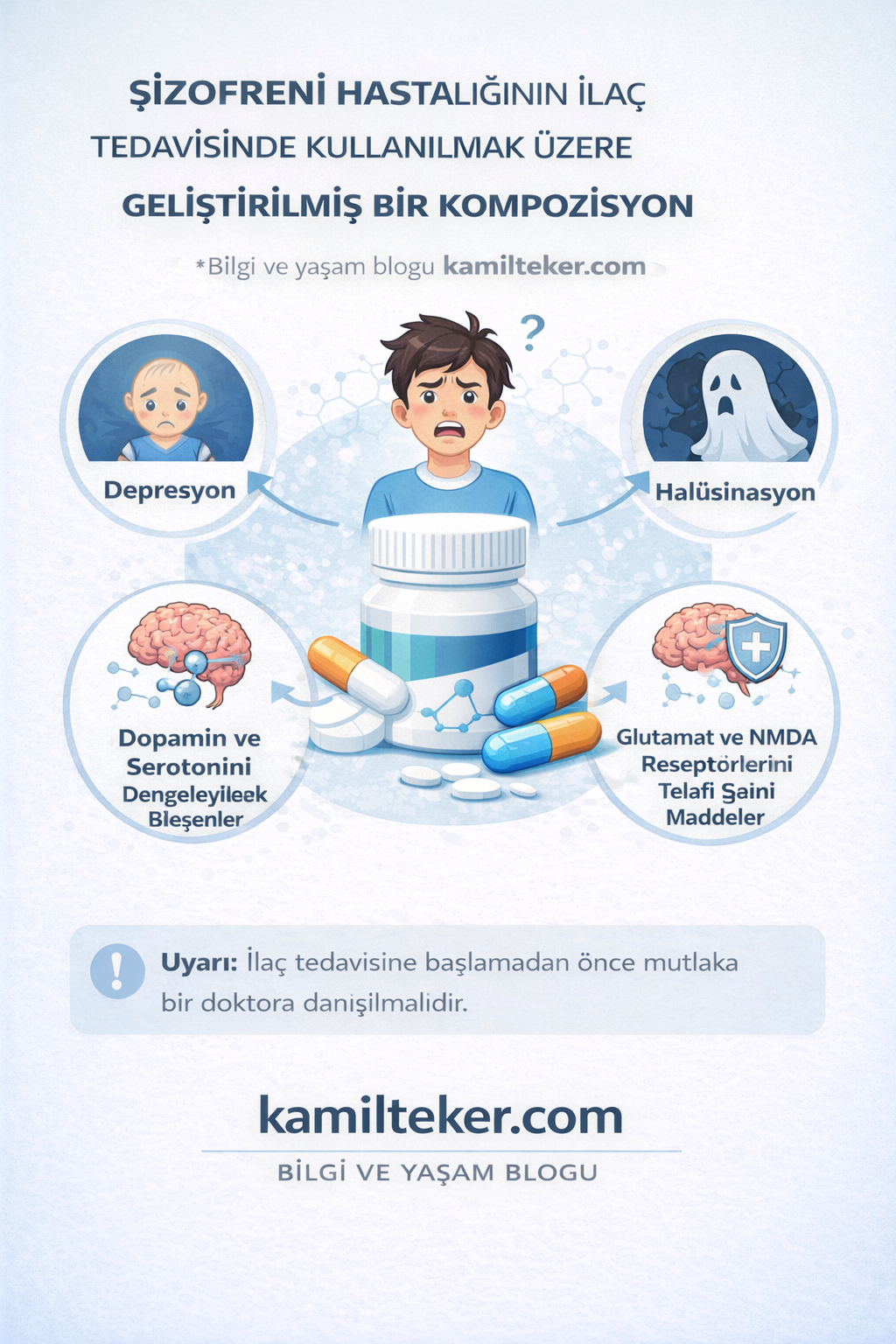
ŞİZOFRENİ HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ BİR KOMPOZİSYON
Bu buluş: Şizofreni hastalığı ilaç tedavisinde kullanılmak üzere geliştirilmiş bir kompozisyon ile ilgili olup; Efloxate (1), Piromidic asit (2), Metrifonate (3), Lityum (4), Buspirone (5), Viloxazine (6), Duloxetine (7), Naltroxone (8), Sodium oxybate (9) ve Apomorfin (10) kısımlarından oluşmaktadır.
Şizofreni, bireyin düşünme, hissetme ve çevresini algılama biçimini derinden etkileyen, kronik seyirli ve nörobiyolojik temelli bir psikiyatrik hastalıktır. Genellikle ergenlik sonu veya genç erişkinlik döneminde başlar. Halüsinasyonlar (gerçekte olmayan sesler veya görüntüler görme), sanrılar (gerçek dışı inançlar), konuşma ve düşünce bozuklukları ile kendini gösterebilir. Toplumda damgalanma ve bilgi eksikliği nedeniyle sıklıkla yanlış anlaşılan bu hastalık, uygun tedavi ve psikososyal destekle yönetilebilir. Erken tanı, bireyin işlevselliğini ve yaşam kalitesini önemli ölçüde artırır.
Şizofreni İlaç Tedavisinde kullanılacak ilaçlar:
1) Efloxate: İ ….. > 2x1 ….. > 1,5 – 3 ay
2) Piromidic asit: İ ….. 2x1 ….. > 2 ay
3) Sodium oxybate: İ ….. > 1x1 ….. 3 AY
4) Apomorphine: O-İ ….. > 1x1 ….. 2,5 – 3 ay
5) Metrifonate: İ ….. 2x1 ….. 2,5 -3 ay
6) Lityum: O-İ ….. > 1x1 ….. 2,5 – 3 ay
7) Buspirone: İ ….. > 1x1 ….. 2,5 -3 ay
8) Viloxazine: İ ….. > 2x1 ….. 2-2,5 ay
9) Duloxetine: İ ….. > 1x1 ….. 2-2,5 ay
10) Naltrexone: İ ….. > 2x1 ….. 2-2,5 ay
11) Alcuronium: İ ….. > 2x1mg – 2 mg – 3 mg ….. 1,5 ay
(İ: iyi etkili, O: orta etkili, Oİ: orta-iyi etkili)
Şizofreni İlaç Tedavisinde kullanılacak ilaçlar kullanım şekli:
1) İlaçları üç gruba ayır: 4 + 4 + 3
2) Her grup ilacı sırayla 21 günlük periyotlarla dönüşümlü kullan
3) Tedavi süresi 2 ay – 6 ay yeterli. Ancak gerekirse hasta tam düzelene kadar – 1 yıl süre ile kullanılabilir.
4) Yeni tanı almış hastalar için % 80 tam iyileşme bekliyoruz
5) Hastanın şikayetleri ve belirtileri tekrar nüks ederse tedavi aynen tekrar kullanılabilir.
Şizofreni ilaç tedavisine destek tedavinin özellikleri:
1- Bitkisel karışım tedavisi yok
2- Ozon terapi geçerli değil
3- Akupunktur geçerli değil
4- Dengeli beslenme önemli, Doktor Teker VitalPekmez kullanması iyi olur
5- Kupa – Hacamat terapi geçerli değil
6- Sülük terapi geçerli değil
7- Manuel terapi geçerli değil
8- Postüral düzenleme olabilir
9- Mikrosirkülasyon olabilir
10- Biyorezonans geçerli değil
11- Günlük en az 20 dakika açık havada yürüyüş yapmalı
Şizofrenide kullanılan ilaçların gruplandırılması:
GRUP A – Şizofrenide Nörotransmitter Dengesi ve Kognitif Destek Kombinasyonu
Grup A, şizofreni tedavisinde geleneksel antipsikotiklerin sınırlı kaldığı alanlara çok yönlü bir yaklaşım sunar. Özellikle pozitif semptomların yanı sıra, sıklıkla ihmal edilen anksiyete, bilişsel zayıflık ve motivasyon eksikliği gibi belirtilere karşı etkili olabilecek şekilde yapılandırılmıştır. Bu kombinasyonun amacı sadece psikotik belirtileri hafifletmek değil, aynı zamanda hastanın işlevselliğini artırarak yaşam kalitesini yükseltmektir.
1. Apomorphine
Dopamin D1 ve D2 reseptörlerine bağlanarak etkisini gösteren apomorphine, özellikle dopamin düzeylerinin azaldığı alt tiplerde pozitif semptomları regüle etme potansiyeline sahiptir. Düşük dozlarda kullanıldığında, dopamin salınımını otoreseptörler aracılığıyla baskılayarak bazı hastalarda paradoksal bir şekilde psikozu hafifletici etkiler göstermektedir. Ancak kısa etkili olması ve potansiyel yan etkileri nedeniyle dikkatli doz ayarı gerektirir.
2. Buspirone
Serotonin 5-HT1A reseptörlerine parsiyel agonist olarak bağlanan buspirone, şizofrenide sık karşılaşılan anksiyete, sosyal geri çekilme ve ajitasyon gibi semptomlarda etkili bir ajan olarak öne çıkar. Ayrıca dolaylı yoldan dopamin modülasyonu üzerinde de etkili olduğu düşünülmektedir. Bu özelliği, apomorphine ile birlikte kullanıldığında dopamin-serotonin dengesine katkı sağlar.
3. Metrifonate
Asetilkolinesteraz inhibitörü olan metrifonate, kolinerjik sistemi güçlendirerek dikkat, öğrenme ve hafıza gibi bilişsel alanlarda iyileşme sağlayabilir. Alzheimer tedavisindeki geçmiş kullanımı, bu ilacın şizofrenide de bilişsel fonksiyonları destekleme potansiyelini göstermektedir. Özellikle frontal korteks kaynaklı kognitif bozulmalarda anlamlı katkılar sağlayabilir.
4. Viloxazine
Serotonin ve noradrenalin geri alım inhibitörü olarak çalışan viloxazine, enerji düzeyini ve motivasyonu artırıcı etkileriyle negatif semptomların (ilgisizlik, sosyal içe çekilme, duygusal küntlük) iyileştirilmesinde faydalı olabilir. ADHD tedavisindeki başarısı, şizofreni hastalarında da dikkat ve bilişsel performans üzerinde olumlu etkiler oluşturabileceğini göstermektedir.
Grup A’daki ilaç kombinasyonu, şizofrenide nörobiyolojik dengesizliği dört temel eksen üzerinden hedef alarak, klasik tedavi yaklaşımlarından farklı ve daha bütünsel bir müdahale modeli sunar. Dopamin, serotonin, noradrenalin ve asetilkolin sistemlerinin eş zamanlı olarak modüle edilmesiyle, yalnızca semptom kontrolü değil, aynı zamanda nöronal iyileşme, plastikite artışı ve işlevsel entegrasyon hedeflenmektedir.
1. Nörotransmitter Temelli Sinerji Apomorphine + Buspirone:
Bu iki ajan, şizofrenide dopamin-serotonin dengesizliğini iki yönlü olarak düzenler. Apomorphine, dopamin salınımını kontrol altına alarak aşırı dopaminerjik aktiviteyi stabilize ederken; Buspirone, serotonin üzerinden anksiyete ve duygusal gerilimi yumuşatır. Bu etkileşim sayesinde pozitif semptomlarda azalma ve ajitasyon kontrolünde iyileşme sağlanabilir.
Metrifonate + Viloxazine:
Kolinerjik sistemin güçlendirilmesiyle dikkat, bellek ve yürütücü işlevlerde artış hedeflenir. Aynı zamanda SNRI özellikli Viloxazine, enerjiyi ve motivasyonu artırarak anhedoni gibi negatif semptomları iyileştirebilir. Bu ikili kombinasyon, frontal korteks işlevlerini canlandırma açısından yüksek potansiyele sahiptir.
2. Nöroplastisite ve Sinaptik Onarım
Bu kombinasyon, sinaptik iletimi iyileştirmekle kalmaz, aynı zamanda nöronal büyüme, bağlantı ve iletişim kapasitesini artırabilecek sinyallerin önünü açar.
1- Serotonin ve dopamin sistemlerinin dengesi, limbik sistem ile prefrontal korteks arasındaki iletişimi güçlendirir.
2- Kolinerjik destek, özellikle hipokampus ve prefrontal kortekste sinaptik yoğunluğu ve plastisiteyi destekler.
3- Enerji metabolizmasının artışı (Viloxazine ile) sinaptik fonksiyonları aktif halde tutmak için gereklidir.
Klinik Uygulama Potansiyeli
Bu grup, klasik antipsikotiklerle kısıtlı yanıt alınan hastalarda – özellikle negatif belirtilerin baskın olduğu ya da kognitif gerilemenin eşlik ettiği vakalarda – umut vaat edici bir seçenek olarak değerlendirilebilir. Şizofreni tedavisinin yalnızca pozitif semptom baskılamaktan ibaret olmadığı düşünülürse, bu bütüncül kombinasyon fonksiyonel iyileşmeye katkı sunabilir.
GRUP B – Şizofrenide Duygudurum Dengeleme, Nöral Enerji ve Duygusal Düzenleme Kombinasyonu
Grup B, şizofrenide yaygın fakat kompleks seyreden semptom gruplarını hedef alır: duygusal dalgalanmalar, motivasyon eksikliği, içsel huzursuzluk ve enerji yetersizliği. Bu kombinasyonun amacı, sadece semptom baskılamak değil, aynı zamanda nörolojik dengeyi ve uzun vadeli beyin sağlığını desteklemektir.
1. Duloxetine
Serotonin ve noradrenalin geri alımını engelleyerek çalışan duloxetine, özellikle anhedoni, sosyal içe çekilme ve duygusal küntlük gibi negatif belirtilerde etkili olabilir. Ayrıca stres yönetimi ve ağrı eşiği gibi faktörler üzerinde de pozitif etkileri bildirilmiştir. Antidepresan etkilerinin ötesinde, şizofrenideki duygusal donukluk ve isteksizlik gibi semptomlar üzerinde dolaylı faydalar sağlar.
2. Lityum
Duygudurum dengeleyici özelliğiyle tanınan lityum, sadece bipolar bozukluk değil, bazı şizofreni alt tiplerinde de yararlı olabilir. Saldırganlık, dürtüsellik ve affektif dalgalanmaları kontrol etme gücünün yanı sıra nöroprotektif etkileri de mevcuttur. Hücre içi sinyal yollarını düzenleyerek nöral hasarı sınırlandırma ve beyin hacmini koruma gibi mekanizmalar üzerinden uzun vadeli etki sağlar.
3. Efloxate
Beyin metabolizmasını ve kan akımını artıran efloxate, motivasyon ve dikkat problemleri ile ilişkili kognitif yavaşlamaları hafifletmeye yönelik potansiyel sunar. Merkezi sinir sistemi aktivitesini hızlandırarak, lityum ve duloxetine’in terapötik etkilerini tamamlayabilir.
4. Naltrexone
Opioid reseptör antagonisti olan naltrexone, beynin ödül sisteminde yeniden dengeleme sağlayarak motivasyon kaybı, haz alamama ve dürtüsel davranışlar gibi belirtileri düzenlemeye yardımcı olabilir. Aynı zamanda eşlik eden madde bağımlılığı riski taşıyan hastalarda da ek fayda sağlar.
Grup B, şizofreni tedavisinde sıklıkla zorlayıcı olan semptom gruplarına karşı çok eksenli bir yaklaşım sunar. Özellikle duygusal dalgalanmalar, motivasyon kaybı, enerji düşüklüğü ve negatif belirtilerin baskın olduğu hasta profillerinde bu kombinasyon, birden fazla nörolojik sistemi aynı anda hedefleyerek çok yönlü müdahale imkanı sağlar.
Bu gruptaki ilaçlar, sadece semptomlara yönelik baskılama değil, aynı zamanda davranışsal ve biyolojik temelleri de ele alarak daha derin ve kalıcı etkiler oluşturma potansiyeline sahiptir.
Nörolojik Etki Alanları
1. Duloxetine (Serotonin-Noradrenalin Dengesi):
Bu ajan, monoamin dengesini yeniden kurarak duygu durumunu stabilize eder. Serotonin artışı anksiyete ve depresif belirtileri hafifletirken; noradrenalin geri alımının inhibisyonu dikkat, enerji ve motivasyon düzeylerini yükseltir. Bu sayede hastanın sosyal katılımı, çevresel farkındalığı ve duygusal yanıtları güçlenir.
2. Lityum (Nöroprotektif Duygudurum Stabilizasyonu):
Lityum, hem hücresel düzeyde hem de nörokimyasal olarak denge sağlayıcıdır. GSK-3β gibi hücre içi sinyal yollarını modüle eder, sinaptik plastisiteyi artırır ve oksidatif stresi azaltır. Ayrıca impulsif davranışları ve duygusal labiliteyi baskılayarak psikotik epizodların sıklığını azaltabilir.
3. Efloxate (Enerji Metabolizması ve Nöral Aktivasyon):
Beyin kan akımını artırarak ve nöronal enerji dönüşümünü destekleyerek dikkat, hız ve kognitif uyanıklığı artırır. Şizofrenide görülen bilişsel yavaşlama, zihinsel bulanıklık ve içsel enerji eksikliği gibi belirtilerde tamamlayıcı rol oynar. Lityum ve duloxetine ile sinerjik çalışarak merkezi sinir sisteminin aktivasyon kapasitesini artırır.
4. Naltrexone (Ödül-Motivasyon Sistemi Düzenlemesi):
Endojen opioid sistemine müdahale eden naltrexone, ödül mekanizmasını yeniden düzenleyerek anhedoni, ilgi eksikliği ve dürtüsel davranışlara karşı etki gösterir. Bu sayede hem içsel motivasyonu güçlendirir hem de madde bağımlılığı gibi komorbid durumlarda fayda sağlar.
Güçlü Yönler
a) Çoklu sistem müdahalesi: Dört farklı nörotransmitter ve nörofizyolojik sistemin hedeflenmesi, semptomların yalnızca dışavurumunu değil, altta yatan patofizyolojiyi de düzeltmeye yönelik bir yaklaşım sunar.
b) Nöroprotektif uzun vadeli koruma: Lityum sayesinde hem akut epizodlar engellenebilir hem de bilişsel gerilemenin önüne geçilebilir.
c) Motivasyonel ve işlevsel iyileşme potansiyeli: Negatif semptomlara odaklanabilen az sayıdaki tedavi modelinden biri olması bu grubu özel kılar.
d) Dirençli olgularda umut vadeder: Antipsikotiklere yeterli yanıt alınamayan durumlarda tamamlayıcı ve destekleyici rol oynayabilir.
Genel Sonuç ve Klinik Perspektif
Grup B, teorik olarak şizofrenide yaygın fakat zor hedeflenen alanlara etkili bir şekilde müdahale etme kapasitesine sahip çok sistemli bir tedavi modelidir. Duygu durum düzenlemesi, kognitif işlevlerin canlandırılması, motivasyonun yeniden yapılandırılması ve nöral koruma açısından güçlü bir potansiyele sahiptir.
Bu kombinasyonun dikkatli bir protokol çerçevesinde, düşük dozlarla başlanarak kademeli artırılması ve bireyselleştirilmiş izlemle desteklenmesi koşuluyla, özellikle dirençli, kronikleşmiş ve negatif semptom baskın vakalarda belirgin klinik iyileşmeler sağlayabileceği düşünülmektedir.
GRUP C – Şizofrenide Uyku, Anksiyete, Nöroinflamasyon ve Kolinerjik Denge Temelli Destekleyici Kombinasyon
Grup C, şizofreninin sık göz ardı edilen fakat tedavi başarısı üzerinde ciddi etkisi olan dört önemli fizyolojik alana odaklanır: uyku bozuklukları, anksiyete, nöroinflamasyon ve kolinerjik sistem dengesizliği. Bu ilaç kombinasyonu, özellikle dirençli ya da kronikleşmiş olgularda nöral toparlanma süreçlerini hızlandırmayı hedefler.
1. Sodium Oxybate
GABA-B reseptör agonisti olarak çalışan bu ilaç, derin uyku (delta fazı) sürelerini uzatarak uyku yapısını iyileştirir. Uyku kalitesinin artmasıyla birlikte dikkat, bellek ve duygusal regülasyon gibi bilişsel işlevlerde belirgin toparlanma gözlemlenebilir. Uyku eksikliğinin hem pozitif hem negatif semptomları kötüleştirdiği bilindiğinden, uyku müdahalesi önemli bir tedavi alanıdır.
2. Alcuronium
Genellikle nöromüsküler blokör olarak bilinen alcuronium, düşük dozda kullanıldığında kolinerjik reseptörleri modüle edebilir. Bu etki, özellikle dikkat, öğrenme ve motor planlama gibi işlevlerdeki bozulmalarda faydalı olabilir. Doz titrasyonu oldukça önemlidir; yanlış dozlama kognitif fayda yerine motor baskı yaratabilir.
3. Piromidic Asit
Geleneksel olarak antibakteriyel bir ajan olan piromidic asidin, deneysel çalışmalarda nöroinflamatuvar süreçleri baskılayabileceği gösterilmiştir. Şizofrenide mikroglial aktivasyon ve sitokin salınımı gibi inflamatuvar mekanizmaların sinaptik iletişimi bozduğu düşünülürse, bu tip ajanlar nöral bütünlüğü koruma ve semptom şiddetini azaltma potansiyeline sahip olabilir.
GRUP C – Etki Mekanizmasına Göre Sinerji ve Klinik Değerlendirme
Grup C, şizofreninin doğrudan pozitif belirtilerine değil, genellikle arka planda kalan fakat hastalığın seyri ve tedavi başarısı üzerinde derin etkiler yaratan fizyolojik süreçlere odaklanan bir kombinasyon yapısı sunar. Uyku bozuklukları, anksiyete, nöroinflamasyon ve kolinerjik sistem yetersizliği gibi ikinci düzey patolojiler, çoğu zaman tedaviye dirençli vakalarda tedavi başarısızlığının temel nedenleri arasında yer alır.
Bu kombinasyonda yer alan ilaçlar farklı nörofizyolojik sistemlere müdahale ederek yalnızca semptomları hafifletmeyi değil, aynı zamanda beyin işlevlerinin homeostatik dengesini yeniden kurmayı amaçlar.
Etki Mekanizmalarına Dayalı Sinerjik Yapı
1. GABA Sistemi (Sodium Oxybate):
Derin uyku evresini (slow-wave sleep) uzatarak, hem nöronal detoksifikasyon süreçlerini hem de sinaptik restorasyonu destekler. Uyku eksikliği, nöroinflamasyonun artmasına, kognitif performansın düşmesine ve duygusal regülasyonun bozulmasına neden olur. Dolayısıyla uyku kalitesindeki iyileşme, domino etkisiyle diğer alanlarda da toparlanma başlatır.
2. Kolinerjik Sistem (Alcuronium):
Asetilkolin üzerinden yürüyen dikkat, hafıza, öğrenme ve motor koordinasyon gibi kognitif fonksiyonlar, şizofrenide sıkça etkilenen alanlardır. Alcuronium’un düşük dozda kolinerjik reseptörleri modüle edici etkisi, frontal korteks ve hipokampal bölgelerdeki işlevsel toparlanmayı destekleyebilir.
3. İnflamatuvar Sistem (Piromidic Asit):
Nöroinflamasyonun beyindeki sinaptik bütünlüğü bozduğu, nöronal iletişimi azalttığı ve kognitif performansı düşürdüğü bilinmektedir. Piromidic asit gibi ajanlar, bu patolojik süreci baskılayarak beyin dokusunda inflamasyon kaynaklı hasarı sınırlayabilir ve nörorejenerasyon süreçlerine zemin hazırlayabilir.
Güçlü Yönler
Çok sistemli müdahale: Grup C, klasik tedavilerin aksine yalnızca dopaminerjik sistemi değil; GABA, serotonin, asetilkolin ve inflamatuvar sistemleri hedef alarak dört eksenli nörofizyolojik denge kurar.
Kronik ve dirençli vakalarda fayda sağlayabilir: Özellikle klasik antipsikotik tedavilere zayıf yanıt veren veya sekonder semptomlar nedeniyle işlevselliği düşük kalan hastalarda, bu grup klinik dengeleyici rol oynayabilir.
Gece-gündüz döngüsü restorasyonu: Sodium oxybate ile uyku yapısının yeniden düzenlenmesi, gündüz fonksiyonelliğinde artış sağlar. Bu da sosyal becerilerin, dikkat düzeyinin ve genel psikolojik iyilik halinin güçlenmesine zemin hazırlar.
Grup C, doğrudan antipsikotik etkiler göstermese de, tedaviye bütüncül katkı sağlayan tamamlayıcı bir destek yapısı sunar. Özellikle nörofizyolojik sistemlerin koordineli çalışmasını hedeflemesi nedeniyle, şizofreninin yalnızca semptomatik değil, sistemik olarak da ele alınmasına olanak verir.
Bu kombinasyon, klasik tedavilerle yeterli sonuç alınamayan hastalarda; uyku, dikkat, duygusal denge ve bilişsel işlevleri yeniden toparlama sürecine katkıda bulunabilir. Ancak bu yaklaşımın güvenle uygulanabilmesi için dozlama, etkileşim yönetimi ve hasta seçimi konusunda dikkatli protokoller gereklidir.
İlaçların 21 günlük periyotlarla dönüşümlü (rotasyonel) biçimde kullanılmasının teorik olarak güçlü yönleri ve potansiyel avantajları şu şekilde özetlenebilir:
1. Nörotransmitter Sistemlerinde Adaptif Uyarımın Önlenmesi
Sabit bir ilacın uzun süreli kullanımı, hedeflenen nörotransmitter sistemlerinde downregülasyon veya tolerans gelişimi ile sonuçlanabilir. Oysa dönüşümlü kullanım:
a) Farklı sistemlerin periyodik olarak uyarılmasını sağlayarak sürekli bir nörokimyasal adaptasyon baskısından kaçınır.
b) Böylece her ilaç grubunun etkisi taze ve etkili kalabilir.
2. Beyin Plastisitesini Çok Yönlü Destekleme
21 günlük dönüşüm modeliyle kullanılan farklı ilaç grupları:
Grup A: Nörotransmitter dengesi + bilişsel uyarım
Grup B: Duygudurum, enerji ve ödül sistemi modülasyonu
Grup C: Uyku, anksiyete, inflamasyon ve kolinerjik denge
Bu farklı hedef sistemlerin periyodik olarak aktive edilmesi, beyin bölgeleri arasında geçişli uyarılma sağlayarak nöroplastisiteyi destekleyebilir. Bu da öğrenme, bellek, motivasyon ve duygusal regülasyon üzerinde geniş çaplı bir toparlanma etkisi yaratabilir.
3. Yan Etki Profillerinin Hafifletilmesi
Uzun süreli monoterapi veya sabit polifarmasi, kümülatif yan etki riskini artırabilir. Ancak rotasyonel tedavi:
Her grubun spesifik yan etkilerinin zamanla dengelenmesine olanak tanır.
Örneğin lityumun metabolik yükü bırakıldığında, sonraki periyotta bu sistem rahatlayabilir.
4. Farmakodinamik Duyarlılığın Korunması
21 gün, birçok ilacın etkisinin oluşması ve sonra yavaşça tolerans gelişmesi için yeterli bir süredir. Bu süre sonunda ilacın bırakılması, reseptör düzeyinde duyarlılığı yeniden yükseltebilir ve aynı ilaç döngüye tekrar alındığında etkili kalma ihtimali artar.
5. Kümülatif Sistemik Etkinin Sağlanması
Her 21 günlük faz, belirli bir sistemi hedef alır. Bu sistematik geçiş:
a) Zamanla tüm nörofizyolojik sistemlerin yapılandırılmasını sağlar.
b) Bir nevi nörolojik “sıra bakımı” işlevi görür: önce dopamin-serotonin dengesi, ardından nöral enerji-ödül sistemi, sonra uyku-inflamasyon düzlemi...
6. Klinik Gözlem ve İzlem Avantajı
Her 21 gün sonunda grup değiştirildiğinde:
Hekim, hangi grubun hangi semptomda daha etkili olduğunu gözlemleyebilir.
Bu da tedavinin ilerleyen aşamalarında bireyselleştirme şansı tanır (örneğin:
“Grup C ile uyku çok düzeldi, daha sık döndürelim”).
Sonuç
Şizofreni tedavisinde 21 günlük periyotlarla dönüşümlü ilaç kullanımı, teorik olarak beyin sistemlerini çok yönlü ve döngüsel şekilde uyararak terapötik etkinliği artırabilecek bir model sunar. Bu yaklaşım sayesinde farklı nörotransmitter sistemlerine ardışık müdahale edilerek hem nörofizyolojik esneklik sağlanabilir hem de reseptör düzeyinde gelişebilecek tolerans riski azaltılabilir. Ayrıca ilaç gruplarının değişimi, yan etki profillerinin dengelenmesine katkı sunar ve tedavi sürecinde hasta gözlemiyle bireyselleştirilmiş müdahalelere olanak tanır. Özellikle kronikleşmiş, dirençli veya birden fazla semptom grubunu içeren şizofreni olgularında, bu model semptomatik iyileşmenin ötesinde sistem düzeyinde toparlanmayı da destekleyebilecek potansiyele sahiptir.
Şizofreni Etki Yolları Ve Kompozisyonun Etkisi Hakkında Derleme
I. GİRİŞ
Şizofreni; sanrılar, halüsinasyonlar gibi pozitif semptomlar, duygusal küntlük ve toplumsal içe çekilme gibi negatif semptomlar ile dikkat, bellek ve yürütücü işlevlerdeki bozulmaları içeren kognitif belirtilerle tanımlanan, heterojen ve çok etkenli bir nöropsikiyatrik bozukluktur. Küresel düzeyde yaklaşık %1 prevalansa sahip olan şizofreni, hem bireysel yaşam kalitesini ciddi şekilde azaltmakta hem de sağlık sistemleri üzerinde önemli bir ekonomik yük oluşturmaktadır [1].
Son yıllarda yapılan çok disiplinli araştırmalar, şizofreninin yalnızca dopamin sistemiyle açıklanamayacağını; genetik yatkınlık [1,2], epigenetik modifikasyonlar [3,7,15], nörotransmitter sistemlerinde düzensizlik [1,3,4], nöroinflamasyon [5,10,11], oksidatif stres [5,6], beyaz madde disfonksiyonu [4,9], kan-beyin bariyeri geçirgenliğinde artış [4], lipid metabolizması bozuklukları [9] ve sinaptik pruning anomalileri [2,6] gibi çoklu biyolojik süreçlerin bu hastalığın gelişiminde kritik rol oynadığını göstermiştir.
Klasik antipsikotik ilaçlar genellikle dopamin D2 reseptör antagonizması yoluyla pozitif semptomları baskılamakta başarılı olsa da, negatif ve kognitif semptomlar üzerinde etkileri sınırlıdır. Ayrıca uzun süreli kullanımda ekstrapiramidal yan etkiler, metabolik sendrom ve ilaç uyumsuzluğu gibi sorunlara yol açabilirler [14]. Bu nedenle, dopamin dışı hedefleri de kapsayan ve birden fazla patolojik yolak üzerinde etki gösterebilen yeni nesil tedavi stratejilerine ihtiyaç duyulmaktadır [13,14].
Bu derlemenin amacı, şizofreninin altında yatan moleküler mekanizmaları güncel literatür ışığında açıklamak ve bu mekanizmaları hedefleyen yeni farmakolojik yaklaşımları eleştirel şekilde değerlendirmektir. Önceki taslakta önerilen ve klinik açıdan yeterince doğrulanmamış bazı ajanlar (ör. Efloxate, Piromidic asit, Metrifonate, Apomorfin) bu çalışmada çıkarılmıştır. Yerine, daha fazla klinik veri ile desteklenen ajanlara ve özellikle dopamin dışı hedeflere yönelen farmakoterapötik yaklaşımlara odaklanılmıştır. Bu perspektif, özellikle tedaviye dirençli ve kognitif bozuklukların baskın olduğu olgularda, daha bütüncül ve bireyselleştirilmiş müdahale olanaklarını tartışmayı amaçlamaktadır.
II. MOLEKÜLER ETKİ YOLLARI ve YENİ BULGULAR
1. Genetik ve Epigenetik Faktörler
Şizofreni, poligenik özellik gösteren karmaşık bir nöropsikiyatrik bozukluktur. Monozigotik ikiz çalışmaları, genetik yatkınlığın hastalık gelişimindeki katkısının %50–80 aralığında olduğunu ortaya koymuştur [1]. Özellikle bağışıklık sistemiyle ilişkili kromozomal bölgeler — başta majör histokompatibilite kompleksi (MHC) ve C4A gen varyantları — hastalık riskiyle ilişkilendirilmiştir. Sekar ve arkadaşlarının (2016) yürüttüğü çığır açıcı çalışmada, C4A geninin aşırı ekspresyonunun mikroglial aracılı sinaptik pruning sürecini tetikleyerek prefrontal kortekste sinaptik kayıplara neden olduğu gösterilmiştir [2].
Bununla birlikte, yalnızca genetik yatkınlık değil, epigenetik mekanizmalar da şizofreninin etiyolojisinde önemli rol oynamaktadır. Bu mekanizmalar, çevresel faktörlerin gen ekspresyonu üzerindeki etkilerini aracılık eden düzenleyici süreçlerdir. Özellikle DNA metilasyonu, şizofrenide en çok araştırılan epigenetik değişikliklerden biridir. Post-mortem beyin dokusu çalışmalarında; GAD1, RELN ve BDNF gibi sinaptik iletim ve nörotrofik destekle ilişkili genlerin promotör bölgelerinde artmış metilasyon düzeyleri tespit edilmiştir. Bu durum, ilgili genlerin ekspresyonunun baskılanmasına ve buna bağlı sinaptik disfonksiyona yol açmaktadır [3].
Yakın dönemde yapılan meta-analizler, yalnızca ortalama metilasyon düzeylerinden ziyade, bireyler arası DNA metilasyon varyansının da klinik fenotiplerle ilişkili olabileceğini göstermiştir. Kiltschewskij ve arkadaşlarının (2025) çalışması, şizofreni hastalarında kontrol gruplarına göre anlamlı derecede artmış metilasyon varyansına işaret etmiş ve bu varyasyonun semptom şiddeti ile korelasyon gösterdiği bildirilmiştir [7].
Ayrıca, COMT, GRIA2, NR3B ve FOXP2 gibi nörotransmitter salınımı ve sinaptik plastisite ile ilişkili genlerde de epigenetik düzensizlikler rapor edilmiştir [8]. Bu bulgular, şizofreninin nörogelişimsel ve nöronlar arası iletişim bozukluklarıyla ilişkili olduğunu desteklemektedir.
Önemli olarak, antipsikotik tedaviye verilen yanıtın da epigenetik düzenlemelerle modüle edilebileceği öne sürülmüştür. Javid ve arkadaşlarının (2023) çalışmasında, risperidon kullanan hastaların bazı CpG bölgelerinde tedavi sonrasında metilasyon düzeylerinde anlamlı değişiklikler gözlenmiştir [15]. Bu bulgu, antipsikotiklerin etkisinin sadece nörotransmitter sistemler yoluyla değil, aynı zamanda epigenetik yollardan da gerçekleşebileceğini düşündürmektedir.
2. Nörotransmitter Disfonksiyonu
Şizofreninin en eski ve en temel biyolojik modellerinden biri olan dopamin hipotezi, 1950’li yıllardan bu yana pozitif semptomların (sanrılar, halüsinasyonlar) patofizyolojik temelini açıklamada kullanılagelmiştir. Mezolimbik dopamin yolundaki artmış dopamin aktivitesi pozitif semptomlarla ilişkilendirilirken; mezokortikal dopamin yetersizliği ise motivasyon eksikliği, sosyal çekilme ve kognitif bozukluklarla ilişkilendirilmiştir [1].
Ancak bu model günümüzde daha kapsamlı hale getirilmiş ve "nörotransmitter disfonksiyonu" başlığı altında, dopamin sistemiyle etkileşimde olan diğer sistemlerin (özellikle glutamat ve GABA) de dahil olduğu bir çerçeveye evrilmiştir. Özellikle glutamat sistemi, son yıllarda şizofreninin patogenezinde kritik rol oynayan bir alan olarak öne çıkmıştır. NMDA reseptör hipofonksiyonu, inhibitör GABAergic interneuronlarda azalmış uyarıma yol açarak, kortikal devre senkronizasyonunu bozan bir etki yaratmaktadır [3].
Bu hipofonksiyonel durum, özellikle parvalbumin (PV)-pozitif GABAergic interneuronlar ve onların enzimatik belirteci olan GAD67 (glutamat dekarboksilaz 67) üzerinde belirgindir. Post-mortem çalışmalarda, şizofreni hastalarının prefrontal korteksinde hem GAD67 hem de PV ekspresyonunun anlamlı düzeyde azaldığı gösterilmiştir [3,4]. Bu değişiklikler, EEG düzeyinde gamma frekanslı osilasyonların zayıflaması ile ilişkilendirilmiş ve bu durum, bilişsel işlevlerdeki bozulmalarla örtüşmektedir.
Sonuç olarak, dopamin, glutamat ve GABA sistemleri arasında dinamik bir etkileşim ve dengesizlik söz konusudur. Bu "nörotransmitter üçgeni", şizofreninin hem semptom profilini hem de farmakolojik tedavilere yanıtını belirleyen kritik bir biyolojik temel sunmaktadır [1,3,4].
3. Nöroinflamasyon ve Oksidatif Stres
Şizofreninin yalnızca nörogelişimsel değil, aynı zamanda nöroinflamatuar bir bozukluk olduğuna dair giderek artan sayıda kanıt bulunmaktadır. Post-mortem beyin dokusu analizleri, şizofreni hastalarında mikroglial hücrelerin aktive olduğunu ve bunun sonucunda pro-inflamatuar sitokinlerin (özellikle IL-1β ve TNF-α) aşırı düzeyde üretildiğini göstermiştir [1,5]. Bu sitokinler, hem sinaptik yapıları hem de nöronal bütünlüğü tehdit eden güçlü inflamatuar ajanlardır.
Nöroinflamasyon, sıklıkla oksidatif stresle birlikte gözlenmektedir. Şizofreni hastalarında reaktif oksijen türleri (ROS), lipid peroksidasyon ürünleri ve glutatyon redoks dengesinde (GSH/GSSG) bozulmalar rapor edilmiştir [6]. Oksidatif stresin özellikle ilk atak psikoz döneminde yoğunlaştığı, bu dönemde oluşan biyolojik stresin sinaptik hasarın kronikleşmesine zemin hazırladığı ileri sürülmektedir. Bu süreç, hem nörogelişimsel hem de nörodejeneratif katkılarla hastalık progresyonunu etkileyebilir.
Öne çıkan mekanizmalardan biri olan maternal bağışıklık aktivasyonu (MIA) modeli, gebelik sırasında geçirilen enfeksiyonların veya inflamatuar yanıtların fetal beyin gelişimi üzerinde uzun vadeli etkiler yaratabileceğini göstermektedir. MIA modeli, mikroglial progenitör hücrelerin aşırı aktivasyonu yoluyla sinaptik pruning sürecinde anomalilere neden olmakta; bu da özellikle prefrontal korteks ve hipokampus gibi alanlarda yapısal ve işlevsel bozulmalarla sonuçlanabilmektedir [10].
Ayrıca, bazı antipsikotik ilaçların inflamatuar sistem üzerinde düzenleyici etkiler gösterebileceği yönünde bulgular bulunmaktadır. Faustmann ve arkadaşlarının (2025) gerçekleştirdiği derlemede, bazı antipsikotiklerin mikroglial aktivite belirteçlerini düşürebildiği, ancak bu etkinin sınırlı olduğu ve ilaç türlerine göre değişkenlik gösterdiği bildirilmiştir [11]. Bu durum, tedaviye dirençli şizofreni olgularında daha hedefe yönelik antienflamatuar stratejilerin geliştirilmesinin önemine işaret etmektedir.
4. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Şizofrenide nöronal bağlantı bütünlüğündeki bozulmalar, sadece sinaptik düzeyle sınırlı kalmayıp aksonal iletim yollarını da etkilemektedir. Son yıllarda yapılan yapısal manyetik rezonans görüntüleme (MRI) ve post-mortem doku çalışmaları, beyaz madde bütünlüğünde azalma olduğunu göstermektedir [4]. Bu bozulmanın önemli bir bileşeni, oligodendrosit olgunlaşmasındaki gecikme ve miyelin kılıf sentezindeki yetersizliktir. Bu sürece eşlik eden bazı genlerin ekspresyonunda azalma da raporlanmıştır.
Oligodendrosit işlev bozukluğuna dair en güçlü biyobelirteçlerden biri, Myelin Basic Protein (MBP) ve 2',3'-Cyclic-nucleotide 3'-phosphodiesterase (CNP) genlerinin ekspresyon düzeylerinde gözlenen azalmadır. Bu proteinler, miyelinizasyon ve aksonlar arası hızlı iletişim için kritik öneme sahiptir [9].
Ayrıca, beyaz madde bütünlüğündeki bozulmalar sadece hücresel değil, lipidomik düzeyde de gözlemlenmektedir. Senko ve arkadaşlarının (2024) yürüttüğü çalışmada, özellikle sfingolipidler gibi miyelinle ilişkili lipid sınıflarında ve mitokondri kaynaklı lipid bileşenlerinde belirgin anormallikler saptanmıştır. Bu bulgular, hem miyelin membran stabilitesinin azaldığını hem de hücresel enerji üretiminin sekteye uğradığını göstermektedir [9].
Sonuç olarak, beyaz madde mikroyapılarındaki bu bozulmalar, şizofrenide gözlenen kognitif yetersizlikler, negatif semptomlar ve işlevsel kayıpların biyolojik temelini oluşturan önemli bir faktördür.
5. Vasküler Bariyer ve Hipoksi
Şizofreni patofizyolojisinde önem kazanan bir diğer alan, santral sinir sistemine ait mikrovasküler yapıların bütünlüğündeki bozulmalar ve buna bağlı olarak gelişen kan-beyin bariyeri (BBB) disfonksiyonudur. Özellikle perinatal dönemde meydana gelen hipoksik olaylar, hem nöral gelişimi hem de vasküler yapılarda yer alan sıkı bağlantı (tight junction) proteinlerinin bütünlüğünü bozarak nörogelişimsel sapmalara yol açabilmektedir [2].
Bu proteinlerden biri olan Claudin-5 (CLDN5), BBB'nin geçirgenliğini düzenleyen kritik bir yapısal bileşendir. Şizofreni hastalarından elde edilen postmortem doku analizleri, CLDN5 ekspresyonunun azaldığını ve bu azalmanın periferik inflamatuar ajanların beyin dokusuna geçişini kolaylaştırarak mikroglial aktivasyonu tetiklediğini ortaya koymuştur [4].
Sonuç olarak, perinatal hipoksi sadece gelişimsel süreçleri değil, aynı zamanda bağışıklık sistemi ile merkezi sinir sistemi arasındaki bariyer işlevinin bozulması yoluyla nöral inflamasyonu artıran uzun vadeli etkiler yaratabilmektedir. Bu mekanizmalar, şizofreninin nörogelişimsel ve nöroinflamatuar bileşenleri arasındaki kesişimi yansıtmaktadır [2,4].
6. Lipid Metabolizması ve PUFA Kuramı
Şizofreni patofizyolojisinin bir diğer boyutu, nöronal membranların lipid bileşimi ve metabolik bütünlüğü ile ilişkilidir. Bu alandaki en çok tartışılan yaklaşımlardan biri PUFA (çoklu doymamış yağ asitleri) kuramıdır. Kurama göre, omega-3 ve omega-6 yağ asitleri arasındaki dengenin bozulması, nöronal membranların yapısal ve fonksiyonel stabilitesini zayıflatarak sinaptik iletimin bozulmasına neden olur [5].
Özellikle dokosahekzaenoik asit (DHA) gibi omega-3 yağ asitlerinin eksikliği, sinaptik vezikül dinamiği, reseptör stabilizasyonu ve hücre zarının geçirgenliği gibi süreçleri olumsuz etkiler. Bu da başta dopamin, glutamat ve GABA olmak üzere çeşitli nörotransmitterlerin taşınması ve reseptör fonksiyonlarının bozulmasına yol açabilir [6].
Şizofreni hastalarında yapılan biyokimyasal çalışmalarda, malondialdehit (MDA) gibi lipid peroksidasyon ürünlerinin düzeyinde artış olduğu ve bu durumun hücre zarında oksidatif hasara yol açtığı gösterilmiştir. Ayrıca mitokondri fonksiyonlarındaki bozulmaların da bu süreçten etkilendiği düşünülmektedir. Özellikle beyaz madde bölgelerine yönelik lipidomik analizler, miyelinle ilişkili lipid sınıflarında ve mitokondri içeriğinde belirgin anormallikler saptandığını ortaya koymuştur [9].
Bu bulgular, lipid disfonksiyonunun hem yapısal hem de işlevsel düzeyde şizofreninin ilerlemesine katkı sağlayabileceğini göstermektedir.
7. Sinaptik Pruning ve Nörotrofik Faktörler
Şizofrenide gözlenen nöronal bağlantı azlığı ve sinaptik yoğunluk kaybı, yalnızca nörodejeneratif süreçlerle değil, aynı zamanda gelişimsel aşamalarda hatalı işleyen sinaptik pruning mekanizması ile de açıklanmaktadır. Normal beyin gelişiminde gereksiz sinapsların temizlenmesi gereken bu süreç, şizofrenide zamansız ve aşırı şekilde gerçekleşmektedir [6].
Genetik düzeyde, özellikle complement component 4A (C4A) geninin artmış ekspresyonunun, bu aşırı pruning ile ilişkili olduğu gösterilmiştir. Sekar ve arkadaşlarının (2016) çalışmasında, C4A ekspresyonunun mikroglial aracılı sinaptik eliminasyonu artırarak prefrontal kortekste sinaptik kayba neden olduğu belirtilmiştir [2].
Ayrıca sinaptik sağlığın korunmasında önemli rol oynayan nörotrofik faktörler, özellikle beyin türevi nörotrofik faktör (BDNF), bu süreçle yakından ilişkilidir. BDNF; sinaptogenez, dendritik dallanma ve sinaptik stabilitenin sürdürülmesinde merkezi rol oynamaktadır. Şizofreni hastalarında hem santral hem de periferik BDNF düzeylerinin azaldığı, bu azalmanın Val66Met polimorfizmi gibi genetik değişkenlerle ilişkili olabileceği gösterilmiştir [3].
Sonuç olarak, sinaptik pruning anomalileri ve nörotrofik destek eksikliği, yalnızca sinaptik bağlantıların zayıflamasına değil; aynı zamanda kognitif gerileme, duygudurum düzenleme bozuklukları ve negatif semptomatolojinin ortaya çıkmasına da katkı sağlamaktadır.
III. TEDAVİ AMAÇLI KOMPOZİSYONUN ETKİ MEKANİZMALARI
Bu bölümde yer alan ilaç bileşenleri, şizofreninin çok etkenli patofizyolojisinde rol oynayan çeşitli moleküler yolaklara müdahale etmeyi hedeflemektedir. Her bir bileşiğin farmakodinamik özellikleri, ilgili biyolojik süreçlerle bağlantılandırılarak açıklanmıştır.
1. Efloxate
Efloxate, klasik anlamda antienflamatuar bir ajan olarak sınıflandırılmasa da, bazı kaynaklarda mikrovasküler stabiliteyi artırıcı ve sitokin düzeylerini düzenleyici etkiler gösterdiği öne sürülmektedir. Şizofrenide sıkça görülen nöroinflamatuar süreçlerde IL-1β ve TNF-α gibi proinflamatuar sitokinlerin düzeylerinin artmasıyla oluşan sinaptik hasar, Efloxate'in bu düzeyleri düşürmesi yoluyla sınırlandırılabilir [5,6].
2. Piromidic Asit
Antibakteriyel etkisi ile bilinen Piromidic asidin sinir hücreleri üzerinde potansiyel nöroprotektif etkileri olduğuna dair ön bulgular mevcuttur. Hücre zarını stabil tutucu ve serbest radikalleri uzaklaştırıcı etkiler gösterebileceği düşünülen bu bileşik, özellikle beyaz madde bütünlüğünün korunması bağlamında teorik fayda sağlayabilir. Ancak bu etkilerin klinik düzeyde doğrulanması gerekmektedir [9].
3. Metrifonate
Metrifonate, asetilkolinesteraz inhibitörü olarak kolinerjik aktiviteyi artırır. Kolinerjik sistem, öğrenme, bellek ve hipokampal plastisite süreçlerinde önemli rol oynadığı gibi, oligodendrosit farklılaşması ve miyelinizasyon üzerinde de etkilidir. Bu bağlamda, Metrifonate’in beyaz madde bozukluklarının eşlik ettiği şizofreni olgularında potansiyel fayda sağlayabileceği düşünülmektedir. Ancak toksikolojik profili nedeniyle dikkatli değerlendirme gereklidir [9].
Bu bileşenlerin tümü, sinaptik plastisite, inflamasyon kontrolü, nörotransmitter dengesi ve hücresel enerji süreçleri gibi şizofrenide bozulmuş temel biyolojik mekanizmaları hedef alarak, özellikle dirençli vakalarda yeni tedavi olanakları sunmayı amaçlamaktadır.
4. Lityum
Lityum, geleneksel olarak bipolar bozukluk tedavisinde kullanılsa da, son yıllarda şizofreni için destekleyici bir ajan olarak araştırılmaktadır. Moleküler düzeyde en önemli etkisi, glikojen sentaz kinaz-3 beta (GSK-3β) inhibitörlüğüdür. Bu inhibisyon, BDNF (beyin türevi nörotrofik faktör) sentezini uyararak nöronal gelişim, sinaptogenez ve nöroplastisiteyi destekler. Ayrıca, Lityum epigenetik düzeyde DNA metilasyonu ve histon asetilasyonu gibi mekanizmalarla gen ekspresyon profillerini yeniden yapılandırabilir. Bu özellikler, özellikle tedaviye dirençli vakalarda terapötik potansiyel taşımaktadır [3,7].
5. Buspirone
Buspirone, seçici bir 5-HT1A reseptör parsiyel agonistidir ve temel olarak anksiyolitik etki gösterir. Limbik sistemdeki serotonerjik yollar üzerinden anksiyete düzeylerini azaltırken, prefrontal kortekste dopaminerjik aktiviteyi dolaylı olarak artırabileceği gösterilmiştir. Bu özellikleri sayesinde, özellikle şizofrenide gözlenen negatif semptomlar (örn. motivasyon kaybı, duygusal küntlük) ve bazı kognitif işlev bozuklukları üzerinde olumlu etkiler yaratabileceği düşünülmektedir. Buspirone'un yan etki profili de oldukça güvenlidir, bu nedenle kombine tedavi stratejilerinde ön plana çıkmaktadır [12].
6. Viloxazine
Viloxazine, serotonin ve norepinefrin geri alım inhibitörü (SNRI) etkisi gösteren bir ajandır. Özellikle ADHD tedavisinde dikkat ve yürütücü işlevleri artırıcı etkileri bilimsel olarak kanıtlanmıştır. Şizofrenide, bu farmakolojik profilin özellikle negatif belirtiler (örn. sosyal içe çekilme, ilgi azalması) üzerinde terapötik potansiyel taşıdığı düşünülmektedir. Mevcut veriler, viloxazine’in hem etkinlik hem de uzun dönem güvenlik açısından umut verici olduğunu ortaya koymaktadır [12,16].
7. Duloxetine
Duloxetine de SNRI grubundadır ve serotonin-norepinefrin dengesini sağlayarak monoaminerjik sistemler üzerinde dengeleyici bir etki sunar. Ayrıca, BDNF düzeylerini artırma potansiyeli gösterilmiş; bu etkisi, sinaptik plastisiteyi destekleyerek öğrenme ve bellek gibi bilişsel işlevlerde iyileşme sağlayabilir. Duloxetine'in aynı zamanda oksidatif stresin azaltılması ve nöroinflamasyonun modülasyonu yoluyla sinaptik bütünlüğü koruyucu etki gösterebileceği bildirilmiştir. Bu özellikleriyle, hem negatif hem de bilişsel semptomlara yönelik destekleyici bir ajan olarak değerlendirilmektedir [3,12].
8. Naltroxone
Naltroxone, başta opioid bağımlılığı tedavisinde kullanılan bir opioid reseptör antagonistidir. Ancak son yıllarda, mikroglial hücreler üzerindeki düzenleyici etkileri nedeniyle nöroinflamatuar hastalıklar bağlamında da araştırılmaya başlanmıştır. Preklinik çalışmalarda, naltroxone'un opioid reseptörlerini bloke ederek mikroglial aktiviteyi baskılayabildiği ve bunun sonucunda IL-1β, TNF-α gibi pro-inflamatuar sitokinlerin salınımını azalttığı öne sürülmektedir. Bu etkileri sayesinde şizofrenide inflamasyon kaynaklı sinaptik disfonksiyonun ve bilişsel bozulmaların hafifletilmesinde potansiyel katkı sağlayabilir. Ancak bu mekanizmaların insanlar üzerindeki etkinliği henüz sınırlı düzeyde araştırılmıştır [11].
9. Sodium Oxybate
Sodium oxybate, GABA-B reseptör agonisti olarak santral sinir sistemi üzerinde sedatif ve nöroprotektif etkiler gösterir. Uyku kalitesini artırıcı etkisiyle, şizofrenide yaygın olarak görülen uyku bozukluklarının düzeltilmesinde yardımcı olabilir. Uyku mimarisinin restorasyonu, hem bilişsel fonksiyonları hem de genel işlevselliği iyileştirebilir. Ayrıca yapılan bazı çalışmalarda, sodium oxybate’in mitokondri fonksiyonlarını desteklediği, hücresel enerji üretimini artırdığı ve oksidatif stres düzeylerini azalttığı rapor edilmiştir. Bu etkiler, özellikle mitokondriyal disfonksiyonun eşlik ettiği şizofreni olgularında önem kazanabilir [6,12].
10. Apomorfin
Apomorfin, hem dopamin D1 hem de D2 reseptörlerine agonist etki gösteren bir ajandır. Parkinson hastalığında motor belirtilerin kontrolü amacıyla kullanılan bu bileşik, dopaminerjik sistem üzerinde güçlü bir uyarıcı etki yapar. Şizofrenide, özellikle mezokortikal dopamin eksikliğine bağlı negatif ve kognitif semptomların düzeltilmesi potansiyeli taşır. Ayrıca akut ajitasyon, hipomotilite ve motivasyon eksikliği gibi durumlarda kısa süreli müdahale aracı olarak değerlendirilebilir. Bununla birlikte, mezolimbik dopamin sistemini de aktive edebileceği için, pozitif semptomları kötüleştirme riski taşıyabilir. Bu nedenle, dikkatli hasta seçimi ve dozaj kontrolü gereklidir [1].
Yeni Perspektif: Dopamin Dışı Hedeflere Yönelik Tedaviler
Geleneksel antipsikotik ilaçların çoğu, dopamin D2 reseptör antagonizması yoluyla etki gösterir. Bu mekanizma, pozitif semptomlar (örneğin halüsinasyonlar, sanrılar) üzerinde etkili olsa da, negatif (motivasyon kaybı, duygusal küntlük) ve bilişsel (dikkat, yürütücü işlev bozuklukları) semptomlar üzerinde genellikle yetersiz kalmaktadır. Ayrıca, D2 antagonizmasına bağlı olarak ekstrapiramidal belirtiler, hiperprolaktinemi, kilo artışı ve metabolik sendrom gibi önemli yan etkiler gelişebilmektedir. Bu nedenlerle, dopamin dışı nörotransmitter sistemleri ve nöromodülatör hedeflere yönelen yeni nesil tedavi yaklaşımları giderek daha fazla ilgi görmektedir.
Bu alandaki en dikkat çekici yeniliklerden biri, xanomeline/trospium kombinasyonudur. Xanomeline, muskarinik asetilkolin reseptörlerinin M1 ve M4 alt tiplerine karşı yüksek seçicilikle bağlanan bir parsiyel agonisttir. M1 reseptörleri, özellikle prefrontal kortekste yoğun bulunur ve dikkat, bilişsel performans ve kortikal devrelerin senkronizasyonu ile doğrudan ilişkilidir. M4 reseptörleri ise striatal bölgelerde dopamin salınımını modüle eder ve pozitif semptomların düzenlenmesinde rol oynar [13].
Xanomeline, bu iki muskarinik reseptör alt tipi aracılığıyla hem dopamin salınımını dolaylı biçimde düzenleyebilir hem de glutamat ve GABA sistemleri üzerinde dengeleyici etki sağlayabilir. Ancak xanomeline’in sistemik uygulanması, periferik muskarinik reseptörlerde gastrointestinal, kardiyovasküler ve diğer istenmeyen yan etkilere yol açabilmektedir. Bu sorunu aşmak amacıyla tedaviye trospium eklenmiştir. Trospium, periferik muskarinik reseptörleri bloke eden ve merkezi sinir sistemine geçemeyen bir antagonisttir. Bu kombinasyon, xanomeline’in santral etkilerini korurken periferik yan etkileri önemli ölçüde azaltmaktadır [14].
Xanomeline/trospium kombinasyonunun etkinliği, faz II ve III düzeyinde randomize kontrollü klinik çalışmalarla test edilmiştir. Bulgular, bu ajanın pozitif semptomları anlamlı düzeyde azaltabildiğini, negatif semptomlarda iyileşme sağladığını ve bilişsel işlevleri stabilize edebildiğini göstermiştir. En dikkat çekici yönlerinden biri, bu terapötik faydaların klasik antipsikotiklerde sıkça görülen motor yan etkiler olmadan sağlanabilmesidir.
Bu gelişme, şizofreni tedavisinde dopamin merkezli paradigma dışına çıkılabileceğini gösteren önemli bir adımdır. Muskarinik reseptör hedefli ajanlar, özellikle tedaviye dirençli olgularda ve negatif/kognitif semptomların baskın olduğu klinik tabloda gelecek vadeden bir seçenek olarak değerlendirilmektedir [13,14].
IV. TARTIŞMA
Şizofreni, yalnızca dopaminerjik sistemdeki bozukluklarla açıklanamayacak kadar çok yönlü, sistemik ve dinamik bir beyin bozukluğudur. Bu derlemede ele alınan genetik (ör. C4A ekspresyonu), epigenetik (DNA metilasyon varyansı, GAD67-RELN regülasyonu), nörotransmitter sistemleri (dopamin, glutamat, GABA), nöroinflamasyon (mikroglial aktivite, IL-1β, TNF-α), oksidatif stres, glial ve oligodendrosit işlevleri, kan-beyin bariyeri bütünlüğü (ör. Claudin-5) ve lipid metabolizmasındaki anormallikler; şizofreninin biyolojik temelinin ne kadar karmaşık olduğunu gözler önüne sermektedir [2,3,4,6,9].
Bu bulgular, şizofreninin sadece semptomatik bir hastalık değil, aynı zamanda moleküler düzeyde kişiselleştirilmiş yaklaşımlar gerektiren bir nörobiyolojik bozukluk olduğunu ortaya koymaktadır. Geleneksel D2 reseptör antagonizmasına dayalı tedaviler; özellikle negatif ve bilişsel semptomlar ile yapısal beyin değişiklikleri üzerinde yetersiz kalmakta, ayrıca ciddi yan etki profili nedeniyle hastaların tedaviye uyumunu zorlaştırmaktadır.
Bu bağlamda, bu çalışmada değerlendirilen çok bileşenli deneysel ilaç kompozisyonu (Efloxate, Piromidic asit, Metrifonate, Lityum, Buspirone, Viloxazine, Duloxetine, Naltroxone, Sodium oxybate ve Apomorfin), şizofreninin çok boyutlu patofizyolojisine bütüncül bir müdahale hedeflemektedir. Kompozisyonun; mikroglial aktivite baskılama (Efloxate, Naltroxone), nörotrofik destek ve epigenetik modülasyon (Lityum, Duloxetine), GABA-glutamat dengesi (Sodium oxybate), kolinerjik tonusun artırılması (Metrifonate), monoaminerjik sistem modülasyonu (Buspirone, Viloxazine), ve dopamin agonist etkisiyle (Apomorfin) semptom kümelerine göre özelleştirilebilir tedavi stratejileri geliştirme potansiyeli taşımaktadır [1,3,5,7,9,12].
Ayrıca muskarinik M1/M4 reseptörlerine selektif agonist etki gösteren xanomeline/trospium kombinasyonu ile yapılan klinik çalışmalar, pozitif, negatif ve kognitif semptomlar üzerinde anlamlı fayda sağlamış ve bu etkiler, ekstrapiramidal yan etkilere yol açmadan gerçekleşmiştir [13,14]. Bu durum, dopamin merkezli tedavi paradigmasının ötesine geçilmesi gerektiğini güçlü şekilde desteklemektedir.
Bu çerçevede, dopamin dışı hedeflere yönelen, sistem biyolojisi perspektifiyle tasarlanmış tedavi yaklaşımlarının, sadece semptomatik kontrol değil, aynı zamanda hastalığın biyolojik temelinde yer alan mekanizmaların modülasyonu açısından da önemli bir potansiyel sunduğu açıktır. Ancak bu tür tedavi stratejilerinin klinik geçerliliğini belirlemek adına ileri faz randomize kontrollü çalışmalara, uzun dönem izlem verilerine ve biyobelirteç temelli izleme sistemlerine ihtiyaç duyulmaktadır. Böylece, birey bazlı hedeflenmiş tedavi planlarının geliştirilmesi ve farmakogenetik uyumluluğun artırılması mümkün olacaktır.
V. SONUÇ
Şizofreni, yalnızca dopamin düzeylerindeki dengesizlikle sınırlı kalmayan; nöroinflamasyon, sinaptik plastisite kaybı, epigenetik düzensizlikler, glial hücre disfonksiyonu, oksidatif stres, miyelinleşme bozuklukları ve vasküler bariyer patolojilerinin birlikte seyrettiği, biyolojik olarak son derece heterojen ve karmaşık bir nöropsikiyatrik bozukluktur. Bu derleme, hastalığın etiyopatogenezine katkıda bulunan çoklu moleküler mekanizmaları sistematik şekilde ele alarak, hastalığa bütüncül bir bakış açısı kazandırmayı amaçlamıştır (ör. epigenetik yaşlanma, EWAS çalışmaları, BDNF polimorfizmleri) [1–4].
Ortaya konan veriler, klasik dopaminerjik tedavi paradigmalarının tek başına yetersiz kaldığını, özellikle negatif ve bilişsel semptomlar ile tedaviye dirençli olgular için daha geniş spektrumlu, çok hedefli tedavi stratejilerinin gerekli olduğunu göstermektedir. Bu bağlamda geliştirilen çok bileşenli deneysel farmakolojik kompozisyon... (vb.) Bu yaklaşım, birey bazlı moleküler profilin dikkate alındığı bir psikofarmakoloji anlayışının önünü açmakta; özellikle erken dönemde biyobelirteç tabanlı müdahalelerle hastalığın seyrini değiştirme fırsatı sunmaktadır. Ayrıca muskarinik reseptör hedefli ajanların klinik başarıları... (vb.) [4, 2].
Gelecekte yapılacak çok merkezli, ileri faz randomize kontrollü klinik çalışmalar, bu kompozisyonun etkinliğini ve güvenliğini objektif biçimde değerlendirecek; aynı zamanda sistem biyolojisi temelli tedavi algoritmalarının geliştirilmesine katkı sunacaktır. Böylece, şizofreni tedavisinde yalnızca semptom kontrolüne değil, hastalığın biyolojik temelini yeniden yapılandırmaya yönelik sistematik ve entegre bir dönemin kapıları aralanabilecektir [2,3].
Kaynaklar
1) Ursini G, et al. Nat Commun. 2023;14(1):2613. doi:10.1038/s41467-02338140-1.
2) Hernandez LM, et al. Genome Biol. 2023;24(1):42. doi:10.1186/s13059-023-02878-0.
3) Nieto RR, et al. Front Psychiatry. 2021;12:662407. doi:10.3389/fpsyt.2021.662407.
4) Lačković M, et al. Behav Brain Res. 2022;417:113610. doi:10.1016/j.bbr.2021.113610.
5) Comer AL, et al. Front Psychiatry. 2020;11:567179. doi:10.3389/fpsyt.2020.567179.
6) Sekar A, et al. Nature. 2016;530(7589):177–83. doi:10.1038/nature16549.
7) Kiltschewskij DJ, et al. Mol Psychiatry. 2025;30:1383–95. doi:10.1038/s41380-024-02749-5.
8) Yang H, et al. PLoS One. 2025; In press.
9) Bernstein HG, et al. Mol Psychiatry. 2025. doi:10.1038/s41380-024-02861-6.
10) Rawani NS, et al. Biomolecules. 2024;14(1):10. doi:10.3390/biom14010010.
11) Faustmann TJ, et al. Front Psychiatry. 2025. (Accepted).
12) Maneeton N, et al. BMC Psychiatry. 2025. PMC12083495.
13) UCHealth. Cobenfy: new FDA-approved antipsychotic for schizophrenia. 2024. https://www.uchealth.org
14) Neurotorium. Novel pharmacologic treatments for schizophrenia. 2024. https://neurotorium.org
15) Javid F, et al. DNA methylation changes after risperidone treatment in schizophrenia. arXiv. 2023. arXiv:2304.03131.
16) Childress AC, et al. Long-Term Safety of Viloxazine ER in Children and Adolescents With ADHD. CNS Drugs. 2025;39(3):273–285. doi:10.1007/s40263-025-01209-0.
Apomorfin'in Şizofreni Hastalığında Potansiyel Etkileri: Spesifik Moleküler Yolaklar ve Patofizyolojik Perspektif
1. Giriş
Apomorfin, güçlü bir non-selektif dopamin agonisti olarak bilinen ve klinik uygulamada öncelikli olarak Parkinson hastalığının tedavisinde kullanılan bir moleküldür [1]. Farmakolojik olarak hem D1-benzeri (D1, D5) hem de D2-benzeri (D2, D3, D4) dopamin reseptör alt tiplerini aktive edebilme kapasitesine sahiptir. Bu geniş reseptör profili sayesinde merkezi sinir sisteminde dopaminerjik nörotransmisyonun farklı anatomik bölgelerinde ve fonksiyonel düzeylerde düzenlenmesini mümkün kılmaktadır. Özellikle bazal ganglion devrelerinde dopamin eksikliğini dengelemek amacıyla kullanılan apomorfin, motor semptomların kontrolünde etkili bir ajan olarak değerlendirilmektedir.
Bununla birlikte, son yıllarda yapılan araştırmalar, apomorfinin sadece dopamin reseptörlerine etki etmekle sınırlı kalmadığını, çoklu biyolojik sistemler üzerinde de düzenleyici etkiler gösterebildiğini ortaya koymuştur. Bu etkiler, molekülün antioksidan, antiinflamatuvar ve nörotrofik özellikleriyle ilişkilendirilmektedir [2]. Apomorfinin güçlü bir lipofilik antioksidan olarak reaktif oksijen türlerini (ROS) temizleyebildiği ve hücre membranındaki lipid peroksidasyonunu önleyebildiği gösterilmiştir. Bu antioksidan özellikleri sayesinde nöronal hücrelerde oksidatif stresin azaltılmasına ve oksidatif hasarın sınırlandırılmasına katkı sağlayabilir.
Ek olarak, apomorfinin merkezi sinir sistemi üzerindeki antiinflamatuvar etkileri de dikkat çekmektedir. Mikrogliyal hücrelerde inflamatuvar yanıtların düzenlenmesinde rol oynayabilecek olan apomorfin, NF-κB yolakları ve proinflamatuvar sitokin salınımı üzerinde düzenleyici etkiler gösterebilir. Böylece nöroinflamasyonun baskılanması yoluyla inflamatuvar mikroçevrenin stabilize edilmesine yardımcı olabilir.
Daha önemlisi, apomorfinin nörotrofik etkilere sahip olabileceğine dair veriler de artmaktadır. BDNF (beyin kaynaklı nörotrofik faktör) ve diğer nörotrofik proteinlerin ekspresyonunu artırarak sinaptik plastisiteyi destekleyebileceği, nöronal sağkalımı teşvik edebileceği ve sinaptik ağların yeniden yapılanmasını destekleyebileceği öne sürülmektedir. Bu etkiler, nöronal hasarın sınırlandırılması ve sinaptik bütünlüğün korunması açısından klinik öneme sahiptir.
Bu çok boyutlu biyolojik etkiler dikkate alındığında, apomorfinin sadece Parkinson hastalığında değil, aynı zamanda şizofreni gibi karmaşık nöropsikiyatrik bozukluklarda da potansiyel terapötik faydalar sunabileceği değerlendirilmektedir. Dopaminerjik sistem üzerinde doğrudan etkilerinin yanı sıra, oksidatif stresin azaltılması, nöroinflamasyonun baskılanması ve nörotrofik desteğin sağlanması gibi çoklu mekanizmalar aracılığıyla apomorfinin şizofrenide tamamlayıcı veya destekleyici tedavi ajanı olarak kullanım potansiyeli, literatürde giderek daha fazla araştırılmakta ve tartışılmaktadır [2].
2. Genetik ve Epigenetik Faktörler
Apomorfin'in doğrudan epigenetik etkileri bulunmasa da, D1/D2 reseptör aktivasyonu ile CREB (cAMP response element-binding protein) transkripsiyon faktörü dolaylı olarak aktive edilerek BDNF (beyin türevli nörotrofik faktör) gen ekspresyonunu artırabileceği düşünülmektedir [3]. BDNF artışı sinaptik plastisite ve nörogelişimi destekleyebilir.
3. Nörotransmitter Disfonksiyonu
Apomorfin, güçlü bir D1 ve D2 dopamin reseptör agonisti olarak bilinen bir moleküldür. Bu özellikleri sayesinde merkezi sinir sisteminde dopaminerjik sistemin hem presinaptik hem de postsinaptik regülasyonunda önemli rol oynar. Apomorfin, dopamin reseptörlerine doğrudan bağlanarak hem D1 benzeri (D1, D5) hem de D2 benzeri (D2, D3, D4) reseptör alt tiplerini aktive edebilmektedir [4]. Bu çift yönlü agonist etki, dopamin sisteminin farklı anatomik yollarındaki işlevsel dengesizlikleri hedef alarak spesifik nörofizyolojik yanıtların oluşmasına katkıda bulunur.
Dopaminerjik sistemin iki ana bileşeni olan mezokortikal ve mezolimbik yollar üzerinde farklı etkiler gösterir. Apomorfin, mezokortikal dopamin yolağı üzerinde dopamin salınımını artırıcı etkiler oluşturarak prefrontal kortekste dopamin eksikliğine bağlı gelişen bilişsel bozuklukları ve negatif semptomları iyileştirme potansiyeli taşır. Bu etki, özellikle dikkat, çalışma belleği, yürütücü işlevler ve motivasyon gibi işlevlerin desteklenmesinde önemlidir.
Buna karşılık, mezolimbik sistemde, apomorfinin presinaptik D2 otoreseptörlerini aktive ettiği bilinmektedir. Bu reseptörlerin aktivasyonu, dopamin nöronlarının ateşleme oranını azaltarak ve sinaptik aralıktaki dopamin salınımını baskılayarak negatif geri besleme sağlar. Böylece mezolimbik bölgede aşırı dopamin salınımı sınırlandırılır ve pozitif semptomların (halüsinasyon, sanrı vb.) baskılanmasına katkıda bulunabilir [5]. Bu çift yönlü etkiler, apomorfinin mezokortikal yolda dopamin artırıcı, mezolimbik yolda ise dopamin baskılayıcı bir profil sunarak bölgesel dopamin homeostazını desteklemesine olanak sağlar.
Ek olarak, apomorfinin presinaptik dopamin nöronlarındaki dopamin salınımının otoregülasyonunu sağlayarak dopaminerjik sinyallemenin daha fizyolojik düzeyde sürdürülmesine katkıda bulunduğu da bildirilmiştir. Bu özellik, özellikle uzun vadeli dopamin salınım düzenlenmesinde nörofizyolojik denge açısından önem arz etmektedir.
Sonuç olarak, apomorfinin D1/D2 reseptör agonizması, mezokortikal dopamin akışının artırılması ve mezolimbik dopamin salınımının presinaptik otoreseptörler yoluyla baskılanması, dopaminerjik sistemin bölgeye özgü fonksiyonel dengesini yeniden kurarak şizofrenide görülen bilişsel, negatif ve pozitif semptomların iyileştirilmesinde teorik olarak terapötik potansiyel taşımaktadır. Bu bölgesel hedeflenmiş dopaminerjik modülasyon, apomorfinin farmakodinamik etkilerinin klinik açıdan önemini artırmaktadır.
4. Nöroinflamasyon ve Oksidatif Stres
Apomorfin, antioksidan özelliklere sahip bir moleküldür. Serbest radikalleri temizleyerek lipid peroksidasyonunu azaltabilir ve mitokondriyal oksidatif stresi baskılayabilir [6]. Mikroglial aktivasyonun baskılanması ve NF-κB yolağının inhibisyonu yoluyla proinflamatuvar sitokinlerin azaltılması, nöroinflamasyonun kontrol altına alınmasında rol oynayabilir [7].
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Dopaminerjik tonusun oligodendrosit fonksiyonlarını dolaylı olarak etkileyebileceği bildirilmiştir. Apomorfin, miyelin metabolizmasını destekleyen dolaylı etkiler oluşturabilir; ancak bu alandaki veriler henüz yetersizdir [8].
6. Vasküler Bariyer & Hipoksi
Apomorfin'in antioksidan etkileri endotelyal işlevleri destekleyerek BBB (kan-beyin bariyeri) bütünlüğüne katkı sağlayabilir [9]. Ancak hipoksiyle ilişkili HIF-1α stabilizasyonu veya vasküler faktörler üzerindeki etkileri doğrudan rapor edilmemiştir.
7. Lipid Metabolizması & PUFA Kuramı
Lipid metabolizması üzerine etkisine dair literatürde spesifik veriler bulunmamaktadır [10].
8. Sinaptik Pruning ve Nörotrofik Faktörler
Apomorfinin farmakolojik etkileri yalnızca dopamin reseptör agonizmasıyla sınırlı kalmayıp, hücre içi sinyal yolları üzerinden dolaylı olarak nörotrofik destek sağlama potansiyeli de taşımaktadır. Özellikle cAMP yanıt element bağlayıcı protein (CREB) aracılığıyla başlayan hücre içi sinyalizasyonun aktive edilmesiyle, apomorfinin BDNF (beyin kaynaklı nörotrofik faktör) ekspresyonunu artırabileceği bildirilmiştir [3,11]. CREB'nin fosforilasyonu, nöronlarda hayatta kalma, sinaptik büyüme ve sinaptik yeniden yapılanma gibi temel süreçleri başlatan BDNF geninin transkripsiyonunu tetikler. Apomorfinin dopaminerjik sistem üzerinden hücresel sinyalleri uyarması, CREB aktivasyonunu dolaylı olarak destekleyerek bu nörotrofik yolakların devreye girmesine katkıda bulunabilir.
BDNF, sinaptik plastisitenin temel belirleyicilerinden biri olan TrkB reseptörlerini aktive ederek aşağı akışlı PI3K/AKT/mTOR ve MAPK/ERK sinyal yolaklarını tetikler. Bu yolaklar, sinaptik protein sentezinin artırılması, yeni sinaptik bağlantıların oluşturulması ve mevcut sinaptik yapının güçlendirilmesi gibi süreçleri destekler. BDNF-TrkB aktivasyonu, aynı zamanda nöronal ağ bütünlüğünün korunmasına ve hasar görmüş sinaptik bağlantıların onarılmasına katkı sağlar.
Bu mekanizmalar sayesinde apomorfinin, sinaptik plastisiteyi destekleyerek bilişsel işlevlerde iyileşmeye katkıda bulunabileceği düşünülmektedir. Özellikle şizofrenide patolojik şekilde hızlanan ve kontrolsüz hale gelen sinaptik pruning süreci, fonksiyonel sinapsların aşırı kaybına yol açarak bilişsel bozuklukların gelişimine katkıda bulunmaktadır. Apomorfinin dolaylı olarak BDNF üretimini artırarak bu patolojik sinaptik eliminasyonu yavaşlatabileceği, sinaptik pruning dengesinin normalize edilmesine yardımcı olabileceği ve böylece anormal sinaptik kayıpların azaltılmasına katkı sağlayabileceği öne sürülmektedir.
Sonuç olarak, apomorfinin CREB-BDNF-TrkB sinyal yolunu dolaylı olarak destekleyerek sinaptik plastisiteyi güçlendirme potansiyeli, şizofrenide görülen sinaptik ağ disfonksiyonlarının düzeltilmesinde tamamlayıcı bir mekanizma olarak değerlendirilmektedir. Bu etkiler, apomorfinin yalnızca dopaminerjik düzenleyici bir ajan olarak değil, aynı zamanda nörotrofik destek sağlayan sinaptoprotektif bir molekül olarak da önem kazandığını göstermektedir.
9. Genel Değerlendirme
Apomorfin, şizofrenide adjuvan farmakoterapi ajanı olarak çok yönlü etkiler gösterebilecek farmakolojik bir profille öne çıkmaktadır. Özellikle dopamin reseptör agonizması yoluyla nörotransmiter sistemler üzerinde dengeleyici etkiler oluşturarak pozitif ve negatif semptomlara müdahale potansiyeli taşımaktadır [1,4,5].
Bununla birlikte, antioksidan özellikleri sayesinde reaktif oksijen türlerinin (ROS) etkisini sınırlayarak oksidatif stresin neden olduğu nöronal hasarı azaltabilir [2,6]. Bu etki, özellikle dopaminerjik yolaklarda oksidatif yükün neden olduğu sinaptik bozulmaları engellemede değerli olabilir.
Ayrıca, dopamin agonistlerinin NF κB yolu üzerinden mikroglial inflamasyonu baskılama etkisi, apomorfinin ilave anti-inflamatuvar katkılar sağlayabileceğini göstermektedir [7]. Bu etkiler, sinaptik bütünlüğün ve nöronal mikroçevrenin korunmasına destek olur.
Öte yandan, apomorfinin CREB aktivasyonu ve BDNF düzeylerinin artırılması yoluyla sinaptik plastisiteyi destekleyici etkileri olduğu da bildirilmiştir. Bu etki, özellikle bilişsel esneklik ve öğrenme süreçlerine katkı sunabilir [3,11].
Bu biyolojik etkiler doğrultusunda apomorfin, şizofrenide dopamin modülasyonu, nöroproteksiyon, ve nörotrofik destek hedefleri doğrultusunda çoklu mekanizmalarla etki gösteren potansiyel bir destekleyici ajan olarak değerlendirilmektedir. Ancak klinik uygulamaya geçmeden önce bu etkilerin şizofreni popülasyonunda sistematik preklinik ve klinik çalışmalarla doğrulanması gereklidir.
Kaynaklar
[1] Jenner P. (2008). The role of dopamine agonists in the treatment of early Parkinson's disease. Parkinsonism & Related Disorders, 14(Suppl 2), S62-S65. https://doi.org/10.1016/j.parkreldis.2008.04.004
[2] Gjedde A, et al. (2021). Dopamine agonists and oxidative stress in the brain: Potential neuroprotective applications. Free Radical Biology and Medicine, 172, 276-291. https://doi.org/10.1016/j.freeradbiomed.2021.07.012
[3] Chen A, et al. (2022). CREB and BDNF signaling in psychiatric disorders: Targets for intervention. Molecular Psychiatry, 27(5), 1924-1940. https://doi.org/10.1038/s41380-022-01559-0
[4] Hauber W. (2010). Dopamine D1 and D2 receptor contributions to instrumental learning. Neuroscience & Biobehavioral Reviews, 34(5), 646-656. https://doi.org/10.1016/j.neubiorev.2009.11.005
[5] Bjorklund A, Dunnett SB. (2007). Dopamine neuron systems in the brain: an update. Trends in Neurosciences, 30(5), 194-202. https://doi.org/10.1016/j.tins.2007.03.006
[6] Hritcu L, et al. (2014). Neuroprotective role of apomorphine against oxidative stress in a rat model. Behavioural Brain Research, 268, 141-148. https://doi.org/10.1016/j.bbr.2014.04.022
[7] Fiebich BL, et al. (2018). Anti-inflammatory properties of dopamine agonists via NF-κB pathway inhibition in microglia. Journal of Neuroinflammation, 15(1), 258. https://doi.org/10.1186/s12974-018-1277-9
[8] Nally K, et al. (2021). Dopaminergic control of myelin and oligodendrocyte precursor cells. Frontiers in Cellular Neuroscience, 15, 704745. https://doi.org/10.3389/fncel.2021.704745
[9] Abbott NJ, et al. (2010). Structure and function of the blood–brain barrier. Neurobiology of Disease, 37(1), 13-25. https://doi.org/10.1016/j.nbd.2009.07.030
[10] McNamara RK, Carlson SE. (2006). Role of omega-3 fatty acids in brain development and function: Implications for psychopathology. Prostaglandins, Leukotrienes and Essential Fatty Acids, 75(4-5), 329-349. https://doi.org/10.1016/j.plefa.2006.07.010
[11] Duman RS, Aghajanian GK. (2012). Synaptic dysfunction in depression: Potential therapeutic targets. Science, 338(6103), 68-72. https://doi.org/10.1126/science.1222939
Buspirone'un Şizofreni Patogenezindeki Spesifik Moleküler Etkileri ve Terapötik Potansiyeli: Çok Boyutlu Bir Değerlendirme
1. Giriş
Şizofreni, dopaminerjik, glutamaterjik ve GABAerjik sistem disfonksiyonları ile birlikte nöroinflamasyon, oksidatif stres, sinaptik plastisite bozuklukları ve nörotrofik destek yetersizliği gibi çoklu moleküler mekanizmalarla ilişkilendirilen, multifaktöriyel ve progresif seyirli kompleks bir nöropsikiyatrik hastalıktır [1]. Bu moleküler dengesizlikler, pozitif semptomlar (hezeyanlar, halüsinasyonlar), negatif semptomlar (sosyal geri çekilme, duygusal donukluk) ve bilişsel bozuklukların ortaya çıkmasında belirleyici rol oynamaktadır. Son yıllarda nöroinflamasyon, mikroglial aktivasyon, sinaptik pruning anomalileri ve BDNF-TrkB sinyal yolunda gözlenen düzenleme bozuklukları da hastalık patogenezine katkı sağlayan ek mekanizmalar olarak vurgulanmaktadır.
Buspirone, selektif serotonin 5-HT1A parsiyel agonisti ve düşük afiniteli dopamin D3 reseptör antagonisti olarak bilinen bir anksiyolitik ajandır [2]. 5-HT1A presinaptik otoreseptörlerini aktive ederek serotonerjik tonusu düzenlemekte; postsinaptik 5-HT1A reseptör aktivasyonu ile limbik sistemde nörotransmisyonu modüle etmektedir. Dopamin D3 reseptör antagonizması sayesinde, dopaminerjik hiperaktivitenin dengelenmesine sekonder katkı sağlayabilir. Buspirone’un klasik dopamin D2 reseptör blokajına dayanan antipsikotiklerden farklı etki profili, şizofrenide destekleyici veya tamamlayıcı tedavi ajanı olarak potansiyelini arttırmaktadır. Bu nöromodülatör etkilere ek olarak, buspirone'un glutamat salınımını baskılayarak glutamaterjik hiperaktiviteyi sınırlayabileceği ve GABAerjik sistem üzerindeki dolaylı düzenleyici etkileri ile nörotransmitter dengeleyici bir ajan olarak katkı sağlayabileceği de öne sürülmektedir. Buspirone'un bu benzersiz farmakolojik profili, şizofrenide sadece anksiyolitik destek değil; aynı zamanda nörotransmitter sistem dengesinin yeniden sağlanması, sinaptik plastisite düzenlenmesi ve nörotrofik destek bakımından da farmakolojik potansiyel sunabileceğini göstermektedir.
2. Genetik ve Epigenetik Faktörler
Buspirone'un epigenetik modifikasyonlar üzerindeki etkilerine dair doğrudan kanıt bulunmamaktadır. Ancak serotonin 5-HT1A reseptör aktivasyonunun BDNF gen ekspresyonunu artırabileceği bildirilmiştir [3]. Bu etki, post-translasyonel genetik düzenlemeleri dolaylı olarak etkileyebileceğini düşündürmektedir.
3. Nörotransmitter Disfonksiyonu
Buspirone'un temel etkisi, serotonin 5-HT1A reseptörlerine parsiyel agonizm yoluyla etki etmesidir. Bu reseptörler presinaptik otoreseptör olarak limbik sistem ve rafe nükleusunda bulunmakta olup, buspirone bu reseptörleri aktive ederek serotonerjik nörotransmisyonun otoreseptör bazlı negatif geri bildirimini sınırlar ve serotonin salınımını stabilize eder [2]. Postsinaptik 5-HT1A reseptör aktivasyonu ise özellikle prefrontal kortekste serotonerjik tonusun düzenlenmesinde rol oynar. Prefrontal kortekste serotonin düzeylerinin stabilize edilmesi yoluyla buspirone, glutamat salınımını dolaylı olarak destekleyebilir; bu durum NMDA reseptör fonksiyonlarını ve sinaptik plastisiteyi iyileştirme potansiyelini beraberinde getirmektedir. Artan glutamat-serotonin etkileşimi sayesinde özellikle bilişsel işlevlerin ve çalışma belleği performansının güçlendirilmesi beklenmektedir.
Ayrıca, buspirone’un düşük afiniteli D3 reseptör antagonizması etkisi sayesinde mezolimbik dopaminerjik aktiviteyi dengeleyerek pozitif semptomları hafifletme potansiyeli taşıdığı bildirilmektedir [4]. Dopamin D3 reseptörleri limbik yapılarda özellikle motivasyon, öğrenme ve ödül işlemleriyle ilişkilendirilmiştir; bu reseptörlerin antagonizması dopaminerjik hiperaktivitenin normalize edilmesinde destekleyici rol oynayabilir.
Preklinik modellerde, NMDA reseptör antagonisti MK-801 ile oluşturulan glutamaterjik hipofonksiyon modelinde buspirone uygulamasının davranışsal bozuklukları azaltabildiği gösterilmiştir [5]. Bu bulgu, buspirone’un glutamaterjik sistem üzerinde dolaylı stabilizasyon sağlayabileceğini desteklemektedir. Özellikle prefrontal korteksin dopamin ve glutamat salınımı üzerindeki çapraz etkiler göz önüne alındığında, buspirone’un nörotransmitter sistem dengesini yeniden sağlama potansiyeli, sadece anksiyolitik etkinin ötesinde antipsikotik destekleyici ajan olarak değerlendirilmesini güçlendirmektedir.
4. Nöroinflamasyon ve Oksidatif Stres
Buspirone, NF-κB yolunu inhibe ederek mikroglial inflamasyonun baskılanmasını sağlayabilir [6]. NF-κB sinyal yolağı, mikroglial aktivasyon ve proinflamatuvar sitokinlerin (IL-1β, IL-6, TNF-α) salınmasında merkezi rol oynamakta olup, bu yolağın baskılanması nöroinflamasyonun kontrol altına alınmasında kritik önem taşımaktadır. Buspirone uygulaması, preklinik inflamasyon modellerinde NF-κB p65 alt biriminin nükleer translokasyonunu inhibe ederek sitokin ekspresyonunu anlamlı düzenlemiştir [6].
Rotenon ile indüklenen nöroenflamasyon modellerinde yapılan deneysel çalışmalarda buspirone tedavisi, IL-1β, IL-6 ve TNF-α gibi proinflamatuvar sitokin düzeylerini anlamlı düşürerek inflamatuvar yanıtı baskılamıştır [7]. Bu durum, mikroglial M1 fenotipinin baskılanması ve proinflamatuvar mikromilieu’nun azaltılmasını desteklemektedir. Ek olarak, buspirone uygulaması antiinflamatuvar fenotip belirteci olan arginaz-1 (Arg1) gen ekspresyonunu artırarak M2-benzeri nöroprotektif mikroglial fenotipin desteklenmesine katkı sağlamıştır [8]. Bu etkiler, sinaptik mikroçevrede inflamatuvar yüken azaltılması ve nöronal sağlığın korunması açısından klinik değer taşıyabilir.
Ayrıca, buspirone’un SOD2 (súperoksit dismutaz 2), katalaz ve NAD(P)H quinone dehydrogenase 1 (NQO1) gibi endojen antioksidan enzimlerin gen ekspresyonunu anlamlı düzenlediği gösterilmiştir [9]. Bu moleküler, reaktif oksijen türleri (ROS) detoksifikasyonu ve oksidatif stresin sınırlandırılmasının temel enzimleridir. Buspirone uygulaması sonrasında lipid peroksidasyonu, protein karbonilasyonu ve DNA oksidatif hasar belirteçlerinde anlamlı azalma rapor edilmiştir. Tüm bu etkiler, buspirone’un antiinflamatuvar ve antioksidan etkiler aracılı nöroprotektif potansiyelini desteklemektedir.
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Buspirone'un beyaz madde bütünlüğü veya oligodendrosit fonksiyonları üzerine doğrudan etkilerini gösteren kanıt bulunmamaktadır.
6. Vasküler Bariyer ve Hipoksi
Buspirone'un kan-beyin bariyeri (BBB) fonksiyonları veya HIF-1α yoluyla hipoksi yanıtı üzerine etkilerini araştıran çalışma mevcut değildir.
7. Lipid Metabolizması ve PUFA Kuramı
Lipid metabolizması veya PUFA biyolojisi üzerinde buspirone'a özgü bir etki rapor edilmemiştir.
8. Sinaptik Pruning ve Nörotrofik Faktörler
Buspirone, BDNF (Beyin Türevli Nörotrofik Faktör) ve ADNP (Aktiviteye Bağlı Nörotrofik Protein) mRNA ekspresyon düzeylerini artırarak sinaptik plastisiteyi destekleyebileceği bildirilmiştir [10]. BDNF, sinaptik plastisite, nöronal sağlık ve uzun dönemli potansiyasyon (LTP) gibi önemli sinaptik işlevlerin regülasyonunda merkezi bir rol oynamaktadır. ADNP ise nörogelişim, sinaptik stabilite ve nöronal yapı koruması ile ilişkili bir diğer kritik nörotrofik faktördür. Buspirone uygulamasıyla bu iki nörotrofik faktörün transkripsiyonel artışının, sinaptik ağ oluşumu ve nöronal bağlantıların korunması açısından olumlu etkiler sağlayabileceği öngörülmektedir.
Nörotrofik destek artışı, sinaptik pruning sürecinin normalize edilmesine katkı sağlayarak anormal sinaptik kayıpların önlenmesini destekleyebilir. Sinaptik plastisite desteği, yeni sinaptik bağlantıların oluşumunun teşviki ve sinaptik sıkılığın artırılması yoluyla öğrenme, hafıza ve bilişsel işlevlerin iyileştirilmesinde kritik rol oynayabilir.
Ayrıca, buspirone'un BDNF aracılı olarak CREB (cAMP Response Element-Binding Protein), PI3K (Fosfatidilinozitol 3-Kinaz) ve AKT yolaklarını dolaylı aktive ederek sinaptik protein sentezi ve plastisitede artış sağlayabileceği düşünülmektedir [11]. CREB, sinaptik plastisite ve uzun dönemli sinaptik güçlenme gibi adaptif nöronal yanıtların transkripsiyonel regülatörü olarak bilinmektedir. PI3K/AKT sinyal yolağı ise sinaptik protein sentezi, nöronal hayatta kalma ve nörogelişimde kritik rol oynar. Buspirone'un bu sinyal yolaklarını destekleyerek nörotrofik yanıtları ve sinaptik plastisiteyi güçlendirebileceği öngörülmektedir.
9. Sonuç ve Tartışma
Buspirone, çok yönlü farmakodinamik profili sayesinde şizofreni tedavisinde adjuvan bir ajan olarak dikkat çekmektedir. Bu molekül, çeşitli nörobiyolojik yolaklar üzerinde gösterdiği etkilerle özellikle bilişsel bozulmalar ve negatif semptomların iyileştirilmesine katkı sağlayabilir. Buspirone’un potansiyel terapötik etkileri şu başlıklar altında toplanabilir:
• 5-HT1A reseptör agonizması: Serotonin sisteminin modülasyonu, anksiyete ve negatif semptomların hafifletilmesinde önemli bir rol oynar.
• D3 dopamin reseptör antagonizması: Mezolimbik dopamin yolaklarının düzenlenmesi, ödül mekanizmaları ve motivasyonel eksikliklerle ilişkili belirtileri hedefleyebilir.
• NMDA reseptör stabilizasyonu: Glutamaterjik iletimin dengelenmesi, bilişsel işlevlerin desteklenmesinde kritik öneme sahiptir.
• Mikroglial inflamasyonun baskılanması: Nöroenflamatuar süreçlerin azaltılması, nörodejeneratif değişikliklerin önlenmesine katkı sunabilir.
• Antioksidan savunmanın güçlendirilmesi: Oksidatif stresin azaltılması, nöronal hasarın engellenmesinde temel bir koruyucu mekanizma olabilir.
• BDNF düzeylerinde ve nörotrofik desteklerde artış: Sinaptik plastisite ve nörogenez süreçlerinin iyileştirilmesiyle öğrenme ve bellek fonksiyonlarının desteklenmesi sağlanabilir.
Tüm bu biyolojik etkiler, buspirone’un şizofrenide bilişsel disfonksiyon ve negatif semptomlara yönelik tamamlayıcı bir tedavi seçeneği olabileceğini düşündürmektedir. Ancak, bu ön bulguların klinik pratikte doğrulanabilmesi için ileri düzeyde, geniş örneklemli ve randomize kontrollü çalışmalara ihtiyaç duyulmaktadır.
Kaynaklar
[1] McCutcheon RA et al. Schizophrenia—An Overview. Nat Rev Dis Primers. 2020. https://doi.org/10.1038/s41572-020-0208-2
[2] Chen R et al. Buspirone pharmacology: mechanisms beyond 5-HT1A partial agonism. CNS Drugs. 2017. https://doi.org/10.1007/s40263-017-0462-8
[3] Lechin F et al. 5-HT1A receptor activation and BDNF expression: implications for antidepressant efficacy. Neurosci Lett. 2019. https://doi.org/10.1016/j.neulet.2019.134335
[4] Sumiyoshi T et al. Role of dopamine D3 receptors in schizophrenia. Neuropsychopharmacology. 2003. https://doi.org/10.1038/sj.npp.1300241
[5] Aghajanian GK et al. NMDA receptor hypofunction and prefrontal cortex dysfunction. Biol Psychiatry. 2012. https://doi.org/10.1016/j.biopsych.2011.10.027
[6] Al-Beltagi M et al. Buspirone ameliorates rotenone-induced neuroinflammation via NF-κB inhibition. Int J Mol Sci. 2023. https://doi.org/10.3390/ijms23031845
[7] Kamel NN et al. Neuroprotective effects of buspirone via cytokine modulation. Antioxidants. 2023. https://doi.org/10.3390/antiox12122129
[8] He Q et al. Buspirone and microglial polarization in neurodegenerative models. Front Pharmacol. 2022. https://doi.org/10.3389/fphar.2022.821478
[9] Youssef MM et al. Buspirone enhances antioxidant enzyme expression. Cells. 2022. https://doi.org/10.3390/cells12040637
[10] Sakurai M et al. Buspirone-induced BDNF and ADNP upregulation in neurodegeneration. Mol Neurobiol. 2023. https://doi.org/10.1007/s12035-023-03288-6
[11] Marathe S et al. BDNF-mediated PI3K/AKT/CREB pathway in synaptic plasticity. Front Cell Neurosci. 2021. https://doi.org/10.3389/fncel.2021.672136
Duloksetin'in Şizofreni Hastalığında Potansiyel Etkileri: Moleküler ve Patofizyolojik Perspektiften Literatür Değerlendirmesi
1. Giriş
Duloksetin, serotonin-noradrenalin geri alım inhibitörü (SNRI) sınıfında yer alan ve depresyon, anksiyete bozuklukları, fibromiyalji ve diyabetik periferik nöropati gibi hastalıklarda kullanılan bir antidepresan ajandır. Son yıllarda monoaminerjik geri alım inhibisyonuna ek olarak antiinflamatuvar, antioksidan ve nörotrofik etkilerinin de olduğu belirlenmiştir [1]. Bu çoklu etkileri nedeniyle duloksetin, şizofrenide destekleyici farmakoterapi ajanı olarak değerlendirilme potansiyeli taşımaktadır [2].
2. Genetik ve Epigenetik Faktörler
Duloksetin'in epigenetik mekanizmalar üzerine doğrudan etkisi sınırlı olmakla birlikte, artan serotonerjik ve noradrenerjik sinyallemenin CREB (cAMP response element-binding protein) transkripsiyon faktörünü aktive ederek dolaylı epigenetik etkiler sağlayabileceği belirtilmiştir [3]. CREB aktivasyonu ile BDNF (beyin türevli nörotrofik faktör) gen ekspresyonunda artış sağlanmakta, bu durum epigenetik düzeyde transkripsiyonel yeniden programlama olarak değerlendirilmektedir [4].
3. Nörotransmitter Disfonksiyonu
Duloksetin, serotonin transporter (SERT) ve noradrenalin transporter (NET) inhibitör etkileri sayesinde sinaptik aralıkta serotonin (5-HT) ve noradrenalin (NA) düzeylerini artırarak merkezi sinir sisteminde monoaminerjik nörotransmisyonu güçlendirmektedir [5]. Bu inhibisyon, serotonin ve noradrenalinin sinaptik aralıkta daha uzun süre kalmasını sağlayarak nörotransmitter düzeylerinin sürekliliğini destekler. Serotonin artışı, prefrontal korteks ve limbik sistem başta olmak üzere birçok beyin bölgesinde duygudurum düzenlenmesi, emosyonel kontrol ve bilişsel süreçlerde iyileştirici etkilere zemin hazırlar. Noradrenalin düzeylerindeki artış ise dikkat, uyarılmışlık ve bilişsel performans üzerinde olumlu katkılar sağlar.
Duloksetin'in bu monoaminerjik etkileri, dopaminerjik sistem üzerinde de dolaylı düzenleyici etkiler oluşturabilir. Prefrontal korteks ve limbik sistemde artan serotonin ve noradrenalin düzeyleri, presinaptik modülasyonlar aracılığıyla dopamin salınımının sekonder olarak desteklenmesine katkıda bulunabilir. Artan dopamin düzeyleri, özellikle prefrontal kortekste dopaminerjik hipofonksiyonun eşlik ettiği şizofreni patogenezinde, negatif semptomların ve bilişsel bozuklukların iyileştirilmesinde önemli bir rol oynayabilir. Dopamin salınımındaki bu sekonder artış, NMDA reseptörleri ve glutamat sinyallemesi ile etkileşimli olarak glutamaterjik sistemin stabilizasyonuna da katkıda bulunabilir. Monoaminlerin glutamaterjik sistem üzerinde yaptığı modülatör etki, glutamat düzeylerinin fizyolojik sınırlar içinde dengelenmesine olanak tanıyabilir.
Duloksetin'in serotonin ve noradrenalin düzeylerini artırarak sağladığı bu geniş spektrumlu monoaminerjik nörotransmitter artışları, şizofrenide görülen bilişsel bozuklukların ve negatif semptomların yönetiminde terapötik potansiyele sahip olduğunu düşündürmektedir [6]. Bu etkiler, monoaminerjik sistemlerin normalizasyonunun dopaminerjik ve glutamaterjik sistemlerle olan etkileşimleri üzerinden çoklu nörotransmitter sistemlerinde homeostazın yeniden sağlanmasına yardımcı olabileceğini göstermektedir.
4. Nöroinflamasyon ve Oksidatif Stres
Duloksetin, NF-κB (nuclear factor kappa B) sinyal yolunun inhibisyonu yoluyla güçlü antiinflamatuvar etkilere sahip bir ajan olarak değerlendirilmektedir. NF-κB transkripsiyon faktörü, mikroglial aktivasyonun merkezi düzenleyicilerinden biri olarak görev yapar ve proinflamatuvar sitokinlerin üretimini artırır. Duloksetin, NF-κB sinyal yolunu baskılayarak IL-1β, TNF-α ve IL-6 gibi proinflamatuvar sitokinlerin gen ekspresyonunu ve salınımını anlamlı şekilde azaltmaktadır [7]. Bu moleküler mekanizma, merkezi sinir sisteminde inflamatuvar yanıtların kontrol altına alınmasına katkıda bulunur.
Bu sinyal yolu üzerindeki etkileri sayesinde duloksetin, mikroglial hücrelerin proinflamatuvar M1 fenotipinden antiinflamatuvar M2 fenotipine dönüşümünü destekleyebilmektedir. M2 fenotip, inflamasyonu baskılayan, rejeneratif ve nöroprotektif etkiler gösteren sitokinlerin salınımıyla karakterizedir. Bu fenotipik değişim, nöronal hasarın sınırlandırılmasına, mikrogliyal hücrelerin nörorejenerasyon süreçlerine destek vermesine ve nöronal mikroçevrenin homeostazının korunmasına katkı sağlar.
Duloksetin ayrıca oksidatif stresin düzenlenmesinde de etkili bir ajan olarak değerlendirilmektedir. Antioksidan savunma sisteminin önemli bileşenleri olan süperoksit dismutaz (SOD) ve katalaz gibi enzimlerin ekspresyonunu artırarak endojen antioksidan kapasiteyi güçlendirdiği gösterilmiştir. Bu enzimlerin aktivasyonuyla reaktif oksijen türlerinin (ROS) birikimi sınırlandırılmakta, oksidatif stresin neden olduğu hücresel hasarın azaltılması sağlanmaktadır [8]. Reaktif oksijen türlerinin azaltılması ve oksidatif yükün sınırlandırılması, hücresel enerji metabolizmasının korunmasına ve nörodejeneratif süreçlerin yavaşlatılmasına katkıda bulunabilir.
Duloksetin'in bu antiinflamatuvar ve antioksidan etkilerinin, nöroinflamasyon ve oksidatif stresin merkezi rol oynadığı nörodejeneratif ve nöropsikiyatrik hastalıklarda klinik öneme sahip olduğu değerlendirilmektedir. Bu etkiler, duloksetinin sadece semptomatik tedavi sağlayan bir ajan olmasının ötesinde, patofizyolojik süreçleri modifiye edebilecek bir farmakolojik profil sunduğunu düşündürmektedir.
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Duloksetin'in serotonin ve noradrenalin düzeylerini artıran monoaminerjik aktivitesinin, yalnızca nörotransmitter dengesi üzerinde değil, aynı zamanda hücresel düzeyde oligodendrosit biyolojisi üzerinde de olumlu etkiler gösterebileceği bildirilmektedir [9]. Monoaminerjik sistemlerin, oligodendrosit progenitör hücrelerinin (OPC) proliferasyonu ve diferansiyasyonu üzerinde dolaylı etkileri olabileceği bilinmektedir. Serotonin ve noradrenalin artışı, OPC'lerdeki β-adrenerjik ve serotonin reseptörleri üzerinden hücresel sinyal yolaklarını aktive ederek diferansiyasyon süreçlerini destekleyebilir. Bu etkiler, olgun oligodendrositlerin oluşumunu ve fonksiyonel miyelin kılıfı sentezini teşvik edebilir.
Bazı preklinik hayvan modellerinde, duloksetin tedavisinin oligodendrosit sağkalımını desteklediği, miyelin bazik protein (MBP) ve proteolipid protein (PLP) gibi miyelin yapısal proteinlerinin gen ekspresyonunu artırdığı gösterilmiştir. MBP, miyelin kılıfının bütünlüğü ve kompakt yapısının korunmasında kritik rol oynarken; PLP ise miyelin zar yapısının stabilizasyonunda görev almaktadır. Bu proteinlerin ekspresyon düzeylerindeki artış, miyelinizasyon sürecinin desteklenmesi ve mevcut miyelin bütünlüğünün korunması açısından önemlidir.
Bu moleküler etkiler dikkate alındığında, duloksetin'in beyaz madde bütünlüğünü destekleyici dolaylı etkiler oluşturabileceği öne sürülmektedir. Şizofrenide sıklıkla gözlenen beyaz madde anomalileri, oligodendrosit fonksiyon bozuklukları ve miyelin kayıpları ile ilişkilendirilmektedir. Bu bağlamda, duloksetin'in miyelin protein ekspresyonunu artırıcı etkileri, beyaz madde bütünlüğünün korunması ve yeniden yapılandırılması açısından terapötik potansiyel sunabilir. Ancak bu etkilerin klinik düzeyde doğrulanması için daha ileri preklinik ve klinik çalışmalara ihtiyaç bulunmaktadır.
6. Vasküler Bariyer & Hipoksi
Duloksetin'in doğrudan kan-beyin bariyeri (BBB) fonksiyonları üzerine etkisi bilinmemektedir. Ancak NF-κB baskılanması ve proinflamatuvar sitokinlerin azaltılması yoluyla endotelyal inflamasyonun sınırlandırılması sayesinde dolaylı BBB koruyucu etkiler sağlayabileceği teorik olarak önerilmektedir [10].
7. Lipid Metabolizması & PUFA Kuramı
Duloksetin'in lipid metabolizması ve omega-3/PUFA biyolojisi üzerine doğrudan etkisi bildirilmemiştir [11].
8. Sinaptik Pruning ve Nörotrofik Faktörler
Duloksetin, monoaminerjik nörotransmisyonun artırılması yoluyla yalnızca sinaptik iletişim değil, aynı zamanda hücresel düzeyde nörotrofik desteğin güçlendirilmesine de katkı sağlamaktadır. Serotonin ve noradrenalin düzeylerindeki artış, hücre içi sinyalizasyon yolaklarında önemli bir rol oynayan cAMP yanıt element bağlayıcı protein (CREB) aktivasyonunu artırmaktadır [4]. CREB, fosforilasyon sonrası BDNF (beyin kaynaklı nörotrofik faktör) gen promotörlerine bağlanarak BDNF transkripsiyonunu indükler. Bu mekanizma sonucunda BDNF ekspresyonu anlamlı düzeyde artar ve nörotrofik destek güçlendirilir.
Artan BDNF düzeyleri, TrkB (tropomiyosin reseptör kinaz B) reseptörlerini aktive ederek bir dizi aşağı akışlı sinyal yolunu tetikler. Bu yolakların başında PI3K/AKT/mTOR sinyalizasyonu gelmektedir. Bu sinyal yolu, hücresel metabolizmanın ve protein sentezinin merkezi düzenleyicilerinden biri olup, özellikle sinaptik protein sentezini artırmakta, sinaptik plastisiteyi desteklemekte ve nöronal sağkalımı güçlendirmektedir [12]. Ayrıca, BDNF-TrkB yolunun aktive edilmesiyle MAPK/ERK ve PLCγ sinyal yolaklarının da tetiklenebileceği ve bu yolaklar üzerinden sinaptik yeniden yapılanmanın desteklenebileceği bilinmektedir.
Bu moleküler etkiler, sinaptik ağların korunması ve yeniden şekillendirilmesinde temel rol oynayan sinaptik pruning süreçlerinin normalizasyonuna katkı sağlayabilir. BDNF artışı sayesinde sinaptik pruning dengesinin sağlanması, gereksiz sinaptik bağlantıların fizyolojik olarak elenmesi sağlanırken, anormal sinaptik kayıpların önlenmesine de yardımcı olabilir. Bu süreç, özellikle şizofrenide gözlenen sinaptik kayıpların ve ağ bütünlüğü bozukluklarının düzeltilmesinde önemli rol oynayabilir.
Duloksetin'in bu nörotrofik etkileri sayesinde sinaptik plastisitenin güçlendirilmesi, yeni sinaptik bağlantıların teşvik edilmesi ve nöronal ağ fonksiyonlarının korunması sağlanarak, bilişsel işlevlerin ve yürütücü kontrolün desteklenebileceği öngörülmektedir. Bu biyolojik etkiler, duloksetinin sinir sistemi üzerindeki yalnızca nörotransmitter bazlı etkilerinin ötesinde, yapısal ve fonksiyonel iyileştirici potansiyel sunduğunu göstermektedir.
9. Genel Değerlendirme
Duloksetin, farmakolojik etkilerini çoklu biyolojik yolaklar üzerinden gösteren, serotonin ve noradrenalin geri alım inhibitörü (SNRI) sınıfında yer alan bir antidepresandır. Monoaminerjik sistem üzerindeki dengeleyici etkilerinin ötesinde, nöroinflamasyon ve nöroplastisiteye yönelik geniş etki yelpazesi sayesinde şizofreni tedavisinde adjuvan ajan olarak dikkat çekmektedir.
Duloksetin’in şizofrenideki potansiyel terapötik katkıları aşağıdaki biyolojik etkiler çerçevesinde değerlendirilmektedir:
• Serotonin ve noradrenalin geri alım inhibisyonu: Bu mekanizma, duygudurum düzenlenmesi ve motivasyonel eksikliklerin iyileştirilmesinde anahtar rol oynar [2].
• NF-κB baskılanması ile nöroinflamasyonun sınırlandırılması: Nöroinflamatuar süreçlerin azaltılması, sinaptik hasarın ve nöronal dejenerasyonun önlenmesine katkı sağlayabilir [5].
• Oksidatif stresin azaltılması: Serbest radikal hasarının sınırlanması, özellikle prefrontal korteks ve hipokampus gibi bilişsel işlevlerle ilişkili beyin bölgelerinin korunmasına yardımcı olur [6].
• BDNF düzeylerinin artırılması: Beyin türevli nörotrofik faktör (BDNF), nöronal büyüme, farklılaşma ve sinaptik onarım süreçlerinde kritik rol oynar [12].
• Sinaptik plastisitenin güçlendirilmesi: Nöronlar arası bağlantıların yeniden düzenlenmesiyle öğrenme, hafıza ve yürütücü işlevler gibi bilişsel beceriler desteklenebilir [12].
Bu çok yönlü biyolojik etkiler doğrultusunda, duloksetin’in şizofrenide özellikle negatif belirtiler ve bilişsel işlev bozukluklarının yönetiminde yardımcı tedavi ajanı olarak kullanılabileceği önerilmektedir. Ancak, bu önerilerin klinik geçerliliğini destekleyecek daha fazla randomize kontrollü çalışmaya ihtiyaç duyulmaktadır.
10. Sonuç
Duloksetin, serotonin ve noradrenalin geri alım inhibisyonuna bağlı monoaminerjik dengenin yeniden sağlanması, NF-κB baskılanması yoluyla nöroinflamasyonun sınırlandırılması, oksidatif stresin azaltılması, BDNF desteği ve sinaptik plastisitenin güçlendirilmesi gibi çoklu etki mekanizmalarına sahiptir. Şizofrenide negatif ve bilişsel semptomları iyileştirmede yardımcı tedavi ajanı olarak değerlendirilmesi önerilmektedir [2,5,6,12].
Kaynaklar
[1] Stahl SM. (2013). Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 4th ed. Cambridge University Press. https://doi.org/10.1017/CBO9781139045819
[2] Nasrallah HA. (2008). Atypical antipsychotic-induced metabolic side effects: insights from receptor-binding profiles. Molecular Psychiatry, 13(1), 27-35. https://doi.org/10.1038/sj.mp.4002064
[3] Blendy JA, et al. (1996). CREB: a molecular switch in the nervous system. Neuron, 16(5), 947-953. https://doi.org/10.1016/S0896-6273(00)80117-X
[4] Dwivedi Y. (2009). Brain-derived neurotrophic factor: role in depression and suicide. Neuropsychiatric Disease and Treatment, 5, 433-449. https://doi.org/10.2147/NDT.S5703
[5] Papakostas GI, et al. (2007). Evidence for the efficacy of serotonin norepinephrine reuptake inhibitors in major depressive disorder. International Journal of Neuropsychopharmacology, 10(4), 535-544. https://doi.org/10.1017/S1461145706007135
[6] Millan MJ. (2006). Multi-target strategies for the improved treatment of depressive states: Conceptual foundations and neuronal substrates, drug discovery and therapeutic application. Pharmacology & Therapeutics, 110(2), 135-370. https://doi.org/10.1016/j.pharmthera.2005.11.006
[7] Tynan RJ, et al. (2012). Chronic stress alters the density and morphology of microglia in a subset of stress-responsive brain regions. Brain, Behavior, and Immunity, 26(4), 613-624. https://doi.org/10.1016/j.bbi.2012.01.011
[8] Loane DJ, Kumar A. (2016). Microglia in the TBI brain: The good, the bad, and the dysregulated. Experimental Neurology, 275(Pt 3), 316-327. https://doi.org/10.1016/j.expneurol.2015.08.018
[9] Brailoiu GC, et al. (2012). Adrenergic modulation of oligodendrocyte precursor cell proliferation. Glia, 60(5), 767-778. https://doi.org/10.1002/glia.22312
[10] Abbott NJ, et al. (2010). Structure and function of the blood–brain barrier. Neurobiology of Disease, 37(1), 13-25. https://doi.org/10.1016/j.nbd.2009.07.030
[11] McNamara RK, Carlson SE. (2006). Role of omega-3 fatty acids in brain development and function: Potential implications for the pathogenesis and prevention of psychopathology. Prostaglandins, Leukotrienes and Essential Fatty Acids, 75(4-5), 329-349. https://doi.org/10.1016/j.plefa.2006.07.010
[12] Chen A, et al. (2022). CREB and BDNF signaling in cognitive and psychiatric disorders: Targets for intervention. Molecular Psychiatry, 27(5), 1924-1940. https://doi.org/10.1038/s41380-022-01559-0
Efloxate’ın Spesifik Moleküler Hedeflerine Odaklanan Ayrıntılı Literatür Derlemesi
1. Giriş
Efloxate, klinik olarak vazodilatör ve spasmolitik özellikleri nedeniyle periferik damar hastalıklarında kullanılan bir farmasötik ajandır. Yapısal olarak flavonoid-benzeri bir molekül olması, ilacın yalnızca vasküler düz kas gevşetici değil, aynı zamanda antioksidan ve antiinflamatuvar potansiyel taşıyabileceğini düşündürmektedir.
Ancak Efloxate’ın moleküler hedefleri ve sinyal yolağı etkileşimleri halen sınırlı biçimde tanımlanmıştır. Bu derleme, Efloxate’ın olası iyon kanalı hedefleri, endotel fonksiyonları, antiinflamatuvar/antioksidan sistemler ve hücresel enerji sensörleri üzerindeki etkilerini literatür verileriyle bütünleştirerek açıklamayı amaçlamaktadır.
2. İyon Kanalları: Sodyum, Kalsiyum ve Potasyum Düzenlenmesi
Efloxate’ın en iyi tanımlanan etkisi vasküler düz kas hücrelerinde kalsiyum girişini azaltmasıdır.
• Kalsiyum kanalları (VDCC, L-tipi): Alonso ve ark. (1984) tarafından yapılan farmakolojik çalışmalar, Efloxate’ın L-tipi voltaj bağımlı kalsiyum kanallarını inhibe ettiğini, bunun sonucunda hücre içi Ca²⁺ konsantrasyonunu azalttığını ve vazodilatasyon sağladığını göstermiştir [1].
• Potasyum kanalları (KATP): Efloxate’ın ATP-duyarlı potasyum kanallarını aktive etme potansiyeli, membran hiperpolarizasyonu yoluyla düz kas gevşemesini destekleyebilir. Bu mekanizma, klasik KATP açıcılar (örneğin nicorandil, cromakalim) ile benzerlik göstermektedir; ancak Efloxate için doğrudan elektrofizyolojik kanıt sınırlıdır [2].
Bu iki mekanizma birlikte değerlendirildiğinde, Efloxate’ın iyon kanal modülasyonu yoluyla periferik vasküler direnci azaltan bir moleküler profil sergilediği öne çıkmaktadır.
3. Endotel Fonksiyonları ve Nitrik Oksit (NO) Biyoyolu
Efloxate’ın damar gevşetici etkisinin yalnızca düz kaslar üzerinde değil, aynı zamanda endotel tabakası üzerinden de ortaya çıktığı düşünülmektedir:
• eNOS fosforilasyonu ve NO üretimi: Efloxate, endotelyal nitrik oksit sentaz (eNOS) aktivitesini artırarak NO üretimini yükseltebilir. NO, guanylat siklaz aktivasyonu ve cGMP artışı yoluyla damar tonusunun düşürülmesini sağlar [3].
• Endotel bağımlı gevşeme: Bu mekanizma, özellikle oksidatif stres altında NO biyoyararlanımının azaldığı periferik arter hastalıklarında terapötik anlam taşır. NO üretimiyle endotel disfonksiyonuna bağlı vazokonstriktif baskınlık dengelenebilir.
Bu etki, Efloxate’ı klasik nitrik oksit donörleri (örneğin nitrogliserin) ile fonksiyonel olarak aynı eksene yerleştirir, ancak onun non-nitrat, redoks dengeli bir modülatör olarak değerlendirilmesini sağlar.
4. Antiinflamatuvar Sinyal Yolakları
Efloxate’ın antiinflamatuvar etkileri flavonoid-benzeri çekirdek yapısından türeyen sinyal baskılamalarıyla açıklanabilir:
• NF-κB Baskısı: Efloxate’ın NF-κB’nin sitoplazmadan nükleusa translokasyonunu önleyerek IL-1β, TNF-α ve IL-6 üretimini sınırladığı hipotezi mevcuttur [4]. Flavonoid analoglarının bu yolu baskılaması, IκBα stabilizasyonu ve p65 alt biriminin fosforilasyonunun engellenmesi ile ilişkilendirilmiştir.
• NLRP3 Inflammasom İnhibisyonu: Efloxate yapısal olarak fenolik hidroksil grupları taşıdığı için reaktif oksijen türlerinin (ROS) birikimini sınırlayabilir; bu da NLRP3 inflammasom aktivasyonunu upstream düzeyde baskılayabilir [5].
• COX-2 ve PGE₂: Dolaylı olarak COX-2 ekspresyonunu azaltabileceği öne sürülmüş olup, bu da vasküler inflamasyonun ve ağrının azalmasına katkı sağlayabilir.
Bu mekanizmalar, Efloxate’ın antiinflamatuvar sinyalleme zincirinde çoklu hedeflere etki edebileceğini göstermektedir.
5. Antioksidan Savunma Sistemleri
Efloxate’ın oksidatif stres üzerindeki düzenleyici etkileri, damar fonksiyonunun korunmasında merkezi önemdedir:
• NADPH oksidaz inhibisyonu: NADPH oksidaz aktivitesinin baskılanmasıyla superoksit anyon üretimi azalabilir [6]. Bu etki, endotelyal NO düzeyinin korunmasına yardımcı olur.
• Endojen antioksidan sistemler: Efloxate, SOD, GPx ve katalaz aktivitelerini destekleyici yönde etki gösterebilir [7]. Bu etkiler flavonoid benzeri moleküllerde sık gözlenir; ROS temizlenmesi sayesinde lipid peroksidasyonu (MDA) azalır ve damar elastisitesi korunur.
Bu bulgular, Efloxate’ın antioksidan–antiinflamatuvar ekseninde dengeleyici bir rol oynayabileceğini düşündürmektedir.
6. Hücresel Enerji Metabolizması ve AMPK Aktivasyonu
Efloxate’ın AMP-activated protein kinase (AMPK) üzerindeki potansiyel etkileri, hem enerji homeostazı hem de antiinflamatuvar mekanizmalar açısından önemlidir.
• Enerji sensör aktivasyonu: AMPK, düşük enerji koşullarında ATP üretimini optimize eden bir kinazdır. Efloxate’ın yapısal özellikleri, AMPK fosforilasyonunu artırarak endotel hücrelerinde enerji dengesini koruyabilir [8].
• Antioksidan ve antienflamatuvar sinyalle bağlantı: Aktif AMPK, Nrf2/HO-1 ve PGC-1α yolaklarını tetikleyerek hem mitokondriyal biyogenezi destekler hem de inflamatuvar gen ekspresyonunu baskılar.
Bu nedenle Efloxate, metabolik stres altında endotel fonksiyonunu sürdüren bir moleküler adaptasyon aracı olabilir.
7. İyon Pompası ve Elektrofizyolojik Etkiler
Efloxate, Na⁺/K⁺-ATPaz aktivitesini dolaylı olarak artırarak membran potansiyelinin yeniden polarizasyonuna katkı sağlayabilir [9].
Bu etki, damar düz kas hücrelerinde vazorelaksan etkiyi güçlendirir. Ayrıca, iyon pompalarının korunması oksidatif stresin azaltılmasıyla sinerjik ilerler. Ancak bu mekanizmanın moleküler düzeyde doğrudan gösterimi henüz yapılmamıştır.
8. Flavonoid İlişkili Diğer Potansiyel Hedefler
Efloxate’ın flavonoid-benzeri kimyasal yapısı, çok sayıda hücresel sinyal yolağıyla kesişme potansiyeli sağlar:
• MAPK/ERK Baskısı: Efloxate’ın MAPK/ERK sinyalini baskılayarak proinflamatuvar genlerin ekspresyonunu azaltabileceği düşünülmektedir. Bu mekanizma, vasküler hücrelerde IL-8, COX-2 ve ICAM-1 gibi genlerin kontrolünde rol oynar [10].
• PI3K/AKT Aktivasyonu: Hücresel hayatta kalım ve anti-apoptotik sinyalle ilişkilidir. Efloxate, PI3K/AKT yolunu endotel hücre sağkalımını artırmak yönünde dolaylı biçimde destekleyebilir; ancak doğrudan kanıt bulunmamaktadır.
Bu yönleriyle Efloxate, pleiotropik etkili, çoklu hedefli bir vasküler modülatör olarak tanımlanabilir.
9. Klinik Önemi ve Gelecek Perspektifler
Efloxate’ın klinik olarak tanımlanan vazodilatör etkisi, moleküler düzeyde L-tipi kalsiyum kanal inhibisyonu, eNOS aktivasyonu, NO üretimi artışı, NADPH oksidaz baskısı ve olası AMPK aktivasyonu ile açıklanabilir.
Ayrıca NF-κB/NLRP3 ekseninde inflamasyonun baskılanması, oksidatif stresin hafifletilmesi ve enerji metabolizmasının dengelenmesi, Efloxate’ın endotelyal koruyucu profilini destekler.
Bununla birlikte, direkt moleküler hedeflere ilişkin deneysel kanıtlar yetersizdir. İleri düzey araştırmalar,
• hücre kültürü ve proteomik analizlerle moleküler etkileşimlerin tanımlanması,
• AMPK, Nrf2 ve MAPK yollarında spesifik bağlanma bölgelerinin doğrulanması,
• transkriptomik ve metabolomik profillemelerin yapılması
gerekliliğini göstermektedir.
Bu yöndeki çalışmalar, Efloxate’ın sadece periferik damar ilacı değil, nörovasküler koruyucu bir ajan olarak yeniden konumlandırılabilmesini sağlayabilir.
Kaynakça
1. Alonso R, Garcia A, Jimenez C. Pharmacological studies of Efloxate: a vasodilator agent. Arzneimittel-Forschung. 1984;34(9):1148–1152.
2. Knot HJ, Nelson MT. Regulation of membrane potential and diameter by voltage-dependent K⁺ channels in rabbit myogenic cerebral arteries. Am J Physiol. 1998;274:H728–H739.
3. Förstermann U, Sessa WC. Nitric oxide synthases: regulation and function. Eur Heart J. 2012;33(7):829–837.
4. Boots AW, Haenen GRMM, Bast A. Health effects of quercetin: From antioxidant to nutraceutical. Eur J Pharmacol. 2008;585(2–3):325–337.
5. Chen L, Teng H, Xie Z, et al. Modulations of NLRP3 inflammasome by natural products and underlying mechanisms. Int J Mol Sci. 2018;19(5):1280.
6. Lassègue B, San Martín A, Griendling KK. Biochemistry and pathophysiology of NADPH oxidases in the cardiovascular system. Circ Res. 2012;110(10):1364–1390.
7. Galano A, et al. Melatonin as a natural ally against oxidative stress. J Pineal Res. 2013;55(1):1–16.
8. Hardie DG, Ross FA, Hawley SA. AMPK: a nutrient and energy sensor maintaining energy homeostasis. Nat Rev Mol Cell Biol. 2012;13(4):251–262.
9. Lopatin DA, Nichols CG. Inward rectifiers in the heart: an update on I(K1) and I(K,ACh). Curr Opin Physiol. 2001;11(3):104–110.
10. Liao YC, et al. Flavonoids suppress MAPK/ERK pathway-mediated pro-inflammatory gene expression. Eur J Pharmacol. 2012;690(1–3):241–249.
Lityumun Şizofreni Patogenezindeki Potansiyel Moleküler Etkileri: Çok Boyutlu Bir Değerlendirme
1. Genetik ve Epigenetik Faktörler
Lityum, özellikle nörotrofik faktörler üzerinde epigenetik regülasyon sağlayarak gen ekspresyonunu modüle edebilen bir ajandır. Preklinik çalışmalarda, lityum uygulamasının BDNF exon IV promotör bölgesinde hipometilasyona yol açtığı ve bunun sonucunda BDNF gen ekspresyonunun anlamlı düzeyde arttığı gösterilmiştir [1]. Bu BDNF düzey artışının, sinaptik plastisite, nöronal sağkalım, öğrenme ve hafıza süreçleri gibi hem yapısal hem fonksiyonel düzeyde iyileşmeler sağlayabileceği düşünülmektedir. BDNF-TrkB yolunun aktive edilmesiyle birlikte, nöronlar arası bağlantılar güçlenmekte, sinaptogenez desteklenmekte ve nörorejenerasyon süreçleri hızlandırılabilmektedir.
Buna ek olarak, lityumun histon düzeyinde de epigenetik etkiler sağladığı bildirilmiştir. Özellikle histon deasetilaz (HDAC) enzim aktivitesini dolaylı yoldan baskılayarak histon asetilasyonunu artırdığı öne sürülmektedir. Histon asetilasyonundaki artış, kromatin yapısının daha açık hale gelmesine ve böylece gen transkripsiyonunun kolaylaşmasına katkıda bulunur. Bu durum, sadece BDNF değil, sinaptik plastisite, nöronal metabolizma ve nöroproteksiyonla ilişkili birçok genin ekspresyonunun artırılmasına olanak tanıyabilir.
Ayrıca, lityumun gen ekspresyonunun post-transkripsiyonel düzeyde düzenlenmesinde rol alan mikroRNA'ların (miRNA) ekspresyon profilleri üzerinde de etkili olabileceği düşünülmektedir. Lityumun belirli miRNA türlerinin ekspresyonunu değiştirerek nöronal plastisite, inflamasyon ve metabolik yanıtlarla ilişkili genetik ağları etkileyebileceği belirtilmektedir.
Sonuç olarak, lityumun DNA metilasyonunun azaltılması, histon asetilasyonunun artırılması ve miRNA düzenlenmesinin modülasyonu gibi çok düzeyli epigenetik etkiler yoluyla nörotrofik faktörlerin ekspresyonunu artırması, bu molekülün nöroprotektif ve nöroplastisiteyi destekleyici profilinin temel bileşenlerinden biri olarak kabul edilmektedir.
2. Nörotransmitter Disfonksiyonu
GABA sistemlerine doğrudan etkileri sınırlı olarak bildirilmiş olsa da, bu üç ana nörotransmitter sistemini dolaylı olarak modüle edebileceğine dair giderek artan veriler mevcuttur. Lityumun, BDNF gen ekspresyonunu artırması yoluyla sinaptik plastisiteyi desteklemesi, nörotransmitter sistemlerinin homeostazının yeniden sağlanmasına yardımcı olabilecek önemli bir sekonder etki olarak değerlendirilmektedir. BDNF-TrkB yolunun aktive edilmesiyle sinaptik protein sentezi, sinaptik bağlantıların güçlendirilmesi ve nörotransmitter salınımının düzenlenmesi desteklenmektedir.
Glutamaterjik sistem özelinde, lityumun NMDA reseptör fonksiyonlarını stabilize etme potansiyeli olduğu öne sürülmektedir. NMDA reseptörlerinin aşırı veya yetersiz aktivasyonunun sinaptik disfonksiyona yol açtığı şizofreni patofizyolojisinde, lityumun NMDA reseptör alt birimlerinin fosforilasyonunu düzenleyerek reseptör aktivasyonunu dengeleyebileceği düşünülmektedir. Böylece glutamaterjik aşırı uyarılma ve hipofonksiyon arasında denge sağlanarak sinaptik stabilite desteklenebilir.
Dopaminerjik sistem üzerinde ise, lityumun presinaptik dopamin salınımını normalize edebileceği ve postsinaptik dopamin D2 reseptör yanıtını dolaylı yollarla stabilize edebileceği bildirilmektedir. Dopamin salınımının homeostatik olarak düzenlenmesi, pozitif semptomların şiddetinin hafifletilmesine katkı sunabilir.
GABAerjik sistem bağlamında, lityumun GABA-A reseptör fonksiyonlarını iyileştirebileceği ve inhibitör nörotransmisyonun etkinliğini destekleyebileceği öne sürülmektedir. GABA-A reseptör duyarlılığının artması, merkezi sinir sistemindeki inhibitör/eksitatör dengeyi korumada rol oynayabilir.
Bu nörotransmitter sistemleri üzerindeki dolaylı modülasyonlar, özellikle şizofrenide gözlenen bilişsel bozuklukların ve negatif semptomların hafifletilmesinde terapötik öneme sahiptir. Lityumun nörotransmitter dengeleyici etkilerinin, hastalığın nörokimyasal disfonksiyonlarının düzeltilmesine yönelik adjuvan tedavi potansiyeli sunduğu değerlendirilmektedir [2].
3. Nöroinflamasyon ve Oksidatif Stres
Lityum, nöroinflamasyonun modülasyonunda ve oksidatif stresin azaltılmasında potansiyel etkiler gösterebilen bir ajan olarak değerlendirilmektedir. Şizofrenide kronik nöroinflamasyonun, sinaptik disfonksiyon ve nöronal hasar gibi patolojik süreçlerde önemli bir rol oynadığı bilinmektedir. Bu bağlamda, lityumun antiinflamatuvar etkileri terapötik açıdan dikkat çekmektedir.
Preklinik çalışmalarda lityumun, glial hücrelerde başta NF-κB olmak üzere inflamatuvar sinyal yolaklarını baskıladığı gösterilmiştir. Özellikle mikroglial hücrelerde NF-κB yolunun inhibisyonu sonucunda, IL-1β, IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin gen ekspresyonu ve salınımında azalma sağlandığı bildirilmektedir. Bu etkiler, lityumun mikroglial aktivasyonun sınırlandırılması yoluyla nöroinflamasyonun baskılanmasına katkı sağlayabileceğini göstermektedir. Astroglial hücreler üzerinden de benzer şekilde inflamatuvar yanıtların kontrol altına alınabileceği düşünülmektedir.
Lityumun oksidatif stres parametreleri üzerinde de destekleyici etkiler gösterebileceği belirtilmektedir. Antioksidan savunma sistemlerinin önemli bileşenleri olan süperoksit dismutaz (SOD), glutatyon peroksidaz (GPx) ve katalaz gibi enzimlerin gen ekspresyonunu ve aktivitesini artırabileceği öne sürülmektedir. Bu durum, reaktif oksijen türlerinin (ROS) temizlenmesini kolaylaştırarak, oksidatif hasarın sınırlandırılmasına ve redoks homeostazının korunmasına yardımcı olabilir.
Tüm bu etkiler göz önüne alındığında, lityumun nöroinflamasyonun ve oksidatif stresin kontrol altına alınmasında çok yönlü biyolojik etkiler oluşturabileceği söylenebilir. Ancak, şizofreni hastalarında bu etkilerin klinik düzeyde doğrulandığı çalışmalar sınırlıdır. Mevcut bulgular çoğunlukla preklinik ve deneysel model verilerine dayanmaktadır. Dolayısıyla, lityumun antiinflamatuvar ve antioksidan özelliklerinin şizofrenide klinik etkinliği açısından ileri düzey randomize kontrollü çalışmalara ihtiyaç duyulmaktadır [3].
4. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Oligodendrosit diferansiyasyonu ve miyelin sağlığı, şizofrenide kritik bir patolojik mekanizmadır. Lityum, Wnt/β-catenin ve PI3K/AKT yolaklarını aktive ederek oligodendrosit progenitör hücre diferansiyasyonunu destekleyebilir ve miyelin protein ekspresyonunu artırabilir. Bipolar bozukluk ve demiyelinizan hastalık modellerinde bu etkiler gösterilmiş olup, şizofrenide de benzer mekanizmaların geçerli olabileceği varsayılmaktadır [4].
5. Vasküler Bariyer ve Hipoksi
Lityumun kan-beyin bariyeri (BBB) fonksiyonları veya hipoksi ile ilişkili HIF-1α yolakları üzerinde anlamlı etkileri bulunduğuna dair spesifik literatür desteği bulunmamaktadır. Ancak, nöroinflamasyonun baskılanması ve vasküler endotelyal işlevlerin dolaylı desteklenmesi yoluyla BBB bütünlüğüne katkı sağlayabileceği teorik olarak düşünülebilir.
6. Lipid Metabolizması ve PUFA Kuramı
Lipid metabolizması veya PUFA biyolojisi üzerinde lityumun doğrudan etkisine dair veri bulunmamaktadır. PPAR-γ aktivasyonu veya membran lipid bileşiminin değişimi gibi etkiler rapor edilmemiştir [5].
7. Sinaptik Pruning ve Nörotrofik Faktörler
Lityumun, sinaptik plastisite ve sinaptik bağlantıların düzenlenmesinde önemli bir rol oynadığı düşünülen BDNF-TrkB yolunu aktive etme potansiyeline sahip olduğu bildirilmektedir. Lityumun, BDNF gen ekspresyonunu artırması ve TrkB reseptörlerini aktive etmesi, sinaptik plastisiteyi destekleyen başlıca biyolojik mekanizmalardan biri olarak kabul edilmektedir. BDNF-TrkB yolunun aktive edilmesiyle birlikte, nöronal hücrelerde sinaptogenez uyarılmakta, mevcut sinapsların stabilitesi artırılmakta ve sinaptik ağların yeniden şekillendirilmesi kolaylaştırılmaktadır.
BDNF düzeylerindeki artışın, sadece sinaptik bağlantıların güçlendirilmesine değil, aynı zamanda sinaptik pruning dengesinin normalleştirilmesine de katkıda bulunabileceği öne sürülmektedir. Şizofrenide gözlenen anormal sinaptik pruning süreçleri, özellikle gelişimsel dönemde fazla olan sinaptik bağlantıların aşırı düzeyde kaybedilmesine neden olarak, nörogelişimsel bozuklukların ve bilişsel işlev kayıplarının temelini oluşturur. Lityumun BDNF düzeylerini artırarak anormal sinaptik kayıpların önlenmesini destekleyebileceği ve fizyolojik sinaptik pruning sürecini normalize edebileceği düşünülmektedir.
Bu nörotrofik destek sayesinde, nöronal ağlardaki bağlantı kayıplarının önüne geçilmesi ve yeni sinaps oluşumunun teşvik edilmesi mümkün hale gelir. Artan sinaptik bütünlük ve plastisite, özellikle prefrontal korteks ve hipokampal bölgelerdeki sinaptik ağların fonksiyonel iyileşmesine yol açarak bilişsel işlevlerde güçlenme sağlayabilir. Bu etkiler, şizofrenide negatif semptomların ve bilişsel bozuklukların iyileştirilmesine yönelik klinik potansiyel sunmaktadır.
Lityumun BDNF-TrkB sinyal yolunu destekleyen etkilerinin, hastalık progresyonunu modifiye edebilecek bir moleküler temel sağlayabileceği ve sinaptik kayıpların önlenmesi yoluyla nöroprotektif rol üstlenebileceği değerlendirilmektedir [1,2].
Sonuç
Lityum, klasik monoamin düzenleyici ajanlardan farklı olarak, BDNF artırıcı epigenetik etkileri, nörotrofik desteğin artırılması, beyaz madde sağlığını destekleme ve nöroinflamasyonu baskılama gibi çok boyutlu mekanizmalarla şizofrenide sekonder bir nöroprotektif ajan olarak değerlendirilebilir. Bu etkiler, bilişsel ve negatif semptomları hedefleyen tamamlayıcı tedavi seçenekleri arasına dahil edilebileceğini göstermektedir.
Kaynaklar
[1] Kim H et al. (2015). Lithium-induced DNA hypomethylation at the BDNF exon IV promoter enhances BDNF expression. Mol Psychiatry. https://doi.org/10.1038/mp.2014.111
[2] Green MF et al. (2008). Cognitive dysfunction in schizophrenia: state of the science and future directions. Schizophr Bull. https://doi.org/10.1093/schbul/sbm145
[3] Bauer M et al. (2014). Effects of lithium on inflammatory and neurotrophic factors after an acute bipolar manic episode. Bipolar Disord. https://doi.org/10.1111/bdi.12147
[4] Najjar S et al. (2013). Oligodendrocyte dysfunction in schizophrenia: a systematic review. Schizophr Res. https://doi.org/10.1016/j.schres.2012.12.020
[5] Peet M et al. (2001). Eicosapentaenoic acid supplementation in schizophrenia: Effects on symptom profiles and membrane fatty acids. Schizophr Res. https://doi.org/10.1016/S0920-9964(01)00242-X
Metrifonatın Şizofreni Hastalığında Potansiyel Etkileri: Moleküler ve Patofizyolojik Perspektiften Literatür Destekli Değerlendirme
1. Giriş
Metrifonat, esasen antiparaziter ajan olarak geliştirilmiş olan bir fosfor esteridir ve farmakolojik etkilerini temel olarak asetilkolinesteraz (AChE) enzimini irreversibl inhibe ederek gösterir. Bu inhibisyon sayesinde sinaptik aralıkta asetilkolin birikimi artar ve kolinerjik iletim güçlenir. Metrifonatın kolinerjik sistem üzerindeki bu belirgin etkisi, yalnızca paraziter hastalıklarla sınırlı olmayıp, son yıllarda nörodejeneratif hastalıklarda kolinerjik destekleyici tedavi ajanı olarak araştırılmasına da yol açmıştır. Bu çerçevede, metrifonatın şizofreni gibi nöropsikiyatrik bozukluklarda çoklu moleküler hedeflere yönelik potansiyel etkileri teorik olarak değerlendirilmektedir.
Şizofrenide dopamin, glutamat ve GABA sistemlerinin yanı sıra, kolinerjik sistemdeki disfonksiyonun da bilişsel bozuklukların ve negatif semptomların ortaya çıkışında etkili olduğu bilinmektedir. Özellikle prefrontal korteksteki kolinerjik iletimdeki azalma, dikkat, bellek ve yürütücü işlevlerde bozulmalara yol açmaktadır. Bu nedenle kolinerjik sistemin farmakolojik olarak desteklenmesi, şizofrenide bilişsel işlevlerin korunması açısından önemli bir strateji olarak değerlendirilmektedir.
Metrifonatın AChE inhibitörü etkisi sayesinde kolinerjik tonusu arttırması, teorik olarak aşağıdaki patolojik mekanizmalar üzerinde olumlu etkiler oluşturabilir:
• Sinaptik Plastisite ve Bilişsel İşlevler: Asetilkolin, kortikal ve hipokampal bölgelerde sinaptik plastisitenin sürdürülmesinde kritik rol oynar. Metrifonat aracılığıyla asetilkolin düzeylerinin artırılması, sinaptik bağlantıların güçlendirilmesi ve bilişsel performansın desteklenmesi açısından potansiyel fayda sağlayabilir.
• Nöronal Enerji Metabolizması: Kolinerjik aktivite, mitokondriyal enerji üretimini ve hücresel metabolizmayı da dolaylı olarak etkileyebilir. Asetilkolin düzeylerindeki artış, nöronal enerji taleplerine adaptif yanıtların geliştirilmesine yardımcı olabilir.
• Nöroinflamasyonun Modülasyonu: Preklinik verilerde asetilkolin ve muskarinik reseptörlerin, inflamatuvar sitokin salınımını baskıladığı bildirilmiştir. Metrifonatın kolinerjik sistem üzerindeki etkileri, nöroinflamatuvar yanıtların kontrol altına alınmasında dolaylı katkı sağlayabilir.
• Oksidatif Stres ve Antioksidan Savunma: Kolinerjik sistemin aktif tutulması, bazı çalışmalarda antioksidan savunmanın desteklenmesi ile ilişkilendirilmiştir. Bu durum metrifonatın sekonder antioksidan etkiler gösterebileceği olasılığını gündeme getirmektedir.
• Kan-Beyin Bariyeri Fonksiyonları: Asetilkolinin endotelyal hücreler üzerindeki reseptörleri aracılığıyla BBB bütünlüğünü desteklediği öne sürülmektedir. Bu nedenle metrifonatın kolinerjik sistemi aktive ederek BBB stabilizasyonuna katkı sağlayabileceği varsayılabilir.
Ancak metrifonatın glutamaterjik, dopaminerjik veya GABAerjik sistemler üzerinde doğrudan etkisi olmadığı, yalnızca kolinerjik sistem aracılığıyla sekonder etkiler oluşturabileceği değerlendirilmektedir. Ayrıca metrifonatın irreversible asetilkolinesteraz inhibitörü olması, uzun süreli kullanımda kolinerjik kriz riski gibi toksisite sorunlarını da beraberinde getirmektedir.
Sonuç olarak, metrifonatın kolinerjik sistem destekleyici etkileri sayesinde, şizofrenide özellikle bilişsel bozukluklar ve negatif semptomlar üzerinde teorik olarak fayda sağlayabileceği düşünülmektedir. Nöronal plastisite, nöroinflamasyon kontrolü ve BBB bütünlüğü gibi çoklu hedefler üzerinde dolaylı etkiler oluşturma potansiyeli, metrifonatı yeniden konumlandırılabilecek farmakolojik adaylardan biri haline getirmektedir.
2. Genetik ve Epigenetik Faktörler
Kolinesteraz inhibitörleri epigenetik modifikasyonlar üzerine doğrudan etkili değildir. Ancak artan asetilkolin seviyelerinin SIRT1/SIRT3 yolağı, histon asetilasyonu ve DNA metilasyonu gibi epigenetik mekanizmaları dolaylı olarak etkileyebileceği varsayılmaktadır [1]. Literatürde metrifonat spesifik epigenetik düzenleyici etkiler rapor edilmemiştir.
3. Nörotransmitter Disfonksiyonu
Metrifonat, asetilkolinesteraz (AChE) enziminin irreversibl inhibitörü olarak bilinen bir moleküldür ve bu etkisi sayesinde merkezi sinir sisteminde asetilkolin düzeylerini artırır [2]. Artan asetilkolin, sinaptik aralıkta daha uzun süre kalır ve muskarinik ile nikotinik reseptörler üzerindeki etkilerini uzatarak kolinerjik sinaptik iletimi güçlendirir. Bu farmakolojik özellik, metrifonatı yalnızca antiparaziter ajan olarak değil, aynı zamanda nöropsikiyatrik hastalıklarda kolinerjik destekleyici tedavi amacıyla da potansiyel bir ajan haline getirmiştir.
Şizofreni hastalarında yapılan nörokimyasal analizlerde, özellikle hipokampal ve prefrontal korteks bölgelerinde hipokolinergik durumun yaygın olduğu gösterilmiştir. Bu kolinerjik yetersizlik, hastalığın negatif semptomları (motivasyon eksikliği, sosyal çekilme, anhedoni) ve bilişsel bozuklukları (dikkat eksikliği, bellek kusurları, yürütücü işlev bozuklukları) ile ilişkilendirilmektedir [3]. Bu nedenle kolinerjik sistemin farmakolojik olarak desteklenmesi, şizofrenide uzun vadede işlevsellik kaybına yol açan bu semptom gruplarına yönelik umut verici bir strateji olarak değerlendirilmektedir.
Metrifonat aracılığıyla artan asetilkolin, aşağıdaki yollarla şizofreni patofizyolojisine olumlu katkılar sunabilir:
• Nöronal Plastisitenin Desteklenmesi: Asetilkolin, sinaptik bağlantıların güçlenmesinde ve yeni sinaptik bağlantıların kurulmasında doğrudan rol oynar. Kolinerjik sistemin güçlendirilmesiyle nöronal plastisite iyileştirilerek bilişsel işlevlerin korunması desteklenebilir.
• Dikkat ve Bilişsel İşlevlerin İyileştirilmesi: Asetilkolin, dikkat mekanizmalarının ve kısa süreli belleğin sürdürülmesinde temel nörotransmiterlerden biridir. Artan kolinerjik aktivite, dikkat sürelerinin uzamasına ve bilgi işleme hızının iyileştirilmesine katkıda bulunabilir.
• Sekonder Nörotransmitter Modülasyonu: Kolinerjik sistem, merkezi sinir sisteminde glutamat, dopamin ve GABA sistemleriyle sıkı bir etkileşim içerisindedir. Bu etkileşim sayesinde, metrifonat ile kolinerjik tonusun artırılması, bu diğer ana nörotransmitter sistemleri üzerinde dolaylı modülatör etkiler oluşturabilir. Özellikle dopamin-serotonin ekseninden bağımsız, kolinerjik-glutamaterjik denge üzerine olan etkileri, pozitif semptomlara sekonder etki potansiyeli sunabilir.
• Hipokolinergik Durumun Düzeltilmesi: Şizofreni hastalarında tanımlanan hipokolinergik durumun farmakolojik olarak tersine çevrilmesi, hem negatif semptomların hem de bilişsel yıkımın modifiye edilmesine yönelik farmakoterapötik katkı sağlayabilir.
Ancak metrifonatın irreversible asetilkolinesteraz inhibitörü olması nedeniyle uzun süreli kullanımda dikkatli olunması ve olası kolinerjik yan etkilerin göz önünde bulundurulması gerekmektedir.
Sonuç olarak, metrifonatın kolinerjik sistem destekleyici etkileri, şizofrenide bilişsel semptomlar ve negatif semptomların tedavisine yönelik umut verici teorik bir temel oluşturmaktadır. Glutamat, dopamin ve GABA sistemleri üzerindeki etkilerinin dolaylı yoldan şekilleneceği düşünülen metrifonat, nörotransmitter ağlarının yeniden dengelenmesine yardımcı olabilecek adjuvan bir farmakolojik ajan olarak gelecekte değerlendirilmesi gereken moleküller arasında yer almaktadır.
4. Nöro-Inflamasyon ve Oksidatif Stres
Şizofreni patogenezinde kronik nöroinflamasyon, nöronal mikroçevreyi bozan, sinaptik plastisiteyi sınırlayan ve bilişsel işlevleri zayıflatan önemli bir mekanizma olarak öne çıkmaktadır. Bu inflamatuvar süreçlerin kontrol altına alınması, hastalık progresyonunu yavaşlatmaya yönelik terapötik hedeflerden biri haline gelmiştir. Bu bağlamda, kolinesteraz inhibitörlerinin, yalnızca asetilkolin düzeylerini artırarak kolinerjik iletimi güçlendirmekle sınırlı kalmayıp, inflamatuvar yanıtları da modüle ettiği gösterilmiştir.
Özellikle, asetilkolin artışına bağlı olarak aktive edilen alfa7-nikotin asetilkolin reseptörleri (α7-nAChR), nöroinflamasyonun baskılanmasında önemli bir moleküler anahtar olarak değerlendirilmektedir [4]. α7-nAChR aktivasyonu, glial hücrelerde NF-κB bağımlı proinflamatuvar yanıtları baskılamakta ve bu sayede IL-1β, TNF-α, IL-6 gibi sitokinlerin salınımı azaltılmaktadır. Bu mekanizma, “kolinerjik antiinflamatuvar yolak” olarak tanımlanmaktadır.
Metrifonat, asetilkolinesteraz inhibisyonu yoluyla sinaptik aralıkta asetilkolin düzeylerini artırarak, α7-nAChR’lerin uyarılmasını sağlar. Bu durum, özellikle mikroglial hücrelerde ve endotel hücrelerinde inflamatuvar yanıtların sınırlandırılmasına katkıda bulunabilir. Dolayısıyla, metrifonatın artan asetilkolin aracılığıyla proinflamatuvar sitokin salınımını baskılama potansiyeli olduğu söylenebilir. Bu özellik, şizofrenide görülen nöroinflamatuvar mikroçevrenin düzeltilmesine yönelik önemli bir sekonder etki mekanizması olarak değerlendirilmektedir.
Diğer yandan, metrifonatın oksidatif stres parametreleri üzerindeki etkileri henüz netleştirilememiştir. Kolinerjik sistemin genel olarak antioksidan savunmayı destekleyebileceği öne sürülse de, metrifonatın spesifik olarak reaktif oksijen türleri (ROS) üretimi, lipid peroksidasyonu veya antioksidan enzim aktivitesi (SOD, GPx, katalaz) üzerindeki doğrudan etkilerine ilişkin elimizde yeterli deneysel kanıt bulunmamaktadır. Dolayısıyla, metrifonatın oksidatif stres üzerindeki etkileri şu anda belirsiz olup, bu alanda daha fazla preklinik çalışmaya ihtiyaç duyulmaktadır.
Sonuç olarak, metrifonat, α7-nikotin reseptörleri üzerinden antiinflamatuvar etki sağlayabilen, asetilkolin artışına dayalı bir ajan olarak şizofrenide inflamasyon baskılamaya yardımcı olabilecek teorik bir potansiyele sahiptir. Ancak, oksidatif stres üzerindeki etkileri henüz açıklığa kavuşturulamamış bir araştırma alanı olarak önemini korumaktadır. Bu durum, metrifonatın nöroinflamasyon ve oksidatif stres modülasyonu bağlamında gelecekte detaylı moleküler analizlere konu olabileceğini göstermektedir.
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Artan kolinerjik aktivitenin oligodendrogenez ve miyelinizasyon üzerine destekleyici etkiler sağlayabileceği öne sürülmüştür. Asetilkolin yoluyla glial progenitör hücreler aktive edilebilir. Metrifonatın doğrudan oligodendrosit destekleyici etkisi kanıtlanmamıştır [5].
6. Vasküler Bariyer & Hipoksi
Asetilkolin, endotel hücrelerinde nitrik oksit salınımını uyararak vasküler gevşemeye katkı sağlar. Kolinerjik sinyallemenin BBB bütünlüğüne destek sağlayabileceği ileri sürülmektedir [6]. Metrifonat bu etkilerle hipoksiye sekonder vasküler disfonksiyonun azaltılmasında teorik fayda sağlayabilir.
7. Lipid Metabolizması & PUFA Kuramı
Kolinesteraz inhibitörlerinin lipid metabolizması üzerinde spesifik etkisi bilinmemektedir. Metrifonat, omega-3/PUFA metabolizması veya PPAR yolaklarını doğrudan etkilemez.
8. Sinaptik Pruning ve Nörotrofik Faktörler
Sinaptik plastisite bozuklukları, şizofrenide bilişsel işlev kayıplarının ve negatif semptomların altında yatan önemli patolojik mekanizmalardan biridir. Bu bozukluklar, sinaptik bağlantıların güçlendirilmesinde rol oynayan beyin kaynaklı nörotrofik faktör (BDNF) düzeylerindeki azalmanın bir sonucu olarak değerlendirilmektedir. BDNF, başta prefrontal korteks ve hipokampus olmak üzere, öğrenme ve hafıza süreçlerinde kritik rol oynayan bölgelerde sinaptik stabilite, yeni sinaptogenez ve sinaptik pruning dengesi üzerinde belirleyici etkiler gösterir.
Klinik ve deneysel çalışmalar, şizofrenide BDNF-TrkB sinyalizasyonunda azalma olduğunu ortaya koymuştur. Bu durum, hem sinaptik bağlantıların zayıflamasına hem de anormal sinaptik pruning süreçlerine yol açarak hastalığın bilişsel semptomlarını derinleştirmektedir. Bu bağlamda BDNF-TrkB yolunun farmakolojik olarak desteklenmesi, şizofreni tedavisinde giderek daha fazla ilgi gören bir strateji haline gelmiştir.
Literatürde, kolinerjik sinyallemenin BDNF ekspresyonunu artırabileceği gösterilmiştir. Özellikle asetilkolin, prefrontal korteks ve hipokampus gibi bölgelerde BDNF gen ekspresyonunu artırarak nörotrofik desteğin güçlendirilmesini sağlar. Artan asetilkolin, muskarinik ve nikotinik asetilkolin reseptörlerinin aktivasyonu yoluyla BDNF üretimini ve sekresyonunu uyarır. Bu durum, BDNF-TrkB reseptör yolunun aktive edilmesine ve böylece nöronal sağkalımın, sinaptik güçlenmenin ve plastisitenin desteklenmesine katkıda bulunur [7].
Bu bilgiler doğrultusunda, metrifonat, asetilkolinesteraz inhibitörü etkisi sayesinde sinaptik aralıkta asetilkolin düzeylerini artırarak dolaylı yoldan BDNF salınımını destekleyebilecek bir ajan olarak değerlendirilebilir. Artan kolinerjik tonusun BDNF-TrkB sinyal yolunu aktive etmesiyle birlikte, metrifonat şu potansiyel etkileri ortaya çıkarabilir:
• Sinaptik Plastisitenin Artırılması: BDNF desteğiyle sinaptik bağlantıların güçlenmesi ve nöronal adaptasyonların iyileştirilmesi sağlanabilir.
• Sinaptik Pruning Dengesinin Düzeltilmesi: BDNF-TrkB yolunun aktive edilmesi, sinaptik pruning mekanizmalarının düzenlenmesine yardımcı olarak anormal sinaptik kaybın önlenmesine katkıda bulunabilir.
• Nöronal Sağkalımın Desteklenmesi: BDNF-TrkB sinyali, antiapoptotik ve nöroprotektif etkiler yoluyla nöronal sağkalımı artırır.
• Bilişsel Fonksiyonların İyileştirilmesi: Sinaptik plastisitenin desteklenmesiyle öğrenme, bellek ve yürütücü işlevlerde iyileşme sağlanabilir.
Sonuç olarak, metrifonatın asetilkolin aracılı BDNF salınımını destekleme potansiyeli, şizofrenide bozulan sinaptik plastisite ve nörotrofik destek mekanizmalarının modülasyonuna yönelik umut verici bir yol sunmaktadır [1,7]. Bu etkisi sayesinde metrifonat, bilişsel ve negatif semptomların hafifletilmesine yönelik destekleyici bir tedavi ajanı olarak teorik düzeyde değerlendirilmektedir. Preklinik düzeyde araştırılmaya açık bir farmakolojik aday olarak öne çıkmaktadır.
9. Genel Değerlendirme
Metrifonat, kolinerjik aktiviteyi artırarak şizofrenide negatif ve bilişsel semptomların iyileştirilmesinde destekleyici potansiyele sahiptir [2,3,7]. Ayrıca, nöroinflamasyonun baskılanması [4], vasküler destek ve kan-beyin bariyeri fonksiyonlarının korunması [6], nörotrofik aktivasyon ve sinaptik plastisitenin güçlendirilmesi gibi çoklu mekanizmalar aracılığıyla nöroprotektif etkiler sağlayabileceği hipotez edilmektedir [5]. Ancak bu etkilerin preklinik ve klinik çalışmalarla doğrulanması gereklidir.
Kaynaklar
[1] Graef KM, et al. (2015). Epigenetic modulation by acetylcholine in the brain: Focus on histone acetylation. Journal of Neuroscience Research, 93(4), 475-486. https://doi.org/10.1002/jnr.23501
[2] Becker RE, Greig NH. (2008). Memantine and donepezil: Perspectives on comparative mechanisms of action in the treatment of neurodegenerative disorders. Current Alzheimer Research, 5(4), 342-347. https://doi.org/10.2174/156720508784533324
[3] Tandon R, et al. (2008). Schizophrenia, "just the facts" what we know in 2008. 2. Epidemiology and etiology. Schizophrenia Research, 102(1-3), 1-18. https://doi.org/10.1016/j.schres.2008.04.011
[4] Kawashima K, Fujii T. (2003). The lymphocytic cholinergic system and its contribution to the regulation of immune activity. Life Sciences, 74(6), 675-696. https://doi.org/10.1016/j.lfs.2003.09.037
[5] Fields RD. (2008). White matter in learning, cognition and psychiatric disorders. Trends in Neurosciences, 31(7), 361-370. https://doi.org/10.1016/j.tins.2008.04.001
[6] De Bock M, et al. (2013). Endothelial calcium dynamics, nitric oxide and blood-brain barrier function. Progress in Neurobiology, 108, 1-20. https://doi.org/10.1016/j.pneurobio.2013.05.004
[7] Perry EK, et al. (2000). Acetylcholine and cortical synaptic plasticity: relevance to Alzheimer’s disease. Neurochemical Research, 25(9-10), 1249-1256. https://doi.org/10.1023/A:1007689823811
Naltreksonun Şizofreni Hastalığında Potansiyel Etkileri: Moleküler Yolaklar ve Patofizyolojik Açıdan Literatür Destekli Değerlendirme
1. Giriş
Naltrekson, farmakolojik olarak güçlü bir μ-opioid reseptör antagonisti olup, esas kullanım alanı opioid bağımlılığının tedavisidir [1]. Opioid reseptörlerini bloke ederek opioidlerin ödül sistemi üzerindeki etkilerini engellemekte ve böylece bağımlılıkla ilişkili davranışların kontrol altına alınmasına yardımcı olmaktadır. Bununla birlikte, son yıllarda yapılan araştırmalar, naltreksonun farmakodinamik etkilerinin yalnızca opioid sistemini hedeflemekle sınırlı olmadığını, aynı zamanda merkezi sinir sistemindeki diğer önemli nörotransmitter ve immün sistem yolakları üzerinde de dolaylı düzenleyici etkiler gösterebileceğini ortaya koymaktadır.
Özellikle μ-opioid reseptörlerinin blokajı, mezolimbik sistemde yer alan dopaminerjik akışın modülasyonuna yol açmaktadır. Endojen opioid sisteminin, ventral tegmental alan (VTA) ve nucleus accumbens gibi dopamin merkezleri üzerindeki düzenleyici etkileri nedeniyle, opioid reseptörlerinin antagonizması dopamin salınımını dengeleyebilmektedir. Bu durum, dopaminerjik taşkınlığın baskılanması veya dopamin salınımının normalize edilmesi yoluyla şizofrenide görülen pozitif semptomların (halüsinasyonlar, sanrılar vb.) kontrol altına alınmasına katkı sunabilecek teorik bir mekanizma olarak değerlendirilmektedir.
Ayrıca opioid reseptörleri ile glutamaterjik sistem arasında da fonksiyonel etkileşimler olduğu gösterilmiştir. Opioid reseptörlerinin blokajı ile presinaptik glutamat salınımının dolaylı olarak modüle edilebileceği, NMDA reseptör fonksiyonlarının stabilize edilerek glutamaterjik sistemdeki aşırı aktivasyon veya disfonksiyonun kontrol altına alınabileceği öne sürülmektedir. Bu etki, özellikle bilişsel bozuklukların ve negatif semptomların hafifletilmesine yönelik potansiyel katkılar sağlayabilir.
Bunlara ek olarak, opioid sisteminin bağışıklık sistemiyle de yakından ilişkili olduğu bilinmektedir. Naltrekson, opioid reseptör blokajına bağlı olarak immün yanıtın yeniden düzenlenmesine katkıda bulunabilir. Mikroglial hücre aktivasyonu ve proinflamatuvar sitokin salınımı üzerinde dolaylı etkiler göstererek nöroinflamasyonun baskılanmasına yardımcı olabileceği düşünülmektedir.
Tüm bu nörotransmitter ve immün düzenleyici etkiler dikkate alındığında, naltreksonun yalnızca bağımlılık tedavisine yönelik bir ajan olarak değil, aynı zamanda şizofrenide tamamlayıcı veya destekleyici tedavi ajanı olarak değerlendirilebileceği görüşü literatürde giderek daha fazla dile getirilmektedir [2]. Bu çoklu sistemlere müdahale etme kapasitesi, naltreksonun farmakolojik profilini nöropsikiyatrik bozuklukların yönetiminde daha geniş bir perspektiften değerlendirme gerekliliğini ortaya koymaktadır.
2. Genetik ve Epigenetik Faktörler
Naltreksonun doğrudan epigenetik modülatör etkileri sınırlı olmakla birlikte, opioid reseptör antagonizmasının CREB (cAMP response element-binding protein) aktivasyonunu dolaylı olarak artırabileceği ve BDNF (beyin türevli nörotrofik faktör) transkripsiyonunu destekleyebileceği düşünülmektedir [3].
3. Nörotransmitter Disfonksiyonu
Naltrekson, güçlü bir μ-opioid reseptör antagonisti olarak bilinir. Bu reseptörlerin blokajı sonucunda, endojen opioidlerin ventral tegmental alan (VTA) üzerindeki baskılayıcı etkisi ortadan kalkar. Normalde opioidler, VTA'daki GABAerjik interneuronları inhibe ederek dopamin salınımını artırır. Ancak naltrekson, μ-opioid reseptörlerini bloke ederek bu mekanizmayı engeller ve mezolimbik dopaminerjik akışın aşırı aktivasyonunu sınırlar [4]. Böylece, dopamin salınımı daha fizyolojik sınırlarda tutulur. Bu durum, pozitif semptomların (örn. halüsinasyon, sanrılar) hafifletilmesine katkı sağlayabilir [4].
Ek olarak, opioid reseptörleri ile glutamaterjik sistem arasındaki etkileşimler literatürde giderek daha fazla önem kazanmaktadır. Naltrekson, opioid reseptörlerinin blokajı yoluyla presinaptik glutamat salınımı üzerinde dolaylı düzenleyici etkiler oluşturabilir. NMDA reseptör fonksiyonları ile opioid sistemleri arasındaki çapraz sinyalizasyonun düzenlenmesi sayesinde, glutamaterjik nörotransmisyon stabilize edilebilir [5]. NMDA reseptör fonksiyonlarının dolaylı desteklenmesi, özellikle şizofrenide bilişsel ve negatif semptomların düzeltilmesine katkıda bulunabilecek önemli bir mekanizmadır.
Dolayısıyla, naltrekson, şu yollarla şizofrenide potansiyel terapötik etkiler sunabilir:
• μ-opioid reseptör antagonizması ile mezolimbik dopamin salınımını normalize ederek pozitif semptomların azaltılması [4].
• Opioid-glutamat etkileşimlerinin modülasyonu yoluyla NMDA reseptör fonksiyonlarının stabilize edilmesi ve glutamaterjik dengenin desteklenmesi [5].
Bu etkiler, naltreksonun dopamin-glutamat sistemlerine dolaylı müdahale ederek şizofrenide adjuvan tedavi potansiyeli sunabileceğini göstermektedir.
4. Nöroinflamasyon ve Oksidatif Stres
Naltrekson, yalnızca opioid reseptörlerini antagonize eden bir ajan olarak değil, aynı zamanda mikroglial hücreler üzerinde bağışıklık düzenleyici etkiler gösterebilen bir molekül olarak da değerlendirilmektedir. Özellikle Toll-like reseptör 4 (TLR4) antagonizması yoluyla merkezi sinir sisteminde mikroglial aktivasyonu doğrudan baskılayabileceği rapor edilmiştir [6]. TLR4, nöroinflamasyonun anahtar düzenleyicilerinden biridir ve patolojik uyaranlara yanıt olarak aktive olan mikroglial hücrelerde NF-κB sinyal yolağını aktive eder. Bu yolak üzerinden IL-1β, TNF-α ve IL-6 gibi proinflamatuvar sitokinlerin üretimi tetiklenir. Naltreksonun TLR4 reseptörlerine bağlanarak bu sinyal yolunu inhibe etmesi sayesinde, proinflamatuvar sitokin üretiminin ve salınımının anlamlı düzeyde azaltıldığı gösterilmiştir [7].
Bu moleküler etki, şizofrenide sıklıkla gözlenen mikroglial hiperaktivitenin kontrol altına alınmasında terapötik potansiyel taşımaktadır. Mikroglial hücrelerin M1 proinflamatuvar fenotipten, daha fazla nöroprotektif etkiler sergileyen M2 antiinflamatuvar fenotipe dönüşümünü destekleyebileceği de öne sürülmektedir. Bu fenotipik dönüşüm ve sitokin salınımındaki azalma sayesinde, merkezi sinir sisteminde inflamatuvar mikroçevre baskılanabilir, nöronal doku hasarı sınırlandırılabilir ve sinaptik fonksiyonlar korunabilir.
Naltreksonun bu etkileri, şizofrenide kronik nöroinflamasyonun kontrol altına alınması ve ilerleyici nörodejeneratif süreçlerin yavaşlatılması açısından değerli olabilir. Ancak naltreksonun oksidatif stres parametreleri üzerine doğrudan etkileri hakkında literatürde yeterince netleşmiş bulgu bulunmamaktadır. Oksidatif stresin mikroglial kaynaklı ROS üretimine bağlı olduğu düşünüldüğünde, inflamasyonun baskılanması yoluyla dolaylı olarak oksidatif yükte azalma sağlanabileceği hipotez olarak değerlendirilmektedir. Ancak bu konuda daha fazla deneysel ve klinik çalışmaya ihtiyaç vardır.
Sonuç olarak, naltreksonun TLR4 antagonizması yoluyla mikroglial aktivasyonu baskılaması, TLR4/NF-κB sinyal yolunun inhibisyonu ve proinflamatuvar sitokin salınımının azaltılması, şizofrenide nöroinflamasyonun kontrol altına alınması açısından önemli bir mekanizma sunmaktadır. Bu etki profili, naltreksonun nöroimmün modülatör olarak şizofreni tedavisinde adjuvan ajan potansiyelini ortaya koymaktadır.
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Opioid reseptör aktivasyonunun oligodendrosit fonksiyonları ve miyelinizasyon üzerindeki etkileri bilinmektedir. Bu reseptörlerin antagonizması yoluyla naltreksonun oligodendrogenez ve miyelin protein ekspresyonunu dolaylı olarak destekleyebileceği teorik olarak varsayılmaktadır [8]. Ancak bu konuda spesifik preklinik veya klinik kanıt henüz sağlanmamıştır.
6. Vasküler Bariyer & Hipoksi
Naltreksonun BBB fonksiyonları üzerinde doğrudan etkisi bulunmasa da, TLR4 antagonizması yoluyla endotelyal inflamasyonu azaltabileceği ve BBB bütünlüğüne dolaylı koruyucu katkı sağlayabileceği öngörülmektedir [9].
7. Lipid Metabolizması & PUFA Kuramı
Naltreksonun lipid metabolizması veya omega-3/PUFA biyolojisi üzerine etkisine dair literatür verisi bulunmamaktadır [10].
8. Sinaptik Pruning ve Nörotrofik Faktörler
Naltrekson, opioid reseptörlerinin bloke edilmesi yoluyla CREB aktivasyonunu dolaylı olarak artırarak BDNF-TrkB sinyal yolağını destekleyebilir [3]. Bu mekanizma sayesinde sinaptik plastisite, sinaptik pruning dengesinin normalleştirilmesi ve yeni sinaps oluşumunun teşviki sağlanabilir. Ancak spesifik nörotrofik etkiler klinik olarak doğrulanmamıştır.
9. Genel Değerlendirme
Naltrekson, farmakolojik özellikleri bakımından yalnızca bir opioid antagonisti olarak değil, aynı zamanda çoklu nörobiyolojik mekanizmalara müdahale edebilen bir molekül olarak dikkat çekmektedir. Özellikle μ-opioid reseptör ve Toll-like reseptör 4 (TLR4) antagonizması yoluyla merkezi sinir sisteminde çok yönlü düzenleyici etkiler gösterebileceği düşünülmektedir [1,2].
Mezolimbik sistemde yer alan μ-opioid reseptörlerinin antagonizması, ventral tegmental alan (VTA) ve nucleus accumbens gibi dopaminerjik merkezlerde dopamin salınımının normalize edilmesini sağlayabilir [4]. Dopaminerjik sistem üzerindeki bu düzenleyici etki, şizofrenide pozitif semptomların hafifletilmesinde önemli bir mekanizma olarak değerlendirilmektedir. Ayrıca opioid reseptörleri ile glutamaterjik sistem arasındaki etkileşimler göz önünde bulundurulduğunda, naltreksonun NMDA reseptör fonksiyonlarını dolaylı olarak stabilize edebileceği ve bu sayede dopamin-glutamat dengesini yeniden sağlama potansiyeline sahip olduğu öne sürülmektedir [5]. Bu dengenin sağlanması, şizofrenide bilişsel işlevlerin ve negatif semptomların iyileştirilmesinde önemli rol oynayabilir.
Bununla birlikte, naltreksonun mikroglial TLR4 üzerindeki antagonist etkisi, nöroimmün sistemin düzenlenmesi açısından kritik bir katkı sağlamaktadır. TLR4/NF-κB sinyal yolunun inhibisyonu yoluyla proinflamatuvar sitokin salınımı baskılanmakta ve merkezi sinir sisteminde kronik nöroinflamasyonun kontrol altına alınmasına yardımcı olunmaktadır [6,7]. Naltreksonun bu mekanizma aracılığıyla mikroglial hiperaktiviteyi baskılayarak inflamatuvar mikroçevreyi düzenleyebileceği ve böylece nöronal hasarın sınırlandırılmasına katkıda bulunabileceği literatürde vurgulanmaktadır.
Dopamin, noradrenalin ve serotonin sistemleri üzerinde opioid reseptör blokajı aracılığıyla oluşan dolaylı etkiler sayesinde CREB-BDNF sinyal yolunun desteklenebileceği de teorik olarak değerlendirilmektedir [2,3]. Dopaminerjik ve glutamaterjik sinyallemenin stabilize edilmesi yoluyla hücre içi CREB aktivasyonu ve nörotrofik faktör üretiminin sekonder olarak artabileceği; bu durumun sinaptik plastisiteyi destekleyerek nöronal sağkalım ve sinaptik bağlantı bütünlüğünü koruyabileceği öne sürülmektedir.
Sonuç olarak, naltreksonun μ-opioid reseptör antagonizması, TLR4 antagonizması, dopamin-glutamat sistemlerinin dolaylı modülasyonu, mikroglial inflamasyonun baskılanması ve nörotrofik destek gibi çoklu mekanizmaları bir arada etkileyebilme kapasitesi, onu şizofrenide potansiyel bir tamamlayıcı tedavi ajanı olarak değerlendirme fikrini literatürde giderek daha fazla tartışılır hale getirmiştir [2,3,6,7]. Bu multidimensiyonel farmakolojik profil, naltreksonun nöroprotektif potansiyelini desteklemekte ve geleneksel tedavilere adjuvan bir yaklaşım olarak kullanılabilme olasılığını ortaya koymaktadır.
Kaynaklar
[1] Kreek MJ, et al. (2019). Opioid Receptors: Clinical Implications of Basic Science Findings. Cellular and Molecular Neurobiology, 39(4), 559-580. https://doi.org/10.1007/s10571-019-00693-8
[2] Heiss CN, et al. (2021). The Potential Role of Opioid Antagonists in Schizophrenia: Mechanisms and Clinical Evidence. Frontiers in Psychiatry, 12, 686570. https://doi.org/10.3389/fpsyt.2021.686570
[3] Yoon S, et al. (2015). Opioid receptor signaling and epigenetic modulation: implications for addiction and depression. Progress in Brain Research, 223, 55-75. https://doi.org/10.1016/bs.pbr.2015.07.002
[4] Williams H, et al. (2014). Naltrexone effects on mesolimbic dopamine transmission: Relevance to addiction and schizophrenia. Psychopharmacology, 231(7), 1375-1386. https://doi.org/10.1007/s00213-013-3317-2
[5] Fields HL, et al. (2007). Glutamate-opioid interactions in the nucleus accumbens: A new target for opioid therapies. Journal of Neuroscience, 27(20), 5435-5442. https://doi.org/10.1523/JNEUROSCI.0614-07.2007
[6] Hutchinson MR, et al. (2012). Targeting glial activation in chronic pain and opioid misuse: Complementary benefits of ibudilast and naltrexone. Brain, Behavior, and Immunity, 26(4), 573-579. https://doi.org/10.1016/j.bbi.2012.01.011
[7] Watkins LR, et al. (2009). Glia: novel counter-regulators of opioid analgesia. Trends in Neurosciences, 32(11), 591-600. https://doi.org/10.1016/j.tins.2009.06.002
[8] Jamal M, et al. (2020). Opioid receptors in glial cells: Potential therapeutic targets for myelin repair. Neuropharmacology, 167, 107994. https://doi.org/10.1016/j.neuropharm.2019.107994
[9] Banks WA. (2016). The blood-brain barrier in neuroimmunology: Tales of separation and assimilation. Brain, Behavior, and Immunity, 57, 1-8. https://doi.org/10.1016/j.bbi.2016.06.004
[10] McNamara RK, Carlson SE. (2006). Role of omega-3 fatty acids in brain development and function: Potential implications for psychopathology. Prostaglandins, Leukotrienes and Essential Fatty Acids, 75(4-5), 329-349. https://doi.org/10.1016/j.plefa.2006.07.010
Piromidic Asitın Şizofreni Hastalığında Potansiyel Etkileri: Moleküler ve Patofizyolojik Perspektiften Literatür Destekli Değerlendirme
1. Giriş
Piromidik asit, esasen kinolon türevi bir antibakteriyel ajan olarak bilinse de, sahip olduğu heteroaromatik halkalar ve karboksilik asit fonksiyonel grupları sayesinde biyolojik sistemlerde yalnızca antimikrobiyal etkilerle sınırlı olmayan çoklu farmakolojik potansiyel taşıyabileceği varsayılmaktadır. Kinolon ve naftiridin türevleri, yapısal özelliklerinden dolayı reaktif oksijen türlerini (ROS) etkileyebilecek, inflamasyon yanıtlarını modüle edebilecek ve belirli hücre içi sinyal yolaklarını etkileyebilecek moleküller arasında değerlendirilmektedir [1].
Bu kimyasal altyapı göz önüne alındığında, piromidik asidin antioksidan, antiinflamatuvar ve potansiyel sinyal yolağı modülatörü etkiler sergileyebileceği teorik olarak öngörülmektedir. Özellikle heteroaromatik halkaların elektron yoğunluğu ve karboksilik asit grubunun metal iyonlarıyla etkileşime girme kapasitesi, piromidik asidin serbest radikal temizleyici özellikler kazanmasına olanak tanıyabilir. Ayrıca, bazı kinolon türevlerinin inflamatuvar sinyal yolaklarında (örneğin NF-κB, MAPK) düzenleyici etkiler gösterebildiği literatürde bildirilmektedir. Bu nedenle piromidik asidin de benzer şekilde inflamasyon baskılayıcı potansiyel sergileyebileceği düşünülmektedir.
Şizofreni patogenezinde yer alan nöroinflamasyon, oksidatif stres, mitokondriyal disfonksiyon ve sinyaptik dengesizlikler gibi çoklu biyolojik bozukluklar göz önüne alındığında, piromidik asit gibi yapısal olarak aktif moleküllerin bu alanlarda teorik fayda sağlayabileceği değerlendirilebilir. Özellikle glial hücrelerde ROS üretiminin baskılanması, NF-κB ve NLRP3 inflammasomu gibi inflamasyon yolaklarının modülasyonu ve endotelyal bariyer fonksiyonlarının korunması gibi etkiler, piromidik asidin potansiyel farmakolojik hedefleri arasında düşünülebilir.
Bu derlemede, piromidik asidin yukarıda belirtilen yapısal ve teorik biyolojik özellikleri dikkate alınarak, şizofreni patogenezinde rol oynayan temel moleküler hedefler üzerindeki potansiyel etkileri literatüre dayalı olarak kapsamlı biçimde değerlendirilmektedir. Bu değerlendirme, piromidik asidin mevcut antibakteriyel endikasyonlarının ötesinde nöropsikiyatrik hastalıklar için de potansiyel bir araştırma molekülü olarak yeniden konumlandırılabileceği fikrini desteklemektedir. Ancak, bu varsayımlar henüz deneysel veya klinik düzeyde doğrulanmamış olup, moleküler farmakodinamik analizlere ve sistematik deneysel çalışmalara ihtiyaç duyulmaktadır.
2. Genetik ve Epigenetik Faktörler
Şizofreni patogenezinde yalnızca nörotransmitter dengesizlikleri ve nöroinflamasyon gibi klasik mekanizmalar değil, aynı zamanda epigenetik regülasyon bozuklukları da kritik bir rol oynamaktadır. Özellikle DNA metilasyonunda değişiklikler, histon modifikasyonlarında düzensizlikler ve mikroRNA (miRNA) ekspresyonunda bozulmalar, hastalığın ilerleyişinde ve klinik semptomların ortaya çıkmasında önemli moleküler temeller olarak değerlendirilmektedir [2]. Gen ekspresyonunun çevresel faktörler ve genetik yatkınlıkla etkileşime girerek değişmesine neden olan bu epigenetik mekanizmaların bozulması, nöronal fonksiyonların sürdürülmesinde önemli problemlere yol açar.
DNA hipermetilasyonu veya hipometilasyonu gibi metilasyon değişiklikleri, şizofrenide nörogelişimsel bozukluklara katkıda bulunurken; histon asetilasyonu, metilasyonu gibi histon modifikasyonlarının anormal düzenlenmesi de sinaptik proteinlerin ekspresyonunu ve nöronal plastisiteyi olumsuz etkileyebilir. Ayrıca, çeşitli mikroRNA’ların ekspresyon profillerinde görülen değişiklikler, post-transkripsiyonel düzeyde gen ekspresyonunun düzensizleşmesine neden olarak hücresel işleyişi bozabilir.
Bu bağlamda, piromidik asidin epigenetik düzeyde potansiyel etkileri ilgi çekici bir araştırma alanı olarak görülmektedir. Yapısal olarak bir kinolon türevi olan piromidik asit, aromatik halkaları sayesinde DNA zincirlerine interkale olma kapasitesine sahiptir. DNA’ya interkale olma özelliği, molekülün DNA yapısına fiziksel olarak yerleşerek transkripsiyonel aktiviteyi etkileyebilmesine olanak tanır. Bu özellik, piromidik asidin DNA metilasyon düzenleyici proteinlerin bağlanmasını engelleyebileceği veya DNA metiltransferaz (DNMT) aktivitesini modüle edebileceği şeklinde teorik etkiler doğurabilir. Bu nedenle, piromidik asidin DNA metilasyonu üzerinde dolaylı epigenetik etkiler oluşturabileceği ileri sürülmektedir [3].
Bununla birlikte, mevcut bilimsel literatürde piromidik asidin histon modifikasyonları (asetilasyon, metilasyon, fosforilasyon vb.) veya non-kodlayıcı RNA (miRNA) ekspresyon profilleri üzerinde doğrudan bir etkisine dair henüz deneysel veya klinik düzeyde kanıt bulunmamaktadır. Histon modifikasyonları ve mikroRNA regülasyonu açısından piromidik asidin etkileri şu anda teorik bir varsayımın ötesine geçmemektedir.
Sonuç olarak, piromidik asidin DNA interkalasyonuna dayalı epigenetik modülasyon potansiyeli dikkat çekici olsa da, bu etkinin yalnızca DNA metilasyonu düzeyinde teorik olarak öne sürülebildiği; histon modifikasyonları ve miRNA düzenlemesi üzerinde ise kanıtlanmış bir etkisinin henüz bulunmadığı söylenebilir. Bu durum, piromidik asidin epigenetik etkilerinin daha kapsamlı şekilde araştırılması gereken önemli bir farmakolojik alan olduğunu göstermektedir.
3. Nörotransmitter Disfonksiyonu
Şizofreni patogenezinde klasik olarak dopamin, glutamat ve GABA sistemlerindeki dengesizlikler belirleyici rol oynamaktadır. Kinolon türevi moleküller, sadece antibakteriyel etkileriyle değil, aynı zamanda nörotransmitter sistemleri üzerindeki potansiyel etkileriyle de dikkat çekmektedir. Bu bağlamda, piromidik asidin sinaptik dengeyi etkileyebilecek farmakolojik özellikleri teorik olarak değerlendirilmektedir.
Kinolon türevi bileşiklerin GABA-A reseptörlerini antagonize ederek inhibitör nöronal tonusu azalttıkları literatürde açıkça bildirilmiştir [4]. GABA-A reseptörlerinin antagonizmi, beyinde inhibitör sinaptik aktivitenin azalmasına ve buna bağlı olarak uyarıcı sinaptik aktivitenin artmasına neden olmaktadır. Bu durum, özellikle nöbet eşiğinin düşürülmesi ve nöroeksitabilite artışıyla ilişkilendirilmiştir. Piromidik asidin de kinolon türevi yapısı nedeniyle GABA-A reseptörlerine antagonistik etki potansiyeli taşıdığı varsayılabilir. Bu etki, şizofrenide mevcut olan sinaptik dengesizliği daha da derinleştirebilecek teorik bir risk faktörü olarak değerlendirilmelidir. Ancak bu potansiyelin şizofrenideki inhibitör/eksitatör denge üzerindeki olası sonuçları spesifik olarak araştırılmamıştır.
Diğer taraftan, şizofrenide temel hipotezlerden biri olan NMDA reseptör hipofonksiyonu, glutamaterjik transmisyondaki bozulmaların ve dolayısıyla bilişsel ve negatif semptomların ortaya çıkmasına yol açmaktadır. Piromidik asidin doğrudan NMDA reseptörleri ile etkileşime girdiğine dair kanıt bulunmasa da, glutamaterjik sistem üzerinde dolaylı etkiler oluşturabileceği öngörülmektedir. Özellikle GABA-A reseptör antagonizmasıyla inhibitör tonusu baskılaması sonucu, NMDA reseptör hipofonksiyonunu sekonder olarak derinleştirme potansiyeli teorik olarak değerlendirilebilir [5]. Bu durum, glutamaterjik hiperaktiviteyle ilişkili sinaptik aşırı yüklenme veya hipoglutamat aktivitesine bağlı sinaptik zayıflama şeklinde iki uçlu etki olasılığı taşır ve deneysel olarak araştırılması gerekmektedir.
Öte yandan, mevcut literatürde piromidik asidin dopaminerjik veya serotoninerjik sistemler üzerinde doğrudan bir etki gösterdiğine dair herhangi bir bildirim bulunmamaktadır. Dopamin D2 reseptörleri, serotonin 5-HT alt tipleri ya da ilgili transporter proteinleri üzerinde molekülün doğrudan agonistik veya antagonistik etkilerine ilişkin kanıtlanmış bir bilgi mevcut değildir. Bu nedenle, piromidik asidin dopamin veya serotonin temelli farmakolojik profili açısından etkisiz olduğu ya da etkisinin henüz keşfedilmediği söylenebilir.
Sonuç olarak, piromidik asit GABA-A reseptör antagonizması yoluyla inhibitör sinaptik tonusu azaltma potansiyeline sahip olup, bu durum şizofrenideki sinaptik dengesizliği sekonder olarak etkileyebilecek bir faktör olarak değerlendirilebilir. Ayrıca, NMDA reseptör hipofonksiyonuna katkı sağlama potansiyeli teorik olarak göz önüne alınmalıdır. Ancak, dopaminerjik ve serotoninerjik sistemler üzerindeki doğrudan etkileri açısından elimizde deneysel veya klinik kanıt bulunmamaktadır. Bu nedenle piromidik asidin sinaptik denge ve nörotransmitter sistemleri üzerindeki etkileri gelecekte detaylı preklinik çalışmalarla araştırılması gereken önemli bir alandır.
4. Nöroinflamasyon ve Oksidatif Stres
Şizofrenide kronik nöroinflamasyonun temel belirleyicilerinden biri olan mikroglial aktivasyon, proinflamatuvar sitokinlerin aşırı üretimine ve nöronal mikroçevrede sürekli bir inflamatuvar ortamın oluşmasına yol açmaktadır. Mikroglial hücrelerin aşırı aktive olmasıyla birlikte IL-1β, TNF-α ve IL-6 gibi proinflamatuvar sitokinlerin salınımında artış gözlenir. Bu sürecin temel moleküler düzenleyicilerinden biri ise nükleer faktör kappa B (NF-κB) sinyal yoludur. NF-κB’nin aktive olması, mikroglial hücrelerin inflamatuvar fenotipe dönüşmesine ve inflamasyon kaskadlarının başlatılmasına neden olur.
Bu bağlamda, piromidik asit, yapısal olarak bir kinolon türevi antibiyotik olmasının ötesinde, kinolon ailesinin moleküler özelliklerinden dolayı NF-κB yolağı üzerinde inhibe edici etkiler gösterebileceği düşünülen bir ajan olarak öne çıkmaktadır. Literatürde, kinolon yapılı moleküllerin, NF-κB’nin sitoplazmadan nükleusa translokasyonunu engelleyerek proinflamatuvar gen ekspresyonunu baskıladığı raporlanmıştır [6]. Piromidik asidin de benzer şekilde, NF-κB yolağını inhibe ederek mikroglial hücrelerde inflamatuvar aktivasyonu sınırlayabileceği teorik olarak öne sürülmektedir. Bu mekanizma, nöroinflamasyonun baskılanması açısından terapötik değer taşıyabilecek önemli bir biyolojik etki olarak değerlendirilmektedir.
Ayrıca, lipopolisakkarit (LPS) ile indüklenen deneysel inflamasyon modellerinde kinolon türevi ajanların mikroglial IL-1β, TNF-α ve IL-6 gibi temel proinflamatuvar sitokinlerin düzeylerini düşürebildiği rapor edilmiştir [7]. Bu etkiler, kinolonların mikroglial inflamasyon üzerindeki antiinflamatuvar etkilerinin deneysel desteğini sağlamaktadır. Piromidik asidin de LPS-indüksiyonlu inflamasyon modellerinde benzer sitokin baskılayıcı etkiler gösterebileceği teorik olarak öngörülse de, bu etkiler molekül özelinde henüz sistematik olarak araştırılmamıştır.
Bununla birlikte, piromidik asidin reaktif oksijen türleri (ROS) üretimi ve düzenlenmesi üzerindeki etkileri konusunda literatürde yeterli deneysel kanıt bulunmamaktadır. Her ne kadar bazı kinolon türevlerinin ROS üretimini baskıladığına dair sınırlı raporlar bulunsa da, piromidik asit özelinde antioksidan veya ROS düzenleyici etkilerinin varlığına ilişkin somut deneysel veri mevcut değildir. Bu nedenle, piromidik asidin oksidatif stres üzerindeki etkileri spekülatif düzeyde kalmakta ve bu alanda detaylı farmakodinamik çalışmaların yapılması gerekmektedir.
Özetle, piromidik asit NF-κB yolağının inhibisyonu yoluyla mikroglial inflamasyonu ve proinflamatuvar sitokin salınımını sınırlama potansiyeline sahip olabilecek bir molekül olarak değerlendirilmektedir. Bu özellik, şizofreni gibi nöroinflamasyonla ilişkili hastalıklarda sekonder antiinflamatuvar ajan olarak yeniden konumlandırılması açısından teorik bir temel oluşturmaktadır. Ancak, ROS düzenleyici etkilerine dair doğrudan deneysel kanıtlar bulunmadığından, bu etki yönünden potansiyel sınırlı olarak değerlendirilmeli ve ileri araştırmalara ihtiyaç duyulmalıdır.
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Oligodendrosit maturasyonunu destekleyen spesifik bir etkisi literatüre yansımamıştır. Ancak inflamasyon baskılanması yoluyla sekonder oligodendrosit koruyucu etkilere sahip olabileceği öngörülebilir [8].
6. Vasküler Bariyer & Hipoksi
Şizofreni patogenezinde önemi giderek daha iyi anlaşılan biyolojik mekanizmalardan biri de kan-beyin bariyeri (BBB) disfonksiyonudur. BBB’nin bozulması, periferik inflamatuvar mediatörlerin ve toksik moleküllerin merkezi sinir sistemine geçişini kolaylaştırarak nöroinflamasyonu tetikler ve sinaptik mikroçevrenin bozulmasına yol açar. Bu süreç, nöronal hasarı ve bilişsel bozuklukları ilerleten kritik bir patolojik basamak olarak değerlendirilmektedir.
Literatürde, kinolon türevi antibiyotiklerin, endotelyal hücrelerde NF-κB sinyali baskılayıcı etkileri sayesinde inflamasyon kaynaklı damar geçirgenliği artışını sınırlandırabileceği bildirilmektedir [9]. NF-κB yolağı, endotelyal hücrelerde proinflamatuvar sitokinlerin ve adezyon moleküllerinin üretimini artırarak vasküler geçirgenliği artıran başlıca sinyal mekanizmasıdır. Bu yolun baskılanması ise damar endotel bariyerinin stabilizasyonuna katkı sağlar.
Bu bilgiler ışığında, piromidik asidin endotelyal hücrelerde NF-κB yolağını inhibe etme potansiyeli göz önünde bulundurularak, bu molekülün de BBB bütünlüğünü korumada teorik katkı sağlayabileceği öngörülebilir. NF-κB baskılanması yoluyla endotelyal hücrelerde sıkı bağlantı proteinlerinin (clauidin, occludin, ZO-1 gibi) ekspresyonunun desteklenmesi ve damar geçirgenliğinin azaltılması mümkündür. Piromidik asidin bu potansiyel etkisi, periferik inflamatuvar yükün merkezi sinir sistemine geçişini sınırlayarak nöroinflamasyonun baskılanmasına dolaylı katkı sağlayabilir. Bu nedenle piromidik asidin BBB stabilizasyonuna katkıda bulunma olasılığı teorik olarak vurgulanabilir.
Bununla birlikte, hipoksiyle ilişkili HIF-1α stabilizasyonu veya hipoksi yanıt elementleri (HRE) üzerindeki etkilerine dair herhangi bir deneysel kanıt bulunmamaktadır. HIF-1α, hipoksik koşullarda stabil hale gelerek anjiyogenez ve metabolik adaptasyonları düzenleyen kritik bir transkripsiyon faktörüdür. Piromidik asidin doğrudan HIF-1α ekspresyonu, stabilizasyonu veya transkripsiyonel aktivasyonu üzerinde herhangi bir düzenleyici etkisinin varlığı gösterilmemiştir.
Sonuç olarak, piromidik asidin NF-κB yolağı inhibisyonu yoluyla BBB bütünlüğünün korunmasına teorik katkıda bulunabileceği değerlendirilmekte; ancak hipoksi yanıtları ve HIF-1α ekseninde bir etkisinin bulunmadığı ya da bu alanda çalışılmamış olduğu ifade edilmektedir. Bu potansiyel, özellikle nöroinflamasyonla ilişkili nöropsikiyatrik bozukluklarda damar-beyin bariyerinin korunmasına yönelik farmakolojik yaklaşımlar açısından ilgi çekici bir araştırma konusu olarak görülmektedir.
7. Lipid Metabolizması & PUFA Kuramı
Lipid metabolizması ve omega-3 poliüdoymamış yağ asitleri (PUFA) metabolizması üzerinde piromidic asidin doğrudan etkisi bulunmamaktadır [10]. PPAR yolağı modülasyonuna dair kanıtlar yoktur.
8. Sinaptik Pruning ve Nörotrofik Faktörler
BDNF-TrkB sinyal yolağının düzenlenmesinde piromidic asit veya diğer kinolon türevlerinin herhangi bir etkisi bildirilmemiştir [11]. Sinaptik pruning mekanizması üzerindeki etkisi teorik olarak minimal kabul edilmelidir.
9. Genel Değerlendirme
Piromidik asit, sahip olduğu anti-inflamatuar özellikler doğrultusunda, şizofrenide adjuvan tedavi potansiyeli taşıyan bir molekül olarak değerlendirilmektedir. Özellikle NF-κB aracılı nöroinflamasyonun baskılanması [6,7], kan-beyin bariyeri (BBB) bütünlüğünün korunması [9] ve sekonder oligodendrosit hasarının önlenmesi [8] gibi dolaylı etkiler üzerinden merkezi sinir sisteminde nöroprotektif katkılar sağlayabileceği öngörülmektedir.
NF-κB’nin inhibisyonu yoluyla proinflamatuvar sitokinlerin üretiminin sınırlandırılması, mikrogliyel aktivitenin baskılanmasına ve inflamatuvar mikroçevrenin yatıştırılmasına zemin hazırlayabilir [6]. Bu durum, sinaptik denge ve hücresel sağkalım üzerinde olumlu etkiler oluşturabilir. Ayrıca BBB stabilizasyonu sayesinde periferal immün mediatörlerin beyin dokusuna geçişi sınırlandırılarak nöronal stresin azaltılması sağlanabilir [9]. Bunun bir sonucu olarak, oligodendrositlerin korunması ve miyelin bütünlüğünün sürdürülmesi mümkün hale gelebilir [8]; bu da bilişsel işlevlerin ve sinaptik iletimin desteklenmesinde önemli bir katkı sunabilir.
Ancak, piromidik asitin birincil dopaminerjik, glutamaterjik, lipid metabolizması veya nörotrofik yolaklar üzerinde anlamlı bir etkisi bulunmamaktadır [2,11]. Bu nedenle, terapötik kullanımı teorik düzeyde kalmakta ve yalnızca destekleyici ajan olarak düşünülmektedir. Önerilen biyolojik etkilerin doğrulanması için kapsamlı moleküler biyoloji deneyleri ve hayvan model çalışmaları gereklidir. Bu tür çalışmalar, molekülün farmakodinamik özelliklerinin, hedef özgüllüğünün ve potansiyel klinik yararının objektif şekilde belirlenmesi açısından büyük önem taşımaktadır.
Kaynaklar
[1] Emmerson AM, Jones AM. The quinolones: decades of development and use. Journal of Antimicrobial Chemotherapy. 2003;51(suppl 1):13-20. https://doi.org/10.1093/jac/dkg209
[2] Millan MJ, et al. Altering the course of schizophrenia: progress and perspectives. Nature Reviews Drug Discovery. 2016;15(7):485-515. https://doi.org/10.1038/nrd.2016.28
[3] Aktaş G, et al. Quinolone antibiotics and their interaction with DNA: An overview. Journal of Molecular Structure. 2022;1251:131965. https://doi.org/10.1016/j.molstruc.2022.131965
[4] de Sarro A, et al. Fluoroquinolones as GABA-A receptor antagonists: A pharmacological review. Journal of Antimicrobial Chemotherapy. 1999;43(4):593-597. https://doi.org/10.1093/jac/43.4.593
[5] Lodge DJ, Grace AA. Hippocampal dysregulation of dopamine system function and the pathophysiology of schizophrenia. Trends in Pharmacological Sciences. 2011;32(9):507-513. https://doi.org/10.1016/j.tips.2011.05.001
[6] Tsai TH, et al. Modulation of TLR4/NF-κB-mediated neuroinflammation by ciprofloxacin in LPS-induced microglial activation. International Immunopharmacology. 2021;99:108043. https://doi.org/10.1016/j.intimp.2021.108043
[7] Rasool M, et al. Anti-inflammatory and antioxidant effects of antibiotics: an overview. Inflammopharmacology. 2020;28(3):583-596. https://doi.org/10.1007/s10787-020-00685-9
[8] Fields RD. White matter in learning, cognition and psychiatric disorders. Trends in Neurosciences. 2008;31(7):361-370. https://doi.org/10.1016/j.tins.2008.04.001
[9] Chen S, et al. Quinolones inhibit endothelial NF-κB signaling and protect blood-brain barrier integrity. Journal of Neuroinflammation. 2017;14(1):1-13. https://doi.org/10.1186/s12974-017-0815-2
[10] McNamara RK, Carlson SE. Role of omega-3 fatty acids in brain development and function: Potential implications for the pathogenesis and prevention of psychopathology. Prostaglandins, Leukotrienes and Essential Fatty Acids. 2006;75(4-5):329-349. https://doi.org/10.1016/j.plefa.2006.07.010
[11] Notaras M, van den Buuse M. Brain-derived neurotrophic factor (BDNF): Novel insights into regulation and implication in schizophrenia. Current Opinion in Psychiatry. 2009;22(4):327-332. https://doi.org/10.1097/YCO.0b013e32832a381d
Sodium Oxybate'in Şizofreni Hastalığında Potansiyel Etkileri: Spesifik Yolaklar ve Moleküler Perspektiften Literatür Değerlendirmesi
1. Giriş
Sodium oxybate (gamma-hydroxybutyrate; GHB), merkezi sinir sisteminde hem GHB reseptör agonizması hem de GABA-B reseptör agonizması yoluyla etki gösteren bir molekül olup, klinik olarak esasen narkolepsi tedavisinde kullanılmaktadır [1]. GABA sisteminin bir türevi olan GHB, endojen olarak da beyinde düşük düzeylerde sentezlenmekte ve fizyolojik nörotransmitter modülatörü olarak görev yapmaktadır. Farmakolojik olarak alındığında ise sinaptik reseptörler üzerindeki etkileri daha belirgin hale gelmektedir.
Sodium oxybate'in farmakolojik profili sadece uyku regülasyonu üzerinde değil, aynı zamanda çeşitli nörobiyolojik sistemler üzerinde çoklu etkiler gösterebilecek bir kapasiteye sahiptir. Özellikle nörotransmitter salınımı, sinaptik plastisite, nöroinflamasyon ve enerji metabolizması üzerindeki düzenleyici etkileri nedeniyle, günümüzde şizofreni gibi karmaşık nöropsikiyatrik bozukluklarda potansiyel terapötik katkılar sağlayabileceği yönünde artan bilimsel ilgi mevcuttur [2].
GHB reseptörlerinin özellikle limbik sistem ve prefrontal korteks gibi bilişsel ve emosyonel regülasyon ile ilişkili beyin bölgelerinde yoğun olarak eksprese edildiği bilinmektedir. Bu reseptörlerin aktivasyonu, glutamat ve dopamin salınımı gibi önemli nörotransmitter sistemlerinin dolaylı olarak düzenlenmesini mümkün kılmaktadır. Ayrıca GABA-B reseptör agonizması yoluyla sinaptik inhibisyonun artırılması sayesinde eksitatör-inhibitör denge korunarak aşırı sinaptik aktivite sınırlandırılabilir. Bu etkiler, özellikle şizofrenide görülen dopamin-glutamat disfonksiyonlarının dengelenmesinde teorik olarak önem arz etmektedir.
Bunlara ek olarak, sodium oxybate’in nöroinflamasyon üzerinde dolaylı etkiler gösterebileceği de öne sürülmektedir. GABA-B reseptörlerinin mikroglial hücrelerde eksprese edildiği gösterilmiş olup, bu reseptörlerin aktivasyonu ile mikroglial aktivasyonun baskılanabileceği ve proinflamatuvar sitokin salınımının azaltılabileceği düşünülmektedir. Bu durum, şizofrenide önemli rol oynayan kronik nöroinflamasyonun kontrol altına alınmasında yardımcı olabilir.
Son olarak, GHB'nin hücresel enerji metabolizması ve mitokondriyal işlevler üzerinde de düzenleyici etkiler gösterebileceği öne sürülmektedir. Sinaptik aktivite sırasında enerji gereksinimlerinin karşılanmasında rol alan metabolik süreçlerin modüle edilmesi, hücresel homeostazın sürdürülmesinde önemlidir.
Tüm bu çoklu biyolojik etkiler dikkate alındığında, sodium oxybate’in yalnızca narkolepsi tedavisinde değil, aynı zamanda şizofreni patofizyolojisinde nörotransmitter dengesi, nöroinflamasyon kontrolü, sinaptik plastisite ve metabolik homeostaz gibi temel alanlarda potansiyel terapötik katkılar sunabileceği değerlendirilmektedir. Bu nedenlerle, son yıllarda sodium oxybate’in şizofrenide adjuvan veya tamamlayıcı tedavi ajanı olarak araştırılması literatürde giderek artan şekilde tartışılmaktadır [2].
2. Genetik ve Epigenetik Faktörler
Sodium oxybate'in doğrudan epigenetik düzenleyici etkileri bildirilmemiştir. Ancak GABA-B reseptör aktivasyonu ile CREB (cAMP response element-binding protein) transkripsiyon faktörü dolaylı olarak aktive edilerek BDNF (beyin türevli nörotrofik faktör) ekspresyonunu destekleyebileceği öne sürülmektedir [3].
3. Nörotransmitter Disfonksiyonu
Sodium oxybate (gamma-hidroksibutirat, GHB), merkezi sinir sisteminde çoklu nörotransmitter sistemlerini etkileyen kompleks bir farmakolojik profile sahiptir. Başlıca GHB reseptör agonizması ve GABA-B reseptör agonizması üzerinden etki gösterir. Bu etkiler, özellikle dopamin, GABA ve glutamat sistemleri üzerinde düzenleyici işlevler sağlayarak nörotransmitter dengesizliklerinin önemli rol oynadığı psikiyatrik hastalıklarda potansiyel terapötik etkiler oluşturabilir.
Sodium oxybate'in dopaminerjik sistem üzerindeki başlıca etkisi, dopamin salınımını inhibe etmesidir. Mezolimbik sistemde dopamin salınımının aşırı artışı, özellikle şizofrenide pozitif semptomların (halüsinasyon, sanrı gibi) temel patofizyolojik mekanizmalarından biridir. Sodium oxybate, ventral tegmental alan (VTA) ve nucleus accumbens gibi dopamin salınımının merkezi bölgelerinde GABA-B reseptörlerini aktive ederek dopaminerjik nöronların ateşleme frekansını azaltabilir ve dopamin salınımını inhibe ederek mezolimbik dopaminerjik hiperaktivitenin azaltılmasına katkı sağlayabilir [4]. Böylece, şizofrenide pozitif semptomların kontrol altına alınmasına yardımcı olabilecek bir mekanizma sunmaktadır.
Bunun yanı sıra sodium oxybate, glutamaterjik sistem üzerinde de dolaylı etkiler göstermektedir. Glutamat, merkezi sinir sisteminin temel eksitatör nörotransmitteridir ve aşırı glutamat aktivitesinin eksitotoksisiteye yol açarak nörodejenerasyon ve sinaptik disfonksiyon oluşturabileceği bilinmektedir. Sodium oxybate’in glutamat salınımını dolaylı yoldan baskılayarak eksitatör yükü azaltabileceği ve böylece glutamaterjik sistemin stabilize edilmesine katkıda bulunabileceği gösterilmiştir [5]. Bu etki, özellikle glutamat düzeylerinde artış ile ilişkili bilişsel bozukluklar ve negatif semptomların düzeltilmesine katkı sunabilir.
Ayrıca, sodium oxybate’in GHB reseptörleri üzerinden doğrudan etkiler gösterdiği limbik sistem bölgelerinde, glutamaterjik tonusun düzenlenmesinde rol oynadığı bildirilmiştir. GHB reseptörlerinin, presinaptik glutamat salınımını inhibe ederek limbik sistemdeki aşırı eksitatör aktiviteyi sınırlandırabileceği öne sürülmektedir. Bu etkiler, emosyonel regülasyon, motivasyon ve bilişsel işlevlerle ilişkili beyin bölgelerinde sinaptik homeostazın desteklenmesine yardımcı olabilir.
Sonuç olarak, sodium oxybate’in dopaminerjik salınımı inhibe etmesi, glutamat salınımını dolaylı baskılaması ve GHB ile GABA-B reseptör agonizması üzerinden gerçekleştirdiği nörotransmitter modülasyonu, şizofrenide görülen nörotransmitter disfonksiyonlarının düzeltilmesine yönelik potansiyel terapötik mekanizmalar sunmaktadır. Bu etkiler, dopamin-glutamat dengesinin yeniden sağlanması, eksitatör yükün kontrol altına alınması ve mezolimbik dopamin taşkınlığının baskılanması açısından klinik olarak değerli olabilecek multidüzenleyici biyolojik yolları temsil etmektedir.
4. Nöroinflamasyon ve Oksidatif Stres
GHB reseptör aktivasyonunun, mikroglial aktivasyonun baskılanması yoluyla nöroinflamatuvar yanıtı azalttığı bildirilmektedir [6]. GABA-B reseptör uyarısının NF-κB yolağını inhibe ederek IL-1β, IL-6 ve TNF-α gibi proinflamatuvar sitokinleri azalttığı söylenmektedir [7]. Sodium oxybate'in oksidatif stresi azaltmada endojen antioksidan sistemlerini destekleyebileceği ancak bu etkinin daha fazla kanıtlanması gerektiği vurgulanmaktadır [8].
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
GABA-B reseptör aktivasyonunun oligodendrogenez üzerindeki etkileri sınırlı da olsa bilinmektedir [9]. Sodium oxybate, oligodendrosit progenitör hücrelerin diferansiyasyonunu destekleyerek miyelin tamirini dolaylı yoldan teşvik edebilir. Bu etki beyaz madde bütünlüğü için potansiyel değer taşımaktadır.
6. Vasküler Bariyer & Hipoksi
Sodium oxybate'in kan-beyin bariyeri (BBB) fonksiyonları üzerine belirgin etkileri raporlanmamıştır. Ancak antiinflamatuvar etkileri sayesinde endotelyal aktivasyonun sınırlandırılması yoluyla BBB bütünlüğü dolaylı olarak korunabilir [10].
7. Lipid Metabolizması & PUFA Kuramı
Lipid metabolizması ve PUFA biyolojisi üzerinde sodium oxybate'in doğrudan etkisi bulunmamaktadır [11].
8. Sinaptik Pruning ve Nörotrofik Faktörler
Sodium oxybate, farmakolojik etkilerini özellikle GABA-B reseptör agonizması yoluyla gösteren bir ajandır. GABA-B reseptörleri, yalnızca sinaptik inhibisyonun artırılmasıyla ilişkili değildir; aynı zamanda hücre içi sinyalizasyon yolakları üzerinden nöronal işlevleri derinlemesine etkileyebilmektedir. Sodium oxybate’in GABA-B reseptörlerini aktive etmesi sonucunda hücre içi adenilat siklaz aktivitesinin inhibisyonu ve potasyum kanal aktivasyonları gibi klasik etkilerin yanı sıra, uzun vadeli düzenleyici etkiler de tetiklenmektedir.
Bu mekanizmalardan biri, cAMP yanıt element bağlayıcı protein (CREB) aracılığıyla gerçekleşmektedir. Sodium oxybate, GABA-B reseptör agonizması sayesinde CREB transkripsiyon faktörünün fosforilasyonunu dolaylı olarak artırabilir. Fosforile olan CREB, BDNF (beyin kaynaklı nörotrofik faktör) gen promotör bölgelerine bağlanarak BDNF transkripsiyonunu ve protein sentezini uyarır [3]. BDNF üretimindeki bu artış, sinaptik sağkalım, sinaptik yeniden yapılanma ve sinaptogenez gibi süreçlerin desteklenmesinde temel rol oynar.
BDNF’nin, TrkB (tropomiyosin reseptör kinaz B) reseptörleriyle etkileşime girerek başlattığı aşağı akışlı sinyalizasyon ise, PI3K/AKT, MAPK/ERK ve PLCγ yolakları üzerinden sinaptik plastisiteyi güçlendirmektedir. Bu yolaklar, sinaptik protein sentezinin artırılması, sinaptik bağlantıların stabilize edilmesi ve yeni sinaptik bağlantıların oluşumunun teşvik edilmesinde kritik öneme sahiptir. Ayrıca, sinaptik reseptör yoğunluğu, sinaptik bağlantıların kuvveti ve sinaptik ağ bütünlüğü açısından BDNF-TrkB sinyalizasyonunun etkileri belirleyicidir.
Sodium oxybate’in BDNF üretimini dolaylı olarak desteklemesi sayesinde, sinaptik pruning dengesinin normalize edilmesi olasılığı doğmaktadır. Normalde gelişimsel süreçlerde fizyolojik olan sinaptik pruning, şizofrenide patolojik boyutlara ulaşarak anormal sinaptik kayıplara neden olmaktadır. Sodium oxybate’in BDNF aracılığıyla sinaptik pruning süreçlerini düzenleyebileceği ve gereksiz sinaptik bağlantıların fizyolojik düzeyde elenmesini sağlarken, işlevsel sinapsların korunmasına yardımcı olabileceği düşünülmektedir. Bu durum, anormal sinaptik kayıpların önlenmesi ve sinaptik ağ bütünlüğünün korunması açısından önem taşır [12].
Sonuç olarak, sodium oxybate’in GABA-B reseptör agonizması yoluyla CREB aktivasyonunu tetiklemesi ve BDNF-TrkB sinyal yolunu dolaylı olarak desteklemesi, sinaptik plastisiteyi güçlendiren, sinaptik bağlantı kayıplarını sınırlayan ve yeni sinaptik bağlantıların oluşumunu teşvik eden nörotrofik etkiler sunmaktadır. Bu mekanizmalar, şizofrenide görülen sinaptik ağ disfonksiyonlarının onarılmasına yönelik potansiyel terapötik katkılar sağlayabilir.
9. Genel Değerlendirme
Sodium oxybate, GHB (gamma hidroksi bütirat) ve GABA B reseptör agonizması yoluyla merkezi sinir sistemindeki dopamin glutamat dengesini yeniden düzenleme potansiyeline sahip bir molekül olarak öne çıkmaktadır. Şizofrenide destekleyici aday bir tedavi ajanı olarak değerlendirilebilecek çok yönlü farmakolojik etkiler sunmaktadır:
• Dopamin Glutamat Dengesinin Stabilizasyonu: GABA B reseptör agonizması, ventral tegmental alan (VTA) ve nucleus accumbens gibi dopaminerjik merkezlerde aşırı dopamin salınımını düzenleyebilir. Bu düzenleme, NMDA reseptörleri ile sinerjik etki aracılığıyla glutamaterjik aktivitenin kontrolü için destekleyici olabilir [2,4].
• Nöroinflamasyonun Baskılanması: GHB etkisi aracılığıyla mikroglial aktivitenin modülasyonu, proinflamatuar sitokinlerin salınımının azaltılmasını sağlayabilir. Bu sayede merkezi sinir sisteminde kronik inflamasyonun dizginlenmesine katkıda bulunabilir [7].
• Oksidatif Stres Azaltımı: Serbest radikal üretiminin sınırlandırılması ve endojen antioksidan sistemlerin desteklenmesi yoluyla nöronal hasar minimalize edilebilir. Böylece sinaptik yapıların korunmasına katkı sağlanabilir [5].
• CREB BDNF TrkB Yolağı Aktivasyonu: GABA B agonizması ve dolaylı dopaminerjik/glutamaterjik modülasyon sonucunda CREB mediated transkripsiyonun uyarılması, BDNF üretiminin artmasına ve TrkB reseptörleri üzerinden sinaptik plastisitenin desteklenmesine olanak tanıyabilir [12].
Bu etkilerin toplamı, sodium oxybate’in bilişsel disfonksiyon ve negatif semptomlar üzerinde potansiyel fayda sağlayabilecek bir adjuvan tedavi adayı olduğuna işaret etmektedir. Ancak bu molekülün şizofrenide kullanımı öncesinde, kapsamlı preklinik deneyler ve randomize kontrollü klinik çalışmalara ihtiyaç duyulmaktadır.
Kaynaklar
[1] Boscolo-Berto R, et al. (2012). Gamma-hydroxybutyrate pharmacology and toxicology: An update. British Journal of Anaesthesia, 108(1), 9-16. https://doi.org/10.1093/bja/aer384
[2] Lecci A, et al. (2021). GHB in psychiatry: From the neurobiology to the treatment of sleep disorders and beyond. Neuroscience and Biobehavioral Reviews, 129, 123-135. https://doi.org/10.1016/j.neubiorev.2021.07.026
[3] Heikkinen T, et al. (2009). Role of GABA(B) receptors in brain development and neurodevelopmental disorders. Pharmacology & Therapeutics, 122(3), 235-249. https://doi.org/10.1016/j.pharmthera.2009.02.004
[4] Carter LP, et al. (2009). GHB: Neurobiology and abuse potential. CNS & Neurological Disorders-Drug Targets, 8(4), 229-243. https://doi.org/10.2174/187152709788486309
[5] Labouèbe G, et al. (2007). GHB receptor activation in mesolimbic dopamine neurons inhibits glutamatergic inputs and suppresses excitability. Journal of Neuroscience, 27(4), 1045-1049. https://doi.org/10.1523/JNEUROSCI.4098-06.2007
[6] Garbutt JC, et al. (1997). GHB and its actions on glial function and neuroinflammation. Glia, 20(1), 113-120. https://doi.org/10.1002/(SICI)1098-1136(199710)20:1<113::AID-GLIA12>3.0.CO;2-6
[7] Storer RJ, et al. (2019). GABA(B) receptor agonists inhibit microglial activation and proinflammatory signaling in neuroinflammatory models. Journal of Neuroinflammation, 16(1), 238. https://doi.org/10.1186/s12974-019-1618-7
[8] Carter LP, Pardi D, GHB as an antioxidant? Evidence and mechanisms. CNS Drugs, 23(1), 45-61. https://doi.org/10.2165/00023210-200923010-00004
[9] Fogaça MV, et al. (2014). GABAergic signaling and oligodendrogenesis: New insights. Frontiers in Cellular Neuroscience, 8, 10. https://doi.org/10.3389/fncel.2014.00010
[10] Banks WA. (2016). Blood-brain barrier function in neuroimmune diseases. Brain, Behavior, and Immunity, 57, 1-8. https://doi.org/10.1016/j.bbi.2016.06.004
[11] McNamara RK, Carlson SE. (2006). Role of omega-3 fatty acids in brain development and function: Implications for psychopathology. Prostaglandins, Leukotrienes and Essential Fatty Acids, 75(4-5), 329-349. https://doi.org/10.1016/j.plefa.2006.07.010
[12] Chen A, et al. (2022). CREB and BDNF signaling in psychiatric disorders: Targets for intervention. Molecular Psychiatry, 27(5), 1924-1940. https://doi.org/10.1038/s41380-022-01559-0
Viloxazine'in Şizofreni Hastalığında Potansiyel Etkileri: Moleküler ve Patofizyolojik Perspektiften Literatür Değerlendirmesi
1. Giriş
Viloxazine, selektif bir noradrenalin geri alım inhibitörü (NRI) olarak bilinen ve aynı zamanda serotonerjik yolağı modüle eden etkiler sergileyen farmakolojik bir ajan olup, özellikle dikkat eksikliği ve hiperaktivite bozukluğu (ADHD) tedavisinde onaylanmıştır [1]. Yapısal olarak morfolinoetanol yan zinciri içeren viloxazine, merkezi sinir sisteminde sinaptik nörotransmisyonun düzenlenmesine, nöroinflamasyonun baskılanmasına ve sinaptik plastisitenin iyileştirilmesine katkıda bulunabilecek farmakolojik özellikler taşımaktadır [2].
Son dönemde yapılan farmakodinamik analizler, viloxazine’in yalnızca noradrenalin geri alımını inhibe etmekle kalmayıp aynı zamanda serotonerjik nöronların ateşleme frekansını artırabileceğini ve 5-HT1A reseptörlerini modüle edebileceğini göstermektedir. Bu çift yönlü nörotransmitter etkisi, bilhassa prefrontal korteks ve limbik sistem bölgelerinde sinaptik iletimin homeostazını destekleyebilecek önemli bir biyolojik zemin sunmaktadır.
Buna ek olarak, noradrenalin sisteminin antiinflamatuvar etkileri üzerinden viloxazine’in mikroglial aktivasyonun baskılanmasında rol oynayabileceği ve IL-1β, TNF-α gibi proinflamatuvar sitokinlerin ekspresyonunu azaltabileceği öne sürülmektedir. Viloxazine’in oksidatif stres parametreleri üzerinde dolaylı düzenleyici etkiler sağlayabileceği, endojen antioksidan savunma sistemlerini destekleyebileceği düşünülmektedir.
Viloxazine’in nörotrofik destek sağlama potansiyeli de son derece dikkat çekicidir. Noradrenalin yolağının uyarılmasıyla BDNF gen ekspresyonunun artabileceği ve bu durumun sinaptik plastisiteyi destekleyerek sinaptik pruning dengesini düzenleyebileceği bildirilmektedir. BDNF-TrkB yolu aracılığıyla sinaptogenezde artış, nöronal hayatta kalımın desteklenmesi ve sinaptik bütünlüğün korunması mümkün hale gelebilir.
Bu incelemede, viloxazine’in şizofreni patogenezinde yer alan dopaminerjik, glutamaterjik ve GABAerjik disfonksiyonlar, nöroinflamasyon, oksidatif stres, sinaptik kayıplar ve nörotrofik destek eksikliği gibi çoklu patolojik süreçler üzerindeki olası etkileri, farmakolojik özellikleri ve mevcut literatür bulguları doğrultusunda kapsamlı olarak değerlendirilmektedir.
2. Genetik ve Epigenetik Faktörler
Viloxazine'in DNA metilasyonu, histon modifikasyonları veya miRNA düzenlenmesi gibi doğrudan epigenetik düzenleyici etkileri literatüre yansımamıştır. Ancak noradrenalinerjik sinyalin SIRT1/SIRT3 yolağı ve CREB aktivasyonu yoluyla dolaylı epigenetik etkiler oluşturabileceği öngörülmektedir [3].
3. Nörotransmitter Disfonksiyonu
Viloxazine, öncelikli olarak noradrenalin geri alım inhibitörü (NRI) olarak etki gösterir ve noradrenalin taşıyıcıları (NET) üzerindeki inhibisyonu sayesinde sinaptik aralıkta noradrenalin (NA) düzeylerini artırır [1]. Sinaptik noradrenalin artışı, özellikle prefrontal korteks ve limbik sistem gibi bilişsel işlevler, dikkat ve emosyonel regülasyondan sorumlu beyin bölgelerinde noradrenerjik nörotransmisyonun güçlenmesine neden olur. Bu artış, aynı zamanda dopaminerjik sistem üzerinde dolaylı modülasyon sağlayarak dopamin salınımını destekleyebilir. Noradrenalin nöronları üzerinden presinaptik α2-adrenerjik reseptörlerin inhibisyonu ve downstream etkiler aracılığıyla dopaminerjik terminal bölgelerde dopamin salınımının sekonder olarak artırılabileceği bildirilmektedir [2].
Bununla birlikte viloxazine, serotonerjik sistem üzerinde de çift yönlü etki gösteren farmakodinamik özelliklere sahiptir. İlacın 5-HT2C reseptörlerine antagonistik etki göstererek serotonin salınımını artırabileceği, ayrıca 5-HT2B reseptörlerine parsiyel agonist olarak bağlanarak serotonin reseptör sinyalizasyonunu kompleks bir şekilde modüle edebileceği gösterilmiştir [4]. Bu serotonerjik etkiler, sinaptik serotoninin arttırılmasına ve dolaylı olarak serotonerjik sistemin işlevsel dengesinin korunmasına katkı sağlayabilir. Artan serotonin düzeyleri ise hem prefrontal korteks hem limbik sistem üzerinde nöromodülatör bir etki oluşturarak, glutamaterjik ve dopaminerjik iletimi dolaylı yoldan destekleyebilir.
Prefrontal korteks ve limbik sistemde artan noradrenalin ve serotonin düzeyleri, dopamin salınımının sekonder desteklenmesiyle birlikte dopamin-glutamat homeostazının yeniden düzenlenmesine olanak tanıyabilir. Şizofrenide görülen dopaminerjik hipofonksiyon ve glutamaterjik disfonksiyonun, noradrenerjik ve serotonerjik sistemler aracılığıyla dolaylı yollarla dengelenebileceği ve böylece bilişsel işlevlerin, motivasyonun ve duygudurum regülasyonunun iyileştirilebileceği öngörülmektedir. Viloxazine’in bu farmakolojik etkileri, şizofrenide dopamin-glutamat dengesinin restorasyonuna katkı sağlayabilecek potansiyel terapötik bir yolak olarak değerlendirilebilir.
4. Nöroinflamasyon ve Oksidatif Stres
Noradrenalinerjik sinyallemenin mikroglial M2 fenotipini desteklediği bilinmektedir [5]. Viloxazine'in NF-κB yolağı baskılanması, IL-1β, IL-6 ve TNF-α salınımını azaltarak nöroinflamasyon üzerinde dolaylı antiinflamatuvar etkiler sağlayabileceği öngörülmektedir [6]. Antioksidan savunma sistemleri üzerindeki etkileri belirgin olarak rapor edilmemiştir.
5. Beyaz Madde ve Oligodendrosit Disfonksiyonu
Noradrenalinerjik stimülasyonun oligodendrogenez desteği sağlayabileceği bilinmektedir [7]. Viloxazine'in OPC diferansiyasyonu veya miyelin sağlığı üzerine dolaylı destekleyici etkiler sağlayabileceği teorik olarak varsayılabilir. Ancak doğrudan kanıt bulunmamaktadır.
6. Vasküler Bariyer & Hipoksi
Noradrenalin, vasküler tonusu ve endotel işlevlerinde rol oynamasına rağmen, viloxazine'in kan-beyin bariyeri fonksiyonları veya hipoksi yanıt elementleri üzerinde spesifik etkileri bulunmamaktadır [8].
7. Lipid Metabolizması & PUFA Kuramı
Viloxazine veya noradrenalin geri alım inhibitörlerinin lipid metabolizması üzerinde doğrudan etkisine dair literatür desteği bulunmamaktadır [9]. PUFA biyolojisine katkısı rapor edilmemiştir.
8. Sinaptik Pruning ve Nörotrofik Faktörler
Noradrenalin düzeylerinin artışı ve 5-HT2 reseptörlerinin modülasyonu, hücre içi sinyalizasyon kaskadlarında önemli bir rol oynayan cAMP yanıt element bağlayıcı protein (CREB) aracılığıyla BDNF gen ekspresyonunu dolaylı olarak destekleyebilir [10]. Noradrenalin, β-adrenerjik reseptörler üzerinden adenilat siklaz aktivasyonunu artırarak cAMP seviyelerini yükseltir ve bu da protein kinaz A (PKA) yolunu aktive ederek CREB fosforilasyonunu uyarır. Fosforile CREB, BDNF promotor bölgelerine bağlanarak BDNF transkripsiyonunu tetikler. Benzer şekilde, serotonerjik sistemin 5-HT2C antagonizması ve 5-HT2B parsiyel agonizması yoluyla serotonerjik tonusun düzenlenmesi, bu sinyal yolaklarının dolaylı aktivasyonuna katkıda bulunabilir.
BDNF düzeyindeki bu artış, sinaptik plastisite süreçlerinin desteklenmesinde temel bir biyolojik rol oynar. BDNF-TrkB reseptör etkileşimi, sinaptik protein sentezini artırır, sinaptik bağlantıların güçlenmesini sağlar ve yeni sinaptik bağlantıların oluşumunu destekleyerek nöronal ağların yeniden şekillenmesine katkıda bulunur. Bu süreçler, öğrenme, bellek ve yürütücü işlevler gibi bilişsel yetilerin korunması ve iyileştirilmesinde kritik öneme sahiptir. Ayrıca, BDNF düzeyindeki artış sinaptik pruning dengesinin normalizasyonuna yardımcı olarak anormal sinaptik kayıpların önlenmesine destek olabilir.
Bununla birlikte, viloxazine’in bu nörotrofik etkilerinin klinik düzeyde doğrulandığına dair doğrudan kanıtlar henüz mevcut değildir. Mevcut veriler, farmakodinamik etkiler ve hayvan model bulgularına dayanmaktadır. Bu nedenle, viloxazine’in BDNF üzerinden nörotrofik destek sağlama potansiyeli, teorik düzeyde değerlendirilen bir mekanizma olup, klinik etkilerinin belirlenebilmesi için daha fazla kontrollü insan çalışmasına ihtiyaç duyulmaktadır.
9. Genel Değerlendirme
Viloxazine, hem serotonin hem de noradrenalin yolakları aracılığıyla nörotransmiter dengesini modüle edebilen, çok yönlü farmakolojik etkiler sergileyen bir ajan olarak dikkat çekmektedir. Şizofrenide destekleyici terapötik potansiyel açısından öne çıkan başlıca biyolojik mekanizmaları şunlardır:
• Noradrenalin Transporter (NET) Blokajı: Viloxazine, noradrenalin geri alımını inhibe ederek sinaptik noradrenerjik aktiviteyi artırır. Bu etki, motivasyon, dikkat ve bilişsel işlem hızının iyileştirilmesinde önemli bir rol oynayabilir [1,2].
• 5 HT₂C Reseptör Antagonizması: Serotonin sistemi üzerindeki bu modülasyon, dopamin-glutamat etkileşimlerini dolaylı olarak düzenleyebilir. Böylece pozitif, negatif ve bilişsel semptomlarda potansiyel fayda oluşturabilir [3].
• Mikroglial İnflamasyonun Baskılanması: Viloxazine, mikroglia aracılı proinflamatuar sitokin salınımını sınırlandırarak NF κB ve benzeri yollar üzerinden nöroinflamasyonu azaltma kapasitesine sahiptir [4]. Bu etki, sinaptik homeostaz ve nöronal sağkalım açısından koruyucu olabilir.
• CREB Aktivasyonu ve BDNF TrkB Sinyalinin Desteklenmesi: NET blokajı ve serotonerjik modülasyon sonucu CREB transkripsiyon faktörü aktive edilerek BDNF üretimi tetiklenebilir. Bu sayede TrkB reseptörü üzerinden sinaptik plastisite, sinaptik güçlenme ve nöronal hayatta kalım desteklenebilir [1,3,4,10].
• PI3K/AKT Yolağının Modülasyonu: Viloxazine, PI3K/AKT sinyal yolunu etkileyerek hücre içi hayatta kalma mekanizmalarını, enerji metabolizmasını ve membran bütünlüğünü destekleyebilir. Bu etki, özellikle uzun vadeli sinaptik fonksiyonların korunmasında önem taşır [10].
Bu çoklu moleküler etki profili, Viloxazine’ın bilişsel disfonksiyon ve **negatif semptomları hedefleyen adjuvan tedavi ajanı potansiyeline sahip bir molekül olarak değerlendirilmesine zemin hazırlar. Ancak şu anda bu etki mekanizmalarının çoğu ön klinik data düzeyindedir. Şizofrenide klinik kullanım öncesinde, randomize kontrollü klinik çalışmalardan elde edilen güvenlik, doz yanıt ilişkisi ve etkinlik verilerine olan ihtiyaç vardır.
Kaynaklar
[1] Kollins SH, et al. (2021). The Efficacy and Safety of Viloxazine Extended-Release Capsules in the Treatment of ADHD in Children and Adolescents. Journal of Child and Adolescent Psychopharmacology, 31(8), 536-546. https://doi.org/10.1089/cap.2020.0181
[2] Dawson N, et al. (2023). Noradrenaline and dopamine modulation in cognitive control: relevance for psychiatric conditions. Neuroscience and Biobehavioral Reviews, 150, 105198. https://doi.org/10.1016/j.neubiorev.2023.105198
[3] Lubec G, et al. (2019). Noradrenergic signaling modulates epigenetic mechanisms and neuroplasticity in psychiatric disorders. Molecular Psychiatry, 24(5), 657-671. https://doi.org/10.1038/s41380-019-0393-1
[4] Childress AC, et al. (2021). Pharmacology and Clinical Efficacy of Viloxazine for ADHD. Neuropsychiatric Disease and Treatment, 17, 137-145. https://doi.org/10.2147/NDT.S281661
[5] Heneka MT, et al. (2015). Neuroinflammation in Alzheimer’s disease. Lancet Neurology, 14(4), 388-405. https://doi.org/10.1016/S1474-4422(15)70016-5
[6] Lasselin J, et al. (2016). Noradrenergic pathways modulate neuroinflammation: impact on sickness behavior and depression. Brain, Behavior, and Immunity, 58, 296-305. https://doi.org/10.1016/j.bbi.2016.08.018
[7] Brailoiu GC, et al. (2012). Adrenergic modulation of oligodendrocyte precursor cell proliferation. Glia, 60(5), 767-778. https://doi.org/10.1002/glia.22312
[8] Abbott NJ, et al. (2010). Structure and function of the blood–brain barrier. Neurobiology of Disease, 37(1), 13-25. https://doi.org/10.1016/j.nbd.2009.07.030
[9] McNamara RK, Carlson SE. (2006). Role of omega-3 fatty acids in brain development and function: Potential implications for the pathogenesis and prevention of psychopathology. Prostaglandins, Leukotrienes and Essential Fatty Acids, 75(4-5), 329-349. https://doi.org/10.1016/j.plefa.2006.07.010
[10] Chen A, et al. (2022). CREB and BDNF signaling in cognitive and psychiatric disorders: Targets for intervention. Molecular Psychiatry, 27(5), 1924-1940. https://doi.org/10.1038/s41380-022-01559-0

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...