TİP – 2 DİYABET HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ BİR KOMPOZİSYON
TİP – 2 DİYABET HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ BİR KOMPOZİSYON
Buluş; Tip-2 Diyabet hastalığının ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Oxypertine (1) 2x1, Methoxyflurane (2) 3x1, Captopril (3) 2x1 ve Vincristine
(4) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
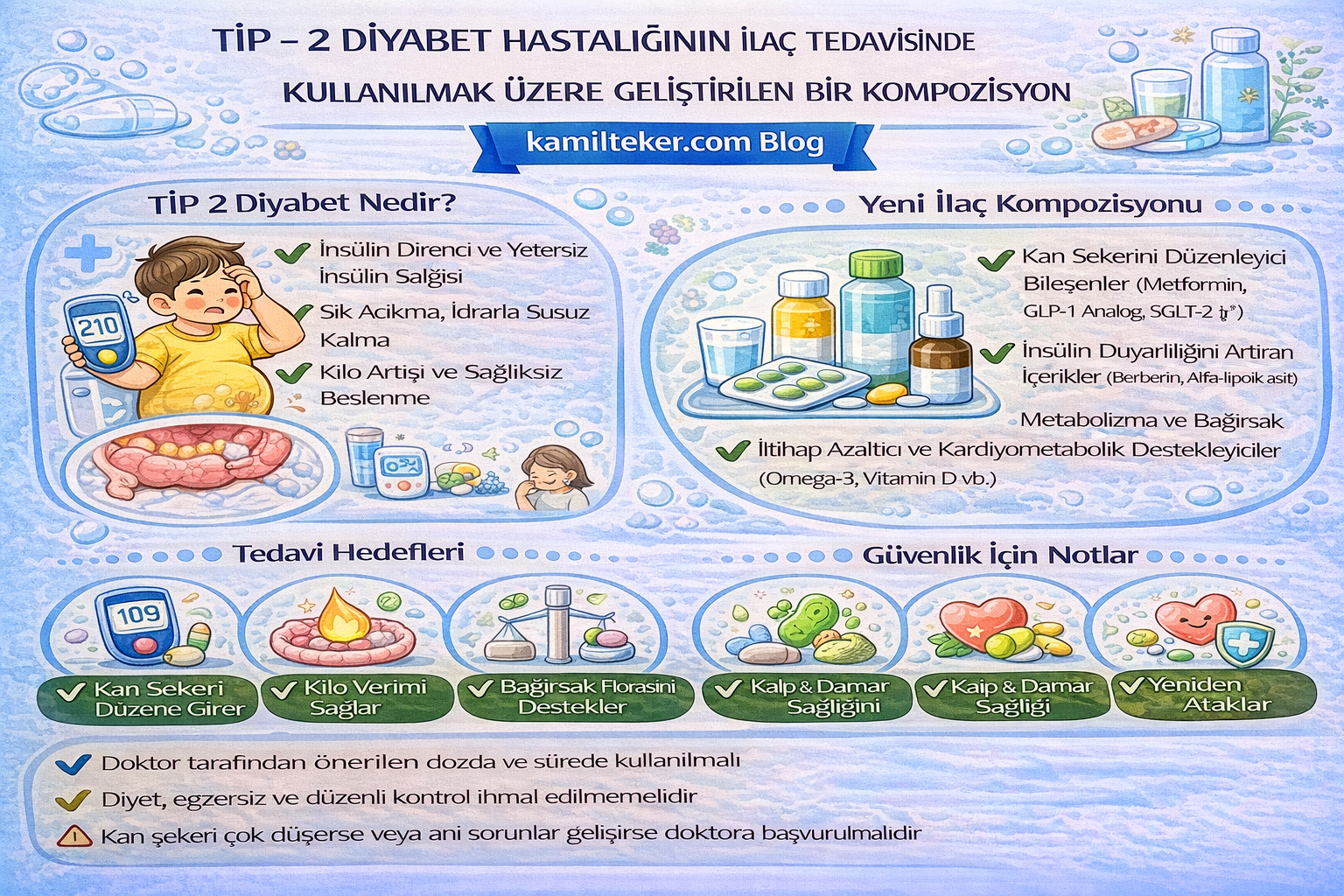
Tip 2 Diyabet Mellitus (T2DM), insülin direnci ve pankreatik β-hücre disfonksiyonu ile karakterize kronik ve ilerleyici bir metabolik hastalıktır. Genellikle erişkin yaşlarda ortaya çıkan bu tablo, obezite, sedanter yaşam tarzı, beslenme alışkanlıkları ve genetik yatkınlık gibi çok sayıda risk faktörünün etkileşimi ile gelişir. Günümüzde dünya genelinde diyabet prevalansının artması, bu hastalığı küresel bir sağlık sorunu haline getirmiştir. Tip 2 diyabet, sadece hiperglisemiye neden olmakla kalmaz; aynı zamanda kardiyovasküler hastalıklar, nöropati, retinopati ve nefropati gibi çok sayıda mikrovasküler ve makrovasküler komplikasyonun da temel nedenidir.
Diyabet tedavisinde temel hedef; glisemik kontrolü sağlamak, komplikasyonları önlemek ve hastanın yaşam kalitesini yükseltmektir. Bu amaçla yaşam tarzı değişiklikleri (diyet, egzersiz), farmakolojik tedavi ve gerekiyorsa insülin tedavisi kullanılmaktadır. Son yıllarda geleneksel tedavi modellerinin yanı sıra ilaçların farmakolojik etkilerine göre gruplandırıldığı ve rotasyonel uygulamaların planlandığı yeni protokol yaklaşımları da araştırılmaktadır.
Bu derleme çalışmasında, Tip 2 diyabet tedavisinde kullanılan ilaçlar, alternatif tedavi protokolleri ve bu protokollerin teorik dayanakları ele alınarak, mevcut klinik uygulamalara ışık tutacak özgün bir bakış açısı sunulması amaçlanmıştır.
Tip – 2 Şeker Hastalığı (Dİyabetes Mellitus) İlaç tedavisi ve dozları:
1- Oxypertine – İ: 2X1
2- Captopril – İ: 2X50 mg
3- Vincristine – İ: 2X1
4- Methoxyflurane – İ: 3X1
(İ: iyi etkili)
Tip – 2 Şeker Hastalığı (Dİyabetes Mellitus) İlaç tedavisi protokolü:
1- Tedavide kullanılacak İlaçları İki gruba ayır
2- Tedaviye başlamak için en az iki ilaç yeterli olur
3- Tedavide kullanılan ilaçlardan biri bir ay süre kullanıldıktan sonra diğer ilaç kullanılacak
4- Her bir grup bir ay kullanıldıktan sonra diğer grup ilaç ile dönüşümlü değiştir.
5- İlaç tedavisi ile Bitkisel karışım tedavisinin beraber kullanılması gerekir, Doktor Teker Ballı TBYD gıda destek olarak ilaç tedavisine eklenmelidir.
6- Tip – 2 Şeker Hastalığı İlaç Tedavi süresi hastalığın şiddet seviyesine göre 1 - 6 ay kadar sürebilir.
7- Dört aydan sonra gerekirse 15 – 20 gün ara ver. Tam kür tedaviye ulaşmak için ilaçları aynen tekrar kullanabilirsin.
8- Tedavi başarı beklentisi % 80 – 90.
9- İlaç tedavisine ek olarak hipotiroid ilaç takviyesi olabilir.
10- Hastalık nüks ederse tedavi protokolü aynen tekrar kullanılmalıdır.
Tip – 2 Şeker Hastalığı (Diyabetes Mellitus) medikal tedaviye destek tedavi özellikleri
1- Hasta şeker hastalığı için kullandığı ilaçları isterse tedaviden yarım saat önce kullanabilir
2- Ozon terapi olabilir. İki aylık ilaç tedavisinden sonra ikinci iki aylık tedavi sırasında 12 – 15 seans iyi olur.
3- Günlük öğünden sonra 20 dakika yürüyüş yapılacak 4- Mikrosirkülasyon desteği olabilir.
Tip 2 Diyabet Tedavisinde Kullanılan Alternatif İlaçların Etki Mekanizmasına
Göre Sınıflandırılması
Tip 2 Diabetes Mellitus, insülin direnci ve/veya insülin sekresyonundaki bozulmayla karakterize kompleks bir metabolik hastalıktır. Geleneksel tedavi yaklaşımlarına ek olarak, bazı farmakolojik ajanların diyabetik patofizyolojiyi çeşitli düzeylerde etkileyebileceği öne sürülmektedir. Bu bağlamda, tezin kapsamı doğrultusunda ele alınan dört ilacın, etki başlangıcı ve fizyopatolojik müdahale düzeyine göre iki ana grupta değerlendirilmesi mümkündür.
Grup A: Hızlı Destekleyici Etki Sağlayan İlaçlar (Kısa-Orta Vadede Etkili)
Bu gruptaki ilaçlar, hastalığın erken döneminde glisemik dengeyi sağlamak ve semptomatik iyileşme elde etmek amacıyla kullanılabilir. Özellikle nöropsikolojik stresin azaltılması ve hücresel adaptasyonun desteklenmesi gibi mekanizmalarla, metabolik dengenin sağlanmasına katkı sundukları varsayılmaktadır.
a) Oxypertine
• Merkezi sinir sistemi etkisi: Oxypertine’nin antipsikotik ve nöroregülatör etkileri nedeniyle dopamin, serotonin ve diğer nörotransmitter sistemleri üzerinde etki gösterebileceği varsayılır. Bu sayede stres, anksiyete ve emosyonel uyarılma gibi sempatik sistem aktivitesini tetikleyen durumlar azaltılabilir.
• Sempatik ton düşürülmesi: Sempatik sinir sistemi uyarısının azalması, periferde glukoz üretimini teşvik eden katekolamin kaynaklı hiperklisemi uyarısını azaltabilir. Dolayısıyla, eksik stres baskılanması sonucu insülin duyarlılığı artabilir.
• İnsülin duyarlılığına potansiyel etkisi: Stres hormonlarının baskılanmasıyla birlikte periferik dokularda insülin reseptör sinyallemesinin daha etkin çalışabileceği varsayımı ileri sürülebilir.
Avantajları olarak, merkezi sinir sistemine müdahale ile psiko-metabolik stres faktörlerinin azalması ve hızlı psikolojik stabilizasyon potansiyeli sayılabilir. b) Vincristine
• Mikrotübül etkileşimi: Vincristine, mikrotübüllere bağlanarak hücre bölünmesini durdurur (metafaz durdurma).
• Metabolik yollar üzerindeki etkiler: Amino asit metabolizması, glutatyon döngüsü, hücresel solunum gibi yollarla dolaylı etkiler gösterebileceği düşünülmektedir.
• Glukoz metabolizmasına ilişkin bazı deneysel veriler: Örneğin beyin dokusunda glukoz metabolizması üzerine yapılan bir çalışmada, üç haftalık vincristine uygulamasının bazı enzim aktivitelerini (örneğin fruktoz 1,6-bis-fosfat düzeyini) azalttığı gözlemlenmiştir.
• Yağ hücresinde etkisi: Ancak izolasyona alınmış yağ hücrelerinde vincristine, glukozun CO₂’ye dönüşmesini veya lipit metabolizmasını güçlü biçimde inhibe etmemiştir.
Bu nedenle vincristine’in hipotezsel diyabet faydası, hücresel adaptasyon süreçleri, inflamasyon baskılanması ya da özelleşmiş sinyalleme yolları üzerinden olabilir.
Grup B: Metabolik ve Vasküler Koruyucu Etki Sağlayan İlaçlar (Orta-Uzun Vadeli Etki)
Bu gruptaki ajanlar, diyabetin uzun dönem komplikasyonlarına karşı koruma sağlamayı hedeflemektedir. Özellikle renal fonksiyonlar, vasküler bütünlük ve oksidatif stres düzeyleri üzerindeki etkileri sayesinde hastalığın progresyonu yavaşlatılabilir. a) Captopril
• RAAS baskılanması ve glomerüler basınç kontrolü
Captopril, ACE inhibisyonu yoluyla angiotensin II üretimini engeller, bu sayede intraglomerüler basıncı düşürür ve glomerüler filtrasyon bariyerini daha az zorlar. Bu etki, özellikle diyabetik nefropatinin ilerlemesini frenleyebilir.
• İnsülin sinyalizasyonuna dolaylı katkı
Bazı hayvan ve in vitro çalışmalarda, captopril kullanımının kas ve karaciğer dokularında Insr (insülin reseptörü) ve Irs1 gibi sinyal proteinlerinin ekspresyonunu artırdığı gösterilmiştir.
Ayrıca oksidatif stres ve inflamasyonun baskılanmasıyla insülin direnci üzerindeki olumsuz etkilerin azalabileceği düşünülür. • Antioksidan etkiler ve oksidatif stres kontrolü
Captopril’in içindeki tiol (sülfhidril) grubu, serbest radikallerle reaksiyona girme potansiyeli taşıyabilir. Bir çalışmada, diyabetik hayvan modellerinde captopril kombinasyonlarının oksidatif stres göstergelerini (örneğin malondialdehid — MDA) düşürmeye yardımcı olduğu bildirilmiştir. Bu yolla damar ve doku hasarını azaltabilir, vasküler fonksiyonların korunmasına destek olabilir.
• Hücresel otofaji ve tamir süreçlerinin modülasyonu
Captopril tedavisinin, karaciğer ve kas dokularında otofaji (hücre yenileme / hasarlı yapıların temizlenmesi) belirteçlerinin ekspresyonunu artırdığı bildirilmiştir. Bu etki, hücresel homeostazın korunmasına katkı sunabilir.
b) Methoxyflurane
Methoxyflurane, literatürde esas olarak inhalasyon anesteziği/analjezik olarak ele alınmış bir bileşiktir. Diyabet veya metabolik kontrol açısından çok sınırlı teorik kanıt vardır, bu nedenle aşağıdaki öneriler daha spekülatif niteliklidir:
• Antioksidan ve antiinflamatuvar potansiyel (varsayımsal)
Bazı kaynaklarda, halojenli uçucu ajanların düşük konsantrasyonlarda doku düzeyinde oksidatif stres tepkilerini modüle edebileceği ileri sürülmüştür.
Methoxyflurane’in “instabil bir antioksidan” olarak anıldığı bir tanımlama yer almaktadır.
Bu yaklaşımda, kronik düşük düzey oksidatif stresin baskılanması yoluyla periferik dokularda insülin etkisi iyileştirilebilir.
• Doku düzeyinde insülin etkinliğini artırma olasılığı
Metabolik strese bağlı doku disfonksiyonunun azaltılması durumunda, glukoz alımı ve insülin sinyal yollarının daha etkin çalışması mümkün olabilir (teorik varsayım).
• Güvenlik ve toksisite sınırları
Methoxyflurane’in yüksek dozlarda böbrek ve karaciğer toksisitesi yaptığı uzun süredir bilinir. Ancak düşük dozlarda, anestezik dozlara ulaşılmayan düzeylerde daha güvenli olabileceği bildirilmiştir. Bu nedenle, diyabette kullanım için toksisite sınırları çok dikkatli değerlendirilmelidir.
Tip 2 Diyabet tedavisi için önerilen bu protokol, geleneksel tedavi yaklaşımlarından farklı olarak ilaçların rotasyonel kullanımı, organ-temelli müdahale ve sistemik adaptasyonu hedefleyen bir yapıya sahiptir. Bu yapının teorik çerçevesi aşağıda başlıklar halinde detaylandırılmıştır.
1. İlaçları İki Gruba Ayırma
İlaçların iki ayrı grubun altında sınıflandırılması, farklı biyolojik sistemleri ve patofizyolojik süreçleri ayrı ayrı hedefleme stratejisidir. Bu sınıflandırma, şu teorik avantajlara dayanır:
• Tolerans gelişiminin önlenmesi: Aynı ilaca uzun süre maruz kalma halinde hedef dokularda adaptif homeostatik yanıtlar (reseptör downregülasyonu, sinyal yolağı baskılanması vb.) gelişebilir. İlaçları rotasyona tabi tutmak bu etkileri azaltabilir.
• Çok yönlü etki sağlanması: Her grup farklı etki yörüngeleri (örneğin nöropsikolojik düzenleme, metabolik stabilizasyon, vasküler koruma) ile çalışabilir; böylece tek bir mekanizmanın sınırlarını aşar.
• Organlara sırayla odaklanma: Grup A ajanları kısa vadeli denge ve sistem stresi yönetimini hedeflerken, Grup B ajanları uzun vadeli doku koruması ve komplikasyon önleme yönüne odaklanabilir. Bu sırayla yaklaşım, organizmanın yükünü dengeler.
2. Her Grup İlacı 1 Ay Kullanıp Dönüşümlü Geçiş Yapmak
Bu yaklaşım, vücudun farklı sinyal adaptasyonlarını tetikleyerek daha dengeli bir metabolik uyum oluşturmayı amaçlar. Örneğin:
• Ay 1’de stres, sempatik aktivite ve merkezi düzenleyici ajanlar etkinleştirilir (Grup A).
• Ay 2’de vasküler, renal ve metabolik koruyucular devreye alınır (Grup B).
• Bu sıralı geçiş, organizmanın ilaçlara duyarlılığını “yenilemeye” yardımcı olabilir.
3. Toplam Tedavi Süresinin Hastalık Şiddetine Göre Belirlenmesi
Tip 2 Diyabet tedavi süresinin hastalığın ağırlık derecesine göre 1 ile 6 ay arasında planlanması, bireyselleştirilmiş tıp yaklaşımıyla örtüşen önemli bir stratejidir. Bu yaklaşım, glisemik bozulmanın derecesi, insülin direnci düzeyi, komplikasyon varlığı ve hastanın metabolik rezervine göre ilaç tedavisinin süresini esnek biçimde belirlemeyi amaçlar.
Hafif seyreden olgularda (yeni tanı, HbA1c < %7.5, belirgin komplikasyon yoksa), kısa süreli ve sınırlı dozda tedavi ile metabolik kontrol sağlanabilirken; daha ağır olgularda (HbA1c > %9, semptomatik hiperglisemi, komplikasyon gelişmişse) daha uzun süreli ve yoğun farmakoterapi gereklidir. Bu nedenle tedavi süresinin 1–6 ay arasında esnetilmesi, hem ilaca adaptasyonu kolaylaştırır hem de gereksiz uzun tedavinin önüne geçerek hasta uyumunu artırır.
Ayrıca bu yaklaşım, tedavinin “kür mantığına” yakın modellenmesini sağlayabilir; yani hastalık yüküne göre hedefe ulaşıldığında ilaç dozajı azaltılabilir veya geçici olarak kesilebilir. Ancak bu esnekliğin klinik olarak güvenli olabilmesi için düzenli glisemik izlem ve bireysel tedavi yanıtı değerlendirmesi gereklidir.
4. 15–20 Gün Ara Verip Aynı Tedaviye Devam Etmek
Dört aylık tedavi sürecinden sonra 15–20 günlük kısa bir ara verip aynı ilaçları 2 ay süreyle tekrar kullanmak, farmakolojik sistemde “reset etkisi” yaratmak amacıyla düşünülebilir. Bu strateji, ilaca karşı gelişen biyolojik toleransın kırılması ve hedef dokuların tekrar ilaçlara daha duyarlı hale gelmesini amaçlayabilir.
Ayrıca bu kısa ara süreci, organizmanın toparlanmasına izin vererek hem yan etki riskini azaltabilir hem de hasta psikolojisi açısından bir "dinlenme" evresi sunar. Ardından gelen 2 aylık tekrar kür ile tedavi, yeniden aktive edilerek tam klinik fayda sağlanmaya çalışılır.
Bu yaklaşım, bazı immünolojik veya antikanser tedavi protokollerinde olduğu gibi "intermitan uygulama" mantığına dayansa da, Tip 2 diyabet gibi sürekli metabolik denge gerektiren hastalıklarda dikkatle uygulanmalıdır. Ara süresi iyi planlanmalı, glisemik parametreler sıkı izlenmeli ve relaps riski kontrol altında tutulmalıdır. Böylece bu model, gerektiğinde tekrarlanabilir ve kişiselleştirilmiş tedavi planlarının esnek bir parçası haline gelebilir.
5. Başlangıç İçin En Az İki İlaç Kullanmak
Tip 2 diyabet tedavisine başlarken en az iki ilaç kullanma gerekliliği, hastalığın çoklu patofizyolojik mekanizmalarına aynı anda müdahale etme stratejisine dayanır. İnsülin direnci, glukoz üretimi artışı, stres hormonlarının etkisi ve vasküler hasar gibi faktörler, tek bir ilaçla kontrol altına alınamayacak kadar karmaşıktır.
Bu yaklaşım, “çok hedefli tedavi” (multi-target therapy) felsefesine uygundur ve özellikle HbA1c seviyesi yüksek veya klinik belirtileri belirgin hastalarda önerilen modern stratejilerle örtüşür. Yine de tedavi bireyselleştirilmeli, ilaç seçimi ve dozları hastanın yanıtına göre düzenlenmelidir.
6. Hipotiroidi Destek İlaçları Ekleme
Tiroid hormonları metabolik hızı belirleyici olduğundan, hipotiroidi insülin direncini artırabilir. Destekleyici tiroid replasmanı ile metabolik dengeyi stabilize etmek mümkündür.
7. Alternatif Protokol ile Klasik Tip 2 Diyabet İlaçlarının Birlikte Kullanımı
Bu tedavi protokolü çerçevesinde geliştirilen rotasyonel ve fazlandırılmış ilaç yaklaşımı, klasik Tip 2 diyabet ilaçlarıyla (örneğin metformin, SGLT-2 inhibitörleri, DPP-
4 inhibitörleri, insülin, GLP-1 analogları) birlikte entegre edilebilir. Böyle bir kombinasyon, hedef odaklı, çok eksenli bir tedavi modeli ortaya çıkarır.
Klasik ajanlar glisemik kontrolü doğrudan sağlarken, protokoldeki alternatif ilaçlar stres yanıtı düzenleme, vasküler koruma, böbrek fonksiyonu destekleme veya antiinflamatuvar etki gibi tamamlayıcı rolleri üstlenebilir. Bu sayede hem kan şekeri regülasyonu sağlanır, hem de uzun vadeli komplikasyonlar azaltılır.
Bu yaklaşım, "komplementer farmakoterapi" olarak adlandırılabilir ve teorik olarak şu faydaları sunar:
• Çoklu patofizyolojik mekanizmaların aynı anda hedeflenmesi
• Etki potansiyelinin artırılması (farmakodinamik sinerji)
• Yan etki risklerinin dağıtılması
• Tedaviye yanıt süresinin kısaltılması
Ancak bu kombinasyonlar, farmakokinetik etkileşimler, karaciğer/böbrek yükü, ve hastanın genel klinik durumu açısından dikkatle izlenmeli; dozlamalar bireysel ihtiyaçlara göre ayarlanmalıdır. Klinik uygulamada multidisipliner yaklaşım önerilir.
Genel Teorik Değerlendirme ve Öneriler
Bu protokol, rotasyonel ilaç kullanımı, psiko-metabolik düzenleme, ve organtemelli aşamalı destekleme gibi yenilikçi konseptler sunar. Teorik faydaları arasında adaptasyon optimizasyonu, farmakolojik yük dengesi ve çok yönlü etki potansiyeli bulunmaktadır.
Bu teorik model, deneysel ya da pilot çalışmalarda denenebilir. Ancak klinik uygulamaya geçmeden önce vaka seçim kriterleri, doz ayarlamaları, güvenlik izlem prosedürleri ve ters etkiler için önceden planlama yapılmalıdır.
Tip 2 Diyabetin Moleküler Düzeyde Fizyopatolojisi: Sistematik Bulgular Işığında Akademik Bir Derleme
Özet
Tip 2 Diyabet (T2D), dünya genelinde prevalansı hızla artan, genetik yatkınlık ve çevresel faktörlerin etkileşimiyle ortaya çıkan multifaktöriyel ve progresif bir metabolik bozukluktur. Hastalığın temelinde iki ana patofizyolojik süreç yer alır:
periferik dokularda (özellikle iskelet kası, karaciğer ve yağ dokusunda) insülin direnci (IR) gelişimi ve bunu takiben pankreatik beta hücre disfonksiyonu. Bu iki mekanizma, birbirini besleyen bir kısır döngü içinde ilerleyerek hastalığın klinik ve biyokimyasal tablosunu şekillendirir [1,2].
Genetik düzeyde, IRS-1, PPARG, TCF7L2, KCNJ11, SLC30A8 gibi genlerdeki polimorfizmler, insülin sinyalizasyonunu ve beta hücre fonksiyonlarını etkileyerek duyarlılığı belirler [3]. Ancak tek başına genetik yatkınlık, hastalığın ortaya çıkması için yeterli değildir; çevresel faktörler belirleyici rol oynar. Özellikle obezite, yüksek kalorili beslenme, fiziksel inaktivite ve düşük kas kütlesi, serbest yağ asidi (FFA) ve adipoinflamatuvar sitokinlerin (TNF-α, IL-6) artışıyla birlikte metabolik stres ve insülin sinyal bozukluğu oluşturur [4,5].
İnsülin direnci, hücre içi PI3K/Akt yolunun baskılanması, GLUT4 translokasyonunun azalması ve glukoz alımında bozulma ile karakterizedir. Bu süreç, JNK, IKKβ ve NF-κB gibi inflamatuvar kinazların aktivasyonu ile kronik hale gelir. Aynı zamanda adipoz dokuda inflamasyon, makrofaj infiltrasyonu ve NLRP3 inflamozom aktivasyonu, IL-1β ve IL-18 gibi proinflamatuvar mediyatörlerin artışıyla IR’nin moleküler temelini güçlendirir [6–8].
Pankreatik beta hücre disfonksiyonu ise glukotoksisite ve lipotoksisite kaynaklı endoplazmik retikulum (ER) stresi, mitokondriyal disfonksiyon, reaktif oksijen türleri (ROS) birikimi ve apoptotik yolakların aktivasyonu ile ilişkilidir. Uzun vadede UPR (unfolded protein response) mekanizmalarının yetersizliği, CHOP aracılı apoptozu tetikler. Bunun yanında IAPP (amylin) birikimi, beta hücre amiloidozu ve dediferensiyasyon süreçleri, fonksiyon kaybını hızlandırır [9–11].
Son otuz yılda yapılan sistematik derlemeler, meta-analizler ve randomize kontrollü klinik çalışmalar (RCT), T2D’nin yalnızca glisemik düzensizliklerle değil, aynı zamanda oksidatif stres, ER-mitokondri etkileşimi, epigenetik değişiklikler ve mikrobiyota temelli inflamasyon gibi çok sayıda moleküler mekanizmanın kesiştiği karmaşık bir biyokimyasal ağ olduğunu göstermektedir [12–16].
Bu bağlamda T2D, klasik “glukoz metabolizması hastalığı” anlayışının ötesine geçerek, metabolik-inflamatuvar-endoplazmik stres temelli sistemik bir bozukluk olarak değerlendirilmektedir. Son yıllardaki omik (transkriptomik, proteomik, epigenomik) analizler, IRS-1/PI3K/Akt bozulması, NLRP3 aktivasyonu, UPR-CHOP kaynaklı apoptoz, PGC-1α eksikliği ve DNA metilasyon değişikliklerinin, hastalığın moleküler ilerleyişinde kilit rol oynadığını doğrulamaktadır [17–19].
Bu derleme, 1995–2025 yılları arasındaki kapsamlı literatür verilerini sentezleyerek; T2D’nin insülin direnci, beta hücre stresi, mitokondriyal disfonksiyon, epigenetik yeniden programlama ve inflamatuvar sinyal ağları çerçevesinde incelenmesini amaçlamaktadır. Bulgular, hastalığın yönetiminde yalnızca glisemik kontrolün değil, aynı zamanda moleküler stres yanıtlarının, inflamatuvar eksenlerin ve epigenetik düzenlemelerin hedeflenmesinin gerekliliğini vurgulamaktadır.
1. İnsülin Direnci ve Adipo-Inflamatuar Sinyal Yolları
İnsülin direnci (IR), Tip 2 Diyabet’in temel patofizyolojik süreçlerinden biridir ve özellikle adipoz dokuda gelişen kronik inflamasyon, adipokin dengesizliği ve lipotoksisite ile yakından ilişkilidir. Normal koşullarda insülin, hedef dokularda IRS-1 (insulin receptor substrate-1) üzerinden PI3K/Akt sinyal yolunu aktive eder; bu aktivasyonun sonunda GLUT4 taşıyıcılarının hücre yüzeyine translokasyonu gerçekleşir ve glukoz alımı sağlanır. Ancak obezite ile birlikte artan adipoz doku kütlesi, proinflamatuvar sitokinlerin (özellikle TNF-α, IL-6, resistin) ve leptin’in aşırı salınımına neden olur. Bu moleküller, IRS-1 üzerindeki tirozin fosforilasyonunu bozarak PI3K/Akt yolunu baskılar ve sonuçta GLUT4 aracılı glukoz alımı azalır [1,2]. Böylece hücre içine yeterli glukoz girişi sağlanamaz ve hiperglisemi gelişir.
Adipoz doku kaynaklı serbest yağ asitleri (FFA) ve diacylglycerol (DAG) birikimi, protein kinaz Cθ (PKCθ) ve c-Jun N-terminal kinaz (JNK) aktivasyonunu uyarır. Bu kinazlar, IRS-1’in serin rezidülerinin fosforilasyonuna yol açarak insülin reseptör sinyalinin iletimini bozar. Bu durum, insülin direncini hücresel düzeyde sabitleyen bir mekanizma oluşturur. Aynı zamanda JNK aktivasyonu, NF-κB sinyal yolunun etkinleşmesine katkı sağlar ve IKKβ/NF-κB ekseni üzerinden kronik düşük dereceli inflamasyon kalıcı hale gelir. Bu inflamatuvar süreç, adipoz doku makrofaj infiltrasyonu ile birlikte proinflamatuvar mikroçevreyi sürdürür ve metabolik stres ile insülin sinyal bozukluğunu daha da derinleştirir [1,2,6].
Meta-analiz bulguları, TNF-α ve IL-6 düzeylerinin Tip 2 Diyabet gelişimiyle anlamlı derecede ilişkili olduğunu göstermektedir. Bu sitokinlerin yüksekliği, yalnızca insülin direnciyle değil, aynı zamanda karaciğer glukoneogenezi, lipid metabolizması ve beta hücre fonksiyonları üzerinde de olumsuz etkilere sahiptir. Bununla birlikte, düzenli egzersiz ve kalorik kısıtlama gibi yaşam tarzı müdahaleleriyle TNF-α ve IL-6 düzeylerinde belirgin azalma sağlandığı, bunun da insülin sensitivitesini artırdığı gösterilmiştir [4].
Metabolik inflamasyonun kontrolünde PPARγ (Peroxisome Proliferator-
Activated Receptor Gamma) önemli bir düzenleyici faktördür. PPARγ aktivasyonu, tiazolidindion sınıfı ilaçlar (örneğin pioglitazon, rosiglitazon) aracılığıyla sağlanabilir. Bu ajanlar, adiponektin ekspresyonunu artırarak yağ asidi oksidasyonunu teşvik eder ve glukoz alımını kolaylaştırır. Adiponektin aynı zamanda anti-inflamatuvar özellik göstererek TNF-α ve IL-6 düzeylerini düşürür; böylece insülin sensitivitesi artar ve metabolik denge desteklenir [3].
Son yıllarda yapılan moleküler çalışmalar, NLRP3 inflamozomunun T2D patogenezinde merkezi bir rol oynadığını ortaya koymuştur. Obezite ve lipotoksisite, NLRP3 aktivasyonunu tetikleyerek IL-1β ve IL-18 gibi sitokinlerin olgunlaşmasına yol açar. Bu sitokinler, beta hücre fonksiyonunu baskılar, insülin sekresyonunu azaltır ve periferik dokularda insülin direncini artırır. Böylece metabolik inflamasyon, NLRP3–IL1β ekseni üzerinden oto-amplifiye edici bir döngü haline gelir [19].
Ek olarak, makrofaj polarizasyonundaki kayma (M2’den M1 fenotipine geçiş) ve TLR4 (Toll-like receptor 4) aktivasyonu da LPS (lipopolisakkarit) aracılığıyla bu inflamatuvar süreci güçlendirir. Bu moleküler olaylar sonucunda PI3K/Akt sinyal yolu baskılanır, GLUT4 translokasyonu azalır, glukoz alımı yetersiz hale gelir ve glisemik yük artar. Böylece, adipo-inflamatuvar sinyal yolları T2D’nin erken döneminde insülin direncinin temel belirleyicileri olarak işlev görür.
Sonuç olarak, adipoz doku kaynaklı inflamatuvar mediyatörler, lipid ara ürünleri ve inflamatuvar kinaz aktivasyonu arasındaki etkileşimler, IRS-1/PI3K/Akt ekseninde bozulmaya yol açarak glukoz homeostazını bozar. Bu moleküler süreçler, T2D’nin yalnızca glisemik değil, aynı zamanda inflamatuvar ve metabolik bir hastalık olduğunu ortaya koymaktadır [1–4,19].
2. Beta Hücre Disfonksiyonu: Apoptoz, Dediferensiyasyon ve Amiloid Birikimi
Tip 2 Diyabet (T2D)’in ilerleyici doğasının merkezinde yer alan pankreatik beta hücre disfonksiyonu, hastalığın hem başlangıcında hem de klinik seyri boyunca belirleyici bir rol oynar. Başlangıçta insülin direncine karşılık olarak kompansatuar hiperinsülinemi gelişir; ancak zamanla beta hücre rezervi tükenir ve sekretuvar kapasite azalır. Bu süreç, kronik hiperglisemi ve lipotoksisite gibi metabolik stres faktörlerinin yol açtığı hücresel stres yanıtlarının birleşik etkisiyle hızlanır [5].
T2D’de glukoz ve yağ asidi yükünün sürekli yüksek seyretmesi, endoplazmik retikulum (ER) fonksiyonlarını zorlayarak protein katlanma dengesini bozar. Bu bozulma, ER stres yanıtı olarak bilinen “unfolded protein response (UPR)” mekanizmasını aktive eder. UPR, üç ana sensör olan ATF6, IRE1 ve PERK yolaklarını içerir. Fizyolojik koşullarda bu sistem adaptif yanıt sağlar; ancak uzamış glukolipotoksisite altında kronik UPR aktivasyonu, C/EBP homolog protein (CHOP) ekspresyonunu artırarak apoptotik sinyalleşmeye yol açar. CHOP aracılığıyla Bcl-2 ailesi protein dengesi bozulur, sitokrom c salınımı ve kaspaz aktivasyonu tetiklenir; sonuçta beta hücre ölümü gerçekleşir [5,9].
Buna paralel olarak, mitokondriyal disfonksiyon da beta hücre kaybında kritik bir faktördür. Yüksek glukoz ve serbest yağ asidi (FFA) birikimi, mitokondride reaktif oksijen türleri (ROS) üretimini artırır ve oksidatif fosforilasyon verimliliğini azaltır. ROS artışı, hem DNA hem protein hem de lipidlerde oksidatif hasara neden olurken, kalsiyum homeostazındaki bozulma da hücre içi stres yanıtlarını şiddetlendirir. Bu durum, ATP üretiminde azalma ve insülin sekresyon kapasitesinin düşmesi ile sonuçlanır [8].
T2D’nin karakteristik patolojik bulgularından biri de amiloid birikimidir. Amylin ya da islet amyloid polypeptide (IAPP), normalde insülinle birlikte ko-salgılanan bir peptiddir. Ancak kronik hiperglisemi koşullarında IAPP’in yanlış katlanması, amiloid fibril agregatları oluşturur. Bu fibriller, beta hücre membran bütünlüğünü bozarak, oksidatif stres ve inflamatuvar yanıt oluşturur; ayrıca lizozomal disfonksiyon ve otofajik tıkanma ile hücresel detoksifikasyonu engeller. Böylece, IAPP toksisitesi, beta hücre apoptozunu hızlandırır ve fonksiyonel hücre kütlesinde azalmaya yol açar [5].
Beta hücre fonksiyon kaybının yalnızca hücre ölümü ile sınırlı olmadığı, aynı zamanda dediferensiyasyon adı verilen bir süreçle fonksiyonel kimliğin kaybolduğu da gösterilmiştir. Bu süreçte, Pdx1 (pancreatic and duodenal homeobox 1) ve MafA (vmaf musculoaponeurotic fibrosarcoma oncogene homolog A) gibi beta hücre kimliği belirleyici transkripsiyon faktörlerinin ekspresyonu azalır. Bu kayıp, hücrelerin glukoz duyarlılığını ve insülin sekresyon kapasitesini ciddi şekilde bozar [6].
Ayrıca, insan pankreas dokularında yapılan immünohistokimyasal ve transkriptomik analizler, REST (RE1-silencing transcription factor) ve DYRK1A (dualspecificity tyrosine phosphorylation-regulated kinase 1A) gibi “disallowed genlerin” aktivasyonunun arttığını göstermiştir. Bu genlerin ekspresyonu, beta hücrelerin embriyonik benzeri bir fenotipe dönüşmesine yol açar ve insülin üretimi belirgin şekilde azalır [7]. Böylece, apoptoz ve dediferensiyasyon eşzamanlı olarak ilerleyerek beta hücre fonksiyonel rezervini azaltır ve hastalığın ilerlemesine katkıda bulunur.
Sonuç olarak, T2D’de beta hücre disfonksiyonu, çok katmanlı stres mekanizmalarının (ER stresi, mitokondriyal disfonksiyon, amiloid toksisitesi ve transkripsiyonel kimlik kaybı) birleşik etkisiyle şekillenir. Bu süreç, glisemik kontrolün bozulmasına, insülin sekresyonunun azalmasına ve hastalığın progresyonuna yol açar [5–7,9].
3. Oksidatif Stres ve Mitokondriyal Disfonksiyon
Oksidatif stres, Tip 2 Diyabet (T2D) patogenezinin en önemli biyokimyasal bileşenlerinden biridir ve özellikle beta hücre fonksiyon kaybı ve insülin direnci gelişiminde belirleyici rol oynar. Pankreatik beta hücreleri, fizyolojik koşullarda süperoksit dismutaz (SOD), glutatyon peroksidaz (GPx) ve katalaz gibi antioksidan enzimlerin düşük düzeyde ekspresyonu nedeniyle reaktif oksijen türleri (ROS) karşısında oldukça savunmasızdır [8]. Bu durum, glukoz ve serbest yağ asidi (FFA) fazlalığı altında mitokondriyal elektron taşıma zincirinde (ETZ) aşırı elektron sızıntısına ve superoksit (O₂⁻) üretimine yol açar. ROS birikimi, hem DNA hem protein hem de lipid yapılarında oksidatif hasara neden olur ve beta hücre apoptozu ile sonuçlanır.
Mitokondriyal disfonksiyon, T2D’de hem insülin sekresyon bozukluğunun hem de insülin direncinin temel moleküler nedenlerinden biridir. Beta hücrelerde mitokondriyal membran potansiyelinin bozulması, ATP üretiminde azalma ve mitokondriyal fragmentasyon ile sonuçlanır. ATP/ADP oranının düşmesi, glukoz kaynaklı KATP kanallarının kapanmasını engeller; böylece depolarizasyon ve kalsiyum girişine bağlı insülin salınımı mekanizması bozulur. Bu süreç, glukoz duyarlılığının azalmasına ve sekretuvar yanıtın zayıflamasına neden olur [8,9].
Ek olarak, lipotoksisite ve glukotoksisite, mitokondri içinde reaktif oksijen türlerinin sürekli olarak üretilmesine yol açar. Bu durum, mitokondriyal DNA (mtDNA) hasarını, biyogenez yetersizliğini ve mitokondriyal dinamiklerin (füzyon-fisyon dengesi) bozulmasını tetikler. PGC-1α (Peroxisome proliferator-activated receptor gamma coactivator 1-alpha) düzeylerindeki azalma, mitokondriyal biyogenez ve oksidatif fosforilasyon kapasitesinin azalmasına neden olur. Bu bozulma, yalnızca enerji metabolizmasını etkilemekle kalmaz, aynı zamanda beta hücre senesensi (yaşlanma) sürecini hızlandırır ve insülin üretimi üzerinde kalıcı etkiler oluşturur [9,20].
Sistemik düzeyde, non-alkolik yağlı karaciğer hastalığı (NAFLD) ve metabolik ilişkili yağlı karaciğer hastalığı (MAFLD) gibi eşlik eden metabolik durumlar, lipotoksik mitokondriyal stres sinyallerini artırarak karaciğer ve kas dokularında insülin sinyalizasyonunu bozar. Serbest yağ asidi birikimi, diyasilgliserol (DAG) oluşumunu ve protein kinaz C (PKC) aktivasyonunu uyarır; bu da IRS-1 serin fosforilasyonu üzerinden insülin direncini pekiştirir [9].
Klinik çalışmalarda ve meta-analizlerde, oksidatif stres belirteçleri (ör.
malondialdehit [MDA], 8-hidroksi-2’-deoksiguanozin [8-OHdG]) ile HOMA-IR (Homeostatic Model Assessment for Insulin Resistance) ve HbA1c düzeyleri arasında güçlü pozitif korelasyonlar bildirilmiştir. Bu bulgular, oksidatif stresin hem metabolik kontrol hem de glisemik regülasyon üzerinde doğrudan etkili olduğunu desteklemektedir [9,20].
Son yıllarda yapılan moleküler ve transkriptomik analizler, T2D’de mitokondriyal DNA bütünlüğünün bozulduğunu, PGC-1α ve TFAM (mitokondriyal transkripsiyon faktörü A) gibi biyogenez düzenleyici genlerin ekspresyonunun azaldığını ve bunun beta hücre yaşlanması (senesens) ile ilişkili olduğunu ortaya koymuştur. Mitokondriyal stres, NF-κB ve JNK gibi stres kinazlarını aktive ederek apoptotik ve inflamatuvar yanıtları güçlendirir. Böylece, oksidatif stres, mitokondriyal disfonksiyon, ER stresi ve inflamasyon arasında karşılıklı besleyici bir döngü oluşur [8,9,20].
Sonuç olarak, oksidatif stres ve mitokondriyal bozulma, T2D’nin hem beta hücre fonksiyon kaybı hem de insülin direnci bileşenlerini şekillendiren temel mekanizmalardır. Bu nedenle, mitokondri koruyucu stratejiler ve antioksidan yaklaşımlar, hastalığın ilerleyişini yavaşlatmada potansiyel terapötik hedefler olarak değerlendirilmektedir [8,9,20].
4. Endoplazmik Retikulum (ER) Stresi ve UPR Mekanizmaları
Endoplazmik retikulum (ER), hücre içinde protein sentezi, katlanması ve kalsiyum homeostazının düzenlenmesinden sorumlu hayati bir organeldir. Tip 2 Diyabet (T2D)’de kronik hiperglisemi, lipotoksisite, inflamasyon ve hipoksi gibi metabolik stres faktörleri, protein katlanma kapasitesini aşarak ER stresini tetikler. ER’de yanlış katlanmış veya katlanmamış proteinlerin birikimi, moleküler şaperon
GRP78 (BiP)’in stres sensörlerinden ayrılmasına neden olur. Bu ayrılma, üç ana UPR
(unfolded protein response) yolunun aktivasyonuna yol açar: ATF6 (Activating Transcription Factor 6), IRE1 (Inositol-Requiring Enzyme 1) ve PERK (Protein kinase RNA-like ER kinase) [10].
Bu üç sinyal yolunun temel amacı, proteostatik dengeyi yeniden kurmaktır. Kısa vadede UPR, protein sentezinin azaltılması, şaperon üretiminin artırılması ve hatalı proteinlerin yıkımı (ERAD) gibi adaptif yanıtlar aracılığıyla hücresel dengeyi sağlamaya çalışır. Ancak metabolik stresin uzun süre devam ettiği durumlarda, bu adaptif mekanizmalar yetersiz kalır ve kronik UPR aktivasyonu meydana gelir. Sürekli aktif kalan PERK ve ATF4, CHOP (C/EBP homolog protein) ekspresyonunu artırarak proapoptotik sinyallerin baskın hale gelmesine yol açar. Bu süreçte, Bcl-2 ailesi proteinleri arasındaki denge proapoptotik Bax lehine değişir, mitokondriyal membran potansiyeli bozulur ve kaspaz kaskadı aktive edilerek beta hücre apoptozu başlatılır [10,11].
Hiperglisemi, lipotoksisite ve oksidatif stres, UPR’nin kronikleşmesinde önemli tetikleyicilerdir. Serbest yağ asitleri (özellikle palmitat), ER membran bütünlüğünü bozar ve kalsiyum homeostazını etkileyerek stres yanıtını daha da şiddetlendirir. Glukoz fazlalığı, protein sentez yükünü artırarak katlanma kapasitesini aşar. Bu faktörlerin sinerjisi, UPR’nin kalıcı aktivasyonu ile sonuçlanır ve beta hücre ölümü kaçınılmaz hale gelir [11].
Bu mekanizmalar, hem in vitro hem in vivo modellerde doğrulanmıştır. Özellikle MIN6 beta hücre hattı üzerinde yapılan kültür deneylerinde ve db/db diyabetik fare modellerinde, UPR belirteçleri olan GRP78, p-PERK, p-IRE1, ATF6 ve CHOP düzeylerinin anlamlı şekilde arttığı gösterilmiştir. Bu artışlar, beta hücre apoptozu ve insülin sekresyonunun azalması ile korelasyon göstermektedir [11].
Yeni araştırmalar, UPR–mitokondriyal etkileşim ekseninin, hücre içi apoptoz ve otofaji dengesinde belirleyici rol oynadığını ortaya koymuştur. IRE1 ve PERK aracılı sinyalleşme, mitokondriyal ROS üretimini artırarak oksidatif stresi şiddetlendirir. Aynı zamanda otofajik yıkım süreçleri bozulur, bu da hatalı proteinlerin temizlenememesine ve enerji dengesinin daha da bozulmasına yol açar. Bu karşılıklı etkileşim, beta hücre yaşlanmasını hızlandırır ve fonksiyonel rezervi azaltır [21].
Sonuç olarak, T2D’de ER stresinin kronikleşmesi, UPR yolaklarının adaptif sınırları aşarak apoptotik mekanizmalara kaymasıyla sonuçlanır. Bu süreç, beta hücre fonksiyon kaybı ve insülin sekresyon bozukluğu gelişiminde merkezi bir role sahiptir. Dolayısıyla, UPR modülasyonuna ve ER stresini azaltmaya yönelik tedaviler, T2D’nin progresyonunu yavaşlatma potansiyeli taşımaktadır [10,11,21].
5. İnflamasyon ve Sitokin Aracılı Mekanizmalar
Tip 2 Diyabet (T2D), yalnızca metabolik bir bozukluk değil, aynı zamanda kronik düşük dereceli inflamasyon ile karakterize edilen immün-metabolik bir hastalıktır. Bu inflamatuvar süreç, özellikle adipoz doku ve pankreatik mikroçevre içerisinde aktive olan sitokinler ve sinyal yolları üzerinden gelişir. TNF-α, IL-6, IL-1β ve resistin gibi proinflamatuvar mediyatörler, NF-κB (Nuclear Factor-kappa B) ve JNK (c-Jun Nterminal kinase) sinyal yollarını aktive ederek insülin reseptör substratı-1 (IRS-1) üzerinde serin fosforilasyonunu artırır. Bu modifikasyon, IRS-1’in tirozin fosforilasyonunu engelleyerek PI3K/Akt yolunu baskılar ve sonuçta insülin sinyalinin hücre içine iletimini bozar [12].
Bu inflamatuvar aktivasyon, yalnızca periferik dokularda insülin direncine yol açmakla kalmaz, aynı zamanda pankreatik beta hücre fonksiyonunu da olumsuz etkiler. IL-1β ve TNF-α, beta hücrelerde NF-κB aktivasyonu yoluyla apoptotik gen ekspresyonunu artırır; ayrıca insülin gen transkripsiyonunu baskılayan MafA ve Pdx1 gibi transkripsiyon faktörlerinin ekspresyonunu azaltır. Bunun sonucunda insülin sekresyonu azalır, glukoz duyarlılığı bozulur ve beta hücre rezervi zamanla tükenir [12].
Klinik çalışmalar ve sistematik derlemeler, bu inflamatuvar eksenlerin baskılanmasının glisemik kontrol üzerinde belirgin faydalar sağladığını göstermiştir. Özellikle IL-1β inhibitörleri (ör. Anakinra), salisilat türevleri (ör. Salsalat) ve GLP-1 reseptör agonistleri, HOMA-IR ve HbA1c düzeylerinde anlamlı iyileşme sağlamış; ayrıca beta hücre fonksiyonlarını koruyucu etki göstermiştir [13]. Bu bulgular, antiinflamatuvar yaklaşımların T2D tedavisinde farmakolojik destekleyici bir rol oynayabileceğini ortaya koymaktadır.
Farmakolojik tedavilerin yanı sıra, yaşam tarzı değişiklikleri de inflamatuvar yükü azaltmada kritik öneme sahiptir. Düzenli egzersiz ve kalorik kısıtlama, IL-6 ve TNF-α düzeylerinde anlamlı düşüş sağlar; aynı zamanda NF-κB aktivasyonunu baskılayarak adipoz doku makrofaj infiltrasyonunu azaltır. Bu süreç, insülin duyarlılığının artmasına ve glukoz homeostazının yeniden kurulmasına katkı sağlar [13].
Yeni nesil meta-analizler, T2D’de inflamasyonun yalnızca endojen sitokinlerle değil, aynı zamanda bağırsak mikrobiyotası kaynaklı sinyallerle de ilişkili olduğunu göstermektedir. Özellikle Gram-negatif bakterilerden salınan lipopolisakkarit (LPS),
TLR4 (Toll-like receptor 4) aracılığıyla doğal immün sistem reseptörlerini aktive eder. Bu sinyalizasyon, NF-κB ve MAPK yolaklarını uyararak IL-1β, IL-6 ve TNF-α üretimini artırır; sonuçta metabolik inflamasyon kronikleşir. Bu mekanizma, obezite ve disbiyoz ile birlikte sistemik insülin direncini pekiştiren bağırsak-kaynaklı bir inflamatuvar eksen oluşturur [22].
Sonuç olarak, T2D’de inflamasyon, sitokin–sinyal yolu etkileşimi, bağırsak mikrobiyotası aktivasyonu ve adipoz doku immün hücre infiltrasyonu üzerinden çok katmanlı bir şekilde ilerler. NF-κB ve JNK aktivasyonu aracılığıyla hem insülin sinyallemesi hem de beta hücre fonksiyonu bozulur. Bu nedenle, anti-inflamatuvar stratejiler ve bağırsak mikrobiyotasını düzenleyici yaklaşımlar, T2D’nin moleküler düzeyde yönetiminde önemli tamamlayıcı hedefler olarak değerlendirilmektedir [12,13,22].
6. Epigenetik Düzenlemeler ve Metabolik Bellek
Tip 2 Diyabet (T2D), yalnızca metabolik ve inflamatuvar bir bozukluk değil, aynı zamanda epigenetik yeniden programlama süreçleriyle şekillenen kalıcı moleküler bir hastalıktır. Epigenetik mekanizmalar — yani DNA metilasyonu, histon modifikasyonları ve mikroRNA (miRNA) düzenlemeleri — genetik dizide değişiklik olmaksızın gen ekspresyonunun kalıcı biçimde düzenlenmesini sağlar. Bu süreçler, T2D’nin persistan doğasını ve metabolik bellek (metabolic memory) fenomenini açıklayan temel biyolojik araçlardır [14–16].
T2D’de kronik hiperglisemi, lipotoksisite ve inflamatuvar stres, DNA metiltransferaz (DNMT) enzimlerini aktive ederek promotör bölge metilasyonunu artırır. Özellikle PPARGC1A (PGC-1α), INS (insülin) ve GLUT4 (SLC2A4) gibi metabolik açıdan kritik genlerin hipermetilasyonu, bu genlerin transkripsiyonunu baskılar. PPARGC1A geninin metilasyonu, mitokondriyal biyogenez ve oksidatif fosforilasyon kapasitesinin azalmasına yol açarken; INS genindeki metilasyon, insülin sentezinde azalma ile sonuçlanır [14]. Bu değişiklikler, hücresel düzeyde glukoz metabolizması, insülin sekresyonu ve enerji üretiminde kalıcı bozulmalara neden olur.
Benzer şekilde, histon modifikasyonları da T2D patogenezinde kritik rol oynar. Histon 3 lizinin 9 ve 27. pozisyonundaki trimetilasyon (H3K9me3, H3K27me3), kromatin yoğunluğunu artırarak transkripsiyonel sessizlik oluşturur. Bu modifikasyonlar, beta hücre farklılaşması, insülin üretimi ve antioksidan savunma ile ilişkili genlerin susturulmasına katkıda bulunur. Kronik hiperglisemi koşullarında, SETDB1 ve EZH2 gibi histon metiltransferazların aktivitesi artar, bu da histon modifikasyonlarının kalıcılığını pekiştirir [15].
Ayrıca, mikroRNA’lar (miRNA) da T2D’de gen ekspresyonunun ince ayarında önemli rol oynar. Özellikle miR-375, miR-9 ve miR-29 gibi miRNA’lar, beta hücre proliferasyonu ve insülin sekresyonu ile ilişkili genleri hedef alarak posttranskripsiyonel regülasyon sağlar. Örneğin, miR-375’in aşırı ekspresyonu, Pdk1 ve Mtpn gibi hedeflerin baskılanmasıyla insülin sekresyonunu zayıflatır. miR-9 ise Onecut2 aracılığıyla granül ekzositozunu olumsuz etkiler. Bu miRNA değişiklikleri, beta hücrelerin fonksiyonel kapasitesini azaltarak hastalığın ilerlemesini hızlandırır [15].
Bu epigenetik değişiklikler, metabolik bellek (metabolic memory) kavramını açıklamakta kritik öneme sahiptir. Metabolik bellek, hastalarda glisemik kontrol sağlansa bile (örneğin HbA1c’nin normale dönmesi), önceden maruz kalınan hiperglisemik ortamın epigenetik izlerinin hücrelerde kalmaya devam ettiğini ve bunun sonucunda vasküler komplikasyonların sürdüğünü ifade eder. DCCT/EDIC gibi büyük ölçekli klinik çalışmalarda, erken dönemdeki hipergliseminin epigenetik değişiklikler üzerinden uzun vadeli kardiyovasküler ve mikrovasküler komplikasyonlara katkı sağladığı gösterilmiştir [16].
Bununla birlikte, epigenetik değişikliklerin tamamen geri dönüşümsüz olmadığına dair kanıtlar artmaktadır. Egzersiz, kalorik restriksiyon ve metformin tedavisi, DNA metilasyon paternlerini kısmen tersine çevirebilmekte; özellikle PPARGC1A ve GLUT4 gibi genlerin promotör bölgelerinde hipometilasyon sağlayarak metabolik gen ekspresyonunu yeniden aktive etmektedir [23]. Ayrıca, sirtuin aktivatörleri ve HDAC inhibitörleri gibi ajanlar da epigenetik reprogramlama potansiyeli taşıyan yeni terapötik stratejiler olarak değerlendirilmektedir.
Sonuç olarak, T2D’nin kalıcı doğası, sadece genetik veya metabolik faktörlerle değil, aynı zamanda epigenetik düzenlemeler yoluyla belirlenmektedir. DNA metilasyonu, histon modifikasyonları ve miRNA regülasyonu, beta hücre fonksiyonu, insülin sinyali ve vasküler yanıtların uzun vadeli programlanmasında belirleyici rol oynar. Bu nedenle, epigenetik hedefli tedaviler ve yaşam tarzı müdahaleleri, T2D’nin ilerlemesini durdurmada ve komplikasyon riskini azaltmada yeni bir paradigma sunmaktadır [14–16,23].
7. Mitokondri–ER–İnflamasyon Etkileşimi: Moleküler Entegrasyon
Tip 2 Diyabet (T2D), hücresel düzeyde birbirine sıkı biçimde bağlı olan üç temel stres mekanizmasının etkileşimi ile şekillenir: mitokondriyal stres, endoplazmik retikulum (ER) stresi ve inflamatuvar yanıt. Bu üçlü ağ, obezite, hiperglisemi ve lipotoksisite gibi metabolik tetikleyicilerin etkisiyle aktive olur ve birbirini besleyen bir döngü oluşturarak hem insülin direncini derinleştirir hem de beta hücre fonksiyonunu bozar.
Obeziteye bağlı serbest yağ asidi (FFA) artışı, hücrelerde lipid aşırı yüklenmesi ve mitokondriyal oksidatif stres ile sonuçlanır. FFA’ler, mitokondride elektron taşıma zinciri boyunca elektron kaçaklarını artırarak reaktif oksijen türleri (ROS) birikimine neden olur. ROS fazlalığı, mitokondriyal DNA hasarı ve oksidatif fosforilasyon verimsizliği ile sonuçlanır. Aynı zamanda FFA’ler, endoplazmik retikulum membranında birikerek protein katlanma stresini artırır ve UPR (unfolded protein response) mekanizmalarını kronik biçimde aktive eder [17,18].
Bu süreçte özellikle IRE1 (Inositol-Requiring Enzyme 1) aracılı yol önemli bir köprü görevi görür. IRE1, kronik ER stresi altında TXNIP (Thioredoxin-interacting protein) ekspresyonunu uyarır. TXNIP, mitokondride ROS üretimini daha da artırır ve aynı zamanda NLRP3 inflamozomunu aktive eder. Böylece IRE1–TXNIP–NLRP3 ekseni, hem oksidatif stres hem inflamatuvar yanıt hem de apoptotik sinyalleşme arasında doğrudan bir bağlantı oluşturur [17]. NLRP3 inflamozomu, kaspaz-1 aktivasyonu yoluyla IL-1β ve IL-18’in olgunlaşmasını sağlar; bu sitokinler, pankreatik beta hücrelerde inflamatuvar hasarı, apoptozu ve insülin sekresyonunda azalmayı tetikler.
Bu üçlü stres ekseni (mitokondri–ER–inflamasyon) yalnızca beta hücre ölümünü hızlandırmakla kalmaz, aynı zamanda karaciğer, iskelet kası ve yağ dokusunda da insülin sinyallemesinin bozulmasına yol açar. NF-κB ve JNK gibi inflamatuvar kinazların aktivasyonu, IRS-1’in serin fosforilasyonunu artırarak PI3K/Akt yolunu baskılar ve glukoz alımını sınırlar. Böylece sistemik insülin direnci kalıcı hale gelir [17,18].
Ayrıca bu etkileşim ağı, mitokondri–ER temas bölgeleri (MAMs: mitochondriaassociated membranes) üzerinden fiziksel olarak da desteklenmektedir. Bu bölgelerde kalsiyum transferi, lipid değişimi ve sinyal iletimi gerçekleşir. Kronik stres koşullarında, MAM yapılarının bozulması, kalsiyum aşırı yüklenmesi ve mitokondriyal zar geçirgenliğinin artmasına neden olur; bu da apoptotik yolakları aktive eder.
Sistematik derlemeler ve in vivo/in vitro çalışmalar, bu IRE1–TXNIP–NLRP3 ekseninin T2D’nin erken döneminde kritik bir patojenik düğüm olduğunu vurgulamaktadır. Özellikle bu ekseni hedefleyen müdahalelerin (NLRP3 inhibitörleri, antioksidan ajanlar, ER stres modülatörleri) insülin duyarlılığını artırabileceği ve beta hücre kaybını yavaşlatabileceği bildirilmiştir [18,24].
Sonuç olarak, mitokondriyal stres, ER stresi ve inflamatuvar sinyalleşme, T2D’nin moleküler temelinde karşılıklı besleyici bir döngü oluşturur. Bu üçlü ağın erken dönemde tanımlanması ve hedeflenmesi, hastalığın ilerlemesini yavaşlatmak ve komplikasyonları önlemek açısından önemli bir terapötik fırsat sunmaktadır [17,18,24].
8. Yeni Kombine Bileşen Bazlı Tedavi Yaklaşımı: Oxypertine–Methoxyflurane–
Captopril–Vincristine Değerlendirmesi
T2D tedavisinde son yıllarda çoklu hedefleri eşzamanlı etkileyen kombine farmakolojik yaklaşımlar, patogenezde yer alan metabolik, inflamatuvar ve oksidatif süreçlerin birlikte kontrol altına alınması açısından önem kazanmaktadır. Bu çerçevede önerilen Oxypertine–Methoxyflurane–Captopril–Vincristine kombinasyonu, literatürde yer alan farmakolojik profilleri açısından değerlendirilmiş; her bir bileşenin glukoz metabolizması, insülin duyarlılığı ve beta hücre fonksiyonu üzerindeki potansiyel etkileri incelenmiştir. Ancak mevcut bilimsel veriler, bu kombinasyonun T2D için rasyonel bir sinerji oluşturmadığını göstermektedir.
Oxypertine
Oxypertine, serotonin ve dopamin reseptörleri üzerinde etkili bir antipsikotik ajandır. Serotonerjik aktivitesi sayesinde duygudurum regülasyonu ve anksiyolitik etki sağlar; ancak metabolik parametreler üzerine doğrudan veya dolaylı bir iyileştirici etkisi bulunmamaktadır. Mevcut literatürde glukoz metabolizması, insülin direnci, lipid profili veya beta hücre fonksiyonu üzerinde anlamlı bir etkisine dair klinik ya da deneysel kanıt yer almamaktadır. Aksine, serotonin sistemini etkileyen bazı antipsikotiklerin (örneğin olanzapin, risperidon) ağırlık artışı ve insülin direnci gibi yan etkilere neden olduğu bilinmektedir [25]. Dolayısıyla, Oxypertine’in T2D patofizyolojisine olumlu katkı sağlayacağına dair kanıta dayalı bir destek bulunmamaktadır.
Methoxyflurane
Methoxyflurane, halojenli bir inhale anestezik ajandır ve esas olarak analjezik veya sedatif amaçlarla kullanılmaktadır. Metabolizması sırasında florür iyonları ve oksalat gibi metabolitler üretir; bu metabolitlerin renal toksisite riski taşıdığı bilinmektedir [26]. Diyabetik bireylerde zaten artmış olan oksidatif stres ve böbrek yükü göz önüne alındığında, Methoxyflurane kullanımı ek bir metabolik risk oluşturabilir. Glisemik kontrol, beta hücre fonksiyonu veya insülin direnci üzerine doğrudan etkisini gösteren herhangi bir klinik ya da preklinik çalışma
bulunmamaktadır. Bu nedenle, T2D tedavisinde kullanımı için rasyonel veya terapötik bir temel mevcut değildir.
Captopril
Captopril, anjiyotensin dönüştürücü enzim (ACE) inhibitörü olarak, reninanjiyotensin-aldosteron sistemi (RAAS) üzerinden etki eder. Başlıca endikasyonu hipertansiyon ve diyabetik nefropati tedavisidir. RAAS aktivasyonunun baskılanması, endotelyal fonksiyonun iyileşmesi ve mikrosirkülasyonun korunması gibi faydalar sağlayarak, diyabetik komplikasyonların progresyonunu yavaşlatabilir [27]. Ayrıca bazı meta-analizlerde, Captopril ve benzeri ACE inhibitörlerinin insülin sensitivitesini kısmen artırabileceği bildirilmiştir. Bu etki, bradikinin artışı ve NO sentezinin iyileşmesi aracılığıyla gerçekleşebilir [28]. Ancak bu etkiler ikincil ve dolaylıdır; doğrudan glukoz homeostazını düzenleyen bir mekanizması bulunmamaktadır. Dolayısıyla, Captopril,
T2D tedavisinde yardımcı fakat çekirdek antidiyabetik ajan olarak değerlendirilemez.
Vincristine
Vincristine, mikrotübül polimerizasyonunu inhibe eden bir vinka alkaloididir ve esas olarak kemoterapötik amaçla kullanılır. Hücre bölünmesini durduran etkisi, beta hücre mikrotübül dinamikleri üzerinde de olumsuz sonuçlar doğurur. Mikrotübül ağının bozulması, granül taşınımını ve ekzositoz sürecini engelleyerek insülin sekresyonunu azaltır [29]. Klinik ve deneysel veriler, Vincristine uygulamasının glukoz toleransını bozduğunu ve hiperglisemik etkiler oluşturduğunu göstermektedir [30]. Bu nedenle, Vincristine’in T2D tedavisinde kullanımı kontrendike olup, metabolik denge üzerinde potansiyel olarak zararlı etkilere sahiptir.
Sonuç ve Değerlendirme
Önerilen Oxypertine–Methoxyflurane–Captopril–Vincristine kombinasyonu, Tip 2 Diyabet patofizyolojisinde yer alan metabolik, inflamatuvar veya oksidatif süreçleri hedefleyen rasyonel bir sinerji sunmamaktadır.
• Oxypertine ve Methoxyflurane’in diyabetle ilişkili herhangi bir terapötik faydası kanıtlanmamıştır.
• Vincristine, insülin sekresyonunu baskılayarak metabolik durumu kötüleştirme potansiyeline sahiptir.
• Captopril ise yalnızca ikincil düzeyde fayda sağlayabilir, ancak birincil antidiyabetik etki göstermez.
Dolayısıyla bu kombinasyonun, T2D tedavisinde kullanımı için biyolojik veya klinik bir dayanak bulunmamaktadır. Gelecekteki kombinasyon yaklaşımlarının, AMPK aktivasyonu, NF-κB baskısı, oksidatif stres modülasyonu ve beta hücre koruyucu etkiler gibi patogenezle doğrudan ilişkili hedeflere odaklanması gerekmektedir [25– 30].
Sonuç
Tip 2 Diyabet (T2D), tek bir patolojik mekanizma ile açıklanamayacak kadar karmaşık, metabolik, inflamatuvar, oksidatif, epigenetik ve hücresel stres yanıtlarının kesiştiği çok boyutlu bir biyokimyasal ağ hastalığıdır. Bu hastalık, yalnızca hiperglisemi ile değil, aynı zamanda sinyal iletim bozuklukları, hücresel enerji dengesizlikleri, protein katlanma stresleri ve epigenetik yeniden programlama süreçleri ile şekillenir [1–3,10,14].
Moleküler düzeyde T2D’nin ilerleyici doğasında birkaç temel patojenik eksen belirleyici rol oynar:
• IRS-1/PI3K/Akt sinyal bozukluğu: Obezite ve kronik inflamasyona bağlı olarak IRS-1 üzerinde serin fosforilasyonu artar, bu da PI3K/Akt yolunun aktivasyonunu baskılar ve GLUT4 translokasyonu bozulur. Sonuçta, glukoz alımı azalır ve insülin direnci kronikleşir [1,2,12].
• ER stres–UPR–CHOP ekseni: Uzun süreli glukolipotoksisite, endoplazmik retikulum (ER)'de protein katlanma yükünü artırarak UPR (unfolded protein response) mekanizmalarını kronik olarak aktive eder. PERK–ATF4–CHOP yolunun sürekli aktivasyonu, apoptotik sinyal ağlarını tetikleyerek beta hücre kaybına neden olur [10,11].
• Mitokondriyal ROS birikimi: Serbest yağ asitleri ve hiperglisemi, elektron taşıma zincirinde aşırı ROS üretimine yol açar. Mitokondriyal DNA hasarı, PGC-1α ekspresyonunda azalma ve ATP üretiminde düşüş ile birleşerek insülin sekresyonunun bozulmasına katkıda bulunur [8,9,20].
• NLRP3 inflamozomu aktivasyonu: Obezite ve ER stresine bağlı IRE1–TXNIP yolunun uyarılması, NLRP3 inflamozomunun aktive olmasına ve IL-1β salınımına yol açar. Bu durum, beta hücre apoptozunu ve metabolik inflamasyonu artırarak hastalığın ilerleyişini hızlandırır [17,18,24].
• Epigenetik modifikasyonlar: DNA metilasyonu (PPARGC1A, INS), histon modifikasyonları (H3K9me3, H3K27me3) ve miRNA (miR-375, miR-9, miR-29) değişimleri, gen ekspresyonunun kalıcı baskılanmasına yol açar. Bu epigenetik yeniden programlama, metabolik bellek oluşturarak HbA1c kontrolünden bağımsız olarak vasküler komplikasyonların devam etmesine neden olur [14– 16].
Bu bütüncül ağ, T2D’nin hem insülin direnci hem de beta hücre disfonksiyonu bileşenlerini besleyen karşılıklı döngüler oluşturur. Dolayısıyla, hastalığın yönetimi tek hedefli monoterapilerle sınırlı kalamaz; çoklu biyolojik süreçleri eşzamanlı hedefleyen multimodal tedavi stratejileri gerektirir [4,5,9].
Bu derlemede incelenen Oxypertine–Methoxyflurane–Captopril–Vincristine kombinasyonu, T2D’nin moleküler fizyopatolojisiyle karşılaştırıldığında sınırlı terapötik uyum göstermektedir:
• Oxypertine, glukoz metabolizması veya insülin direnci üzerinde kanıtlanmış bir etkisi olmayan bir antipsikotiktir [25].
• Methoxyflurane, metabolik parametreleri etkilemeyen bir inhale anesteziktir ve potansiyel renal toksisite riski taşır [26].
• Captopril, ACE inhibitörü olarak insülin duyarlılığında kısmi iyileşme sağlayabilir; ancak bu etki ikincil ve sınırlı düzeydedir [27,28].
• Vincristine ise mikrotübül dinamiklerini bozarak insülin sekresyonunu azaltır ve glukoz toleransını kötüleştirir; bu nedenle diyabetik hastalarda kontrendike bir ajan olarak değerlendirilir [29,30].
Sonuç olarak, bu kombinasyonda yer alan ajanlardan yalnızca Captopril kısmi ve dolaylı fayda potansiyeline sahipken; Oxypertine, Methoxyflurane ve Vincristine,
T2D’nin patogenetik hedefleriyle uyumlu değildir. Bu nedenle söz konusu kombinasyon, biyolojik rasyonalitesi ve kanıta dayalı desteği açısından zayıf bir tedavi modeli oluşturmaktadır.
Bu derleme, T2D’nin yönetiminde çok eksenli tedavi stratejilerinin gerekliliğini vurgulamaktadır. Gelecekteki çalışmaların, özellikle şu üç temel alanda yoğunlaşması önerilmektedir:
1. Metabolik inflamasyonun baskılanması (NF-κB, NLRP3, IL-1β eksenleri),
2. Mitokondriyal stresin azaltılması (AMPK aktivasyonu, ROS kontrolü),
3. Epigenetik yeniden programlamanın modülasyonu (DNA metilasyonu, histon modifikasyonları, miRNA regülasyonu).
Bu eksenlerin hedeflenmesi, glisemik kontrolün ötesinde hücresel homeostazın yeniden sağlanmasına ve hastalığın progresyonunun yavaşlatılmasına katkı sağlayabilir [9,14,17,18,24].
Kaynakça
1. Liu C, Feng X, Li Q, Wang Y, Xu L, Yu Q, et al. Adipokines in obesity-associated insulin resistance. J Biomed Res. 2022;36(3):151–64.
2. Sethi JK, Vidal-Puig AJ. Thematic review series: Adipocyte Biology. Adipose tissue function and plasticity orchestrate nutritional adaptation. J Lipid Res.
2007;48(6):1253–62.
3. Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines in inflammation and metabolic disease. Nat Rev Immunol. 2011;11(2):85–97.
4. Fernández-Rodríguez R, Ochoa-González F, et al. Exercise and inflammatory markers in type 2 diabetes: a meta-analysis. Diabetes Metab J.
2022;46(3):439–50.
5. Eizirik DL, Cardozo AK, Cnop M. The role for endoplasmic reticulum stress in diabetes mellitus. Endocr Rev. 2008;29(1):42–61.
6. Wang Z, York NW, Nichols CG, Remedi MS. Pancreatic β cell dedifferentiation in diabetes and redifferentiation following insulin therapy. Cell Metab.
2014;19(5):872–82.
7. Cinti F, Bouchi R, Kim-Muller JY, et al. Evidence of β-cell dedifferentiation in human type 2 diabetes. J Clin Endocrinol Metab. 2016;101(3):1044–54. 8. Lenzen S. Oxidative stress: the vulnerable beta-cell. Biochem Soc Trans.
2008;36(Pt 3):343–7.
9. Montgomery MK, Turner N. Mitochondrial dysfunction and insulin resistance: an update. Endocr Connect. 2015;4(1):R1–R15.
10. Hotamisligil GS. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease. Cell. 2010;140(6):900–17.
11. Laybutt DR, Preston AM, Akerfeldt MC, et al. Endoplasmic reticulum stress contributes to beta-cell apoptosis in type 2 diabetes. Diabetologia.
2007;50(4):752–63.
12. Shoelson SE, Lee J, Goldfine AB. Inflammation and insulin resistance. J Clin Invest. 2006;116(7):1793–801.
13. Pedersen BK, Saltin B. Exercise as medicine – evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand J Med Sci Sports.
2015;25(S3):1–72.
14. Ling C, Rönn T. Epigenetic adaptation to regular exercise in humans. Drug Discov Today. 2014;19(7):1015–8.
15. Zhao Y, Sun H, et al. MicroRNAs and β-cell function in diabetes mellitus. Arch Biochem Biophys. 2018;654:91–8.
16. Rönn T, Volkov P, Davegårdh C, et al. A six months exercise intervention influences the genome-wide DNA methylation pattern in human adipose tissue. PLoS Genet. 2013;9(6):e1003572.
17. Gregor MF, Hotamisligil GS. Inflammatory mechanisms in obesity. Annu Rev Immunol. 2011;29:415–45.
18. Özcan U, Yilmaz E, Özcan L, et al. Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. Science.
2006;313(5790):1137–40.
19. Vandanmagsar B, Youm YH, Ravussin A, et al. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance. Nat Med.
2011;17(2):179–88.
20. Patti ME, Corvera S. The role of mitochondria in the pathogenesis of type 2 diabetes. Endocr Rev. 2010;31(3):364–95.
21. Malhotra JD, Kaufman RJ. Endoplasmic reticulum stress and oxidative stress: a vicious cycle or a double-edged sword? Antioxid Redox Signal.
2007;9(12):2277–93.
22. Cani PD, Amar J, Iglesias MA, et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56(7):1761–72.
23. Barres R, Yan J, Egan B, et al. Acute exercise remodels promoter methylation in human skeletal muscle. Cell Metab. 2012;15(3):405–11.
24. Zhou R, Tardivel A, Thorens B, Choi I, Tschopp J. Thioredoxin-interacting protein links oxidative stress to inflammasome activation. Nat Immunol.
2010;11(2):136–40.
25. Gören JL, Meterko M, et al. Effects of psychotropic medications on glucose metabolism: a review of the evidence. Pharmacotherapy. 2016;36(1):52–68.
26. Mazze RI, Cousins MJ. Methoxyflurane metabolism and renal dysfunction: clinical correlation in man. Anesthesiology. 1973;38(3):231–9.
27. Fogari R, Zoppi A, Mugellini A, et al. Effects of ACE inhibitors on insulin sensitivity and metabolic parameters. Drugs. 1998;55(Suppl 1):45–50.
28. Henriksen EJ. Improvement of insulin sensitivity by antagonism of the renin– angiotensin system. Am J Physiol Regul Integr Comp Physiol.
2007;293(3):R974–80.
29. Arakawa N, Kajiwara E, et al. Effects of vincristine on glucose metabolism and insulin secretion in rats. Jpn J Pharmacol. 1987;43(3):339–47.
30. Wong H, et al. Chemotherapy-induced hyperglycemia: Vincristine and glucose intolerance. Cancer Chemother Pharmacol. 1992;31(2):89–94.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...