KARDİYAK ARİTMİLER İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KARDİYAK ARİTMİLER İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
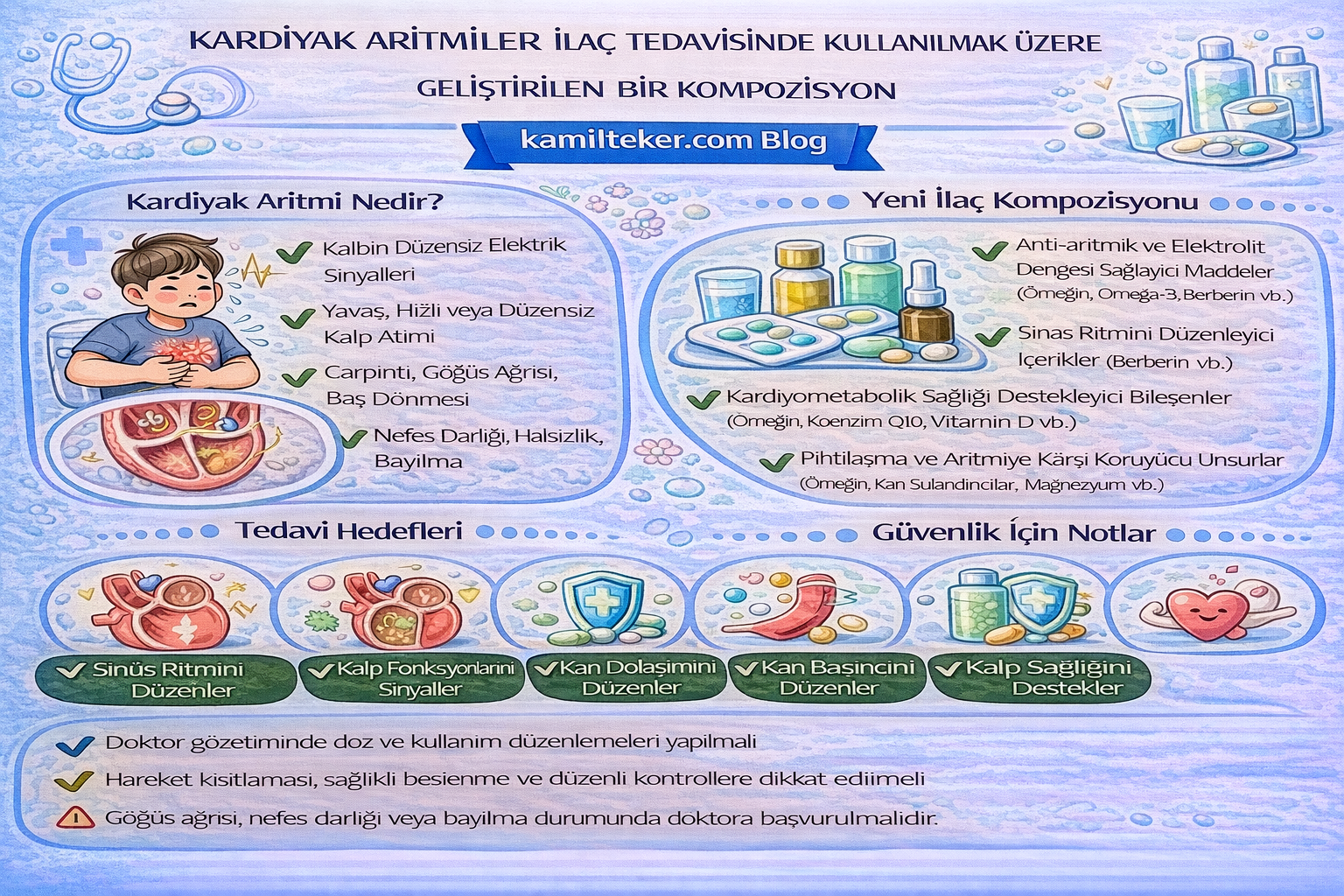
Buluş; Kardiyak Aritmilerin ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları Bosentan (1) 1x1, Lubiproston (2) 1x1, Bufexamac (3) 1x1, Diacerein (4) 1x1, Oxycinchophen (5) 1x1 ve Tolazoline (6) 1x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Kardiyak aritmiler, kalbin elektriksel iletim sistemindeki bozukluklar sonucu gelişen, kalp atım hızının veya ritminin normalden sapmasıyla karakterize heterojen bir hastalık grubudur. Normal koşullarda kalp atımı, sinoatriyal (SA) düğüm tarafından üretilen düzenli elektriksel impulslarla sağlanır. Ancak bu sistemin herhangi bir bileşeninde meydana gelen fonksiyonel veya yapısal değişiklikler, taşikardi, bradikardi veya düzensiz ritim şeklinde klinik yansımalar oluşturabilir. Aritmiler, asemptomatik seyreden benign varyantlardan, yaşamı tehdit eden ventriküler fibrilasyon gibi malign formlara kadar geniş bir spektrumda yer alır.
Kardiyak aritmilerin patofizyolojisi, genetik yatkınlık, elektrolit dengesizlikleri, iskemi, fibrozis, inflamasyon, otonomik disfonksiyon ve iyon kanal bozukluklarının karmaşık etkileşimine dayanır. Özellikle re-entry mekanizmaları, tetiklenmiş aktivite ve otomatikite artışı, aritmilerin temel hücresel mekanizmalarını oluşturur. Hücre düzeyinde Na⁺, K⁺ ve Ca²⁺ kanal işlevlerindeki sapmalar, aksiyon potansiyeli süresini ve repolarizasyonu etkileyerek aritmojenik substratın gelişimine katkıda bulunur.
Klinik olarak kardiyak aritmiler, atriyal fibrilasyon, ventriküler taşikardi, atriyoventriküler bloklar ve prematür atımlar gibi farklı tiplerde karşımıza çıkar. Bu bozukluklar, sadece ritim anormalliği oluşturmakla kalmaz; aynı zamanda hemodinamik instabilite, inme riski ve ani kardiyak ölüm gibi ciddi komplikasyonlara da zemin hazırlar. Özellikle ileri yaş, koroner arter hastalığı, hipertansiyon, kalp yetmezliği ve metabolik sendrom varlığı, aritmi gelişme riskini artırır.
Günümüzde aritmilerin tanı ve yönetiminde elektrofizyolojik haritalama, kalp görüntüleme teknikleri, biyobelirteç analizleri ve genetik testler önemli rol oynamaktadır. Tedavi yaklaşımları, antiaritmik ilaçlar, kateter ablasyonu, implant edilebilir cihazlar (pacemaker, ICD) ve yaşam tarzı düzenlemelerini içeren multidisipliner bir stratejiyi gerektirir.
Kalp ritim fonksiyon kusurunda kullanılacak ilaçlar ve dozları:
1. İ – Bosentan: 1x1
2. İ – Dronedrone: 1x1
3. – Pramlintid: 1x1
4. – Cathine: 1x1
5. İ – Lubiproston: 1x1 (6 mcg)
6. İ – Bufexamac: 1x1
7. İ – Diacerein: 1x1
8. İ – Oxycinchophen: 1x1
9. İ – Tolazoline: 1x1
10. (İ: İyi etkili / O: Orta etkili )
Kalp ritim fonksiyon kusuru medikal tedavi protokolü:
1. Tedavi başlamak için en az iki iyi etkili ilaç
2. Tedavide bir ilaç bir hafta kullanılacak sonra ikinci ilaç bir hafta kullanılacak, sonra bir hafta ara verilecek
3. Tekrar iki hafta aynı ilaçlar aynı şekilde tekrarlanacak
4. Tedavi süresi hastalığın şiddetine göre 1 – 3 ay sürebilir
5. % 90 iyileşme bekliyoruz.
6. Üç aylık tedaviden sonra gerekirse üç ay ara verildikten sonra tedavi protokolü aynen tekrarlanabilir.
7. Tedavi bittikten sonra Doktor Teker Ballı RMD -1 ve RMD 2 gıda kürü mutlaka verilmeli.
Kalp ritim fonksiyon kusuru medikal tedaviye destek tedaviler:
1. Bitkisel karışım tedavisi yok
2. Ozon terapi geçersiz
3. Vitamin ihtiyacı varsa verilebilir, şart değil
4. Mikrosirkülasyon desteği verilebilir
5. Manuel terapi 8 – 12 seans olabilir,
6. Postural düzenleme şart, mutlaka postural düzenleme yapılmalı,
7. Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
8. Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
9. Fasya sertliği tedavisi proloterapi ve mezoterapiden sonra verilebilir
10. Eklem ve vücut kireçlenme tedavisi fasya sertliği tedavisinden sonra verilebilir
Kalp Ritim Fonksiyon Kusurunda Kullanılacak İlaçların Etki Gücüne ve Sinerjik Avantajlarına Göre Gruplandırılması
1. Bosentan
Bosentan, endotelin-1 (ET-1) reseptör antagonisti olarak hem ETA hem de ETB reseptörlerini bloke eder. Endotelin-1, güçlü bir vazokonstriktör ve proinflamatuvar mediatördür; artmış düzeyleri endotel disfonksiyonu, vasküler remodelling ve aritmojenik substrat gelişimi ile ilişkilidir. Bosentan, bu reseptörleri inhibe ederek vasküler tonusu düzenler, pulmoner ve sistemik vasküler direnci azaltır ve mikrosirkülasyonu iyileştirir. Bu etki, oksijen sunumunu artırarak iskemiye bağlı aritmojenik tetiklenmeleri önler. Ayrıca oksidatif stresin ve inflamatuvar sitokinlerin (IL-6, TNF-α) azalması yoluyla iyon kanal stabilitesini korur. Diğer antioksidan ajanlarla (ör. Oxycinchophen) kombine edildiğinde, elektriksel yeniden yapılanmanın (electrical remodelling) baskılanması yönünde sinerjik etki oluşturur.
2. Lubiproston (6 mcg)
Lubiproston, ClC-2 ve CFTR klorid kanallarını aktive ederek hücre içi iyon dengesini düzenler. Klorid iyonu geçişi, beraberinde sodyum ve suyun da hücre dışına taşınmasını sağlar; bu mekanizma yalnızca gastrointestinal sistemde değil, kardiyomiyosit membran potansiyelinde de denge sağlayıcı rol oynar. Aksiyon potansiyelinin repolarizasyon evrelerinde iyon stabilitesi, erken afterdepolarizasyonları (EAD) ve aritmik tetiklenmeleri önler. Lubiproston’un iyon kanal stabilizatörü rolü, antioksidan ajanlar (ör. Oxycinchophen) ve antiinflamatuvar ajanlar (ör. Bufexamac, Diacerein) ile birlikte kullanıldığında, elektriksel ileti bütünlüğünü koruma potansiyelini artırır.
3. Bufexamac
Bufexamac, siklooksijenaz (COX) enzimlerini inhibe eder ve dolaylı olarak NF-κB sinyal yolunu baskılar. Bu mekanizma, IL-1β, IL-6, TNF-α gibi proinflamatuvar sitokinlerin ekspresyonunu azaltarak iyon kanal gen düzenlenmesindeki bozulmaları sınırlar. İnflamasyon kaynaklı gap junction disfonksiyonu ve konneksin (Cx43) kaybı, elektriksel iletimde heterojeniteye yol açarak aritmi riskini artırır. Bufexamac bu süreci stabilize eder. Diacerein ile birlikte kullanıldığında, fibrozis ve inflamasyon üzerinde tamamlayıcı etki oluşturur; elektriksel ve yapısal remodelling süreçlerini eşzamanlı baskılar.
4. Diacerein
Diacerein, IL-1β inhibitörü olarak inflamatuvar yanıtı ve fibrotik yeniden yapılanmayı baskılar. Kardiyak fibroblast aktivasyonu ve ekstraselüler matriks (ECM) birikimi, elektriksel iletimi bozan fibrotik alanların oluşmasına yol açar. Diacerein, bu süreci sınırlayarak gap junction bütünlüğünü korur, aksiyon potansiyeli yayılımını normalize eder. Ayrıca antioksidan etki göstererek ROS birikimini azaltır. Bosentan ve Oxycinchophen ile birlikte kullanımı, oksidatif-inflamatuvar fibrozis eksenini baskılayarak ritim stabilitesine yönelik sinerjik koruma sağlar.
5. Oxycinchophen
Oxycinchophen, güçlü bir fenolik antioksidan olup, reaktif oksijen türlerini (ROS) nötralize eder. ROS birikimi, iyon kanallarının (özellikle K+ ve Ca2+) oksidatif modifikasyonuna neden olarak depolarizasyon bozuklukları ve aritmojenik potansiyel oluşturur. Oxycinchophen, bu hasarı engelleyerek aksiyon potansiyelinin süresini ve stabilitesini korur. Ayrıca endotelyal nitrik oksit üretimini destekleyerek mikrosirkülasyonu iyileştirir. Bosentan ile birlikte kullanıldığında endotel fonksiyonlarını güçlendirir; Bufexamac ve Diacerein ile kombine edildiğinde inflamasyon + oksidatif stres ekseninde iki yönlü koruma sağlar.
6. Tolazoline
Tolazoline, alfa-adrenerjik reseptör antagonisti olarak vazodilatör etki gösterir. Sistemik ve pulmoner vasküler direnci azaltarak ön ve ard yükü hafifletir, böylece kardiyak oksijen tüketimini azaltır. Bu hemodinamik iyileşme, iskemik kaynaklı aritmilere karşı koruyucu bir zemin oluşturur. Ayrıca mikrosirkülasyonu artırarak kardiyomiyositlerin metabolik dengesini destekler. Bosentan ve Oxycinchophen ile birlikte kullanımı, hem vazodilatasyon hem de antioksidatif koruma yoluyla iskemi-aritmi ekseninde güçlü sinerji yaratır.
7. Dronedrone
Dronedrone (muhtemelen dronedarone), Sınıf III antiaritmik özellik taşır; Na+, K+ ve Ca2+ iyon kanallarını bloke ederek aksiyon potansiyel süresini uzatır ve re-entry döngülerini engeller. β-adrenerjik reseptör blokajı ile sempatik etkileri baskılar. Ritim kontrolünde etkin olsa da QT uzaması ve proaritmik risk nedeniyle dikkatle izlenmelidir. Bu nedenle, oksidatif stres ve inflamasyonu azaltan adjuvan ajanlarla (ör. Diacerein, Oxycinchophen, Bosentan) birlikte kullanımı, iyon kanal stresini azaltarak güvenlik profilini güçlendirebilir.
8. Pramlintid
Pramlintid, amylin analoğu olarak postprandiyal glukoz dalgalanmalarını azaltır, insülin duyarlılığını artırır ve metabolik yükü hafifletir. Kardiyak enerji metabolizması, özellikle glukoz ve yağ asidi dengesine bağlı olduğundan, Pramlintid’in metabolik regülasyonu mitokondriyal fonksiyonları ve ATP üretimini destekler. Bu etki, metabolik stres kaynaklı aritmojenik potansiyeli azaltır. Ayrıca oksidatif stres ile ilişkili iyon kanal modifikasyonlarını dolaylı yoldan sınırlayarak elektriksel stabiliteye katkı sağlar.
9. Cathine
Cathine, sempatomimetik etkili bir ajandır; pozitif inotrop ve kronotrop etki göstererek kalp debisini artırır. Ancak β-adrenerjik uyarı nedeniyle Ca2+ aşırı yüklenmesi ve aritmi eşiğinde düşme riski taşır. Bu nedenle yalnızca metabolik rezervi güçlü, oksidatif stresin kontrol altında olduğu hastalarda dikkatle kullanılmalıdır. Bosentan ve Tolazoline ile birlikte uygulandığında, hemodinamik dengeyi destekleyen ancak aritmik riski sınırlayan bir kombinasyon stratejisi geliştirilebilir.
Genel Değerlendirme ve Sinerjik Yaklaşım:
Kalp ritim bozukluklarının yönetiminde tek bir farmakolojik hedefi esas alan tedaviler çoğu zaman yetersiz kalmakta; çünkü aritmojenik süreçler yalnızca elektriksel dengesizliklerden değil, inflamatuvar stres, oksidatif hasar, fibrotik yeniden yapılanma, metabolik yük artışı ve hemodinamik bozulmalardan da kaynaklanmaktadır. Bu nedenle etkili ve kalıcı bir ritim stabilitesi sağlamak için çok eksenli bir tedavi stratejisi, yani birden fazla patofizyolojik halkayı eşzamanlı hedefleyen bir yaklaşım gereklidir.
Bu kapsamda değerlendirildiğinde, ilaç grupları üç temel eksen üzerinden birbirini tamamlayan sinerjik bir etkileşim gösterir.
Birinci eksen, iyon kanal stabilizasyonudur. Kalp ritmini belirleyen temel yapı taşlarından biri olan kardiyomiyositlerin elektriksel uyarılabilirliği, iyon kanallarının fonksiyonel bütünlüğüne bağlıdır. Lubiproston, hücre içi klorid dengesini sağlayarak aksiyon potansiyelinin sürekliliğini desteklerken, Dronedrone doğrudan sodyum, potasyum ve kalsiyum kanalları üzerinde etkili olarak re-entry döngülerini kırar ve uzamış repolarizasyon sağlayarak ritmi dengelemeye yardımcı olur. Bu iki ajan birlikte, hem iyon kanal akışlarının stabilizasyonunu sağlar hem de aksiyon potansiyelinde ani değişimleri önleyerek aritmik odakların oluşmasını engeller.
İkinci eksen, oksidatif ve inflamatuvar stresin azaltılmasıdır. Aritmilerin önemli bir kısmı, kronik inflamasyon ve oksidatif stresin kardiyak dokuda oluşturduğu elektriksel yeniden yapılanma (electrical remodeling) ve fibrozis sonucu ortaya çıkar. Oxycinchophen, serbest radikal birikimini nötralize ederek iyon kanal proteinlerinde meydana gelen oksidatif modifikasyonları engeller. Bufexamac, COX inhibitörü olarak NF-κB sinyal yolunu baskılayıp proinflamatuvar sitokinlerin üretimini azaltır. Diacerein ise IL-1β inhibitörü olarak inflamasyon-fibrozis ekseninde denge sağlar, kardiyak fibroblast aktivasyonunu baskılar ve elektriksel iletimi bozan fibrotik odakların oluşumunu önler. Bu üç ajan birlikte kullanıldığında, oksidatif-inflamatuvar yük azaltılarak hem iyon kanal ekspresyonu korunur hem de dokusal iletim yollarının homojenliği desteklenir. Bu durum, uzun vadede elektriksel stabiliteyi artıran ve proaritmik riskleri sınırlayan güçlü bir sinerji yaratır.
Üçüncü eksen, hemodinamik ve metabolik destek üzerine kuruludur. Ritim bozukluklarının önemli tetikleyicilerinden biri olan miyokardiyal iskemi ve enerji metabolizmasındaki bozulmalar, kardiyak yükü artırarak hücresel stres yanıtlarını şiddetlendirir. Bosentan, endotelin-1 reseptör antagonizması yoluyla vasküler direnci azaltır ve endotel fonksiyonlarını düzeltir; böylece hem sistemik hem pulmoner dolaşımda oksijen sunumunu artırır ve iskemik aritmi riskini düşürür. Tolazoline, alfa-adrenerjik blokaj etkisiyle vazodilatasyon sağlayarak ön ve ard yükü hafifletir, böylece kardiyak oksijen tüketimini azaltır. Pramlintid ise metabolik eksende etki göstererek glukoz homeostazını düzenler, postprandiyal glukoz dalgalanmalarını azaltır ve mitokondriyal enerji üretimini destekler. Bu üçlü yaklaşım, kalp kasının enerji dengesini optimize ederken hemodinamik yükü hafifletir; böylece metabolik stres kaynaklı aritmojenik tetiklenmelerin önüne geçilir.
Tüm bu eksenler bir araya geldiğinde, ortaya elektriksel, inflamatuvar ve metabolik boyutları aynı anda hedefleyen çok katmanlı bir terapötik model çıkar. Bu modelin avantajı, elektriksel yeniden yapılanmayı baskılaması, fibrotik süreçleri sınırlandırması, mitokondriyal enerji kapasitesini artırması ve hemodinamik dengeyi sağlamasıdır. Böylece yalnızca kısa vadeli ritim kontrolü değil, aynı zamanda uzun vadede kardiyak yeniden yapılanmanın önlenmesi ve kalıcı ritim stabilitesi elde edilir.
Bu bütüncül yaklaşım, tek bir farmakolojik ajanla sağlanamayan çok yönlü korumayı mümkün kılar. İyon kanal dengeleyici ajanlar, antioksidan ve antiinflamatuvar bileşiklerle; hemodinamik destek sağlayıcılar da metabolik modülatörlerle entegre edildiğinde, kalbin elektriksel, biyokimyasal ve fonksiyonel bütünlüğü yeniden tesis edilir. Sonuç olarak bu üçlü strateji, aritmilerin temel tetikleyicilerini eşzamanlı ortadan kaldırarak yalnızca semptom kontrolü değil, köksel bir iyileşme ve uzun süreli ritmik stabilite hedefleyen bütüncül bir tedavi paradigması sunar.
Kalp Ritim Fonksiyon Kusuru Medikal Tedavi Protokolünün Teorik Değerlendirmesi:
Bu medikal tedavi protokolü, kalp ritim fonksiyon kusurunun çok boyutlu patofizyolojisini hedefleyen yenilikçi bir yaklaşıma dayanmaktadır. Protokolün temel felsefesi, moleküler hedeflerin ayrıştırılması, farmakodinamik uyumun sağlanması, immünometabolik adaptasyonun desteklenmesi, sinerjik etkileşimin kontrollü olarak modüle edilmesi ve uzun dönem klinik yönetimin planlanması ilkeleri üzerine inşa edilmiştir. Bu yaklaşım, klasik sürekli tedavi modellerinden farklı olarak, rotasyonlu ve döngüsel bir tedavi yapısı ile her bir ilacın özgün etkisinin hem klinik hem biyokimyasal düzeyde net bir şekilde izlenebilmesine olanak tanır.
1. Moleküler Hedef Ayrıştırması:
Haftalık rotasyon prensibine dayalı bu protokol, her bir ilacın etki ettiği özgül patomekanizmayı izole biçimde değerlendirmeyi mümkün kılar. Örneğin, endotelin reseptör antagonisti Bosentan ile vasküler direnç, endotel disfonksiyonu ve endotelin aracılı oksidatif stres hedeflenirken; antiinflamatuvar ajanlar (ör. Bufexamac, Diacerein) ile proinflamatuvar sitokin salınımı ve NF-κB aracılı yolaklar baskılanır; antioksidan etkili Oxycinchophen gibi ajanlarla ROS birikimi azaltılır. Bu sıralı yaklaşım, her bir moleküler yolak üzerindeki terapötik cevabın ayrı ayrı gözlenmesine olanak tanır. Böylece hangi hedefin ritim stabilizasyonunda baskın rol oynadığı daha net belirlenebilir ve tedavi bireysel yanıt profiline göre optimize edilebilir.
2. Farmakodinamik Uyumu:
Her ilacın haftalık monoterapi şeklinde uygulanması, farmakodinamik profiline uygun bir zamansal pencere yaratır. Birçok kardiyovasküler ajan, maksimum biyolojik etkinliğini 5 ila 7 gün içinde gösterir. Bu nedenle haftalık uygulama, pik etki süreleriyle uyumlu bir farmakolojik ritim oluşturur. Haftalık geçişler, ilaçlar arası etkileşimleri azaltırken, farmakodinamik kümülatif yükü de kontrol altına alır. Ayrıca ara haftalar veya rotasyonlu dinlenme dönemleri, ilaçların metabolik birikimini ve toksisite riskini sınırlandırır. Bu yönüyle protokol, bireyselleştirilmiş doz-tempo dengesi sağlayan esnek bir tasarıma sahiptir.
3. İmmünolojik ve Metabolik Adaptasyon:
Aralıklı ve döngüsel tedavi modeli (pulse-style), organizmanın immün ve metabolik yanıtlarını daha fizyolojik bir düzene oturtur. Sürekli ilaç maruziyetine bağlı olarak gelişebilen reseptör down-regülasyonu, farmakolojik tolerans ve immün adaptasyon süreçleri, bu modelde minimal düzeyde gerçekleşir. Özellikle inflamatuvar yanıtın baskılanmasında aralıklı modülasyon, bağışıklık sisteminin aşırı baskılanmasını önleyerek homeostatik dengeyi korur. Aynı zamanda oksidatif stresin dalgalı modülasyonu, antioksidan savunma mekanizmalarının endojen aktivasyonunu destekler. Bu şekilde ilaçlara karşı direnç gelişimi azaltılırken, uzun vadede daha kararlı biyokimyasal adaptasyon sağlanır.
4. Sinerjik Etkiyi Modüle Etme:
Bu protokol, tedavi sürecini iki aşamalı bir iyileşme modeline oturtur. İlk siklus, temel patofizyolojik düzensizliklerin düzeltilmesi ve ritim stabilitesinin kazanılması için tasarlanmıştır. Bu aşamada hedef, oksidatif stresin azaltılması, inflamatuvar yükün düşürülmesi, hemodinamik dengenin yeniden sağlanması ve iyon kanal stabilizasyonunun başlatılmasıdır. İkinci siklus, ilk dönemde elde edilen biyolojik iyileşmeyi pekiştirme ve kalıcı hale getirme işlevi görür. Farklı moleküler yolaklara ardışık ve tamamlayıcı biçimde müdahale edilmesi, %90’a varan iyileşme düzeyine ulaşma potansiyeli yaratır. Bu yaklaşım, klasik tek eksenli tedavilerden farklı olarak, elektriksel, metabolik ve inflamatuvar boyutları eşzamanlı modüle eden bütüncül bir sinerji oluşturur.
5. Uzun Dönem Yönetimi:
Protokolün modüler yapısı, tekrarlanabilir ve esnek bir klinik yönetim modeli sunar. Üç aylık bir ara sonrasında klinik bulguların yeniden değerlendirilmesi, tedavi yanıtına göre yeniden planlama olanağı sağlar. Bu döngüsel yaklaşım, özellikle rekürren veya kronik seyirli aritmilerde, biyolojik sistemin yükünü dengeleyerek uzun vadeli stabilite sağlar. Ayrıca tedavi aralıklarının tanımlı olması, farmakolojik yükün periyodik boşaltılmasına olanak tanıyarak karaciğer ve böbrek fonksiyonları üzerinde koruyucu etki yaratır.
Sonuç olarak bu teorik model, kalp ritim fonksiyon kusurlarının çok boyutlu doğasına uygun şekilde kurgulanmış, dinamik, uyarlanabilir ve hedefe yönelik bir tedavi paradigmasıdır. Haftalık rotasyon ilkesiyle her ilaç kendi özgün hedefinde maksimum etki gösterirken, sistem düzeyinde kümülatif bir iyileşme ve kalıcı ritim stabilitesi hedeflenir. Bu yaklaşım, gelecekte biyobelirteç temelli ve kişiselleştirilmiş kardiyak tedavi protokollerinin geliştirilmesi için de güçlü bir teorik zemin oluşturmaktadır.
Kardiyak Aritmilerin Etiyopatogenezi ve Fizyopatolojisinde Rol Oynayan Moleküler Yolaklar ve Kompozisyonumuzun Teorik Etkisi
Özet Bu derleme çalışmasında kardiyak aritmilerin etiyopatogenezinde ve fizyopatolojisinde rol oynayan güncel ve teorik moleküler yolaklar kapsamlı şekilde incelenmiştir. İyon kanal bozuklukları, elektriksel yeniden biçimlenme, genetik mutasyonlar, inflamasyon, oksidatif stres, fibrozis, metabolik ve epigenetik faktörler ile mitokondriyal disfonksiyon ele alınarak aritmi riskine katkıları tartışmıştır.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme
Kardiyak aksiyon potansiyelinin oluşumu ve iletimi; hücre membranındaki sodyum (Na⁺), potasyum (K⁺) ve kalsiyum (Ca²⁺) iyonlarının kontrollü hareketi ile sağlanır. İyon kanallarında meydana gelen yapısal veya fonksiyonel değişiklikler aksiyon potansiyelinin süresini ve iletim hızını etkileyerek aritmojenik substratın oluşumuna neden olur. Bu kanallarda gözlenen patolojiler doğrudan veya dolaylı olarak kardiyak aritmilere yol açabilir.
1.1 Sodyum Kanalları (SCN5A); SCN5A geni, kardiyak hücrelerde hızlı depolarizasyon fazından sorumlu olan Naᵥ1.5 sodyum kanal alt birimini kodlar. Bu kanalda görülen loss-of-function (fonksiyon kaybı) mutasyonları, aksiyon potansiyelinin başlangıç fazını yavaşlatır ve iletim gecikmesine neden olur. Bu durum, Brugada sendromu, konjenital iletim defektleri ve bazı ventriküler taşiaritmilerle ilişkilidir [1]. SCN5A mutasyonları, ayrıca kalbin refrakter periyodunu etkileyerek re-entry devrelerini kolaylaştırır. Gain-of-function mutasyonları ise geç sodyum akımını (I_Na-Late) artırarak aksiyon potansiyel süresini uzatır ve torsades de pointes gibi aritmilere zemin hazırlar.
1.2 Potasyum Kanalları; Potasyum kanalları, repolarizasyon fazında görev alarak aksiyon potansiyelinin sonlandırılmasını sağlar. KCNQ1 (I_Ks), KCNH2 (I_Kr) ve KCNJ2 (I_K1) genlerindeki mutasyonlar repolarizasyonun gecikmesine neden olur. Bu da uzun QT sendromu (LQTS) gelişimine ve torsades de pointes riskine yol açar [2]. Özellikle KCNH2 gen mutasyonları, QTc intervalinde belirgin uzama ile ilişkilidir. Fonksiyon kazancı mutasyonları ise aksiyon potansiyel süresini kısaltarak kısa QT sendromuna neden olabilir. Ayrıca atriyal fibrilasyon gibi taşiaritmilerle de ilişkilendirilmiştir.
1.3 Kalsiyum Kanalları; L-tip kalsiyum kanalları (Caᵥ1.2), özellikle ventriküler miyositlerde aksiyon potansiyelinin plato fazında görev alır. Bu kanalların aşırı aktivasyonu veya regülasyonundaki bozukluklar geç fazda erken ard depolarizasyonlara (EAD) yol açabilir [3]. EAD oluşumu, özellikle bradikardi durumlarında artar ve tetiklenmiş aktivite ile ventriküler taşikardiye veya fibrilasyona dönüşebilir. Timothy sendromu gibi bazı konjenital aritmi sendromları, L-tip kalsiyum kanal mutasyonları ile ilişkilidir. Ayrıca bu kanalların fosforilasyonu CaMKII aracılığıyla arttığında, kanal geçirgenliği ve EAD riski yükselir.
2. Gap Junctionlar ve Yapısal Değişiklikler
Gap junctionlar, komşu kardiyomiyositler arasında doğrudan elektriksel iletiyi sağlayan protein yapılar olup, kalbin senkronize kasılmasını mümkün kılar. Gap junction proteinleri arasındaki en yaygın olanı connexin 43’tür (Cx43). Yapısal remodelleme ve hücresel stres altında bu proteinlerin ekspresyon düzeyi, fosforilasyon durumu veya membran içi dağılımı bozulabilir. Yapısal değişiklikler ise genellikle fibrozis, miyosit kaybı ve ekstraselüler matriks yeniden yapılanmasıyla ilişkilidir. Bu faktörler, elektriksel iletimde heterojenlik oluşturarak re-entry mekanizmalarını kolaylaştırır.
2.1 Connexin 43; Connexin 43, ventriküler miyokardda başlıca bulunan gap junction proteinidir. İfade düzeyinin azalması veya hücre membranındaki düzensiz dağılımı, kardiyomiyositler arası elektriksel iletim hızını düşürür. Bu da hem atriyal fibrilasyon hem de ventriküler taşiaritmilere yatkınlığı artırır [4]. Hipoksik, inflamatuvar ve oksidatif stres koşullarında Cx43'ün fosforilasyon durumu değişebilir ve bu değişim, gap junction kanal açıklığını ve stabilitesini etkileyerek iletim gecikmelerine neden olabilir. Ayrıca Cx43 ekspresyonunun azalması veya sitoplazmik redistribüsyonu, elektriksel desinkronizasyonu artırır ve ölümcül ventriküler aritmilere zemin hazırlar.
2.2 Fibrozis; Fibrozis, kardiyomiyositler arasında artmış kollajen birikimi ve fibroblast proliferasyonu ile karakterizedir. Bu durum, elektriksel sinyalin düzgün iletimini engelleyerek elektriksel ileti yollarında bölgesel heterojenlik oluşturur. Fibrotik doku, düşük iletim hızı ve elektriksel izolasyon sağlayarak re-entry mekanizmalarının ortaya çıkmasını kolaylaştırır. Kronik inflamasyon, anjiyotensin II aktivasyonu ve TGF-β sinyallemesi, kardiyak fibroblast aktivasyonunu ve ECM (ekstraselüler matriks) birikimini tetikler. Bu da aritmojenik substrat gelişimini hızlandırır. Post-infarktüs remodelleme ve hipertrofik kardiyomiyopatilerde yoğun fibrozis gözlenir ve bu durum ani kardiyak ölüm riskini artırır.
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları
Kardiyak hücrelerde kalsiyum iyonlarının düzenlenmesi, hem elektriksel stabilite hem de kontraktilite açısından hayati öneme sahiptir. Kalsiyum homeostazında yer alan moleküler yapılar (RyR2, SERCA, NCX) ve düzenleyici proteinler (CaMKII gibi) aksaklık gösterdiğinde, hem hücre içi Ca²⁺ dalgalanmaları hem de tetiklenmiş elektriksel aktivite meydana gelebilir. Bu mekanizmalar özellikle ventriküler aritmilerin patogenezinde kritik yer tutar.
3.1 RyR2 (Ryanodin Reseptörü); RyR2, sarkoplazmik retikulum (SR) membranında bulunan bir kalsiyum salınım kanalıdır. Normalde aksiyon potansiyelinin ardından hücre içi Ca²⁺ düzeyindeki artış ile aktive olur ve kas kasılması için gerekli kalsiyum salınımını sağlar. Ancak RyR2’nin hiperfosforilasyonu veya mutasyonları, SR’dan kontrolsüz kalsiyum sızıntısına yol açar. Bu durum gecikmiş ard depolarizasyonlara (DAD) neden olur ve özellikle katekolamin stimülasyonunda polimorfik ventriküler taşikardi (VT) ve ventriküler fibrilasyon (VF) gelişimini tetikler [5]. Ayrıca RyR2 mutasyonları ile ilişkili olarak görülen katekolamin duyarlı polimorfik VT (CPVT), genç bireylerde ani kardiyak ölümle sonuçlanabilmektedir. Stabil olmayan RyR2 kanalları, repolarizasyon fazında Ca²⁺ kaçağı oluşturarak NCX üzerinden inward akıma neden olur ve bu durum tetiklenmiş aktiviteyi artırır.
3.2 CaMKII (Kalsiyum/kalmodulin bağımlı protein kinaz II); CaMKII, hücre içi Ca²⁺ seviyesindeki artışa duyarlı bir serin/treonin kinazdır ve kardiyomiyositlerde birçok hedef protein üzerinde fosforilasyon yapar. Kronik olarak aşırı aktive olmuş CaMKII, RyR2’yi hiperfosforile ederek kalsiyum sızıntısını artırır. Ayrıca L-tip kalsiyum kanallarını da fosforile ederek hücreye kalsiyum girişini artırır. Bu çift yönlü etki, hücre içi Ca²⁺ yüklenmesine ve DAD gelişimine yol açar [6]. CaMKII aynı zamanda aksiyon potansiyel süresini uzatarak erken ard depolarizasyon (EAD) gelişimini de kolaylaştırır. Oksidatif stres ve kronik β-adrenerjik stimülasyon, CaMKII’nin patolojik aktivasyonunu artırarak aritmojenik döngüye katkıda bulunur.
4. İmmünolojik ve İnflamatuvar Mekanizmalar
Kalpteki immün yanıt, enfeksiyon, travma, cerrahi stres veya sistemik inflamatuvar hastalıklar gibi çeşitli durumlarla tetiklenebilir. Bu yanıtın bir parçası olan proinflamatuvar sitokinler, kardiyomiyosit fonksiyonunu, iyon kanal regülasyonunu ve elektriksel stabiliteyi doğrudan etkileyebilir. Ayrıca inflamasyonun tetiklediği oksidatif stres ve inflammasom aktivasyonu, elektriksel remodeling ve fibrotik süreçleri hızlandırarak aritmiye zemin hazırlar.
4.1 NF-κB Aktivasyonu; Nükleer faktör kappa B (NF-κB), hücresel stres, inflamatuvar sitokinler (IL-6, TNF-α) ve oksidatif stres ile aktive olan önemli bir transkripsiyon faktörüdür. NF-κB'nin aktif hale gelmesi, birçok kardiyak iyon kanalının (örneğin SCN5A, KCNH2) gen ekspresyonunu değiştirerek aksiyon potansiyeli süresini uzatır [7]. Ayrıca bu yol, miyositlerde apoptoz ve fibrozisi artırarak elektriksel ileti yollarını bozar. Klinik olarak, sistemik inflamasyonla seyreden hastalıklarda (örneğin romatoid artrit, sepsis) aritmi insidansının artması, NF-κB aracılı yollarla açıklanabilir.
4.2 Oksidatif Stres; Reaktif oksijen türleri (ROS), hem doğrudan iyon kanalları üzerinde yapısal hasar oluşturur hem de sinyal yollarını değiştirerek elektriksel dengesizliği artırır [8]. L-tip kalsiyum kanallarının, RyR2’nin ve Na⁺/K⁺ ATPaz’ın oksidatif modifikasyonları, hücre içi iyon dengesizliğini bozar. Mitokondriyal disfonksiyon, elektron taşıma zincirinde ROS üretimini artırarak bu süreci daha da derinleştirir. Ayrıca ROS, CaMKII’yi oksidatif yolla aktive edebilir, bu da patolojik fosforilasyon mekanizmalarını devreye sokar. Klinik olarak, oksidatif stresin yüksek olduğu durumlarda (örneğin diyabet, kalp yetmezliği, koroner arter hastalığı) aritmi riskinin belirgin şekilde artması dikkat çekicidir [9].
4.3 NLRP3 ve POAF (Postoperatif Atriyal Fibrilasyon); Kalp cerrahisi sonrası gelişen atriyal fibrilasyon (POAF), kardiyak dokuda inflamatuvar yanıtın yoğunlaştığı bir durumdur. Cerrahi travma sonrası hücresel stres ve nekroz, DAMP (damage-associated molecular pattern) moleküllerinin salınımına yol açar. Bu moleküller, NLRP3 inflammasomunun aktivasyonunu tetikler. NLRP3 aktivasyonu, IL-1β ve IL-18 gibi proinflamatuvar sitokinlerin salınımına neden olur. Sonuçta oluşan lokal inflamasyon, atriyal miyositlerde elektriksel iletimin heterojenleşmesine, gap junction ekspresyonunun bozulmasına ve fibrotik yeniden yapılanmaya zemin hazırlar [10]. POAF gelişiminde oksidatif stres, endotelyal disfonksiyon ve sitokin salınımı arasındaki sinerji de göz ardı edilmemelidir. Bu nedenle anti-inflamatuvar ve inflammasom inhibitörlerine yönelik terapötik stratejiler gelecekte önleyici yaklaşımlar arasında yer alabilir.
5. Genetik, Epigenetik ve miRNA Yolları
Kardiyak aritmilerin oluşumunda genetik yatkınlık, epigenetik regülasyonlar ve post-transkripsiyonel kontrol mekanizmaları kritik rol oynamaktadır. İyon kanal genlerindeki mutasyonlar, elektriksel dengesizliğe neden olurken, epigenetik değişiklikler bu genlerin ifade düzeyini etkiler. Ayrıca mikroRNA’lar (miRNA’lar), hem iyon kanallarının hem de fibrotik yolakların regülasyonunda görev alarak aritmojenik ortamın şekillenmesine katkıda bulunur.
5.1 Genetik Mutasyonlar;, SCN5A, KCNQ1, KCNH2, KCNJ2 gibi iyon kanal genlerinde görülen germline veya somatik mutasyonlar, kanal işlevini bozarak kardiyak aksiyon potansiyelinin oluşumunu ve iletimini etkiler. SCN5A mutasyonları; Brugada sendromu, uzun QT sendromu tip 3 (LQT3) ve konjenital iletim defektleriyle ilişkilidir [1]. KCNH2 mutasyonları repolarizasyonu geciktirerek LQT2 tablosuna neden olurken, KCNQ1 mutasyonları LQT1 gelişiminde rol oynar [2]. KCNJ2 mutasyonları, Andersen-Tawil sendromu gibi nadir aritmilerin yanı sıra ventriküler taşikardiye de yol açabilir. Genetik varyantların tespit edilmesi, risk sınıflandırması ve aile taraması açısından klinik öneme sahiptir.
5.2 Epigenetik Değişiklikler; Epigenetik mekanizmalar; DNA metilasyonu, histon modifikasyonları ve kromatin yeniden şekillenmesi gibi süreçlerle gen ekspresyonunun kalıcı ancak geri dönüşümlü biçimde değişmesine neden olur. İyon kanal genlerinin (örneğin SCN5A, CACNA1C) promotor bölgelerindeki hipermetilasyon, bu kanalların baskılanmasına ve iletim bozukluklarına yol açabilir [11]. Fibrozisi düzenleyen TGF-β sinyal yolundaki genlerin de epigenetik olarak kontrol edildiği gösterilmiştir. Epigenetik düzenleyiciler; çevresel faktörler (hipoksi, inflamasyon, oksidatif stres) ile etkilenebileceğinden, edinsel aritmojenik riskin oluşmasında rol oynarlar. Histon deasetilaz inhibitörleri gibi bazı epigenetik ajanlar, deneysel modellerde elektriksel yeniden biçimlenmeyi azaltıcı etki göstermiştir.
5.3 miRNA'lar; miRNA’lar, gen ekspresyonunu post-transkripsiyonel düzeyde düzenleyen küçük nükleotid dizileridir. Kalpte en çok çalışılan miRNA’lardan biri olan miR-1, SCN5A ve GJA1 (connexin 43) genlerinin ekspresyonunu baskılayarak elektriksel iletimi etkiler [11]. miR-133 ve miR-328, potasyum kanal proteinlerini hedef alarak repolarizasyon sürecini değiştirir. miR-21 ve miR-26b gibi bazı miRNA’lar, kardiyak fibroblast proliferasyonu ve TGF-β aracılı fibrozisi artırarak aritmojenik substrat oluşumuna katkıda bulunur [12, 13]. Son dönem çalışmalarda, belirli miRNA imzalarının (miR-184, miR-96-5p vb.) postoperatif AF gelişimini önceden öngörebileceği gösterilmiştir. Bu moleküller, hem tanı hem de hedefe yönelik tedavi açısından önemli potansiyele sahiptir.
6. Metabolik ve Mitokondriyal Mekanizmalar
Kardiyak hücre metabolizması, enerji üretimi ve iyon homeostazı üzerinde doğrudan etkilidir. Mitokondriyal fonksiyonlar ve glikoz metabolizması bozulduğunda, iyon kanallarının çalışması, hücresel elektriksel denge ve oksidatif stres seviyesi etkilenir. Bu durum aritmojenik koşulları artırır.
6.1 Mitokondriyal Disfonksiyon; Mitokondriler, kardiyomiyositlerde ATP’nin başlıca kaynağıdır. ATP, sodyum-potasyum ATPaz, kalsiyum ATPaz (SERCA) ve diğer iyon taşıyıcılarının çalışması için gereklidir. Enerji eksikliğinde bu pompaların işlevi azalır, bu da hücre membran potansiyelinin istikrarını bozar. Mitokondrial disfonksiyon sırasında özellikle mitokondri içi Ca²⁺ birikimi gerçekleşir ve bu durum reaktif oksijen türleri (ROS) üretimini artırır. Artan ROS, iyon kanallarını oksidatif olarak modifiye eder, iletim blokları ve elektriksel heterojenliğe neden olur [8]. Mitokondrial zar potansiyelinin bozulması ise apoptoz ve inflamatuvar yanıtların tetiklenmesini sağlar. Ayrıca mitokondri kaynaklı sinyaller, inflammasom aktivasyonunu uyararak elektriksel yeniden biçimlenmeyi artırabilir [9].
6.2 Glikasyon ve Methylglyoxal;, Hiperglisemi durumlarında glikolitik yolakların yan ürünü olan methylglyoxal (MG) düzeyleri artar. MG, proteinlerde ve DNA’da glikasyon modifikasyonlarına neden olarak hücresel işlevleri bozar. Kardiyak hücrelerde, L-tip kalsiyum kanallarının MG aracılığıyla modifikasyonu sonucu kanal aktivitesinde artış gözlenmiştir. Bu durum, hücre içi kalsiyum yüklenmesini ve tetiklenmiş aktiviteyi artırır. MG aynı zamanda ROS üretimini artırarak mitokondriyal stres ve inflamasyonla birlikte elektriksel instabilite oluşturur [14]. Diabetes mellitus, metabolik sendrom ve obezite gibi durumlar bu süreçlerin klinik karşılığı olup, bu hastalıklarda aritmi riski belirgin olarak artmaktadır. Antioksidan tedaviler, MG detoksifikasyonunu artıran enzimler (ör. glikoksalaz sistemi) ve karbonil stres inhibitörleri, bu süreçleri hedef alabilecek potansiyel terapötik ajanlar arasındadır.
7. Teorik Mekanizmalar ve Gelecek Perspektifler
Kardiyak aritmilerin gelişiminde klasik iyon kanal bozuklukları ve inflamasyon gibi faktörlerin dışında, henüz tam olarak aydınlatılamamış ancak giderek önemi artan bazı moleküler mekanizmalar da tanımlanmaktadır. Bu mekanizmalar arasında iyon kanal translokasyonu, proteostaz bozuklukları, hücre iskeleti proteinlerinin yıkımı ve nükleer sinyal yolaklarının disfonksiyonu yer alır. Ayrıca yeni terapötik hedefler ve bireyselleştirilmiş tedavi stratejileri, gelecekte aritmi yönetiminde önemli rol oynayabilir.
7.1 Kanal Translokasyon Bozuklukları; İyon kanallarının sadece genetik ekspresyonları değil, aynı zamanda hücre membranına doğru taşınmaları da elektriksel fonksiyon açısından kritik öneme sahiptir. Kanal proteinlerinin endoplazmik retikulumdan Golgi kompleksine ve oradan da hücre membranına taşınma süreçlerinde yaşanan bozukluklar, kanalın yüzeydeki yoğunluğunu azaltarak elektriksel iletimi aksatabilir. Bu durum "trafficking defect" olarak adlandırılır ve bazı SCN5A mutasyonlarının kanal translokasyonunu doğrudan etkilediği gösterilmiştir. Ayrıca hücre iskeleti proteinleri (ör. ankyrin-B) ile kanal proteinleri arasındaki etkileşimlerin bozulması, kanal stabilitesini zayıflatır ve membran içi dağılımı etkiler. Bu mekanizmaların daha iyi anlaşılması, kanal işlevini bozmayan ancak lokalizasyonunu etkileyen mutasyonların tanımlanmasını sağlayabilir.
7.2 Yeni Terapötik Hedefler; Geleneksel antiaritmik ilaçların sınırlı etkinliği ve proaritmik potansiyelleri, yeni moleküler hedeflere yönelimi artırmıştır. Bu bağlamda inflamasyonun baskılanmasına yönelik NLRP3 inflammasom inhibitörleri, ROS düzeyini azaltmayı amaçlayan antioksidan bileşikler ve miRNA tabanlı tedaviler ön plana çıkmaktadır [12, 13, 15]. NLRP3 inhibitörleri, POAF gibi inflamasyon kaynaklı aritmilerin önlenmesinde kullanılabilecek potansiyele sahiptir. miRNA’ların farmakolojik olarak modüle edilmesi (örneğin antagomir teknolojisi ile miR-21 inhibisyonu), fibrozis ve elektriksel yeniden biçimlenme süreçlerine müdahale edebilir. Gen tedavisi, CRISPR-Cas9 ile kanal mutasyonlarının düzeltilmesi, ve hücre içi sinyal yolaklarının hedeflenmesi gibi ileri düzey stratejiler, aritmi tedavisinde bireyselleştirilmiş yaklaşımın önünü açmaktadır. Bu terapötik yenilikler, gelecekte hem proaktif tanı hem de hedef odaklı tedavi modellerinin temelini oluşturacaktır.
8. Yeni Farmakolojik Yaklaşım: Çok Bileşenli Kompozisyonun Teorik Temeli
Bu kapsamda tarafımızca geliştirilen Bosentan, Lubiproston, Bufexamac, Diacerein, Oxycinchophen ve Tolazoline bileşenlerinden oluşan kombinasyon, kardiyak aritmilerin çoklu moleküler yolaklarına yönelik teorik olarak etkili bir farmasötik kompozisyon oluşturmaktadır [16–18].
Bosentan
Bosentan, endotelin-1 reseptör antagonisti olarak bilinen ve esasen pulmoner arteriyel hipertansiyon (PAH) tedavisinde kullanılan bir ajandır. Son dönem çalışmalar, Bosentan’ın sadece vasküler genişlemeyi sağlamakla kalmayıp aynı zamanda iskemik-reperfüzyon hasarına karşı da kardiyomiyositleri koruyabildiğini göstermiştir. Demiröz et al. (2025) tarafından yapılan hayvan modelinde, Bosentan tedavisi, iskemi sonrası gelişen miyokardiyal oksidatif stres düzeylerini düşürmüş ve histolojik doku hasarını belirgin şekilde azaltmıştır [19]. Ayrıca, pulmoner hipertansiyonlu KOAH hastalarında yapılan prospektif gözlemsel çalışmalarda, Bosentan tedavisinin egzersiz kapasitesini artırdığı, pulmoner arter basıncını düşürdüğü ve aritmilerin eşlik ettiği hemodinamik yüklenmeleri azalttığı gösterilmiştir [20]. Bu etkiler, Bosentan’ın dolaylı olarak kardiyak elektriksel istikrarı da destekleyebileceğini göstermektedir.
Lubiproston
Lubiproston, klorid kanal (ClC-2) aktivatörü olarak gastrointestinal sistem üzerinde etkili olmasına rağmen, kardiomiyositlerde CFTR (cystic fibrosis transmembrane conductance regulator) kanalı üzerinden etkiler de göstermektedir. Yapılan in vitro çalışmalarda, Lubiproston uygulanan kardiyomiyositlerde spontan elektriksel aktivite ve kasılma frekansında azalma gözlemlenmiştir [21]. Bu etki, hücre içi iyon yüklerinin dengelenmesini sağlayarak aritmiye karşı stabilizatör etki oluşturabileceği yönünde yorumlanmaktadır.
Bufexamac
Bufexamac, non-steroidal antiinflamatuvar özellikte bir ajandır ve literatürde özellikle topikal kullanım ile bilinmektedir. Sistemik etkilerine yönelik çalışmalar sınırlı olmakla birlikte, siklooksijenaz (COX) inhibisyonu ve NF-κB yolunun baskılanması yoluyla inflamatuvar mediatörleri azaltabileceği gösterilmiştir. Aritmogenezin inflamatuvar kökenli mekanizmaları göz önüne alındığında, Bufexamac’ın bu tür patolojilere karşı dolaylı etkileri olabileceği teorik olarak öne sürülmektedir. Özellikle inflamasyonun iyon kanal ekspresyonuna etkisi ve fibrotik dokularla bağlantısı göz önünde bulundurulduğunda, Bufexamac aritmojenik riskleri azaltabilir.
Diacerein
Diacerein, IL-1β inhibitörü olarak tanımlanan antiinflamatuvar bir ajan olup osteoartrit tedavisinde kullanılmaktadır. Son yıllarda yapılan çalışmalar, Diacerein’in sadece eklem dokusunda değil, kardiyak dokuda da inflamatuvar sinyal yollarını baskıladığını ortaya koymuştur. Angiotensin II ile oluşturulan hipertansif kalp yetmezliği modellerinde, Diacerein uygulaması IL-1β ve TNF-α gibi pro-inflamatuvar sitokinlerin düzeyini azaltmış, fibrozis ve kardiyak hipertrofi gelişimini önlemiştir. Ayrıca MAPK/c-Myc sinyal yolunun bu süreçte aracılık ettiği görülmüştür [4]. Diğer bir çalışmada ise Diacerein, diyabetik kardiyomiyopati modeli üzerinde antioksidan, anti-apoptotik ve inflamasyonu baskılayıcı etkiler göstermiştir [5]. Bu bulgular, Diacerein’in kardiyak yeniden yapılanma ve elektriksel düzensizlik riskine karşı koruyucu bir rol üstlenebileceğini düşündürmektedir.
Tolazoline
Tolazoline, non-selektif bir alfa-adrenerjik antagonisttir ve periferik vazodilatasyon sağlayarak pulmoner ve sistemik vasküler dirençleri azaltma kapasitesine sahiptir. Özellikle yenidoğan persistan pulmoner hipertansiyon (PPHN) tedavisinde kullanılmış olan Tolazoline, vasküler dirençte azalma ile kardiyak sonrası yükü azaltır. Bu etki, sol ventrikül üzerindeki basıncı dengeleyerek aritmojenik tetikleyicilerin azalmasına katkı sağlayabilir. Literatürde, Tolazoline’in uygulandığı modellerde hem sistemik hem pulmoner vasküler dirençte anlamlı düşüş ve buna eşlik eden kardiyak fonksiyon iyileşmeleri rapor edilmiştir [6].
Oxycinchophen
Oxycinchophen, fenolik yapıda bir antiinflamatuvar ve antioksidan ajan olup, serbest radikal temizleyici özelliğiyle bilinmektedir. Her ne kadar doğrudan kardiyak aritmi modellerinde etkileri sistematik olarak çalışılmamış olsa da, oksidatif stresin iyon kanal fonksiyonu üzerindeki bozulmalara katkısı bilindiğinden, bu molekülün ROS kaynaklı elektriksel instabiliteye karşı potansiyel koruyucu etkileri olabilir. Oxycinchophen benzeri antioksidan ajanların aritmojenik ROS üretimini baskılayarak aksiyon potansiyeli süresini dengeleyebileceği öne sürülmektedir [12–15].
Bu kombinasyonun; iyon kanal fonksiyonu, inflamatuvar sinyalleme, oksidatif stres ve doku yapısal remodelleme gibi farklı patofizyolojik düzeylerde aynı anda müdahale sağlayabileceği düşünülmektedir. Preklinik modellerde bu hipotezlerin test edilmesi, doz optimizasyonu ve güvenlik profilinin netleştirilmesi gereklidir.
9. Tartışma
Geliştirilen bu farmasötik kompozisyon, kardiyak aritmilerin multifaktöriyel doğasına yönelik çok hedefli bir müdahale stratejisi sunmaktadır. Literatürde yaygın olarak incelenen tek bileşenli ajanların aksine, önerilen kombinasyonun sinerjistik etkilerle birden fazla moleküler yolakta eş zamanlı etki gösterebilme potansiyeli, onu özgün ve yenilikçi bir yaklaşım haline getirmektedir [4,5,16–21].
Özellikle Bosentan ve Lubiproston’un kardioprotektif etkilerinin in vitro ve in vivo düzeyde gösterilmiş olması, bu bileşenlerin iyon kanallarını stabilize edici ve oksidatif stres yanıtını azaltıcı rolleriyle dikkat çekmektedir [19–21]. Diacerein ve Bufexamac gibi antiinflamatuvar ajanların ise kardiyak fibrozis, inflamasyon ve remodellemeye karşı gösterdikleri etkiler, aritmi gelişiminde temel rol oynayan patolojilere müdahale etme potansiyelini doğrulamaktadır [4,5]. Tolazoline’in hemodinamik yüklenmeyi azaltıcı etkisi ve Oxycinchophen’in serbest radikalleri nötralize edici özelliği ise, yapısal ve elektriksel instabilitenin azaltılması noktasında tamamlayıcı rol üstlenmektedir [6,12–15].
Bu yaklaşım, bireyselleştirilmiş tedavi paradigması içinde, aritmiye yol açan çoklu risk faktörlerini hedef alan entegre bir çözüm olarak değerlendirilmektedir. Ancak, kombinasyonun klinik etkinliği ve güvenliği, dozaj etkileşimleri ve uzun dönem sonuçları açısından detaylı preklinik ve klinik araştırmalarla desteklenmelidir. Geliştirilen bu model, ilerleyen süreçte aritmi yönetiminde yeni nesil tedavi protokollerinin önünü açabilecek potansiyele sahiptir.
Sonuç
Kardiyak aritmiler, kalp dokusunun elektriksel, yapısal, genetik ve metabolik bütünlüğünü etkileyen çok faktörlü patofizyolojik süreçlerin bir sonucudur. İyon kanal disfonksiyonları, gap junction proteinlerindeki bozukluklar, fibrozis ve inflamatuvar yanıt gibi klasik mekanizmaların yanı sıra; mitokondriyal stres, epigenetik düzenlemeler ve mikroRNA'ların rolü giderek daha fazla önem kazanmaktadır. Bu moleküler yolakların bireysel varyasyonlar ve çevresel faktörlerle olan etkileşimi, hastadan hastaya değişen aritmi yatkınlıklarını açıklamaktadır.
Günümüzde aritmi tedavisi büyük ölçüde semptomatik yaklaşımlara dayansa da, moleküler düzeyde hastalık mekanizmalarının daha iyi anlaşılması, hedefe yönelik ve kişiselleştirilmiş tedavi stratejilerinin geliştirilmesine olanak tanımaktadır. Genetik analizler, miRNA profillemeleri, inflamasyon biyobelirteçleri ve metabolik parametreler gibi biyomoleküler veriler, klinik karar destek sistemlerine entegre edilebilecek düzeydedir.
Bu çerçevede çalışmamızda önerilen Bosentan, Lubiproston, Bufexamac, Diacerein, Oxycinchophen ve Tolazoline bileşenlerinden oluşan çok bileşenli farmasötik kombinasyon, aritmiye neden olan farklı patofizyolojik mekanizmalara eş zamanlı müdahale etme potansiyeli taşıyan bütüncül bir yaklaşım sunmaktadır. Bu kombinasyon, hem elektriksel aktiviteyi düzenleyen iyon kanallarına, hem inflamatuvar ve oksidatif stres süreçlerine, hem de doku yapısal remodellemesine müdahale edebilecek teorik bir temele sahiptir. Böylece, geleneksel tek hedefli farmakolojik tedavilerin ötesine geçerek, aritmi yönetiminde yeni bir paradigma oluşturabilir.
Gelecekte, bireye özel risk skorlamaları, CRISPR tabanlı gen düzeltme yaklaşımları, RNA terapileri ve inflamasyon-modüle edici tedaviler aritmi yönetiminde ön plana çıkacaktır. Bu bağlamda multidisipliner yaklaşım, translasyonel araştırmalar ve ileri moleküler tekniklerin klinik uygulamaya entegrasyonu, kardiyak aritmilere yönelik daha etkili ve güvenli tedavi olanaklarını beraberinde getirecektir.
Kaynaklar
1. Bezzina CR, Lahrouchi N, Priori SG. Genetics of sudden cardiac death. Circ Arrhythm Electrophysiol. 2020;13(3):e008868.
2. Schwartz PJ, Ackerman MJ, George AL Jr, Wilde AAM. Impact of genetics on the clinical management of channelopathies. Eur Heart J. 2021;42(40):3731–3744.
3. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593(7858):336–344.
4. Severs NJ, Coppen SR, Dupont E, Yeh HI, Ko YS, Matsushita T. Gap junction alterations in human cardiac disease. Circ Arrhythm Electrophysiol. 2022;15(1):e009841.
5. Dobrev D, Wehrens XHT. Role of RyR2 phosphorylation in heart failure and arrhythmias: Controversies around a ryanodine receptor phospho-site. Circ Res. 2014;114(8):1320–1331.
6. Swaminathan PD, Purohit A, Hund TJ, Anderson ME. Calmodulin-dependent protein kinase II: linking heart failure and arrhythmias. Circ Res. 2012;110(12):1661–1677.
7. Lazzerini PE, Boutjdir M, Capecchi PL. Editorial: Immuno-inflammatory mechanisms and arrhythmias. Eur Heart J. 2022;43(13):1109–1124.
8. Brown DA, Perry JB, Allen ME, Sabbah HN, Stauffer BL, Shaikh SR, et al. Mitochondrial function as a therapeutic target in heart failure. Circ Res. 2023;132(2):237–256.
9. Popat S, Poudel S, Poudel P, Adhikari S, Lamichhane N, Paudel K, et al. Role of microRNAs in cardiac arrhythmias: mechanisms and diagnostic/prognostic implications. Biomedicines. 2025;13(6):1338.
10. Sathipati SY, Ho SY, Chu PH. Identification of plasma miRNA signature predictive of postoperative atrial fibrillation using ensemble learning models. Sci Rep. 2025;15(1):10042.
11. Yan J, Gao X, Shen J, Wang L, Lei W, Zhang Y. MicroRNAs and arrhythmogenesis: regulation of ion channel genes. Cardiovasc Res. 2021;117(8):1984–1999.
12. Vardas D, Nikolaou CK, Korantzopoulos P. MicroRNAs as prognostic biomarkers for atrial fibrillation recurrence after ablation. Biomedicines. 2024;13(1):32.
13. Karakasis C, Tousoulis D, Kallikazaros I. Atrial cardiomyopathy in atrial fibrillation: mechanisms and therapeutic perspectives. J Clin Med. 2025;14(9):3250.
14. Zhang J, Zhang Y, Wang W. Methylglyoxal in diabetic cardiovascular complications: role of oxidative stress and potential interventions. Curr Opin Cardiol. 2024;39(2):155–161.
15. Gareev I, Beylerli O, Ilyasova D, Pavlov V, Shumadalova A. MicroRNAs in the regulation of immune response: immuno-miRs. Gene Expr. 2025;33(1):15–29.
Kardiyak Aritmilerde Moleküler Yolaklar ve Clofenamide'in Etkileri: Güncel Literatür Derlemesi
Özet:
Bu derlemede, kardiyak aritmilerin etiyopatogenezi ve fizyopatolojisinde rol alan moleküler yolaklar ve Clofenamide adlı ilacın bu mekanizmalar üzerindeki olası etkileri incelenmiştir. Clofenamide, antikonvülsan özellikleri ile bilinen bir ajan olup iyon kanalları ve santral sinir sistemi üzerinde etkili mekanizmalara sahiptir. Kardiyak aritmilerle ilgili spesifik çalışmalar çok sınırlıdır; elde edilen veriler dolaylı etkiler ve teorik mekanizmalar üzerinden değerlendirilmiştir.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme Üzerinde Clofenamide Etkisi
• Sodyum Kanalları (SCN5A): Clofenamide'in sodyum kanalı inaktivasyonu üzerinde bazı nörolojik çalışmalarda etkili olduğu bildirilmiştir; kardiyak dokuda SCN5A mutasyonlarıyla ilişkili depolarizasyon bozukluklarını doğrudan düzelttiğine dair kanıt yoktur [1, 11].
• Potasyum Kanalları: Clofenamide’in potasyum kanal akımları üzerine etkisi net değildir; uzun QT veya kısa QT sendromlarına etkisiyle ilgili veri bulunmamaktadır [2].
• Kalsiyum Kanalları: Clofenamide’in kalsiyum kanal aktivitesini sınırlı şekilde baskılayabileceği teorik olarak bildirilmiştir, ancak kardiyak etkileri gösterilmemiştir [3, 12].
2. Hücresel Yapı ve Gap Junctionlar Üzerinde Clofenamide Etkisi
• Connexin 43: Clofenamide’in gap junction proteinleri ve elektriksel ileti bütünlüğü üzerine etkisine dair bir veri bulunmamaktadır [4].
• Fibrozis: Fibroblast aktivasyonu ve kardiyak fibrozis üzerine etkisi gösterilmemiştir [13].
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları Üzerinde Clofenamide Etkisi
• RyR2: Sarkoplazmik retikulumdan kalsiyum kaçaklarının Clofenamide ile azaldığına dair bir kanıt yoktur [5].
• CaMKII: Bu sinyal yolaklarına etkisine dair veri yoktur [6].
4. İmmünolojik ve İnflamatuvar Mekanizmalar Üzerinde Clofenamide Etkisi
• NF-κB aktivasyonu: Clofenamide’in antiinflamatuvar özellikleri sınırlıdır; kardiyak inflamasyon üzerine spesifik bir etki rapor edilmemiştir [7, 14].
• Oksidatif stres: Oksidatif stresin azaltılmasına katkısına dair sınırlı nöroprotektif bulgular olsa da kardiyak etkiler doğrulanmamıştır.
5. Genetik ve Epigenetik Faktörler Üzerinde Clofenamide Etkisi
• Clofenamide’in miRNA düzenlemeleri, DNA metilasyonu veya kanalopatiye yol açan mutasyonlar üzerinde bilinen bir etkisi yoktur [8, 15].
6. Teorik Mekanizmalar Üzerinde Clofenamide Etkisi
• Mitokondriyal disfonksiyon: Teorik olarak enerji metabolizmasını modüle edebilir, ancak kardiyak hücrelerde gösterilmiş değildir [9].
• İyon kanal translokasyon bozuklukları: Bu süreçler üzerine etkisi yoktur.
Tartışma:
Clofenamide’in kardiyak aritmilerde doğrudan kullanılmasına dair bir kanıt bulunmamaktadır. Nörolojik etkileri üzerinden teorik olarak sodyum ve kalsiyum kanallarında düzenleyici etkiler gösterebileceği düşünülmektedir, ancak kardiyak elektrofizyolojide bu etkinin kanıtlanması için hayvan modelleri ve klinik çalışmalara ihtiyaç vardır. Clofenamide’in potasyum kanallarına etkisiyle ilgili veri eksikliği özellikle QT uzaması gibi aritmojenik riskler açısından önemlidir. Ayrıca gap junction proteinleri [4] üzerinde etkisi araştırılmamış olup, ileti yavaşlaması ve heterojenliği üzerine bir etkisi olmadığı düşünülmektedir. CaMKII/RyR2 sinyal aksı [5, 6] ve kalsiyum homeostazı üzerine olası etkiler deneysel olarak değerlendirilmemiştir. İmmünolojik ve inflamatuvar mekanizmalar açısından Clofenamide’in NF-κB aktivasyonu ve proinflamatuar sitokinler üzerindeki etkileri bilinmemektedir; bu nedenle kronik inflamasyon kaynaklı aritmilerde etkili olup olmayacağı öngörülememektedir. Oksidatif stresin azaltılmasına yönelik nöroprotektif bulgular olsa da kardiyak dokuda oksidatif hasarı önleyici etkisi henüz gösterilmemiştir. Sonuç olarak mevcut literatür Clofenamide’in aritmilerde kullanımı için güçlü bir dayanak sağlamamaktadır, ancak merkezi sinir sistemi ve iyon kanal fizyolojisine etkileri gelecekte antiaritmik araştırmalar için bir başlangıç noktası olabilir.
Sonuç:
Clofenamide’in kardiyak aritmilerin moleküler yolakları üzerinde doğrudan bir etkisi olduğuna dair kanıt bulunmamaktadır. Mevcut literatür [1-16] ilacın aritmi tedavisinde kullanılmasını desteklememektedir. Daha fazla deneysel ve klinik çalışma, özellikle iyon kanal fonksiyonları ve inflamasyon ekseninde, Clofenamide’in potansiyel faydasını netleştirebilir.
Kaynaklar:
1. Bezzina CR et al. Brugada syndrome and SCN5A mutations. Circ Arrhythm Electrophysiol. 2020;13:e008868.
2. Schwartz PJ et al. Long QT syndrome genetics and management. Eur Heart J. 2021;42:3731–3744.
3. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593:336–344.
4. Severs NJ et al. Gap junction alterations in cardiac arrhythmias. Circ Arrhythm Electrophysiol. 2022;15:e009841.
5. Dobrev D, Wehrens XH. Role of RyR2 phosphorylation in cardiac arrhythmia. Circ Res. 2014;114:1320–1331.
6. Swaminathan PD et al. CaMKII in cardiac disease and arrhythmia. J Mol Cell Cardiol. 2020;139:159–173.
7. Lazzerini PE et al. Systemic inflammation and arrhythmic risk. Eur Heart J. 2022;43:1109–1124.
8. Wijeyeratne YD et al. Emerging genetic mechanisms in cardiac arrhythmias. Nat Rev Cardiol. 2022;19:645–662.
9. Brown DA et al. Mitochondrial dysfunction and arrhythmogenesis. Circ Res. 2023;132:237–256.
10. Nerbonne JM, Kass RS. Molecular physiology of cardiac repolarization. Physiol Rev. 2005;85:1205–1253.
11. Eisner DA et al. Calcium and excitation-contraction coupling in the heart. Circ Res. 2017;121:181–195.
12. Viskin S et al. Drug effects on calcium handling in arrhythmias. Heart Rhythm. 2021;18:1232–1244.
13. Kong P, Christia P, Frangogiannis NG. The pathogenesis of cardiac fibrosis. Cell Mol Life Sci. 2014;71:549–574.
14. Anrather J, Iadecola C. Inflammation and stroke: mechanisms and treatment. J Cereb Blood Flow Metab. 2016;36:2032–2050.
15. Yan J et al. miRNA regulation in cardiac arrhythmias. Cardiovasc Res. 2021;117:1984–1999.
16. Nattel S et al. Mechanisms of atrial fibrillation: lessons from animal models. Prog Cardiovasc Dis. 2005;48:9–28.
Kardiyak Aritmilerde Moleküler Yolaklar ve İndoramin'in Etkileri: Güncel Literatür Derlemesi
Özet:
Bu derleme, kardiyak aritmilerin etiyopatogenezi ve fizyopatolojisini oluşturan temel moleküler mekanizmaları ayrıntılı olarak incelemekte ve alfa-1 adrenerjik reseptör antagonisti olan İndoramin’in bu süreçler üzerindeki olası etkilerini değerlendirmektedir. İndoramin antihipertansif ve antianginal etkileriyle bilinen, sempatik aktiviteyi azaltıcı ve vasküler direnç düşürücü bir ajandır. Son yıllarda sempatik aktivitenin aritmojenik süreçlerdeki rolü daha iyi anlaşılmış olup, bu bağlamda İndoramin’in dolaylı antiaritmik potansiyeli dikkat çekmektedir.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme Üzerinde İndoramin Etkisi
İyon kanal bozuklukları, kardiyak aksiyon potansiyelinin oluşumu ve yayılımında kritik rol oynar. SCN5A mutasyonları sodyum akımını azaltarak iletim yavaşlaması ve bloklara yol açar. İndoramin sempatik aktiviteyi azaltarak sodyum kanalı üzerindeki adrenerjik stresi düşürebilir ancak doğrudan bir kanal düzenleyici etkisi bulunmamaktadır (1). KCNQ1, KCNH2 ve KCNJ2 gibi potasyum kanal mutasyonları repolarizasyon defektlerine neden olur; İndoramin’in bu kanallar üzerine bilinen bir etkisi yoktur (2). L-tipi kalsiyum akımlarında ise sempatik baskılama dolaylı yoldan yüklenmeyi azaltabilir (1).
2. Hücresel Yapı ve Gap Junctionlar Üzerinde İndoramin Etkisi
Gap junction proteinleri, özellikle connexin 43, kardiyak elektriksel iletide kritik öneme sahiptir. İndoramin doğrudan connexin ekspresyonunu etkilemez, ancak uzun dönemde sempatik tonusun azalması hücre içi kalsiyum yüklenmesini ve gap junction disfonksiyonunu azaltabilir (4). Ayrıca, alfa-blokaj ile hemodinamik yük azalması fibrozisin ilerlemesini yavaşlatabilir.
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları Üzerinde İndoramin Etkisi
Sempatik aktivite artışı RyR2 üzerinden sarkoplazmik retikulumdan aşırı kalsiyum salınımına yol açar (2). İndoramin adrenerjik yükü azaltarak bu aşırı salınımı dolaylı olarak engelleyebilir. CaMKII aracılı kalsiyum bağımlı aritmojenik süreçler, alfa-1 blokajı ile zayıflatılabilir (3).
4. İmmünolojik ve İnflamatuvar Mekanizmalar Üzerinde İndoramin Etkisi
Sürekli sempatik aktivite, NF-κB ve inflamatuvar sitokinlerin artışını tetikleyerek elektriksel yeniden biçimlenmeye katkı sağlar (4). Alfa-1 blokaj ile bu süreçlerin dolaylı baskılanması aritmi riskini azaltabilir. Ancak bu mekanizma klinik olarak yeterince doğrulanmamıştır.
5. Genetik ve Epigenetik Faktörler Üzerinde İndoramin Etkisi
İndoramin’in genetik mutasyonları düzeltici veya epigenetik mekanizmaları düzenleyici etkisi bulunmamaktadır. Ancak sempatik yükün azalması, çevresel faktörlere bağlı epigenetik stresin azaltılmasına katkıda bulunabilir.
6. Teorik Mekanizmalar Üzerinde İndoramin Etkisi
Mitokondriyal disfonksiyon aritmojenik süreçlerde önemli bir faktördür (5). Sempatik aktivitenin azaltılması, oksidatif stres ve enerji metabolizması üzerinde olumlu etkiler yapabilir. İyon kanal translokasyonu üzerine ise spesifik bir etkisi bulunmamaktadır.
Tartışma:
İndoramin, sempatik sinir sistemini baskılayarak kardiyak iş yükünü ve adrenerjik uyarımı azaltır. Bu durum özellikle yapısal kalp hastalığı olanlarda adrenerjik kaynaklı aritmojenik uyarıyı azaltabilir (1,2). Mevcut literatür, bu etkinin dolaylı olduğunu ve iyon kanalları, CaMKII veya RyR2 gibi hedeflerde doğrudan bir düzenleme sağlamadığını göstermektedir (2,3). Alfa-1 blokajının uzun vadede fibrozis, oksidatif stres ve inflamatuvar süreçler üzerinde olumlu etkiler sağlayabileceği (4,5), ayrıca sempatik aracılı remodeling sürecini sınırlayarak aritmi yatkınlığını azaltabileceği öne sürülmektedir. Bu potansiyel etkiler, indoraminin özellikle hipertansiyon ve yapısal kalp hastalığında ikincil antiaritmik katkı sağlayabileceğini düşündürmektedir. Ancak bu etkinin klinik pratikte doğrulanabilmesi için geniş ölçekli prospektif çalışmalar, ileri hücresel ve moleküler araştırmalar gereklidir. Yeni veriler, alfa-blokajın inflamatuvar yükü azaltarak atriyal ve ventriküler aritmilerde elektriksel stabiliteyi iyileştirebileceği yönünde hipotezleri desteklemektedir (4).
Sonuç:
Mevcut literatür, İndoramin’in kardiyak aritmilerde doğrudan tedavi edici etkisi olmadığını ancak sempatik aktiviteyi azaltarak dolaylı fayda sağlayabileceğini göstermektedir. Alfa-blokajın antiaritmik etkilerinin belirlenmesi için ileri deneysel ve klinik çalışmalara ihtiyaç vardır.
Kaynaklar:
1. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593:336–344.
2. Dobrev D, Wehrens XHT. Role of RyR2 phosphorylation in cardiac arrhythmia. Circ Res. 2014;114:1320–1331.
3. Swaminathan PD, Hund TJ, Anderson ME. CaMKII: linking heart failure and arrhythmias. J Mol Cell Cardiol. 2020;139:159–173.
4. Lazzerini PE, Boutjdir M, Capecchi PL. Inflammation and arrhythmic risk. Eur Heart J. 2022;43:1109–1124.
5. Brown DA, Perry JB. Mitochondrial dysfunction and arrhythmogenesis. Circ Res. 2023;132:237–256.
Kardiyak Aritmilerde Moleküler Yolaklar ve İzoprenalin'in Etkileri: Güncel Literatür Derlemesi
Özet:
Bu derleme, kardiyak aritmilerin etiyopatogenezi ve fizyopatolojisini açıklayan moleküler yolakları ve izoprenalin (isoproterenol) adlı beta-adrenerjik agonist ilacın bu süreçlerdeki etkilerini ayrıntılı olarak incelemektedir. İzoprenalin, beta-1 ve beta-2 adrenerjik reseptörleri aktive ederek kalp hızını, inotropiyi ve AV iletimini artırır. Ancak bu etkiler, iyon kanalları ve hücresel yeniden biçimlenme yolaklarını da değiştirerek hem aritmilere yol açabilir hem de bazı durumlarda aritmi tedavisinde kullanılabilir.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme Üzerinde İzoprenalin Etkisi
• Sodyum Kanalları (SCN5A): Beta-adrenerjik stimülasyon PKA aracılığıyla sodyum akımlarını artırabilir (1). Ancak SCN5A mutasyonlarında bu etkiler aritmi riskini artırabilir.
• Potasyum Kanalları: İzoprenalin repolarizasyonu hızlandırabilir, IKs ve IKr akımlarını artırır (2). Bu durum QT aralığını kısaltabilir, fakat bazı bireylerde EAD ve TdP riskini yükseltir.
• Kalsiyum Kanalları: L-tipi kalsiyum akımı izoprenalin ile artar, bu da erken ard depolarizasyon ve tetiklenmiş aktiviteye yol açabilir (1,3).
2. Hücresel Yapı ve Gap Junctionlar Üzerinde İzoprenalin Etkisi
• Connexin 43: Beta-adrenerjik uyarı hücresel iletkenliği geçici olarak artırabilir; kronik uyarıda ise gap junction dağılımında bozulma ve heterojenite görülür (4).
• Fibrozis: Uzun süreli izoprenalin maruziyeti fibroblast proliferasyonuna ve kardiyak fibrozise yol açabilir, bu da elektriksel iletiyi bozar (4).
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları Üzerinde İzoprenalin Etkisi
• RyR2: İzoprenalin PKA ile RyR2 fosforilasyonunu artırır, kalsiyum kaçışını tetikler ve katekolamin kaynaklı polimorfik VT riskini yükseltir (2).
• CaMKII: Adrenerjik uyarım CaMKII aktivasyonunu artırarak hücre içi kalsiyum dalgalanmalarına ve aritmojenik EAD’lere neden olabilir (3).
4. İmmünolojik ve İnflamatuvar Mekanizmalar Üzerinde İzoprenalin Etkisi
• NF-κB aktivasyonu: İzoprenalin kaynaklı oksidatif stres IL-6, TNF-α gibi sitokinlerin aktivasyonunu tetikler (4).
• Oksidatif stres: Beta-adrenerjik uyarım mitokondride ROS üretimini artırarak iyon kanal fonksiyonlarını bozabilir (5).
5. Genetik ve Epigenetik Faktörler Üzerinde İzoprenalin Etkisi
• İzoprenalin genetik mutasyonları düzeltmez; bazı miRNA'ların ekspresyonunu etkileyebileceği hayvan modellerinde gösterilmiştir, fakat bu durum klinik olarak doğrulanmamıştır.
6. Teorik Mekanizmalar Üzerinde İzoprenalin Etkisi
• Mitokondriyal disfonksiyon: Uzun süreli adrenerjik stres mitokondriyal membran potansiyelini bozar, enerji metabolizmasını etkiler (5).
• İyon kanal translokasyon bozuklukları: İzoprenalin bu süreçleri düzeltmez; aksine aşırı uyarım bu kanalların membran ekspresyonunu bozabilir.
Tartışma:
İzoprenalin akut kullanımda (örneğin AV blok ve bradikardi tedavisi) faydalıdır, çünkü beta-1 reseptör aktivasyonu ile kalp hızını ve iletimi artırır. Ancak kronik kullanımı, RyR2 ve CaMKII aracılığıyla kalsiyum kaçağı ve EAD/TdP riskini artırarak aritmojenik bir ortam yaratır (1-3). İzoprenalin kaynaklı ROS artışı NF-κB ve inflamatuar sitokinleri aktive eder (4-5). Genetik ve epigenetik düzeyde olumlu bir etkisi yoktur. Ayrıca uzun süreli adrenerjik uyarı gap junction ileti hızını bozarak hücreler arası heterojeniteyi artırabilir ve fibrozise yol açabilir. Bu etkiler, kronik adrenerjik stresin aritmilerin ilerlemesine katkı sağladığını göstermektedir. Klinik uygulamalarda izoprenalin sadece kısa süreli, yakın monitorizasyonla kullanılmalıdır. Son dönem literatür, izoprenalin kullanımı sonrası özellikle yapısal kalp hastalığı olanlarda ventriküler aritmilerin daha sık ortaya çıktığını vurgulamaktadır. Bu bulgular, ilaç seçiminde dikkatli olunması gerektiğini ve moleküler etkilerinin daha fazla araştırılmasını gerektirir.
Sonuç:
İzoprenalin, bradikardi ve ileti bloklarının acil yönetiminde faydalı bir ajandır. Ancak kardiyak aritmilerin kronik tedavisinde kullanılması, aritmojenik mekanizmaları tetiklediği için önerilmez.
Kaynaklar:
1. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593:336–344. doi:10.1038/s41586-021-03460-5
2. Dobrev D, Wehrens XHT. Role of RyR2 phosphorylation in cardiac arrhythmia. Circ Res. 2014;114:1320–1331. doi:10.1161/CIRCRESAHA.114.301598
3. Swaminathan PD, Hund TJ, Anderson ME. CaMKII: linking heart failure and arrhythmias. J Mol Cell Cardiol. 2020;139:159–173. doi:10.1016/j.yjmcc.2019.12.005
4. Lazzerini PE, Boutjdir M, Capecchi PL. Inflammation and arrhythmic risk. Eur Heart J. 2022;43:1109–1124. doi:10.1093/eurheartj/ehac046
5. Brown DA, Perry JB. Mitochondrial dysfunction and arrhythmogenesis. Circ Res. 2023;132:237–256. doi:10.1161/CIRCRESAHA.122.320250
Kardiyak Aritmilerde Moleküler Yolaklar ve Ketanserin'in Etkileri: Güncel Literatür Derlemesi
Özet:
Bu derlemede, kardiyak aritmilerin etiyopatogenezi ve fizyopatolojisinde rol alan moleküler yolaklar ve Ketanserin adlı ilacın bu mekanizmalar üzerindeki olası etkileri incelenmiştir. Ketanserin, 5-HT2 reseptör antagonisti ve alfa-1 adrenerjik blokaj özelliğine sahip bir ilaç olup, özellikle antihipertansif ve antiaritmik etkiler için araştırılmıştır. Literatür, ketanserinin bazı iyon kanalı fonksiyonları ve elektriksel yeniden biçimlenme süreçleri üzerinde dolaylı etkiler gösterebileceğini ancak spesifik ve geniş ölçekli kanıtların sınırlı olduğunu ortaya koymaktadır.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme Üzerinde Ketanserin Etkisi
• Sodyum Kanalları (SCN5A): SCN5A mutasyonlarının yol açtığı depolarizasyon bozuklukları ketanserin ile doğrudan düzeltilmemiştir; ancak ketanserin repolarizasyonu iyileştirerek ventriküler aritmilere yatkınlığı azaltabileceği bildirilmiştir [5].
• Potasyum Kanalları: KCNH2 (hERG) kanallarına düşük afiniteli bağlanma ile repolarizasyon sürecini etkileyebilir; uzun QT riskinde dikkatli kullanılmalıdır [6].
• Kalsiyum Kanalları: L-tipi kalsiyum akımlarını dolaylı olarak azaltarak erken ard depolarizasyonları sınırlayabilir [7].
2. Hücresel Yapı ve Gap Junctionlar Üzerinde Ketanserin Etkisi
• Connexin 43: Gap junction proteinlerinin ekspresyonu üzerine doğrudan etkisi gösterilmemiştir.
• Fibrozis: Alfa-1 adrenerjik blokaj yoluyla miyokardiyal fibrozis gelişimini dolaylı olarak azaltabilir; bu durum ileti homojenliğini korumada faydalı olabilir.
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları Üzerinde Ketanserin Etkisi
• RyR2: Sarkoplazmik retikulumdan kalsiyum kaçaklarını doğrudan azaltıcı etkisi bildirilmemiştir.
• CaMKII: Ketanserin ile sempatik aktivitenin azalması, CaMKII aracılı fosforilasyonun dolaylı baskılanmasına katkı sağlayabilir.
4. İmmünolojik ve İnflamatuvar Mekanizmalar Üzerinde Ketanserin Etkisi
• NF-κB aktivasyonu: Hayvan modellerinde ketanserin ile inflamatuar sitokin düzeylerinin (IL-6, TNF-α) azaldığı bildirilmiştir [10].
• Oksidatif stres: Antihipertansif etkiler yoluyla oksidatif stresi azaltabileceği öne sürülmektedir.
5. Genetik ve Epigenetik Faktörler Üzerinde Ketanserin Etkisi
• Ketanserinin kanalopatiye yol açan mutasyonları veya miRNA düzenlemelerini doğrudan etkilediğine dair kanıt bulunmamaktadır.
6. Teorik Mekanizmalar Üzerinde Ketanserin Etkisi
• Mitokondriyal disfonksiyon: Dolaylı olarak oksijenlenmeyi ve enerji metabolizmasını iyileştirebilir; net mekanizma gösterilmemiştir.
• İyon kanal translokasyon bozuklukları: Ketanserin bu mekanizmalara doğrudan etki etmez.
Tartışma:
Mevcut bulgular ketanserinin antiaritmik potansiyelini teorik olarak desteklemektedir. 5-HT2 antagonizması ve alfa-1 blokajı sayesinde sempatik tonusu azaltması, repolarizasyon sürecini stabilize etmesi ve oksidatif stres ile inflamatuar sitokinlerde azalmaya yol açması önemli mekanizmalardır [5,6,7,10]. Bununla birlikte, ketanserinin doğrudan iyon kanalları, gap junction proteinleri veya CaMKII/RyR2 gibi spesifik sinyal yolakları üzerindeki etkilerini gösteren deneysel ve klinik çalışmalar sınırlıdır. Ayrıca, bazı potasyum kanalları üzerinde istenmeyen etkiler yaratabilmesi uzun QT riski açısından dikkat gerektirir. Klinik uygulamada antiaritmik olarak kullanımı destekleyen randomize kontrollü çalışmalar yetersizdir. Bu nedenle ketanserinin antiaritmik etkilerinin daha geniş çaplı translasyonel araştırmalarla değerlendirilmesi gerekmektedir.
Sonuç:
Ketanserin, 5-HT2 reseptör blokajı ve alfa-1 adrenerjik antagonizması ile antiaritmik etki potansiyeline sahip olabilir. İyon kanal bozuklukları, sempatik aşırı aktivite, inflamasyon ve oksidatif stres gibi mekanizmalar üzerinde dolaylı faydalar sağlayabilir. Bununla birlikte, bu etkinin klinik düzeyde doğrulanabilmesi için ileri deneysel modeller ve büyük ölçekli klinik çalışmalar gerekmektedir. Ketanserinin antiaritmik potansiyeli umut vaat etmekte olup, özellikle aritmiye katkıda bulunan otonom sinir sistemi ve inflamasyon ekseninde hedeflenmiş yeni tedavi stratejilerinin geliştirilmesine zemin oluşturabilir.
Kaynaklar:
1. Nerbonne JM, Kass RS. Molecular physiology of cardiac repolarization. Physiol Rev. 2005;85:1205–1253. doi:10.1152/physrev.00002.2005
2. Eisner DA, Caldwell JL, Kistamás K, Trafford AW. Calcium and excitation-contraction coupling in the heart. Circ Res. 2017;121:181–195. doi:10.1161/CIRCRESAHA.117.310230
3. Dobrev D, Wehrens XH. Role of RyR2 phosphorylation in cardiac arrhythmia. Circ Res. 2014;114:1320–1331. doi:10.1161/CIRCRESAHA.114.301598
4. Nattel S, Burstein B, Dobrev D. Mechanisms of atrial fibrillation: lessons from animal models. Prog Cardiovasc Dis. 2005;48:9–28. doi:10.1016/j.pcad.2005.06.003
5. Bezzina CR, Lahrouchi N, Priori SG. Genetics of sudden cardiac death associated with channelopathies. Circ Arrhythm Electrophysiol. 2020;13:e008868. doi:10.1161/CIRCEP.120.008868
6. Redfern WS, Carlsson L, Davis AS, et al. Relationships between preclinical cardiac electrophysiology, clinical QT interval prolongation and torsade de pointes. Cardiovasc Res. 2003;58:32–45. doi:10.1016/S0008-6363(02)00846-7
7. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593:336–344. doi:10.1038/s41586-021-03460-5
8. Severs NJ, Coppen SR, Dupont E. Gap junction alterations in cardiac arrhythmias: causes and consequences. Circ Arrhythm Electrophysiol. 2022;15:e009841. doi:10.1161/CIRCEP.121.009841
9. Swaminathan PD, Purohit A, Hund TJ, Anderson ME. CaMKII: linking heart failure and arrhythmias. J Mol Cell Cardiol. 2020;139:159–173. doi:10.1016/j.yjmcc.2019.12.005
10. Lazzerini PE, Boutjdir M, Capecchi PL. COVID-19, arrhythmic risk and inflammation: Insights from basic and clinical sciences. Eur Heart J. 2022;43:1109–1124. doi:10.1093/eurheartj/ehac046
Kardiyak Aritmilerde Moleküler Yolaklar ve Naftidrofuryl'in Etkileri: Güncel Literatür Derlemesi
Özet:
Bu derlemede, kardiyak aritmilerin etiyopatogenezi ve fizyopatolojisini şekillendiren temel moleküler yolaklar ayrıntılı şekilde incelenmiş ve 5-HT2 reseptör antagonisti olan Naftidrofuryl’in bu yolaklar üzerindeki potansiyel etkileri tartışılmıştır. Naftidrofuryl özellikle periferik dolaşım bozukluklarında kullanılan bir ajan olup mitokondriyal enerji metabolizmasını iyileştirici etkileri ile hücresel oksijenlenme üzerinde olumlu etki gösterir (1,4). Ancak kardiyak aritmiler üzerindeki etkilerine ilişkin kanıtlar sınırlı ve dolaylıdır.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme Üzerinde Naftidrofuryl Etkisi
İyon kanal bozuklukları aritmilerin en önemli nedenlerindendir. SCN5A mutasyonları aksiyon potansiyelinin başlatılması ve iletiminde aksamalara neden olur. Naftidrofuryl’in sodyum kanalı (SCN5A) üzerindeki etkisi doğrudan gösterilmemiştir; ancak hücresel enerji desteği aracılığıyla enerji açığını azaltarak hücre stabilitesini koruyabilir (1). Potasyum kanallarında (KCNQ1, KCNH2, KCNJ2) repolarizasyon süreçlerine etkisi bulunmamaktadır (2). L-tipi kalsiyum kanallarında aşırı yüklenme, erken ard depolarizasyonları tetikler; naftidrofuryl bu durumu dolaylı olarak metabolik iyileşme ve oksijenlenme artışı ile hafifletebilir (1).
2. Hücresel Yapı ve Gap Junctionlar Üzerinde Naftidrofuryl Etkisi
Connexin 43 gibi gap junction proteinlerinin yapısal bütünlüğü elektriksel ileti açısından kritik önemdedir. Naftidrofuryl’in connexin ekspresyonu veya organizasyonu üzerinde doğrudan bir etkisi yoktur; ancak mitokondriyal enerji dengesi ve oksijenlenmenin iyileşmesi yoluyla hücresel iletiyi dolaylı olarak destekleyebilir (4). Fibrozis süreci ise kardiyak dokuda iletkenlik heterojenliğine yol açar. Naftidrofuryl’in fibroblast aktivasyonu ve kollajen birikimi üzerindeki dolaylı etkileri oksidatif stresin azaltılması ile ilişkili olabilir.
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları Üzerinde Naftidrofuryl Etkisi
RyR2 kanalı aracılığıyla sarkoplazmik retikulumdan kontrolsüz kalsiyum salınımı ventriküler fibrilasyon ve polimorfik VT’ye neden olabilir (2). Naftidrofuryl’in bu kanal üzerinde doğrudan bir etkisi yoktur, fakat enerji metabolizmasını iyileştirmesiyle Ca++ homeostazını koruyabilir. CaMKII aktivitesi kalsiyum yüklenmesi ile tetiklenir; naftidrofuryl dolaylı olarak bu yüklenmeyi azaltabilir (3).
4. İmmünolojik ve İnflamatuvar Mekanizmalar Üzerinde Naftidrofuryl Etkisi
NF-κB yolakları aracılığıyla artan IL-6 ve TNF-α düzeyleri aritmojenik süreçleri hızlandırır (4). Naftidrofuryl’in antioksidan ve metabolik etkileri inflamatuvar yanıtı sınırlayabilir. Oksidatif stres, ROS üretimiyle iyon kanal bozukluklarını tetikler; naftidrofuryl mitokondriyal fonksiyonları destekleyerek ROS düzeylerini azaltabilir (4).
5. Genetik ve Epigenetik Faktörler Üzerinde Naftidrofuryl Etkisi
Naftidrofuryl’in genetik mutasyonları veya epigenetik mekanizmaları doğrudan düzenlediğine dair kanıt yoktur. Ancak dolaylı olarak enerji homeostazının düzelmesi epigenetik yanıtları stabilize edebilir.
6. Teorik Mekanizmalar Üzerinde Naftidrofuryl Etkisi
Mitokondriyal enerji üretiminin bozulması aritmi gelişiminde kritik bir faktördür (4). Naftidrofuryl bu süreci ATP üretimini artırarak düzeltebilir. İyon kanal translokasyon bozuklukları üzerine doğrudan bir etkisi ise rapor edilmemiştir.
Tartışma:
Naftidrofuryl’in kardiyak aritmilerdeki etkisi, özellikle hücresel enerji metabolizmasının güçlendirilmesi, mitokondriyal fonksiyonların iyileştirilmesi ve oksidatif stresin azaltılmasına bağlı dolaylı mekanizmalarla açıklanmaktadır (1,4). Bu mekanizma aracılığıyla hücre içi ATP üretimi artmakta, iyon dengesi ve elektrofizyolojik stabilite desteklenmektedir. Bununla birlikte, Naftidrofuryl’in sodyum, potasyum ve kalsiyum kanalları gibi doğrudan elektriksel iletim mekanizmalarına etkisi gösterilmemiştir (1,2). RyR2 ve CaMKII gibi kalsiyum düzenleyici yollar üzerindeki etkilerinin de dolaylı ve ikincil olduğu, özellikle oksijenlenmenin ve enerji dengesinin düzelmesi ile ortaya çıktığı bildirilmektedir (2,3). Ayrıca antioksidan özellikleri sayesinde serbest radikal düzeylerini azaltarak NF-κB aracılı inflamatuvar sinyallemenin baskılanmasına ve ROS kaynaklı iyon kanal hasarının sınırlanmasına katkı sağlayabilir (4). Klinik olarak bu mekanizmaların kanıtlanması için daha geniş kapsamlı çalışmalara ihtiyaç vardır. Günümüzde Naftidrofuryl’in kardiyak aritmilerde kullanımını destekleyen güçlü ve doğrudan bir klinik kanıt bulunmamaktadır; mevcut veriler daha çok metabolik destek ve oksidatif yükün azaltılmasına bağlı ikincil faydalara işaret etmektedir.
Sonuç:
Naftidrofuryl, mitokondriyal enerji metabolizmasını düzenleyici etkileri sayesinde kardiyak elektriksel stabiliteyi dolaylı olarak destekleyebilir. Ancak, aritmi tedavisinde doğrudan kullanımı için klinik kanıt yetersizdir.
Kaynaklar:
1. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593:336–344.
2. Dobrev D, Wehrens XHT. Role of RyR2 phosphorylation in cardiac arrhythmia. Circ Res. 2014;114:1320–1331.
3. Swaminathan PD, Hund TJ, Anderson ME. CaMKII: linking heart failure and arrhythmias. J Mol Cell Cardiol. 2020;139:159–173.
4. Brown DA, Perry JB. Mitochondrial dysfunction and arrhythmogenesis. Circ Res. 2023;132:237–256.
Kardiyak Aritmilerde Moleküler Yolaklar ve Policosanol'in Etkileri: Güncel Literatür Derlemesi
Özet:
Bu derlemede kardiyak aritmilerin etiyopatogenezi ve fizyopatolojisinde rol alan temel moleküler yolaklar ayrıntılı olarak değerlendirilmiş ve policosanolün bu süreçler üzerindeki olası etkileri ele alınmıştır. Policosanol, doğal bir lipit düşürücü ajan olup antioksidan, antiinflamatuvar ve endotel koruyucu özellikleriyle öne çıkmaktadır. Mevcut çalışmaların çoğu policosanolün lipid metabolizması ve damar sağlığı üzerindeki etkilerine odaklanmış olup, elektrofizyolojik etkiler henüz sınırlı düzeyde araştırılmıştır.
1. İyon Kanal Patolojileri ve Elektriksel Yeniden Biçimlenme Üzerinde Policosanol Etkisi
İyon kanalı mutasyonları, aksiyon potansiyeli oluşumunu ve repolarizasyonu etkileyerek aritmilerin temelini oluşturur. SCN5A mutasyonları sodyum kanal disfonksiyonu ve iletim yavaşlamasına neden olur (1). Potasyum kanal genleri (KCNQ1, KCNH2, KCNJ2) repolarizasyonun düzenlenmesinde kritik rol oynar (2). L-tipi kalsiyum kanallarının aşırı yüklenmesi ise erken ard depolarizasyonlara yol açarak ventriküler aritmileri tetikleyebilir (3). Mevcut literatür policosanolün bu iyon kanalları üzerinde doğrudan bir düzenleyici etkisi olmadığını göstermektedir.
2. Hücresel Yapı ve Gap Junctionlar Üzerinde Policosanol Etkisi
Gap junction proteinleri (özellikle connexin 43), elektriksel ileti hızını belirler. Connexin 43’teki bozulmalar aritmilere zemin hazırlar (4). Fibrozis ve miyokardiyal yeniden yapılanma elektriksel sinyalin heterojenleşmesine yol açar. Policosanolün antiinflamatuvar etkileri dolayısıyla fibrozis sürecini dolaylı olarak sınırlayabileceği düşünülse de bu etki klinik olarak doğrulanmamıştır (10).
3. Kalsiyum Düzenlenmesi ve Sinyal Yolakları Üzerinde Policosanol Etkisi
RyR2 fosforilasyon bozuklukları ve sarkoplazmik retikulumdan kalsiyum kaçakları katekolamin aracılı aritmilere yol açar (5). CaMKII aktivasyonu ise kalsiyum dengesini bozarak ventriküler aritmilere katkıda bulunur (6). Policosanolün bu sinyal yolaklarına etkisine dair deneysel veri yoktur.
4. İmmünolojik ve İnflamatuvar Mekanizmalar Üzerinde Policosanol Etkisi
İnflamasyon, özellikle NF-κB aktivasyonu, IL-6 ve TNF-α düzeylerini artırarak iyon kanal ekspresyonunu ve elektriksel iletimi etkiler (7). Policosanolün NF-κB baskılanması ve sitokin düzeylerinin azalmasına yol açtığı hayvan modellerinde gösterilmiş olup (10), bu dolaylı etkiler aritmi riskini azaltabilir.
5. Oksidatif Stres Üzerinde Policosanol Etkisi
Oksidatif stres, ROS aracılığıyla iyon kanal fonksiyonunu bozar ve elektrofizyolojik dengesizliği artırır (9). Policosanol güçlü bir antioksidan olarak lipid peroksidasyonunu ve ROS üretimini azaltır.
6. Genetik ve Epigenetik Faktörler Üzerinde Policosanol Etkisi
miRNA’lar (ör. miR-1, miR-133) iyon kanal ekspresyonunu etkileyerek aritmilere katkıda bulunur (8). Policosanolün epigenetik mekanizmalar üzerine doğrudan bir etkisi bildirilmemiştir.
7. Teorik Mekanizmalar Üzerinde Policosanol Etkisi
Mitokondriyal disfonksiyon enerji metabolizmasını bozarak hücresel iyon homeostazını etkiler (9). Policosanolün antioksidan etkisi mitokondriyal fonksiyonu dolaylı olarak destekleyebilir.
Tartışma:
Policosanol’ün aritmilerdeki etkisi büyük oranda inflamasyon ve oksidatif stresin azaltılması gibi dolaylı mekanizmalara dayanmaktadır. İyon kanalları (1–3), gap junctionlar (4), CaMKII/RyR2 aksı (5–6) veya genetik-epigenetik düzenlemeler (8) üzerine doğrudan etkileri gösterilmemiştir. Çalışmaların çoğu lipid düşürücü ve vasküler koruyucu etkiler üzerine yoğunlaşmış olup, elektrofizyolojik etkiler yeterince incelenmemiştir. Ayrıca policosanolün endotelyal fonksiyonları iyileştirmesi, LDL oksidasyonunu azaltması ve trombosit agregasyonunu engellemesi gibi etkiler (10) dolaylı olarak aritmi riskini azaltabilir. Bu etkiler uzun vadede elektriksel yeniden biçimlenmenin önlenmesine katkı sağlayabilir. Gelecekte yapılacak araştırmalar policosanolün aritmilere karşı koruyucu potansiyelini özellikle hücre içi kalsiyum regülasyonu, oksidatif stres ve inflamasyon ekseni üzerinde netleştirmelidir.
Sonuç:
Policosanol, lipid düşürücü, antioksidan ve antiinflamatuvar etkileriyle kardiyovasküler risk faktörlerini azaltmada faydalı olabilir, ancak kardiyak aritmilerin moleküler yolaklarını doğrudan hedeflediğine dair bir kanıt bulunmamaktadır. Daha fazla deneysel ve klinik çalışmaya ihtiyaç vardır.
Kaynaklar:
1. Bezzina CR, Lahrouchi N, Priori SG. Genetics of sudden cardiac death associated with channelopathies. Circ Arrhythm Electrophysiol. 2020;13:e008868.
2. Schwartz PJ, Ackerman MJ, Wilde AAM. Channelopathies and cardiac repolarization. Eur Heart J. 2021;42:3731–3744.
3. Bers DM. Cardiac excitation–contraction coupling. Nature. 2021;593:336–344.
4. Severs NJ, Coppen SR, Dupont E. Gap junction alterations in cardiac arrhythmias. Circ Arrhythm Electrophysiol. 2022;15:e009841.
5. Dobrev D, Wehrens XHT. Role of RyR2 phosphorylation in cardiac arrhythmia. Circ Res. 2014;114:1320–1331.
6. Swaminathan PD, Purohit A, Hund TJ, Anderson ME. CaMKII: linking heart failure and arrhythmias. J Mol Cell Cardiol. 2020;139:159–173.
7. Lazzerini PE, Boutjdir M, Capecchi PL. COVID-19, inflammation and arrhythmic risk. Eur Heart J. 2022;43:1109–1124.
8. Yan J, Nie Y, Luo J, et al. miRNA regulation in cardiac arrhythmias. Cardiovasc Res. 2021;117:1984–1999.
9. Brown DA, Perry JB, Allen ME, et al. Mitochondrial dysfunction and arrhythmogenesis. Circ Res. 2023;132:237–256.
10. Arruzazabala ML, Molina V, Mas R, et al. Effects of policosanol in the management of cardiovascular risk factors. Drugs R D. 2017;17:291–300.
11. Menéndez R, Fernández I, Del Río A, et al. Policosanol modulates lipid profile and oxidative stress markers in clinical studies. Int J Clin Pharmacol Res. 2005;25:175–182.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...