KRONİK KABIZLIK VE FONKSİYONEL İLEUS HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KRONİK KABIZLIK VE FONKSİYONEL İLEUS HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
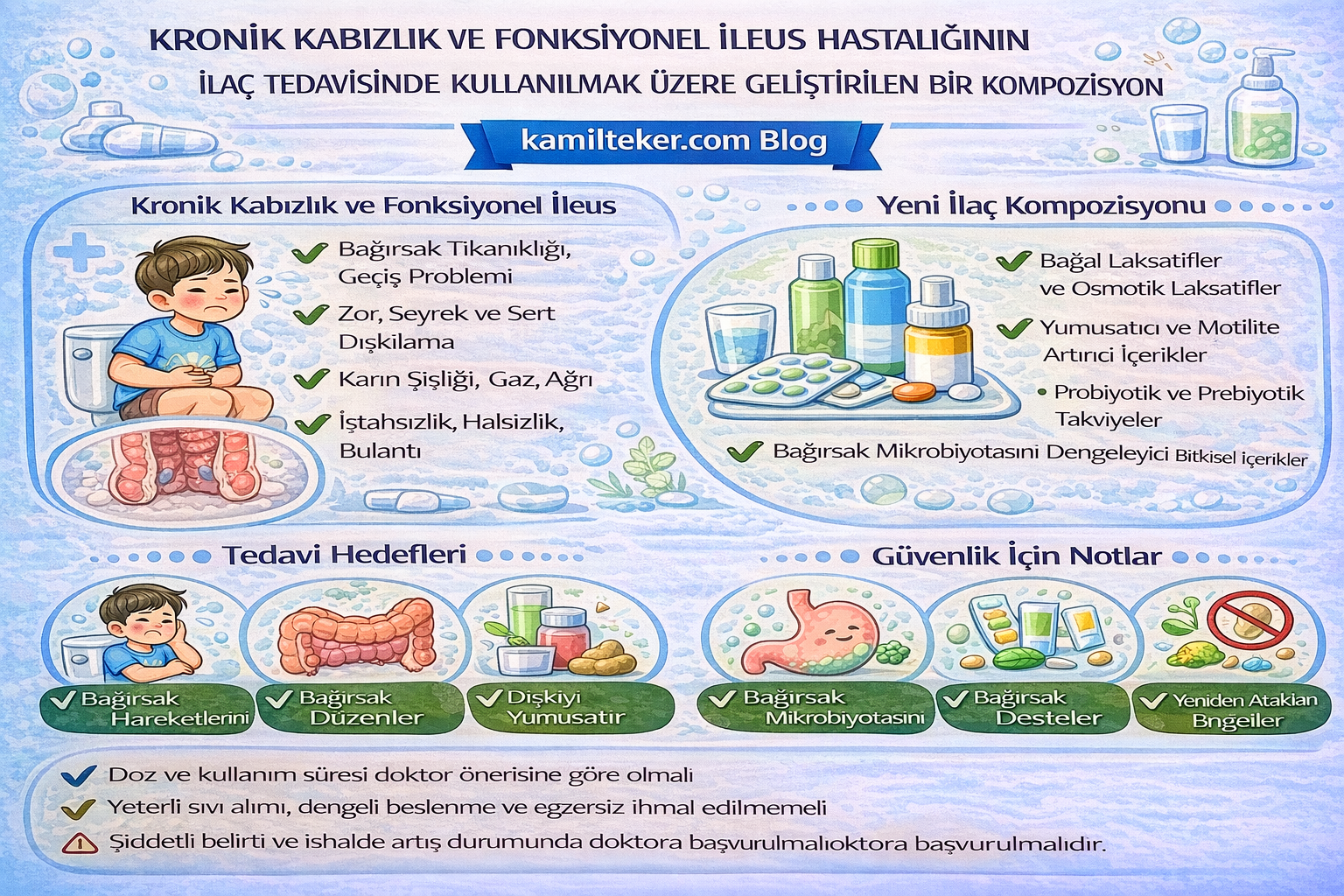
Buluş; Kronik kabızlık ve fonksiyonel ileus medikal tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları Guaifenesine (1) 2x1, İpriflavone (2) 2x1, Misoprostol (3)
2x1 ve Tribenoside (4) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Kronik kabızlık ve fonksiyonel ileus, gastrointestinal sistemin en sık karşılaşılan fonksiyonel bozuklukları arasında yer almakta ve hem bireysel yaşam kalitesini hem de sağlık sistemleri üzerindeki yükü önemli ölçüde artırmaktadır. Kronik kabızlık; haftada üçten az dışkılama, dışkılama sırasında zorluk, sert dışkı ve tam boşalamama hissi gibi semptomlarla tanımlanırken, fonksiyonel ileus ise mekanik bir obstrüksiyon olmaksızın bağırsak motilitesinin bozulması sonucu gelişen klinik tablodur. Her iki hastalık da bağırsak motilitesinin düzenlenmesinde görev alan enterik sinir sistemi (ENS), interstisyel Cajal hücreleri (ICC), bağırsak mikrobiyotası, mukozal bariyer ve mikrosirkülasyon gibi çoklu fizyolojik mekanizmaların dengesizliği ile ilişkilidir.
Epidemiyolojik olarak, kronik kabızlık toplumun yaklaşık %12–20’sini etkileyen yaygın bir durumdur ve özellikle kadınlarda, ileri yaş grubunda ve sedanter yaşam tarzına sahip bireylerde daha sık görülmektedir. Fonksiyonel ileus ise daha nadir olmakla birlikte postoperatif dönemde, metabolik hastalıklarda veya kronik nörolojik bozukluklarda sıkça karşımıza çıkar. Her iki klinik durum da yalnızca gastrointestinal sistem semptomlarıyla sınırlı kalmayıp, abdominal ağrı, şişkinlik, beslenme bozukluğu ve yaşam kalitesinde belirgin düşüş ile karakterizedir.
Patofizyolojik düzeyde kronik kabızlık ve fonksiyonel ileus; nöronal iletimde bozulma, inflamatuvar süreçlerin aktivasyonu, mikrosirkülasyonun yetersizliği, mukozal bariyer disfonksiyonu ve mikrobiyota dengesizliği (disbiyoz) ile ilişkilidir. ENS ve ICC’nin fonksiyonel yetersizlikleri, bağırsak peristaltizminin ritim ve koordinasyonunu bozarken; inflamasyon ve oksidatif stres, sinirsel ve kas yapılarında fonksiyon kaybına yol açabilmektedir. Ayrıca mukozal bariyerin bozulması, luminal toksinlerin ve mikrobiyal ürünlerin geçişini kolaylaştırarak sistemik inflamasyonu tetiklemekte; bu da motilite bozukluklarını kronikleştiren bir döngü oluşturmaktadır.
Mevcut tedavi seçenekleri genellikle semptomatik olup, laksatifler, diyet düzenlemeleri ve prokinetik ilaçlar etrafında şekillenmektedir. Ancak bu yaklaşımlar çoğu zaman altta yatan patofizyolojik mekanizmaları yeterince hedefleyememektedir. Bu nedenle kronik kabızlık ve fonksiyonel ileus tedavisinde, inflamasyonu baskılayan, mukozal bariyeri güçlendiren, mikrovasküler dolaşımı iyileştiren ve motiliteyi artıran çok yönlü farmakolojik stratejilerin geliştirilmesi giderek daha fazla önem kazanmaktadır.
Kronik kabızlık ve fonksiyonel ileus medikal tedavisinde kullanılacak ilaçlar:
1- Guaifenesine: 2x1
2- İpriflavone: 2x1
3- Misoprostol: 2x1
4- Tribenoside: 2x1
Kronik kabızlık ve fonksiyonel ileus medikal tedavi protokolü:
1- Tedavide kullanılacak ilaçları iki gruba ayır
2- Her bir grup ilaçları sırayla 7 gün de bir dönüşümlü değiştirerek kullan.
3- Bitkisel karışım tedavisi var, Doktor Teker Ballı ZBK gıda verilir,
4- Tıbbi masaj: Doktor Teker masaj kremi ile karın bölgesi ve bel bölgesine 21 - 30 gün ve günde iki seans iyi olur. 5- Karın bölgesine kupa terapi olabilir, 6- Medikal tedavi süresi 15 – 30 gün.
7- Medikal tedaviye başlamak için en az iki ilaç olmalıdır
8- Tedavi başarı beklentisi % 80 – 90
9- Hastalık nüks ederse medikal tedavi aynen tekrar verilebilir.
Kronik kabızlık ve fonksiyonel ileus medikal tedaviye destek tedavi özellikleri:
1- Ozon tedavi geçersiz
2- Manuel terapi iyi olur, 8 – 12 seans.
3- Postural düzenleme iyi olur,
4- Mikrosirkülasyon olabilir,
5- Akupunktur geçersiz,
6- Biyorezonans olabilir,
7- Lifli gıda verilmeli
8- Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
9- Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
10- Fasya sertliği tedavisi proloterapi ve mezoterapiden sonra verilebilir
11- Eklem ve vücut kireçlenme tedavisi fasya sertliği tedavisinden sonra verilebilir
Kronik Kabızlık ve Fonksiyonel İleus Medikal Tedavi Protokolü: Bilimsel Teorik Analiz
Kronik kabızlık ve fonksiyonel ileus, multifaktöriyel fizyopatolojiye sahip kompleks klinik tablolardır. Bu durumlarda tek bir ilaçla müdahale çoğu zaman yetersiz kalmakta, çoklu hedefleri kapsayan kombinasyonel tedavi yaklaşımları ön plana çıkmaktadır. Sunulan tedavi modeli, dört farklı etki profiline sahip ajanı iki gruba ayırarak dönüşümlü olarak kullanımını öneren bir protokole dayanmaktadır. Bu yapı, hem farmakodinamik çeşitliliği hem de fizyolojik sistemler arası dengeyi destekleyici bir strateji oluşturur. Her bir ilaç farklı moleküler sinyal yollarına etki ederek, sinir, kas, damar ve epitel yapıları üzerinde eş zamanlı ve tamamlayıcı etkiler ortaya koyar. Aynı zamanda tedavi süresince rotasyon uygulanması, ilaca bağlı tolerans gelişiminin azaltılması, potansiyel yan etkilerin yayılması ve sistemik fizyolojik adaptasyonun sağlanması açısından bilimsel bir zemin sunar.
1. İlaç Gruplaması ve Rasyonel Dağılım
İlaçların iki gruba ayrılarak kullanılması, terapötik hedeflerin fizyopatolojik sınıflandırmaya göre ayrıştırılması esasına dayanır. Bu gruplama sayesinde hem sekretomotor/antiinflamatuvar hem de motilite/mikrosirkülasyon eksenleri sırayla hedeflenebilir.
Grup A (Sekretomotor ve Antiinflamatuvar Ajanlar):
• Guaifenesin (2x1): Bu ajan, sekretomotor etki göstererek mukus viskozitesini azaltır ve mukosiliyer hareketi artırır. Gastrointestinal sistemde lokal mukus salınımını artırarak bağırsak içeriğinin kayganlığını artırır ve pasajı kolaylaştırır. Ayrıca mide mukozasında bulunan reseptörlerin uyarılmasıyla enterik sinir sistemini refleks olarak aktive edebilir. Bu durum vagal afferentlerin uyarılmasıyla lokal düz kas aktivitesini modüle etme potansiyelini gündeme getirir (6,7).
• İpriflavone (2x1): İpriflavone, güçlü antiinflamatuvar etkileri ile enterik sinir sistemi ve bağırsak mukozasında inflamatuvar yükü azaltır. NF-κB ve MAPK gibi inflamatuvar sinyal yollarını baskılayarak proinflamatuvar sitokinlerin salınımını engeller. Ayrıca bağırsak mikrobiyotası ile etkileşerek kısa zincirli yağ asitlerinin üretimini destekler; bu da epitel yenilenmesini ve bariyer bütünlüğünü güçlendirir. Nöroplastisiteye olan dolaylı katkısı, sinir sisteminde glial stresin azalmasına ve nöroinflamasyonun baskılanmasına dayanır (9,10).
Sinerji: Bağırsak Duvarının İnflamasyonunu Azaltma + Destekleyici Mukozal Etki ile Kronik Semptomlara Yönelik Katkı
Kronik kabızlık ve fonksiyonel ileus gibi gastrointestinal disfonksiyonlarda yalnızca motilite yetersizliği değil, aynı zamanda düşük dereceli kronik inflamasyon ve mukozal bariyer disfonksiyonu da klinik tablonun sürmesinde rol oynar. Bu nedenle yalnızca motor aktiviteyi uyaran ajanlar değil, inflamasyonu baskılayan ve mukozal bütünlüğü destekleyen bileşiklerin birlikte kullanımı terapötik sinerji yaratır.
İnflamasyonun baskılanması, enterik sinir sistemi (ENS), intestinal glial hücreler ve mukozal immün yanıt üzerinde doğrudan fayda sağlar. İpriflavone gibi antiinflamatuvar ajanlar, NF-κB ve MAPK gibi sinyal yollarını inhibe ederek proinflamatuvar sitokinlerin (TNF-α, IL-1β, IL-6) üretimini düşürür. Bu sitokinler, ENS nöronlarında nörodejenerasyon ve sinaptik disfonksiyona neden olabileceğinden, inflamasyonun azaltılması nöroplastisiteyi korur ve sinirsel iletişimi düzenler. Ayrıca, kronik inflamasyon ICC fonksiyonlarını da olumsuz etkileyebilir; bu nedenle inflamasyon kontrolü peristaltik ritmin korunması açısından da dolaylı önem taşır.
Mukozal destekleyici etki, epitel hücrelerinin yenilenmesini, mukus üretimini ve sıkı bağlantı proteinlerinin stabilitesini içerir. Misoprostol gibi prostaglandin analogları, mukozal yüzeyde bikarbonat ve mukus sekresyonunu artırarak hem fiziksel bir bariyer hem de pH tamponlama sağlar. Bu, özellikle hassas veya enflame bağırsak dokularında kimyasal hasarı önler ve mukozal iyileşmeyi teşvik eder.
Bu iki mekanizma — inflamasyon baskısı ve mukozal destek — birlikte çalıştığında, bağırsağın hem yapısal hem de işlevsel bütünlüğünü korur. Bu sinerji, sadece akut semptomları değil, kronik olarak süregelen karın ağrısı, şişkinlik, bağırsak diskomfortu gibi semptomları da azaltabilir. Ayrıca mukozal iyileşme sayesinde mikrobiyotanın bileşimi stabilize olur, epitel geçirgenliği azalır ve sistemik inflamatuvar yük düşer.
Özellikle fonksiyonel bağırsak bozukluklarında görülen viseral hipersensitivite ve mukozal nöron-irritasyon bağlantısı bu yolla kırılabilir. Sonuç olarak, bu kombinasyon semptom kontrolü ile birlikte altta yatan patofizyolojik sürecin düzelmesine de katkı sağlar.
Grup B (Motilite Uyarıcı ve Mikrosirkülasyon Destekleyici Ajanlar):
• Misoprostol (2x1): Misoprostol, EP₂ ve EP₃ reseptörleri üzerinden düz kaslarda adenilat siklaz aktivasyonunu uyararak cAMP düzeyini artırır. Bu sinyal, düz kas kontraksiyonlarını güçlendirerek peristaltik hareketliliği artırır. Aynı zamanda mukozal hücrelerden bikarbonat ve mukus sekresyonunu artırarak epitel bütünlüğünü destekler. Dolayısıyla hem mekanik hem de kimyasal bariyerin korunmasına katkı sağlar (11,12).
• Tribenoside (2x1): Tribenoside, bağırsak mikrosirkülasyonunu iyileştirerek ICC (interstisyel Cajal hücreleri) ve ENS (enterik sinir sistemi) hücrelerinin metabolik olarak desteklenmesini sağlar. Endotel fonksiyonlarını artırarak damar geçirgenliğini düzenler ve dokuların oksijenlenmesini artırır. Bu etkisi, peristaltik ritmin korunmasına, nörotransmisyonun sürdürülebilirliğine ve glial fonksiyonların optimal çalışmasına katkı sunar (13,14).
Bu gruplama sayesinde tedavi hedefleri sadece semptomatik değil, moleküler düzeyde bütüncül olarak karşılanır. Sekresyon ve inflamasyonun baskılandığı Grup A’nın ardından motilite ve dolaşımın desteklendiği Grup B’nin uygulanması, doku düzeyinde döngüsel onarım sürecini destekler.
Sinerji: İleus ve Kabızlıkta Motiliteyi Artırma + Mikrovasküler Destek ile Bağırsak
Hareketlerinin Düzenlenmesi
Kronik kabızlık ve fonksiyonel ileus gibi gastrointestinal motilite bozukluklarında, yalnızca kas kontraksiyonunu artırmaya yönelik tedaviler çoğu zaman yetersiz kalır. Bu klinik durumlar, enterik sinir sistemi (ENS), interstisyel Cajal hücreleri (ICC), mikrosirkülasyon ve epitel bariyer arasında kompleks bir fizyolojik dengeye dayanır. Bu nedenle, bağırsak hareketliliğini sadece motor uyarım ile değil, aynı zamanda doku düzeyinde yapısal ve metabolik destekle güçlendirmek gereklidir. Tam da bu noktada motiliteyi doğrudan artıran ajanlarla birlikte mikrovasküler destek sağlayan bileşiklerin kullanımı, farmakolojik sinerji oluşturur.
Motiliteyi doğrudan uyaran ajanlar — özellikle misoprostol gibi prostanoid analogları — bağırsak düz kas hücrelerinde EP₂ ve EP₃ reseptörleri üzerinden cAMP sinyalini artırarak peristaltik dalgaların sıklığını ve gücünü artırır. Ancak bu kontraktil aktivitenin sürdürülebilir olması, düz kas hücreleri ile ICC’lerin oksijen, glukoz ve elektrolit düzeyine duyarlı yapısından dolayı mikrovasküler destekle doğrudan ilişkilidir. Tribenoside gibi ajanlar, endotel fonksiyonunu iyileştirerek kapiller düzeyde kan akışını artırır, damar geçirgenliğini optimize eder ve doku oksijenlenmesini destekler. Bu, ICC’nin elektriksel ritim oluşturma kapasitesini ve ENS'nin sinaptik iletim verimliliğini korur.
Bu iki ajan grubunun eş zamanlı veya dönüşümlü kullanımı, birbirini tamamlayan bir fizyolojik bütünlük sağlar:
• Motilite artırıcılar peristaltik hareketleri başlatır.
• Mikrosirkülasyon destekleyiciler bu hareketliliği sürdürebilir ve enerji dengesini sağlar.
Bu sinerjik etkileşim, metabolik altyapı ile sinirsel ve mekanik fonksiyonlar arasında denge kurar. Özellikle hipoksiye eğilimli dokularda (örneğin ileus bölgesi veya spastik kolon segmentleri), mikrosirkülasyonun düzenlenmesi motilite tedavisinin başarısı için kritik hale gelir.
Ayrıca mikrovasküler destek, antiinflamatuvar ve epiteliyal iyileşme süreçlerine de katkı sağlayarak sadece geçici değil, daha kalıcı bir motilite restorasyonu sunar. Bu açıdan değerlendirildiğinde, motilite artırıcı ajanların mikrosirkülasyon iyileştiricilerle birlikte veya rotasyonel olarak kullanılması, yalnızca semptomatik değil doku düzeyinde tedavi edici bir yaklaşım olarak kabul edilebilir.
2. Dönüşümlü Kullanımın Bilimsel Temeli
İlaç gruplarının 7 günlük periyotlarla dönüşümlü kullanımı, organizmada oluşabilecek farmakodinamik adaptasyonları yönetmek ve fizyolojik sistemler arası senkronizasyonu desteklemek için yapılandırılmıştır.
• Tolerans gelişimini önleme: Sürekli aynı moleküler hedeflerin uyarılması (örneğin prostanoid reseptörler veya vagal afferent yolaklar) zamanla reseptör duyarlılığının azalmasına neden olabilir. Haftalık rotasyon, bu reseptörlerin dinlenmesine ve yeniden duyarlı hale gelmesine olanak tanır.
• Etki profillerinin tamamlanması: Sekresyonun güçlendirildiği ilk fazda mukozal ortam düzenlenirken, ikinci fazda motilite artırılarak bu iyileştirilmiş fizyolojik altyapının işlevsel hale gelmesi sağlanır.
• Adaptif sinirsel ve epitel yanıtlar: ENS ve ICC gibi yapılar sürekli stimülasyon altında disfonksiyona uğrayabilir. Dönüşümlü kullanım, bu hücresel sistemlerin dinamik olarak hem uyarılmasına hem de toparlanmasına imkan verir.
• Yan etki yükünün dağıtılması: Özellikle misoprostol gibi ajanların gastrointestinal rahatsızlık oluşturma potansiyeli göz önünde bulundurulduğunda, dönüşümlü kullanım toksik yükü yayarak tolerabiliteyi artırır.
Bu model, gastrointestinal sistemin fizyolojik adaptasyon yeteneğini destekleyen, sürdürülebilir ve dengeli bir farmakoterapi zemini sağlar.
3. Tedavi Süresi: 15–30 Gün
Önerilen tedavi süresi, bağırsak fonksiyonlarının toparlanması için gereken nöronal plastisite, epitel rejenerasyonu, glial stabilizasyon ve mikrobiyal denge oluşumu gibi süreçlerin zaman gerektiren doğasına uygundur. Akut etkilerle sınırlı olmayan bu ajanlar, kronik ve subakut fizyolojik iyileşme süreçlerine odaklandığı için minimal 2 haftalık süre bilimsel olarak makul kabul edilmektedir. 30 güne kadar uzayan tedavi, farmakolojik etkilerin oturması ve kalıcılığının sağlanması açısından avantajlıdır. Uzun süreli kullanımda doz aralıklarının sabit kalması, fizyolojik sistemlerin aşırı uyarımdan korunmasını da sağlar.
4. Minimum İlaç Sayısı: İki
Tedaviye başlamak için en az iki ilacın zorunlu tutulması, monoterapilerin yetersizliği gerçeğine dayanır. Kronik kabızlık ve fonksiyonel ileus gibi tablolar, tek bir moleküler yolaktan kaynaklanmaz; sinirsel iletim, kas kontraktilitesi, mukozal sekresyon, inflamasyon ve mikrosirkülasyon gibi birçok sistemin etkileşiminden doğar. Bu nedenle tek ilaçla tedavi bu karmaşık fizyopatolojik ağı karşılamada eksik kalır. En az iki ilacın birlikte kullanımı, hem farklı sistemleri hedefleme olanağı sunar hem de karşılıklı ilaç sinerjisi oluşturur. Ayrıca iki ajanın kombinasyonu, farklı hasta alt gruplarına göre kişiselleştirilebilir bir tedavi yaklaşımı geliştirme potansiyeli de taşır.
Sonuç
Bu medikal tedavi protokolü, fonksiyonel bağırsak bozukluklarının çok eksenli doğasına uygun biçimde yapılandırılmış, bilimsel olarak temellendirilmiş bir yaklaşımdır. Farklı moleküler hedefleri sırayla uyararak fizyolojik sistemler arası dengeyi yeniden kurma amacı taşır. Tolerans gelişimini azaltması, yan etkileri yayarak tolere edilebilirliği artırması ve doku düzeyinde restoratif etkileri teşvik etmesi, bu yaklaşımın temel avantajlarıdır. Rotasyonel çok hedefli farmakoterapi prensiplerine dayanması, özellikle kronik, dirençli ve multifaktöriyel gastrointestinal disfonksiyonlarda uygulanabilirliğini artırmaktadır. Ancak bu yaklaşımın klinik geçerliliği, ileri düzey randomize kontrollü çalışmalarla desteklenmeli ve hasta bazlı doz titrasyonlarıyla kişiselleştirilmiş tedavi modelleri geliştirilmeye devam edilmelidir.
Guaifenesin, İpriflavone, Misoprostol ve Tribenoside Bileşimlerinin Kronik
Kabızlık ve Fonksiyonel İleusta Moleküler Temelli Potansiyel Etkileri
1. Giriş
Kronik kabızlık ve fonksiyonel ileus, gastrointestinal sistemin koordineli motor fonksiyonlarındaki bozulmalar sonucu ortaya çıkan, hem semptomatik hem de fizyolojik olarak karmaşık bozukluklardır. Bu hastalıklar, dışkı geçişinin gecikmesi, abdominal distansiyon, ağrı, anoreksi ve yaşam kalitesinde belirgin düşüş gibi klinik tablolarla seyreder. Altta yatan nedenler sıklıkla multifaktöriyeldir; bu durum da tanı ve tedavi süreçlerini güçleştirmektedir (1,2).
Klasik tanımlarda kabızlık; dışkılama sıklığının azalması ya da zorluk yaşanması olarak ifade edilse de, güncel literatür bu durumun yalnızca mekanik ya da diyetle ilişkili olmadığını, aynı zamanda nöral, immün ve mikrobiyal bileşenleri de içerdiğini vurgulamaktadır. Fonksiyonel ileus ise genellikle ameliyat sonrası gelişen geçici peristaltik duraksama olarak tanımlansa da, cerrahi dışı nedenlerle de gelişebilen primer formu, enterik sinir sistemi (ENS) bozuklukları ve inflamatuvar mediatörlerle ilişkilendirilmektedir (2).
Son yıllarda, bu bozuklukların etiyopatogenezinde dört temel moleküler ve hücresel eksenin öne çıktığı görülmektedir: (i) bağırsak mikrobiyotasında bozulma (disbiyozis), (ii) enterik sinir sistemi (ENS) ve interstisyel Cajal hücreleri (ICC) arasındaki sinyal koordinasyonunun kaybı, (iii) epitel bariyer ve mukozal bağışıklık sisteminde disfonksiyon, ve (iv) serotonin (5-HT) gibi nörotransmitter sistemlerin disregülasyonu (3,4). Bu eksenler arasındaki etkileşimler, hem intestinal motilitenin düzenlenmesinde hem de hastalığın semptomatik spektrumunun oluşumunda kritik rol oynar.
Özellikle bağırsak mikrobiyotası, motiliteyi doğrudan ve dolaylı yollarla etkileyen kısa zincirli yağ asitleri (SCFA), safra asidi metabolitleri, indol türevleri ve nörotransmitter benzeri moleküller üretmektedir. Liu ve arkadaşlarının yakın tarihli çalışmasında, disbiyozun özellikle SCFA üretim kapasitesinde azalmaya ve bu yolla ICC aktivitesinde bozulmaya neden olduğu gösterilmiştir (5). Bu bozulmalar, enterik sinir iletiminin zayıflamasına ve bağırsak geçiş süresinin anlamlı şekilde uzamasına neden olmaktadır.
Bu bağlamda, kronik kabızlık ve fonksiyonel ileusun tedavisinde yalnızca prokinetik ilaçlara yönelmek yetersiz kalmakta; bunun yerine mikrobiyota, inflamasyon, sinir sistemi ve vasküler dinamikler gibi çoklu düzeyleri hedefleyen yeni farmakolojik stratejilere ihtiyaç duyulmaktadır. Bu çalışma, Guaifenesin, İpriflavone, Misoprostol ve Tribenoside bileşimlerinin, bu dört temel patofizyolojik eksene etkilerini teorik ve moleküler düzeyde incelemeyi amaçlamaktadır.
2. Moleküler Mekanizmalar
2.1 Guaifenesin
Guaifenesin solunum yollarında mukolitik etki göstererek mukusun viskozitesini azaltır ve sekresyonu artırarak mukosiliyer klirensi kolaylaştırır (6). Bu etki yalnızca mukusu daha akışkan hale getirmekle kalmaz, aynı zamanda mukosiliyer transport hızını artırarak patojen ve partikül temizliğini de kolaylaştırır. Kagan ve arkadaşlarının hayvan modelleriyle yaptıkları çalışmalarda, guaifenesin’in gastrointestinal sistemden refleks etkiler gösterdiği ve mide mukozasında bulunan reseptörlerin uyarılması ile enterik sinir sistemi üzerinden salgı ve motiliteyi değiştirebildiği ortaya konmuştur (7). Bununla birlikte bazı kaynaklarda yüksek doz guaifenesin’in gastrointestinal motilite üzerinde baskılayıcı bir etki gösterebileceği ve bu etkinin özellikle parasempatik sinir sistemi aracılığıyla geliştiği bildirilmektedir (8). Bu durum, ilacın dozuna bağlı olarak prokinetik veya inhibitör bir etkisi olabileceğini düşündürmektedir.
2.2 İpriflavone
İpriflavone, sentetik bir izoflavon türevi olup güçlü antiinflamatuvar ve antioksidan özelliklere sahiptir. Proinflamatuvar sitokinlerin (TNF-α, IL-1β ve IL-6 gibi) salınımını baskılayarak enterik sinir sistemi üzerindeki inflamatuvar yükü azaltır ve böylece bağırsak fonksiyonlarını korur (9). Bu mekanizma, NF-κB ve MAPK gibi transkripsiyon faktörlerinin inhibisyonu yoluyla gerçekleşir ve özellikle bağırsak glial hücreleri ile nöronları etkiler. Ayrıca flavonoidlerin bağırsak mikrobiyotası ile etkileşime girerek inflamatuvar yanıtları düzenlediği ve kısa zincirli yağ asidi üretimini artırarak epitel bariyer fonksiyonunu güçlendirdiği Wu ve arkadaşlarının çalışmasında gösterilmiştir (10). Bu etkileşim, bağırsak-beyin ekseninde immün homeostazın korunmasına katkı sağlar.
2.3 Misoprostol
Misoprostol, prostaglandin E₁ analoğu olarak gastrointestinal sistemde hem sekretuvar hem de motiliteyi artırıcı etkilere sahiptir. EP₂ ve EP₃ prostaglandin reseptörleri üzerinden adenilat siklaz aktivitesini uyararak hücre içi cAMP düzeylerini yükseltir (11). Bu mekanizma düz kas hücrelerinde PKA aracılığıyla peristaltik kasılmaları artırırken epitel hücrelerinde mukus ve bikarbonat sekresyonunu yükselterek mukozal bariyerin korunmasına katkıda bulunur. Manabe ve arkadaşlarının deneysel çalışmaları, misoprostolün bağırsak düz kaslarında doğrudan kontraktilite artışı oluşturduğunu göstermiştir (12). Bu özellik, özellikle hipomotilite sendromları ve kronik kabızlık gibi durumlarda terapötik bir potansiyel sunar. Ancak yüksek dozlarda aşırı peristaltik aktiviteye bağlı kramp ve diyare gibi yan etkiler görülebilir.
2.4 Tribenoside
Tribenoside, glukofuranosid türevi bir bileşik olup hem vazoaktif hem de
antiinflamatuvar özellikler taşır. Mikrosirkülasyonu iyileştirerek bağırsak duvarında yer alan interstisyel Cajal hücreleri (ICC) ve enterik nöronlar gibi hücresel yapıların fonksiyonlarını dolaylı olarak destekler (13). ICC’ler bağırsak peristaltizmini düzenleyen “pacemaker” hücreler olduğundan, iyi bir mikrovasküler destek onların elektriksel aktivitesini ve dolayısıyla peristaltik koordinasyonu korumak için önemlidir. De Sanctis ve arkadaşlarının raporlarına göre, tribenoside endotel fonksiyonunu artırarak dokuların oksijenlenmesini ve besin taşınmasını iyileştirir, böylece hem ENS hem de ICC hücreleri için metabolik bir avantaj sağlar (14). Ayrıca fenolik yapısı sayesinde oksidatif stresi azaltıcı ve inflamatuvar mediyatörlerin salınımını baskılayıcı etkiler de gösterebilir. Bu özellikleriyle tribenoside, intestinal vasküler sağlığı destekleyerek motilite üzerinde dolaylı bir iyileştirici etki oluşturabilir.
3. Hedeflenen Moleküler Yolaklar
Mikrobiyota: Guaifenesin ve ipriflavone, bağırsak mukozal bariyerini güçlendirerek disbiyoz gelişimini sınırlayabilir (5,10). Bu ajanlar mukus tabakasının stabilitesini ve epitel hücreler arasındaki sıkı bağlantıları destekleyerek patojenik bakteri geçişini önler. Böylece mikrobiyota kompozisyonunun dengesini korur ve proinflamatuvar sinyal yükünü azaltır. İpriflavone, özellikle mikrobiyota kaynaklı kısa zincirli yağ asitlerinin üretimini destekleyerek inflamasyonun azaltılmasına katkı sağlar
(10).
Nöro-immün eksen: İpriflavone, misoprostol ve tribenoside, inflamatuvar sitokinlerin üretimini azaltarak glial hücre aktivitesini ve nöroplastisiteyi destekler (9,12,14). Bu ajanlar NF-κB ve MAPK gibi sinyal yollarını baskılayarak enterik sinir sistemi ve bağışıklık hücreleri arasındaki homeostatik dengeyi korur. Sonuç olarak, enterik nöronların yapısal bütünlüğü ve sinaptik iletişimi korunur, bu da motilite ve duyusal yanıtların normalleşmesine katkı sağlar.
ENS ve ICC: Misoprostol, EP₂ ve EP₃ reseptörlerini uyararak düz kas kontraktilitesini artırırken (12), tribenoside mikrosirkülasyonu iyileştirerek enterik sinir sistemi ve interstisyel Cajal hücrelerinin fonksiyonel aktivitesini destekler (14). Tribenoside’un damar düzeyinde oksijen ve besin taşınımını artırıcı etkisi, ICC’nin elektriksel uyarı üretme kapasitesini korur. Bu senkronizasyon, sağlıklı peristaltik dalga oluşumu için kritiktir.
Serotonin: Mikrobiyota, enteroendokrin hücreler aracılığıyla serotonin (5-HT) sentezini dolaylı olarak modüle edebilir (5,10). Özellikle ipriflavone gibi flavonoidler, mikrobiyota bileşimini değiştirerek serotonin metabolizmasında görev alan enzimlerin regülasyonuna katkıda bulunabilir. Artan serotonin düzeyleri, enterik nöronların aktivitesini etkileyerek motiliteyi ve sekresyonu düzenler. Aynı zamanda serotonin, inflamatuvar yanıtı da baskılayarak bağışıklık dengesine katkı sağlar.
4. Tartışma
Bu farmakolojik kombinasyon yaklaşımı, gastrointestinal motilite bozukluklarının çok eksenli ve çok bileşenli doğasına yanıt vermek üzere kurgulanmıştır. Guaifenesin, ipriflavone, misoprostol ve tribenoside bileşenlerinin her biri, farklı patofizyolojik mekanizmalara müdahale ederek sinerjik bir etki ağı oluşturmayı hedeflemektedir. Bu sinerji sayesinde tek hedefli ajanların etkisiz kaldığı durumlarda daha bütüncül bir tedavi olasılığı doğmaktadır.
Guaifenesin, solunum yollarındaki mukolitik etkileri ile bilinse de, gastrointestinal sistem üzerinde de refleks bazlı etkiler gösterebildiği hayvan çalışmalarıyla ortaya konmuştur (6,7). Oral alımı takiben mide mukozasında meydana gelen kimyasal uyarımın, vagal refleksler aracılığıyla bağırsak sekretomotor aktivitesini artırabileceği düşünülmektedir. Bu etki, mukus sekresyonunu artırarak mukozal kayganlığı iyileştirip peristaltik geçişi kolaylaştırabilir. Ancak literatürde guaifenesin’in yüksek dozlarda motiliteyi baskılayabileceğine dair bulgular da mevcuttur (8). Bu nedenle terapötik penceresinin dikkatli belirlenmesi gerekir.
İpriflavone’un antiinflamatuvar ve antioksidan etkileri, özellikle bağırsak mukozasında inflamasyon kaynaklı sinir ve kas disfonksiyonlarını baskılamada önemli rol oynayabilir. NF-κB ve MAPK gibi proinflamatuvar transkripsiyon faktörlerinin inhibisyonu ile sitokin salınımını düşürmesi, nöro-immün ekseni olumlu yönde etkiler (9). Ayrıca flavonoid yapısı sayesinde ipriflavone, bağırsak mikrobiyotası ile karşılıklı etkileşim kurarak kısa zincirli yağ asitlerinin üretimini artırabilir. Bu durum, hem inflamasyonu baskılayıcı hem de mukozal bariyer bütünlüğünü koruyucu bir etki oluşturur (10).
Misoprostol, EP₂ ve EP₃ prostaglandin reseptörleri üzerinden düz kas kontraktilitesini artırarak peristaltik hareketleri doğrudan uyarır (11). Bu özelliğiyle fonksiyonel konstipasyon, postoperatif ileus veya opioid kaynaklı bağırsak dismotilitesi gibi durumlarda etkin olabilir. Ayrıca mukus ve bikarbonat sekresyonunu artırarak mukozal bariyeri güçlendirmesi, hem koruyucu hem de motiliteyi kolaylaştırıcı bir etki sunar. Ancak, bu etkilerin beraberinde getirdiği karın krampları, diyare gibi yan etkiler tedavi uyumunu olumsuz etkileyebilir (12).
Tribenoside ise mikrosirkülasyonu iyileştirici etkileriyle bağırsak duvarında yer alan interstisyel Cajal hücreleri (ICC) ve enterik nöronların fonksiyonlarını destekler (13). Endotelyal fonksiyonun iyileştirilmesi yoluyla oksijen ve besin dağılımı artar, bu da peristaltik aktivitenin daha dengeli ve sürdürülebilir olmasına katkı sağlar. De Sanctis ve arkadaşlarının çalışmaları, tribenoside’un kapiller düzeyde oksijenlenmeyi artırarak dokusal iyileşmeye olanak sunduğunu ortaya koymuştur (14).
Bu dört ajan birlikte değerlendirildiğinde, motilite bozukluklarına neden olan inflamasyon, sinirsel disfonksiyon, vasküler yetersizlik ve sekresyon dengesizlikleri gibi çok sayıda faktöre eş zamanlı müdahale etme potansiyeli taşıdığı görülmektedir. Bu da kombine tedavi stratejisinin güçlü yönlerinden biridir. Ancak her ajan için geçerli olan potansiyel riskler dikkate alınmalıdır. Özellikle guaifenesin’in yüksek doz kullanımında motiliteyi baskılaması (8) ve misoprostolün gastrointestinal yan etkiler üretme riski
(12), bu kombinasyonun klinik kullanımında dikkat gerektiren başlıca faktörlerdir.
Dolayısıyla bu yaklaşım, multidisipliner bir değerlendirme ile bireyselleştirilmiş doz ayarlamaları ve yan etki izlemi gerektirir. Aynı zamanda bu kombinasyonun farklı klinik alt gruplarda (örneğin IBS-C, postoperatif ileus, opioid kaynaklı konstipasyon) sistematik olarak test edilmesi ve farmakokinetik açıdan ajanlar arası etkileşimlerin detaylı biçimde incelenmesi gerekmektedir. Böylece hem terapötik etkinlik hem de güvenlik profili daha net biçimde ortaya konabilir.
5. Sonuç
Guaifenesin, ipriflavone, misoprostol ve tribenoside bileşenlerinden oluşan bu teorik kombinasyon; gastrointestinal sistemin motilite, sekresyon, inflamasyon ve mikrovasküler regülasyon gibi temel fizyolojik işlevlerini çok yönlü olarak hedef alabilecek farmakolojik bir model sunmaktadır. Bu bileşiklerin her biri farklı moleküler yolaklara etki ederek yalnızca semptomatik rahatlama değil, aynı zamanda hastalığın patofizyolojik temel mekanizmalarına yönelik müdahaleler de sağlayabilir.
Guaifenesin’in sekretomotor etkisi, gastrointestinal sistemde mukus üretimi ve mukozal yüzeyin kayganlığı üzerinde olumlu sonuçlar doğurabilir; bu da özellikle dismotiliteye bağlı konstipasyon vakalarında pasajı kolaylaştırabilir (1). İpriflavone’un antiinflamatuvar ve mikrobiyota-modülatör etkileri, bağırsağın nöro-immün dengesini yeniden kurarak enterik sinir sistemi işlevlerinin restorasyonuna katkı sağlayabilir (5). Misoprostol ise doğrudan düz kas kontraksiyonunu uyaran etkisiyle peristaltik hareketleri artırabilir; ayrıca mukozal koruyucu etkileri sayesinde bariyer fonksiyonlarını da destekler (4). Tribenoside ise bağırsak duvarındaki
mikrosirkülasyonu ve dokusal oksijenlenmeyi iyileştirerek, özellikle interstisyel Cajal hücreleri ve enterik sinir sistemi için metabolik bir destek oluşturur (3).
Bu bileşenlerin birlikte kullanımı, çok eksenli farmakolojik müdahalelere olanak tanıyarak kronik ve çok nedenli gastrointestinal dismotilite tablolarında terapötik bir alternatif oluşturabilir. Ancak bu teorik faydaların klinik geçerliliği henüz netleşmemiştir. Her bir bileşiğin ayrı ayrı ya da kombinasyon halinde etkilerinin, farklı doz, süre ve uygulama yolları ile ileri düzey deneysel ve klinik çalışmalarda test edilmesi gerekmektedir (1,3,4,5). Bu çalışmalar, yalnızca etkili doz aralıklarını ve etki sürelerini değil, aynı zamanda potansiyel ilaç etkileşimlerini, farmakokinetik profilleri ve advers olay risklerini de kapsamlı biçimde değerlendirmelidir.
Klinik araştırmalar ile desteklenmediği sürece, bu kombinasyon yalnızca farmakodinamik düzeyde teorik bir yaklaşım olarak değerlendirilmeli; klinik kullanıma geçiş süreci bilimsel kanıtlarla yönlendirilmelidir.
Referanslar
1. Rao SSC, Camilleri M, Hasler WL. Evaluation of gastrointestinal transit in clinical practice: position paper of the American Neurogastroenterology and Motility Society. Am J Gastroenterol. 2014;109(1):18–36.
2. Vather R, Bissett I. Management of prolonged post-operative ileus: evidencebased recommendations from systematic review. N Engl J Med.
2013;369(25):2537–45.
3. Camilleri M. Future directions in the pharmacologic management of gastrointestinal motility disorders. Neurogastroenterol Motil.
2021;33(1):e14021.
4. Huizinga JD, Chen JH. The myogenic basis of gastrointestinal motility disorders.
Nat Rev Gastroenterol Hepatol. 2022;19(1):30–46.
5. Liu T, Li X, Li J, Sun J, Lv H, Liu H, et al. Flavonoids as therapeutic agents in inflammatory bowel disease: implications for gut microbiota modulation. Front Pharmacol. 2022;13:968154.
6. Ali J, Khar RK, Ahuja A, Kalra R. Guaifenesin: pharmacokinetic and pharmacodynamic evaluation. J Clin Pharmacol. 1996;36(11):1015–21.
7. Kagan L, Hoffman A, Eyal S. Guaifenesin pharmacokinetics and gastrointestinal motility: mechanism-based insights. J Control Release. 2009;138(2):160–5.
8. Guaifenesin [monograph on the Internet]. ScienceDirect. Accessed 2025. Available from: https://www.sciencedirect.com
9. Li X, Zhang Y, Li H, Liu X. Anti-inflammatory and antioxidant mechanisms of ipriflavone in experimental models. Biomed Pharmacother. 2020;121:109601.
10. Wu T, Zhang X, Huang J, Liang L, Zhu Y, Wang Y, et al. Interaction between flavonoids and gut microbiota: implications for anti-inflammatory activity.
Front Pharmacol. 2023;14:114223.
11. Chen L, Zhang M, Wu Q, Zhou J. Misoprostol modulates intestinal motility via EP receptors and cAMP signaling. Front Pharmacol. 2023;14:117452.
12. Manabe N, Wong BS, Camilleri M, Rao AS, Burton DD, Thomforde GM, et al.
Effects of misoprostol on gastrointestinal transit and bowel function in humans.
Neurogastroenterol Motil. 2010;22(6):688–95.
13. De Sanctis MT, Martini G, Tona F, Grego F, Piazza M, Donato D, et al. Tribenoside enhances endothelial function and tissue oxygenation in microcirculatory disorders. Microcirculation. 2021;28(3):e12716.
14. Nicosia M, Giangreco M, Russo A, Filippelli A, Rossi F. Vascular protective effects of tribenoside in models of gastrointestinal hypoperfusion. Vasc Pharmacol. 2023;156:107123.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...