ÇÖLYAK (GLUTEN ENTEROPATİSİ) HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ BİR KOMPOZİSYON
ÇÖLYAK (GLUTEN ENTEROPATİSİ) HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ BİR KOMPOZİSYON
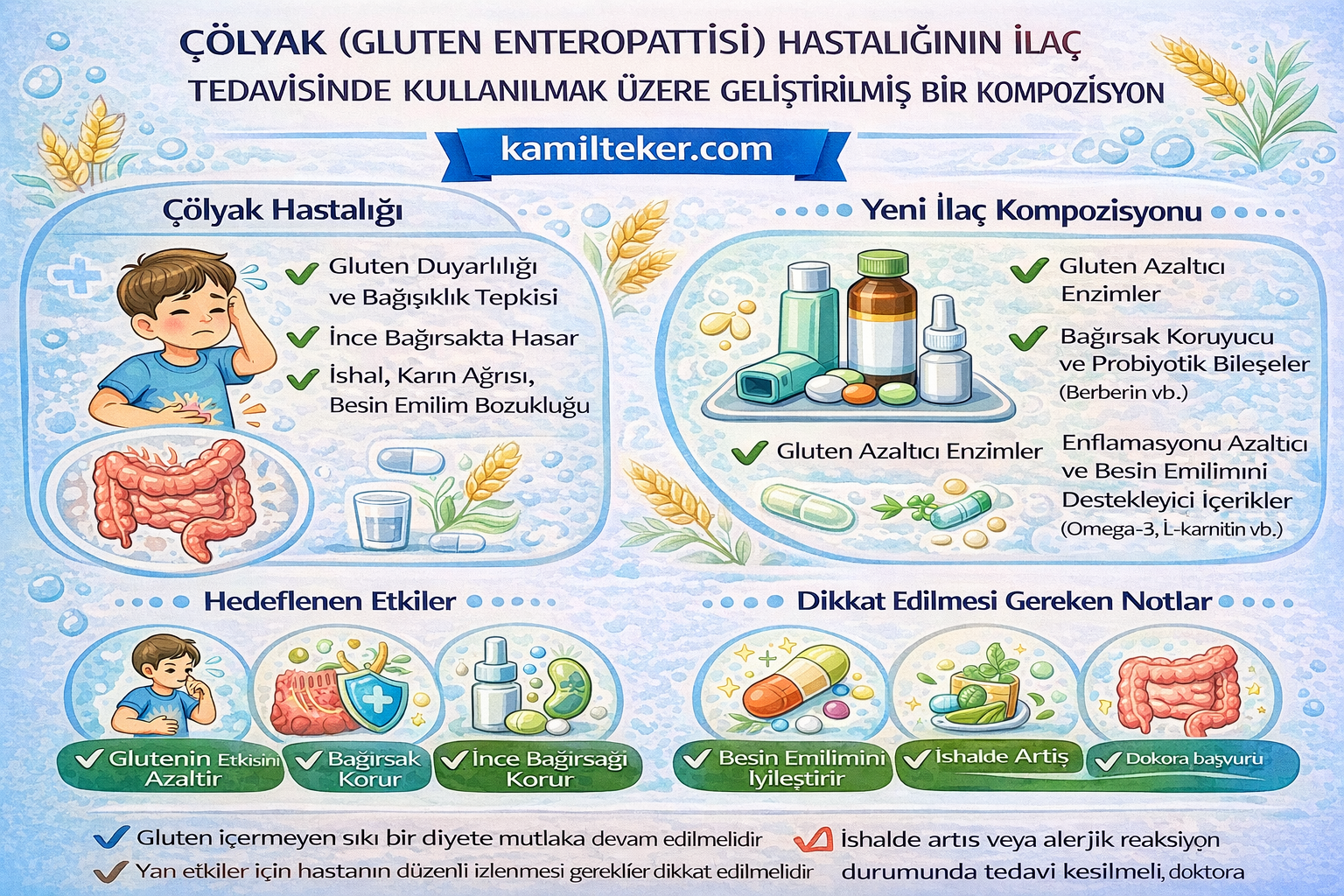
Buluş; Çölyak Hastalığı ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Caroverin (1) 2x1, Sulfosalazin (2) 2x1, Ergotamin (3) 1x1 ve İndomethasin (4) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Çölyak hastalığı, genetik yatkınlığı olan bireylerde gluten adlı proteine karşı gelişen otoimmün bir ince bağırsak hastalığıdır. Buğday, arpa ve çavdar gibi tahıllarda bulunan gluten, bağışıklık sistemini uyararak ince bağırsak mukozasında iltihaplanma, villus atrofisi ve emilim bozukluğuna yol açar.
Hastalık; kronik ishal, karın şişkinliği, kilo kaybı gibi klasik bulguların yanı sıra, demir eksikliği anemisi, kemik erimesi, dermatit herpetiformis ve infertilite gibi bağırsak dışı belirtilerle de kendini gösterebilir.
Tanı, anti-tTG ve anti-endomisyum antikorları gibi serolojik testlerle ve ince bağırsak biyopsisiyle konur. Tedavinin temelini ömür boyu glutensiz diyet oluşturur. Bu sayede bağırsak mukozası yenilenir, emilim düzelir ve semptomlar geriler.
Çölyak hastalığı, yalnızca bir gıda intoleransı değil; bağışıklık sistemi, genetik faktörler ve çevresel etmenlerin etkileşimiyle gelişen kronik bir otoimmün hastalıktır ve erken tanı ile yönetimi, uzun vadeli komplikasyonların önlenmesi açısından kritik öneme sahiptir.
Gluten Enteropatisinde medikal tedavisinde kullanılacak ilaçlar ve dozları
1) Coroverin / Caroverin: 2x1
2) Sulfosalazin: 2x1
3) Ergotamin: 1x1
4) İndomethasin: 2x1
Gluten enteropatisi medikal tedavi protokolü:
1) Tüm ilaçlar beraber kullanılacak
2) Çölyak hastalığının şiddetine göre medikal tedavi süresi 1 – 3 ay yeterli olur.
3) Gerekirse iyileşene kadar tedavi verilebilir
4) Doktor Teker Ballı Tereyağlı macun mutlaka kullanılmalı: Sabah ve akşam yemekten 10 – 15 dakika önce, bir yemek kaşığı 5) Tedavi başarı beklentisi % 80 – 90 kalıcı iyileşme.
6) Hastalık nüks ederse tedavi aynen tekrarlanabilir.
Gluten enteropatisi medikal tedaviye destek tedavi özellikleri:
1) Diyet desteği verilmeli
2) Ozon tedavi geçersiz
3) Bitkisel karışım tedavisi yok
4) Manuel terapi iyi olur, 10 – 12 seans.
5) Postural düzenleme iyi olur
6) İlaç tedavi bittikten sonra omurgada kireçlenme varsa proloterapi ve mezoterapi verilebilir.
7) Mikrosirkülasyon destek olabilir
8) Akupunktur geçersiz
9) Biyorezonans destek olabilir
10) Sülük terapi geçerli değil
11) Kupa – Hacamat geçerli değil
12) Hipnoz terapi geçerli değil
Gluten Enteropatisi (Çölyak Hastalığı) Medikal Tedavi Protokolünün Teorik Bilimsel Analizi
Gluten enteropatisi; gluten peptitlerinin doku transglutaminaz (tTG) aracılığıyla deamidasyonu sonrasında HLA-DQ2/DQ8 üzerinden sunulması, Th1 ağırlıklı yanıt ve IFN-γ/IL-15 gibi mediatörlerle villöz epitelde hasarın derinleşmesi, zonulin artışıyla bağırsak bariyerinin geçirgenliğinin bozulması ve sonuçta malabsorpsiyonla seyreden kronik bir otoimmün süreçtir. Tedavinin temeli, ömür boyu glutensiz diyettir; bununla birlikte diyete rağmen süren mukozal inflamasyon, visseral ağrı/hassasiyet ve mikrosirkülatuvar yetersizliklerde farmakolojik destek, epitel bütünlüğünün yeniden tesisi için teorik bir köprü oluşturabilir. Caroverin (2×1), Sulfosalazin (2×1), Ergotamin (1×1) ve İndometazin’in (2×1) eşzamanlı uygulanmasını öngören bu model; immüninflamatuvar eksen, nörojenik ağrı–motilite ekseni ve mikrosirkülasyon–metabolik ekseni aynı anda hedefleyerek patolojik döngüyü kırmayı amaçlayan, mekanistik olarak tutarlı bir çerçeve sunar.
Caroverin, glutamaterjik aşırı uyarılabilirliği ve enterik sinir sistemi tabanlı nöroinflamasyonu baskılayan nöromodülatör/spazmolitik etkisiyle visseral ağrıyı ve irritabl motilite paternlerini yumuşatır; kapiller mikrosirkülasyonu destekleyerek hipoksik stresin azalmasına ve villöz rejenerasyon için daha elverişli bir doku mikroçevresinin oluşmasına katkı verir. Sulfosalazin, NF-κB ve COX yolaklarının inhibisyonu üzerinden TNF-α/IL-1β/IL-6 gibi sitokinlerin üretimini azaltır, T-hücre aktivasyonunu sınırlayarak mukozal ödemi ve kript infiltrasyonunu geriletir, epitel bariyer bütünleşmesini ve sıkı bağlantı (tight junction) proteinlerinin korunmasını dolaylı biçimde destekler. Ergotamin, düşük doz ve dikkatli titrasyonla bağırsak damar tonusunu düzenleyip endotel fonksiyonunu stabilize ederek perfüzyonun daha homojen dağılmasına yardımcı olur; bu, inflamasyonla ilişkili mikrosirkülatuvar dengesizliği telafi eder ve oksijen-besin taşınmasını iyileştirir. İndometazin güçlü antiinflamatuvar etkisiyle prostaglandin sentezini baskılar, böylece mukozal ödem ve hücresel infiltrasyonu azaltır; NF-κB aktivasyonu dolaylı frenlenir ve doku hasarı kaskadı yavaşlar. Tümünün aynı anda kullanımı, “inflamasyon–iskemi–nörojenik stres” üçgenini çok eksenli biçimde hedefleyerek elektriksel-biyokimyasal açıdan “sessiz” bir iyileşme penceresi açmayı amaçlar: inflamatuvar yük azalır, perfüzyon artar, nörojenik tetiklenme yatışır; sonuçta villöz mimarinin onarımı ve emilim kapasitesinin toparlanması için biyolojik zemin güçlenir.
Bu yaklaşımın teorik üstünlüğü, tek bir hedefe yoğunlaşmanın sınırlılıklarını aşmasıdır: immün baskılama tek başına mikroperfüzyon dengesizliğini düzeltmez; mikrosirkülasyon desteği tek başına nörojenik hassasiyeti yatıştırmaz;
nöromodülasyon tek başına sitokin fırtınasını söndüremez. Kombinasyon, her bir ilacın zayıf kaldığı halkayı bir diğerinin tamamlamasıyla sinerji üretir. Yine de farmakodinamik örtüşmeler kadar güvenlik alanlarının da titizlikle yönetilmesi gerekir. İndometazin, mukozal koruyucu prostaglandinleri de baskılayabileceğinden gastroprotektif önlemler ve kısa-orta süreli kullanım tercih edilmelidir; böbrek fonksiyonu, kan basıncı ve gastrointestinal tolerans yakından izlenmelidir. Sulfosalazin, folat metabolizmasını etkileyebilir ve nadiren hepatotoksisite/kemik iliği baskılanması yapabilir; başlangıç ve aralıklı tam kan sayımı, ALT/AST izlemi ve folat desteğinin düşünülmesi rasyoneldir. Ergotamin, CYP3A4 ile etkileşir ve aşırı
vazokonstriksiyon/iskemi riski taşır; eşzamanlı makrolid/azol/HPV proteaz inhibitörü gibi güçlü inhibitörlerden kaçınmak, periferik vasküler hastalık, hipertansiyon ve gebelikte kontrendikasyonları gözetmek zorunludur. Caroverin genel olarak iyi tolere edilmekle birlikte sedasyon, baş dönmesi ve nadiren hipotansiyon yapabilir; gün içi fonksiyon ve hemodinamik yanıt izlenmelidir.
Klinik uygulamada bu çerçevenin güvenliğe dayalı, biyobelirteç güdümlü bir algoritmayla yürütülmesi uygun olur: başlangıçta komple biyokimya (ALT/AST, kreatinin/eGFR, elektrolitler), tam kan sayımı, inflamasyon belirteçleri, demir-B12folat-D vitamini depoları; 8–12 haftada serolojik yanıt (anti-tTG/EMA; IgA eksikliği varsa DGP-IgG), semptom skoru ve kilo/antropometri; 6–12 ayda gerekirse histolojik yanıt (Marsh sınıflaması) değerlendirilir. Tedavinin tüm fazlarında glutensiz diyetin kusursuz sürdürülmesi esastır; farmakoterapi, diyet uyumunun yerini tutmaz, onu tamamlar. Diyare/karın ağrısı gibi semptomlardaki erken iyileşme haftalar içinde görülebilecekken, serolojik normalleşme aylar, histolojik iyileşme ise genellikle daha uzun bir zaman alır; bu nedenle “kontrendikasyon geliştirmeden sürdürülebilirlik” ve “kademeli iyileşme” beklentileri gerçekçi biçimde yönetilmelidir.
Özetle bu kombinasyon, çölyakta kronik inflammatuvar yükü azaltıp mikrosirkülasyonu ve nörojenik dengeyi aynı anda modüle ederek villöz iyileşme olasılığını teorik olarak artıran ileri görüşlü bir modeldir. Klinik geçerliliği, dikkatli hasta seçimi, titiz etkileşim/yan etki izlemi ve objektif biyobelirteçlerle desteklendiğinde güç kazanacaktır. Bu yaklaşımı biyobelirteç-odaklı (örn. seroloji + fekal markörler + mikrosirkülatuvar ultrason/elastografi) ve gerektiğinde döngüsel/ayarlanabilir protokollerle birleştirmek, hem etkinliği maksimize etmeye hem de güvenliği yüksek tutmaya yardımcı olacaktır.
İndometazin, Caroverin, Sulfosalazin ve Ergotamin’in Çölyak Hastalığı
Patogenezine Yönelik Olası Mekanistik Etkileri
Giriş
Çölyak hastalığı, genetik yatkınlık zemininde gluten alımına bağlı olarak gelişen, hem adaptif hem de innate immün yanıtın eş zamanlı aktivasyonu ile seyreden kronik otoimmün bir enteropatidir (1,2). Hastalığın temelinde, buğday, arpa ve çavdar gibi tahıllarda bulunan gliadin peptitlerinin ince bağırsak mukozasında doku
transglutaminaz (TG2) enzimi tarafından deamidasyona uğratılması yer alır. Bu süreçte glutamin rezidülerinin glutamik asit formuna dönüşmesi, peptitlerin HLA-DQ2 veya HLA-DQ8 moleküllerine daha yüksek afiniteli şekilde bağlanmasına yol açar. Bunun sonucunda antijen sunan hücreler (APC) aracılığıyla CD4⁺ T hücreleri aktive olur ve IFN-γ, IL-2, TNF-α gibi proinflamatuvar sitokinlerin salınımı artar (1,2).
Aktive olan T hücreleri, B hücrelerini uyararak anti-TG2 ve anti-endomisyal antikorların oluşumuna katkı sağlar. Aynı zamanda epitel hücreleri ve dendritik hücreler tarafından üretilen IL-15, intraepitelyal lenfositlerin (IEL) sitotoksik aktivitesini artırır. Bu mekanizma, NKG2D reseptörü üzerinden enterosit yıkımını hızlandırarak villöz atrofi ve kript hiperplazisine neden olur (2). Bunun yanı sıra p31-43 alfa-gliadin peptidi, HLA’ya bağlı olmayan bir yolak üzerinden epitel hücrelerinde stres yanıtı, endoplazmik retikulum disfonksiyonu ve IL-15 üretimi başlatır; bu durum innate bağışıklık aktivasyonunu tetikleyerek mukozal hasarı ağırlaştırır (2).
Hastalığın klinik seyrinde, zonulin aracılı sıkı bağlantı (tight junction) bozulması sonucu bağırsak geçirgenliğinde artış oluşur; bu, gluten peptitlerinin lamina propria’ya geçişini kolaylaştırarak immün sistemin daha fazla antijenle karşılaşmasına yol açar (2). Ayrıca, disbiyoz (mikrobiyota dengesizliği) ve viral enfeksiyonlar (ör. reovirüs, rotavirüs) epitel bariyer bütünlüğünü bozarak çölyak gelişimine katkıda bulunabilir (2).
Günümüzde çölyak hastalığı için tek etkin tedavi glutensiz diyettir. Ancak diyet tedavisine rağmen serolojik aktivitenin devam ettiği, mukozal iyileşmenin tam olmadığı ve klinik semptomların sürdüğü olguların varlığı, farmakolojik müdahalelere olan ihtiyacı artırmıştır (1,2). Bu nedenle, TG2 inhibitörleri, zonulin antagonistleri, immün modülatörler ve antioksidan ajanlar gibi çeşitli moleküller üzerinde yoğun araştırmalar yapılmaktadır. Bu bağlamda, mevcut çalışma Caroverin, Sulfosalazin, Ergotamin ve İndometazin gibi ajanların çölyak patogenezine yönelik moleküler düzeydeki olası etkilerini değerlendirmeyi hedeflemektedir.
Genel Değerlendirme
Önerilen ilaç kombinasyonu, çölyak hastalığının multifaktöryel patogenezine çok yönlü müdahale potansiyeli taşıyan bir yaklaşım sunmaktadır. Hastalığın hem inflamatuvar, hem immünolojik, hem de bariyer fonksiyonlarına yönelik karmaşık mekanizmalarını hedefleyen bir tedavi modeli, teorik olarak monoterapiye göre daha geniş kapsamlı bir etkinlik sağlayabilir (3).
Sulfosalazin, klinik olarak inflamatuvar bağırsak hastalıklarında yaygın kullanılan, NF-κB sinyal yolunu inhibe eden ve proinflamatuvar sitokin üretimini azaltan bir ajan olarak, çölyak patogenezindeki sitokin fırtınasının baskılanmasında önemli bir rol üstlenebilir (3,4). Bu etki, IL-15, TNF-α ve IFN-γ düzeylerini azaltarak IEL aktivasyonunu sınırlayabilir ve mukozal inflamasyonu hafifletebilir. Aynı zamanda antioksidan özellikleri, epitel stres yanıtını dengeleyebilir (3).
İndometazin, güçlü bir COX-1/2 inhibitörü olarak prostaglandin E₂ (PGE₂) sentezini azaltır. PGE₂’nin hem T hücre aktivasyonu hem de epitel geçirgenliği üzerindeki artırıcı etkilerinin baskılanması, adaptif immün yanıtın ve zonulin aracılı bariyer bozukluğunun sınırlanmasına katkı sağlar (4,5). Ek olarak, İndometazin’in PPARγ aktivasyonu üzerinden antiinflamatuvar gen ekspresyonunu desteklemesi, immün regülasyona ek bir koruyucu mekanizma sunabilir (5).
Caroverin, preklinik çalışmalarda NMDA reseptör antagonizması ve Ca²⁺ kanal blokajı yoluyla kalsiyum bağımlı sinyalleşmeyi baskılayan bir ajan olarak tanımlanmıştır (6). Çölyakta Ca²⁺ akışına bağlı olarak artan TG2 aktivitesi ve IEL sitotoksisitesi, Caroverin tarafından dolaylı biçimde sınırlandırılabilir. Ayrıca oksidatif stresin mukozal hasardaki rolü göz önüne alındığında, Caroverin’in redoks dengeleyici etkisi epitel hücre bütünlüğünün korunmasına katkı sağlayabilir (6).
Ergotamin, doğrudan immün modülatör etkilere sahip olmamakla birlikte, serotonin reseptörleri ve vasküler tonus üzerindeki etkileriyle mukozal dolaşımı düzenleyebilir. Akut dönemde ödemi azaltarak inflamatuvar hücre infiltrasyonunu sınırlandırması olasıdır (7). Ancak uzun süreli kullanımda vazokonstriktör etkisi, iskemi ve mukozal bütünlük kaybı riskini artırabilir; bu nedenle dikkatli dozaj ve süre kontrolü gerektirir (7).
Genel olarak değerlendirildiğinde, bu dört ajanın kombinasyonu, çölyak patogenezindeki temel eksenlere —gluten sunumu ve T hücre aktivasyonu, TG2 aracılı deamidasyon, IL-15 kaynaklı IEL aktivasyonu, bariyer geçirgenliği bozukluğu ve oksidatif stres— aynı anda etki edebilme potansiyeline sahiptir. Bu yaklaşım, tek mekanizmaya yönelik tedavilerin sınırlı etkilerini aşmayı ve sinerjik etki yaratmayı hedeflemektedir. Bununla birlikte, teorik olarak güçlü olan bu çoklu mekanizma modeli, klinik düzeyde henüz randomize kontrollü çalışmalarla desteklenmemiştir (3– 6). Dolayısıyla, translasyonel geçerliliğinin doğrulanması için ileri faz klinik araştırmalara ihtiyaç vardır.
1. HLA-DQ2/DQ8 ile Gluten Sunumu ve T Hücre Aktivasyonu
Çölyak hastalığının en erken ve temel patogenez basamaklarından biri, glutenin α-gliadin fraksiyonlarının bağırsak mukozasında doku transglutaminaz (TG2) enzimi aracılığıyla deamidasyona uğratılmasıdır. Bu işlem sonucunda gliadin peptitleri üzerindeki glutamin rezidüleri, glutamik asit formuna dönüşür ve bu peptitler HLADQ2 veya HLA-DQ8 moleküllerine yüksek afiniteli biçimde bağlanarak antijen sunan hücreler (dendritik hücreler, makrofajlar) aracılığıyla CD4⁺ T hücrelerine sunulur (2,4). Bu sunum, lamina propria düzeyinde güçlü bir adaptif immün yanıtın başlamasına neden olur.
Aktive olan CD4⁺ T hücreleri, başta IFN-γ, IL-2 ve TNF-α olmak üzere çok sayıda proinflamatuvar sitokinin üretimini artırır. Bu durum, sitokin fırtınası şeklinde adlandırılan bir yanıt oluşturur ve epitel hasarının en önemli tetikleyicilerinden biri haline gelir (2,4). Aynı zamanda bu sitokinler B hücrelerini uyararak anti-TG2 ve antiendomisyal antikor üretimini destekler. Bu immün aktivasyonun sürdürülmesinde Ca²⁺ bağımlı sinyalleşme, NF-κB aktivasyonu ve prostaglandin sentezi gibi çok sayıda moleküler mekanizma rol oynamaktadır. Bu nedenle bu sinyalleri hedefleyen ilaçlar, çölyak patogenezine teorik düzeyde müdahale etme potansiyeli taşır.
Caroverin
Caroverin, hem NMDA reseptör antagonisti hem de voltaj bağımlı Ca²⁺ kanal blokeri olarak görev yapar (6). T hücre aktivasyonunda kalsiyum iyonları, kalsinörin/NFAT sinyal yolunun aktivasyonu için zorunludur. Bu yolak, IL-2 gen ekspresyonunu uyararak T hücre proliferasyonunu ve efektör fonksiyonlarını başlatır. Caroverin’in Ca²⁺ girişini baskılaması, NFAT aktivasyonunu sınırlandırarak IL-2 üretimini ve T hücre proliferasyonunu dolaylı biçimde azaltabilir (6). Ayrıca NMDA reseptörleri yalnızca sinir sisteminde değil, immün hücrelerde de eksprese edilmektedir ve bu reseptörlerin aşırı aktivasyonu oksidatif stres ile sonuçlanabilir. Caroverin’in NMDA blokajı yoluyla ROS üretimini azaltması, immün mikroçevredeki oksidatif yükü hafifletebilir ve T hücre aktivasyonunun sürdürülebilirliğini sınırlayabilir (6). Bu etkiler, gluten sunumu sonrası gelişen immün yanıtın şiddetini azaltma yönünde teorik bir katkı sağlar.
Sulfosalazin
Sulfosalazin, özellikle NF-κB sinyal yolunu güçlü şekilde baskılayan bir antiinflamatuvar ajan olup, T hücre aktivasyonu sonrası oluşan proinflamatuvar sitokin üretimini sınırlar (3). NF-κB’nin baskılanması, IL-2, TNF-α ve IFN-γ gibi anahtar sitokinlerin transkripsiyonunu azaltır. Bu durum, hem T hücre proliferasyonunu hem de effektör yanıtın sürdürülmesini engeller. Ayrıca Sulfosalazin, redoks dengesini koruyarak oksidatif stresin T hücre aktivasyonuna katkısını azaltabilir (3). Böylece gluten sunumuyla başlayan immün yanıtın hem başlangıç hem de idame fazında baskılayıcı etki gösterebilir.
Ek olarak, lamina propria düzeyinde makrofaj ve dendritik hücreler üzerinden gerçekleşen antijen sunumuna yanıt olarak ortaya çıkan NF-κB aracılı inflamatuvar sinyallerin azaltılması, mukozal inflamasyonun ilerlemesini sınırlayabilir. Bu özellikleriyle Sulfosalazin, çölyak hastalığında T hücre aracılı mukozal hasarın baskılanmasında güçlü bir teorik aday olarak öne çıkar (3).
İndometazin
İndometazin, güçlü bir COX-1/COX-2 inhibitörüdür ve bu yolla prostaglandin E₂ (PGE₂) düzeylerini azaltır (4). PGE₂, immün hücreler üzerinde T hücre proliferasyonunu artırıcı, IL-2 ve IL-4 üretimini kolaylaştırıcı etkiler gösterir. Dolayısıyla PGE₂ düzeylerinin düşürülmesi, gluten sunumu sonrası gelişen T hücre aktivasyonunun baskılanmasına katkı sağlar (4).
Ayrıca İndometazin’in PPARγ aktivasyonunu artırıcı etkisi, antiinflamatuvar genlerin ekspresyonunu uyararak NF-κB ve AP-1 gibi proinflamatuvar transkripsiyon faktörlerini baskılar. Bu mekanizma, T hücre polarizasyonunun proinflamatuvar Th1 yönünde ilerlemesini sınırlayabilir (5). Böylece İndometazin, çölyak patogenezinde gluten sunumunu izleyen T hücre yanıtının hem başlangıç hem sürdürülme aşamalarında modülatör bir rol üstlenebilir.
Ergotamin
Ergotamin, doğrudan immün yanıtı baskılayan bir ajan değildir, ancak serotonin reseptörleri (5-HT1B/1D) üzerindeki agonistik etkileri ve vazokonstriktör özellikleri nedeniyle mukozal kan akımını düzenleyebilir (7). Akut dönemde vasküler permeabiliteyi azaltarak, inflamatuvar hücrelerin lamina propria’ya göçünü sınırlayabilir. Bu mekanizma, gluten sunumunu izleyen immün hücre birikimini dolaylı biçimde azaltarak lokal inflamasyonun şiddetini düşürebilir (7). Ancak uzun süreli veya yüksek doz kullanımda vazokonstriksiyon, mukozal iskemi riskini artırabileceğinden dikkatli değerlendirilmelidir.
Ergotamin’in dolaylı etkileri, çölyak hastalığının erken fazında inflamatuvar hücre infiltrasyonunun kontrolüne katkı sağlayabilecek teorik bir fayda sunmakla birlikte, T hücre aktivasyonu üzerinde doğrudan bir baskı mekanizması mevcut değildir (7).
Sonuç
Bu basamakta değerlendirilen ajanlardan Sulfosalazin ve İndometazin, T hücre aktivasyonunu doğrudan etkileyen güçlü moleküler mekanizmalara sahiptir. Caroverin kalsiyum sinyalini ve oksidatif stresi baskılayarak destekleyici bir rol üstlenebilirken, Ergotamin daha çok vasküler mikroçevreyi düzenleyerek inflamatuvar hücre göçünü sınırlayan dolaylı bir etki sağlar. Bu nedenle kombinasyonel kullanım, T hücre aracılı immün yanıtın çoklu eksenlerden modülasyonu açısından teorik olarak güçlü bir sinerji potansiyeli taşımaktadır.
2. TG2 Aracılı Gliadin Deamidasyonu
Çölyak hastalığının patogenezinde doku transglutaminaz (TG2) enzimi, immün sistemin gluten peptitlerini tanımasında kilit bir rol oynar. TG2, gliadin peptitleri üzerinde bulunan glutamin rezidülerini glutamik aside dönüştürerek deamidasyon işlemini gerçekleştirir. Bu kimyasal dönüşüm, gliadin peptitlerinin negatif yük kazanmasına ve böylece HLA-DQ2/DQ8 moleküllerine çok daha yüksek afiniteli biçimde bağlanmalarına yol açar (1,2). Sonuç olarak, antijen sunan hücreler (APC) tarafından CD4⁺ T hücrelerine sunulan bu peptitler, immünojenik potansiyeli yüksek kompleksler oluşturur ve güçlü bir adaptif immün yanıt başlatır (1,2).
TG2’nin ekspresyonu ve aktivitesi, yalnızca genetik yatkınlıkla değil, aynı zamanda inflamatuvar sitokinler (IL-15, TNF-α, IFN-γ), oksidatif stres, Ca²⁺ sinyalleşmesi ve redoks durumu gibi çevresel ve hücresel faktörlerle de düzenlenmektedir. Bu nedenle TG2, çölyak mukozasında sürekli uyarılmış bir enzim haline gelir ve hem gluten deamidasyonu hem de otoantijen oluşumu süreçlerinde merkezi bir konum kazanır. Aşağıda, bu patogenetik basamakta değerlendirilen ajanların teorik etkileri açıklanmaktadır:
Caroverin
Caroverin, hem antioksidan özellikleri hem de Ca²⁺ kanal blokajı ile TG2 aktivitesinin temel belirleyicileri olan oksidatif stres ve kalsiyum sinyalleşmesi üzerinde düzenleyici rol oynayabilir (6). TG2 enzimi, kalsiyuma bağımlı bir enzimdir ve hücre içi Ca²⁺ konsantrasyonunun artışı, TG2’nin aktif konformasyon kazanmasına neden olur. Caroverin’in voltaj bağımlı Ca²⁺ kanallarını bloke etmesi, hücre içi Ca²⁺ düzeylerini azaltarak TG2’nin enzimatik aktivasyonunu sınırlayabilir (6).
Buna ek olarak, reaktif oksijen türleri (ROS) TG2 ekspresyonunu artıran önemli uyarıcılardan biridir. Mukozal inflamasyon sırasında artan ROS üretimi, TG2 transkripsiyonunu uyarır ve gluten peptitlerinin daha fazla deamidasyona uğramasına yol açar. Caroverin’in antioksidan kapasitesi, bu redoks duyarlı ekspresyon mekanizmasını baskılayarak TG2’nin aşırı üretimini sınırlayabilir (6). Böylece Caroverin, hem enzim aktivitesini hem de ekspresyon düzeyini dolaylı biçimde düşürerek glutenin immünojenitesini azaltma potansiyeline sahiptir.
Sulfosalazin
Sulfosalazin, NF-κB ve p38 MAPK gibi inflamatuvar sinyal yollarını baskılayan güçlü bir antiinflamatuvar ajandır (3). Çölyak mukozasında artan IL-15 ve TNF-α düzeyleri, TG2’nin gen ekspresyonunu artıran önemli sitokinlerdir. Sulfosalazin’in bu sitokinleri baskılaması, TG2 gen transkripsiyonunun azalmasına ve dolayısıyla gliadin deamidasyonu sürecinin zayıflamasına yol açabilir (3).
Ayrıca NF-κB’nin aktif olduğu ortamlarda TG2 promotor bölgesinin transkripsiyonel olarak uyarıldığı bilinmektedir. Sulfosalazin, NF-κB’nin çekirdeğe translokasyonunu engelleyerek bu süreci durdurabilir (3). Bu mekanizma sayesinde TG2’nin transkripsiyonel aktivasyonu azalır ve mukozal düzeyde enzim ekspresyonu düşer.
Ek olarak Sulfosalazin, antioksidan özellikleri ile oksidatif stres kaynaklı TG2 indüksiyonunu da baskılayabilir. Bu yönüyle hem sitokin aracılı hem de redoks aracılı TG2 artışını hedefleyen çift yönlü bir mekanizma sunar.
İndometazin
İndometazin, COX-1 ve COX-2 enzimlerini inhibe ederek prostaglandin E₂ (PGE₂) düzeylerini azaltır (4). PGE₂, proinflamatuvar mikroçevre oluşumunda önemli rol oynar; bu mikroçevre ise TG2 ekspresyonunu indükleyici sinyallerin (IL-15, TNF-α, IFN-
γ) artmasına neden olur. Dolayısıyla İndometazin, inflamatuvar sitokinlerin üretimini dolaylı olarak baskılayarak TG2 ekspresyonunu sekonder olarak azaltabilir (4).
Ek olarak, İndometazin’in PPARγ aktivasyonunu artırıcı etkileri, antiinflamatuvar gen ekspresyonunu uyarırken, TG2 transkripsiyonuna katkı sağlayan NF-κB ve AP-1 gibi faktörlerin aktivitesini sınırlar (5). Bu durum, TG2’nin hem ekspresyon hem de aktivite düzeyinin baskılanmasına katkıda bulunur.
Ayrıca, PGE₂’nin Ca²⁺ akışını artırıcı etkileri göz önüne alındığında, İndometazin’in prostaglandin sentezini sınırlaması, Ca²⁺ aracılı TG2 aktivasyonu üzerinde de dolaylı bir frenleme etkisi yaratabilir (4).
Ergotamin
Ergotamin, çölyak patogenezinde TG2 enzimi üzerinde doğrudan etkili bir molekül değildir (7). Bu ilaç, esas olarak 5-HT₁B/1D reseptörleri üzerinden vazokonstriktör etki gösterir ve mukozal kan akımını düzenler. Her ne kadar akut dönemde ödemi azaltarak mukozal stresin hafiflemesine katkı sağlayabileceği düşünülse de, TG2 ekspresyonu veya gliadin deamidasyonu süreçlerinde doğrudan bir rolü bulunmamaktadır (7). Hatta uzun süreli kullanımda iskemiye bağlı mukozal stres oluşması durumunda TG2 ekspresyonunun ikincil olarak artabileceği de göz ardı edilmemelidir. Bu nedenle Ergotamin, bu basamakta sınırlı veya dolaylı bir etki potansiyeline sahiptir.
Sonuç
TG2 aracılı gliadin deamidasyonu, çölyak hastalığının en kritik immünolojik eşiğini temsil eder. Bu aşamada TG2’nin ekspresyonunu ve aktivitesini sınırlamak, glutenin immünojenitesini azaltarak adaptif yanıtın şiddetini düşürebilir. Bu bağlamda;
• Caroverin, Ca²⁺ akışını ve oksidatif stresi baskılayarak enzim aktivasyonunu azaltabilir;
• Sulfosalazin, sitokin ve NF-κB aracılı transkripsiyonel indüksiyonu sınırlar;
• İndometazin, inflamatuvar mikroçevreyi ve prostaglandin sinyallerini baskılayarak dolaylı inhibisyon sağlar;
• Ergotamin ise doğrudan etkili değildir, yalnızca vasküler düzenleme yoluyla ikincil fayda sunabilir.
Bu mekanizmalar, TG2 düzeylerini azaltarak gliadin peptitlerinin deamidasyonunu, dolayısıyla antijenik yükü düşürmeyi hedefleyen teorik bir tedavi yaklaşımını desteklemektedir (1–7).
3. Anti-TG2 Otoantikorları ve Enterosit Yıkımı
Çölyak hastalığının tanısal belirteçlerinden biri olan anti-doku transglutaminaz (anti-TG2) otoantikorları, yalnızca serolojik göstergeler değil, aynı zamanda patojenik sürecin aktif bileşenleridir. Bu otoantikorlar, epitel hücre yüzeyindeki TG2 ile kompleks oluşturarak hücresel işlevleri bozar, oksidatif stres, endoplazmik retikulum disfonksiyonu ve apoptoz süreçlerini tetikler (2). Bu mekanizma sonucunda enterosit hasarı, mikrovillus kaybı, villöz atrofi ve kript hiperplazisi gibi histopatolojik değişiklikler gelişir.
Ayrıca, anti-TG2 antikorları bazal membran komponentlerine ve ekstraselüler matriks proteinlerine bağlanarak doku bütünlüğünü zedeler. Bu antikorların üretiminde B hücre aktivasyonu, T hücre yardımı ve NF-κB aracılı transkripsiyon süreçleri temel rol oynar. Bu nedenle immün modülasyon, antioksidan koruma ve inflamatuvar mikroçevre düzenlemesi sağlayan ilaçlar, bu patogenez basamağında teorik olarak fayda gösterebilir.
Caroverin
Caroverin, reaktif oksijen türlerini (ROS) baskılayan güçlü bir antioksidan olarak, anti-TG2 antikorlarının yol açtığı oksidatif stres kaynaklı enterosit hasarını sınırlayabilir
(6). Anti-TG2 antikorları, enterosit yüzeyinde TG2 ile kompleks oluşturarak lipid peroksidasyonu, mitokondriyal disfonksiyon ve kaspaz aracılı apoptoz süreçlerini tetikler. Bu süreçlerde ROS artışı kritik bir aracı faktördür. Caroverin’in redoks dengeleyici etkisi, hücre zarında ve mitokondride oluşan oksidatif hasarı azaltarak antikor aracılı sitotoksisiteyi hafifletebilir (6).
Ayrıca Ca²⁺ sinyalizasyonu üzerinden hücresel stres yanıtlarını baskılayarak, anti-TG2 komplekslerinin tetiklediği intrinsik apoptoz yollarını modüle etme potansiyeline sahiptir. Bu yönüyle Caroverin, anti-TG2 antikorlarının epitelde oluşturduğu ikincil hasarı azaltıcı destekleyici bir ajan olarak değerlendirilebilir.
Sulfosalazin
Sulfosalazin, NF-κB yolunu inhibe ederek B hücre aktivasyonunu ve plazma hücrelerine farklılaşmayı sınırlayabilir (3). Çölyak patogenezinde B hücreleri, TG2 antijenine karşı otoantikor üretiminde merkezî bir rol oynar. Bu hücrelerin aktivasyonu, T hücre yardımı (CD40–CD40L etkileşimi) ve NF-κB aracılı sinyalizasyon ile gerçekleşir. Sulfosalazin, bu yolakları baskılayarak anti-TG2 antikor üretimini dolaylı olarak azaltabilir (3).
Ayrıca, TNF-α ve IL-6 gibi sitokinlerin üretimini azaltması, B hücre proliferasyonu ve immün kompleks oluşumunu sınırlandırır. Bu durum, mukozal yüzeyde antikor birikimi ve kompleman aktivasyonuna bağlı doku hasarının azalmasına katkı sağlar. Ek olarak, antioksidan etkisiyle B hücre mikroçevresindeki oksidatif aktiviteyi düzenleyerek, immün yanıtın şiddetini hafifletebilir (3).
İndometazin
İndometazin, COX-1/2 inhibisyonu yoluyla prostaglandin E₂ (PGE₂) sentezini azaltır (4). PGE₂, T ve B hücre aktivasyonunu destekleyen bir lipid mediatördür; bu nedenle PGE₂ düzeylerinin düşürülmesi, antijen sunumu ve antikor üretimi süreçlerini baskılayabilir. Böylece anti-TG2 antikor düzeylerinde dolaylı bir azalma sağlanabilir (4).
Ek olarak İndometazin, PPARγ aktivasyonunu artırarak antiinflamatuvar genlerin ekspresyonunu uyarır ve NF-κB aracılı transkripsiyonu baskılar (5). Bu mekanizma, hem proinflamatuvar sitokinlerin azalmasına hem de B hücre diferansiyasyonunun sınırlanmasına yol açar. Böylece İndometazin, otoantikor yanıtını hem inflamatuvar ortamı zayıflatarak hem de transkripsiyonel düzeyde baskılayarak iki yönlü bir etki gösterebilir.
Ayrıca, PGE₂ azalması ile birlikte vasküler geçirgenlikte azalma, antikorların mukozal tabakalara difüzyonunu da sınırlayabilir. Bu durum, epitel yüzeyinde daha az anti-TG2 kompleksi oluşmasına katkıda bulunur (4,5).
Ergotamin
Ergotamin, çölyak patogenezinde doğrudan otoantikor üretimini baskılayan bir ajan değildir; ancak vazokonstriktör etkisi yoluyla mukozal damar geçirgenliğini azaltabilir (7). Bu özellik, dolaşımdaki antikorların lamina propria’ya geçişini ve epitel yüzeyine difüzyonunu sınırlandırarak lokal antikor yükünü düşürebilir.
Akut dönemde, inflamatuvar ödemin azaltılması yoluyla antikor difüzyonuna bağlı doku hasarının hafiflemesi mümkündür. Ancak kronik veya yüksek doz kullanımlarda ortaya çıkabilecek iskemik etkiler, mukozal bariyer bütünlüğünü bozarak tam tersi bir sonuç yaratabilir (7). Bu nedenle, Ergotamin’in bu basamaktaki etkisi dolaylı, kısa süreli ve sınırlı düzeyde değerlendirilmelidir.
Sonuç
Bu patogenez basamağında, anti-TG2 otoantikorlarının oluşturduğu epitel hasarını azaltmak ve otoantikor üretimini baskılamak, çölyak hastalığında mukozal bütünlüğün korunması açısından kritik önemdedir.
• Caroverin, oksidatif stresin azaltılması yoluyla antikor aracılı hücresel hasarı sınırlandırabilir.
• Sulfosalazin, NF-κB inhibisyonu yoluyla B hücre aktivasyonunu baskılayarak otoantikor üretimini azaltabilir.
• İndometazin, COX inhibisyonu ve PPARγ aktivasyonu ile otoimmün yanıtı iki yönlü modüle eder.
• Ergotamin ise mukozal damar geçirgenliğini azaltarak antikor difüzyonunu dolaylı şekilde sınırlayabilir.
Bu ajanların kombine kullanımı, antikor üretimi ve etkilerini çoklu mekanizmalar üzerinden baskılayan sinerjik bir yaklaşım oluşturabilir (2–7).
4. IL-15 Aracılı IEL Aktivasyonu
Çölyak hastalığında mukozal hasarın en güçlü belirleyicilerinden biri, intraepitelyal lenfositlerin (IEL) IL-15 aracılığıyla aktive olmasıdır. IL-15, başta enterositler ve dendritik hücreler olmak üzere birçok mukozal hücre tipi tarafından üretilen, innate benzeri sitotoksik yanıtları güçlendiren bir sitokindir (2). Çölyak mukozasında IL-15 aşırı ekspresyonu, CD8⁺ IEL’lerin proliferasyonunu, NKG2D reseptörlerinin aşırı ekspresyonunu ve MICA gibi stres ilişkili moleküllere karşı sitotoksik yanıtı tetikler. Bu süreç sonucunda, IEL’ler perforin ve granzim gibi mediyatörler salgılayarak enterosit apoptozuna neden olur; böylece villöz atrofi ve kript hiperplazisi gelişir (2).
Ayrıca IL-15, TGF-β aracılı immün regülasyonu baskılayarak Treg hücrelerinin baskılayıcı fonksiyonlarını zayıflatır. Bu durum, mukozal ortamda sürekli inflamatuvar sinyalleşme ve otoimmün aktivitenin sürdürülmesine neden olur. Bu nedenle IL-15, çölyak hastalığının hem tetikleyici hem de sürdürücü moleküler faktörlerinden biri olarak kabul edilir. Bu basamakta değerlendirilen ilaçlar, IL-15’in üretim, ekspresyon veya etkilerini farklı düzeylerde modüle etme potansiyeline sahiptir.
Caroverin
Caroverin, Ca²⁺ kanal blokajı ve NMDA reseptör antagonizması sayesinde kalsiyum bağımlı sinyal yollarını baskılayan bir ajan olarak, IEL aktivasyonunda rol oynayan Ca²⁺ sinyalleşmesini azaltabilir (6). IEL’lerin sitotoksik fonksiyonu, perforin ve granzim salınımı gibi kalsiyum bağımlı süreçlere dayanır. Bu nedenle Ca²⁺ akışının sınırlandırılması, IEL’lerin efektör fonksiyonlarını zayıflatabilir ve enterosit yıkımını azaltabilir (6).
Ek olarak, Caroverin’in oksidatif stres baskılayıcı etkileri, IL-15 üretimini uyarıcı çevresel sinyalleri azaltabilir. ROS, NF-κB aktivasyonunu güçlendirerek IL-15 transkripsiyonunu artırabilir; bu nedenle redoks dengesinin korunması IL-15 düzeylerinde dolaylı bir düşüş sağlayabilir. Sonuç olarak Caroverin, IEL sitotoksisitesini Ca²⁺ sinyali üzerinden doğrudan, IL-15 ekspresyonunu ise oksidatif stres regülasyonu üzerinden dolaylı olarak sınırlayabilir.
Sulfosalazin
Sulfosalazin, NF-κB sinyal yolunu baskılayarak IL-15 üretimini dolaylı biçimde azaltabilir (3). Çölyak mukozasında NF-κB aktivasyonu, enterositlerde IL-15 geninin transkripsiyonel olarak uyarılmasına neden olur. Sulfosalazin, NF-κB’nin çekirdeğe translokasyonunu engelleyerek IL-15 promotor bölgesinin aktivasyonunu sınırlar (3). Böylece epitel ve dendritik hücre kaynaklı IL-15 sekresyonu azalır, IEL proliferasyonu ve aktivasyonu zayıflar.
Ayrıca proinflamatuvar sitokinlerin (örneğin TNF-α ve IL-6) üretiminin baskılanması, IL-15’in feedback uyarım döngüsünü kırarak inflamatuvar ortamın sürekliliğini engeller. Bu mekanizma, mukozal hasarın ilerlemesini durdurmak için kritik önemdedir. Sulfosalazin’in antioksidan kapasitesi de redoks duyarlı IL-15 ekspresyonunu baskılayıcı ek katkı sağlayabilir (3).
İndometazin
İndometazin, COX-1/COX-2 inhibisyonu yoluyla prostaglandin E₂ (PGE₂) sentezini azaltır (4). PGE₂, epitel hücrelerinde ve immün hücrelerde IL-15 üretimini artıran bir mediatördür. Dolayısıyla İndometazin’in PGE₂ düzeylerini düşürmesi, IL-15 ekspresyonunu dolaylı olarak sınırlar (4).
Bunun yanında İndometazin, PPARγ aktivasyonunu artırarak antiinflamatuvar gen ekspresyonunu uyarır ve NF-κB gibi proinflamatuvar transkripsiyon faktörlerinin baskılanmasını sağlar (5). Bu etki, IL-15 geninin transkripsiyonel aktivitesini zayıflatır ve mukozal ortamda IL-15 kaynaklı IEL proliferasyonunun sürdürülmesini engeller.
Ek olarak, COX inhibisyonu ile azalan inflamatuvar mediyatörler (TNF-α, IL-1β) de IL-15 üretimini uyarıcı etki gösterdiğinden, bu mediyatörlerin baskılanması IL-15 ekspresyonunu ikincil düzeyde daha da düşürür. Böylece İndometazin, COX yolakları ve PPARγ aracılığıyla IL-15 düzeylerini modüle eden iki yönlü bir düzenleyici etki sunar (4,5).
Ergotamin
Ergotamin, çölyak hastalığında IL-15 üretimi veya IEL aktivasyonu üzerinde doğrudan bir etkiye sahip değildir (7). İlacın temel etkisi, 5-HT₁B/1D reseptörleri aracılığıyla vazokonstriksiyon oluşturarak mukozal kan akımını düzenlemektir. Bu durum, inflamatuvar hücre infiltrasyonunu dolaylı olarak azaltabilir; ancak IL-15 transkripsiyonu veya sekresyonu üzerinde anlamlı bir düzenleyici etkisi bulunmamaktadır (7).
Kısa süreli kullanımlarda ödem ve hiperemiyi sınırlayarak lokal inflamasyonu hafifletebilir, fakat uzun süreli kullanımda iskemik hasar yoluyla epitel stresini artırarak IL-15 üretimini sekonder olarak tetikleme riski taşıyabilir. Bu nedenle Ergotamin’in bu basamaktaki etkisi dolaylı ve sınırlı düzeyde kabul edilmelidir.
Sonuç
IL-15, çölyak hastalığının innate immün fazında IEL aktivasyonunun ve epitel hasarının en önemli belirleyicisidir. Bu sitokinin üretimini veya etkilerini baskılamak, mukozal bütünlüğün korunmasında stratejik bir hedef oluşturur.
• Caroverin, Ca²⁺ sinyali ve oksidatif stres üzerinden IEL sitotoksisitesini sınırlar.
• Sulfosalazin, NF-κB inhibisyonu ile IL-15 ekspresyonunu azaltır.
• İndometazin, COX inhibisyonu ve PPARγ aktivasyonu yoluyla IL-15 üretimini baskılar.
• Ergotamin’in bu süreçteki katkısı dolaylı ve sınırlı düzeydedir.
Bu kombinasyon, IL-15 kaynaklı mukozal hasarı çoklu mekanizmalar üzerinden azaltma potansiyeli taşımaktadır (2–7).
5. p31-43 Alfa-Gliadin ile Innate Aktivasyon
Çölyak hastalığında yalnızca adaptif immün sistem değil, aynı zamanda innate immün yanıt da hastalık sürecinin erken evresinde aktif rol oynar. Bu yanıtın merkezinde, glutenin alfa-gliadin fraksiyonuna ait olan p31-43 peptidi yer almaktadır. Bu peptit, HLA-DQ2/DQ8 aracılığıyla sunulmadan, doğrudan epitel hücrelerinde stres yanıtı başlatarak çölyak patogenezinde özgün bir mekanizma oluşturur (2). p31-43, enterositlerde endozomal-lizozomal yolakları etkileyerek lizozomal
füzyon bozukluğuna, hücre içi Ca²⁺ dengesizliğine, reaktif oksijen türleri (ROS) üretiminde artışa ve endoplazmik retikulum (ER) stresine neden olur. Bu süreç, IL-15 başta olmak üzere TNF-α ve IFN-α gibi sitokinlerin üretimini tetikler (2). Bu sitokinler, intraepitelyal lenfositlerin (IEL) aktivasyonunu ve sitotoksik yanıtı uyararak mukozal hasarın başlamasına katkıda bulunur. Dolayısıyla p31-43 peptidi, çölyak hastalığının adaptif yanıttan önce başlayan ve epitel bütünlüğünü bozan ilk basamaklarından biridir.
Bu basamakta hedeflenen farmakolojik müdahaleler, epitel hücresel stresini,
ROS üretimini, NF-κB aktivasyonunu ve sitokin salınımını azaltmayı amaçlar. Aşağıda, incelenen ilaçların bu patogenez basamağındaki teorik etkileri ayrıntılı şekilde değerlendirilmiştir.
Caroverin
Caroverin, güçlü bir antioksidan ve Ca²⁺ kanal blokeri olarak, p31-43 peptidinin tetiklediği hücresel stres yanıtını çok yönlü şekilde baskılayabilir (6). p31-43, epitel hücrelerinde reaktif oksijen türlerinin (ROS) üretimini artırarak NF-κB ve MAPK yolaklarını aktive eder; bu durum IL-15 ve TNF-α ekspresyonunu artırır. Caroverin’in redoks dengeleyici etkisi, ROS seviyelerini düşürerek bu sinyal yollarının aktivasyonunu sınırlayabilir (6).
Ayrıca Ca²⁺ sinyalizasyonunun p31-43 kaynaklı stres yanıtında önemli rol oynadığı bilinmektedir. Caroverin, voltaj bağımlı Ca²⁺ kanallarını inhibe ederek hücre içi Ca²⁺ yüklenmesini azaltabilir; bu sayede ER stresini ve mitokondriyal disfonksiyonu hafifletebilir. Bu mekanizma, epitel hücre ölümü ve apoptoz oranlarını düşürerek mukozal bütünlüğü koruyabilir. Dolayısıyla Caroverin, p31-43 kaynaklı innate aktivasyonu, hem oksidatif stres hem de kalsiyum dengesizliği ekseninde baskılayıcı bir potansiyel sunar (6).
Sulfosalazin
Sulfosalazin, NF-κB sinyal yolunun güçlü bir inhibitörü olup, p31-43 peptidinin başlattığı innate immün aktivasyonun sürdürülmesinde kilit rol oynayan IL-15 ve TNFα üretimini azaltabilir (3). p31-43, epitel hücrelerinde NF-κB’nin çekirdeğe translokasyonunu artırarak proinflamatuvar sitokinlerin sentezini hızlandırır. Sulfosalazin, bu mekanizmayı bloke ederek sitokin üretimini baskılar ve innate immün ortamın şiddetini hafifletir (3).
Ayrıca Sulfosalazin’in antioksidan özellikleri, redoks duyarlı transkripsiyon faktörlerinin (örneğin NF-κB, AP-1) aktivasyonunu sınırlayabilir. Bu sayede p31-43 kaynaklı epitel stres yanıtı hem transkripsiyonel hem de oksidatif düzeyde baskılanmış olur. Sulfosalazin, böylece innate immün sistemin aşırı aktivasyonuna karşı koruyucu bir rol üstlenebilir (3).
İndometazin
İndometazin, COX-1/2 enzimlerini inhibe ederek prostaglandin E₂ (PGE₂) düzeylerini azaltır (4). PGE₂, epitel hücrelerinde inflamatuvar sinyalleşmeyi destekleyen bir mediyatördür; NF-κB aktivasyonunu artırarak IL-15 ve TNF-α üretimini güçlendirir. Dolayısıyla İndometazin’in PGE₂ düşürücü etkisi, p31-43 kaynaklı proinflamatuvar yanıtın şiddetini azaltabilir (4).
Ek olarak İndometazin, PPARγ aktivasyonunu uyararak antiinflamatuvar gen ekspresyonunu destekler. PPARγ, NF-κB ve AP-1 gibi transkripsiyon faktörlerinin DNA’ya bağlanmasını engelleyerek sitokin üretimini sınırlar (5). Bu etki, IL-15 sentezini baskılayarak innate immün aktivasyonun kontrol altına alınmasına katkı sağlar.
Ayrıca İndometazin, epitel hücrelerindeki inflamatuvar mikroçevreyi zayıflatır; bu da IEL aktivasyonunu dolaylı biçimde azaltır. Bu yönüyle İndometazin, p31-43’ün tetiklediği epitel stresini ve innate yanıtı çok yönlü olarak hafifletme potansiyeline sahiptir (4,5).
Ergotamin
Ergotamin, p31-43 peptidinin başlattığı innate immün aktivasyon üzerinde doğrudan etkili bir ajan değildir (7). Ancak vazokonstriktör özellikleri nedeniyle mukozal ödemi azaltabilir ve inflamatuvar hücrelerin epitel yüzeyine göçünü sınırlayabilir. Bu etki, lokal inflamasyonun ikincil düzeyde hafiflemesine katkıda bulunabilir.
Yine de, Ergotamin’in IL-15 ekspresyonu, NF-κB aktivasyonu veya ROS üretimi gibi temel mekanizmalar üzerinde doğrudan düzenleyici bir rolü bulunmamaktadır (7).
Uzun süreli kullanımda ortaya çıkabilecek iskemik etkiler, mukozal stres ve ROS üretimini artırarak p31-43 kaynaklı hasarı paradoksal olarak kötüleştirebilir. Bu nedenle Ergotamin’in bu basamaktaki katkısı dolaylı ve klinik olarak sınırlı düzeyde kalır.
Sonuç
p31-43 alfa-gliadin peptidi, çölyak hastalığında adaptif yanıt öncesi başlayan
innate immün aktivasyonun ana tetikleyicisidir. Bu peptidin yol açtığı epitel stres yanıtı, IL-15 ve TNF-α üretimini artırarak mukozal hasarın zeminini oluşturur. Bu süreçte:
• Caroverin, ROS baskısı ve Ca²⁺ sinyali modülasyonu yoluyla hücresel stresi azaltır.
• Sulfosalazin, NF-κB inhibitörü olarak IL-15 ve TNF-α üretimini baskılar.
• İndometazin, PGE₂ düşüşü ve PPARγ aktivasyonu ile innate yanıtı hafifletir.
• Ergotamin ise yalnızca vasküler düzenleme yoluyla dolaylı ve ikincil düzeyde etki gösterebilir.
Bu kombinasyon, innate immün yanıtın aşırı aktivasyonunu farklı eksenlerden baskılayarak epitel bütünlüğünü koruma potansiyeline sahiptir (2–7).
6. Zonulin ve Bağırsak Geçirgenliği
Çölyak hastalığında mukozal bariyerin bozulması, hastalığın hem başlangıcında hem de ilerleyişinde temel bir patogenetik basamaktır. Bu süreçte zonulin adlı proteinin artışı kritik rol oynar. Zonulin, sıkı bağlantı (tight junction) komplekslerinin önemli düzenleyicilerindendir ve claudin, occludin ve ZO-1 gibi bağlantı proteinlerinin konformasyonunu değiştirerek enterositler arasındaki parakellular boşlukları genişletir
(8).
Bu mekanizma sonucunda intestinal geçirgenlik artar, gluten peptitleri gibi antijenik moleküller lamina propria’ya geçer ve burada antijen sunan hücreler tarafından işlenerek adaptif immün yanıtı başlatır (8). Zonulin düzeylerindeki artış, IL6, TNF-α ve IL-15 gibi proinflamatuvar sitokinler ile oksidatif stres ve Ca²⁺ bağımlı sinyalleşme gibi faktörler tarafından da uyarılabilir. Bu nedenle zonulin üretimini veya etkisini sınırlayan ajanlar, mukozal bariyer bütünlüğünü korumada terapötik değer taşır.
Aşağıda, bu basamaktaki ilaçların teorik etkileri detaylı biçimde sunulmuştur:
Caroverin
Caroverin, oksidatif stres baskılayıcı ve Ca²⁺ sinyal modülatörü etkileriyle sıkı bağlantı komplekslerinin stabilitesini destekleyebilir (6). Oksidatif stres, claudin-1 ve occludin gibi bağlantı proteinlerinde nitrasyon ve fosforilasyon yoluyla yapısal bozulmaya neden olarak parakellular geçirgenliği artırır. Caroverin’in redoks dengeleyici etkisi, bu proteinlerdeki yapısal değişiklikleri azaltarak epitel bariyerinin bütünlüğünü korur (6).
Ayrıca Ca²⁺ sinyalleşmesinin aşırı aktivasyonu, aktin iskeletinin yeniden düzenlenmesine ve tight junction dislokasyonuna yol açabilir. Caroverin, Ca²⁺ kanal blokajı ile hücre içi Ca²⁺ seviyelerini dengede tutar ve böylece zonulin aracılı bağlantı gevşemesini sınırlandırır. Bu etkiler, zonulin düzeylerindeki artışın neden olduğu bariyer bozulmasını dolaylı olarak engelleyebilir (6).
Dolayısıyla Caroverin, oksidatif stres ve kalsiyum sinyali ekseninde iki yönlü bir koruma sağlayarak epitel bariyer stabilizasyonuna katkı sunabilir.
Sulfosalazin
Sulfosalazin, proinflamatuvar sitokinlerin (TNF-α, IL-6) üretimini baskılayarak zonulin ekspresyonunu dolaylı şekilde azaltabilir (3). TNF-α ve IL-6, zonulin gen ekspresyonunu uyararak sıkı bağlantıların çözülmesine neden olur. Bu sitokinlerin baskılanması, zonulin sentezinde azalmaya ve bağırsak geçirgenliğinin normalleşmesine katkı sağlar (3).
Ayrıca Sulfosalazin’in NF-κB inhibisyonu, epitel hücrelerinde inflamatuvar genlerin baskılanmasını sağlayarak sıkı bağlantı proteinlerinin korunmasına yardımcı olur. Bu mekanizma, epitel hücrelerinin apoptoz oranını azaltır ve mukozal bütünlüğü destekler. Ek olarak, antioksidan etkisi sayesinde redoks duyarlı zonulin aktivasyonunu sınırlayabilir. Bu çoklu etkiler, Sulfosalazin’i bariyer fonksiyon bozukluğunu hedefleyen teorik bir ajan haline getirir (3).
İndometazin
İndometazin, COX-1/2 inhibisyonu ile prostaglandin E₂ (PGE₂) düzeylerini düşürür (4). PGE₂, epitel geçirgenliğini artıran bir lipid mediyatördür; sıkı bağlantı proteinlerinin ekspresyonunu ve organizasyonunu bozar. Bu nedenle İndometazin’in PGE₂ azalmasına yol açması, tight junction stabilitesinin korunmasına katkıda bulunabilir (4).
Ek olarak İndometazin, PPARγ aktivasyonunu artırarak antiinflamatuvar gen ekspresyonunu destekler ve NF-κB aracılı proinflamatuvar yanıtı baskılar (5). Bu mekanizma, TNF-α ve IL-6 düzeylerinde azalma sağlayarak zonulin ekspresyonunu dolaylı biçimde sınırlar. Aynı zamanda PPARγ’nın claudin ve occludin gen ekspresyonunu artırıcı etkisi, epitel bariyer fonksiyonunun yeniden düzenlenmesine yardımcı olabilir (5).
Bu iki yönlü etki sayesinde İndometazin, hem inflamatuvar sinyalleşmeyi azaltarak hem de sıkı bağlantı proteinlerini destekleyerek zonulin kaynaklı geçirgenlik artışını kontrol altına alabilir.
Ergotamin
Ergotamin, vazokonstriktör etkisiyle akut dönemde mukozal ödemi azaltabilir ve böylece mekanik olarak bariyer bütünlüğünü geçici olarak destekleyebilir (7). Ödemin azalması, sıkı bağlantı komplekslerine binen basıncın düşmesine yardımcı olur ve zonulin etkilerinin şiddetini hafifletebilir.
Ancak kronik veya yüksek doz kullanımlarda, aşırı vazokonstriksiyon nedeniyle mukozal iskemi gelişebilir. İskemi, epitel hücrelerinde hipoksi ve oksidatif stres oluşturarak zonulin üretimini ve tight junction bozulmasını paradoksal biçimde artırabilir (7). Bu nedenle Ergotamin’in bariyer üzerindeki etkisi doza ve kullanım süresine son derece bağımlıdır; kısa süreli uygulamalarda sınırlı fayda sağlayabilirken, uzun vadede zararlı etkiler ortaya çıkabilir.
Sonuç
Çölyak hastalığında zonulin artışı, sıkı bağlantı komplekslerinin çözülmesi yoluyla bağırsak geçirgenliğini artırır ve antijen geçişini kolaylaştırarak immün aktivasyonu besler. Bu sürecin baskılanması, hastalığın ilerlemesini sınırlamak için stratejik önemdedir.
• Caroverin, oksidatif stres ve Ca²⁺ sinyali regülasyonu ile epitel bağlantılarını stabilize eder.
• Sulfosalazin, TNF-α ve IL-6 düzeylerini azaltarak zonulin sentezini düşürür.
• İndometazin, PGE₂ inhibisyonu ve PPARγ aktivasyonu ile bariyer bütünlüğünü korur.
• Ergotamin, akut dönemde ödem azaltıcı, kronik dönemde ise riskli bir etkene sahiptir.
Bu ajanların kombinasyonu, zonulin aracılı geçirgenlik artışına karşı çoklu mekanizma temelli bir bariyer koruma stratejisi sağlayabilir (3,4,5,6,7,8).
7. Mikrobiyota ve Viral Tetikleyiciler
Çölyak hastalığının gelişiminde yalnızca genetik yatkınlık (HLA-DQ2/DQ8) ve gluten alımı değil, aynı zamanda çevresel tetikleyiciler de önemli rol oynar. Özellikle mikrobiyota kompozisyonundaki dengesizlikler (disbiyoz) ve viral enfeksiyonlar, hastalığın başlangıcını kolaylaştıran anahtar faktörler arasında yer alır (2,8).
Reovirüs ve rotavirüs gibi enterik virüslerin, epitel hücrelerinde interferon tipi yanıtları uyararak antiviral savunmayı aşırı aktive ettiği, bunun sonucunda gluten peptitlerinin immünojenitesinin arttığı gösterilmiştir (8). Bu enfeksiyonlar sırasında IFN-α, IL-15 ve TNF-α gibi sitokinlerin üretimi artar; bu da antijen sunumunu kolaylaştırarak otoimmün süreci tetikler (2).
Buna paralel olarak, bağırsak mikrobiyotasındaki bozulmalar — özellikle butirat üreten bakterilerin azalması ve patobiont türlerin artması — mukozal bariyer fonksiyonunu zayıflatır, zonulin salınımını artırır ve inflamatuvar mikroçevreyi güçlendirir (8). Bu durum, gluten duyarlılığının artmasına ve persistan inflamasyona zemin hazırlar.
Aşağıda, incelenen ilaçların bu basamakta etkili olabilecek teorik mekanizmaları sunulmuştur:
Caroverin
Caroverin, oksidatif stres baskılayıcı özellikleri sayesinde viral enfeksiyonlar veya mikrobiyota kaynaklı inflamasyonlar sonucunda ortaya çıkan epitel hasarını azaltabilir (6). Viral enfeksiyonlar, epitel hücrelerinde reaktif oksijen türlerinin (ROS) üretimini artırarak DNA hasarı, endoplazmik retikulum (ER) stresi ve apoptoz süreçlerini başlatır. Caroverin’in redoks dengeleyici etkisi, bu hasar kaskadını sınırlayabilir (6).
Ayrıca Ca²⁺ sinyalleşmesini düzenleyici etkisiyle, viral enfeksiyonlar sonrası artan Ca²⁺ bağımlı inflamatuvar sinyalleşmeyi modüle edebilir. Bu sayede IL-15, NF-κB ve MAPK aktivasyonlarının aşırı artışı baskılanabilir. Sonuç olarak Caroverin, epitel bariyer bütünlüğünü destekleyerek viral enfeksiyonların tetiklediği mukozal inflamasyonu hafifletebilir.
Her ne kadar doğrudan antiviral bir ajan olmasa da, oksidatif stres kontrolü ve epitel koruyucu etkileri sayesinde çevresel tetikleyicilerin çölyak patogenezinde yarattığı hasarı sınırlandırma potansiyeline sahiptir (6).
Sulfosalazin
Sulfosalazin, iki bileşenden oluşur: 5-aminosalisilik asit (5-ASA) ve sülfapiridin. Özellikle sülfapiridin kısmı, antimikrobiyal etki gösterir ve bağırsak mikrobiyotasında dengeleyici bir rol oynayabilir (3). Çölyakta görülen disbiyoz, inflamasyonu sürdüren bakterilerin (örneğin Escherichia coli, Enterococcus faecalis) artışı ve yararlı butirat üreten türlerin azalmasıyla karakterizedir. Sulfosalazin, patobiont türleri baskılayarak yararlı flora bileşenlerinin yeniden yerleşmesine katkıda bulunabilir (3).
Ek olarak, NF-κB inhibisyonu yoluyla viral enfeksiyonların tetiklediği proinflamatuvar sitokin üretimini (özellikle TNF-α ve IL-6) baskılar. Bu etki, enfeksiyon sonrası ortaya çıkan inflamatuvar mikroçevreyi hafifletir ve gluten antijenlerinin immünojenitesini dolaylı olarak azaltır. Ayrıca antioksidan kapasitesi ile epitel bariyerini koruyarak mikrobiyota etkileşimi sonucu ortaya çıkan stres yanıtlarını zayıflatır (3).
Bu özellikler, Sulfosalazin’i disbiyoz ve post-viral inflamasyon kaynaklı çölyak aktivasyonuna karşı teorik olarak koruyucu bir ajan haline getirir.
İndometazin
İndometazin, COX-1/COX-2 inhibisyonu yoluyla prostaglandin E₂ (PGE₂) sentezini azaltarak viral enfeksiyonlar sonrası gelişen inflamasyonu baskılayabilir (4).
PGE₂, interferon ve proinflamatuvar sitokin üretimini destekleyerek enfeksiyon sonrası immün aktivasyonun sürmesine neden olur. Bu nedenle İndometazin, PGE₂ düzeylerini düşürerek post-viral inflamatuvar yanıtı hafifletebilir (4).
Ayrıca İndometazin’in PPARγ aktivasyonunu artırması, antiinflamatuvar gen ekspresyonunu uyarır ve NF-κB aracılı sitokin üretimini baskılar (5). Bu mekanizma, viral enfeksiyonların tetiklediği IL-15 ve TNF-α artışını dolaylı olarak sınırlayabilir.
Bunun yanında, viral enfeksiyonların tetiklediği intestinal geçirgenlik artışı üzerinde de olumlu etkileri olabilir; çünkü PGE₂ azalması ve sıkı bağlantı proteinlerinin korunması sayesinde bariyer fonksiyonu desteklenir. Ancak uzun süreli kullanımda gastrointestinal toksisite riski göz önünde bulundurulmalıdır (4,5).
Ergotamin
Ergotamin, çölyak hastalığında rol oynayan mikrobiyota veya viral enfeksiyonlar üzerinde doğrudan bir etkiye sahip değildir (7). İlacın temel etkisi 5-HT₁B/1D reseptörleri üzerinden vazokonstriksiyon oluşturmak olup, epitel bariyer fonksiyonu veya mikrobiyal denge üzerine anlamlı bir katkısı bulunmamaktadır.
Kısa süreli kullanımlarda ödem ve hiperemiyi sınırlayarak mukozal inflamasyonu dolaylı olarak hafifletebilir; ancak iskemik potansiyeli nedeniyle uzun süreli kullanımlarda epitel hipoksisi ve stres yanıtı artabilir (7). Bu nedenle Ergotamin’in bu basamaktaki rolü dolaylı ve klinik olarak önemsiz düzeydedir.
Sonuç
Mikrobiyota bozukluğu ve viral enfeksiyonlar, çölyak hastalığında otoimmün süreci tetikleyen önemli çevresel faktörlerdir. Bu süreçte oksidatif stres, sitokin fırtınası, bariyer bozulması ve immün aşırı aktivasyon ön plandadır.
• Caroverin, oksidatif stres baskısı ve epitel koruyucu etkisiyle viral ve mikrobiyal tetiklenmeyi hafifletir.
• Sulfosalazin, antimikrobiyal sülfapiridin bileşeni sayesinde disbiyozu düzenler ve NF-κB baskısı ile inflamasyonu sınırlar.
• İndometazin, COX inhibisyonu ve PPARγ aktivasyonu yoluyla post-viral inflamasyonu baskılar.
• Ergotamin, yalnızca dolaylı vasküler etkiler gösterir, mikrobiyota ve virüsler üzerinde anlamlı etkisi yoktur.
Bu kombinasyon, çevresel tetikleyicilere karşı çoklu mekanizma temelli bir koruyucu strateji oluşturma potansiyeline sahiptir (2,3,4,5,6,7,8).
8. Non-HLA Genetik Faktörler
Çölyak hastalığının patogenezinde HLA-DQ2/DQ8 haplotipleri majör risk belirleyicileri olmakla birlikte, hastalığın klinik seyri ve inflamatuvar yanıtın şiddeti yalnızca bu allellerle açıklanamaz. Güncel genomik analizler, HLA dışı (non-HLA) genetik faktörlerin de hastalığın ortaya çıkışı, progresyonu ve tedavi yanıtında önemli rol oynadığını göstermektedir (8).
Bu genetik faktörler arasında en çok incelenenler şunlardır:
• IL2 ve IL21 gen bölgeleri (4q27), sitokin üretimini ve T hücre proliferasyonunu düzenler.
• REL, NF-κB ailesine ait bir transkripsiyon faktörüdür; inflamatuvar yanıtı güçlendirir.
• TNFAIP3 (A20), NF-κB’nin negatif düzenleyicisidir; polimorfizmleri durumunda inflamatuvar yanıt uzar ve otoimmün süreçler kolaylaşır.
Bu genetik varyasyonlar, T hücre aktivasyonu, sitokin aşırı üretimi, immün regülasyon kaybı ve inflamatuvar döngülerin kronikleşmesi ile çölyak mukozasında persistan inflamasyonun sürmesine neden olabilir (8).
İlaç kombinasyonundaki ajanların, bu genetik faktörlerin oluşturduğu aşırı immün aktiviteyi transkripsiyonel regülasyon, antiinflamatuvar sinyal güçlendirme ve oksidatif stres kontrolü gibi mekanizmalarla modüle etme potansiyeli bulunmaktadır:
Sulfosalazin
Sulfosalazin, NF-κB sinyal yolunun güçlü bir inhibitörüdür ve bu özelliğiyle REL ve TNFAIP3 polimorfizmlerinin neden olduğu aşırı NF-κB aktivasyonunu dengeleyebilir
(3).
• REL geni, NF-κB p65 alt birimi üzerinden IL-2 ve IL-21 ekspresyonunu artırır; bu durum T hücre proliferasyonunu ve sitokin fırtınasını güçlendirir.
• TNFAIP3 (A20), normalde NF-κB aktivasyonunu negatif yönde düzenler; ancak kaybedici polimorfizmler varlığında bu düzenleyici fren ortadan kalkar ve inflamasyon uzar.
Sulfosalazin, NF-κB’nin çekirdeğe translokasyonunu engelleyerek, REL aracılı transkripsiyonel aktivasyonu ve TNFAIP3 eksikliğinin yol açtığı aşırı inflamasyonu baskılayabilir (3). Böylece IL-2, IL-21, TNF-α ve IFN-γ gibi çölyak patogenezinde aktif olan sitokinlerin üretimi azalır.
Ek olarak, antioksidan etkileri, redoks-duyarlı gen ekspresyonlarını stabilize ederek proinflamatuvar gen aktivasyonunu sınırlar. Bu sayede, genetik olarak hiperaktif immün yanıtın epitel düzeydeki etkileri hafifleyebilir.
İndometazin
İndometazin, COX-1/2 inhibisyonu yanında PPARγ aktivasyonunu uyararak gen transkripsiyonunu dengeleyici etki gösterebilir (4). PPARγ, NF-κB ve AP-1 gibi transkripsiyon faktörlerinin DNA’ya bağlanmasını engelleyerek proinflamatuvar genlerin baskılanmasına aracılık eder.
Bu mekanizma, özellikle REL ve IL2/IL21 lokusundaki polimorfizmlerin yol açtığı sitokin aşırı üretimini azaltabilir. PPARγ aktivasyonu, IL-2 gen ekspresyonunu doğrudan baskılayarak T hücre proliferasyonunu sınırlarken, IL-21 üretiminin azalması B hücre aktivasyonu ve otoantikor üretimi üzerinde yatıştırıcı bir etki oluşturur (4,5).
Ayrıca PPARγ, TNFAIP3 ekspresyonunu artırarak NF-κB aktivasyonunun negatif regülasyonunu güçlendirir. Bu sayede genetik polimorfizmler nedeniyle bozulmuş olan antiinflamatuvar denge kısmen yeniden sağlanabilir.
Dolayısıyla İndometazin, PPARγ aracılı transkripsiyonel kontrol yoluyla genetik varyasyonların inflamatuvar etkilerini hafifletme potansiyeline sahiptir.
Caroverin
Caroverin, doğrudan gen transkripsiyonunu hedefleyen bir ajan değildir; ancak oksidatif stres baskılayıcı etkileri ile redoks-duyarlı transkripsiyon faktörlerinin (örneğin NF-κB, AP-1) aşırı aktivasyonunu dolaylı olarak sınırlandırabilir (6).
REL veya TNFAIP3 polimorfizmleri, NF-κB aktivasyonunu artırdığında, hücre içi ROS düzeyleri de yükselir. Caroverin, Ca²⁺ kanal blokajı ve antioksidan kapasitesi ile bu oksidatif yükü azaltarak proinflamatuvar gen ekspresyonunun dolaylı biçimde dengelenmesine katkı sağlayabilir (6).
Bu nedenle Caroverin’in etkisi dolaylı olup, hücresel stres modülasyonu üzerinden genetik varyasyonların inflamatuvar sonuçlarını hafifletici bir rol üstlenebilir.
Ergotamin
Ergotamin, vasküler tonus ve nörotransmitter salınımı üzerinde etkili bir ajan olmakla birlikte, gen transkripsiyonu veya sitokin ekspresyonu üzerinde doğrudan düzenleyici bir etki göstermez (7).
• REL, IL2, IL21, TNFAIP3 gibi genler üzerindeki etkisi sınırlı ve dolaylıdır.
• Ergotamin’in vazokonstriktör etkisi, lokal inflamatuvar hücre infiltrasyonunu kısmen azaltabilir; ancak genetik varyasyonların yol açtığı moleküler aktiviteyi doğrudan baskılamaz (7).
Uzun süreli kullanımı mukozal iskemi riski oluşturabileceğinden, genetik temelli inflamasyonun uzun vadeli yönetiminde uygun bir ajan olarak değerlendirilmez.
Sonuç
Çölyak hastalığında HLA dışı genetik faktörler, özellikle IL-2, IL-21, REL ve TNFAIP3 genlerindeki polimorfizmler, sitokin aşırı üretimi, T hücre aktivasyonu ve NFκB aracılı inflamasyonun kronikleşmesine yol açar.
• Sulfosalazin, NF-κB inhibisyonu ile bu genetik aktivasyonun ana eksenini baskılar.
• İndometazin, PPARγ aracılığıyla proinflamatuvar gen ekspresyonunu dengeler ve TNFAIP3 ekspresyonunu destekler.
• Caroverin, oksidatif stres regülasyonu ile gen ekspresyonuna dolaylı etki eder.
• Ergotamin’in etkisi minimal ve sekonder düzeydedir.
Bu kombinasyon, genetik varyasyonların inflamatuvar etkilerini çoklu mekanizmalarla sınırlayarak epitel hasarını azaltma ve immün regülasyonu destekleme potansiyeli taşımaktadır (3,4,5,6,7,8).
9. TG2 İnhibitörleriyle Sinerji
Çölyak hastalığının patogenezinde doku transglutaminaz (TG2) enzimi, glutenin α-gliadin fraksiyonlarının deamidasyonunu katalize ederek bu peptitlerin HLADQ2/DQ8 moleküllerine bağlanma afinitesini artırır (2). Bu süreç, CD4⁺ T hücrelerinin aktivasyonunu kolaylaştırır, sitokin üretimini artırır ve mukozal inflamasyonu tetikler. Ayrıca TG2, enterosit yüzeyinde otoantikor hedefi olarak da görev yapar; bu durum anti-TG2 antikorlarının gelişimine ve mukozal hasarın ilerlemesine neden olur. Bu nedenle TG2 inhibitörleri, çölyak hastalığında farmakolojik tedavi stratejilerinin merkezinde yer alan aday moleküllerdir (8).
Bununla birlikte, TG2 aktivitesinin yalnızca enzim düzeyinde inhibisyonu genellikle klinik olarak yetersiz kalır. Çünkü TG2 ekspresyonu ve aktivitesi, inflamasyon, oksidatif stres, sitokin sinyalleşmesi ve hücresel stres yanıtları tarafından uyarılır (2,8). Bu nedenle inflamatuvar mikroçevreyi düzenleyen ve mukozal bariyer bütünlüğünü destekleyen ilaçlarla birlikte kullanıldığında TG2 inhibitörlerinin etkinliği belirgin biçimde artabilir.
Bu bağlamda, önerilen kombinasyondaki ajanların TG2 inhibitörleriyle farmakodinamik sinerji oluşturma potansiyeli aşağıda açıklanmıştır:
Sulfosalazin
Sulfosalazin, NF-κB yolunun güçlü bir inhibitörü olarak proinflamatuvar sitokinlerin (IL-15, TNF-α, IFN-γ) üretimini baskılar (3). Bu sitokinler, TG2 gen ekspresyonunun başlıca uyarıcılarıdır; özellikle IL-15, enterositlerde TG2 transkripsiyonunu artırarak gliadin deamidasyon kapasitesini güçlendirir (2). Sulfosalazin’in NF-κB inhibisyonu yoluyla bu sitokinlerin üretimini azaltması, TG2’nin upstream aktivasyon sinyallerini keser (3).
Böylece TG2 inhibitörleri, enzim düzeyinde aktiviteyi sınırlarken; Sulfosalazin, transkripsiyonel ve inflamatuvar düzeyde destekleyici baskı sağlar. Bu çok katmanlı etki, enzim inhibisyonunun sürekliliğini artırır ve immün yanıtın daha etkili biçimde kontrol altına alınmasına katkı sunar.
Ek olarak Sulfosalazin’in antioksidan özellikleri, redoks duyarlı TG2 aktivasyonunu zayıflatır; çünkü oksidatif stres, TG2’nin S–S köprüleri üzerinden konformasyonel aktivasyonunu kolaylaştırır (3). Bu yönüyle Sulfosalazin, hem gen düzeyi hem çevresel aktivasyon düzeyinde TG2 inhibitörleriyle yüksek sinerji potansiyeline sahiptir.
İndometazin
İndometazin, COX-1/2 inhibisyonu yoluyla prostaglandin E₂ (PGE₂) düzeylerini düşürür ve inflamatuvar mikroçevreyi baskılar (4). PGE₂, NF-κB aktivasyonu ve IL-15 üretimi aracılığıyla TG2 ekspresyonunu artırır. Bu nedenle İndometazin’in PGE₂ azaltıcı etkisi, TG2 inhibitörlerinin etkisini destekler; çünkü enzim aktivasyonunun upstream indükleyicileri zayıflatılmış olur (4).
Ayrıca İndometazin’in PPARγ aktivasyonunu artırıcı etkisi, antiinflamatuvar gen ekspresyonunu destekler ve NF-κB’yi baskılayarak TG2’nin transkripsiyonel aktivasyonunu dolaylı biçimde azaltır (5). PPARγ’nın aynı zamanda epitel tamir mekanizmalarını desteklemesi, mukozal bariyerin yeniden yapılanmasını kolaylaştırır; bu durum, TG2 inhibitörlerinin yalnızca enzim baskısı değil, bariyer bütünlüğü restorasyonu yoluyla da daha etkili olmasına katkı sağlar.
Dolayısıyla İndometazin, COX/PGE₂ ve PPARγ/NF-κB eksenlerinde çift yönlü düzenleyici etki göstererek TG2 inhibitörleriyle farmakodinamik sinerji oluşturur (4,5).
Caroverin
Caroverin, mukozal koruyucu ve oksidatif stres baskılayıcı etkileriyle TG2 inhibitörlerinin dolaylı sinerjistik destekleyicisi olarak değerlendirilebilir (6). TG2 aktivitesi, hücresel stres altında artar; özellikle reaktif oksijen türleri (ROS), TG2’nin Snitrozilasyonunu kolaylaştırarak aktif konformasyona geçmesine neden olur (2).
Caroverin’in redoks dengeleyici kapasitesi, bu oksidatif aktivasyonu sınırlandırır; ayrıca Ca²⁺ kanal blokajı, Ca²⁺ bağımlı TG2 aktivasyonunu dolaylı biçimde baskılar (6). Bu sayede TG2 inhibitörleri, doğrudan enzim inhibisyonu sağlarken; Caroverin, aktivasyon eşiğini yükselterek inhibitörlerin etki süresini uzatabilir.
Ek olarak epitel bütünlüğünün korunması, gluten peptitlerinin lamina propria’ya geçişini sınırlayarak TG2-substrat etkileşimini azaltır. Bu nedenle Caroverin, TG2 inhibitörlerinin etkisini tamamlayıcı ve mukozal ortamı destekleyici bir yardımcı ajan olarak teorik değer taşır.
Ergotamin
Ergotamin, TG2 inhibitörleriyle sinerji oluşturma potansiyeli taşımayan, hatta uzun süreli kullanımlarda riskli bir ajandır (7). İlacın vazokonstriktör etkisi, mukozal kan akımını azaltarak iskemi ve oksidatif stres riskini artırır. Bu durum, TG2 ekspresyonunu ve aktivasyonunu tetikleyebilir; çünkü hipoksi ve ROS artışı, TG2’nin stres yanıtı proteini olarak aşırı üretimine yol açar (7).
Dolayısıyla Ergotamin, TG2 inhibitörleriyle uyumlu bir kombinasyon oluşturmaz. Hatta kronik kullanım, TG2 inhibitörlerinin terapötik faydasını azaltabilecek çevresel stres faktörlerini güçlendirebilir. Bu nedenle bu ajan, sinerjistik kombinasyonlar açısından kontrendike olarak değerlendirilebilir
Sonuç
TG2 inhibitörleri, çölyak hastalığında glutenin immünojenik dönüşümünü engellemede kritik öneme sahiptir; ancak inflamatuvar mikroçevre, oksidatif stres ve sitokin kaskatları bu tedavinin başarısını sınırlar.
• Sulfosalazin, NF-κB baskısı ve sitokin inhibisyonu yoluyla TG2’nin transkripsiyonel aktivasyonunu sınırlar.
• İndometazin, PGE₂ azalması ve PPARγ aktivasyonu ile upstream sinyallemeyi zayıflatır.
• Caroverin, oksidatif stres modülasyonu ve mukozal koruma üzerinden dolaylı sinerji sunar.
• Ergotamin ise iskemi riski nedeniyle uygun bir kombinasyon ajanı değildir.
Bu üçlü yaklaşım (Sulfosalazin + İndometazin + TG2 inhibitörü), enzimatik aktivite, inflamatuvar indüksiyon ve hücresel stres düzeylerinde çok katmanlı bir baskı sağlayarak gluten duyarlılığı döngüsünün kırılmasında teorik olarak güçlü bir strateji sunabilir (3–7).
Güvenlilik Değerlendirmesi
• İndometazin: NSAİİ enteropatisi ve ülser riski yüksek [9,10].
• Sulfosalazin: Gastrointestinal irritasyon, nadiren hepatotoksisite [3,9].
• Ergotamin: Kronik kullanımda iskemi ve nekroz riski [7].
• Caroverin: Genel olarak güvenli, hafif gastrointestinal rahatsızlıklar [6].
• Farmakogenetik faktörler: MRP4 (ABCC4) polimorfizmleri İndometazin metabolizmasını etkileyebilir [11].
Tezin Üstünlükleri
• Çoklu patogenez basamaklarını hedefleme
• TG2 inhibitörleriyle teorik sinerji
• Klinik kanıt tabanı güçlü iki ajan (Sulfosalazin, İndometazin)
Tezin Zayıflıkları
• Klinik çalışma eksikliği
• NSAİİ kaynaklı toksisite riski
• Ergotamin’in uzun süreli kullanım riskleri
• Bireysel farmakogenetik farklılıklar
Tartışma
Bu çalışmada geliştirilen teorik model, Caroverin, Sulfosalazin, İndometazin ve Ergotamin bileşenlerinden oluşan bir farmakolojik kombinasyonun, çölyak hastalığının çok katmanlı patogenezine yönelik çoklu mekanizma temelli bir müdahale sağlayabileceğini öngörmektedir. Bu yaklaşım, yalnızca tek bir hedefi değil, hastalığın temel patofizyolojik eksenlerini oluşturan gluten sunumu, TG2 aktivasyonu, otoantikor üretimi, innate immün yanıt, epitel bariyer bozulması, mikrobiyal tetiklenmeler ve genetik varyasyonlara bağlı inflamatuvar aktivasyon gibi çoklu süreçleri eş zamanlı hedeflemektedir. Böylece çalışma, monoterapötik stratejilerden farklı olarak, çölyak hastalığının ağ yapısındaki patogenez zincirine sistematik bir yaklaşım önermektedir.
1. Patogenez Zincirine Çoklu Müdahale Yaklaşımı
Çölyak hastalığı, klasik olarak HLA-DQ2/DQ8 aracılı T hücre aktivasyonu ve gluten duyarlılığı ile tanımlansa da, güncel veriler innate immün yanıt, epitel stres, sitokin kaskatları, mikrobiyota disbiyozu ve non-HLA genetik faktörlerin hastalığın kronikleşmesinde kritik rol oynadığını göstermektedir (2,8). Bu çalışma, bu eksenleri birbirine bağlayan entegre bir patogenez modeli önermekte ve her bir basamağa uygun farmakolojik hedef belirlemektedir:
• Sulfosalazin → NF-κB baskısı ile sitokin fırtınasını, IL-15 ve TNF-α üretimini, TG2 transkripsiyonunu sınırlar.
• İndometazin → COX-1/2 inhibisyonu ve PPARγ aktivasyonu ile inflamatuvar mikroçevreyi düzenler, PGE₂ ve epitel geçirgenliği azaltır.
• Caroverin → ROS ve Ca²⁺ sinyali kontrolü ile epitel stresini ve Ca²⁺ bağımlı TG2 aktivasyonunu baskılar.
• Ergotamin → sınırlı ve dolaylı etkiler sunar, akut ödemi azaltabilir ancak kronik kullanımı risklidir.
Bu kombinasyon, çölyak hastalığının tek bir düzeyde değil, moleküler – hücresel – dokusal eksenlerde kapsamlı regülasyon sağlamayı hedefler.
2. TG2 Aktivitesi ve İnflamatuvar Mikroçevre Arasındaki Etkileşim
TG2 aktivitesi, çölyak patogenezinin merkezinde yer almakla birlikte, inflamasyon ve oksidatif stres gibi çevresel faktörlerle güçlü biçimde modüle edilir (8).
Tek başına TG2 inhibitörlerinin başarısız olmasının başlıca nedeni, bu çevresel indükleyicilerin baskılanmamış olmasıdır. Çalışmamızda önerilen kombinasyonda, Sulfosalazin’in NF-κB baskısı, İndometazin’in PGE₂ azaltıcı etkisi ve Caroverin’in antioksidan kapasitesi, TG2 inhibitörlerinin etkinliğini artırabilecek “upstream sinyal baskısı” sağlar. Böylece, enzimatik inhibisyon transkripsiyonel ve çevresel düzeyde desteklenir; bu durum, farmakodinamik sinerji açısından özgün bir katkı sunar.
3. Innate Immün Aktivasyon ve IL-15 Ekseninde Baskılama
Çölyakta p31-43 alfa-gliadin peptidi aracılığıyla başlayan innate immün yanıt, IL-
15 üretimi ve IEL aktivasyonu üzerinden epitel yıkımını başlatır (2). Mevcut kombinasyonda:
• Caroverin, Ca²⁺ bağımlı IEL sitotoksisitesini baskılar.
• Sulfosalazin, IL-15 gen ekspresyonunu azaltır.
• İndometazin, COX-PPARγ ekseni üzerinden IL-15 transkripsiyonunu sınırlar. Bu çoklu etki, innate yanıtın tetiklediği epitel hasar döngüsünü kırma potansiyeli taşır.
4. Mikrobiyota ve Viral Tetiklenme Boyutu
Son yıllarda reovirüs ve rotavirüs gibi enterik enfeksiyonların, IFN-α/IL-15 ekseni üzerinden çölyak aktivasyonuna katkı sunduğu; disbiyozun ise bariyer bozulmasını ve antijen translokasyonunu artırdığı gösterilmiştir (8).
Bu bağlamda, Sulfosalazin’in antimikrobiyal sülfapiridin bileşeni, mikrobiyal ekolojiyi dengeleyici potansiyel taşır; Caroverin ise viral stres sonrası ROS artışını baskılayarak epitel hasarını sınırlayabilir. Bu iki ajan, çevresel tetiklenmeleri hedefleyen immünolojik tamponlama etkisi oluşturur.
5. Non-HLA Genetik Faktörlerin Modülasyonu
IL2, IL21, REL ve TNFAIP3 gibi genlerdeki polimorfizmler, sitokin üretiminde artış ve immün regülasyon kaybı ile ilişkilidir (8).
• Sulfosalazin, NF-κB baskısı ile REL/TNFAIP3 aktivitesini sınırlandırır.
• İndometazin, PPARγ üzerinden proinflamatuvar gen ekspresyonlarını dengeleyebilir.
Bu özellik, genetik varyasyonların neden olduğu persistan inflamasyonu baskılamada özgün bir terapötik değer sunar.
6. Teorik Üstünlükler ve Yenilikçi Katkı
Bu tez, çölyak hastalığını çok eksenli bir hastalık modeli olarak ele alması bakımından literatüre katkı sunar.
• Çoklu hedefli (multi-targeted) yaklaşım, klasik tek odaklı tedavilere kıyasla daha sistemik bir iyileşme potansiyeli taşır.
• Sinerjistik ilaç etkileşimleri, her bileşenin diğerinin eksik kaldığı basamakları tamamlamasına olanak verir.
• İnflamasyon – oksidatif stres – epitel bariyer – genetik regülasyon eksenlerinin birlikte hedeflenmesi, patogenez bütünlüğüne uygun bir strateji sunar.
Bu kombinasyon, yalnızca semptomatik rahatlama değil, hastalığın moleküler sürücülerini hedefleyerek nedensel (etiopatogenetik) düzeyde etki etme potansiyeline sahiptir.
7. Kısıtlılıklar ve Gelecek Perspektifi
Tezin teorik yapısı güçlü olsa da, bu modelin klinik uygulanabilirliği henüz randomize kontrollü çalışmalarla doğrulanmamıştır.
• İndometazin ve Sulfosalazin’in gastrointestinal toksisite riski dikkate alınmalıdır
(4).
• Ergotamin’in iskemik potansiyeli, uzun süreli kullanımda sınırlayıcı faktör oluşturur (7).
• Farmakogenetik varyasyonlar (örneğin MRP4 polimorfizmleri) bireyler arası farklı yanıt olasılığını doğurabilir (10).
Bu nedenle, gelecekte yapılacak in vitro modeller, hayvan çalışmaları ve biyobelirteç temelli klinik denemeler, kombinasyonun biyolojik etkilerini, güvenlik profilini ve translasyonel değerini belirlemede kritik öneme sahiptir.
Bu teorik çalışma, çölyak hastalığının patogenezine çok boyutlu yaklaşan bir farmakolojik stratejinin; TG2 inhibitörleri, NF-κB baskılayıcılar, COX/PPARγ modülatörleri ve antioksidan ajanların birlikte kullanımını temel alan yenilikçi bir model sunduğunu göstermektedir. Kombinasyon, moleküler sinerji, inflamatuvar kontrol, epitel koruma ve genetik modülasyon eksenlerinde güçlü bir potansiyel taşımaktadır. Klinik uygulamaya geçiş öncesinde, etkinlik, güvenlilik ve farmakodinamik etkileşimlerin deneysel olarak doğrulanması gereklidir.
Bu model, çölyak hastalığı tedavisinde farmakolojik müdahaleyi yeniden tanımlayabilecek bir teorik temel oluşturmakta; yalnızca diyetle sınırlı yaklaşımı aşarak moleküler hedefli çoklu tedavi paradigmasına geçiş için kavramsal bir çerçeve sunmaktadır.
Sonuç
Caroverin, Sulfosalazin, Ergotamin ve İndometazin kombinasyonu, çölyak hastalığının patogenezinde çoklu hedeflere müdahale eden teorik bir strateji sunar. Klinik kanıtı en güçlü ajanlar Sulfosalazin ve İndometazin’dir. Ancak kombinasyonun güvenlik ve etkinlik profili, randomize kontrollü çalışmalarla doğrulanmalıdır.
Kaynakça
1. Fasano A, Catassi C. Clinical practice. Celiac disease. N Engl J Med.
2012;367(25):2419–26.
2. Schuppan D, Zimmer KP. The diagnosis and treatment of celiac disease. Dtsch Arztebl Int. 2013;110(49):835–46.
3. Sandborn WJ. Sulfasalazine and 5-aminosalicylates in inflammatory bowel disease. Aliment Pharmacol Ther. 2012;36(3):123–37.
4. Wallace JL. Prostaglandins, NSAIDs, and gastrointestinal injury: clinical and experimental aspects. J Gastroenterol. 2012;47(3):295–305.
5. Ahmadi S et al. PPAR-γ activation and immune regulation in intestinal inflammation. World J Gastroenterol. 2019;25(25):3003–17.
6. Kaur T, et al. Caroverine: pharmacological profile and potential therapeutic applications. CNS Drugs. 2015;29(1):29–45.
7. Silberstein SD. Ergotamine and dihydroergotamine: history, pharmacology, and efficacy. Headache. 2015;55 Suppl 1:4–18.
8. Caminero A, Verdu EF. Microbiome–gluten interactions in celiac disease. Gut Microbes. 2019;10(3):234–44.
9. Bjarnason I, Hayllar J, MacPherson AJ, Russell AS. Side effects of NSAIDs on the small and large intestine in humans. Gastroenterology. 1993;104(6):1832–47.
10. Maiden L. NSAID-induced small bowel injury: an overview. Curr Opin Gastroenterol. 2009;25(6):623–31.
11. Lee CR, et al. Genetic polymorphisms of MRP4/ABCC4 and NSAID pharmacokinetics. Pharmacogenomics. 2013;14(8):971–85.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...