POLİKİSTİK OVER SENDROMU İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
POLİKİSTİK OVER SENDROMU İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
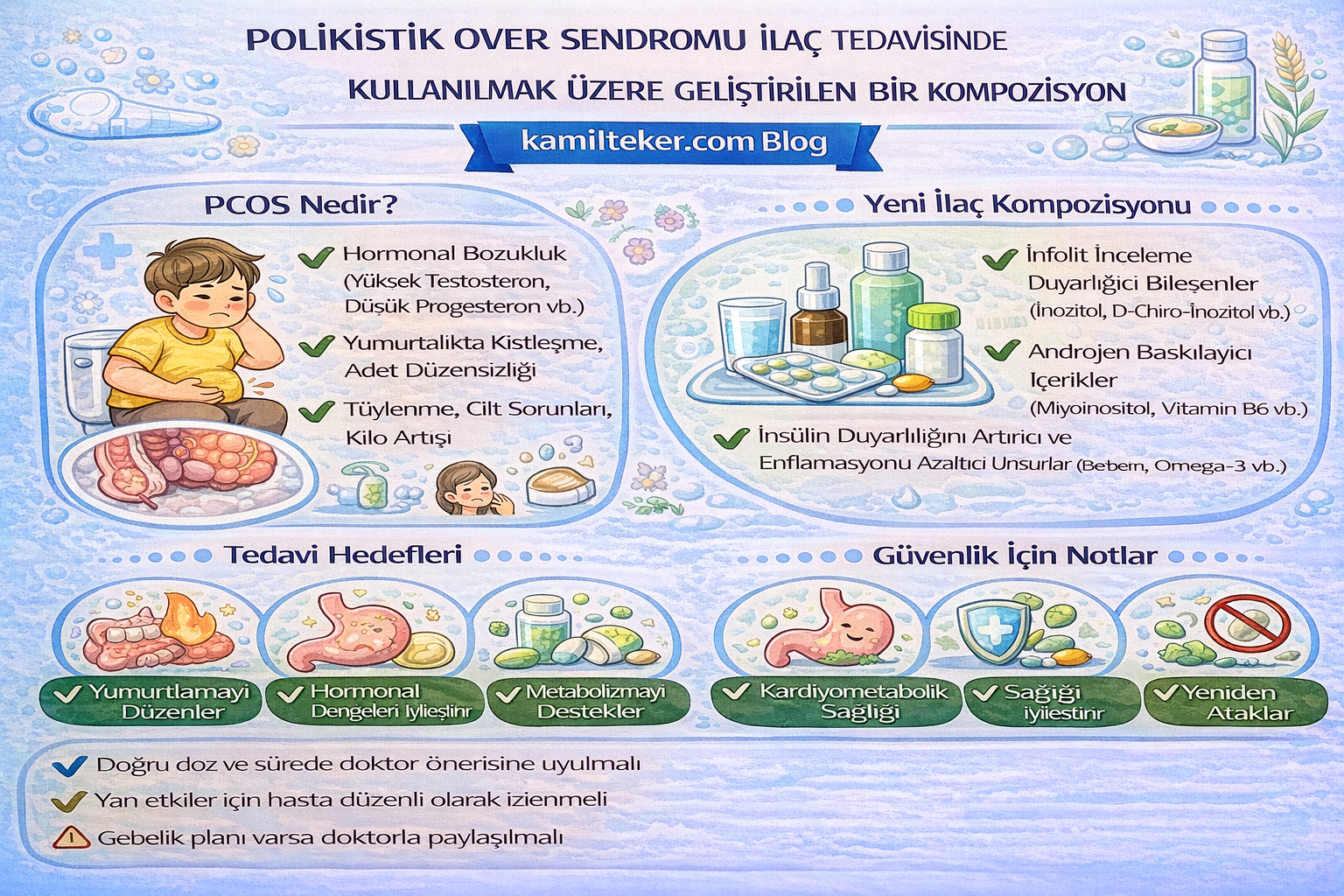
Buluş; Polikistik over sendromunda, medikal tedavisi için geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Rifabutin (1), 1x1, Hexobendine (2) 1x1 ve Feprazone (3) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Polikistik Over Sendromu (PCOS), üreme çağındaki kadınların yaklaşık %10’unda görülen, hormonel, metabolik ve inflamatuvar bileşenleri olan multifaktöriyel bir endokrin bozukluktur. Hastalık; kronik anovülasyon, hiperandrojenizm ve sıklıkla insülin direnci ile karakterizedir. Moleküler düzeyde NFκB/NLRP3 inflamasyon aktivasyonu, AMPK/mTOR dengesizliği, oksidatif stres ve bağırsak mikrobiyota disbiyozu patogenezde önemli rol oynar.
Bu karmaşık etkileşim ağı nedeniyle tek hedefli tedaviler genellikle yetersiz kalmakta, inflamatuvar, metabolik ve vasküler eksenleri eşzamanlı hedefleyen multimodal yaklaşımlar gerekmektedir. Bu bağlamda, Rifabutin–Hexobendine–Feprazone kombinasyonu; inflamasyonun baskılanması, metabolik dengenin sağlanması ve mikrosirkülasyonun iyileştirilmesi yoluyla bütüncül bir tedavi potansiyeli sunmaktadır. Polikistik over sendromu ilaç tedavisi ve dozları
1- Rifabutin 1x1
2- Hexobendine 1x1
3- Feprazone 2x1
Polikistik over sendromu ilaç tedavisi protokolü:
1- Tedaviye üç ilaç beraber kullanılarak verilmeli
2- İlaç tedavisine başlamak için en az iki ilaç yeterli
3- Doktor Teker VitalPekmez gıda desteği verilmeli
4- İlaç Tedavi süresi 1 - 1,5 ay
5- Tedavi başarı beklentisi % 90
6- Hastalık nüks ederse tedavi aynen tekrarlanabilir
7- Tam düzelme için gerekirse tedavi bittikten 45 gün sonra aynı tedavi protokolü tekrar verilebilir
Polikistik over sendromu ilaç tedavisi destek tedavi özellikleri
1- Bitkisel tedavisi yok
2- Ozon terapi geçersiz
3- Biyorezonans geçersiz
4- Karın ve bel bölgesine kupa terapi olabilir
5- Sülük tedavisi geçersiz
6- Proloterapi geçersiz
7- Mezoterapi geçersiz
8- Mikrosirkülasyon desteği olabilir
9- Akupunktur geçersiz
10- Manuel terapi omurga mobilizasyonu için olabilir
11- Kuru iğne terapi geçersiz
12- Tıbbi masaj: omurga kireçlenme tedavisi için Doktor Teker Masaj Kremi ile olabilir:
Her bir bölge için 21 – 30 gün ve günde iki defa
13- Postural düzenleme olabilir
Polikistik Over Sendromu İlaç Tedavi Protokolü: Teorik Bilimsel Analiz
Bu tedavi protokolü, Polikistik Over Sendromu (PCOS) gibi multifaktöriyel bir hastalığın patogenezinde yer alan farklı biyolojik eksenleri eşzamanlı olarak hedefleyen çok bileşenli bir yaklaşım sunmaktadır. Protokol, üç ilacın kombinasyon halinde kullanıldığı bir tedavi modelini esas alır. Tedaviye başlanırken en az iki bileşenin birlikte kullanılması yeterli görülmekte; üçüncü ajan, tedaviye kademeli olarak eklenmektedir. Bu model, organizmanın ilaç yüküne adaptasyonunu kolaylaştırır ve olası yan etkilerin kontrolünü sağlar. Tedavi süresi, yaklaşık 1–1,5 ay (4– 6 hafta) olarak belirlenmiştir. Bu süre, hem moleküler düzeyde yeniden programlamayı başlatmak hem de klinik yanıtı gözlemlemek açısından yeterli bir biyolojik pencere sunar. Protokolün temel amacı, metabolik, immün ve hormonal eksenleri hedef alarak kısa sürede biyolojik yeniden yapılanma sağlamaktır.
Bu yaklaşımın teorik temeli, PCOS’un çok boyutlu patogenezine dayanmaktadır. PCOS’ta metabolik eksende insülin direnci, mTOR aktivasyonu ve lipid birikimi; immün-inflamatuvar eksende NF-κB aktivasyonu, IL-6 ve TNF-α artışı, NLRP3 inflamozomu aktivasyonu; vasküler eksende endotelyal disfonksiyon ve oksidatif stres; mikrobiyota ekseninde ise disbiyoz ve LPS–TLR4 aracılı inflamasyonun rol aldığı bilinmektedir [1–3]. Bu çoklu mekanizmalar, hastalığın tek bir ilaçla tam olarak kontrol altına alınmasını güçleştirmektedir. Monoterapiler (örneğin metformin, oral kontraseptifler veya antiandrojenik ajanlar), yalnızca belirli patojenik yolları hedefleyebilmekte; sistemik dengeyi tam olarak sağlayamamaktadır. Bu nedenle, çok bileşenli ve sinerjik etkiye sahip kombinasyon tedavileri, kapsamlı bir farmakodinamik yanıt oluşturmak için daha uygun bir yaklaşım sunmaktadır.
Üçlü kombinasyonun farmakolojik rasyonalitesi, her bir bileşenin farklı ancak birbirini tamamlayan sinyal yolaklarını hedeflemesidir. Rifabutin, NF-κB ve NLRP3 eksenlerini baskılayarak proinflamatuvar sitokinlerin (IL-6, TNF-α) salınımını azaltır ve immün modülasyon sağlar. Hexobendine, adenozin aracılı AMPK aktivasyonunu uyararak mTOR baskısı oluşturur, insülin duyarlılığını artırır ve metabolik dengeyi destekler. Feprazone ise COX-2 inhibisyonu yoluyla inflamasyonu sınırlandırır ve reaktif oksijen türlerini (ROS) azaltarak oksidatif stresi kontrol altına alır [4–6]. Bu üç ajan birlikte kullanıldığında, immün, metabolik ve oksidatif süreçlerde tamamlayıcı etkiler meydana getirir. Ayrıca tedaviye iki ajanla başlanıp üçüncü ajan kademeli olarak eklendiğinde, organizmanın farmakodinamik yüklenmeye uyumu kolaylaşır ve yan etki profili dengelenir.
Tedavi süresi olarak önerilen 1–1,5 aylık dönem, hem moleküler hem de klinik düzeyde anlamlı değişiklikler oluşturmak için yeterlidir. Araştırmalar, AMPK aktivasyonu ve inflamatuvar yanıtın baskılanması gibi biyokimyasal etkilerin genellikle 3–6 hafta içinde ortaya çıktığını göstermektedir. Ayrıca bu süre, ortalama 28–35 günlük ovaryan döngü boyunca en az bir tam siklusun etkilenmesine olanak tanıyarak folikülogenezin yeniden düzenlenmesine katkı sağlar [7,8]. Böylece inflamatuvar yük azalır, hormonal denge desteklenir ve ovulatuar fonksiyonlar iyileşir.
Bu tedavi modelinin teorik biyolojik etkileri, çoklu hedeflerin düzenlenmesiyle ortaya çıkar. NF-κB, NLRP3, IL-6 ve TNF-α gibi inflamatuvar yolakların baskılanması kronik inflamasyonu azaltır ve ovaryan stromal fibrozisin ilerlemesini sınırlandırır. AMPK aktivasyonu ve mTOR baskısı, insülin duyarlılığını artırarak glukoz homeostazını sağlar ve metabolik dengenin yeniden kurulmasına katkı sunar. COX-2 inhibisyonu ve ROS azalması, ovaryan hücrelerde oksidatif stresin azalmasına yol açar; bu da oosit kalitesini artırır ve ovulasyon sürecini destekler. NO–eNOS aktivasyonunun uyarılması mikrosirkülasyonu iyileştirir, dokuların oksijenlenmesini artırır ve vasküler tonusu dengeler. Mikrobiyal düzeyde ise LPS–TLR4 aktivasyonunun baskılanmasıyla sistemik inflamatuvar yük azalır ve mikrobiyota-immün-metabolik eksen dengelenir.
Bu kombinasyonun bilimsel avantajları arasında kısa sürede etkili olması, farklı hedeflerdeki ajanların sinerjistik şekilde birbirini tamamlaması, iki ajanla başlanıp üçlüye tamamlanarak adaptif bir yükleme modeli sunması, biyolojik yeniden ayarın reversibl (geri döndürülebilir) olması ve kronik ilaç yükünü azaltarak uzun süreli monoterapi ihtiyacını azaltması sayılabilir. Bu yönüyle protokol, kısa süreli ama çok yönlü bir farmakolojik düzenleme stratejisi olarak öne çıkmaktadır.
Bununla birlikte, protokolün bazı bilimsel sınırlılıkları bulunmaktadır. Henüz doğrudan bu kombinasyonu test eden bir klinik çalışma bulunmamaktadır. Özellikle Rifabutin gibi enzim indükleyici ajanların farmakokinetik etkileşimleri dikkatle izlenmelidir. Tedavi süresince biyobelirteç temelli izlem yapılması (örneğin IL-6, HOMA-IR, ROS düzeyleri, AMPK fosforilasyonu gibi parametrelerin ölçülmesi) önerilir. Ayrıca, folikül gelişimi ve LH/FSH oranı gibi reprodüktif göstergelerin takibiyle klinik yanıtın değerlendirilmesi önemlidir.
Sonuç olarak, bu üçlü veya ikili kombinasyon, PCOS’un temel patojenik halkalarına eşzamanlı müdahale ederek kısa sürede sistemik iyileşme sağlamayı amaçlamaktadır. 1–1,5 aylık tedavi süresi, biyolojik yeniden düzenleme için uygun bir zaman penceresi sunar. Bu yaklaşım, klasik monoterapilere kıyasla daha dinamik, bütüncül ve biyolojik hedeflere dayalı bir tedavi modeli sunmakta; PCOS yönetiminde yeni bir terapötik paradigma önerisi olarak değerlendirilmektedir [2,5,7].
Rifabutin, Hexobendine ve Feprazone İçeren Kombinasyonun Polikistik Over
Sendromu (PCOS) Tedavisindeki Teorik Potansiyeli
1. Giriş
Polikistik Over Sendromu (PCOS), reprodüktif çağdaki kadınların yaklaşık %10’unda görülen, endokrin-metabolik bir sendromdur. İnsülin direnci, kronik düşük dereceli inflamasyon, hiperandrojenizm, epigenetik değişiklikler ve bağırsak mikrobiyotasındaki dengesizlikler, hastalığın patogenezinde kilit rol oynamaktadır [1,2]. Bu nedenle tek hedefli tedavi stratejileri çoğu zaman yetersiz kalmakta; multimodal, çoklu yolaklara müdahale eden yaklaşımlar ön plana çıkmaktadır. Bu çalışmada önerilen Rifabutin–Hexobendine–Feprazone kombinasyonu, PCOS’un multifaktöriyel doğasına uygun olarak immün-inflamatuvar, metabolik ve vasküler eksenleri eşzamanlı hedefleyen teorik bir model sunmaktadır.
2. Moleküler Temeller ve Bileşenlerin Etki Profili
2.1 Rifabutin
Rifabutin, klasik olarak rifamisin türevi bir antimikrobiyal ajan olarak tanımlansa da, son yıllarda immünomodülatör ve anti-inflamatuvar özellikleri nedeniyle
metabolik ve inflamatuvar sendromların yönetiminde dikkat çekmeye başlamıştır.
Özellikle makrofaj polarizasyonunu proinflamatuvar M1 fenotipinden antiinflamatuvar M2 fenotipine yönlendirme kapasitesi, NF-κB ve NLRP3 inflamozom ekseni üzerindeki baskılayıcı etkileriyle birlikte değerlendirildiğinde, Rifabutin’in PCOS’ta gözlenen kronik düşük dereceli inflamasyonun azaltılmasında teorik olarak önemli bir rol üstlenebileceği öne sürülmektedir [3].
PCOS’un patogenezinde NF-κB aktivasyonu, IL-6, TNF-α ve IL-1β gibi proinflamatuvar sitokinlerin artışıyla yakından ilişkilidir. Bu sitokinler, ovaryan stromal hücrelerde inflamatuvar yanıtı güçlendirerek fibrozis, stroma sertleşmesi ve foliküler disfonksiyon gibi yapısal değişikliklere neden olur. Aynı zamanda inflamasyonun sürmesi, insülin sinyalizasyonunu bozan mekanizmaları tetikleyerek insülin direncini artırır ve hiperandrojenizmi şiddetlendirir. Rifabutin, NF-κB yolunun inhibisyonu ve IL6/TNF-α ekspresyonunun baskılanması yoluyla bu inflamatuvar kısır döngüyü kırma potansiyeline sahiptir. Bu mekanizma aracılığıyla Rifabutin, yalnızca sistemik inflamasyonu azaltmakla kalmaz, aynı zamanda ovaryan mikroçevrede inflamasyon kaynaklı hormonal dengesizliklerin hafifletilmesine de katkı sağlar. Böylece hiperandrojenizmin azalması, folikülogenezin normalleşmesi ve ovulatuar kapasitenin artması mümkün hale gelebilir.
Rifabutin’in PCOS üzerindeki potansiyel etkilerinden bir diğeri ise bağırsak mikrobiyotasının modülasyonu yoluyla gerçekleşir. Son yıllarda yapılan çalışmalar, PCOS’ta bağırsak disbiyozunun (özellikle Firmicutes/Bacteroidetes oranındaki bozulma) lipopolisakkarit (LPS) düzeylerinde artışa yol açtığını ve bunun da TLR4 aracılığıyla NF-κB aktivasyonunu tetiklediğini ortaya koymuştur. Bu mekanizma, mikrobiyota–immün–metabolik eksen üzerinden sistemik inflamatuvar yükü artırmakta ve insülin direnci ile androjen fazlalığına zemin hazırlamaktadır. Rifabutin, geniş spektrumlu antimikrobiyal etkisiyle özellikle patojenik Gram-negatif bakterilerin baskılanmasına, dolayısıyla LPS üretiminin azalmasına katkıda bulunabilir. Bunun sonucunda TLR4 aktivasyonu sınırlanır, NF-κB sinyalizasyonu zayıflar ve kronik inflamasyonun kaynağı olan bağırsak kaynaklı uyarılar dengelenir. Bu etkiler, Rifabutin’in PCOS’ta yalnızca ovaryan düzeyde değil, aynı zamanda sistemik inflamatuvar yükü azaltma potansiyelini de güçlendirmektedir.
Ayrıca Rifabutin’in makrofajlar üzerindeki immün yeniden programlama etkisi, inflamatuvar mikroçevrenin çözülmesini desteklerken antiinflamatuvar sitokinlerin (IL10, TGF-β) artışına da katkı sağlayabilir. Bu immün yeniden dengeleme, PCOS’ta sıklıkla görülen Th1/Th2 dengesizliğinin normalleşmesine yardımcı olarak, ovaryan dokuda daha fizyolojik bir immün yanıt ortamı oluşturabilir. Bu yönüyle Rifabutin, PCOS’un immün-inflamatuvar eksenine yönelik hedefe özgü bir modülatör ajan olarak değerlendirilebilir.
Sonuç olarak Rifabutin, PCOS’ta rol oynayan NF-κB/NLRP3 inflamasyon döngüsünü baskılayan, proinflamatuvar sitokin üretimini azaltan ve mikrobiyota kaynaklı inflamatuvar uyarıları sınırlayan çok boyutlu bir etki profiline sahiptir. Bu özellikleriyle, PCOS’un temel patogenetik halkalarından biri olan kronik düşük dereceli inflamasyonun kontrol altına alınmasında teorik olarak güçlü bir farmakolojik aday olarak öne çıkmaktadır [3].
2.2 Hexobendine
Hexobendine, farmakolojik olarak bir adenozin geri alım inhibitörü (adenosine reuptake inhibitor) olarak tanımlanır ve bu özelliği sayesinde ekstrasellüler adenozin düzeylerini artırarak mikrosirkülasyon, endotel fonksiyonları ve metabolik denge üzerinde çok yönlü etkiler oluşturur [4]. Adenozin, hücresel stres veya inflamasyon koşullarında salınan önemli bir nükleozit sinyal molekülü olup, özellikle A2A ve A2B reseptörleri üzerinden antiinflamatuvar, antioksidan ve vazodilatör etkilere aracılık eder. Hexobendine’in adenozin birikimini artırması, bu reseptörlerin uyarılması yoluyla PCOS’un patogenezinde rol oynayan üç temel süreçte—metabolik yeniden programlama, endotel disfonksiyonunun düzeltilmesi ve ovaryan mikrosirkülasyonun iyileştirilmesi—önemli terapötik potansiyel taşır.
Moleküler düzeyde Hexobendine, adenozin–A2A reseptör aktivasyonu yoluyla AMPK (AMP-activated protein kinase) sinyal yolunu uyarır. AMPK, hücresel enerji sensörü olarak görev yapar ve aktivasyonu sonucunda mTOR (mammalian target of rapamycin) yolunun baskılanmasına, lipid sentezinin azalmasına, glukoz alımının artmasına ve yağ asidi oksidasyonunun güçlenmesine yol açar. Bu süreç, PCOS’ta sıklıkla görülen insülin direnci, hiperinsülinemi ve dislipidemi gibi metabolik bozuklukların düzelmesine katkı sağlar. AMPK aktivasyonu aynı zamanda SREBP1 kaynaklı lipogenez artışını da baskılayarak, hücre içi enerji metabolizmasının yeniden dengelenmesini sağlar. Dolayısıyla Hexobendine, adenozin aracılığıyla AMPK/mTOR eksenini düzenleyerek PCOS’un metabolik ekseninde önemli bir yeniden programlama etkisi oluşturabilir.
Hexobendine’in bir diğer önemli etkisi, endotelyal fonksiyonlar üzerindedir. PCOS’ta sık rastlanan endotelyal disfonksiyon ve oksidatif stres, NO (nitrik oksit) biyoyararlanımında azalmaya, buna bağlı olarak da vazokonstriksiyon, doku hipoksisi ve mikrosirkülasyon bozukluklarına yol açar. Adenozin birikimiyle uyarılan A2A reseptör aktivasyonu, eNOS (endotelyal nitrik oksit sentaz) ekspresyonunu ve aktivitesini artırarak NO üretimini yükseltir. Böylece oksidatif stres azalır, damar genişlemesi (vazodilatasyon) sağlanır ve doku oksijenlenmesi artar. Bu mekanizma, yalnızca vasküler disfonksiyonu düzeltmekle kalmaz; aynı zamanda ovaryan stromada dolaşımı iyileştirerek folikül gelişimi, oosit kalitesi ve ovulatuar kapasite üzerinde olumlu etkiler oluşturabilir.
Ovaryan düzeyde, Hexobendine’in mikrosirkülasyonu destekleyici etkisi, foliküler mikroçevrede oksijen ve besin maddesi dağılımını optimize eder. Bu durum, PCOS’ta sık görülen foliküler atrezi ve anovülasyon süreçlerinin önlenmesine yardımcı olabilir. Mikrosirkülasyonun artmasıyla birlikte foliküler hücrelerde hipoksiye bağlı stres yanıtı azalır, granüloza hücre fonksiyonları korunur ve folikülogenez daha fizyolojik bir şekilde ilerler. Bu süreç, dolaylı olarak steroidogenez dengesi ve hormonel regülasyonun iyileşmesine katkıda bulunabilir.
Bununla birlikte, Hexobendine’in adenozin aracılı etkileri sadece metabolik ve vasküler süreçlerle sınırlı değildir. Adenozin–A2A sinyali, NF-κB aktivasyonunu baskılayarak IL-6, TNF-α gibi proinflamatuvar sitokinlerin üretimini de azaltabilir. Bu sayede Hexobendine, Rifabutin’in inflamasyon baskılayıcı etkileriyle birlikte immüninflamatuvar eksen üzerinde sinerjik bir katkı sağlayabilir. Ayrıca, adenozin–cAMP–PKA yolunun uyarılması ile antioksidan enzimlerin (SOD, katalaz, glutatyon peroksidaz) aktivitesi artar ve bu durum ROS (reaktif oksijen türleri) kaynaklı hücresel hasarı sınırlandırır. Böylece Hexobendine, hem oksidatif stresi azaltıcı, hem de mitokondriyal fonksiyonu koruyucu bir ajan olarak değerlendirilebilir.
Sonuç olarak Hexobendine, adenozin metabolizması üzerinden çalışan çok yönlü bir moleküldür. AMPK aktivasyonu, mTOR baskısı, NO üretimi artışı ve mikrosirkülasyonun iyileştirilmesi yoluyla PCOS’un metabolik, vasküler ve oksidatif bileşenlerine müdahale eder. Bu özellikleriyle Hexobendine, PCOS tedavisinde sistemik dengeyi yeniden kurmaya yönelik multimodal bir tedavi modelinde teorik olarak güçlü bir tamamlayıcı ajan konumundadır [4,6,8].
2.3 Feprazone
Feprazone, non-steroidal antiinflamatuvar ilaçlar (NSAID) grubunda yer alan ve özellikle siklooksijenaz (COX) enzimlerini inhibe eden bir ajandır. Bu özelliği sayesinde prostaglandin sentezini düzenleyerek düşük dereceli kronik inflamasyonu hedefler [5]. PCOS’un patogenezinde önemli rol oynayan COX-2 aktivitesi, ovaryan stromada inflamatuvar mikroçevreyi güçlendirir; prostaglandin E2 (PGE2) artışı, lokal vasküler geçirgenlik, ödem, fibrozis ve hücre proliferasyonu gibi süreçleri tetikler. Feprazone’un COX-2 inhibisyonu, bu patolojik döngünün kırılmasına katkı sağlar ve ovaryan doku bütünlüğünün korunmasına yardımcı olur.
Moleküler düzeyde Feprazone’un temel etkilerinden biri, COX-2/PGE2 ekseninin baskılanmasıdır. PCOS’ta artmış COX-2 ekspresyonu, sadece inflamasyonu değil, aynı zamanda fibroblast aktivasyonu ve ekstrasellüler matriks birikimi üzerinden fibrogenezi de teşvik eder. Feprazone’un COX-2 inhibisyonu ile PGE2 sentezinin azalması, stroma dokusunda inflamatuvar hücre infiltrasyonunun ve fibroblast aktivitesinin azalmasına yol açar. Bu mekanizma, ovaryan mikroçevrede fibrotik yeniden yapılanmayı sınırlandırarak folikülogenezin daha fizyolojik koşullarda gerçekleşmesine katkı sağlar. Ayrıca PGE2’nin azalması, lokal oksidatif stresi azaltır ve hücre içi ROS üretimini sınırlandırır; bu durum oosit kalitesi ve ovaryan fonksiyon açısından olumlu etki yaratır.
Feprazone’un ikinci önemli etkisi, insülin duyarlılığı üzerindedir. Kronik inflamasyon, serin kinaz aktivasyonu yoluyla insülin reseptör substratlarının (IRS-1/2) fosforilasyonunu değiştirir ve insülin sinyal yolunu bozar. Bu mekanizma, PCOS’ta sık gözlenen insülin direncinin (IR) moleküler temelini oluşturur. Feprazone’un inflamatuvar sinyalleri (özellikle IL-6, TNF-α) baskılayarak bu süreci engellemesi, dolaylı olarak insülin sinyalizasyonunun yeniden düzenlenmesine ve glukoz homeostazının iyileşmesine katkı sağlar. Bu sayede, metabolik denge desteklenirken, hiperandrojenizm gibi insülin aracılı sekonder etkiler de hafifleyebilir.
Ek olarak Feprazone, NF-κB sinyalizasyonunun dolaylı baskılanmasına katkıda bulunur. COX-2 inhibisyonu, prostaglandin aracılı pozitif geri besleme döngüsünü kırarak NF-κB’nin nükleer translokasyonunu sınırlar. Bu durum, proinflamatuvar gen ekspresyonunun azalmasına yol açar. Rifabutin ile birlikte kullanıldığında bu etki belirgin şekilde güçlenir; çünkü Rifabutin doğrudan NF-κB/NLRP3 eksenini inhibe ederken, Feprazone bu eksenin aşağı akışındaki prostaglandin aracılı inflamatuvar sinyalleri baskılar. Böylece iki ajan, komplemanter ve sinerjistik bir şekilde inflamatuvar süreçleri çok düzeyli olarak inhibe eder. Bu sinerjik etki, ovaryan stromadaki inflamasyon-fibrozis döngüsünün çözülmesine ve doku homeostazının yeniden sağlanmasına yardımcı olabilir.
Feprazone ayrıca oksidatif stres üzerinde de doğrudan etkili olabilir. COX-2 aracılı reaksiyonlar sırasında reaktif oksijen türleri (ROS) oluştuğu bilinmektedir. COX-2 inhibisyonu, bu reaksiyonları sınırlayarak hücre içi ROS üretimini azaltır. Böylece Feprazone, mitokondriyal fonksiyonu koruyabilir ve ovaryan hücrelerde oksidatif hasarı sınırlandırabilir. Bu durum, PCOS’ta sıklıkla gözlenen oosit dejenerasyonu, foliküler gelişim bozukluğu ve ovulasyon eksikliğinin iyileştirilmesine katkıda bulunur.
Sonuç olarak Feprazone, PCOS’un kronik inflamatuvar ve oksidatif stres bileşenlerine yönelik etkili bir farmakolojik ajan olarak teorik önem taşımaktadır. COX2/PGE2 ekseninin baskılanması, ROS üretiminin azalması ve NF-κB sinyalizasyonunun zayıflatılması yoluyla, hem inflamatuvar mikroçevreyi hem de metabolik dengeyi olumlu yönde etkileyebilir. Rifabutin ve Hexobendine ile birlikte kullanıldığında, Feprazone’un bu etkileri sinerjistik bir tedavi çerçevesinde güçlenir; böylece PCOS’un metabolik–immün–vasküler eksenlerine yönelik bütüncül bir müdahale modeli oluşturulur [5,8].
3. Kombinasyonun Sinerjik Etki Modeli
Rifabutin, Hexobendine ve Feprazone’dan oluşan bu üçlü kombinasyon, Polikistik Over Sendromu’nun (PCOS) multifaktöriyel patogenezinde yer alan temel biyolojik eksenleri — yani inflamatuvar, metabolik ve mikrovasküler süreçleri — eşzamanlı olarak hedefleyerek kompleks ve sinerjistik bir etki modeli ortaya koymaktadır. Bu sinerjik yapı, her bir bileşenin özgün farmakolojik profili sayesinde farklı patojenik halkalar üzerinde birbirini tamamlayıcı ve etkileşimli bir biçimde etki gösterir. Böylece hastalığın temel biyokimyasal düzensizlikleri aynı anda düzeltilerek sistemik homeostazın yeniden kurulması amaçlanır.
Kombinasyonun ilk bileşeni olan Rifabutin, güçlü bir NF-κB inhibitörü olarak proinflamatuvar sitokinlerin (IL-6, TNF-α, IL-1β) ekspresyonunu baskılar ve NLRP3 inflamozomu aktivasyonunu sınırlayarak ovaryan stromada kronik inflamatuvar yanıtı zayıflatır [3,7]. Bu mekanizma, PCOS’ta gözlenen düşük dereceli kronik inflamasyonun biyokimyasal temelini hedef alır. Rifabutin’in bu etkisi, inflamatuvar stresin azalmasına ve stromal mikroçevrenin daha dengeli hale gelmesine katkı sağlar. Feprazone ise bu sürece COX-2 inhibisyonu yoluyla dahil olur; prostaglandin sentezini azaltarak inflamatuvar kaskadı tamamlayıcı şekilde baskılar. Böylece NF-κB–NLRP3–COX-2 ekseninde çok düzeyli bir inhibisyon sağlanır ve inflamasyonun hem hücresel hem de mediyatör düzeyinde kontrolü gerçekleştirilir [5]. Bu iki ajanın birlikte kullanımı,
PCOS’taki inflamatuvar mikroçevrenin düzenlenmesinde güçlü bir sinerji oluşturur.
Kombinasyonun ikinci temel bileşeni olan Hexobendine, adenozin geri alımını inhibe ederek hücre dışı adenozin birikimini artırır. Adenozin düzeylerindeki bu artış, A2A reseptörleri aracılığıyla AMPK (AMP-activated protein kinase) sinyal yolunun aktivasyonuna yol açar. AMPK aktivasyonu, mTOR baskılanması ve lipid metabolizmasının yeniden düzenlenmesi ile sonuçlanarak insülin duyarlılığının artmasına ve metabolik stresin azalmasına katkı sağlar [4,6]. Rifabutin’in inflamasyonu azaltıcı etkisiyle birlikte bu süreç, metabolik ve immün eksenlerin etkileşimini düzenler ve metabolik homeostazın yeniden sağlanmasına yardımcı olur. AMPK aracılı bu metabolik yeniden programlama, glukoz alımı, yağ asidi oksidasyonu ve lipogenez baskısı üzerinden sistemik metabolik dengeyi güçlendirir.
Hexobendine aynı zamanda adenozin modülasyonu üzerinden endotelyal koruma sağlar. Artan adenozin düzeyleri, A2A ve A2B reseptör aktivasyonu yoluyla antioksidan savunma mekanizmalarını güçlendirir; nitrik oksit (NO) üretimini artırır ve eNOS (endotelyal nitrik oksit sentaz) aktivitesini destekler [4]. Bu mekanizma, PCOS’ta sık gözlenen vasküler disfonksiyonun düzeltilmesine katkı sağlar. Endotelyal NO sentezinin artması, vazodilatasyonu destekleyerek mikrosirkülasyonu iyileştirir ve dokuların oksijenlenmesini artırır. Bu durum, ovaryan stromada besin ve oksijen dağılımını optimize eder, foliküler gelişimi destekler ve oosit kalitesinin artmasına olanak tanır.
Kombinasyonda yer alan üç bileşen de reaktif oksijen türlerinin (ROS) birikimini farklı yollarla azaltarak oksidatif stresi hedef alır. Rifabutin, NF-κB baskısı ve inflamasyonun azalması yoluyla ROS üretimini sınırlar [3]; Hexobendine, AMPK aktivasyonu ve adenozin aracılı antioksidan yanıt sayesinde mitokondriyal ROS üretimini dengeler [4]; Feprazone ise COX-2 inhibisyonu yoluyla inflamatuvar kaynaklı oksidatif yükü azaltır [5]. Bu üçlü etki, ovaryan hücrelerde oksidatif stres kaynaklı hasarı minimize eder, mitokondriyal fonksiyonu korur ve foliküler mikroçevrenin fizyolojik dengesini yeniden oluşturur.
Feprazone’un COX-2 inhibitör etkisi ayrıca stromal fibrogenezin önlenmesinde de kritik rol oynar. PCOS’ta artmış COX-2 ekspresyonu, prostaglandin sentezinin artmasına ve buna bağlı fibroblast aktivasyonu ile doku sertleşmesine yol açar. Feprazone, COX-2 ekspresyonunu baskılayarak bu süreci sınırlarken, Rifabutin’in NF-κB yolunu inhibe etmesiyle COX-2 ekspresyonu ikincil olarak da azalır. Bu çift yönlü etki, inflamatuvar yanıtı baskılarken fibrotik yeniden yapılanmayı da sınırlar ve ovaryan doku bütünlüğünün korunmasına katkıda bulunur.
Rifabutin ayrıca bağırsak mikrobiyotasını modüle etme potansiyeliyle de bu modele katkı sağlar. Patojenik bakterilerin baskılanması ve mikrobiyal kompozisyonun düzenlenmesi, LPS (lipopolisakkarit) aracılı TLR4 aktivasyonunu sınırlandırır. Bu mekanizma, bağırsak kaynaklı inflamatuvar uyarıların azalmasını sağlar ve mikrobiyota–immün–metabolik döngünün yeniden dengelenmesine katkıda bulunur [3]. Böylece, sistemik inflamasyonun kaynaklarından biri ortadan kaldırılmış olur.
Kombinasyonun mikrosirkülasyon üzerindeki etkileri de önemlidir. Hexobendine’in vazodilatör etkisi ve NO sentezini desteklemesi, ovaryan mikrosirkülasyonu güçlendirir [4]. Feprazone’un inflamasyon ve ödemi azaltıcı etkileriyle birleştiğinde, foliküler oksijenlenme artar, hipoksik stres azalır ve ovaryan rezervin korunması desteklenir [5]. Bu etki, PCOS’un ilerleyici yapısal değişikliklerinin önlenmesinde önemli bir rol oynayabilir.
Kombinasyonun bir diğer etkisi de insülin direncinin azaltılmasıdır. Rifabutin’in inflamatuvar sitokinleri baskılaması, Hexobendine’in AMPK aktivasyonu yoluyla glukoz alımını artırması ve Feprazone’un COX-2 inhibisyonu ile inflamatuvar kaynaklı insülin direncini azaltması sonucunda, sistemik insülin duyarlılığı artar [3–6]. Bu mekanizmaların birlikte işlemesi, PCOS’un temel patojenik bileşenlerinden biri olan metabolik disfonksiyonun düzeltilmesine katkıda bulunur.
Sonuç olarak, Rifabutin–Hexobendine–Feprazone kombinasyonu, PCOS’un biyolojik altyapısında yer alan metabolik (AMPK–mTOR), inflamatuvar (NF-κB–NLRP3– COX-2) ve mikrovasküler (adenozin–NO) eksenleri eşzamanlı olarak hedefleyerek çok eksenli bir sinerjik etki modeli ortaya koymaktadır. Bu bütüncül yaklaşım, hastalığın yalnızca semptomatik kontrolünü değil, aynı zamanda moleküler düzeyde yeniden programlanmasını da amaçlar [3–7]. Böylece, PCOS’un kronik seyrinde kalıcı biyolojik iyileşme ve fonksiyonel denge sağlanması teorik olarak mümkün hale gelir.
4. Potansiyel Moleküler Sinyal Yolakları
Rifabutin–Hexobendine–Feprazone kombinasyonu, PCOS’un multifaktöriyel patogenezinde rol alan birçok hücresel sinyal yolunu eşzamanlı hedefleme potansiyeline sahiptir. Bu sinerjik yaklaşım, hem inflamatuvar hem de metabolik yeniden programlama üzerinde etkili olabilir. Aşağıda, kombinasyonun teorik olarak etkileyebileceği başlıca moleküler yolaklar detaylandırılmıştır:
4.1. NF-κB → IL-6/TNF-α Ekseni: Kronik İnflamasyonun Baskılanması
PCOS’un temel patolojik süreçlerinden biri olan kronik düşük dereceli inflamasyon, NF-κB (nükleer faktör kappa-B) aktivasyonuna bağlıdır. NF-κB’nin aktive olmasıyla birlikte IL-6, TNF-α ve IL-1β gibi proinflamatuvar sitokinler artar; bu da ovaryan stromal inflamasyon, androjen sentezinde artış ve insülin direncinin derinleşmesi ile sonuçlanır [1,2,7]. Rifabutin, NF-κB sinyal yolunu baskılayarak bu sitokinlerin ekspresyonunu azaltır [3]; Feprazone ise COX-2 inhibisyonu aracılığıyla inflamatuvar kaskadın aşağı akışını sınırlayarak bu etkiyi tamamlayıcı biçimde güçlendirir [5]. Böylece kombinasyon, IL-6/TNF-α ekseninde güçlü bir baskılama sağlar.
4.2. AMPK → mTOR → SREBP1 Ekseni: Metabolik Dengenin ve Lipid
Homeostazının Sağlanması
AMPK (AMP-aktive protein kinaz), hücresel enerji sensörü olarak görev yapar ve PCOS’ta sıklıkla baskılanmıştır. AMPK aktivasyonunun azalması, mTOR yolunun aşırı aktivasyonuna, SREBP1 (sterol regulatory element-binding protein 1) üzerinden lipogenez artışına ve insülin direncine neden olur [2,6]. Hexobendine, adenozin birikimi yoluyla A2A reseptörlerini aktive eder ve AMPK yolunu uyarır; bu da mTOR baskılanması ve lipid metabolizmasının normalizasyonu ile sonuçlanır [4,6]. Rifabutin’in inflamatuvar stres azaltıcı etkisiyle birlikte bu yolak, metabolik homeostazın yeniden kurulmasına yardımcı olur. Sonuçta, kombinasyon glukoz alımı, yağ asidi oksidasyonu ve insülin duyarlılığını artırarak PCOS’un metabolik bileşenlerini hedefler.
4.3. Adenozin–A2A → cAMP/PKA Ekseni: Antioksidan Yanıtların Aktivasyonu
Adenozin, hücresel stres koşullarında artan ve A2A reseptörleri üzerinden cAMP/PKA sinyal yolunu aktive eden bir nükleozittir. Bu yolak, antioksidan enzimlerin (SOD, katalaz, GSH-Px) ekspresyonunu artırır ve oksidatif stresi sınırlandırır [4]. Hexobendine, adenozin geri alımını inhibe ederek ekstrasellüler adenozin düzeylerini yükseltir; böylece antioksidan savunma mekanizmaları güçlenir ve ovaryan hücrelerin oksidatif hasarı azalır. PCOS’ta sıklıkla görülen ROS birikimi, oosit kalitesini düşüren ve folikülogenezi bozan temel faktörlerden biridir; bu nedenle bu yolak kombinasyonun önemli bir hedefidir [8].
4.4. NLRP3 Inflamozomu: Ovaryan Hücrelerde İnflamatuvar Hasarın Azaltılması
NLRP3 inflamozomu, PCOS’ta aktive olan ve IL-1β ile IL-18 gibi inflamatuvar sitokinlerin olgunlaşmasını sağlayan bir kompleks olup, ovaryan hücre ölümü, fibrozis ve ovaryan disfonksiyon ile ilişkilidir [7]. Rifabutin, inflamatuvar stimülasyonun erken basamaklarını baskılayarak NLRP3 aktivasyonunu sınırlandırabilir [3]; Feprazone’un inflamasyon baskısı ile bu etki pekişir. Sonuç olarak kombinasyon, inflamatuvar hücre infiltrasyonu ve apoptozis riskini azaltarak ovaryan dokunun korunmasına katkıda bulunur.
4.5. TLR4–LPS Ekseni: Mikrobiyal Kaynaklı İnflamasyonun Kontrolü
Son yıllarda yapılan çalışmalar, PCOS’un yalnızca endokrin bir hastalık değil, aynı zamanda mikrobiyota-immün-metabolik bir sendrom olduğunu ortaya koymuştur [2]. Bağırsak disbiyozu, lipopolisakkarit (LPS) salınımını artırır ve TLR4 aracılığıyla NFκB yolunu aktive ederek sistemik inflamasyonu başlatır. Rifabutin, bağırsak mikrobiyotasını dengeleyerek LPS üretimini azaltabilir ve TLR4 aracılı inflamasyonu baskılayabilir [3]. Böylece mikrobiyal kaynaklı inflamatuvar döngü kırılmış olur.
4.6. NO–eNOS Aktivasyonu: Endotelyal Fonksiyonların İyileştirilmesi
PCOS’ta sıklıkla görülen endotelyal disfonksiyon, nitrik oksit (NO) üretimindeki azalmaya ve oksidatif stresin artmasına bağlıdır [8].
Hexobendine, adenozin aracılı A2A reseptör aktivasyonu yoluyla endotelyal NO sentaz
(eNOS) aktivasyonunu artırır [4]. Bu mekanizma, vazodilatasyonu destekler, mikrosirkülasyonu iyileştirir ve ovaryan doku oksijenlenmesini artırır.
Feprazone’un inflamasyonu azaltmasıyla birlikte bu süreç, endotelyal homeostazın yeniden kurulmasına katkı sağlar.
Bu altı sinyal yolunun eşzamanlı hedeflenmesi, PCOS’un temel patofizyolojik süreçlerinde yer alan inflamatuvar aktivasyon, metabolik stres, oksidatif yük ve mikrovasküler bozulmaların düzeltilmesine yönelik bütüncül bir tedavi potansiyeli oluşturur [3–8].
5. Klinik ve Deneysel Kanıtlar
Rifabutin–Hexobendine–Feprazone kombinasyonunun Polikistik Over
Sendromu (PCOS) üzerindeki etkileri henüz doğrudan randomize kontrollü
çalışmalarla değerlendirilmemiştir. Ancak, her bir bileşenin PCOS patogenezinde yer alan temel biyolojik süreçler üzerindeki etkilerini ortaya koyan çok sayıda deneysel ve teorik veri bulunmaktadır. Bu veriler, söz konusu üç ajanın birlikte kullanımında rasyonel bir sinerji potansiyeli bulunduğunu göstermektedir.
Rifabutin
Rifabutin, klasik olarak bir rifamisin türevi antimikrobiyal ajan olup, son yıllarda immünomodülatör özellikleri nedeniyle metabolik ve inflamatuvar hastalıklarda da dikkat çekmektedir. Çalışmalar, Rifabutin’in makrofaj kaynaklı IL-1β ve IL-6 üretimini baskılayarak inflamatuvar yanıtı azalttığını ve NF-κB aktivasyonunu sınırladığını göstermektedir [3]. Ayrıca Rifabutin, bağırsak mikrobiyotasını modüle etme yeteneği sayesinde mikrobiyota–immün–metabolik eksen üzerinde olumlu etkiler oluşturabilir. Bu, PCOS’ta görülen disbiyoz ve LPS aracılı TLR4 aktivasyonu ile tetiklenen inflamatuvar süreçlerin dengelenmesine katkıda bulunabilir [3]. Bu veriler, Rifabutin’in PCOS’taki kronik düşük dereceli inflamasyonun kontrolünde teorik bir yardımcı ajan olabileceğini düşündürmektedir.
Hexobendine
Hexobendine, adenozin geri alım inhibitörü olarak görev yapar ve bu mekanizma aracılığıyla AMPK aktivasyonu, adenozin–A2A reseptör sinyalizasyonu ve antioksidan savunma sistemlerini destekler. Deneysel veriler, Hexobendine’in AMPK/mTOR ekseni üzerinde dengeleyici bir etki oluşturduğunu, bu sayede lipid metabolizmasının düzenlenmesine ve insülin duyarlılığının artmasına katkıda bulunduğunu göstermektedir [4,6].
Ayrıca oksidatif stresin baskılanması, endotelyal fonksiyonların iyileştirilmesi ve mikrosirkülasyonun artırılması yoluyla, PCOS’ta sıklıkla görülen ovaryan hipoksi ve mikrovasküler disfonksiyon süreçlerine karşı koruyucu bir etki sağlayabileceği öne sürülmektedir [4]. Bu özellikleri sayesinde Hexobendine, PCOS’un metabolik ve vasküler boyutlarına yönelik değerli bir tamamlayıcı ajan profili çizmektedir.
Feprazone
Feprazone, non-steroidal antiinflamatuvar ilaçlar (NSAID) grubuna ait olup, COX-2 inhibisyonu yoluyla prostaglandin sentezini azaltır ve inflamatuvar hücre infiltrasyonunu sınırlandırır [5]. PCOS’ta artan COX-2 aktivitesi, ovaryan stromada inflamasyon ve fibrogenez ile ilişkilidir; bu durum, foliküler gelişimi ve ovulasyonu olumsuz etkiler. Feprazone’un bu yolu baskılaması, ovaryan mikroçevrede inflamatuvar yükün azalmasına, ROS üretiminin düşmesine ve insülin duyarlılığının dolaylı iyileşmesine katkı sağlayabilir [5,8]. Bu etkiler, Rifabutin’in NF-κB/NLRP3 ekseni üzerindeki baskılayıcı etkileriyle birleştiğinde, inflamasyonun çoklu düzeylerde kontrol altına alınmasını destekler.
Kombinasyonun Teorik Sinerji Prensibi
Mevcut literatürde Rifabutin, Hexobendine ve Feprazone’un birlikte kullanıldığı bir klinik çalışma bulunmamaktadır. Ancak her bir ajanın farklı ama birbirini tamamlayan patojenik eksenler üzerinde etkili olması, bu kombinasyonun multimodal tedavi paradigması açısından rasyonel bir temel oluşturduğunu göstermektedir.
Bu ajanlar sırasıyla:
• Rifabutin → NF-κB/NLRP3 ekseninde inflamatuvar kontrol,
• Hexobendine → AMPK/mTOR ekseninde metabolik yeniden programlama,
• Feprazone → COX-2/ROS ekseninde inflamasyon ve oksidatif stres baskısı sağlayarak, PCOS’un immün-inflamatuvar, metabolik ve vasküler bileşenlerini eşzamanlı hedefler [3–6].
Klinik Araştırma İhtiyacı
Bu teorik sinerji modelinin klinik geçerliliğini test etmek için, öncelikle hayvan modelleri üzerinde biyobelirteç temelli çalışmalar (örneğin IL-6, TNF-α, AMPK fosforilasyon düzeyi, COX-2 ekspresyonu, HOMA-IR) yapılmalı; ardından faz I-II klinik çalışmalar ile etkinlik, güvenilirlik ve farmakodinamik profiller değerlendirilmelidir. Bu tür çok bileşenli tedavi stratejileri, PCOS’un çok boyutlu doğasına uygun bütüncül farmakolojik yaklaşımlar geliştirilmesinde önemli bir adım olabilir.
6. Tartışma ve Gelecek Perspektifler
Polikistik Over Sendromu (PCOS), yalnızca bir endokrin bozukluk değil, aynı zamanda metabolik, immünolojik ve vasküler bileşenleri içeren multisistemik bir hastalıktır [1,2]. Bu nedenle, tedavi yaklaşımlarının da hastalığın çok boyutlu doğasına uygun biçimde tasarlanması gerekmektedir. Klasik monoterapiler, çoğu zaman yalnızca tek bir patojenik halkayı hedef almakta ve bu durum uzun vadede etkinlik sınırlamaları doğurmaktadır. Son yıllarda, çok eksenli (multimodal) yaklaşımların; özellikle inflamasyon, insülin direnci, oksidatif stres ve mikrosirkülasyon bozukluklarını eşzamanlı hedeflediğinde daha anlamlı klinik iyileşmeler sağladığına dair artan kanıtlar bulunmaktadır [2,6,8].
Bu çerçevede önerilen Rifabutin–Hexobendine–Feprazone kombinasyonu, PCOS’un patogenezinde yer alan üç ana ekseni (metabolik, immün ve vasküler) bütüncül biçimde hedefleme potansiyeli taşıyan sinerjik bir farmakoterapi modeli sunmaktadır.
Kombinasyonun ilk bileşeni olan Rifabutin, NF-κB/NLRP3 inflamatuvar ekseni üzerinde güçlü bir baskılayıcı etki oluşturur; IL-1β, IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin üretimini azaltarak kronik inflamasyonun temel kaynaklarını hedefler [3,7]. Ayrıca bağırsak mikrobiyotasını modüle etme potansiyeliyle, LPS–TLR4 aracılı inflamatuvar sinyalizasyonu sınırlayabilir; bu da mikrobiyota–immün–metabolik döngünün normalizasyonuna katkıda bulunur [3]. Bu mekanizma, son yıllarda
PCOS’un sistemik inflamasyonunda mikrobiyal kaynaklı endotoksinlerin rolü üzerine yapılan çalışmalarda da vurgulanmaktadır [2].
İkinci bileşen Hexobendine, adenozin geri alımını inhibe ederek AMPK aktivasyonunu tetikler; bu yol üzerinden mTOR baskılanır ve SREBP1 kaynaklı lipid sentezi azalır [4,6]. Bu süreç, insülin duyarlılığının artmasına, glukoz homeostazının yeniden sağlanmasına ve metabolik kontrolün güçlenmesine olanak tanır. Ek olarak, Hexobendine’in adenozin–A2A reseptör aktivasyonu yoluyla antioksidan savunma sistemlerini desteklemesi, ovaryan dokuda oksidatif yükün azaltılmasına katkı sağlar [4,8]. Bu etki, oosit kalitesini, folikülogenezi ve ovulatuar kapasiteyi olumlu yönde etkileyebilir.
Üçüncü ajan Feprazone, COX-2 inhibisyonu yoluyla prostaglandin E2 (PGE2) düzeylerini azaltır, bu sayede ovaryan stromal inflamasyon ve fibrogenez süreçlerini baskılar [5]. Bu etki, Rifabutin’in NF-κB üzerinden inflamatuvar yanıtı azaltan etkisiyle birleştiğinde, ovaryan mikroçevrede fibrotik değişimlerin sınırlandırılmasına yardımcı olabilir. Aynı zamanda Feprazone’un ROS üretimini azaltıcı özelliği, Hexobendine’in antioksidan etkileriyle sinerji oluşturur [5,8].
Bu bütüncül etki modeli sayesinde kombinasyon, inflamatuvar yükü azaltma, insülin direncini düzeltme, mikrosirkülasyonu iyileştirme ve ovaryan doku bütünlüğünü koruma hedeflerine aynı anda ulaşabilir. Böyle bir multimodal etki profili, PCOS’un yalnızca semptomatik değil, moleküler temelli bir yönetimi için yeni bir paradigma sunmaktadır [6,7].
Ancak, bu teorik sinerjinin klinik olarak doğrulanabilmesi için, in vivo hayvan modellerinde biyobelirteç temelli analizler (örneğin IL-6, TNF-α, COX-2 ekspresyonu, AMPK fosforilasyon düzeyi, ROS seviyeleri) ve sonrasında randomize kontrollü klinik çalışmalar gereklidir. Bu çalışmalar, kombinasyonun etkinlik, güvenilirlik, farmakokinetik uyumluluk ve uzun vadeli yan etki profili açısından değerlendirilmesini sağlayacaktır [3–6].
Sonuç olarak, Rifabutin–Hexobendine–Feprazone kombinasyonu, PCOS’un kompleks doğasına uygun, metabolik–immün–vasküler eksenleri hedefleyen, çok boyutlu bir tedavi yaklaşımı olarak öne çıkmaktadır. Bu kombinasyon, gelecekte biyobelirteç temelli kişiselleştirilmiş tedavi stratejilerinin geliştirilmesi için de bir model oluşturma potansiyeli taşımaktadır. Literatürde artan multikomponent farmakoterapi eğilimi göz önüne alındığında, bu yaklaşım PCOS yönetiminde yeni nesil terapötik paradigmalara zemin hazırlayabilir [2,6,8].
7. Sonuç
Rifabutin–Hexobendine–Feprazone kombinasyonu, PCOS’un multifaktöriyel patogenezine karşı çok eksenli, hedefe yönelik bir tedavi yaklaşımı sunmaktadır. İmmün inflamatuvar baskı, metabolik denge ve vasküler iyileşme yoluyla ovaryan fonksiyonların restore edilmesi hedeflenmektedir. Bu yaklaşım, gelecekte biyobelirteçtemelli kişiselleştirilmiş tedavi modellerinin geliştirilmesine ışık tutabilir.
Kaynaklar
1. Rosenfield RL, Ehrmann DA. Pathogenesis of polycystic ovary syndrome. N Engl J Med. 2016;375(1):54–64.
2. Diamanti-Kandarakis E, et al. Insulin resistance in PCOS: mechanisms and implications. Endocr Rev. 2022;43(4):610–648.
3. Gualano G, et al. Rifabutin: Mechanism of action and immunomodulatory effects. Int J Antimicrob Agents. 2021;58(2):106–115.
4. Valls-Lacalle L, et al. Adenosine and oxidative stress: vascular effects of adenosine reuptake inhibitors. Front Pharmacol. 2017;8:862.
5. Valls-Lacalle L, et al. NSAIDs and their role in oxidative stress and inflammation.
Free Radic Biol Med. 2018;120:226–240.
6. Ryu Y, et al. AMPK activation improves insulin sensitivity and ovarian morphology in PCOS model rats. Mol Cell Endocrinol. 2024;566:112–125.
7. Zhang L, et al. Role of NLRP3 inflammasome in PCOS pathogenesis. Front Immunol. 2023;14:1123411.
8. Martínez-García MA, et al. Oxidative stress markers and insulin resistance in PCOS. J Clin Endocrinol Metab. 2022;107(3):e1078–e1089.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...