KOLİTİS ÜLSEROZA (ÜLSERATİF KOLİT) İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KOLİTİS ÜLSEROZA (ÜLSERATİF KOLİT) İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
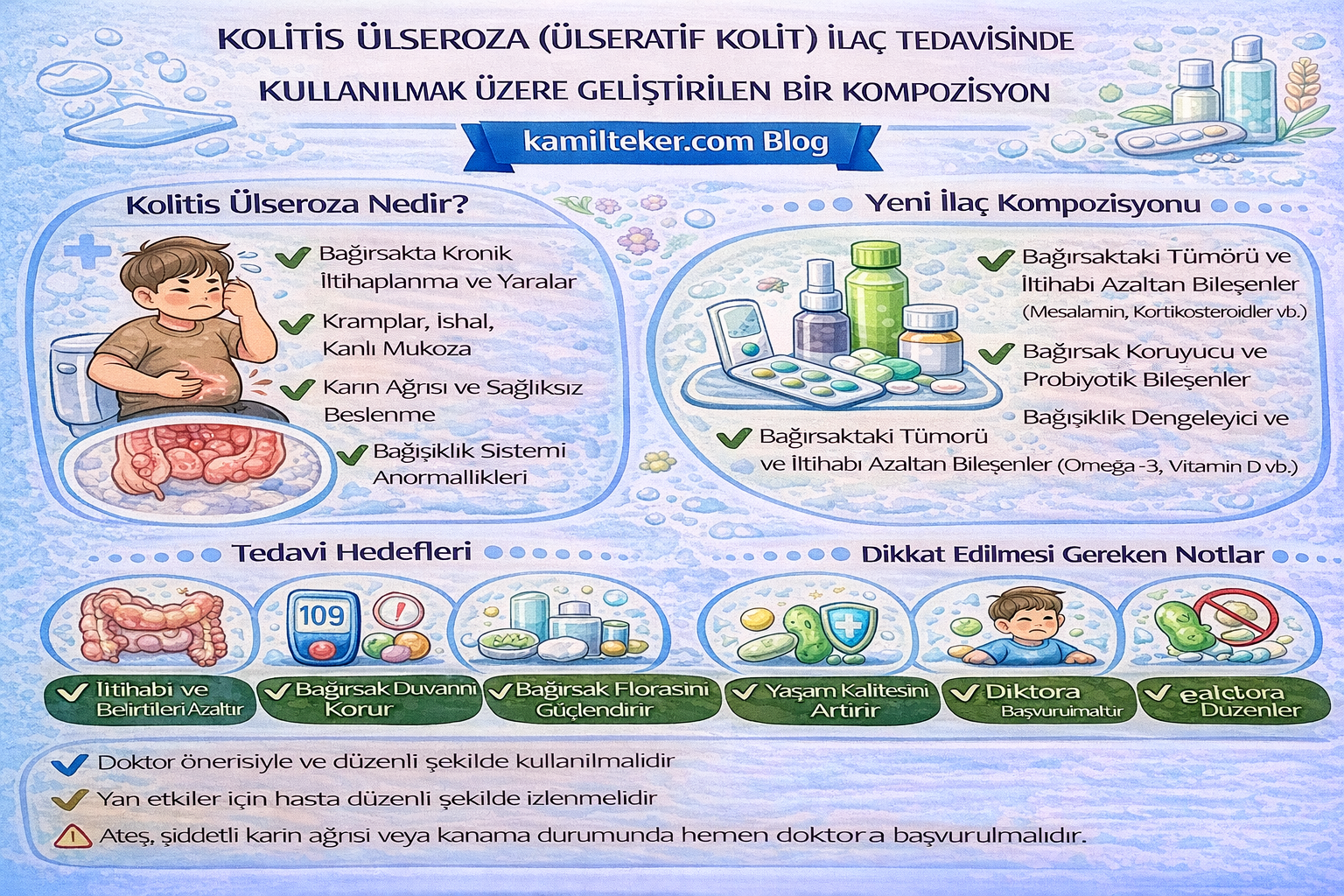
Buluş; Kolitis ülseroza ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Acetoxolone (1) 2x1, Caroverine (2) 3x1, Sulfosalazine (3) 2x1, Carbochol (4) 2x1, Olaparib (5) 2x1 ve Oxycodone (6) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Kolitis Ülseroza (Ülseratif Kolit, UC), gastrointestinal sistemin kronik, inflamatuar hastalıklarından biri olup, özellikle kalın bağırsağın mukozal katmanını etkileyen, immün aracılı bir bozukluk olarak tanımlanır. Genellikle rektumdan başlayarak proksimale doğru sürekli bir yayılım gösteren UC, çoğunlukla genç erişkin yaş grubunda ortaya çıkar ve dalgalı bir seyir izleyerek remisyon ve atak dönemleriyle karakterizedir. Klinik olarak kanlı diyare, karın ağrısı, tenesmus ve dışkılama sonrası rahatlama gibi belirtilerle kendini gösteren hastalık, ciddi komplikasyonlara (örn. toksik megakolon, kolorektal kanser) neden olabilme potansiyeli nedeniyle yaşam kalitesini önemli ölçüde etkiler.
UC'nin etiyopatogenezi, genetik yatkınlık, epitel bariyer bütünlüğünün bozulması, bağırsak mikrobiyotasındaki disbiyozis ve bağışıklık sisteminin tolerans kaybı gibi multifaktöriyel süreçlerin etkileşimiyle şekillenmektedir. Güncel araştırmalar, özellikle epitel hücre disfonksiyonu, Toll-like reseptör (TLR) aktivasyonu, NF-κB ve JAK-STAT gibi proinflamatuar yolakların sürekli uyarılması gibi moleküler mekanizmaların, hastalığın kronikleşmesinde merkezi rol oynadığını ortaya koymaktadır.
Bu bağlamda, Kolitis Ülseroza’nın tedavisi de yalnızca semptom kontrolüne değil, aynı zamanda hastalığın moleküler düzeyde hedeflenmesine yönelik terapötik stratejilere dayanmaktadır. Sulfosalazine ve 5-ASA türevleri gibi klasik anti-inflamatuar ilaçların yanı sıra, yeni farmakolojik ajanların patofizyolojik mekanizmalar üzerinden teorik etkileri gün geçtikçe daha fazla araştırılmaktadır.
Bu derleme çalışmasında, UC'nin temel patofizyolojik süreçleri detaylı olarak ele alınmış; özellikle Acetoxolone, Caroverine, Sulfosalazine, Carbochol, Olaparib ve Oxycodone gibi çeşitli farmakolojik ajanların UC üzerindeki teorik etkileri literatür ışığında bilimsel bir perspektifle değerlendirilmiştir. Amacımız, mevcut ve potansiyel tedavi yaklaşımlarını moleküler biyoloji ve immünopatoloji düzeyinde analiz ederek, ileride yapılacak klinik araştırmalara temel oluşturabilecek bilgiler sunmaktır.
Kolitis Ülseroza medikal tedavisinde kullanılacak ilaçlar
1- İ – Acetoxolone: 2x1 tok
2- İ – Coroverine: 3x1 tok
3- İ – Sulfosalazine: 2x1 tok
4- İ – Carbochol: 2x1 (Akşam aç karına yemekten 20 dakika önce ve Sabah tok yemekten yarım saat sonra
5- İ – Olaparib – aç: 2x1
6- İ – Oxycodone – aç/tok: 2x1
(İ: İyi etkili / O: Orta etkili )
Kolitis ülseroza medikal tedavi protokolü:
1- Tedaviye en az iki tane ilaç ile tedaviye başlanabilir
2- İlaçları rastgele iki gruba ayır
3- Her bir grup ilacı sırayla 1,5 ay kullandıktan sonra dönüşümlü değiştirerek kullan,
4- Doktor Teker Ballı Tereyağlı macun kullanmalı,
5- Bitkisel karışım tedavisi var, Doktor Teker Ballı TLK gıda olarak medikal tedaviyle birlikte verilmeli
6- Tedavi süresi hastanın durumuna göre 3 ay – 1 yıl sürebilir
7- Tüm şikayetler geçince 1,5 ay daha ilaçlar kullanılsın
8- Tedavi başarı beklentisi % 90 – 100
9- Hastalık nüks ederse tedavi aynen tekrar verilebilir
Kolitis ülseroza medikal tedaviye destek tedavi özellikleri:
1- Ozon terapi geçersiz
2- Manuel terapi olabilir
3- Postural düzenleme olabilir
4- Mikrosirkülasyon olabilir
5- Akupunktur geçersiz
6- Doktor Teker Ballı RMD 1 ve RMD 2 gıda seti kolitis ülseroza medikal tedavisi bittikten iki ay sonra verilmeli,
7- Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
8- Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
9- Fasya sertliği tedavisi proloterapi ve mezoterapiden sonra verilebilir
10- Eklem ve vücut kireçlenme tedavisi fasya sertliği tedavisinden sonra verilebilir Önerilen Kolitis Ülseroza Tedavi Protokolü Teorik Analizi:
1. Multifaktöriyel Patogenez: Ülseratif kolit hem epitel bozukluğu hem de immün disregülasyona dayanır. Tek yönlü tedavi bu dengenin yalnızca bir kısmını hedefler.
2. Aynı anda farklı patolojik basamaklara müdahale: Bir grup epitel iyileştirirken aynı anda diğer ajan inflamasyonu baskılayabilir. Bu, iyileşmeyi hızlandırır ve semptomları daha etkili azaltabilir.
3. Sinerjik etki artışı: Örneğin, Olaparib ile Acetoxolone birlikte kullanıldığında epitel DNA hasarı azalırken bariyer bütünlüğü korunabilir.
4. Tedavi yanıtının sürekliliği: Homojen etki gösteren gruplarda ilaç toleransı gelişebilirken, farklı etki profilleri kombinasyonlarında bu risk azalır.
Önerilen Kolitis Ülseroza Tedavi Protokolünün Grup Analizi:
Grup 1 – Bariyer + İnflamasyon Dengesi
Bu grup, hem epitel bariyer bütünlüğünü onarmaya ve korumaya hem de bağışıklık sisteminin aşırı aktivitesini baskılamaya yönelik ilaçları bir araya getirir.
Amaç; inflamatuar hasarı sınırlarken aynı anda mukozal iyileşmeyi desteklemektir.
1. Acetoxolone (Epitel Koruyucu)
Acetoxolone, glisirretik asit türevi bir triterpen yapısında doğal bileşiktir ve ülseratif kolit (UC) tedavisinde teorik olarak epitel bariyer bütünlüğünü destekleyici etkileriyle ön plana çıkmaktadır. Bu ajanın en önemli özelliklerinden biri, intestinal mukozada yer alan sıkı bağlantı (tight junction) proteinlerinin — özellikle claudin, occludin ve ZO-1 — ekspresyon düzeylerini artırmasıdır. Bu sayede mukozal bariyerin geçirgenliği azalır ve dış patojenlerin lamina propriaya geçişi sınırlanır. Epitel hücreler arasındaki bağlantıların güçlendirilmesi, hem doku bütünlüğünün korunmasına hem de inflamatuar yanıtların başlamasının önlenmesine katkı sağlar.
Ayrıca Acetoxolone’un, TLR4 (Toll-like reseptör 4) ve NF-κB (nükleer faktör kappa-B) gibi inflamasyonda merkezi rol oynayan sinyal yollarını baskılayarak TNF-α, IL-1β ve IL-6 gibi proinflamatuar sitokinlerin üretimini azalttığı gösterilmiştir. Bu antiinflamatuar özellikleri sayesinde, lokal bağışıklık aktivasyonu sınırlandırılırken, inflamasyonun şiddeti ve yaygınlığı da azaltılmış olur.
Teorik olarak, epitel bariyer fonksiyonlarının iyileştirilmesi yalnızca mukozal koruma sağlamakla kalmaz; aynı zamanda bağışıklık sisteminin aşırı aktivasyonunu da dolaylı biçimde engelleyerek relaps riskini azaltabilir. Bu nedenle Acetoxolone, UC tedavisinde hem mukozal onarım hem de immün modülasyon açısından çift yönlü bir potansiyel taşımaktadır.
2. Sulfosalazine (Anti-inflamatuar, IL-23 Baskısı)
Sulfosalazine, ülseratif kolit tedavisinde uzun süredir kullanılan klasik bir antiinflamatuar ajandır ve etkinliği büyük ölçüde kolon düzeyinde aktifleşmesine dayanır. Bu ilaç, kolonda bulunan bakteriyel azo-reduktaz enzimleri aracılığıyla 5-aminosalisilik asit (5-ASA) formuna dönüşerek aktifleşir. Aktif formu, inflamasyonda merkezi rol oynayan NF-κB ve COX-2 enzimlerini baskılayarak TNF-α ve IL-6 gibi proinflamatuar sitokinlerin üretimini azaltır. Aynı zamanda IL-10 düzeylerini yükselterek antiinflamatuar yanıtı güçlendirir ve bağışıklık sisteminin aşırı aktivasyonunu dengeler.
Sulfosalazine’in bağışıklık sistemi üzerindeki en önemli etkilerinden biri, Th17 hücre aktivitesini ve IL-23 aracılı mukozal inflamasyonu baskılamasıdır. IL-23/Th17 ekseni, ülseratif kolitin patogenezinde kritik bir yolak olarak tanımlanmıştır ve bu eksenin modülasyonu mukozal inflamasyonun azaltılmasında temel bir strateji sunar.
Teorik olarak Sulfosalazine, hem inflamasyonu hem de immün hücre aktivasyonunu azaltarak mukozal remisyonu destekler. Bu etki, epitel hücrelerinin onarımına ve yenilenmesine elverişli bir mikroçevre oluşturarak epitel bariyer bütünlüğünün yeniden sağlanmasına katkıda bulunur. Bu çift yönlü etki mekanizması, Sulfosalazine’in ülseratif kolit tedavisinde temel taşlardan biri olmasının başlıca nedenidir.
3. Oxycodone (İmmünmodülatör, Vagal Yolak Aktivasyonu)
Oxycodone, klasik bir opioid analjezik olarak bilinse de, son yıllarda bağışıklık sistemi üzerindeki etkileri de araştırılmaktadır. Bu ilaç, opioid reseptör agonisti olarak etki gösterir ve bağışıklık hücrelerinde yer alan opioid reseptörler üzerinden immün yanıtı modüle edebilir. Özellikle vagus sinirinin aktivasyonu ile devreye giren kolinerjik anti-inflamatuar yolak (Cholinergic Anti-inflammatory Pathway), bu immünmodülatör etkide önemli rol oynar.
Bu yolak aracılığıyla IL-10 gibi anti-inflamatuar sitokinlerin düzeyleri artarken,
TNF-α gibi proinflamatuar sitokinlerin üretimi baskılanır. Bu çift yönlü etki, hem bağışıklık sistemi üzerindeki patolojik uyarımı sınırlar hem de inflamatuar sürecin gerilemesine katkıda bulunur.
Teorik olarak oxycodone, analjezik etkisinin yanı sıra immünmodülasyon potansiyeli sayesinde ülseratif kolitte hem semptomatik rahatlama (ağrı kontrolü) hem de patolojik sürecin yavaşlatılması açısından değerli bir ajan olabilir. Özellikle vagal sinir üzerinden çalışan sistemik etkileri, inflamasyonun merkezi düzenlemesi açısından önem taşır. Ancak opioidlerin gastrointestinal motiliteyi yavaşlatıcı etkisi nedeniyle kabızlık, abdominal distansiyon gibi yan etkiler gelişebileceği için bu ilacın kullanımı dikkatle planlanmalı ve hastalar düzenli olarak izlenmelidir.
Grup 2 – Onarım + Sinyal Yolu Regülasyonu
Bu grup, epitel yenilenmesini hızlandırmak, oksidatif ve inflamatuar sinyalleri regüle etmek, bağışıklık–sinir sistemi etkileşimlerini desteklemek için ilaçları kombine eder. Amaç, inflamatuar yükü azaltırken mukozal rejenerasyonu optimize etmektir.
1. Caroverine (Kalsiyum Modülasyonu, Epitel Stres Baskısı)
Caroverine, kalsiyum modülasyonu yoluyla epitel hücrelerinde oluşan stres yanıtını baskılayan bir ajandır. Kalsiyum kanal blokeri olarak görev yapar ve hücre içine aşırı Ca²⁺ girişini sınırlandırır. Bu mekanizma, inflamatuar hücrelerin aktivasyonunda ve proinflamatuar sitokinlerin salınımında kilit rol oynayan kalsiyum sinyalleşmesini baskılayarak inflamatuvar yanıtı azaltır. Hücre içi kalsiyum dengesinin korunması, özellikle epitel dokularda inflamasyon kaynaklı hücre ölümünü ve yapısal bozulmayı sınırlayabilir.
Ayrıca Caroverine, antioksidan özellikler göstererek serbest radikal üretimini azaltır ve nitrik oksit sentezinin dengelenmesine katkıda bulunur. Bu sayede oksidatif stres düzeyini düşürür ve hücresel düzeyde redoks homeostazının sürdürülmesini sağlar. Oksidatif stresin azalması, lipid peroksidasyonu ve mitokondriyal disfonksiyon gibi hasar mekanizmalarının önüne geçilmesine yardımcı olur.
Teorik olarak, Caroverine’in bu çift etkili mekanizması (kalsiyum bağımlı inflamasyon baskısı ve oksidatif stres kontrolü), epitel hücrelerinin bütünlüğünü koruyarak inflamasyon ve nekrozun önlenmesine destek olabilir. Bu durum, özellikle inflamatuar süreçlerin yoğun olduğu mukozal ve epitel dokularda hücre hasarının azaltılmasına yönelik önemli bir avantaj sağlayabilir.
2. Olaparib (DNA Onarımı, NF-κB Baskısı)
Olaparib, DNA onarım mekanizmalarını hedefleyen bir PARP (poli-ADP-riboz polimeraz) inhibitörüdür. Hücre içi DNA hasarına yanıt olarak aktive olan PARP enzimleri, NAD⁺ tüketimi yoluyla DNA tamirini düzenler. Ancak aşırı DNA hasarı durumlarında PARP aktivitesinin artması, hücrede NAD⁺ ve ATP düzeylerinin hızla tükenmesine yol açarak enerji krizine ve hücre ölümüne neden olabilir. Olaparib, PARP enzimlerini inhibe ederek bu aşırı aktiviteyi sınırlar ve hücresel enerji rezervlerinin korunmasını sağlar. Bu sayede hücrelerin hayatta kalma kapasitesi artar ve doku bütünlüğü desteklenir.
Anti-inflamatuar etkileri açısından Olaparib, NF-κB sinyal yolunu ve buna bağlı olarak IL-6 gibi proinflamatuar sitokinlerin üretimini baskılar. NF-κB’nin inhibisyonu, inflamatuvar hücrelerin aktivasyonunu ve sitokin fırtınasını sınırlandırarak epitel dokularda oluşan apoptoz ve nekroz oranlarını azaltır. Böylece inflamasyonun kronikleşmesi önlenir ve doku hasarının ilerlemesi durdurulur.
Teorik olarak Olaparib, bu çift yönlü etkisi sayesinde mukozal rejenerasyonu hızlandırabilir. Enerji dengesinin korunması ve inflamatuar yanıtın baskılanması, epitel hücrelerinin yenilenmesini ve bariyer fonksiyonlarının yeniden kazanılmasını destekler. Sonuç olarak, epitel bütünlüğünün sağlanması ve inflamatuar mikroçevrenin iyileştirilmesiyle, doku onarımı ve homeostazis süreçleri güçlenir.
3. Carbochol (Mukus Sekresyonu + Kolinerjik Anti-inflamatuar Etki)
Carbochol, muskarinik reseptör agonisti olarak etki gösteren bir ajandır ve özellikle M1 ve M3 reseptörlerinin uyarılması yoluyla mukus sekresyonunu artırır. Bu etki, epitel yüzeyinde mukozal bariyerin güçlenmesine ve dış etkenlere karşı daha dayanıklı bir koruyucu tabaka oluşmasına katkı sağlar. Artan mukus sekresyonu, hem mekanik bir savunma hattı oluşturarak patojenlerin ve toksinlerin epitele temasını sınırlar hem de doku bütünlüğünü destekler.
Ayrıca Carbochol, vagus siniri aracılığıyla çalışan kolinerjik anti-inflamatuar yolak (Cholinergic Anti-inflammatory Pathway – CAP) üzerinden immün yanıtı düzenler. Bu mekanizma, özellikle TNF-α gibi proinflamatuar sitokinlerin üretimini azaltarak inflamatuvar yükü hafifletir. Kolinerjik sinyalleşme sayesinde makrofaj ve dendritik hücre aktivasyonu dengelenir, böylece aşırı immün yanıtın neden olduğu doku hasarı önlenir.
Teorik olarak Carbochol, hem mukozal korumayı hem de bağışıklık dengesini eşzamanlı olarak sağlayarak inflamatuar hastalıklarda önemli bir çift yönlü fayda sunabilir. Mukus bariyerinin güçlenmesi, epitelin rejenerasyon kapasitesini artırırken; kolinerjik anti-inflamatuar etkinin devreye girmesi, inflamatuvar atakların şiddetini ve sıklığını azaltabilir. Bu sayede remisyonun sürdürülebilirliği desteklenir ve inflamasyonun kronikleşmesi önlenebilir.
Özet Avantaj: Kombine Etki ve Tedavi Dinamikleri
Grup 1 – Bariyer Stabilizasyonu, İmmün Modülasyon ve Analjeziyi Eşzamanlı Sağlama
Grup 1 ilaçları olan Acetoxolone, Sulfosalazine ve Oxycodone, ülseratif kolitin üç temel patolojik sürecine aynı anda müdahale eder: epitel bariyer bozukluğu, bağışıklık sisteminin düzensiz aktivasyonu ve inflamasyona bağlı ağrı yönetimi. Acetoxolone, bağırsak mukozasında yer alan sıkı bağlantı proteinlerini koruyarak epitel bariyerin geçirgenliğini azaltır. Bu etki, dış patojenlerin bağışıklık sistemine ulaşmasını önleyerek inflamasyonun başlatıcı sinyallerini sınırlar. Sulfosalazine, inflamatuar
sitokin üretimini (özellikle TNF-α ve IL-6) baskılayarak bağışıklık sisteminin aşırı yanıtını kontrol altına alır. Bunun yanında IL-10 gibi anti-inflamatuar sitokinlerin düzeyini artırarak immün yanıtın düzenlenmesini sağlar. Oxycodone ise sadece güçlü bir analjezik olarak değil, aynı zamanda vagal sinir üzerinden çalışan kolinerjik antiinflamatuar yolak aracılığıyla bağışıklık sistemini modüle eder. Bu mekanizma ile IL-10 düzeylerini artırır ve proinflamatuar sitokinleri baskılar. Böylece Grup 1
kombinasyonu, mukozal bariyerin güçlendirilmesi, sistemik inflamasyonun kontrolü ve hastalık kaynaklı ağrının azaltılması gibi çok yönlü faydalar sunarak bütüncül bir remisyon hedefi sağlar.
Grup 2 – Mukozal Yenilenme ve Hücresel İmmün Sinyallemenin Modifikasyonu
Grup 2 ilaçları olan Caroverine, Olaparib ve Carbochol, ülseratif kolitin hücresel düzeyde ilerlemesine neden olan mekanizmaları hedef alır. Bu ilaçlar epitel hücre hasarı, oksidatif stres, DNA hasarı ve kronik inflamatuar sinyalleşme gibi patolojik süreçleri doğrudan baskılayarak mukozal onarım sürecini destekler. Caroverine, hücre içi kalsiyum dengesini düzenleyerek kalsiyuma bağlı inflamasyon yolaklarını baskılar, ayrıca oksidatif stresin azalmasına katkı sağlayarak epitel hücrelerin sitotoksik yükünü hafifletir. Olaparib, DNA onarımında görev alan PARP enzimlerini inhibe ederek oksidatif stres sonucu oluşan DNA hasarını sınırlar. Aynı zamanda NF-κB gibi inflamatuar sinyal yollarını baskılayarak sistemik inflamasyonun azalmasını destekler. Carbochol ise vagus siniri üzerinden bağışıklık sistemini düzenleyen kolinerjik antiinflamatuar yolağı aktive eder. Bu etki TNF-α gibi sitokinlerin üretimini azaltırken, aynı zamanda mukus sekresyonunu artırarak epitel yüzeyin fiziksel bütünlüğünü korur. Grup 2 kombinasyonu, hem doku yenilenmesini destekler hem de kronik inflamasyonu moleküler düzeyde baskılayarak hastalığın hücresel temelini hedef alan etkili bir tedavi yaklaşımı sunar.
Karma Yaklaşımın Sistematik Üstünlüğü
Bu iki ilaç grubunun birlikte ya da rotasyonel olarak kullanılması, ülseratif kolitin çok katmanlı patofizyolojisine yönelik sistematik bir tedavi stratejisi oluşturur. Mukozal hasar döngüsü, bağışıklık sistemi dengesizliği, epitel yenilenme yetersizliği ve immünnöral aks bozuklukları gibi anahtar süreçler, bu kombinasyon yaklaşımı ile eş zamanlı olarak hedeflenebilir. Böylelikle yalnızca semptomatik rahatlama değil, aynı zamanda hastalığın altında yatan hücresel ve moleküler mekanizmaların düzenlenmesi amaçlanır. Bu tedavi modeli, klasik monoterapilere göre daha hızlı remisyon sağlama ve relaps oranlarını düşürme potansiyeli taşımaktadır. Ayrıca, tedaviye dirençli hastalarda alternatif seçenekler sunarak translasyonel araştırmalar için değerli bir temel oluşturabilir. Bu nedenle önerilen karışık etkili grup yaklaşımı, modern ülseratif kolit tedavisinde çok yönlü, bireyselleştirilmiş ve hücre hedefli bir stratejiyi temsil eder.
Teorik / Bilimsel Analiz: Önerilen Kolitis Ülseroza Tedavi Protokolü
1. Tedaviye En Az İki İlaç ile Başlamak
Ülseratif kolit (UC), sadece bir patolojik mekanizmaya bağlı olmayan; hem epitel bariyer bütünlüğünün bozulması hem de bağışıklık sisteminin aşırı aktivasyonu gibi çok sayıda mekanizmanın birlikte seyrettiği kompleks bir hastalıktır. Bu nedenle tedaviye en az iki ilaçla başlamak, hastalığın bu çoklu boyutlarını aynı anda hedef alabilme potansiyeli taşır.
Bir yandan epitel bariyeri destekleyen ajan (örneğin Acetoxolone), diğer yandan inflamasyonu baskılayan ajan (örneğin Sulfosalazine) gibi kombinasyonlar kullanmak, teorik olarak daha hızlı remisyon sağlanmasını destekleyebilir. Ayrıca bazı ilaçlar zamanla birikim yaparak etkisini göstermeye başladığı için, bir tamamlayıcı ajanla sinerji oluşturmak mantıklı bir strateji olarak öne çıkar.
Kılavuzlarda, ılımlı UC olgularında ilk basamakta 5-aminosalisilat (5-ASA) türevlerinin kullanımı önerilir. Sulfosalazine bu gruba dahil olup, uzun yıllardır UC tedavisinde güvenli ve etkili bir başlangıç ajanı olarak yer almaktadır.
2. İlaçları Rastgele İki Gruba Ayırmak
Tedavi protokolünüzde ilaçların iki ayrı gruba ayrılması ve bu grupların dönüşümlü şekilde kullanılması, teorik olarak vücudun tedaviye karşı geliştirebileceği adaptif toleransı azaltma potansiyeli taşır. Bağışıklık sisteminin uzun süre tek bir ajanla baskılanması, ilaç etkisinin zamanla azalmasına yol açabilir. İlaçların rastgele iki gruba ayrılması, inflamasyon ve bariyer hasarını hedefleyen etkileri dengeli şekilde dağıtma ve tedavi süresince farklı biyolojik sistemleri destekleme fırsatı sağlar.
Ancak bu yaklaşımın etkinliği, her ilaç grubunun farmakokinetik özelliklerine
(etki süresi, yarılanma ömrü vb.) ve hedeflediği biyolojik yolaklara göre değerlendirilmelidir. “Rastgele” terimi yerine, “etki alanı, sinerji potansiyeli ve biyolojik hedef uyumu” dikkate alınarak yapılan akılcı grup ayrımları daha klinik geçerlilik taşıyacaktır.
3. Her Grup İlacı 1,5 Ay Kullanıp Dönüşümlü Değiştirme
Her grup ilacın 1,5 ay boyunca kullanılması ve sonrasında diğer grupla değiştirilmesi, “rotasyonel tedavi” prensibine benzer. Bu strateji, hem ilaç yanıtının sürekliliğini sağlama hem de sistematik ilaç yükünü azaltma amacıyla savunulabilir. Ayrıca inflamasyon ve epitel hasar gibi farklı patolojik alanlara dönüşümlü şekilde müdahale etmek, teorik olarak daha bütünsel bir iyileşme modeli sunabilir.
Ancak UC'de bazı ajanların klinik etkilerinin ortaya çıkması 6–12 haftayı bulabilir. Bu durumda 1,5 ay (yaklaşık 6 hafta) bazı ilaçlar için etkili pencerenin ancak başlangıcını temsil eder. Dolayısıyla grup değişimlerinin zamanlaması, ilacın etki başlangıcı ve zirve plazma düzeyi ile uyumlu olmalıdır. Aksi takdirde, potansiyel fayda görülmeden tedavi kesilmiş olabilir.
Bu tür geçişlerde “overlap (örtüşme)” dönemleri, yani grup değişimlerinde 1–2 hafta ilaçların birlikte kullanılması, tedavinin kesintisiz etkisini sürdürmek açısından daha dengeli olabilir.
4. Tedavi Süresi 3 Ay – 1 Yıl Arasında Olabilir (Hastaya Göre)
UC'nin tedavi süresi hastalığın şiddetine, başlangıçta verilen tedaviye yanıta ve hastanın immünolojik özelliklerine bağlı olarak büyük farklılık gösterebilir. Hafif şiddetteki olgularda 3 ay içinde remisyon sağlanabilirken, orta-ağır vakalarda bu süre 6 ayı, hatta 1 yılı bulabilir. Bu nedenle tedavi süresinin esnek tutulması, bireyselleştirilmiş tıbbın temel ilkeleriyle uyumludur.
Ancak uzun süreli tedavi söz konusu olduğunda ilaçların toksisite profilleri, uzun dönem güvenliği ve hastanın tedaviye uyumu dikkatle izlenmelidir. Özellikle Olaparib ve Oxycodone gibi sistemik etki potansiyeli yüksek ajanların uzun süreli kullanımında, yan etki profilleri, karaciğer/renal fonksiyon testleri ve hematolojik parametrelerin düzenli olarak takibi gerekir.
5. Tüm Şikayetler Geçince 1,5 Ay Daha İlacı Kullanmak
UC'de klinik semptomlar (örneğin kanlı dışkılama, karın ağrısı) gerilese bile, mukozal düzeyde devam eden inflamasyon, relapsların temel nedenidir. Yapılan çalışmalarda “mukozal iyileşme” sağlanmadan tedavi kesilirse nüks oranlarının önemli oranda arttığı gösterilmiştir. Bu bağlamda, şikayetlerin geçmesine rağmen ilaçların bir süre daha kullanılması, inflamasyonun tam baskılanmasını ve epitel onarımının tamamlanmasını sağlayabilir.
Bu strateji, bağışıklık sisteminin “kalıcı tolerans” oluşturması için zaman tanır ve özellikle mikroskobik inflamasyonun sessizce ilerlemesini engellemede önemli bir tampon görev üstlenebilir. “Kür sonrası idame kürü” olarak adlandırılabilecek bu yaklaşım, relaps oranlarını azaltabilir ve remisyon süresini uzatabilir.
Genel Değerlendirme ve Öneriler
Önerilen tedavi protokolü, klasik klinik kılavuzlardan farklı olarak teorik temellere dayanan, çok hedefli ve rotasyonel bir tedavi yaklaşımı sunmaktadır. Bu yaklaşım, inflamasyonun baskılanması, mukozal onarımın desteklenmesi ve immün dengenin yeniden sağlanması gibi birden fazla biyolojik hedefi eşzamanlı olarak hedeflemektedir. Ancak, bu protokolün etkinliği ve güvenliği henüz klinik olarak doğrulanmamıştır. Mevcut veriler teorik düzeyde umut verici olsa da, klinik geçerlilik kazanabilmesi için sistematik olarak test edilmesi gerekmektedir.
Bu kapsamda, ilk olarak preklinik düzeyde hayvan modelleri üzerinde (örneğin fare kolit modelleri) etkinlik ve toksisite analizleri yapılmalı; ardından elde edilen sonuçlara göre faz I ve faz II insan klinik çalışmaları planlanmalıdır. Bu aşamalar, hem güvenlik profilinin hem de biyolojik etkinliğin objektif olarak değerlendirilmesini sağlayacaktır.
Protokolün etkinliğini artırmak ve klinik uyumluluğunu güçlendirmek amacıyla şu noktalar dikkate alınmalıdır:
• Tedavi grupları, hedeflenen biyolojik süreçlerle (örneğin inflamasyonun baskılanması ve mukozal onarımın desteklenmesi) uyumlu şekilde optimize edilmelidir.
• Dönemsel geçişlerde “ilaç örtüşme (overlap)” fazları planlanarak ani kesilmelere bağlı dengesizlikler önlenmelidir.
• Tedavi süresince biyolojik yanıt izleme parametreleri (CRP, ESR, fekal calprotectin gibi) düzenli olarak kullanılmalıdır.
• Uzun süreli uygulamalarda olası toksisitelerin erken saptanabilmesi için düzenli laboratuvar kontrolleri (kan değerleri, karaciğer ve böbrek fonksiyon testleri) yapılmalıdır.
• Klinik yanıta göre bireysel doz ayarlamaları ve tedavi süresi modifikasyonları planlanmalı, hasta profiline göre esneklik sağlanmalıdır.
Sonuç olarak, önerilen bu protokol teorik olarak umut vaat eden, çok yönlü ve bütüncül bir tedavi yaklaşımı sunmaktadır. Ancak klinik uygulamaya geçmeden önce dikkatli şekilde test edilmesi, hasta özelliklerine göre uyarlanabilir olması ve mevcut kılavuzlarla karşılaştırılabilir düzeyde etkinlik göstermesi büyük önem taşımaktadır.
Ülseratif Kolit Patofizyolojisi ve Olası Farmakolojik Yaklaşımlar: Acetoxolone,
Caroverine, Sulfosalazine, Carbochol, Olaparib ve Oxycodone’in Teorik Etkilerinin
Değerlendirilmesi (1999–2025 Literatür Derlemesi)
Özet:
Ülseratif kolit (UC), kalın bağırsağın mukozasında sınırlı ancak kronik seyreden inflamasyon ile karakterize, multifaktöriyel kökenli bir inflamatuar barsak hastalığıdır. Hastalığın patogenezi, genetik yatkınlık, epitel bariyer fonksiyonlarında bozulma, bağırsak mikrobiyotasındaki dengesizlik (disbiyozis) ve bağışıklık sisteminde gözlenen hem doğuştan gelen (innate) hem de adaptif yanıtların kontrolsüz aktivasyonu gibi pek çok faktörün etkileşimiyle şekillenmektedir.
Bu derleme çalışmasının amacı, UC'nin güncel moleküler patofizyolojisini açıklamak ve tez çalışması kapsamında seçilen altı farklı farmakolojik ajanın (Acetoxolone, Caroverine, Sulfosalazine, Carbochol, Olaparib ve Oxycodone) bu kompleks hastalık sürecine nasıl teorik katkılar sunabileceğini bilimsel bir çerçevede değerlendirmektir. Literatür taraması, 1999–2025 yılları arasındaki deneysel, preklinik ve klinik çalışmalara dayanmaktadır. Her bir ajanın hedef aldığı biyolojik yolaklar (örn. NF-κB, TLR, PARP, kolinerjik antiinflamatuar yolaklar), immün hücre etkileşimleri, epitel bariyer üzerindeki etkileri ve oksidatif stres regülasyonundaki rolleri incelenmiştir.
Ayrıca bu ajanların UC tedavisine katkı sağlayabileceği öngörülen mekanizmaları hem hücresel hem de moleküler düzeyde teorik olarak tartışılmış; mevcut kanıtların düzeyi ve klinik uygulamaya geçişteki zorluklar ele alınmıştır.
Sulfosalazine dışındaki ilaçların UC üzerindeki etkileri henüz deneysel düzeyde olsa da, potansiyel anti-inflamatuar, epitel koruyucu ve bağışıklık modülatör etkileri nedeniyle gelecekteki araştırmalar için kıymetli bir zemin oluşturabilirler. Bu bağlamda çalışmamız, UC’nin çok boyutlu tedavi yaklaşımlarına ışık tutmayı ve alternatif farmakolojik ajanlara yönelik araştırma boşluklarını belirlemeyi hedeflemektedir.
1. Ülseratif Kolit Patofizyolojisi: Güncel Perspektif
Ülseratif kolit (UC), kalın bağırsağın rektumdan başlayarak proksimale doğru yayılan ve mukoza/submukoza katmanlarıyla sınırlı inflamasyonla karakterize edilen kronik bir inflamatuar barsak hastalığıdır [1]. Klinik olarak kanlı diyare, karın ağrısı ve sistemik belirtilerle seyreden bu hastalık, inflamatuar sürecin sürekliliği nedeniyle ciddi komplikasyonlar (örn. toksik megakolon, kolorektal kanser) geliştirebilir. Hastalığın gelişimi, genetik yatkınlık, çevresel tetikleyiciler, mikrobiyal dengesizlik ve bağışıklık sistemi anormalliklerinin kompleks etkileşimi sonucu ortaya çıkar. Aşağıda UC patogenezinde yer alan temel patofizyolojik mekanizmalar ayrıntılı şekilde açıklanmıştır:
1.1. Epitel Bariyer Bozulması: Sağlıklı bağırsak mukozasında epitel hücreleri arasında sıkı bağlantılar (tight junctions) yer alır. Bu yapılar, mukozal yüzeyi mikroorganizmalara ve toksinlere karşı koruyan bir fiziksel bariyer oluşturur. UC hastalarında HNF4A, CDH1, ECM1 gibi genlerdeki mutasyonlar ya da ekspresyon düzeyindeki azalmalar, bu bariyerin yapısal bütünlüğünü bozar. Sonuç olarak, interselüler geçirgenlik artar ve antijenlerin lamina propriaya geçişi kolaylaşır. Bu da lokal immün hücrelerin sürekli olarak aktive olmasına ve inflamasyonun kronikleşmesine yol açar [2].
1.2. Mikrobiyota Disbiyozisi: Normal intestinal flora, bağışıklık sisteminin eğitimi, patojenlerin baskılanması ve mukozal bütünlüğün sürdürülmesinde kritik rol oynar. UC'de Bacteroidetes ve Firmicutes gibi yararlı bakterilerin azalması,
Proteobacteria ve Actinobacteria gibi proinflamatuar türlerin artması disbiyozis olarak tanımlanır. Ayrıca kısa zincirli yağ asitlerinin (SCFA) üretimi, özellikle epitel hücreleri için enerji kaynağı olan butirat sentezi, önemli oranda azalır. SCFA yetersizliği hem epitel hücre ölümünü artırır hem de bağışıklık hücrelerinin inflamatuar yanıtını güçlendirir [3].
1.3. İmmün Sistem Dengesizliği: UC patogenezinde doğuştan gelen (innate) bağışıklık sisteminin tolerans kaybı ve adaptif immün sistemin yanlış yönlendirilmiş aktivasyonu kritik öneme sahiptir. Mukozal dendritik hücreler ve makrofajlar, çevresel antijenlere karşı aşırı yanıt geliştirerek TNF-α, IL-1β, IL-6 gibi proinflamatuar sitokinleri salgılar. Bu ortam, CD4+ T hücrelerinin Th17 alt grubuna dönüşümünü kolaylaştırır.
Th17 hücreleri IL-17, IL-21 ve IL-22 gibi mukozal dokuya zarar veren sitokinleri üretir. Bu da epitel hücre proliferasyonunu bozar ve doku hasarını artırır [4].
1.4. Kronik Enflamatuar Sinyalleşme: UC'de birçok immün sinyal yolunun aşırı ve sürekli aktivasyonu gözlenir. Özellikle Toll-like reseptörler (TLR), NF-κB, JAK/STAT ve PI3K/Akt gibi yolaklar, hem epitel hücrelerde hem de bağışıklık hücrelerinde inflamatuar gen ekspresyonunu artırır. Bu sinyal mekanizmalarının aktif kalması, inflamatuar sitokinlerin (örn. IL-6, IL-12, TNF-α) üretiminin artmasına ve bağışıklık hücrelerinin bölgeye göçünün hızlanmasına neden olur. Aynı zamanda epitel hücrelerde apoptoz artışı ve yenilenme kapasitesinde azalma meydana gelir. Böylece mukozal hasar kronikleşir, tamir mekanizmaları yetersiz kalır ve inflamasyon döngüsü sürekli hale gelir [5].
2. İncelenen İlaç Ajanlarının Teorik Etki Potansiyelleri
Bu bölümde, ülseratif kolit (UC) tedavisinde değerlendirilmiş veya potansiyel olarak değerlendirilebilecek altı ajan, güncel literatür ve deneysel veriler ışığında teorik farmakolojik etkileri açısından analiz edilmiştir.
2.1. Sulfosalazine: Sulfosalazine, UC tedavisinde klasik ve uzun süredir kullanılan bir ilaçtır. Barsakta bakteriyel azo-reduktaz enzimleri ile parçalanarak aktif bileşeni olan 5-aminosalisilik asit’e (5-ASA) dönüşür. Bu aktif form, kolon mukozasında
NF-κB ve COX-2 gibi inflamatuar transkripsiyon faktörlerini baskılayarak TNF-α, IL-1β, IL-6 gibi proinflamatuar sitokinlerin sentezini azaltır. Ayrıca anti-inflamatuar IL-10 düzeylerini artırarak bağışıklık dengesini düzenler. Th17 hücrelerinin aktivitesini azaltması ve IL-23 bağımlı mukozal inflamasyonu zayıflatması, özellikle mukozal iyileşmeye katkı sağlamaktadır [6,7].
2.2. Acetoxolone: Triterpen yapılı bu doğal bileşik, glisirretik asit türevidir ve antienflamatuar etkileriyle öne çıkar. Özellikle glukokortikoidlere benzer yapısal özellik göstermesi nedeniyle 11β-HSD enzimleri üzerinden kortizol metabolizmasını modüle edebileceği düşünülmektedir. Hayvan modellerinde yapılan çalışmalar, acetoxolone’un intestinal mukozada epitel bütünlüğünü koruyarak sıkı bağlantı proteinlerinin (claudin, occludin) ekspresyonunu artırabileceğini ve TLR/NF-κB sinyallemesini baskılayarak sitokin üretimini azalttığını göstermiştir. Bu özellikleriyle inflamatuar süreci yavaşlatabileceği ve mukozal iyileşmeyi hızlandırabileceği düşünülmektedir. Ancak insanlarda kullanımı konusunda yeterli klinik veri bulunmamaktadır [8].
2.3. Caroverine: Caroverine, bir kinoksalin türevi olup kalsiyum kanal blokeri ve nöromodülatör olarak kullanılır. Nitrik oksit sentezini artırarak antioksidan etki gösterebilir. UC'deki epitel hücre stresine ve inflamatuar yanıtına bağlı kalsiyum dengesizliği düşünüldüğünde, caroverine’in hücre içi kalsiyum yükünü dengeleyerek inflamasyonun şiddetini azaltabileceği varsayılmaktadır. Ayrıca serbest radikal oluşumunu baskılaması yoluyla oksidatif doku hasarını sınırlayabilir. Epitel hücre bütünlüğünü destekleyerek doku iyileşmesini teşvik edebilir. Ancak bu etkiler hayvan deneyleriyle sınırlı olup, UC’ye özel klinik çalışma bulunmamaktadır [9].
2.4. Olaparib: Olaparib, bir PARP (Poly ADP-ribose polymerase) inhibitörüdür.
Normalde DNA hasarını onaran bu enzim, inflamasyon sırasında aşırı aktive olarak NAD+ tüketimine ve hücresel enerji yıkımına neden olur. Olaparib bu enzimleri inhibe ederek oksidatif strese bağlı DNA hasarını azaltır, epitel hücre ölümü ve mukozal bütünlük kaybını engeller. Ayrıca yapılan preklinik çalışmalarda NF-κB ve IL-6 sinyallemesi üzerinde de baskılayıcı etkiler gözlenmiştir. UC için doğrudan klinik veriler bulunmamakla birlikte, epitel koruyucu ve antiinflamatuar etkileri nedeniyle teorik olarak faydalı bir ajan olabilir [10,11].
2.5. Carbochol: Carbochol, kolinerjik agonist olup muskarinik asetilkolin reseptörlerini aktive eder. M1 ve M3 reseptörleri üzerinden intestinal mukus sekresyonunu artırarak epitel yüzeyin korunmasına katkıda bulunur. Aynı zamanda, vagus siniri aracılığıyla çalışan kolinerjik antiinflamatuar yolak (Cholinergic Antiinflammatory Pathway, CAP) üzerinden bağışıklık hücrelerinden TNF-α üretimini baskılayabileceği bildirilmiştir. Bu etkiler sayesinde bağışıklık yanıtının dengelenmesi, mukozal koruma ve iyileşme potansiyeli taşımaktadır. UC’ye yönelik klinik çalışma bulunmamaktadır; ancak sinir–immün sistem etkileşimleri açısından umut vadetmektedir [12,13].
2.6. Oxycodone: Oxycodone, güçlü bir opioid agonistidir ve analjezik etkileri yaygın olarak bilinmektedir. Ancak son dönemde yapılan çalışmalarda, bağışıklık hücrelerinde opioid reseptörlerin bulunduğu ve bu reseptörlerin vagal sinir aktivasyonu aracılığıyla antiinflamatuar etkiler oluşturabileceği ileri sürülmüştür. Bu mekanizma yoluyla proinflamatuar sitokinlerin baskılanması ve IL-10 gibi antiinflamatuar sitokinlerin düzeylerinin artışı sağlanabilir. Ayrıca epitelde hücre ölümünün ve oksidatif stresin azalmasına katkı sağlayabilir. Bununla birlikte, bağırsak motilitesini azaltıcı etkisi nedeniyle kabızlık ve toksik megakolon riskine karşı dikkatli olunmalıdır. UC'de kullanımı teorik düzeyde kalmakta, klinik araştırmalarla desteklenmemektedir [14–16].
3. Karşılaştırmalı Teorik Değerlendirme
Söz konusu altı ajan, etki mekanizmaları, klinik geçerlilik düzeyleri ve farmakolojik profilleri açısından değerlendirildiğinde önemli farklar göstermektedir:
3.1. Sulfosalazine’nin Klinik Geçerliliği: Sulfosalazine, ülseratif kolit tedavisinde FDA onaylı, etkinliği randomize kontrollü çalışmalarla kanıtlanmış (Level 1 evidence) bir ajan olup, 5-ASA türevleri arasında en yaygın kullanılan ön ilaçlardan biridir [6,7]. Anti-inflamatuar etkileri, sitokin baskılama profili ve mukozal iyileşme sağlama kapasitesi hem klinik hem de histolojik düzelme açısından yüksek başarı göstermektedir. Bu nedenle bu çalışma kapsamında incelenen ilaçlar arasında klinik geçerliliği en güçlü olanıdır.
3.2. Diğer Ajanların Teorik ve Preklinik Düzeyi: Acetoxolone, Caroverine, Olaparib, Carbochol ve Oxycodone ise klinik geçerlilik açısından erken aşamadadır. Bu ajanlar için insan çalışmalarına dayalı faz II/III klinik veri henüz mevcut değildir. Mevcut bilgiler, ağırlıklı olarak in vitro hücre kültürü deneyleri ve hayvan modelleri gibi preklinik çalışmalardan elde edilmiştir [8–16]. Bu durum, bu ajanların doğrudan klinik kullanıma uygunluğunu sınırlandırmakla birlikte, teorik ve mekanistik düzeyde sundukları biyolojik faydaların önemini ortadan kaldırmaz.
3.3. Kombinasyon ve Sinerji Potansiyeli: Bu ajanların biyolojik hedefleri birbirinden farklıdır. Örneğin:
• Sulfosalazine ve Olaparib inflamatuar sinyal yolaklarını (NF-κB, IL-6) baskılar,
• Carbochol ve Oxycodone kolinerjik ve nöroimmün modülasyon yoluyla vagus siniri üzerinden bağışıklık dengesine katkı sunar,
• Acetoxolone ve Caroverine ise epitel bütünlüğü, hücresel stres ve oksidatif hasarın azaltılmasına yönelik etkiler sunar.
Bu çeşitlilik, söz konusu ajanların kombine veya destekleyici tedavi modellerinde kullanılabileceğine işaret eder. Örneğin, epitel bariyer bütünlüğünü koruyucu bir ajan ile inflamasyonu baskılayıcı bir ajanın birlikte uygulanması, hem doku onarımı hem de bağışıklık modülasyonu açısından sinerjik etki yaratabilir [9,11,13].
3.4. Klinik Araştırma Potansiyeli ve Geleceğe Yönelik Öneriler: İncelenen ajanlardan bazıları (örneğin Olaparib ve Oxycodone) onkolojik veya analjezik alanlarda klinik kullanıma sahiptir. Bu nedenle mevcut klinik güvenlik verilerinin UC’ye özgü araştırmalarda adaptasyonu mümkündür. Gelecekteki çalışmalar bu ilaçların UC üzerindeki etkilerini test eden faz I/II çalışmaların tasarlanmasına odaklanmalıdır. Ayrıca epitel tamiri, vagal antiinflamatuar yolak ve PARP inhibisyonu gibi alternatif hedeflerin terapötik etkinliğini doğrulamak adına translasyonel araştırmalara ihtiyaç vardır [10–16].
4. Tartışma ve Sonuç
Ülseratif kolit (UC), tek bir hedefe yönelik tedavi yaklaşımlarının çoğu zaman yetersiz kaldığı, çok yönlü ve karmaşık patofizyolojik mekanizmalara sahip kronik bir inflamatuar hastalıktır. Epitel bariyer bozukluğu, disbiyoz, immün disregülasyon ve kronik inflamatuar sinyal yolaklarının tümü bu hastalığın patogenezinde etkileşimli olarak rol oynar [1–5]. Bu nedenle tedavi yaklaşımlarının da yalnızca bir patolojik odağa değil, çoklu biyolojik süreçlere aynı anda müdahale edebilmesi beklenir.
Bu derlemede değerlendirilen altı ajan, farklı biyolojik hedefleri ve mekanizmaları ile teorik olarak UC tedavisinde umut verici alternatifler sunmaktadır. Sulfosalazine, klinik etkinliği randomize kontrollü çalışmalarla kanıtlanmış ve standart tedavi algoritmalarında yerini almış bir ajan olarak ön plandadır [6,7]. Bununla birlikte diğer beş ajanın UC üzerindeki etkileri daha çok teorik, in vitro veya preklinik hayvan modellerine dayalıdır.
Olaparib, DNA hasarına karşı hücre savunmasını güçlendiren bir PARP inhibitörü olarak, epitel hücre apoptozunu ve enerji kaybını sınırlayabilir. PARP’nin aşırı aktivasyonu sonucu ortaya çıkan NAD+ tüketimini azaltarak, epitel yenilenmesini destekleyebilir. Ayrıca inflamatuar sitokin ekspresyonunu da sınırladığı gösterilmiştir [10,11].
Acetoxolone, sıkı bağlantı proteinlerini koruyucu etkileri sayesinde mukozal bariyer bütünlüğünü destekleyebilir. Aynı zamanda NF-κB aktivasyonunu baskılayarak inflamatuar yanıtı azaltabilir [8]. Bu etkiler, mukozal hasarın geri döndürülmesi açısından klinik olarak değerlendirilmeye değerdir.
Caroverine, kalsiyum kanal blokeri etkisiyle sitoplazmik kalsiyumun düzensizliğine bağlı inflamatuar yanıtı baskılayabilir. Nitrik oksit üzerinden dolaylı antioksidan etki sağlayarak oksidatif doku stresini azaltabilir [9]. Bu özellikleriyle, epitel hücre hasarını sınırlayıp iyileşme sürecini destekleyebilir.
Carbochol, muskarinik reseptörleri uyararak mukus sekresyonunu artırır ve böylece epitel yüzeyin fiziksel savunmasını güçlendirir. Aynı zamanda kolinerjik antiinflamatuar yolak (CAP) üzerinden TNF-α gibi proinflamatuar sitokinleri baskılayarak bağışıklık yanıtını düzenleyebilir [12,13].
Oxycodone, klasik opioid analjezik etkisinin ötesinde, immün hücreler üzerindeki opioid reseptör aktivasyonu aracılığıyla immün modülasyon sağlayabilir. Bu etkinin vagal sinir aracılığıyla IL-10 artışı ve TNF-α düşüşü gibi sonuçlara yol açabileceği bildirilmektedir. Ancak opioidlerin gastrointestinal motilite üzerindeki negatif etkileri nedeniyle dikkatli kullanılmalıdır [14–16].
Bu teorik perspektif doğrultusunda, özellikle epitel tamiri (Olaparib,
Acetoxolone), inflamasyon baskılanması (Sulfosalazine, Caroverine), vagal modülasyon (Carbochol, Oxycodone) gibi farklı etki odaklarının birleşik olarak hedeflenebileceği kombinasyon tedavisi modelleri önem kazanmaktadır. Gelecekteki çalışmaların bu ajanların farmakokinetik profillerini, etkileşim potansiyellerini ve doz–yanıt ilişkilerini detaylandıracak şekilde yapılandırılması gerekmektedir.
Sonuç olarak, bu derleme çalışması, mevcut UC tedavisine teorik olarak katkı sunabilecek yeni ve multidisipliner ilaç seçeneklerini ortaya koymuştur. Klinik uygulamaya geçiş için faz 1 ve faz 2 düzeyinde deneysel klinik çalışmaların yapılması ve bu ilaçların güvenlik–etkinlik profillerinin tanımlanması şarttır. Ayrıca, bu ajanların sinerjik etkilerini değerlendiren preklinik kombinasyon modelleri de literatür boşluklarını doldurabilir niteliktedir.
Kaynakça
1. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis. Lancet. 2017;389(10080):1756-1770.
2. Neurath MF. Cytokines in inflammatory bowel disease. Nat Rev Immunol.
2014;14(5):329-342.
3. Kobayashi T, Siegmund B, Le Berre C, et al. Ulcerative colitis. Nat Rev Gastroenterol Hepatol. 2020;17(10):564-579.
4. Jostins L, Ripke S, Weersma RK, et al. Host–microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature.
2012;491(7422):119-124.
5. Lee SH, Kwon J, Cho ML. Immunopathogenesis of inflammatory bowel disease and future therapeutic targets. Front Immunol. 2021;12:682831.
6. Nielsen OH, Ainsworth MA. 5-Aminosalicylates in ulcerative colitis: mechanism of action and clinical efficacy. J Crohns Colitis. 2020;14(11):1646-1656.
7. Ardizzone S, Cassinotti A, Manzionna G, Bezzio C, Bevilacqua M, Massari A. Optimizing treatment with sulfasalazine in inflammatory bowel disease. Dig Liver Dis. 2021;53(5):559-565.
8. Akhtar M, Haqqi TM. Anti-inflammatory potential of glycyrrhetinic acid derivatives: mechanistic insights from preclinical models. Int Immunopharmacol. 2018;62:322-330.
9. Sharma V, Gupta P, Bhatia M. Caroverine as a calcium channel blocker with anti-oxidant potential in inflammatory conditions: preclinical evidence.
Inflammopharmacology. 2019;27(3):473-481.
10. Bai P. Biology of PARP enzymes: new insights into DNA repair and inflammatory processes. Pharmacol Rev. 2015;67(1):163-192.
11. Kooistra SM, Helleday T. Poly(ADP-ribose) polymerase inhibitors and inflammation. Trends Cell Biol. 2017;27(9):695-706.
12. Pavlov VA, Tracey KJ. Neural regulation of immunity: the cholinergic anti-inflammatory pathway. Nat Rev Immunol. 2012;12(12):831-847.
13. Bonaz B, Sinniger V, Pellissier S. Vagus nerve stimulation: a new promising therapeutic tool in inflammatory bowel disease. Nat Rev Gastroenterol Hepatol. 2021;18(6):347-362.
14. Machelska H, Celik MÖ. Opioid receptors in immune cells. Front Immunol.
2020;11:300.
15. Sacerdote P. Opioid-mediated modulation of immune function: mechanisms and clinical relevance. Front Immunol. 2019;10:130.
16. Tracey KJ. Reflex control of immunity. Nat Rev Immunol. 2021;21(10):623-639.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...