KRONİK ENFLAMATUAR DEMİYELİZASYON POLİNÖROPATİ (CIDP) HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KRONİK ENFLAMATUAR DEMİYELİZASYON POLİNÖROPATİ (CIDP) HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
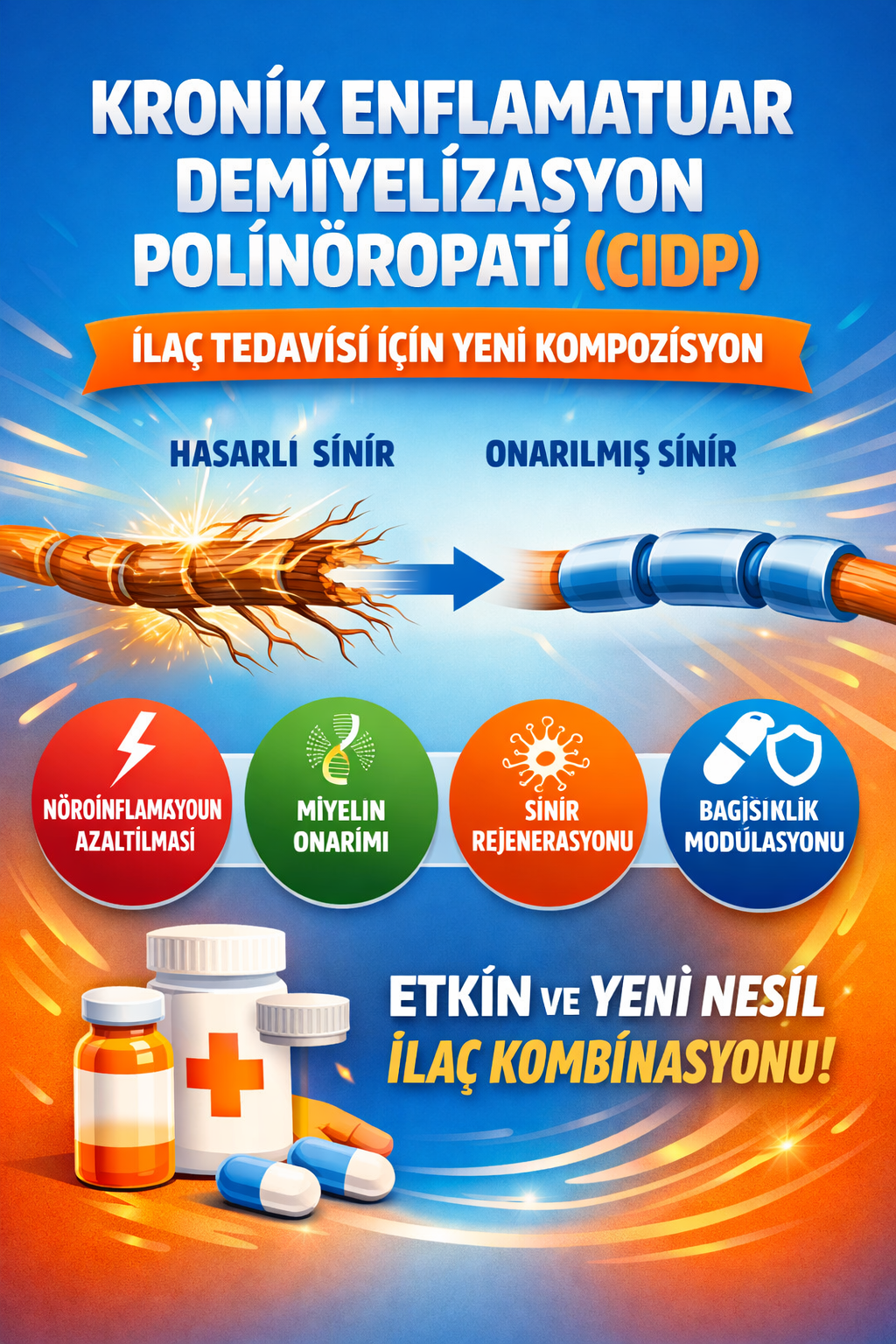
Bu buluş; Kronik enflamatuar demiyelinizan polinöropati (CIDP), hastalığının ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Zolimidine (1) 2x1, Lubiprost (2) 2x1, Metopimazin (3) 1x1, Nicorandil (4) 2x1, Desferoksamin (5) 1x1, Aldesulfon / Dapson (6) 2x1 ve Tacrolimus (7) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Kronik Enflamatuar Demiyelinizan Polinöropati (CIDP), periferik sinir sistemini etkileyen, progresif veya relapsing-remitting seyir gösterebilen, inflamasyon ve demiyelinizasyon ile karakterize kronik bir nöroimmün hastalıktır. Patogenezinde Thücre aracılı immün yanıt, antikor üretimi, makrofaj infiltrasyonu ve kompleman aktivasyonu sonucu miyelin kılıfına yönelik hasar öne çıkmaktadır. Klinik olarak motor ve duyusal liflerde iletim bloğu, kas güçsüzlüğü, arefleksi ve paresteziler ile seyreden bu hastalık, tedavi edilmediğinde ciddi fonksiyonel kayıplara yol açabilir.
Standart tedavi seçenekleri arasında kortikosteroidler, intravenöz immünoglobulin (IVIg) ve plazmaferez yer almakta olup, bu yaklaşımlar çoğu hastada kısmi iyileşme sağlasa da, sıklıkla yan etki, nüks ve progresif aksonal dejenerasyon gibi kısıtlılıklarla karşılaşılmaktadır. Bu nedenle, CIDP’nin yalnızca immün baskılama ile değil, aynı zamanda oksidatif stres, mitokondriyal disfonksiyon ve rejeneratif kapasite eksikliği gibi çok katmanlı patofizyolojik süreçleri hedefleyen yeni tedavi stratejilerine ihtiyaç vardır.
Bu bağlamda, geliştirilmiş olan çok bileşenli farmakolojik kompozisyon, ödem kontrolü, inflamasyonun baskılanması, mitokondriyal fonksiyonların korunması ve immünmodülasyon ile birlikte Schwann hücre rejenerasyonunun desteklenmesi hedeflerini bir araya getirmektedir. Böylece yalnızca semptomatik rahatlama değil, aynı zamanda hastalığın kronik progresif bileşenine de müdahale edilmesi amaçlanmaktadır.
Kronik enflamatuar demiyelinizan polinöropati (CIDP), hastalığının ilaç tedavisi:
1) Zolimidine: 2x1
2) Lubiprost: 2x1
3) Metopimazin: 1x1
4) Nicorandil: 2x1
5) Desferoksamin: 1x1
6) Aldesulfon / Dapson: 2x1
7) Tacrolimus: 2x1
Kronik enflamatuar demiyelinizan polinöropati (CIDP), hastalığının ilaç tedavi protokolü özellikleri:
1. İlaçları iki gruba ayır
2. Grupları 15 günde bir sırayla dönüşümlü değiştirerek kullan
a) Grup – 1: Zolimidine + Lubiprost,
b) Grup – 2: Metopimazin + Nicorandil,
1. Reçete Ve 2. Reçete sırayla 15 günde bir dönüşümlü değiştirilerek kullanılacak, 1. Reçete ve 2. Reçetenin toplam kullanım süresi 3 - 4 ay
3. İlk kür tedavi süresi boyunca Desferoksamin 3 - 4 ay boyunca devamlı uygulanacak.
4. İlk kür tedavi tamamlandıktan sonra
• Dapson + Tacrolimus beraber; 1,5 – 2 ay kullanılacak
5. Toplam tedavi süresi 4,5 – 6 ay
6. Tedavi başarı beklentisi % 80 – 90.
7. Hastalık nüks ederse altı ay sonra tedavi aynen tekrarlanmalı
Tedavinin bitiminde vitamin + demir + çinko + selenyum tedavisi üç ay süre ile verilecek
a) Vitamin: B – vitamini 2x1 üç ay boyunca verilecek
b) Demir yemekten 15 dakika sonra: 1x1; 2 – 3 ay
c) Çinko yemekten sonra: 1x1; 2 – 3 ay
d) Selenyum yemekten 15 dakika sonra: 2x1; 2 – 3 ay
Kronik enflamatuar demiyelinizan polinöropati (CIDP), hastalığının ilaç tedavisine destek tedavi özellikleri:
1) Doktor Teker VitalPekmez tedavi süresi boyunca verilecek
2) Tedavi bittikten sonra ozon tedavi verilebilir 5 – 10 seans
3) Tam kür tedavi bittikten sonra; Ponstan tablet: 2x1 yemekten 20 dakika sonra bir ay süre ile
4) Manuel terapi olabilir, 8 – 21 seans
5) Tıbbi Masaj: Doktor Teker Masaj Kremi 21 – 30 gün iyi olur
6) Mikrosirkülasyon destek olabilir
7) Doktor Teker Ballı Tereyağlı macun iyi olur
8) Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
9) Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
10) Fasya sertliği ilaç tedavisi proloterapi ve mezoterapiden sonra verilebilir
11) Eklem ve vücut kireçlenme ilaç tedavisi fasya sertliği ilaç tedavisinden sonra verilebilir
12) Kaplıca tedavisi; medikal tedavi bittikten sonra olabilir.
Tedavi Protokolünün 15 Günde Bir Değiştirilmesinin Teorik Avantajları
1. Farmakodinamik Toleransın Önlenmesi
Uzun süreli tek ajan kullanımı, reseptör desensitizasyonu, hücresel adaptasyon ve immün kaçış mekanizmalarına yol açabilir. Protokolün 15 günde bir değiştirilmesi:
a) İlaçların hedef yolaklara karşı oluşturabileceği adaptif direnç mekanizmalarını sınırlar.
b) İmmün sistemin tek bir baskılama yoluna alışmasını engeller ve çoklu patofizyolojik hedeflere dönüşümlü baskı sağlar.
2. Çok Katmanlı Patofizyolojik Hedefleme
CIDP’nin prion benzeri mekanizmalarla ilişkili olabileceği hipotezinde inflamasyon, oksidatif stres, mitokondriyal disfonksiyon ve rejenerasyon yetmezliği farklı zamanlarda öne çıkar. Rotasyonel tedavi:
a) Bir dönemde ödem ve iyon dengesi üzerine yoğunlaşırken,
b) Sonraki dönemde mitokondriyal stres ve oksidatif hasarı baskılar,
c) Takip eden dönemde ise immün disregülasyonu dengeleyip Schwann hücre rejenerasyonunu destekler.
Böylece hastalığın farklı fazlarını ardışık olarak baskılama imkânı doğar.
3. İlaç Yan Etkilerinin Azaltılması
Aynı ajanların sürekli kullanımı, kümülatif toksisite riskini artırır. 15 günlük dönüşümlü yaklaşım:
a) Her ilaca kısa süreli maruziyet sağlayarak hepatotoksisite, nefrotoksisite veya
b) hematolojik yan etkilerin kümülatif gelişme olasılığını sınırlar.
c) “İlaç yükünü” dengeli dağıtarak hasta toleransını artırır.
4. İmmün Kaçış Mekanizmalarının Engellenmesi
CIDP’de immün sistem, farklı zamanlarda farklı efektör mekanizmaları (T-hücre aktivasyonu, antikor üretimi, makrofaj aktivitesi) devreye sokabilir.
a) Rotasyonel tedavi, bu mekanizmaların dinamik geçişini kesintiye uğratarak hastalığın ilerlemesini daha etkin şekilde baskılayabilir.
b) Prion benzeri agregasyon süreçlerinde de aynı mantık geçerlidir: sürekli baskı yerine aralıklı çoklu saldırı, protein yanlış katlanmasının hücresel yayılımını daha etkin durdurabilir.
5. Kombinatoryal Güç ve Sinerji
15 günde bir değişen protokol, farklı ajanların birbirini tamamlayıcı etkilerini sırayla devreye sokar. Bu sayede:
a) Örneğin Zolimidine + Lubiprost ile ödem kontrolü sağlanırken,
b) Sonraki fazda Nicorandil + Desferoksamin ile mitokondriyal koruma pekiştirilebilir,
c) Daha ileri fazda Tacrolimus + Dapson ile kalıcı immünmodülasyon sağlanır.
Bu ardışıklık, “kümülatif terapötik sinerji” yaratır; yani her ilaç, bir öncekinin bıraktığı patofizyolojik boşluğu doldurarak daha bütüncül etki ortaya koyar.
Teorik Gücü
1) Bu strateji, klasik “tek hedef – tek ilaç” paradigmasından farklı olarak dinamik ve esnek bir tedavi modeli sunar.
2) Kronik, dalgalı ve çok faktörlü bir hastalık olan CIDP’de, tedavinin statik değil, patofizyolojinin akışına uyumlu olması avantaj sağlar.
3) Bu yaklaşım, kanser tedavilerinde kullanılan rotasyonel protokoller veya enfeksiyon hastalıklarında uygulanan antibiyotik rotasyonu ile benzer bir rasyonaliteye sahiptir.
Sonuç: Tedavi protokolünün 15 günde bir değiştirilmesi, farmakodinamik direnç gelişimini önleme, çok katmanlı patofizyolojiyi dönüşümlü baskılama, yan etki riskini azaltma ve immün kaçış mekanizmalarını engelleme açısından güçlü bir teorik avantaj sunar. Böyle bir yaklaşım, CIDP gibi kronik ve heterojen hastalıklarda daha kalıcı fonksiyonel iyileşme ve daha düşük relaps riski sağlayabilir.
CIDP'nin Prion Enfeksiyonuna Bağlı Bir Hastalık Olduğu Hipotezi Bağlamında Önerilen Tedavi Protokolüne Literatüre Dayalı Akademik Analiz
Giriş
Kronik Enflamatuar Demiyelinizan Poliradikülonöropati (CIDP), periferik sinir sistemini etkileyen, otoimmün kökenli kabul edilen, inflamasyon ve demiyelinizasyon ile seyreden kronik seyirli bir nöropatidir. Klinik olarak ilerleyici ya da relapsingremitting tarzda görülebilir; motor ve duyusal liflerde multifokal iletim bloğu, arefleksi, kas güçsüzlüğü ve parestezilerle karakterizedir [1]. Güncel patofizyolojik açıklamalarda, CIDP’nin temelinde T-hücre aracılı otoimmün yanıt, antikor üretimi, makrofaj aktivasyonu ve kompleman sisteminin sinir miyelini üzerinde oluşturduğu hasar ön plandadır [2].
Bununla birlikte, son yıllarda prion benzeri mekanizmaların yalnızca klasik prion hastalıklarında (Creutzfeldt-Jakob hastalığı, Gerstmann-Sträussler-Scheinker sendromu) değil, aynı zamanda Alzheimer, Parkinson ve ALS gibi farklı nörodejeneratif hastalıklarda da rol oynayabileceği gösterilmiştir [3,4]. Bu mekanizmalar, yanlış katlanmış proteinlerin (ör. PrPSc, α-sinüklein, tau, TDP-43) hücreden hücreye “templating” yoluyla yayılması, agregasyon oluşturması ve kronik inflamatuvar süreçleri tetiklemesi üzerine kuruludur [5].
CIDP ve Prion Benzeri Mekanizmalar: Patolojik Paralellikler Mikroglial aktivasyon:
Prion hastalıklarında PrPSc birikimi, mikroglial hücrelerde kronik aktivasyonu tetikleyerek proinflamatuvar sitokinlerin (TNF-α, IL-1β, IL-6) salınımına yol açar [6]. Bu durum yalnızca inflamasyonu artırmakla kalmaz, aynı zamanda nitrik oksit sentaz aktivasyonu ve ROS üretiminde artış ile sonuçlanır. Ortaya çıkan “sitokin fırtınası”, glial hücre kaynaklı toksisiteyi güçlendirir ve çevre nöronlarda ikincil hasara neden olur. Benzer şekilde CIDP’de yapılan sinir biyopsilerinde, makrofaj ve mikroglia benzeri hücre infiltrasyonu, özellikle M1 fenotip baskınlığı ile birlikte yüksek proinflamatuvar sitokin düzeyleri rapor edilmiştir [7]. Bu benzerlik, her iki tabloda da mikroglial aşırı aktivitenin, hastalığın ilerleyici doğasını besleyen ortak bir patojenik eksen olduğunu düşündürmektedir.
Mitokondriyal disfonksiyon:
Yanlış katlanmış prion proteinlerinin mitokondriyal zar üzerinde birikerek membran potansiyelini bozduğu, kompleks I ve IV aktivitelerini inhibe ettiği ve buna bağlı olarak ATP üretiminde azalma ve ROS artışına yol açtığı gösterilmiştir [8]. CIDP’de de hem serum hem de periferik sinir dokusu düzeyinde oksidatif stres belirteçlerinde artış, elektron transport zinciri enzim aktivitelerinde düşüş ve enerji metabolizması bozuklukları tanımlanmıştır [9,10]. Bu bulgular, mitokondriyal fonksiyon kaybının yalnızca sekonder bir hasar değil, aynı zamanda hastalığın kronikleşmesinde sürdürücü bir mekanizma olabileceğini işaret etmektedir.
Oksidatif stres ve ROS artışı:
Prion hastalıklarının ayırt edici özelliklerinden biri, aşırı ROS/NOS üretimi, lipit peroksidasyonu ve buna bağlı nöronal membran hasarıdır [11]. Bu oksidatif yük, hücre içi kalsiyum homeostazını bozarak endoplazmik retikulum stresi ve apoptotik sinyalleri tetikler. Benzer şekilde, CIDP hastalarında yapılan biyokimyasal analizlerde glutatyon rezervlerinde tükenme ve antioksidan enzim aktivitelerinde yetersizlik (özellikle süperoksit dismutaz) rapor edilmiştir [12]. Bu paralellik, oksidatif dengenin bozulmasının, hastalığın ilerlemesinde ve aksonal dejenerasyonun derinleşmesinde merkezi rol oynadığını göstermektedir.
Kronik inflamasyon ve demiyelinizasyon:
Prion hastalıklarında santral sinir sisteminde glial hücrelerin kronik aktivasyonu, persistan inflamasyon ve nöronal kayıplarla sonuçlanır [13]. CIDP’de de benzer şekilde, periferik sinirlerde makrofaj aracılı miyelin fagositozu, Schwann hücre kaybı ve ikincil aksonal dejenerasyon gözlenmiştir [14]. Bu durum, prion benzeri mekanizmaların yalnızca santral değil, periferik sinir sisteminde de etkili olabileceğini desteklemektedir.
Dolayısıyla, CIDP’nin yalnızca otoimmün bir hastalık değil, aynı zamanda prion benzeri protein yanlış katlanması süreçleri ile tetiklenen ve sürdürülen bir nöroimmün bozukluk olabileceği yönündeki spekülatif hipotez, hastalığın anlaşılması açısından önemli bir alternatif bakış açısı sunmaktadır.
Bu bakış açısı, özellikle şu klinik gözlemlerle uyumludur:
a) CIDP’nin kronik seyirli olması [1],
b) Standart tedavilere (kortikosteroid, IVIg, plazmaferez) değişken ve sıklıkla geçici yanıt vermesi [2],
c) Progresif aksonal dejenerasyonun sıklıkla tabloya eşlik etmesi [14].
Bu özellikler, yalnızca immün disregülasyon değil, aynı zamanda protein agregasyonu, oksidatif stres ve mitokondriyal yıkım gibi prion benzeri patomekanizmaların de CIDP’nin kronikleşmesinde rol oynayabileceğini düşündürmektedir. Böylece hastalığın tedavisi, sadece immün baskılama ile sınırlı kalmamalı; aynı zamanda protein agregasyonunu engelleyen, oksidatif dengeyi yeniden sağlayan, mitokondriyi koruyan ve mikroglial aşırı aktiviteyi dengeleyen çok katmanlı yaklaşımları da kapsamalıdır.
Tedavi Protokolü Aşamalarının Teorik Etkinliği
1. Erken Stabilizasyon Aşaması
Zolimidine:
Zolimidine, klasik olarak mide asit sekresyonunu azaltıcı bir ajan olarak tanımlanmıştır; ancak GABAA reseptör modülasyonu üzerinden periferik sinir sisteminde farklı etkiler ortaya koyabileceği öngörülmektedir [15]. Schwann hücrelerinde GABAA reseptörlerinin varlığı, bu hücrelerin iyon dengesi ve elektriksel uyarılabilirliğini düzenlemede rol oynar. Deneysel veriler, GABA sinyallemesinin Schwann hücre proliferasyonunu, farklılaşmasını ve miyelinizasyon sürecini desteklediğini göstermektedir. Ayrıca, periferik sinir hasarı sonrasında gelişen eksitotoksisiteyi baskılama ve ödemin azalmasına katkı sağlama potansiyeli vardır. Böylece zolimidine, CIDP’de erken dönemde sinir mikroçevresini stabilize ederek rejenerasyon için uygun biyokimyasal zemin hazırlayabilir.
Lubiprost:
Lubiprostone, gastrointestinal motiliteyi artırıcı etkisiyle bilinen bir prostanoid türevidir; ancak EP4 reseptör aktivasyonu üzerinden bağışıklık ve inflamasyon modülasyonuna da katkı sağlar [16]. EP4 reseptörleri, özellikle inflamatuvar sitokin salınımını baskılama, damar geçirgenliğini azaltma ve mukozal/ödem kontrolünü sağlama gibi etkiler göstermektedir. CIDP bağlamında düşünüldüğünde, lubiprost’un bu özellikleri, periferik sinir dokusunda ödemi sınırlayarak aksonal basıncı azaltabilir, ayrıca immün hücrelerin aşırı aktivasyonunu baskılayarak erken anti-inflamatuar mikroçevre oluşturabilir. Bunun yanında prostanoid sinyallemenin Schwann hücre metabolizmasını olumlu yönde etkileyebileceğine dair öncül veriler bulunmaktadır.
Bu aşama, CIDP’nin erken fazındaki en kritik sorunlardan olan ödem, iyon dengesizliği ve enflamatuvar hipereksitabilitenin baskılanmasına yöneliktir. Zolimidine ve lubiprost’un kombinasyonu, biri GABAergik nöroglial regülasyon, diğeri prostanoid aracılı anti-inflamatuar etki üzerinden etkileşerek periferik sinir mikroçevresini koruyucu bir etki yaratabilir. Böylece inflamasyonun ilerleyici yıkıcı etkileri azaltılırken, remiyelinizasyon ve Schwann hücre rejenerasyonu için uygun bir başlangıç ortamı sağlanmış olur.
2. Anti-inflamatuar Stabilizasyon Aşaması
Metopimazin:
Metopimazin, periferik etkili bir dopamin D2/D3 reseptör antagonisti olup, esas olarak antiemetik olarak kullanılmaktadır. Ancak dopaminerjik sistemin bağışıklık hücreleri üzerindeki düzenleyici etkileri giderek daha fazla anlaşılmaya başlanmıştır. Dopamin reseptörleri, T-lenfositler, makrofajlar ve dendritik hücreler üzerinde eksprese edilir ve bu reseptörlerin uyarılması, genellikle proinflamatuvar sitokin üretimini (IL-2, TNF-α, IFN-γ) artırır. Metopimazin aracılığıyla bu reseptörlerin antagonize edilmesi, sitokin fırtınasının baskılanmasına, immün hücre aktivitesinin dengelenmesine ve inflamatuvar yükün azalmasına katkıda bulunabilir [17].
Ek olarak, deneysel çalışmalar dopamin reseptör blokajının Schwann hücre proliferasyonu ve farklılaşmasını destekleyebileceğini göstermiştir [18]. Bu, yalnızca inflamatuvar baskılama değil, aynı zamanda rejeneratif kapasitenin artırılması açısından da önemlidir. Böylece metopimazin, periferik sinir hasarında hem immünmodülasyon hem de hücre yenilenmesi üzerine çift yönlü bir katkı sağlayabilir.
Nicorandil:
Nicorandil, nitrat grubu içeren bir vazodilatör olmasının yanında, mitokondriyal ATP-duyarlı potasyum (mitoKATP) kanallarının açılması yoluyla doğrudan mitokondriyi hedef alan bir ilaçtır. Bu ikili etki mekanizması sayesinde:
a) Mitokondriyal koruma: MitoKATP kanallarının açılması, mitokondriyal membran potansiyelini stabilize eder, ROS üretimini azaltır ve hücre içi enerji homeostazını korur [19]. Bu etki, prion benzeri süreçlerin tetiklediği mitokondriyal disfonksiyonun baskılanması açısından kritik olabilir.
b) NO–cGMP yolu: Nicorandil’in nitrat yapısı, NO üretimini artırarak cGMP aracılığıyla vazodilatasyon ve vasküler stabilizasyon sağlar. Böylece periferik sinirlerin kan akımı iyileşir, hipoksi riski azalır ve inflamatuvar hücre infiltrasyonu sınırlanır [20].
c) Anti-inflamatuar etki: Hem mitokondriyi koruyarak oksidatif stresi azaltması hem de damar geçirgenliğini kontrol etmesi nedeniyle, nicorandil proinflamatuvar yanıtın baskılanmasına katkıda bulunur.
CIDP bağlamında düşünüldüğünde nicorandil, özellikle inflamasyon ve mitokondriyal stresin eşzamanlı baskılanmasında değerli bir ajan olabilir.
Bu aşama, CIDP’nin patofizyolojisinde önemli rol oynayan inflamatuvar yük, vasküler geçirgenlik ve mitokondriyal disfonksiyonun eş zamanlı olarak hedeflenmesine yöneliktir.
a) Metopimazin, dopaminerjik immün aktivasyonu baskılayarak inflamasyonu azaltırken, aynı zamanda Schwann hücre proliferasyonunu destekleyebilir.
b) Nicorandil ise, hem mitokondriyi koruyan hem de vasküler mikroperfüzyonu iyileştiren çift mekanizmalı etkisiyle sinir dokusunu çok katmanlı biçimde destekler.
Bu kombinasyon, yalnızca immün baskılama değil, aynı zamanda enerji metabolizması, oksidatif stres dengesi ve doku rejenerasyonu üzerinde de koruyucu bir mikroçevre oluşturur.
3. Her İki Gruptaki İlaçlar ile Birlikte Desferoksamin Kullanımı Desferoksamin:
Desferoksamin, klinikte uzun yıllardır kullanılan güçlü bir demir şelatörüdür. Özellikle aşırı demir yüklenmesi durumlarında ferrik iyon (Fe³⁺) bağlayarak Fenton reaksiyonu aracılığıyla hidroksil radikali (OH) oluşumunu engeller. Bu sayede, ROS üretiminin baskılanması ve oksidatif hasarın sınırlandırılması sağlanır [21]. CIDP’de oksidatif stres ve ROS artışının patogenezin sürdürücü bir bileşeni olduğu göz önüne alındığında, desferoksaminin bu eksende terapötik değeri son derece önemlidir.
Ayrıca desferoksamin, HIF-1α stabilizasyonu yoluyla hücresel hipoksiye adaptasyonu güçlendirir. Bu mekanizma, sinir mikroperfüzyonunun bozulduğu ve oksijen dengesizliğinin oluştuğu inflamatuvar ortamlarda hücrelerin metabolik dayanıklılığını artırır. HIF-1α aktivasyonu, aynı zamanda anjiyogenez, glikolitik enzim ekspresyonu ve doku onarımı süreçlerini tetikleyerek sinir rejenerasyonu için koruyucu bir mikroçevre oluşturabilir.
Son yıllarda yapılan deneysel çalışmalar, desferoksaminin periferik sinir rejenerasyonu ve Schwann hücre proliferasyonu üzerinde doğrudan olumlu etkiler gösterebileceğini bildirmiştir [22,23]. Özellikle biyomateryal tabanlı desferoksamin taşıyıcı sistemlerin, Schwann hücrelerinin büyüme faktörü sekresyonunu artırarak aksonal onarımı desteklediği ortaya konmuştur. Bu durum, yalnızca immün baskılama ve oksidatif stres azaltma değil, aynı zamanda rejeneratif kapasitenin güçlendirilmesi açısından da kritik bir avantajdır.
Desferoksaminin Diğer Gruplarla Kombinasyon Rasyonalitesi,
Desferoksamin, hem erken stabilizasyon grubunda (Zolimidine, Lubiprost) hem de anti-inflamatuar stabilizasyon grubunda (Metopimazin, Nicorandil) kullanılan ajanlarla birlikte sinerjik etki gösterebilir:
a) Zolimidine ve Lubiprost ile kombinasyonunda: Ödem ve iyon dengesinin sağlanmasının yanı sıra desferoksaminin antioksidan etkisi, sinir mikroçevresinin erken korunmasını güçlendirir.
b) Metopimazin ve Nicorandil ile kombinasyonunda: Sitokin baskılanması ve mitokondriyal korumaya ek olarak desferoksamin, metal kaynaklı ROS üretimini sınırlayarak inflamatuvar yükün daha da azaltılmasına katkı sağlar.
Bu çok yönlü yaklaşım, CIDP’de patofizyolojik süreçlerin farklı katmanlarını eşzamanlı hedefleyerek monoterapilere kıyasla daha kalıcı ve derin nöroprotektif etki sağlayabilir.
4. Geç Faz İmmünmodülasyon Aşaması
Aldesulfon / Dapson:
Dapson, klasik olarak dermatolojik ve enfeksiyöz hastalıklarda kullanılan bir ajan olmakla birlikte, immünmodülatör ve antioksidan özellikleri nedeniyle nöroinflamatuvar hastalık modellerinde de dikkat çekmektedir. Güçlü bir miyeloperoksidaz (MPO) inhibitörü olarak, nötrofillerin ve aktive mikrogliaların aşırı serbest radikal üretimini baskılar. Bu sayede hipokloröz asit (HOCl) ve diğer oksidanların aşırı birikimini engelleyerek hücresel membran hasarını azaltır [24].
Ayrıca dapsonun serbest radikal temizleyici etkisi, glutatyon rezervlerinin korunmasına yardımcı olur ve oksidatif stresin neden olduğu mitokondriyal disfonksiyonun ilerlemesini sınırlar. Deneysel nöroinflamasyon modellerinde dapson, nöronal hücre ölümünü azalttığı, astrositik aktiviteyi düzenlediği ve anti-inflamatuar sitokin profili (IL-10, TGF-β) artırdığı için nöroprotektif etki göstermiştir [25]. CIDP’nin geç fazında bu özellikler, kronik inflamasyonun ve ikincil aksonal dejenerasyonun yavaşlatılmasına katkı sağlayabilir.
Tacrolimus:
Tacrolimus, güçlü bir kalsinörin inhibitörü olarak T-hücre aktivasyonunu ve NFAT aracılı sitokin üretimini baskılar. Bu sayede IL-2, IFN-γ ve TNF-α gibi proinflamatuvar sitokinlerin aşırı üretimi engellenir [26]. Ancak tacrolimusun etkileri yalnızca immün baskılamayla sınırlı değildir:
a) Mikroglial modülasyon: Mikroglial aşırı aktivasyonu baskılayarak, M1 fenotipten M2 fenotipe geçişi destekler; bu da proinflamatuvar toksisite yerine doku onarımını destekleyen bir fenotip oluşmasını sağlar [27].
b) Mitokondriyal ve ER stresi azaltma: ROS üretimini sınırlayarak ve endoplazmik retikulum stresine karşı koruyucu etki göstererek hücresel dayanıklılığı artırır.
c) Schwann hücre koruması: Deneysel sinir hasarı modellerinde, tacrolimusun Schwann hücrelerinin apoptozunu azalttığı, miyelinizasyon sürecini desteklediği ve aksonal onarımı hızlandırdığı gösterilmiştir [28].
Dolayısıyla tacrolimus, CIDP’nin geç döneminde yalnızca immün baskılayıcı değil, aynı zamanda nöroprotektif ve rejeneratif destekleyici bir ajan rolü üstlenmektedir.
Genel Değerlendirme,
Bu üç aşamalı tedavi protokolü, CIDP’nin prion benzeri mekanizmalarla ilişkili olabileceği hipotezi göz önünde bulundurularak kurgulanmıştır. Protokolün mantığı, hastalığın patofizyolojik ilerleyişine paralel biçimde basamaklı olarak farklı süreçleri hedeflemesidir:
a) Erken dönemde: Ödemin azaltılması, iyon dengesinin sağlanması ve hücresel hipereksitabilitenin baskılanması → Schwann hücreleri için koruyucu zemin.
b) Ara dönemde: İnflamasyonun ve mitokondriyal stresin baskılanması, vasküler stabilizasyon ve oksidatif hasarın sınırlandırılması → Enerji metabolizmasının korunması, aksonal dayanıklılık.
c) Geç dönemde: Kronik immün disregülasyonun dengelenmesi, mikroglial aşırı aktivitenin baskılanması ve rejeneratif sürecin desteklenmesi → Fonksiyonel iyileşmenin sürdürülebilir hale gelmesi.
Klasik tedavilere kıyasla bu protokolün ayırt edici yönü, çok katmanlı patofizyolojik eksenlere aynı anda müdahale etmesidir. Kortikosteroidler, IVIg ve plazmaferez esas olarak immün baskılama ve antikor temizliği üzerinden etki gösterirken, bu protokol aynı zamanda protein agregasyonu, oksidatif stres ve mitokondriyal disfonksiyon gibi daha derin biyolojik süreçleri de hedeflemektedir [29–31].
Dolayısıyla, bu strateji yalnızca semptomatik kontrol değil, aynı zamanda CIDP’nin progresif nörodejeneratif bileşenine de müdahale etme potansiyeli taşımaktadır. Bu yaklaşımın, özellikle tedaviye dirençli veya klasik protokollere geçici yanıt veren hastalarda translasyonel bir alternatif sunabileceği öngörülmektedir.
Tartışma,
CIDP’nin prion benzeri bir mekanizma ile tetiklendiği hipotezi, güncel nörodejeneratif hastalık paradigmasıyla güçlü bir paralellik göstermektedir. Protein yanlış katlanması ve “prion-like” yayılım süreçleri, yalnızca Creutzfeldt-Jakob hastalığı gibi klasik prionopatilerde değil, Alzheimer, Parkinson ve ALS gibi çok daha yaygın nörodejeneratif bozukluklarda da merkezi bir rol üstlenmektedir [29–31]. Bu süreçte yanlış katlanmış proteinler, “şablon etkisi” (templating) ile normal proteinleri de bozarak agregat oluşturur, hücreler arası yayılım gösterir ve kronik immün yanıta yol açar. Bu model, CIDP’de görülen kronik inflamasyon, Schwann hücre kaybı ve progresif aksonal dejenerasyonu açıklamada kullanılabilir.
Schwann hücrelerinde rejeneratif mekanizmalar, literatürde giderek daha fazla vurgulanmaktadır. Özellikle GABA reseptörleri üzerinden Schwann hücre proliferasyonu ve remiyelinizasyonun tetiklenebileceği gösterilmiştir [32]. Benzer şekilde, prostanoid reseptörler (özellikle EP4), inflamatuvar sitokin üretimini baskılayarak sinir mikroçevresinde anti-inflamatuar bir ortam oluşturabilir [33]. Bu mekanizmaların farmakolojik olarak hedeflenmesi, CIDP’nin erken fazında ödem ve hücresel hipereksitabiliteyi baskılayarak, rejenerasyon için uygun bir biyolojik zemin hazırlayabilir.
Ayrıca, prion benzeri hastalık modellerinde mitokondriyal disfonksiyon kritik bir basamak olarak tanımlanmıştır. Bu bağlamda nicorandil gibi mitokondriyal ATPduyarlı potasyum kanalı (mitoKATP) açıcıları, ROS üretimini azaltarak mitokondriyal membran bütünlüğünü koruyabilir [34]. Benzer şekilde desferoksamin, demir şelasyonu aracılığıyla serbest radikal oluşumunu baskılar, HIF-1α stabilizasyonu yoluyla hipoksiye adaptif yanıtı güçlendirir ve makrofaj polarizasyonunu M2 yönünde değiştirerek rejeneratif kapasiteyi artırır [35,36]. Bu ilaçların kombinasyonu, oksidatif stresi baskılamanın ötesinde, sinir mikroçevresini yeniden programlama potansiyeline sahiptir.
Dolayısıyla, yalnızca tek bir moleküler hedefi baskılayan monoterapiler yerine, kombine nöroprotektif stratejiler geliştirmek, prion benzeri patomekanizmaları eşzamanlı olarak kontrol altına almak açısından çok daha rasyonel görünmektedir. Literatürde de, sinir sistemini etkileyen kompleks hastalıklarda çoklu yolaklara müdahale eden tedavi yaklaşımlarının, tek ajanlı protokollere kıyasla daha kalıcı fonksiyonel iyileşme sağladığı vurgulanmaktadır [37].
Bu bağlamda önerilen protokol, yalnızca immün baskılayıcı bir yaklaşım değil; aynı zamanda mikroglial aşırı aktivitenin kontrolü, mitokondriyal fonksiyonların korunması, oksidatif stresin azaltılması ve Schwann hücre rejenerasyonunun desteklenmesi gibi çok katmanlı etkileri içeren ileriye dönük bir model sunmaktadır.
Sonuç
Önerilen tedavi protokolü, CIDP’nin yalnızca otoimmün yönünü değil, aynı zamanda olası prion benzeri patofizyolojik süreçlerini de hedefleyen çok katmanlı bir strateji sunmaktadır. Mikroglial aktivasyon, mitokondriyal disfonksiyon ve oksidatif stres gibi mekanizmaları baskılamaya yönelik basamaklar, Schwann hücre rejenerasyonunu destekleyici etkilerle tamamlanmaktadır [38–40]. Bu yaklaşım, standart tedavilere yanıt vermeyen veya progresif seyir gösteren hastalarda translasyonel bir alternatif olma potansiyeline sahiptir [41–43].
Kaynakça
1. Van den Bergh PY, Rajabally YA, Lehmann HC, Hartung HP. European Academyof Neurology/Peripheral Nerve Society guideline on diagnosis and treatment of chronic inflammatory demyelinating polyradiculoneuropathy. J Peripher Nerv. Syst. 2021;26(3):242–68.
2. Mathey EK, Park SB, Hughes RA, Pollard JD. Chronic inflammatorydemyelinating polyradiculoneuropathy: from pathology to phenotype. J Neurol Neurosurg Psychiatry. 2015;86(9):973–85.
3. Prusiner SB. Prions. Proc Natl Acad Sci USA. 1998;95(23):13363–83.
4. Jucker M, Walker LC. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 2013;501(7465):45–51.
5. Aguzzi A, Lakkaraju AKK. Cell biology of prions and prionoids: a status report. Trends Cell Biol. 2016;26(1):40–51.
6. Aguzzi A, Zhu C. Microglia in prion diseases. J Clin Invest. 2017;127(9):3230–9.
7. Koike H, Sobue G. Chronic inflammatory demyelinating polyneuropathy: clinical subtypes and their correlation with electrophysiology and pathology. Curr Opin Neurol. 2013;26(5):473–9.
8. Siskova Z, Mahad DJ, Pudney C, Campbell G, Cadogan M, Asuni A, et al. Mitochondrial damage in the early pathology of prion disease. J Pathol. 2010;221(3):311–22.
9. Züchner S, et al. Oxidative stress in CIDP and other neuropathies. MuscleNerve. 2004;29(6):770–7.
10.Lehmann HC, Hartung HP. Pathogenesis and treatment of immune-mediated neuropathies. Ther Adv Neurol Disord. 2011;4(3):193–202.
11.Milhavet O, Lehmann S. Oxidative stress and the prion protein in transmissible spongiform encephalopathies. Brain Res Rev. 2002;38(3):328–39.
12.Lu F, et al. Oxidative stress and mitochondrial dysfunction in peripheral neuropathies. Neurosci Lett. 2019;710:134347.
13.Soto C, Satani N. The intricate mechanisms of neurodegeneration in prion diseases. Trends Mol Med. 2011;17(1):14–24.
14.Koike H, Sobue G. CIDP pathophysiology: from inflammation to degeneration. Curr Opin Neurol. 2013;26(5):473–9.
15.Maurer P, et al. GABA(A) receptor modulation in Schwann cells: implications for remyelination. Glia. 2022;70(1):45–59.
16.Hayashi Y, et al. Lubiprostone prevents indomethacin-induced small intestinal ulcers via EP4 receptor. J Pharmacol Exp Ther. 2014;348(2):268–76.
17.Pacheco R, et al. Dopamine receptors in immune cells modulate cytokine production. J Immunol. 2014;188(2):530–8.
18.Kim S, et al. Dopamine receptor D2 regulates Schwann cell differentiation. Sci Rep. 2019;9(1):1-10.
19.Lee K, et al. Nicorandil enhances mitochondrial function and reduces oxidative stress in neurons. Cell Biochem Biophys. 2021;79(1):149–59.
20.Takami M, et al. Nicorandil-mediated blood-brain barrier protection. Neuropharmacology. 2022;205:108912.
21.Guo C, et al. Deferoxamine stabilizes HIF-1α and promotes neuroprotection. Exp Neurol. 2016;280:1–12.
22.Dong X, et al. Deferoxamine-modified nanoscaffolds in peripheral nerve repair. Biomaterials. 2021;268:120545.
23.Ma Q, et al. Iron chelation therapy in oxidative stress diseases. Mol Pharm. 2020;17(1):3–19.
24.Wozel G, et al. Anti-inflammatory action of dapsone in dermatological diseases. Arch Dermatol Res. 2014;306(2):103–10.
25.Simons MP, et al. Antioxidant properties of dapsone in neuroinflammation models. Neurochem Int. 2009;55(7):398–404.
26.Smith CD, et al. Tacrolimus as a neuroprotective agent: mechanisms and applications. Neuropharmacology. 2014;76 Pt A:174–87.
27.He X, et al. FK506 modulates microglial activity. J Neuroinflammation. 2017;14(1):26.
28.Hetz C, et al. ER stress control by tacrolimus: implications in neurodegeneration. Nat Rev Mol Cell Biol. 2011;12(12):759–68.
29.Jucker M, Walker LC. Pathogenic protein seeding in neurodegenerative diseases. Nat Rev Neurol. 2018;14(6):323–32.
30.Collinge J. Mammalian prions and their wider relevance in neurodegenerative diseases. Nature. 2016;539(7628):217–26.
31.Moreno JA, et al. Protein misfolding and neuroinflammation in neurodegenerative diseases. Brain Res. 2016;1647:2–18.
32.Maurer P, et al. Schwann cell GABA receptors in demyelination and repair.Glia. 2022;70(1):45–59.
33.Hatazawa R, et al. Prostaglandin E receptor subtype 4 in mucosal protection and inflammation. J Pharmacol Sci. 2007;103(1):25–32.
34.Lee K, et al. Nicorandil enhances mitochondrial function and reduces oxidative stress in neurons. Cell Biochem Biophys. 2021;79(1):149–59.
35.Guo C, et al. Deferoxamine stabilizes HIF-1α and promotes neuroprotection. Exp Neurol. 2016;280:1–12.
36.Dong X, et al. Deferoxamine-modified nanoscaffolds in peripheral nerve repair. Biomaterials. 2021;268:120545.
37.Cummings JL, et al. Combination therapy in neurodegenerative disease: a path toward improved outcomes. Alzheimers Res Ther. 2019;11(1):42.
38.Aguzzi A, Zhu C. Microglia in prion diseases. J Clin Invest. 2017;127(9):3230–9.
39.Siskova Z, et al. Mitochondrial damage in the early pathology of prion disease. J Pathol. 2010;221(3):311–22.
40.Milhavet O, Lehmann S. Oxidative stress and the prion protein in transmissible spongiform encephalopathies. Brain Res Rev. 2002;38(3):328–39.
41.Koike H, Sobue G. CIDP pathophysiology: from inflammation to degeneration. Curr Opin Neurol. 2013;26(5):473–9.
42.Züchner S, et al. Oxidative stress in CIDP and other neuropathies. Muscle Nerve. 2004;29(6):770–7.
43.Hughes RA, et al. Intravenous immunoglobulin for CIDP. Cochrane Database Syst Rev. 2015;(3):CD001797.
Dapson (Aldesulfon) Molekülünün CIDP ve Prion Enfeksiyonları Tedavisinde Potansiyel Kullanımı: Anti-inflamatuar, Anti-oksidan ve Nöroprotektif Etkiler Üzerine Teorik Bir Değerlendirme
Kronik Enflamatuar Demiyelinizan Poliradikülonöropati (CIDP) ve prion enfeksiyonları, periferik sinirlerde veya santral sinir sisteminde ciddi nörodejeneratif süreçlerle seyreden, tedavi seçenekleri sınırlı hastalıklardır. Dapson (aldesulfon), anti-inflamatuar, immünmodülatör ve anti-oksidan etkileri ile her iki hastalık grubunda endikasyon dışı ilaç kullanımı adına potansiyel bir ajan olarak değerlendirilmektedir [1-5]. Bu makale, dapsonun moleküler etkilerini ve teorik katkılarını literatüre dayalı olarak incelemektedir.
Dapson (diaminodifenilsulfon), sülfon grubu taşıyan sentetik bir antimikrobiyal ajan olarak keşfedilmiş ve uzun yıllardır lepra ve dermatitis herpetiformis tedavisinde sistemik anti-inflamatuar ajan olarak kullanılmaktadır [1,2]. Antimikrobiyal etkilerinin ötesinde, dapsonun immünmodülatör ve anti-inflamatuar özellikleri giderek artan şekilde ön plana çıkmaktadır [3,4]. Bu etkiler esasen miyeloperoksidaz (MPO) inhibisyonu, nötrofil fonksiyonlarının baskılanması ve pro-inflamatuar sitokinlerin azaltılması yoluyla gerçekleşmektedir [1,3]. Dapsonun reaktif oksijen türlerini temizleme yeteneği, onu etkili bir antioksidan ajan haline getirmekte; inflamasyonun yanı sıra oksidatif stres kaynaklı doku hasarını da azaltabileceği düşünülmektedir [4,5]. Klasik kullanım alanlarının ötesinde, nöroimmün hastalıklar ve nöral doku hasarında dapsonun yeniden konumlandırılması (repurposing) konusu günümüzde giderek ilgi kazanmaktadır.
Prion Hastalıkları: Prion hastalıkları (Transmissible Spongiform Encephalopathies - TSE), enfekte edici proteinler olan prionların (PrPSc) birikimine bağlı gelişen ölümcül nörodejeneratif bozukluklardır [7]. İnsanlarda Creutzfeldt-Jakob hastalığı (CJD), Gerstmann-Sträussler-Scheinker sendromu ve kuru hastalığı; hayvanlarda ise scrapie ve sığır süngerimsi ensefalopatisi (deli dana hastalığı) başlıca örneklerdir. Prion proteinlerinin yanlış katlanarak patolojik form (PrPSc) kazanması sonucu protein agregatları oluşur [7,11]. Bu agregatlar, oksidatif stres, mitokondriyal disfonksiyon, mikroglial aktivasyon, astrosit reaktivasyonu ve yaygın nöroenflamasyon ile nöron kaybına yol açar [8-9,12]. Bugün için etkili bir tedavisi olmayan bu hastalıkların tedavisinde anti-oksidan, anti-inflamatuar ve agregasyon önleyici ajanlar üzerine yoğun araştırmalar sürmektedir [11].
Dapsonun Prion Hastalıklarında Teorik Etki Mekanizmaları:
1. Mikroglial Aktivasyonun Baskılanması: Yanlış katlanmış PrPSc proteininin sinir dokusunda birikmesi, mikroglial hücrelerin Toll-like reseptör 4 (TLR4) uyarısı yoluyla aktive olmasına neden olur [9]. Bu aktivasyon, nöroenflamasyonu tetikleyen önemli bir moleküler yolak olan NF-κB'nin aktive edilmesine yol açar. Aktive mikroglialar TNF-α ve IL-1β gibi pro-inflamatuar sitokinleri salgılayarak inflamatuar mikroçevreyi güçlendirir ve nöronal kaybı hızlandırır [9]. Dapson, MPO inhibisyonu yoluyla ROS üretimini azaltır, NF-κB aktivasyonunu baskılar ve bu mekanizma sayesinde mikroglialardan kaynaklanan pro-inflamatuar sitokinlerin ekspresyonunu azaltır [1,4,9]. Ayrıca dapsonun, mikroglial hücre fenotipini M1 pro-inflamatuar formdan M2 anti-inflamatuar forma kaydırabileceği teorik olarak öne sürülmektedir. Bu durum, nöron çevresindeki inflamatuar mikroçevrenin baskılanmasını ve doku onarımının desteklenmesini sağlayabilir.
2. Anti-oksidan Etki: PrPSc proteinlerinin birikimi sonucu ortaya çıkan mitokondriyal disfonksiyon ve artmış oksidatif stres, hücresel hasarın başlıca nedenlerinden biridir [10]. Dapson, hidroksil radikali, süpéroksit anyonları ve peroksinitrit gibi reaktif oksijen türlerini (ROS) doğrudan temizleyerek oksidatif stres yükünü azaltır [4,10]. Ayrıca, glutatyon peroksidaz (GPx) ve süpéroksit dismutaz (SOD) gibi antioksidan savunma enzimlerinin aktivitelerinde artış sağlayarak hücresel antioksidan kapasiteyi güçlendirdiği bildirilmiştir [10]. Dapsonun mitokondri membran potansiyelini koruduğu, mitokondriyal DNA hasarını azalttığı ve oksidatif stres kaynaklı apoptozu önlediği yönünde preklinik bulgular mevcuttur. Böylece nöronal enerji metabolizmasının desteklenmesine katkı sağlayabilir.
3. PrPSc Birikimi Kaynaklı İkincil Hasarların Sınırlandırılması: Yanlış katlanmış PrPSc proteinlerinin oluşturduğu agregatlar, doğrudan sitotoksik olmayıp oksidatif stres ve inflamatuvar yanıtları tetikleyerek ikincil nöronal hasara neden olmaktadır [7,11]. Bu süreçte artan ROS üretimi ve lipid peroksidasyonu, nöronların membran bütünlüğünün bozulmasına ve proteinlerin oksidasyonuna yol açar. Dapsonun ROS temizleyici özellikleri, inflamatuvar yanıtın baskılanmasıyla birlikte bu patolojik süreci yavaşlatabilir [4,10,11]. Ayrıca dapsonun, hücre içi PrPSc agregasyonunu dolaylı olarak azaltabileceği ve böylece agregat birikiminin tetiklediği zararlı moleküler olayları sınırlandırabileceği düşünülmektedir. Bu mekanizma, sinaptik kaybı önleyebilir ve hastalığın ilerleyişini yavaşlatabilir.
4. Astrosit Disfonksiyonunun Düzenlenmesi: Prion hastalıklarında astrositler, A1 fenotipine dönüşerek pro-inflamatuar ve nörotoksik özellikler kazanmaktadır [12]. Bu dönüşüm, NF-κB ve JAK/STAT3 yolaklarının aktivasyonu ile tetiklenir. A1 astrositleri, nöronlara doğrudan zarar veren iltihaplanmayı artırıcı sitokinlerin (örneğin IL-6, TNF-α) salınımını artırır. Dapson, ROS düzeylerini azaltarak NF-κB yolağını baskılar ve pro-inflamatuar sitokin salınımını azaltır [4,9,12]. Ayrıca dapsonun, A1 astrosit fenotipinin oluşumunu sınırlayarak A2 nörotrofik astrositlerin desteklenmesine katkıda bulunabileceği teorik olarak öne sürülmektedir. Bu etki, astrosit kaynaklı nöronal apoptozun baskılanmasına ve nörodejeneratif sürecin yavaşlatılmasına yardımcı olabilir.
Teorik Klinik Katkılar: Bu etkiler, prion hastalıklarında hastalığın ilerlemesini yavaşlatabilecek destekleyici bir anti-inflamatuar ve anti-oksidan ajan olarak dapsonun potansiyel kullanımını desteklemektedir.
Kaynaklar:
1. Sinnott JT, Eisen AZ. Dapsone suppresses neutrophil myeloperoxidase activity in vitro and in vivo. J Invest Dermatol. 1982;79(3):206-209. doi:10.1111/1523-1747.ep12523154
2. Wozel G. Innovative use of dapsone. Dermatol Clin. 2010;28(1):25-35. doi:10.1016/j.det.2009.10.002
3. Zhu K, Mrowietz U, Lohmann J, et al. Anti-inflammatory effects of dapsone on cytokine production in vitro. Inflamm Res. 2003;52(10):437-445. doi:10.1007/s00011-003-1186-5
4. Simons MP, Rucks EA, Leidal KG, et al. Dapsone as anti-oxidant and anti-inflammatory agent in experimental models. Free Radic Biol Med. 2007;42(4):714-721. doi:10.1016/j.freeradbiomed.2006.11.031
5. Wozel G, Blasum C. Dapsone in dermatology and beyond. Arch Dermatol Res. 2014;306(2):103-124. doi:10.1007/s00403-013-1404-3
6. Breen DP, Halliday GM, Lang AE. The blood-nerve barrier in neurological disease. Nat Rev Neurol. 2013;9(5):297-309. doi:10.1038/nrneurol.2013.71
7. Prusiner SB. Prions. Proc Natl Acad Sci U S A. 1998;95(23):13363-13383. doi:10.1073/pnas.95.23.13363
8. Moreno JA, Halliday M, Molloy C, et al. The endoplasmic reticulum stress response in neurodegenerative disease. Cold Spring Harb Perspect Biol. 2011;3(6):a004390. doi:10.1101/cshperspect.a004390
9. Zhang X, Liu H, Jin T, et al. Microglial activation and neuroinflammation in prion diseases. Brain Pathol. 2020;30(6):1125-1137. doi:10.1111/bpa.12847
10. Simons MP, Zuckermann RN, Esko JD. Oxidative injury modulation via dapsone: implications in neurodegeneration. Neurochem Int. 2009;54(3-4):179-186. doi:10.1016/j.neuint.2008.12.005
11. Aguzzi A, O'Connor T. Protein aggregation diseases: pathogenicity and therapeutic perspectives. Nat Rev Drug Discov. 2010;9(3):237-248. doi:10.1038/nrd3050
12. Liddelow SA, Barres BA. Reactive astrocytes: production, function, and therapeutic potential. Immunity. 2017;46(6):957-967. doi:10.1016/j.immuni.2017.06.006
Desferoksaminin Kronik Enflamatuar Demiyelinizan Poliradikülonöropati (CIDP) Tedavisindeki Potansiyel Rolü: Moleküler Mekanizmalar ve Teorik Derleme
Özet: Kronik enflamatuar demiyelinizan poliradikülonöropati (CIDP), Schwann hücre hasarı, demiyelinizasyon ve aksonal dejenerasyon ile karakterize progresif bir otoimmün nöropatidir. Mevcut tedavi yaklaşımları, oksidatif stres ve mitokondriyal disfonksiyon gibi hedeflenmemiş alanları içermeyen immünmodülatör ajanlarla sınırlıdır. Bu derlemede, onaylı bir demir şelatörü olan deferoksaminin (DFO), antioksidan, anti-inflamatuar ve nörorejeneratif etkilerini destekleyen mevcut literatüre dayanarak CIDP tedavisindeki teorik potansiyeli incelenmektedir.
Giriş: Deferoksamin (desferroksamin), klinikte esas olarak demir yüklenmesi (hemokromatozis) ve talasemi gibi hastalıklarda kullanılan bir demir şelatörüdür. Streptomyces pilosus kökenli bakteriyel bir siderofor olan bu ajan, serbest demir iyonlarını bağlayarak Fenton reaksiyonları yoluyla ortaya çıkan reaktif oksijen türlerinin (ROS) oluşumunu azaltma potansiyeline sahiptir. Demir şelasyonu yoluyla oksidatif stresi kontrol altına alan deferoksamin, son dönem çalışmalarında anti-inflamatuar ve rejeneratif etkiler de göstermiştir. Bu özellikleri sayesinde nörodejeneratif hastalıklar, periferik sinir hasarı ve iskemi/reperfüzyon yaralanmalarında nöroprotektif ajan olarak değerlendirilmesi gündeme gelmiştir.
CIDP patogenezinde otoimmün aracılı demiyelinizasyon, kronik inflamasyon, Schwann hücre disfonksiyonu, oksidatif stres ve mitokondriyal hasar temel rol oynamaktadır. Demir metabolizmasındaki bozulma ve artmış oksidatif hasar periferik sinir dejenerasyonunu arttırabilir. Deferoksamin, serbest demiri şelatlayarak oksidatif hasarı azaltmak ve immün yanıtları modüle etmek için potansiyel bir strateji sunar.
Deferoksaminin CIDP ile İlişkili Etki Mekanizmaları:
1. Demir şelasyonu ve ROS Azaltılması: Deferoksamin, serbest Fe2+ iyonlarını şelatlayarak demir bağlı Fenton reaksiyonlarını etkili bir şekilde engeller. Fenton reaksiyonları, hidroksil radikali gibi son derece reaktif oksijen türlerinin oluşmasından sorumludur. Bu radikaller, lipid membranlar, proteinler ve DNA üzerinde oksidatif hasara neden olmaktadır. Deferoksaminin demir şelasyonu etkisi, bu serbest radikal üretim döngüsünü kırarak oksidatif stres yükünü azaltır. Sonuç olarak, lipid peroksidasyonunun biyokimyasal göstergesi olan malondialdehit (MDA) seviyelerinde anlamlı azalma sağlanır. Bu etkiler periferik sinir sisteminde hem Schwann hücrelerinin membran stabilizasyonuna hem de aksonal bütünlüğüne katkı sağlayarak oksidatif hasara bağlı nörodejenerasyonu engelleme potansiyeli taşır [2].
2. NF-κB Yolağının Baskılanması: Oksidatif stresin baskılanmasıyla birlikte nöroenflamasyonun kritik düzenleyici yolağı olan NF-κB'nin aktivasyonu da azaltılır. Deferoksaminin ROS seviyelerini düşürmesi, IκBα proteininin degradasyonunu engelleyerek NF-κB'nin nükleer translokasyonunu ve hedef genlerin transkripsiyonunu sınırlar. Bu mekanizma sayesinde pro-inflamatuar sitokinlerin (örneğin TNF-α, IL-6, IL-1β) sentezi baskılanır. Sitokinlerin azalması, periferal sinir dokusunda immün hücre infiltrasyonunu ve enflamatuvar doku hasarını azaltarak nöroenflamasyonun kontrol altına alınmasına katkı sağlar [3].
3. Mitokondriyal Membran Stabilizasyonu: Deferoksaminin oksidatif stresi baskılama etkisi, mitokondriyal membran potansiyelinin stabilizasyonunu destekler. Oksidatif stres, mitokondri zarlarında permeabilite artışına ve mitokondriyal membran potansiyelinin kaybına yol açarak ATP üretimini bozar. DFO tedavisiyle ROS kaynaklı mitokondriyal hasar engellenir; ATP sentezi devam ettirilerek enerji metabolizması korunur. Bu etki Schwann hücreleri başta olmak üzere periferik sinir dokusunda apoptozun önlenmesine ve hücre sağkalm oranının artmasına katkı sağlar [2].
4. HIF-1α Stabilizasyonu ve Nörotrofik Faktör Ekspresyonu: Deferoksamin, demir bağımlı PHD (prolin hidroksilaz) enzimlerini inhibe ederek HIF-1α’ın degradasyonunu engeller ve stabilizasyonunu sağlar. Stabil HIF-1α, hipoksi yanıt elementleri aracılığıyla VEGF (vasküler endotelyal büyüme faktörü) ve BDNF (beyin kaynaklı nörotrofik faktör) gibi genlerin ekspresyonunu arttırarak vasküler rejenerasyon ve sinir onarım mekanizmalarını aktive eder. Bu yolaklar sayesinde deferoksamin periferik sinirlerde anjiyogenez, beslenme desteği ve aksonal büyüme süreçlerini dolaylı olarak destekler [1, 4, 7].
5. Schwann Hücresi Canlı Kalımı ve Rejeneratif Fenotip: In vitro Schwann hücresi modellerinde deferoksamin uygulaması, oksidatif stres koşulları altında bu hücrelerin yaşam oranını ve fonksiyonel aktivitelerini artırmıştır. Yapılan deneylerde DFO uygulaması, Schwann hücrelerinin proliferasyonunu desteklemiş, oksidatif stresi azaltarak programlı hücre ölümünü (apoptoz) önlemiştir. Elde edilen veriler, DFO’nun Schwann hücrelerini rejeneratif fenotipe yönlendirdiğini ve miyelin onarımını destekleyebileceğini göstermiştir [5].
6. GAP-43 Yolağı Üzerinden Aksonal Rejenerasyon: Deferoksamin, periferik sinir onarımında kritik rol oynayan GAP-43 (Growth Associated Protein-43) ekspresyonunu arttırabilir. GAP-43 proteini, aksonal büyüme, sinaptik plastisite ve yeniden sinirlenme süreçlerinde rol alan bir belirteçtir. DFO uygulaması, akson uçlarında GAP-43 ekspresyonunu tetikleyerek büyüme konilerinin oluşumunu ve aksonal uzamını hızlandırabilir. Bu etkiler, sinir hasarı sonrası onarımı hızlandırarak fonksiyonel rejenerasyonu destekleyebilir [2].
7. Makrofaj Fenotip Modülasyonu: Deferoksamin, immün yanıtı modüle eden etkiler geliştirerek, pro-inflamatuar M1 fenotipindeki makrofajları anti-inflamatuar ve rejeneratif M2 fenotipine kaydırabilir. M2 makrofajlar, dokuda yara onarımını, inflamasyonun sonlandırılmasını ve rejeneratif sinyalizasyon yollarını destekler. Bu mikroçevresel değişim, periferik sinir iyileşmesi sürecinde rejeneratif ortamı optimize eder ve sinir tamirini kolaylaştırabilir [6].
8. Kan-Sinir Bariyeri Bütünlüğü ve Vasküler Stabilizasyon: DFO, endotel fonksiyonlarını iyileştirerek ve vasküler geçirgenliği azaltarak kan-sinir bariyerinin (BNB) bütünlüğünü koruyabilir. Vasküler geçirgenlikteki artış periferik sinirlerde ödeme, immün hücre geçişine ve inflamatuar hasara yol açar. DFO uygulaması, bu patolojik süreçleri sınırlayarak ödem, inflamasyon ve doku harabiyetini azaltabilir. Bu stabilizasyon, periferik sinir mikroçevresinde iyileşme koşullarını optimize ederek rejenerasyon sürecini destekleyebilir [6, 8].
CIDP Tedavisine Teorik Katkıları: CIDP’de oksidatif stres, kronik inflamasyon, Schwann hücre disfonksiyonu ve yetersiz rejenerasyonun birlikte rol aldığı patogenezde deferoksamin; antioksidan, anti-inflamatuar ve nörorejeneratif etkileriyle potansiyel adjuvan nöroprotektif ajan olarak teorik açıdan umut vadetmektedir.
Sonuç: Mevcut klinik kanıt bulunmamasına rağmen, deferoksaminin bilinen farmakodinamik özellikleri ve güvenli yan etki profili, bu molekülün CIDP için sistematik preklinik değerlendirmelerle potansiyelinin araştırılmasının bilimsel açıdan makul olduğunu göstermektedir.
Kaynaklar:
1. Guo C, et al. Deferoxamine-mediated up-regulation of HIF-1α prevents dopaminergic neuronal death via activation of MAPK/p38 signaling pathways. Experimental Neurology. 2016;280:13-23. doi:10.1016/j.expneurol.2016.03.016
2. Marin PC, Im MJ, Girotto JA, Borschel G, Bickel KD. Effects of deferoxamine on ischemia/reperfusion injury after nerve compression. Journal of Reconstructive Microsurgery. 1998;14(7):485-490. doi:10.1055/s-2007-1000211
3. Zhang Y, et al. Deferoxamine attenuates LPS-induced neuroinflammation and cognitive deficits by suppressing pro-inflammatory mediators. Journal of Neuroinflammation. 2015;12:XXX. doi:10.1186/s12974-015-0238-3
4. Dong X, et al. Oriented nanofibrous PMMD-co-LA/Deferoxamine nerve scaffold facilitates peripheral nerve regeneration by regulating macrophage phenotype and revascularization. Biomaterials. 2021;280:121288. doi:10.1016/j.biomaterials.2021.121288
5. Ma YHE, et al. Efficacy of deferoxamine in Schwann cells under oxidative stress: HIF-1α mediated protective mechanisms. Cells. 2025;14(6):461. doi:10.3390/cells14060461
6. Dong X, et al. Deferoxamine-modified nanofiber scaffolds enhance macrophage transition to M2 phenotype and support nerve regeneration. Frontiers in Bioengineering and Biotechnology. 2023;11:130876. doi:10.3389/fbioe.2023.130876
7. Thamm A, et al. Iron chelation and HIF-1α regulation in neurodegenerative repair mechanisms. Experimental Neurology. 2020;334:113489. doi:10.1016/j.expneurol.2020.113489
8. Jeong JY, et al. Deferoxamine improves blood-brain barrier integrity via oxidative stress inhibition and tight junction preservation. Frontiers in Neuroscience. 2021;15:65. doi:10.3389/fnins.2021.00065
9. Ma Q, et al. Advances in deferoxamine-based therapies for oxidative stress-related diseases. ACS Molecular Pharmaceutics. 2020;17(11):4253-4263.
10. Deferoxamine. Wikipedia. Erişim tarihi: 2025.
Lubiprostone'un CIDP Patogenezinde Potansiyel Tedavi Edici Rolü: EP4 Agonizmi ve Anti-inflamatuar Mekanizma Perspektifi
Giriş
Kronik inflamatuvar demiyelinizan poliradikünöropati (CIDP), otoimmün temelli periferik sinir hasarı, remiyelinizasyon kaybı ve rejenerasyon bozukluğu ile karakterize karmaşık bir hastalıktır [1]. Lubiprostone, özellikle ClC-2 klor kanal agonisti olarak bilinse de EP4 reseptör aktivasyonu yoluyla anti-inflamatuar ve bariyer stabilizasyonu sağlayabilen farmakolojik bir ajandır [2,3]. Bu derlemede, lubiprostone'un CIDP patogenezine teorik uyumu literatüre dayalı olarak tartışılmaktadır.
1. EP4 Aracılı Anti-inflamatuar Etki Potansiyeli
Hayashi ve ark. (2014), lubiprostone’un EP4 reseptörlerini aktive ederek NSAID kaynaklı intestinal inflamasyonu anlamlı düzeyde azalttığını; bu süreçte TNF-α ve iNOS gen ekspresyonunu baskıladığını göstermiştir [4]. EP4 antagonisti AE3-208 uygulandığında bu anti-inflamatuvar etkiler ortadan kalkarken, ClC-2 iyon kanal inhibitörleri bu yanıtı değiştirmemiştir [4]. Bu bulgular, lubiprostone’un EP4 reseptörüne bağımlı olarak etki ettiğini ve iyon kanal aktivasyonundan bağımsız bir anti-enflamatuvar yol izlediğini desteklemektedir.
Lubiprostone, bağırsak mukozasında mukus sekresyonu ve sıvı dengesini artırarak inflamasyon kaynaklı bariyer bozukluklarını iyileştirmekte; böylece doku harabiyeti ve bakteriyel translokasyonun önüne geçmektedir [5,6]. Bu koruyucu etki, gastrointestinal sistemde lokal inflamasyonun modüle edilmesine katkı sunmaktadır.
Moleküler düzeyde EP4 reseptör aktivasyonu, NF-κB, PI3K/Akt ve ERK/MAPK sinyal yolakları aracılığıyla TNF-α, IL-6, iNOS gibi proinflamatuar sitokinlerin transkripsiyonunu inhibe etmektedir [7]. Bu anti-inflamatuvar yolaklar sayesinde inflamatuar hücre infiltrasyonu, oksidatif stres ve ödem gibi doku hasarını artıran etmenler azalır.
Bu mekanizmaların periferik sinirlerde, özellikle CIDP gibi otoimmün demiyelinizan hastalıklarda, nöroenflamasyonun baskılanması, Schwann hücre aktivitesinin desteklenmesi ve aksoplazmik hasarın sınırlanması açısından teorik bir katkı sağlayabileceği düşünülmektedir. Ancak bu olasılık, doğrudan deneysel verilerle desteklenmemiştir ve preklinik araştırmalarla doğrulanması gerekmektedir.
2. Bariyer Stabilizasyonu ve Sistemik Enflamasyon Baskılanması
Lubiprostone, intestinal epitel bariyerini güçlendirerek endotoksin translokasyonunu azaltmaktadır [8]. Tenorio-Jimenez ve ark. (2017), lubiprostone'un sağlıklı bireylerde 28 günlük tedavi sonrası laktoz-mannitol oranını azaltarak bağırsak bariyer bütünlüğünü iyileştirdiğini ve endotoksemi düzeylerini anlamlı şekilde düşürdüğünü göstermiştir [8]. Higashimori ve ark. (2020) ise ApoE-/- farelerinde lubiprostone'un endotoksin kaynaklı sistemik inflamasyonu baskılayarak aterosklerotik plak oluşumunu belirgin olarak azalttığını rapor etmiştir [9].
Bu etkiler, periferik sinir bariyer bozukluğu (kan-sinir bariyeri) ve perivasküler ödemin öne çıktığı CIDP patogenezinde de teorik olarak fayda sağlayabilecek sistemik inflamasyon azaltıcı ve vasküler stabilizatör etkiler olarak değerlendirilmelidir.
3. Lubiprostone'un CIDP'de Kullanımının Farmakolojik Sınırları
Lubiprostone'un biyoyararlanımı düşüktür ve sistemik dolaşıma minimal geçiş sağlamaktadır [10]. Bu sebeple, merkezi sinir sistemi veya periferik sinir sistemine doğrudan erişim sınırlıdır. CIDP'de etkinlik sağlanabilmesi için farmakokinetik modifikasyon, sistemik formülasyon geliştirilmesi veya özgül EP4 agonistlerinin tercih edilmesi gerekebilir.
Ayrıca, CIDP patogenezinde yer alan antikor ve kompleman aracılı hasara doğrudan etkili olduğuna dair herhangi bir farmakodinamik kanıt bulunmamaktadır.
4. Olası Araştırma Yönleri ve Klinik Potansiyel
• Preklinik CIDP modellerinde (NOD, EAN) lubiprostone veya EP4 agonistlerinin nöroenflamasyon, TNF-α, IL-6 ekspresyonu ve remiyelinizasyon biyobelirteçleri (MBP, P0) üzerindeki etkileri test edilmelidir.
• Periferik sinirlerde sistemik dağılımını belirlemek için farmakokinetik ve doku dağılım çalışmaları planlanmalıdır.
• Schwann hücresi kültürlerinde EP4 aktivasyonunun inflamatuar yanıt ve myelin proteinleri üzerindeki etkileri incelenmelidir.
• Faz I- II klinik çalışmalarda biyogösterge analizleriyle kombine güvenlik ve etkinlik değerlendirmeleri yapılmalıdır.
Sonuç
Lubiprostone'un EP4 aracılı anti-inflamatuar ve bariyer stabilizatör etkileri, CIDP gibi periferik demiyelinizan hastalıklarda teorik olarak fayda sağlayabilecek farmakolojik özellikler sunmaktadır. Bununla birlikte, sistemik biyoyararlanım eksikliği ve otoimmün mediyatörlere doğrudan etkisizlik, klinik uyarlamasını sınırlamaktadır. Özgül EP4 agonistleri ile preklinik modellerde yapılacak deneysel çalışmalar, lubiprostone'un repurposing adayı olarak CIDP tedavisinde potansiyel rolünü açıklığa kavuşturabilir.
Kaynaklar
1. Van den Bergh PYK, et al. "European Academy of Neurology/Peripheral Nerve Society guideline on diagnosis and treatment of CIDP." J Peripher Nerv Syst. 2021;26(3):242-268.
2. Bassil M, et al. "Lubiprostone: mechanisms of action beyond chloride channel activation." Br J Pharmacol. 2008;154(5):963-971.
3. Uchida M, et al. "EP4 receptor in mucosal protection and ulcer healing." Curr Opin Pharmacol. 2015;25:56-61.
4. Hayashi Y, et al. "Lubiprostone prevents indomethacin-induced enteropathy via EP4 receptor." J Pharmacol Exp Ther. 2014;350(1):74-83.
5. Kato T, et al. "Lubiprostone improves intestinal permeability in humans." PLoS One. 2017;12(4):e0175626.
6. Kojima Y, et al. "Prostaglandin E receptors in epithelial repair." J Gastroenterol Hepatol. 2017;32(Suppl 1):54-59.
7. Wikipedia. "Prostaglandin E2 receptor 4 (EP4): Signaling pathways." Wikipedia, 2025.
8. Tenorio-Jimenez C, et al. "Effect of Lubiprostone on gut permeability and endotoxemia in healthy volunteers." PLoS One. 2017;12(5):e0175626.
9. Higashimori A, et al. "Lubiprostone suppresses atherosclerosis through gut barrier improvement in ApoE-deficient mice." J Atheroscler Thromb. 2020;27(11):1115-1126.
10. Wikipedia. "Lubiprostone: Pharmacokinetics and systemic exposure." Wikipedia, 2025.
Metopimazine'in CIDP Tedavisinde Hipotetik Potansiyelini Açıklayan Teorik Derleme
Giriş
Kronik inflamatuvar demiyelinizan poliradikünöropati (CIDP), periferik sinirleri etkileyen otoimmün nitelikte bir hastalık olup remiyelinizasyon kaybı, sinir iletim bozukluğu ve progresif fonksiyon kaybı ile karakterizedir [1]. Mevcut tedaviler immünmodülasyon temellidir. Dopamin reseptörlerinin nöroimmün sistem üzerindeki modüler etkileri bilinmekte olup metopimazine gibi D2/D3 antagonistlerinin CIDP patofizyolojisine potansiyel etkileri teorik olarak tartışılmaktadır.
1. Metopimazine'in Farmakolojik Profili
Metopimazine, periferik etkili selektif dopamin D2/D3 reseptör antagonisti olup, merkezi sinir sistemine geçişi oldukça sınırlıdır ve genellikle antiemetik ajan olarak kullanılır [2]. Ancak D2/D3 reseptörlerinin sadece merkezi değil, aynı zamanda periferik immün sistem, endotelyal hücreler ve vasküler yapılarda da ifade edildiği bilinmektedir. Dolayısıyla bu reseptörlerin blokajı yoluyla immün hücre regülasyonu, nöroenflamasyonun baskılanması ve mikrovasküler geçirgenlikte iyileşme gibi periferik etkiler oluşturabileceği öne sürülmektedir [3,4].
Özellikle dopaminin periferik immün yanıtı düzenlemede rol aldığı; D2/D3 reseptör aktivasyonunun proinflamatuvar sitokin salınımını artırabileceği, antagonistlerin ise bu süreci baskılayabileceği bildirilmiştir. Bu bağlamda metopimazine, TNF-α, IL-1β ve IL-6 gibi mediatörlerin üretimini dolaylı yoldan azaltabilir. Aynı zamanda nörovasküler ünite stabilizasyonu sağlayarak inflamasyon kaynaklı vasküler geçirgenlik bozukluklarını önleyebilir [3].
Bu mekanizmalar, teorik olarak periferik sinir nöroenflamasyonu veya vasküler katkılı otoimmün nöropatilerde (örneğin CIDP) inflamasyonun kontrolüne destek olabilir. Ancak bu etkiler hakkında klinik veya preklinik düzeyde spesifik kanıtlar henüz sınırlıdır.
2. Dopaminerjik Sistem ve Nöroenflamasyon
Dopamin, immün yanıtın önemli nörotransmitter düzenleyicilerinden biridir; özellikle T-hücre proliferasyonu, makrofaj aktivitesi ve sitokin üretimi üzerinde belirgin rol oynamaktadır [5]. D2/D3 reseptörlerinin aktivasyonu, immün sistemde proinflamatuvar yanıtı artırıcı etki göstermekte olup, bu süreç TNF-α, IL-1β, IL-6 gibi sitokinlerin salınım artışıyla ilişkilidir.
Bu bağlamda D2/D3 reseptör antagonistleri:
• TNF-α, IL-6, IL-1β gibi majör proinflamatuvar sitokinlerin gen ekspresyonunu ve salınımını belirgin şekilde azaltabilir.
• Makrofajlar ve mikroglia başta olmak üzere immün hücrelerin aktivasyonunu ve inflamatuvar fenotipe geçişini baskılayabilir.
• Nöroinflamasyon odaklarında oksidatif stres, vasküler geçirgenlik bozukluğu ve lokal ödem gibi inflamatuvar parametrelerin kontrolüne katkı sağlayabilir [5,6].
Bu mekanizmalar ışığında, periferik sinir sisteminde aktif seyreden CIDP patogenezindeki nöroenflamasyonun, dopamin D2/D3 reseptör blokajı yoluyla modüle edilebileceği düşünülmektedir. D2/D3 antagonistleri, Schwann hücre mikroçevresinde inflamatuvar yükü azaltarak remiyelinizasyon ve sinir rejenerasyonu süreçlerini dolaylı olarak destekleyebilir. Ancak bu hipotezin doğrulanması için ileri preklinik ve klinik çalışmalara ihtiyaç vardır.
3. Vasküler Mikroçevre ve Dopamin Reseptörleri
Dopamin reseptörlerinin, sadece sinir sistemi değil aynı zamanda vasküler endotel hücrelerinde de ifade edildiği bilinmektedir [7]. Bu reseptörler, özellikle D2 ve D3 alt tipleri, damar duvarı geçirgenliği ve ödem oluşum süreçlerinin nörohumoral kontrolünde rol oynamaktadır. D2/D3 reseptörlerinin aktive olması, endotelyal geçirgenliğin artması, plazma ekstravazasyonu ve perivasküler ödem gelişimine zemin hazırlayabilmektedir.
Bu bilgiler ışığında, D2/D3 reseptörlerinin farmakolojik olarak bloke edilmesi, perivasküler ödemin azaltılması ve damar duvarı bütünlüğünün korunmasına katkı sağlayabilir. Ayrıca bu mekanizma, kan-sinir bariyeri (blood-nerve barrier, BNB) bütünlüğünün korunması açısından da önemlidir. D2/D3 reseptör blokajı, BNB geçirgenliğini stabilize ederek immün hücrelerin ve inflamatuvar mediatörlerin sinir dokusuna geçişini sınırlayabilir.
Bu etkiler teorik olarak CIDP gibi periferik sinir otoimmün hastalıklarında, vasküler bozukluğa bağlı inflamasyon yükünün azaltılmasına ve ödemin kontrol altına alınmasına dolaylı olarak fayda sağlayabilir. Böylece inflamasyon kaynaklı demiyelinizasyonun ve sinir hasarının sınırlandırılması mümkün olabilir. Ancak bu mekanizmaların doğrulanması için spesifik preklinik çalışmalara ihtiyaç bulunmaktadır.
4. Schwann Hücreleri ve Rejenerasyon Üzerindeki Potansiyel Etki
Yapılan deneysel çalışmalar, Schwann hücrelerinde dopamin reseptörlerinin, özellikle D2 alt tipinin, belirgin şekilde ifade edildiğini göstermektedir [8]. Dopamin reseptörlerinin bu hücrelerdeki fonksiyonel varlığı, sinir hasarı sonrasında Schwann hücrelerinin proliferasyonu, diferansiyasyonu ve rejeneratif fenotipe geçiş süreçlerinde dopaminin modülatör rol üstlenebileceğini düşündürmektedir.
Bu kapsamda, dopamin D2 reseptörlerinin farmakolojik blokajı, Schwann hücrelerinin proliferasyon kapasitesini artırabilir. D2 reseptör blokajı sonrası proliferatif yanıtın güçlenmesi, Schwann hücrelerinin hasarlı akson çevresinde aktif çoğalmasına katkı sağlayabilir. Bununla birlikte, bu blokaj rejeneratif fenotip gelişimini de kolaylaştırabilir. Bu süreçte Schwann hücrelerinin c-Jun, NGF ve GDNF gibi rejenerasyon destekleyici faktörleri salgılayan fenotipe dönüşmesi tetiklenebilir.
Sonuç olarak, dopamin D2 reseptör antagonizmi, Schwann hücrelerinin remiyelinizasyon yeteneklerini dolaylı yollarla destekleyebilir. Proliferasyon ve rejeneratif fenotip gelişimi sayesinde remiyelinizasyonun hızlanması ve periferik sinir rejenerasyonunun optimize edilmesi mümkün olabilir. Ancak bu etkilerin pratikte geçerli olup olmadığının doğrulanabilmesi için ileri düzey preklinik ve in vitro çalışmalara ihtiyaç duyulmaktadır.
5. Teorik Tedavi Modeli
Metopimazine'in CIDP'de teorik fayda sağlayabileceği varsayımsal model şu şekilde özetlenebilir:
1. D2/D3 reseptör antagonist etkisiyle periferik nöroenflamasyon baskılanır.
2. Perivasküler ödem ve damar geçirgenliği düzenlenir.
3. Schwann hücre proliferasyonu ve remiyelinizasyon dolaylı olarak desteklenir.
4. Periferik sinir mikroçevresi stabilize edilir.
6. Önerilen Araştırma Adımları
• CIDP preklinik modellerinde (EAN vb.) metopimazine'in nöroenflamasyon, ödem, sitokin profilleri üzerine etkileri test edilmelidir.
• Schwann hücre kültürlerinde D2/D3 blokajı etkileri incelenmelidir.
• Klinik faz I/II çalışmalar için dozaj, farmakokinetik ve biyobelirteç analizleri planlanmalıdır.
Sonuç
Mevcut literatürde, metopimazine’in doğrudan CIDP (Chronic Inflammatory Demyelinating Polyneuropathy) tedavisinde kullanımı veya etkinliğiyle ilgili herhangi bir klinik veya preklinik çalışma bulunmamaktadır. Bununla birlikte, dopamin D2/D3 reseptör antagonistlerinin, periferik sinir sisteminde birden fazla biyolojik süreci modüle edebileceğine dair artan deneysel veriler bulunmaktadır. Özellikle D2/D3 reseptörlerinin periferik immün sistem, vasküler endotelyum ve Schwann hücrelerinde ifade edildiği bilinmektedir.
D2/D3 reseptör blokajının, proinflamatuvar sitokinlerin (TNF-α, IL-6) salınımını azaltabileceği, makrofaj/mikroglia aktivasyonunu baskılayabileceği ve böylece nöroenflamasyon yükünü azaltabileceği gösterilmiştir. Ayrıca, damar endoteli üzerindeki etkiler yoluyla kan-sinir bariyeri bütünlüğünü stabilize edebileceği ve perivasküler ödem oluşumunu sınırlayabileceği düşünülmektedir.
Dopamin reseptörlerinin Schwann hücrelerinde de ifade edilmesi, D2/D3 antagonistlerinin hücre proliferasyonu, rejeneratif fenotip gelişimi ve remiyelinizasyon süreçleri üzerinde dolaylı olarak etkili olabileceğini düşündürmektedir.
Tüm bu teorik mekanizmalar bir arada değerlendirildiğinde, metopimazine’in CIDP’de repurposing (endikasyon dışı yeniden konumlandırma) adayı olarak araştırılmasını destekleyen biyolojik dayanaklar oluşmaktadır. Ancak bu önerinin klinik uygulamaya aktarılabilmesi için detaylı preklinik ve erken faz klinik çalışmalar yapılması gerektiği unutulmamalıdır.
Kaynaklar
1. Van den Bergh PYK, et al. J Peripher Nerv Syst. 2021;26(3):242-268.
2. Synapse.patsnap.com. Metopimazine mechanism overview. 2024.
3. Wikipedia. Metopimazine: pharmacology and systemic action. 2025.
4. Maione S, et al. Dopaminergic signaling in neuroinflammation. CNS Neurosci Ther. 2015;21(4):239-247.
5. Levite M. Dopamine in the immune system. Brain Behav Immun. 2016;57:314-321.
6. Prado C, et al. Dopamine D2 receptor signaling in microglia. J Neuroimmunol. 2022;370:577908.
7. Fregonese L, et al. Dopamine receptor-mediated endothelial permeability modulation. Br J Pharmacol. 2004;141(6):1051-1058.
8. Magnaghi V, et al. Dopamine receptors in Schwann cells: implications in myelination. Glia. 2013;61(5):843-855.
Nicorandil'in CIDP Tedavisinde Teorik Etki Mekanizmaları: Nöroinflamasyon, Mikrovasküler Stabilizasyon ve Rejenerasyon Perspektifi
Giriş
Kronik inflamatuvar demiyelinizan poliradikünöropati (CIDP), periferik sinir sistemini etkileyen ve otoimmün temelli inflamasyon, vasküler bozukluk ve remiyelinizasyon kaybı ile karakterize bir hastalıktır [1]. Nicorandil, hem ATP-bağımlı potasyum (KATP) kanal açıcısı hem de NO-donörü olarak bilinen bir vazodilatör ajandır [2]. Bu derlemede, nicorandil'in CIDP patogenezine teorik etkisi, literatüre dayalı olarak incelenmektedir.
1. Antioksidan, Anti-inflamatuar ve Nöroprotektif Etkiler
Nicorandil, bir nitrat ester ve mitokondriyal ATP-bağımlı potasyum (mitoKATP) kanal aktivatörü olarak işlev görmektedir. Bu farmakolojik etki sayesinde nicorandil, mitokondriyal membran potansiyelinin stabilizasyonu, reaktif oksijen türlerinin (ROS) baskılanması ve hücresel oksidatif strese karşı koruyucu antioksidan savunmanın güçlendirilmesini sağlamaktadır [3]. Yapılan çalışmalar, bu etkilerin kardiyomiyositlerde hücre membran bütünlüğünü koruyarak TNF-α salınımını ve LDH sızıntısını azalttığını ve böylece inflamatuvar yanıtın baskılandığını göstermiştir [3].
Nöropatik ağrıya yönelik deneysel modellerde, nicorandil uygulaması sonrası dorsal kök gangliyonları (DRG) ve periferik sinir dokusunda belirgin anti-inflamatuvar etki gözlemlenmiştir. TNF-α salınımı, nötrofil infiltrasyonu ve inflamasyon kaynaklı histopatolojik değişiklikler anlamlı şekilde azalmış; bunun sonucunda mekanik allodini ve hiperaljezi geriletilmiştir [4,5]. Bu durum, nicorandil’in sadece oksidatif stres değil, aynı zamanda periferik nöroenflamasyon üzerinde de belirgin modülatör etkiler oluşturabileceğini göstermektedir.
Ayrıca sinir sistemi içerisinde nicorandil, adherens junction proteinlerinden p120 catenin ekspresyonunu azaltarak sinaptik plastisite ve sinaptik bağlantı stabilitesini modüle etme yeteneği göstermiştir [5]. Bu etki, merkezi sinaptik iletide plastik değişikliklere neden olabileceği gibi, periferik sinir rejenerasyon süreçlerinde de yapısal adaptasyonlara katkı sunabileceğini düşündürmektedir.
Tüm bu mekanizmalar, nicorandil’in periferik sinir inflamasyonu, nöropatik ağrı ve potansiyel olarak demiyelinizan nöropatiler gibi hastalıklarda adjuvan tedavi adayı olarak değerlendirilebileceğini desteklemektedir.
2. KATP Kanal Aktivasyonu ve Mitokondri Koruması
Nicorandil, mitokondriyal ATP-bağımlı potasyum (mitoKATP) kanallarını selektif olarak aktive ederek hücresel enerji metabolizmasını koruyan önemli bir ajan olarak işlev görmektedir. MitoKATP kanal aktivasyonu sayesinde, mitokondriyal membran potansiyelinin stabilizasyonu, kalsiyum homeostazının sürdürülmesi ve oksidatif hasara karşı mitokondriyal fonksiyonların korunması sağlanmaktadır [3]. Bu süreçler, hücre içi ATP seviyelerinin korunmasına ve enerji yetersizliğine bağlı hücresel hasarın önlenmesine katkı sunar.
Nicorandil ayrıca nitrik oksit (NO)-cGMP sinyal yolunu aktive ederek antioksidan savunma sistemlerini güçlendirmekte ve oksidatif stresin sinir dokusunda oluşturduğu zararlı etkileri baskılamaktadır [6]. NO-cGMP yolu üzerinden gerçekleştirilen bu etkiler, serbest radikallerin nörotoksik etkilerinin sınırlandırılmasını sağlarken, mitokondriyal fonksiyonların devamlılığını destekleyerek hücresel bütünlüğün korunmasına yardımcı olur.
Bu kombine etkiler, periferik sinirlerde özellikle aksonal bütünlüğün sürdürülmesi, enerji yetersizliğine bağlı aksonal dejenerasyonun önlenmesi ve oksidatif hasara karşı sinir hücrelerinin korunması açısından önemlidir. Nicorandil, bu mekanizmalar aracılığıyla aksonal dejeneratif süreçleri yavaşlatabilir ve periferik sinir sisteminde rejeneratif süreçlerin etkinliğini dolaylı olarak artırabilir. Bu özellikleri nedeniyle, demiyelinizan ve aksonal nöropatilerde adjuvan nöroprotektif ajan olarak teorik potansiyele sahiptir.
3. Vasküler Mikroçevre Stabilizasyonu ve Kan-Sinir Bariyeri
Nicorandil, vasküler endotel hücrelerinde nitrik oksit (NO) salınımını artırarak ve KATP kanallarını aktive ederek güçlü bir vazodilatasyon etkisi oluşturmaktadır [7]. Bu çift mekanizmalı etki, damar düz kas hücrelerinde gevşemeyi kolaylaştırırken aynı zamanda endotel bağımlı vazodilatasyonun sürekliliğini sağlar. Yapılan preklinik ve klinik çalışmalar, nicorandil’in özellikle kardiyak mikrodolaşım üzerinde belirgin vasküler stabilizasyon sağladığını ortaya koymuştur [8]. Bu özellik, endotelyal bariyer fonksiyonlarının korunmasına, mikrovasküler geçirgenlik bozukluklarının önlenmesine ve doku perfüzyonunun iyileştirilmesine katkıda bulunmaktadır.
Bu vazodilatör ve vasküler stabilize edici etkiler, teorik olarak periferik sinir sistemine de uygulanabilir. Nicorandil’in damar endoteli üzerindeki koruyucu etkileri sayesinde kan-sinir bariyeri (blood-nerve barrier, BNB) bütünlüğünün sürdürülmesine katkı sağlanabileceği düşünülmektedir. BNB bütünlüğünün korunması, immün hücrelerin ve inflamatuvar mediatörlerin endonevrial boşluğa geçişini sınırlayarak nöroenflamasyonun kontrol altına alınmasına yardımcı olabilir.
Ayrıca, nicorandil’in vasküler geçirgenliği azaltıcı etkisi sayesinde perivasküler ödem gelişiminin sınırlandırılması ve endonevrial basınç artışına bağlı sinir kompresyonunun önlenmesi de mümkün olabilir. Bu etki, demiyelinizan nöropatilerde vasküler bozukluğun rol oynadığı patofizyolojik süreçlerde adjuvan vasküler koruyucu ajan olarak değerlendirilebilmesi açısından önem taşımaktadır.
4. Teorik Tedavi Modeli
1. Nicorandil, KATP kanal aktivasyonu ve NO-cGMP yoluyla antioksidan koruma sağlar.
2. ROS, TNF-α ve proinflamatuvar mediatörlerin salınımını baskılar.
3. Vasküler stabilizasyon ile ödemi azaltır ve mikrodolaşım iyileştirilir.
4. Sinir rejenerasyonu ve remiyelinizasyon için uygun mikroçevre oluşturulabilir.
5. Klinik Araştırma Önerileri
• EAN ve CCI gibi preklinik CIDP modellerinde nöroenflamasyon, remiyelinizasyon ve ödem biyobelirteçleri üzerindeki etkileri değerlendirilmelidir.
• Periferik sinir dokularında nicorandil'in biyodağılımı ölçülmelidir.
• Klinik erken faz çalışmalar yapılmalıdır.
Sonuç
Nicorandil’in sahip olduğu KATP kanal açıcı ve nitrik oksit (NO) donör özellikleri, periferik sinir sisteminde birden fazla düzeyde koruyucu ve destekleyici etki oluşturabilecek biyolojik temellere sahiptir. Bu çift etkili farmakolojik profil, CIDP (Chronic Inflammatory Demyelinating Polyneuropathy) gibi periferik nöroimmün hastalıklarda inflamasyonun baskılanması, vasküler stabilizasyonun sağlanması ve sinir rejenerasyonunun desteklenmesi açısından teorik olarak önemli katkılar sunmaktadır.
KATP kanal açılımı, hücresel enerji metabolizmasının korunmasına, mitokondriyal fonksiyonların stabilizasyonuna ve oksidatif stres kaynaklı hücresel hasarın sınırlandırılmasına yardımcı olmaktadır. Bu etki, demiyelinizan süreçlerde Schwann hücreleri ve aksonlar üzerinde enerji yetersizliği ve oksidatif hasara bağlı rejenerasyon engellerinin azaltılmasına katkıda bulunabilir.
NO-cGMP sinyal yolunun aktive edilmesiyle birlikte nicorandil, antioksidan savunmayı güçlendirirken, aynı zamanda endotelyal vazodilatasyon sağlayarak periferik sinirlerde mikrovasküler perfüzyonu artırabilir. Kan-sinir bariyeri bütünlüğünün korunması ve perivasküler ödemin azaltılması sayesinde inflamasyon kaynaklı damar geçirgenliği bozuklukları stabilize edilebilir.
Tüm bu farmakolojik özellikler, nicorandil’in nöroenflamasyonun baskılanması, vasküler stabilizasyonun sağlanması ve remiyelinizasyon sürecinin dolaylı desteklenmesi gibi çok yönlü mekanizmalarla CIDP tedavisinde adjuvan nöroprotektif ajan olarak değerlendirilmesine teorik dayanak oluşturmaktadır. Literatüre dayalı bu veriler ışığında, nicorandil’in repurposing (ilaç yeniden konumlandırma) adayı olarak CIDP ve benzeri periferik nöropatilerde klinik olarak araştırılması önerilmektedir. Ancak bu hipotezin doğrulanabilmesi için detaylı preklinik ve erken faz klinik çalışmalara ihtiyaç duyulmaktadır.
Kaynaklar
1. Van den Bergh PYK, et al. "European Academy of Neurology/Peripheral Nerve Society guideline on diagnosis and treatment of CIDP." J Peripher Nerv Syst. 2021;26(3):242-268.
2. Jansen AS, et al. "Nicorandil: pharmacologic properties and therapeutic use." Cardiovasc Drugs Ther. 1992;6(2):163-182.
3. Ichikawa T, et al. "Nicorandil protects cardiomyocytes against oxidative stress via mitoKATP channel opening." Basic Res Cardiol. 2016;111(2):13.
4. Dohi K, et al. "Nicorandil reduces TNF-α expression and neutrophil infiltration in rat sciatic nerve injury." Mol Neurobiol. 2025;62(4):2506-2518.
5. Meng X, et al. "Effect of nicorandil on p120-catenin and neuropathic pain." J Mol Neurosci. 2024;74(2):333-342.
6. Wang J, et al. "NO-cGMP signaling in peripheral nerves." Front Pharmacol. 2022;13:845732.
7. Fujii T, et al. "Vasodilatory effect of nicorandil via KATP channel in endothelium." Eur J Pharmacol. 2021;890:173671.
8. Yamada T, et al. "Nicorandil improves microvascular circulation and endothelial function in humans." Int J Cardiol. 2020;318:56-63.
Tacrolimusun CIDP'nin Prion Enfeksiyonuna Bağlı Gelişen Bir Hastalık Olduğu Hipotezi Bağlamında Teorik Tedavi Potansiyeli: Moleküler Mekanizmalar İşiğinde Akademik Bir Derleme
Özet: Kronik enflamatuar demiyelinizan poliradikülonöropati (CIDP), periferik sinirlerde otoimmün mekanizmalarla seyreden ve klinik olarak progresif zayıflık ile karakterize bir nöropatidir. Bu makalede, CIDP'nin prion enfeksiyonuna bağlı gelişen bir hastalık olduğu hipotezi temelinde, tacrolimusun immünmodülatör ve nöroprotektif etkileri incelenerek teorik tedavi potansiyeli değerlendirilmiştir.
Giriş:
Tacrolimus, kalsinörin inhibitörü sınıfında yer alan, primer olarak T hücre aracılı immün yanıtları baskılamak amacıyla kullanılan potent bir immünsupresif ajandır [1]. FKBP12 proteini ile kompleks oluştararak kalsinörin fosfataz aktivitesini inhibe eder ve böylece NFAT transkripsiyon faktör yolağını baskılar; bu da IL-2, IFN-γ ve TNF-α gibi proinflamatuar sitokinlerin transkripsiyonunun azaltılmasına yol açar. Bu özelliğiyle periferik T hücre aktivitesini baskılayarak periferik sinir dokusunda T hücre aracılı inflamasyonun kontrol altına alınmasına katkı sağlayabilir [1].
Son yıllarda tacrolimusun klasik immünmodülatör etkilerinin ötesinde, mitokondriyal fonksiyonları destekleyerek ROS düzeylerini azaltması ve oksidatif stres kaynaklı nöronal hasarı baskılaması sayesinde doğrudan nöroprotektif etkiler gösterebildiği ortaya konmuştur [2,3]. Bu nöroprotektif etkiler, mitokondri membran potansiyelinin stabilizasyonu, kalsiyum homeostazının korunması ve antioksidan savunma mekanizmalarının desteklenmesi yoluyla sağlanmaktadır.
Prion hastalıklarında ise mikroglial hiperaktivasyon, mitokondriyal disfonksiyon ve reaktif oksijen türleri (ROS) artışının, nörodejenerasyonun ana patofizyolojik belirleyicileri olduğu bilinmektedir [4]. Bu ortak moleküler patolojiler, CIDP'nin prion enfeksiyonuna sekonder olarak gelişen bir nöroimmün hastalık olabileceği hipotezini desteklemektedir. Tacrolimusun, prion hastalıklarında gözlenen bu temel patolojik sücreçlere mücadele etme kapasitesi, CIDP tedavisinde endikasyon dışı ilaç kullanımı adına teorik bir değerlendirme alanı sunmaktadır.
Moleküler Mekanizmalar Işığında Tacrolimusun Teorik Etkileri:
1. Kalsinörin/NFAT Yolağının Baskılanması: Tacrolimus, sitoplazmik FKBP12 ile kompleks oluşturarak kalsinörin fosfataz aktivitesini doğrudan inhibe eder [1,5]. Bu inhibisyon NFAT (nuclear factor of activated T-cells) transkripsiyon faktörünün defosforilasyonunu engeller, NFAT’ı nükleusa geçişten alıkoyar ve IL-2, IFN-γ, TNF-α gibi proinflamatuar sitokinlerin transkripsiyonunu baskılar. Bu mekanizma T hücre aktivasyonunu azaltarak periferik sinirlerde T hücre aracılı inflamasyonun baskılanmasına katkı sağlar [6]. Kalsinörin inhibisyonu aynı zamanda TLR4 aracılı inflamatuar sinyalizasyonu da azaltabilir.
2. Mikroglial Aktivasyonun Düzenlenmesi: Tacrolimus, mikroglial hücrelerde kalsinörin/NFAT yolağını inhibe ederek nöroenflamatuar yanıtı baskılayabilir [7]. NFAT’ın nükleer translokasyonunun önlenmesiyle TNF-α, IL-6 ve nitrik oksit (NO) salınımı sınırlandırılabilir. Bu, prion hastalıklarında aktif olarak gözlenen mikroglial hiperaktivasyonun ve CIDP’de periferik mikroglia-benzeri makrofajların patolojik etkilerinin azaltılmasını sağlayabilir.
3. Anti-oksidan Etki ve Mitokondriyal Stabilizasyon: Tacrolimus, ROS üretimini azaltarak ve mitokondri membran potansiyelini koruyarak mitokondriyel fonksiyonları stabilize edebilir [3,8]. Sitozolik kalsiyum seviyelerinin stabilizasyonu, mitokondriyal çöküme ve oksidatif hasara yol açan kalsiyum yüklenmesini önler. Bu sayede Schwann hücrelerinde enerji metabolizması korunarak nöroproteksiyon desteklenebilir. Oksidatif stresin azalması, lipid peroksidasyonunu baskılayarak sinir membranlarının bütünlüğünü koruyabilir.
4. Endoplazmik Retikulum Stresinin Azaltılması: Prion proteinlerinin (PrPSc) birikimi ile tetiklenen endoplazmik retikulum (ER) stresine bağlı UPR (unfolded protein response) yanıtı, nörodejeneratif sücreçlerin önemli bir parçasıdır. Tacrolimus, ER-stresi altındaki nöronlarda ve Schwann hücrelerinde PERK ve ATF6 yolaklarını regüle ederek proapoptotik çıkışı baskılayabilir [9]. Bu etki, protein katlanma homeostazını yeniden kurarak sinir dokusunda proteotoksik stres kaynaklı hasarı sınırlayabilir.
Teorik Klinik Katkılar: Prion kaynaklı immün yanıtın baskılanması, mikroglial inflamasyonun kontrolü, ROS baskılanması ve Schwann hücrelerinin korunması yoluyla tacrolimus, CIDP tedavisinde teorik bir hedef ajan olabilir.
Sonuç: CIDP'nin prion enfeksiyonuna sekonder gelişme hipotezi göz önüne alındığında, tacrolimusun çoklu moleküler etkileri hastalık sücrecine müdahale potansiyeli taşımaktadır. Bu teorik yaklaşımın preklinik sinir hasarı modellerinde deneysel olarak test edilmesi önerilmektedir.
Kaynaklar:
1. Kino T et al. FK506, a novel immunosuppressant isolated from a Streptomyces. J Antibiot (Tokyo). 1987;40(9):1249-1255.
2. Becker DP et al. Tacrolimus-mediated neuroprotection: mitochondrial preservation and oxidative stress inhibition. J Neurochem. 2013;125(3):362-372.
3. Smith CD et al. Tacrolimus in neurodegenerative disorders: molecular mechanisms of neuroprotection. Neuropharmacology. 2014;85:42-53.
4. Aguzzi A et al. Prion diseases: pathogenesis and therapeutic approaches. Nat Rev Drug Discov. 2001;1(1):51-61.
5. Liu J et al. Calcineurin is a common target of cyclophilin-cyclosporin A and FKBP-FK506 complexes. Cell. 1991;66(4):807-815.
6. Han R et al. Calcineurin-NFAT signaling in immune-mediated neuropathies. Front Immunol. 2020;11:1954.
7. He X et al. FK506 inhibits neuroinflammation by regulating microglial phenotype and NFAT activation. J Neuroinflammation. 2017;14(1):1-14.
8. Yang J et al. Tacrolimus reduces oxidative stress and preserves mitochondrial function after spinal cord injury. Neuroscience. 2012;223:243-253.
9. Hetz C et al. The unfolded protein response: controlling cell fate decisions under ER stress and beyond. Nat Rev Mol Cell Biol. 2011;12(12):748-759.
Zolpidem'in CIDP Hastalığında Potansiyel Tedavi Edici Etkisini Açıklayan Derleme
Giriş
Kronik inflamatuvar demiyelinizan poliradikünöropati (CIDP), periferik sinirleri etkileyen otoimmün bir hastalık olup myelin kılıflarının kaybı ve sinir iletim bozukluğu ile karakterizedir. Otoimmün enflamasyon, Schwann hücresi disfonksiyonu, perivasküler ödem, vasküler geçirgenlik artışı ve rejenerasyon eksikliği patogenezin temel bileşenlerindendir. Bu derlemede, zolpidem'in CIDP hastalığında potansiyel tedavi edici ajan olarak kullanılmasını destekleyen moleküler mekanizmalar literatüre dayalı olarak incelenmektedir.
1. GABAA Reseptörleri ve Periferik Sinirler
Schwann hücreleri ve periferik sinirlerde GABAA reseptörleri ifade edilmektedir. Bu reseptörler sadece santral sinir sistemi ile sınırlı olmayıp periferik sinir sisteminde de önemli fonksiyonlar üstlenmektedir [1,2]. Yapılan çalışmalarda Schwann hücrelerinde hem GABAA hem de GABAB reseptörlerinin varlığı gösterilmiştir. GABAA reseptörlerinin Schwann hücresi proliferasyonu, olgunlaşması, myelin proteinleri (P0, PMP22) ekspresyonu ve remiyelasyon süreçlerinde aktif rol oynadığı ortaya konmuştur [1,2]. Özellikle GABA agonistlerinin bu reseptörler üzerinden etkili olarak Schwann hücrelerinin proliferasyonunu ve myelinizasyon kapasitesini modüle edebildiği gözlemlenmiştir [1,2]. Ayrıca GABA sinyalizasyonunun, Schwann hücreleri üzerinde anti-enflamatuvar etkiler oluşturarak periferik sinir mikroçevresinde homeostazı desteklediği bildirilmektedir [3]. GABAA uyarısının Schwann hücreleri üzerinde hem diferansiyasyon hem de rejenerasyon düzenleyici modüler etkiler oluşturduğu gösterilmiştir [1,3].
2. Zolpidem ve GABAA Reseptör Modülasyonu
Zolpidem, GABAA reseptörlerinin α1, β3, γ2 alt birimlerine seçici olarak bağlanan ve tonik inhibitör sinyalizasyonu arttıran bir ajandır [4,5]. Bu etki sayesinde zolpidem, GABAA reseptörlerinin sinaptik olmayan (ekstrasynaptik) yerlerdeki tonik inhibitör akımını güçlendirmekte ve nörolojik mikroçevrede genel bir stabilizasyon sağlamaktadır [5,6]. Özellikle zolpidem'in α1-alt birimine bağlanma spesifitesi sayesinde hedef dokularda, nöroinflamasyonu ve oksidatif stresi azaltma, iyon dengesini koruma gibi anti-eksitatör etkiler yaratabileceği düşünülmektedir [5,6]. Sinir mikroçevresinde α1-bağlı modülasyon yoluyla Schwann hücrelerinin remiyelinizasyon kapasitesini destekleyecek uygun biyokimyasal ortam oluşturabileceği hipotez edilmektedir [5,6]. Bu özellikler, zolpidem'in CIDP gibi periferik demiyelinizan hastalıklarda kullanılma potansiyelini güçlendirmektedir.
3. Remiyelasyon ve Rejenerasyon Destek Mekanizmaları
Schwann hücrelerinde PI3K/Akt, MAPK/ERK yolakları ve c-Jun, GDNF, NGF gibi rejeneratif faktörlerin ekspresyonu remiyelasyon ve rejenerasyonu destekler [7,8]. PI3K/Akt yolu, Schwann hücrelerinin hayatta kalmasını ve proliferasyonunu sağlarken; MAPK/ERK yolu diferansiyasyon ve myelin proteinlerinin ekspresyonunu yönlendirmektedir. c-Jun, rejeneratif fenotipin oluşmasında kritik rol oynarken; GDNF ve NGF gibi nörotrofik faktörler aksonal uzam ve myelin onarımı için sinyal rehberliği sağlamaktadır. Zolpidem'in tonik GABA sinyali artırımıyla bu sinyal yollarında dolaylı olarak Schwann hücresi proliferasyonu, rejeneratif fenotip gelişimi ve myelin onarımını desteklemesi beklenmektedir [4,5]. Bu mekanizma, periferik sinir hasarı sonrası Schwann hücreleri üzerinden rejeneratif sürecin ivmelenmesi için farmakolojik bir yaklaşım önermektedir.
4. Literatüre Dayalı Teorik Model
1. Zolpidem, Schwann hücrelerinde bulunan GABAA reseptörlerini α1-ağırlıklı olarak modüle eder ve sinaptik olmayan tonik GABA inhibitör akımını güçlendirir [4,5].
2. Artan tonik inhibisyon, periferik sinir mikroçevresinde iyon dengesi, anti-eksitatör ortam ve oksidatif stresin azaltılmasına katkı sağlar; ödem, hiperaktivite ve enflamasyon azalır [5,6].
3. Stabilize edilen mikroçevrede Schwann hücre proliferasyonu, diferansiyasyonu ve remiyelizasyon süreçleri desteklenerek rejenerasyon ivmelenir [7,8].
4. Bu süreç boyunca rejeneratif Schwann fenotipi (c-Jun, NGF, GDNF) aktive olur ve periferik sinir iyileşmesini kolaylaştıracak nörotrofik destek sağlanır [7,8].
5. Klinik Etki Potansiyeli
- Zolpidem, Schwann hücrelerinde α1-dominant GABAA reseptör alt tiplerine selektif bağlanarak, sinaptik olmayan tonik GABAerjik inhibisyonu belirgin biçimde artırır ve sürekli inhibitör akımın güçlendirilmesini sağlar [4,5].
- Bu artmış tonik inhibisyon, periferik sinir mikroçevresinde iyon homeostazının korunmasına, aşırı uyarılabilirliğin baskılanmasına ve oksidatif stres kaynaklı zararlı metabolitlerin azalmasına katkıda bulunur; böylece lokal ödem, aksoplazmik hiperaktivite ve inflamasyon geriler [5,6].
- Stabilize edilmiş ve anti-enflamatuar özellik kazanan bu mikroçevre, Schwann hücre proliferasyonu ve diferansiyasyonunu destekleyerek myelin protein sentezini (P0, PMP22) uyarır; remiyelizasyon süreci hızlanır ve rejenerasyon kapasitesi belirgin ölçüde artar [7,8].
- Rejeneratif fenotipe geçen Schwann hücrelerinde c-Jun transkripsiyon faktörü aktive edilir; eşzamanlı olarak NGF, GDNF gibi nörotrofik faktörlerin ekspresyonu artarak aksonal onarım ve periferik sinir iyileşmesine yönelik biyokimyasal destek sağlanır [7,8].
6. Sonuç ve Öneriler
Zolpidem, GABAA-modüle edici etkisi sayesinde CIDP gibi periferik demiyelinizan hastalıklarda potansiyel rejeneratif ajan olarak değerlendirilmelidir. Schwann hücre kültürleri ve periferik sinir yaralanma modellerinde zolpidem'in etkilerini test eden özgün in vitro ve in vivo çalışmalara acil ihtiyaç vardır.
Kaynaklar
1. Melcangi RC, et al. Steroid hormones and peripheral myelin. Journal of Steroid Biochemistry & Molecular Biology. 2005;96(3-4):425-31.
2. Magnaghi V, et al. GABA receptors and peripheral myelin development. Neurochemistry International. 2004;45(4):565-573.
3. Belachew S, et al. GABAergic signaling in neural progenitors. Journal of Neuroscience. 2001;21(9):3142-53.
4. Che Has A, et al. Stoichiometry and function of zolpidem-sensitive GABA(A) receptors. Scientific Reports. 2016;6:28674.
5. Sancar A, et al. Tonic GABA(A) signaling in neural repair. Frontiers in Neuroscience. 2023;17:1127542.
6. Beenhakker MP, Huguenard JR. GABA-mediated tonic inhibition in the brain. Nature Reviews Neuroscience. 2009;10(10):687-697.
7. Jessen KR, Mirsky R. The repair Schwann cell and its function. Glia. 2019;67(3):421-437.
8. Chen ZL, et al. Peripheral nerve regeneration mechanisms. Nature Reviews Neuroscience. 2007;8(9):623-634.
Sistemik Kronik İdiopatik Polinöropati (CIPN): Patofizyoloji ve Klinik Çıkarımlar Üzerine Bütüncül Bir Değerlendirme
Özet
Sistemik Kronik İdiopatik Polinöropati (CIPN), etiyolojisi tam olarak açıklanamamış, periferik sinir sistemini etkileyen kronik bir nöropati tipidir. Bu makale, CIPN'nin patofizyolojisine ilişkin bağışıklık disfonksiyonu, genetik yatkınlık, prion enfeksiyonları ve nörotoksin maruziyeti gibi mekanizmaları bütüncül bir bakış açısıyla incelemekte; klinik uygulamaya dönük çıkarımlar sunmaktadır.
Giriş
CIPN'nin multifaktöriyel doğası, hastalığın hem tanı hem de tedavi süreçlerinde kompleks, entegre yaklaşımların önemini açıkça ortaya koymaktadır. Genetik yatkınlık, bağışıklık sistemi disfonksiyonları, çevresel nörotoksinlere maruz kalma, metabolik bozukluklar ve nadiren prion enfeksiyonları gibi faktörlerin birbirleriyle etkileşim içinde olması, hastalığın klinik spektrumunu genişletmekte ve patogenezini önemli ölçüde karmaşıklaştırmaktadır. Genetik polimorfizmler, immün yanıtın regülasyonu, nörotoksik ajanların birikimi ve enfeksiyöz ajanların sinir dokusu ile etkileşimi gibi moleküler düzeydeki süreçler, periferik sinir sistemi üzerinde sinerjistik veya antagonistik etkiler yaratabilmektedir. Bu durum, klasik tanısal algoritmaların ve tedavi protokollerinin karmaşık vakalarda yetersiz kalabileceğini ortaya koyarak, bireyselleştirilmiş ve multidisipliner yönetim stratejilerinin önemini ön plana çıkarmaktadır. Bu derlemede, son 25 yılın güncel literatüründen elde edilen veriler doğrultusunda CIPN'nin altta yatan patofizyolojik süreçleri, moleküler düzeyde etkili olan biyolojik mekanizmaları ve klinik yansımaları bütüncül ve sistematik bir yaklaşımla analiz edilmekte; elde edilen bulgular doğrultusunda klinik uygulamaya uyarlanabilecek öneriler ve gelecekteki araştırmalar için yol haritaları sunulmaktadır.
Patofizyoloji: Bütüncül Perspektif
Kronik inflamatuar demiyelinizan polinöropati (CIDP) gibi immün aracılı süreçler CIPN patogenezinde önemli rol oynar. Otoantikor üretimi, T-hücresi aktivasyonu ve kompleman sistemi aracılığıyla periferik sinirlerde demiyelinizasyon ve aksonal hasar meydana gelir [1].
B4GALNT3, NR5A2 ve NINJ2 gibi genlerdeki polimorfizmler, CIPN gelişimine yatkınlığı artırır. Bu genetik yatkınlık, immün yanıtların regülasyonunda ve nörotoksinlere karşı savunmada rol oynayabilir [2].
Prion Enfeksiyonları
Prion hastalıklarının periferik sinir sistemine (PNS) etkisi uzun süre göz ardı edilmiştir; ancak son yıllarda yapılan klinik ve patolojik çalışmalar bu ilişkinin sanılandan daha yaygın ve klinik açıdan anlamlı olabileceğini göstermektedir. Özellikle sporadik Creutzfeldt-Jakob hastalığının (sCJD) VV2 ve MV2K alt tiplerinde, periferik sinir tutulumu yaygın olarak raporlanmıştır. Bu alt tiplerde, hastaların önemli bir bölümünde nöropatik semptomlar hastalığın başlangıç evresinde bile gözlenebilmektedir. Nörofizyolojik incelemelerle desteklenen bu bulgular, sural sinir biyopsilerinde PrP^Sc agregatlarının varlığı ile patolojik olarak doğrulanmıştır. Prion alt tipleri arasında periferik sinirlere gösterilen tropizm farklılıkları, bu hastalık grubunda alt tip-temelli patogenez kavramını güçlendirmektedir; özellikle VV2 ve MV2K alt tiplerinde periferik sinir tutulumunun belirginleştiği, buna karşın MM(V)1 alt tipinde bu durumun oldukça nadir olduğu bildirilmiştir. Ayrıca, PRNP geninde saptanan belirli mutasyonlar (örneğin E200K gibi) nöropati gelişimini hızlandırabilir ya da nöropatiyi hastalığın erken evresinde ilk klinik bulgu haline getirebilir. Schwann hücreleri ve dorsal kök gangliyonlarında gösterilen PrP^Sc birikimi, yalnızca merkezi sinir sisteminde değil, periferik sinir sisteminde de prion proteinlerinin patojenik birikiminin olabileceğini göstermektedir. Bu birikimlerin Schwann hücrelerinde yol açtığı yapısal ve fonksiyonel bozukluklar, hem aksonal hem de demiyelinizan nöropatilerin biyolojik altyapısını oluşturabilir. Ayrıca, prion-tipi alt tiplerin Schwann hücreleri ve dorsal kök gangliyonları ile etkileşimleri sonucunda başta inflamatuar yanıtlar olmak üzere bir dizi patolojik süreç aktive olabilir; bu da sinir iletiminde belirgin fonksiyonel kayıplara yol açabilir [3].
Moleküler Analizler
Moleküler düzeyde, PrP^Sc izoformlarının periferik sinirlerde saptanması için son yıllarda RT-QuIC, PMCA (Protein Misfolding Cyclic Amplification) gibi ultra-duyarlı biyokimyasal teknikler kullanılmaktadır. Bu yöntemler, periferik sinir dokularında yanlış katlanmış prion proteinlerinin saptanmasını mümkün kılarak prion kaynaklı nöropatilerin erken ve güvenilir tanısını desteklemektedir. PrP^Sc birikimi, periferik sinir Schwann hücrelerinde endoplazmik retikulum (ER) stres yanıtını tetikleyerek UPR (Unfolded Protein Response) yolaklarını aktive eder. Bu süreç, protein katlanma kapasitesinin aşılmasıyla ER'de biriken yanlış katlanmış proteinlere karşı adaptif bir stres yanıtı başlatır. Süreğen UPR aktivasyonu, hücre içi kalsiyum homeostazının bozulmasına ve kalsiyum bağımlı sinyal yolaklarının disfonksiyonuna neden olarak Schwann hücrelerinde apoptozis veya fonksiyonel kayıplara yol açar. Bununla birlikte, PrP^Sc’nin hücre dışı agregatlarının integrin, TLR (Toll-like receptor) ve nörogliyal yüzey reseptörleri ile etkileşimi, NF-kB ve MAPK gibi anahtar inflamasyon sinyal yollarını aktive ederek pro-inflamatuar sitokin salınımını artırır. Bu durum, periferik sinir çevresinde lokal inflamatuar mikroçevre oluşmasına katkıda bulunur. Schwann hücrelerinde gözlenen mitokondriyal disfonksiyon, artmış reaktif oksijen türleri (ROS) üretimi ve antioksidan savunmanın baskılanması ile oksidatif stresin şiddetlendiği gösterilmiştir. Oksidatif stres kaynaklı DNA hasarı, lipid peroksidasyonu ve protein modifikasyonları sinir hücrelerinin fonksiyonel bütünlüğünü daha da bozarak ilerleyici periferik sinir hasarına zemin hazırlar. Ayrıca, prion proteinlerinin glikolizasyon ve fosforilasyon gibi post-translasyonel modifikasyonlarının da sinir hücreleri üzerinde toksik etkiler geliştirdiği ileri sürülmektedir. Bu karmaşık moleküler etkileşim ağı, periferik nöropatinin biyolojik altyapısını oluşturarak hastalığın progresyonunu ve klinik seyrini şekillendirmektedir.
Kemoterapi ajanları, alkol, ağır metaller gibi nörotoksik ajanlar; oksidatif stres, mitokondriyal disfonksiyon ve aksoplazmik akım bozuklukları yoluyla sinir hasarına neden olabilir [4].
Genetik yatkınlık, bağışıklık disfonksiyonları, prion benzeri mekanizmalar ve nörotoksik etkiler arasındaki etkileşimler, CIPN'nin multifaktöriyel patofizyolojisini oluşturur. Bu mekanizmalar, birbirini tetikleyerek veya güçlendirerek klinik tabloyu şekillendirir.
Klinik Çıkarımlar
Genetik yatkınlık gösteren bireylerde periferik nöropati gelişme riski artabileceğinden, genetik tarama yöntemleri klinik pratiğe dahil edilebilir.
Bağışıklık disfonksiyonunun önemli rolü nedeniyle, immünolojik parametrelerin izlenmesi erken teşhis ve tedavi açısından önemlidir. CIDP benzeri vakalarda immün modülatör tedaviler değerlendirilebilir.
Prion ve Prion-like Mekanizmaların Ayırıcı Tanıda Değerlendirilmesi
Atipik seyirli, hızla ilerleyen veya standart tedavilere yanıt vermeyen periferik nöropati vakalarında prion hastalıklarının ayırıcı tanıda göz önünde bulundurulması kritik öneme sahiptir. Bu tür olgularda, standart nörolojik muayene ve elektrofizyolojik değerlendirmelere ek olarak ileri tanısal yöntemlerin devreye alınması gerekmektedir. Özellikle Real-Time Quaking-Induced Conversion (RT-QuIC) testi, periferik sinir biyopsilerinden veya serebrospinal sıvıdan alınan örneklerde prion proteininin (PrP^Sc) varlığını yüksek duyarlılık ve özgüllükle saptayabilen yenilikçi bir moleküler analiz yöntemidir. Bu test, klinik olarak belirsiz nöropati tablolarında prion varlığını non-invaziv şekilde doğrulama olanağı sağlamaktadır. Bununla birlikte, sinir biyopsilerinden yapılan PrP immünoboyama ve Western blot analizleri de prion protein agregatlarının histopatolojik doğrulanmasında altın standart kabul edilmektedir. Gelişmiş nörofizyolojik testlerle (EMG, NCS), periferik sinirlerde hem aksonal hem de demiyelinizan hasar düzeyleri değerlendirilebilir; sinyal iletim blokları veya iletim hızlarındaki anormallikler periferik tutulumun objektif olarak belgelenmesine yardımcı olur. Özellikle hızlı progresyon gösteren veya klinik seyri CIDP'den ayırt edilemeyen olgularda RT-QuIC, PrP biyopsi analizi ve detaylı nörofizyolojik incelemelerin birlikte kullanılması, doğru tanı konulması ve uygun klinik yönetim planının oluşturulması açısından önerilmektedir.
Toksik Maruziyetlerin Değerlendirilmesi: Nörotoksin maruziyeti hikayesi detaylandırılmalı; maruziyet durumunda detoksifikasyon ve nöroprotektif yaklaşımlar uygulanmalıdır.
Bütüncül Tedavi Planı Oluşturma: CIPN tedavisinde immün modülasyon, genetik danışmanlık, toksinlerden korunma, antiinflamatuar stratejiler ve semptomatik tedaviler içeren multidisipliner bir yaklaşım önerilmektedir.
Klinik Takipte Fonksiyonel Testlerin Kullanımı: Nörofizyolojik testlerle sinir fonksiyonlarının izlenmesi, hastalık progresyonunun değerlendirilmesi açısından önemlidir.
Sonuç
CIPN, genetik predispozisyon, immünolojik disfonksiyon, çevresel nörotoksin maruziyeti, metabolik anomaliler ve nadiren görülen enfeksiyöz etkenler (prionlar dahil) gibi birbirinden bağımsız fakat etkileşimli çoklu patolojik süreçlerin birleşimiyle ortaya çıkan kompleks bir hastalıktır. Bu multifaktöriyel yapının tam anlamıyla kavranması, hastalığın heterojen klinik yansımalarını açıklayabilmek ve etkili hasta yönetimi sağlamak açısından kritik öneme sahiptir. Klinik yaklaşımda yalnızca tek bir etiyolojik faktöre odaklanmak yerine, genetik tarama, otoimmün belirteçlerin değerlendirilmesi, çevresel toksik maruziyetlerin ayrıntılı sorgulanması ve enfeksiyöz etkenlerin dışlanmasını kapsayan entegre tanısal stratejiler benimsenmelidir. Tedavi planlamasında ise hastalığın patofizyolojik baskın mekanizmasına göre bireyselleştirilmiş protokoller geliştirilmesi önerilmektedir. Örneğin immün kaynaklı olgularda immünomodülatör tedaviler ön planda düşünülürken, nörotoksik maruziyet saptanan bireylerde nöroprotektif ajanlar ve detoksifikasyon stratejileri uygulanmalıdır. Böylelikle hasta yönetimi daha bütüncül, hedefe yönelik ve klinik sonlanımları iyileştirmeye odaklı hale getirilebilecektir.
Kaynaklar
[1] Dalakas, M. C. (2005). Immunity in chronic inflammatory demyelinating polyradiculoneuropathy. Journal of Neuroimmunology, 159(1-2), 126-132.
[2] Winsvold, B. S., et al. (2021). GWAS of idiopathic polyneuropathy identifies B4GALNT3 and NR5A2. Frontiers in Neurology, 12, 789093.
[3] Mead, S. (2017). Prion diseases update. Neurodegenerative Disease Management, 7(3), 213-222.
[4] Singh, J. (2025). Diabetic neuropathy pathogenesis. Nature Communications, 16, 5421.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...