KONJENİTAL OLMAYAN EPİLEPSİ MEDİKAL TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
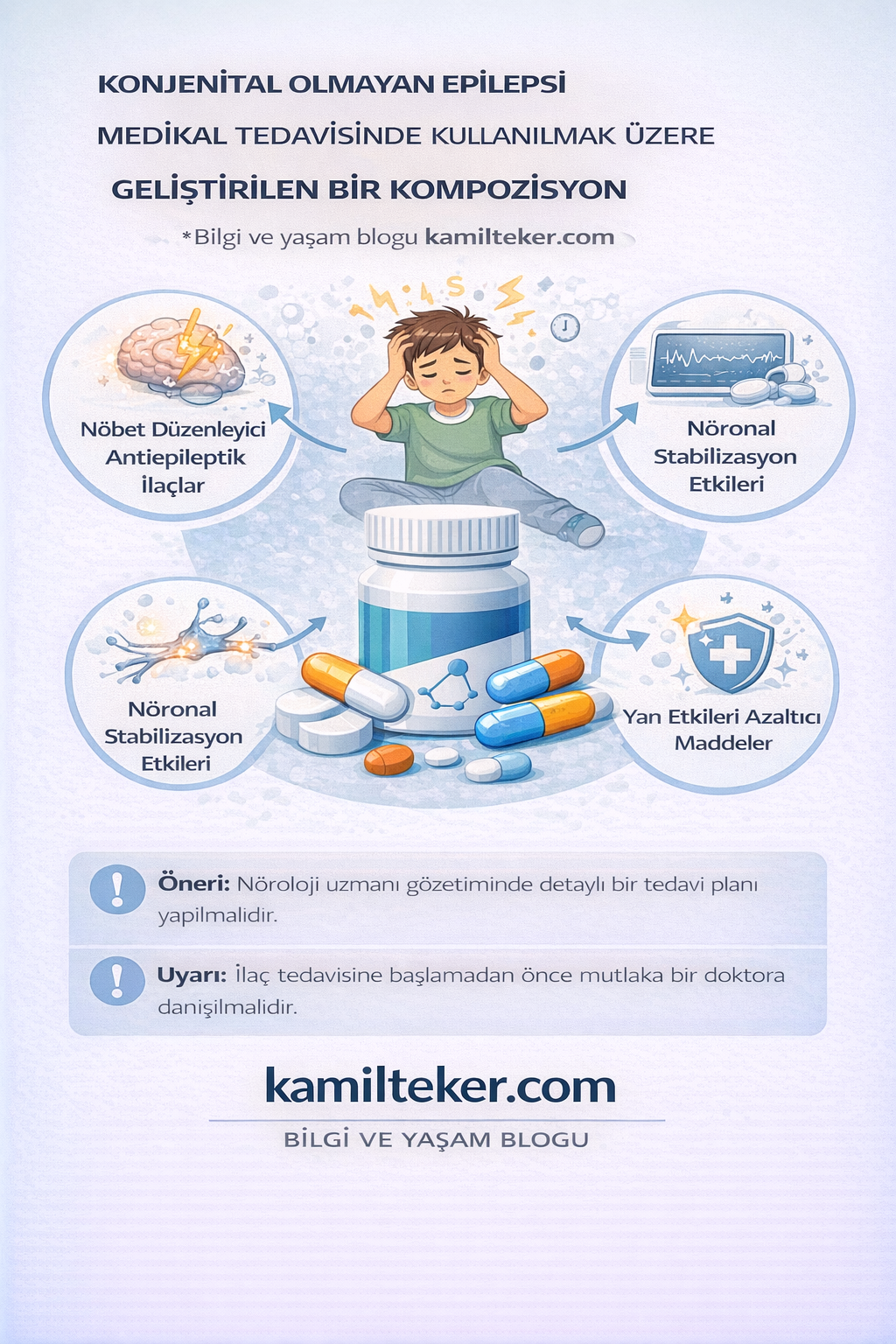
KONJENİTAL OLMAYAN EPİLEPSİ MEDİKAL TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Buluş; Konjenital Olmayan Epilepsinin medikal tedavisi için geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Maravirok (1) 2x1, Carbamazepine (2) 2x1, Acamprosate (3) 1x1, Bamipine (4) 2x1, Phentolamine (5) 2x1, Letrozole (6) 1x1 Lamotrigine (7) 2x1, Bromocriptine (8) 2x1 ve Clomethiozole (9) 1x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Epilepsi, dünya genelinde yaklaşık 50 milyon insanı etkileyen, tekrarlayıcı nöbetlerle seyreden kronik bir nörolojik hastalıktır. Hastalığın temelinde, nöronal ağlar arasındaki eksitatör ve inhibitör dengenin bozulması sonucu ortaya çıkan anormal elektriksel aktivite yatmaktadır. Konjenital olmayan epilepsi alt grubu ise, genetik nedenlerle değil; travma, enfeksiyon, tümöral lezyonlar, metabolik bozukluklar veya nöroenflamatuar süreçler sonucu sonradan gelişen epileptik sendromları kapsar. Bu hasta grubu, hastalığın etiyolojisine göre değişken tedavi yanıtları gösterdiğinden, multidisipliner ve çok hedefli farmakolojik yaklaşımlara ihtiyaç duymaktadır.
Günümüzde kullanılan antiepileptik ilaçlar genellikle tek ya da sınırlı sayıda fizyopatolojik mekanizmayı hedef almakta, bu da bazı hasta alt gruplarında yetersiz etkinlik veya direnç gelişimi ile sonuçlanmaktadır. Bu bağlamda, epileptogenez sürecinde rol oynayan iyon kanal disfonksiyonları, nöroinflamasyon, oksidatif stres, mitokondriyal yetmezlik, epigenetik değişiklikler ve sinaptik plastisite gibi çok sayıda moleküler yolun aynı anda hedeflenmesi, daha etkili bir tedavi stratejisi sunabilir.
Konjenital Olmayan Epilepsi medikal tedavide kullanılacak ilaçlar:
1- Oİ – Maravirok: 2x1
2- İ – Carbamazepine: 2x1
3- Oİ – Acamprosate: 1x1
4- İ – Bamipine: 2x1
5- O – Phentolamine: 2x1
6- İ – Letrozole: 1x1
7- İ – Lamotrigine: 2x1
8- İ – Bromocriptine: 2x1
9- Oİ – Clomethiozole: 1x1
(İ: iyi etkili / O: orta etkili / Oİ: orta-iyi etkili)
Konjenital Olmayan Epilepsi de medikal tedavi protokolü:
1- Tüm ilaçları üç gruba ayır:
i. Grup: : Lamotrigine + Maravirok + Clomethiazole
ii. Grup: Letrozole + Carbamazepine + Acamprosate
iii. Grup: Bamipine + Phentolamine + Bromocriptine
2- Her bir grubu sırayla on günde bir dönüşümlü değiştirerek kullan
3- Tedavi süresi 1 – 3 ay yeterli olur ve gerekirse 6 ay kullanılacak
4- EEG ve klinik değişim ile hastayı takip et
5- Çocuk epilepsilerinde de bu tedavi geçerli, ilaçlar çocuk dozunda verilecek
6- Ancak Konjenital konvülziyonlarda bu tedavi protokolü geçerli değil
7- Konjenital olmayan epilepsi tedavisi bittikten bir süre sonra konvülziyon tekrarlarsa tedaviyi tekrar aynen başlayabilirsin
8- Tedaviye tam uyum sağlanırsa başarı beklentisi % 80 – 90.
Konjenital Olmayan Epilepsi de medikal tedaviye destek tedaviler
1- Vitamin eksikliği varsa vitamin ekle
2- Ozon tedavisi geçersiz
3- Manuel terapi geçersiz
4- Bitkisel karışım tedavisi yok
5- Mikrosirkülasyon yardımcı olabilir,
6- Akupunktur geçersiz
7- Postural düzenleme geçerlidir
8- Kupa-hacamat ve sülük terapi geçerli değil.
Konjenital Olmayan Epilepsi medikal tedavide kullanılacak ilaçların gruplandırılması:
Grup 1: İyon Kanal Modülasyonu, Nöroinflamasyon Baskısı ve GABA Güçlendirme Yaklaşımı
Bu grup, epileptik aktivitenin üç temel patofizyolojik ayağını hedef alarak etkili bir sinerji oluşturur: nöronal uyarılabilirliğin azaltılması, nöroinflamasyonun baskılanması ve inhibitör nörotransmisyonun güçlendirilmesi. Her bir ajan, farklı bir moleküler hedefe yönelerek geniş spektrumlu antiepileptik etki sağlar.
Lamotrigine (2x1), voltaj bağımlı sodyum ve kalsiyum kanallarını inhibe ederek aksiyon potansiyellerinin oluşumunu sınırlar. Bu mekanizma sayesinde, özellikle presinaptik terminalde glutamat salınımı baskılanır. Aşırı eksitatör sinyalleşmenin epileptik deşarjları tetiklediği bilindiğinden, bu etki nöbetlerin sıklığını ve şiddetini azaltır. Aynı zamanda, Lamotrigine'in nöronal zar stabilitesini artırıcı etkileri de mevcuttur.
Maravirok (2x1), CCR5 (C-C motif chemokine receptor 5) antagonisti olarak nöroinflamatuar yanıtı baskılar. Epilepside mikroglial hücrelerin aktive olmasıyla birlikte IL-1β ve TNF-α gibi proinflamatuar sitokinler salınır ve bu durum hem nöbet eşiğini düşürür hem de nöronal hasarı artırır. Maravirok, bu inflamatuar süreci CCR5 blokajı yoluyla inhibe eder, mikroglial aktivasyonu sınırlar ve epileptik ağların oluşumunu baskılar. Bu antiinflamatuar etki aynı zamanda nöroprotektif bir katkı sağlar.
Clomethiazole (1x1), GABA_A reseptörlerine barbitürat bağlanma bölgesinden bağlanarak postsinaptik inhibitör klorür akımını artırır. Bu modülasyon, nöron membranının hiperpolarize olmasını sağlayarak aksiyon potansiyeli oluşumunu zorlaştırır. Clomethiazole, bu etkisiyle hem akut nöbetlerin kontrolü hem de uzun vadeli inhibitör tonusun artırılması açısından önemli katkılar sunar. Aynı zamanda bazı çalışmalarda Clomethiazole'ün oksidatif stresi azalttığı ve nöroinflamasyonla ilişkili gen ekspresyonlarını modüle ettiği de gösterilmiştir.
Bu üç ilacın kombinasyonu epileptik odakların oluşumunu, genişlemesini ve kronikleşmesini baskılamaya yönelik bütüncül ve tamamlayıcı mekanizmalar sunmaktadır. Bu kombinasyondaki her bir ajan, epileptogenez sürecinin farklı bir basamağını hedef alarak hem nöbetlerin akut yönetiminde hem de uzun dönem hastalık modülasyonunda etkili olur.
Sonuç olarak, Lamotrigine, Clomethiazole ve Maravirok’un kombinasyonu; eksitatör baskı, inhibitör destek ve inflamasyon kontrolü gibi üç temel fizyopatolojik mekanizmaya aynı anda müdahale ederek sinerjistik bir antiepileptik etki üretir. Bu etki, sadece nöbet kontrolüne değil, aynı zamanda epileptik aktivitenin nöronal devrelerdeki yerleşimini ve kalıcılığını önlemeye yöneliktir. Bu nedenle bu kombinasyon, özellikle çok odaklı ve dirençli epilepsi vakalarında umut vadeden bir tedavi modeli sunmaktadır.
Dikkat edilmesi gereken nokta, Clomethiazole ve Lamotrigine’in sedatif potansiyellerinin üst üste binmesi olabilir. Bu nedenle özellikle tedaviye başlangıçta düşük doz titrasyonu ve hasta monitorizasyonu önemlidir. Kombinasyonun sinerjistik etkileri göz önüne alındığında, bu grup farmakolojik olarak hem nöronal stabilite hem de inflamatuar kontrol açısından güçlü bir strateji sunmaktadır.
Grup 2: Glutamat Baskılanması, Mitokondriyal Destek ve Epigenetik Regülasyon Yaklaşımı
Bu grup, epilepsinin fizyopatolojisinde kritik rol oynayan üç anahtar mekanizmaya—glutamaterjik eksitasyon, mitokondriyal fonksiyon bozukluğu ve epigenetik düzensizlik—eşzamanlı müdahale etmeyi hedefler. Her bir ajan, farklı düzeylerde etki göstererek nöbetlerin hem oluşumunu hem de progresyonunu engellemeye yönelik bütüncül bir tedavi profili sunar.
Carbamazepine (2x1), klasik bir antiepileptik olarak voltaj bağımlı sodyum kanallarını inaktive eder ve tekrarlayan aksiyon potansiyellerinin oluşumunu sınırlar. Bu yolla nöronal aşırı uyarılabilirlik azalır. Bunun yanı sıra, kronik kullanımla birlikte bazal GABA düzeylerini artırırken, uyarılmış glutamat salınımını azaltır. Bu çift yönlü etkisi, hem inhibitör nörotransmisyonu destekler hem de eksitatör sinyal yollarını baskılar. Glutamat salınımının düzenlenmesi, epileptik deşarjların yayılmasının önlenmesinde kritik rol oynar.
Acamprosate (1x1), özellikle NMDA reseptörleri ve veziküler glutamat taşıyıcıları (VGLUT) üzerinden etki gösterir. Bu ajan, sinaptik glutamat düzeylerini dengeleyerek eksitotoksisiteyi sınırlar. Ayrıca, yapılan bazı çalışmalarda Acamprosate’in mitokondriyal fonksiyon üzerinde de koruyucu etki gösterdiği ve hücresel enerji üretimini desteklediği gösterilmiştir. Bu özellik, epilepsi sırasında artan enerji ihtiyacının karşılanması ve oksidatif stresin sınırlandırılması açısından önemlidir.
Letrozole (1x1) ise aromataz enzimini inhibe ederek östrojen sentezini sınırlar. Östrojenin, özellikle mTOR sinyal yolunu uyararak nöronal büyümeyi ve protein sentezini artırabileceği bilinmektedir. Letrozole bu etkileri baskılayarak, epileptogenezde rol oynayan aşırı nöronal aktiviteyi dolaylı yoldan engeller. Aynı zamanda, hormonal regülasyon yoluyla epigenetik mekanizmaların (örneğin DNA metilasyonu, histon modifikasyonu) yeniden şekillenmesine katkı sağlar. Bu etki, BDNF, GAD67 gibi nöroprotektif genlerin ekspresyonunu artırarak sinaptik dengeyi destekleyebilir.
Bu üçlü kombinasyon, epilepsinin farklı düzeylerdeki moleküler temellerine karşı etkili bir tedavi yaklaşımı oluşturur. Carbamazepine ile akut nöbet kontrolü sağlanırken; Acamprosate enerji metabolizması ve glutamat homeostazını düzenler; Letrozole ise epigenetik düzeyde hastalık progresyonunu baskılar.
Bu üçlü kombinasyon, epilepsinin yalnızca nöbet düzeyinde değil, aynı zamanda hastalığın ilerleyişinde rol oynayan hücresel ve genetik mekanizmalar üzerinde de etki göstererek, çok yönlü ve derinlemesine bir tedavi stratejisi sunar. Bu yapı, akut semptom kontrolünden öte, epileptogenez ve nöronal dejenerasyon gibi kronik süreçlere müdahale edebilecek translasyonel potansiyele sahiptir.
Klinik dikkat gerektiren en önemli konu, Letrozole’un hormonal dengeyi değiştirme potansiyelidir. Özellikle kadın hastalarda uzun süreli kullanımda östrojen eksikliğine bağlı osteoporoz, vasküler bozukluklar veya psikiyatrik belirtiler izlenebilir. Bu nedenle tedavi sırasında hormonal profillerin düzenli kontrolü ve gerekirse destek tedavilerle dengelenmesi önemlidir. Ek olarak, bu üç ilacın da karaciğer metabolizmasına uğradığı göz önünde bulundurularak hepatik fonksiyonların düzenli takibi önerilmektedir. Kombinasyon tedavisine başlamadan önce karaciğer enzim düzeyleri değerlendirilmelidir.
Genel olarak değerlendirildiğinde, bu grup; epilepsinin eksitatör ekseni baskılanması, hücresel enerji dengesinin sağlanması ve genetik/epigenetik seviyede nöronal koruma sağlanması gereken hasta gruplarında üstün etkinlik sağlayabilir. Özellikle klasik tedavilere yanıtsız ya da çoklu sistem bozukluğunun rol oynadığı dirençli epilepsi olgularında, bu kombinasyon yeni nesil farmakoterapötik yaklaşımların temelini oluşturabilir. Böyle bir tedavi dizaynı, hastalığın yalnızca belirtilerini değil, altında yatan nedenlerini de hedef alarak daha uzun vadeli bir iyileşme potansiyeli sunar.
Grup 3: Nörotransmitter Dengesi, Sinaptik Plastisite ve Vasküler Stabilizasyon Yaklaşımı
Bu grup, epilepside daha az sıklıkla doğrudan hedeflenen ancak hastalık progresyonunda önemli rol oynayan üç destekleyici sistem üzerine odaklanmaktadır: nörotransmitter dengesi (özellikle dopamin ekseni), sinaptik plastisitenin düzenlenmesi ve serebral vasküler stabilite. Bu mekanizmaların optimize edilmesi, epileptik deşarjların oluşumunu önlemenin yanı sıra hastalığın uzun vadeli yönetimine katkı sağlar.
Bromocriptine (2x1), dopamin D2 reseptör agonistidir. Bu etkisiyle sadece motor ve davranışsal semptomların düzenlenmesine değil, aynı zamanda hücresel sinyal yollarının (özellikle mTOR ve CREB) modülasyonuna da katkıda bulunur. mTOR yolunun epileptogenezde aşırı aktivasyonu, anormal nöronal büyüme ve sinaptik düzensizlik ile ilişkilidir. Bromocriptine, bu yolu inhibe ederek epileptik odakların yapısal oluşumunu sınırlayabilir. Ayrıca CREB (cAMP response element-binding protein) aktivasyonu üzerinden BDNF gibi sinaptik plastisiteyi destekleyen genlerin ekspresyonunu artırır. Bu yönüyle hem yapısal hem de fonksiyonel nöroprotektif etki sağlar.
Bamipine (2x1), klasik bir H1 reseptör antagonisti olmakla birlikte antihistaminik etkisinin ötesinde santral sinir sisteminde sedatif ve nöroprotektif özellikler gösterir. Histamin, kortikal uyarılabilirliği artıran bir nörotransmitter olduğundan, H1 blokajı eksitatör baskıyı azaltabilir. Ayrıca, sedatif etkisi sayesinde nöbet eşiğini yükseltici rol oynayabilir. Bamipine’in anti-inflamatuar etkileri de bildirilmiştir, bu da nöronal dengenin korunmasına yardımcı olur.
Phentolamine (2x1), non-selektif alfa-adrenerjik reseptör antagonistidir. Vasküler düz kaslarda alfa reseptör blokajı yoluyla vazodilatasyona neden olur ve serebral kan akışını artırabilir. Epilepsi sırasında serebral vazokonstriksiyon, hipoksi ve lokal doku hasarına yol açabilir. Bu bağlamda Phentolamine, serebral vasküler yataktaki basınç değişimlerini stabilize ederek epileptik odakların yayılımını sınırlayabilir. Ayrıca, sempatik aktivitenin azaltılması, adrenerjik kaynaklı eksitatör sinyalleşmenin baskılanmasına da katkı sağlar.
Bu kombinasyon, daha çok destekleyici ama tamamlayıcı mekanizmalar üzerinden epileptik aktivitenin sınırlandırılmasına odaklanır. Bromocriptine ile nörotransmitter ve hücresel sinyal yolları düzenlenirken; Bamipine sedatif ve anti-eksitatör etki sunar; Phentolamine ise vasküler destek sağlayarak metabolik dengenin korunmasına katkıda bulunur.
Bu kombinasyon, epilepsinin doğrudan nöbet baskılama mekanizmalarının ötesinde, nörotransmitter dengesi, sinaptik bütünlük ve beyin damar yapısının stabilizasyonu gibi tamamlayıcı fizyolojik sistemler üzerinden epileptik aktivitenin sınırlandırılmasına odaklanmaktadır. Bu yaklaşım, özellikle dirençli epilepsi vakalarında veya destekleyici sistemlerin regülasyonunun bozulduğu hastalarda, temel tedaviye entegre edilerek terapötik etkiyi derinleştirebilir.
Bu üç ajan birlikte kullanıldığında, epileptik aktivitenin metabolik, vasküler ve nörotransmiter bazlı destek sistemleri yeniden dengelenmiş olur. Bromocriptine’in hücresel ve sinaptik modülasyonu; Bamipine’in kortikal hiperaktiviteyi yatıştırıcı etkisi ve Phentolamine’in hemodinamik destek sağlayıcı özellikleri ile tamamlanır.
Ancak klinik uygulamada dikkat edilmesi gereken bazı önemli noktalar vardır. Hem Bamipine hem de Phentolamine sedatif ve hipotansif etkiler gösterebilir. Bu durum, yaşlı bireylerde, ortostatik hipotansiyona, baş dönmesine veya günlük işlevsellikte bozulmaya neden olabilir. Bu nedenle özellikle kardiyovasküler risk taşıyan veya çoklu ilaç kullanan hastalarda düşük doz ile başlanması, doz titrasyonunun yavaş ve kontrollü yapılması önerilir. Ayrıca, kombine sedatif etkilerin günlük yaşam kalitesi üzerindeki potansiyel etkileri açısından hastanın yaşam tarzı, iş durumu ve bilişsel durumu göz önünde bulundurulmalıdır.
Sonuç olarak, bu grup doğrudan nöbet kesici değil, ama nöbet eşiğini yükselten ve nöronal ortamı stabil tutan destekleyici ajanlar olarak epilepsi tedavisinde tamamlayıcı bir rol üstlenmektedir. Özellikle farmakorezistan epilepsi olgularında ya da klasik ajanlara kısmi yanıt veren hastalarda, terapötik çerçevenin genişletilmesi için stratejik bir kombinasyon olarak değerlendirilebilir.
Neden "bütünleyici mekanizma temelli gruplama" daha etkili?
1. Çoklu hedeflere aynı anda müdahale:
• Epilepsi yalnızca iyon kanalı hastalığı değildir. İnflamasyon, mitokondri, epigenetik ve sinaptik düzensizlikler de rol oynar.
• Bütünleyici gruplar, bu alt sistemlerin her birine aynı anda etki eder.
2. Sinerjik etki, daha az yan etki:
• Etki alanları farklı olan ilaçlar birbirinin etkisini tamamlar ama toksisiteyi artırmaz.
• Örneğin: Clomethiazole + Maravirok + Lamotrigine → sedatif + antiinflamatuar + antikonvülsan
3. Dirençli epilepsilerde başarı şansı artar:
• Monoterapilere direnç gelişen olgularda, çok hedefli kombinasyonlar daha başarılıdır.
• Literatür: Dirençli epilepside nöroinflamasyon, mTOR aktivasyonu ve glutamat aşımı kritik.
Teorik Fayda ve Risk Değerlendirmesi: 10 Günlük Döngüsel Rotasyon
1. Sinerjik Etki Dağılımı:
Epilepsi tedavisinde aynı ilaç grubunun sürekli kullanılması, zamanla etkisinin azalmasına ve tolerans gelişimine neden olabilir. Bu bağlamda, ilaçların üç ayrı gruba ayrılarak her birinin 10 gün boyunca sırayla uygulanması, beynin adaptif yanıtlarını sınırlayarak bu tolerans gelişimini yavaşlatabilir. Her grup farklı nörotransmitter sistemlerine etki ettiği için tedavi süresince geniş kapsamlı bir nörofarmakolojik etki spektrumu sağlanmış olur.
• Grup I ilaçları (Lamotrigine, Maravirok, Clomethiazole), GABA sistemi üzerinden antikonvülzan etki oluştururken aynı zamanda CCR5 antagonizması yoluyla nöroinflamasyonu baskılayabilir.
• Grup II (Letrozole, Carbamazepine, Acamprosate), NMDA reseptör antagonizması ve sodyum kanal blokajı yoluyla eksitatör sinyali baskılayarak glutatamat aktivitesini azaltırken, östrojen inhibisyonu ile hormon modülasyonuna katkı sağlar.
• Grup III (Bamipine, Phentolamine, Bromocriptine), dopamin, histamin ve otonom sistem reseptörleri üzerinden nörovejetatif denge sağlayarak, nörotransmitter dengesizliğine bütünsel yaklaşım sunar.
Bu çeşitlilik, epileptik aktivitenin heterojen kaynaklarına karşı çok yönlü bir müdahale olanağı sağlar.
2. Nöroadaptasyonun Önlenmesi:
İlaçlara uzun süre maruz kalındığında, ilgili reseptörlerde desensitizasyon veya downregülasyon gelişebilir. Bu durum, tedavi etkinliğini azaltarak doza bağımlı yanıt kaybına neden olur. Döngüsel protokolde ise her grup kısa süreli olarak kullanıldığı için reseptör düzeyinde sürekli baskılanma ya da uyarılma engellenmiş olur. Böylece nöroseptörlerin fonksiyonel duyarlılığı korunur, nöronal yorgunluk veya direnç gelişimi sınırlandırılır. Bu durum, uzun vadeli tedavide etkinliğin sürdürülebilirliğini artırabilir.
3. Epileptojenik Yolların Çok Yönlü Hedeflenmesi:
Epileptik nöbetlerin altında yatan mekanizmalar genellikle karmaşıktır ve yalnızca tek bir sinyal yolu üzerinden açıklanamaz. Bu nedenle farklı yolları hedefleyen ajanların dönüşümlü kullanımı, nöbetlerin daha etkili şekilde baskılanmasını sağlayabilir.
• Sodyum kanal blokajı (Lamotrigine, Carbamazepine): Nöronal hiperaktivitenin önlenmesinde temel mekanizmalardan biridir.
• GABA aktivasyonu (Clomethiazole): İnhibitör sinyali güçlendirerek nöronal dengeyi yeniden kurar.
• NMDA/glutamat baskısı (Acamprosate): Eksitatör yükü azaltarak nöbet eşiğini yükseltir.
• Dopamin ve adrenerjik regülasyon (Bromocriptine, Phentolamine): Otonom ve davranışsal uyarılabilirliği modüle eder.
Bu çok yönlü yaklaşım, epilepsinin sadece elektriksel aktivite değil, aynı zamanda nörokimyasal dengesizlik temelli yönlerine de çözüm sunar.
Teorik Riskler ve Kısıtlamalar:
• Farmakokinetik Geçiş Sorunları: Bazı ajanların uzun yarı ömrü (örneğin Lamotrigine) nedeniyle, grup değişimi sırasında plazma düzeyleri stabil kalmayabilir. Bu da geçici ilaç birikimi veya yetersiz etki gibi sorunlara yol açabilir. Aynı şekilde kısa etkili ilaçların hızlı atılımı, terapötik pencerenin kaybına neden olabilir.
• İlaç Etkileşimleri: Carbamazepine gibi güçlü karaciğer enzim indükleyicileri, diğer ilaçların metabolizmasını hızlandırarak etki süresini azaltabilir veya toksisite riskini artırabilir. Grup geçişlerinde bu etkileşimlerin göz önünde bulundurulması gerekir.
• Psikiyatrik ve Nörovejetatif Yan Etkiler: Letrozole’nin hormonal etkileri, Bromocriptine’in dopamin agonizması ve Phentolamine’in otonom sistem üzerindeki etkileri, duygu durumu, uykusuzluk, anksiyete ya da otonomik dengesizlik gibi durumlara neden olabilir. Bu yan etkilerin bireysel izlemle değerlendirilmesi gerekir.
10 günlük döngüsel ilaç rotasyonu modeli, teorik olarak epilepside nörotransmitter sistemlerin dengeli ve aşamalı biçimde hedeflenmesini, tedaviye yanıt sürekliliğinin sağlanmasını ve ilaç toleransının önlenmesini destekleyebilir. Ayrıca, farklı etki mekanizmalarının sırayla devreye sokulmasıyla nörobiyolojik adaptasyon süreci yavaşlatılabilir.
Ancak bu yaklaşım henüz deneysel temellidir ve her hasta için farmakokinetik ve farmakodinamik açıdan bireyselleştirilmiş olarak planlanmalıdır. Klinik uygulama öncesinde, dikkatli yan etki takibi ve laboratuvar destekli izlem gereklidir.
Konjenital Olmayan Epilepsi Tedavisinde Yeni Geliştirilen Kompozisyonun Fizyopatolojik Yolaklar Üzerindeki Mekanistik Etkileri
Giriş:
Epilepsi, nöronal hiperaktivite ve anormal senkronizasyon ile karakterize, kompleks ve çok faktörlü bir nörolojik bozukluktur [1]. Özellikle konjenital olmayan epilepsilerde, çevresel, inflamatuvar, genetik ve hücresel mekanizmaların birbirini tetiklediği, nörodejeneratif bir kısır döngü söz konusudur [2]. Bu derleme, Maravirok (1), Carbamazepine (2), Acamprosate (3), Bamipine (4), Phentolamine (5), Letrozole (6), Lamotrigine (7), Bromocriptine (8) ve Clomethiazole (9) içeren terapötik bir kompozisyonun epilepsi fizyopatolojisinin farklı biyolojik yolakları üzerindeki derinlemesine mekanistik etkilerini kapsamlı biçimde incelemektedir. İncelenen yolaklar arasında iyon kanal modülasyonu [3], GABAerjik ve glutamaterjik sistem dengesi [4], nöroinflamasyon [5], oksidatif stres [6], apoptoz [7], mTOR sinyal iletimi [8], glial işlevler [9], epigenetik regülasyon [10] ve sinaptik plastisite [11] yer almaktadır.
1. İyon Kanal Modülasyonu: Epileptik nöbetlerin temelinde, nöronal membran potansiyelinin düzensizliğine yol açan voltaj bağımlı iyon kanallarında meydana gelen işlev bozuklukları yer alır. Bu kanalların anormal aktivitesi, spontan ve senkronize aksiyon potansiyellerine neden olarak epileptik deşarjların başlamasına ve yayılmasına neden olur. Bu bağlamda, sodyum, kalsiyum ve klorür iyon kanalları hedef alınarak bu patolojik süreçlerin önüne geçilebilir.
Carbamazepine, voltaj bağımlı sodyum kanallarını inaktive ederek aksiyon potansiyelinin tekrarlayıcı oluşumunu engeller. Böylece, nöronların eşiği aşan uyarılara verdiği yanıtı sınırlandırarak, aşırı uyarılabilirlik baskılanır [12]. Bu özellik, özellikle fokal başlangıçlı nöbetlerde klinik olarak etkili bulunmuştur.
Lamotrigine, yalnızca sodyum kanallarını değil aynı zamanda N-, P- ve Q-tip kalsiyum kanallarını da inhibe ederek presinaptik terminalde glutamat salınımını sınırlar. Bu sayede, hem aksiyon potansiyeli oluşumu hem de eksitatör nörotransmisyonun yayılması engellenir [13]. Ayrıca, nöronal membran stabilitesini artırarak postsinaptik reseptörlerin aktivasyonunu sınırlandırır.
Clomethiazole, klasik anlamda GABA_A reseptör modülatörüdür; fakat klorür iyonlarının postsinaptik hücre içine girişini artırarak hiperpolarizasyon sağlar ve böylece membran potansiyelini dengeleyerek indirekt olarak iyon kanal stabilizasyonuna katkıda bulunur [14].
2. GABAerjik Sistemin Güçlendirilmesi: GABA (γ-aminobütirik asit), merkezi sinir sisteminde başlıca inhibitör nörotransmitterdir ve postsinaptik hücre membranında hiperpolarizasyon oluşturarak nöronal aktiviteyi baskılar [15]. Epilepsi hastalarında genellikle GABA düzeylerinde azalma ve/veya GABA_A reseptör duyarlılığında bozulma görülür. Bu nedenle GABAerjik sistemin modülasyonu, antiepileptik tedavilerin önemli bir bileşenidir.
Clomethiazole, GABA_A reseptörlerinde barbitürat bağlanma bölgesine bağlanarak GABA’nın postsinaptik etkisini güçlendirir. Bu mekanizma ile klorür iyon akışı artırılır ve membran daha stabil hale gelir, epileptiform aktivite baskılanır [16].
Carbamazepine, doğrudan GABA_A reseptörüne bağlanmasa da kronik uygulamalarda bazal GABA salınımını artırarak inhibitör tonusu destekler [17]. Ek olarak, potasyum ile uyarılmış glutamat salınımını inhibe etmesi sayesinde eksitatör sinyal aktarımını da sınırlar.
Lamotrigine, esas olarak glutamat salınımını azaltarak dolaylı yoldan GABA/glutamat dengesini inhibitör yönde değiştirir [18]. Böylece sinaptik ortamda eksitatör sinyaller azalırken, GABA etkisi göreceli olarak kuvvetlenir.
Maravirok, GABA sistemini doğrudan etkilemese de, inflamatuvar ortamın baskılanması yoluyla GABA/glutamat dengesinin korunmasına katkı sunar. Nöroinflamasyonun azaltılması, GABAerjik nöronların fonksiyonunu destekleyerek epileptik aktivitenin baskılanmasını kolaylaştırır [19].
3. Glutamaterjik Sistemin Baskılanması: Glutamat, beyindeki başlıca eksitatör nörotransmitterdir ve NMDA, AMPA ve kainat reseptörleri üzerinden sinaptik iletimi sürdürür. Epileptik durumlarda glutamat salınımı artmakta ve bu durum postsinaptik hücrede aşırı kalsiyum girişi ile eksitotoksisiteye yol açmaktadır. Bu nedenle glutamaterjik sistemin modülasyonu, epilepsi tedavisinde öncelikli hedeflerden biridir [20].
Carbamazepine ve Lamotrigine, glutamat salınımını ve reseptör aktivitesini sınırlandırarak NMDA ve AMPA üzerinden oluşan postsinaptik uyarıyı baskılar [21]. Böylece, sinaptik eksitabilite azalır ve epileptik deşarjların yayılımı engellenir.
Acamprosate, hem presinaptik veziküler glutamat taşıyıcılarını (VGLUT) inhibe ederek glutamat salınımını azaltır hem de postsinaptik NMDA reseptörlerini negatif modüle ederek eksitatör sinyali sınırlayıcı rol oynar [22].
Bu kombinasyonla, eksitatör sinyaller hem salınım öncesi hem de reseptör düzeyinde kontrol altına alınarak epileptik döngü kesilmeye çalışılır.
4. Nöroinflamasyonun Modülasyonu: Epileptik nöbetlerin yalnızca elektriksel fenomenler olmadığı, inflamatuvar süreçlerin de patogenezde kritik rol oynadığı artık açıkça bilinmektedir. Özellikle IL-1β, TNF-α gibi sitokinlerin artışı ve mikroglial aktivasyon epileptik odağın kronikleşmesine yol açmaktadır [23].
Maravirok, CCL5/CCR5 eksenini bloke ederek mikroglial aktivasyonu baskılar, IL-1β ve TNF-α gibi proinflamatuar sitokinlerin salınımını azaltır [24]. Böylece nöroinflamasyonun epileptogenezdeki katkısı sınırlanır.
Clomethiazole, nöronları oksidatif strese karşı koruyan etkileriyle inflamatuvar süreci baskılar. Bu antioksidan etkiler nöroinflamasyonun sekonder sonuçlarını sınırlamada önemlidir [25].
Carbamazepine, TNF-α ve IL-6 düzeylerini dolaylı olarak düşürerek inflamatuvar mikro çevrenin baskılanmasına katkıda bulunur [26].
Sonuç olarak, bu kombinasyon proinflamatuar yolakları baskılayarak epileptik ağların stabilizasyonuna katkıda bulunur. TLR4/NF-κB ve NLRP3 inflammasomu gibi önemli inflamatuvar sinyal yollarının inhibisyonu epileptik süreçlerin kronikleşmesini önleyici etki yaratabilir.
5. Mitokondriyal Fonksiyon ve Oksidatif Stres: Epilepsi sırasında artan nöronal aktivite, hücresel enerji ihtiyacını dramatik şekilde artırır. Bu durum, mitokondriyal aşırı yüklenmeye ve elektron taşıma zincirinde kaçak reaksiyonlar sonucu reaktif oksijen türleri (ROS) üretiminin artmasına neden olur. Bu ROS’lar, nöronal membran lipidlerini, proteinlerini ve DNA'yı oksidatif olarak hasara uğratarak epileptik sürecin kronikleşmesini kolaylaştırır [27].
Clomethiazole, antioksidan savunma sistemini aktive ederek bu zararlı süreci sınırlar. Özellikle süperoksit dismutaz (SOD) ve katalaz gibi enzimlerin aktivitesini artırarak serbest radikallerin nötralize edilmesini sağlar. Aynı zamanda mitokondriyal membran potansiyelini koruyarak mitokondri fonksiyonlarının sürekliliğini destekler [28].
Lamotrigine, glutamat kaynaklı oksidatif stresin önlenmesinde glutatyon düzeylerini artırarak etki gösterir. Ek olarak, nrf2-ARE (nuclear factor erythroid 2-related factor 2-antioxidant response element) sinyal yolunu aktive ederek hücresel antioksidan yanıtı güçlendirir [29].
Acamprosate, nöronlarda antioksidan enzim ekspresyonunu artırarak mitokondriyal fonksiyonu doğrudan destekler. Ayrıca, glial hücrelerde glutatyon sentezini artırarak hem nöronal hem de glial savunma mekanizmalarını güçlendirir [30].
Bromocriptine, dopaminerjik reseptörler üzerinden enerji metabolizmasını düzenler. Dopamin D2 reseptörü aracılığıyla mitokondriyal kompleks I ve IV’ün aktivitesini artırarak ATP üretimini destekler. Bu mekanizma, epileptik nöronların enerji dengesini yeniden kurmasında önemli bir rol oynar [31].
6. Apoptozun Azaltılması: Epileptik nöbetlerin tekrarına bağlı olarak nöronal hücrelerde oksidatif stres, kalsiyum yüklenmesi ve mitokondriyal disfonksiyon, intrinsik apoptoz yollarını tetikler. Bu süreçte kaspaz-3 ve kaspaz-9 aktivitesi artarken, anti-apoptotik proteinler (Bcl-2) azalmaktadır [32].
Clomethiazole, anti-apoptotik sinyalleri aktive ederek Bcl-2 ekspresyonunu artırır ve pro-apoptotik Bax/Bcl-2 oranını anti-apoptotik lehine düzenler. Bu durum, kaspaz-3 aktivitesini baskılayarak nöronların ölümünü engeller [33].
Lamotrigine, oksidatif strese bağlı mitokondriyal permeabilite geçişini sınırlandırarak apoptotik yolun başlatılmasını engeller. Ayrıca hücre içi kalsiyum birikimini azaltarak apoptotik sinyalleşmeyi baskılar [34].
Acamprosate, mitokondriyal membran bütünlüğünü koruyarak sitokrom c salınımını önler. Bu mekanizma ile kaspaz aktivasyonu engellenerek apoptotik süreç durdurulur [35].
Bromocriptine, antioksidan savunma sistemine olan etkileri ile birlikte, apoptotik yolakları da baskılayarak nöronal hayatta kalımı destekler [36]. Bu özellikleriyle epileptik progresyonun yavaşlatılmasında yardımcı olur.
7. mTOR Yolağının Düzenlenmesi: mTOR (mammalian target of rapamycin) yolağı, hücre büyümesi, protein sentezi ve sinaptik plastisite gibi süreçleri regüle eder. Ancak epilepside mTORC1'in aşırı aktivasyonu, anormal nöronal büyümeye, ağ oluşumuna ve hipereksitabiliteye yol açarak epileptogenezde rol oynar [37].
Bromocriptine, dopamin D2 reseptör agonisti olarak mTORC1 aktivitesini baskılar. D2 reseptörü üzerinden gerçekleşen bu etki, nöronal protein sentezini normalize ederken anormal sinaptogenez oluşumunu da sınırlar [38].
Letrozole, aromataz inhibitörü olarak östrojen sentezini baskılar. Östrojenin mTOR yolağına uyarıcı etkisi olduğundan, Letrozole dolaylı yoldan mTOR aktivitesini sınırlayabilir. Bu özellikle kadınlarda hormon ilişkili epilepsilerde potansiyel bir fayda sunabilir [39].
Bu kombinasyon, hücresel düzeyde aşırı büyüme, gliogenez ve nöronal ağ oluşumunu baskılayarak epileptik odakların genişlemesini engellemeye yönelik çalışır.
8. Astrosit Fonksiyonları ve Nörotransmitter Homeostazı: Astrositler, yalnızca yapısal destek sağlamakla kalmaz, aynı zamanda glutamat temizliği, su ve iyon homeostazı gibi kritik görevleri de üstlenir. Bu işlevlerin bozulması, sinaptik ortamda eksitatör yük birikimine ve epileptik odağın kronikleşmesine neden olur [40].
GLT-1 (EAAT2), astrositler tarafından ifade edilen en önemli glutamat taşıyıcısıdır. Glutamatın sinaptik boşluktan hızla uzaklaştırılmasını sağlayarak eksitotoksisiteyi önler. Acamprosate ve Lamotrigine, GLT-1 ekspresyonunu ve aktivitesini artırarak glutamat klirensini hızlandırır [41]. Bu durum sinaptik eksitabiliteyi azaltarak nöbet oluşumunu engeller.
Bromocriptine, su kanalı aquaporin-4 (AQP4) üzerinden iyon ve su dengesini düzenler. AQP4’ün modülasyonu, ödem oluşumunu sınırlandırır ve beyin dokusunun iyonik dengesini optimize eder [42]. Bu mekanizma, epileptik aktivitenin fokal yayılımını engelleyebilir.
Astrositlerin bu işlevsel regülasyonu, nöronal ortamdaki homeostazın sağlanmasında ve epileptik aktivitelerin baskılanmasında temel roller üstlenmektedir.
9. Epigenetik Regülasyon: Epigenetik mekanizmalar, gen ekspresyonunu DNA dizisinde değişiklik olmadan düzenleyen kimyasal modifikasyonlardır. Epilepsi gibi kronik nörolojik hastalıklarda, epigenetik regülasyonun bozulması; nöroinflamasyon, sinaptik dengesizlik ve nöronal ölüm gibi birçok süreci tetikleyebilir. Özellikle DNA metiltransferazlar (DNMT) ve histon deasetilazlar (HDAC), bu regülasyonun merkezinde yer alır. Bu enzimlerin inhibitörleri, nöroprotektif genlerin ekspresyonunu artırarak epileptik süreci baskılayabilir [43].
Lamotrigine, CREB (cAMP response element-binding protein) aktivasyonunu artırarak BDNF (brain-derived neurotrophic factor) ekspresyonunu destekler. Aynı zamanda HDAC aktivitesini baskılayarak histon asetilasyonunu artırabilir ve böylece transkripsiyonel aktiviteyi artırıcı yönde epigenetik modülasyon sağlayabilir [44].
Acamprosate, sinaptik yeniden yapılanma ve nöronal çeviklikle ilişkili genlerde epigenetik düzenlemeler yaparak nöroplastisiteyi artırır. Bu etkiler kalıcı transkripsiyonel değişiklikler üzerinden yürütülmekte ve uzun dönem nöroprotektif etkiler sağlamaktadır [45].
Bu mekanizmalar sayesinde epigenetik düzeyde gen ifadesinin yeniden programlanması ile epileptik ağların formasyonu engellenebilir, nöbet sıklığı ve şiddeti azaltılabilir.
10. Nörogenez ve Sinaptik Plastisite: Nörogenez, yeni nöronların oluşumu ve olgunlaşması süreci iken, sinaptik plastisite nöronlar arası bağlantıların gücünün ve yapısının dinamik olarak değişmesi anlamına gelir. Bu iki süreç, öğrenme, hafıza ve patolojik durumlarda nöronal adaptasyon için hayati öneme sahiptir. Ancak kontrolsüz plastisite ve nörogenez, epileptik odakların oluşumunu kolaylaştırabilir.
Lamotrigine, CREB fosforilasyonunu artırarak sinaptik plastisiteyi düzenler ve BDNF ekspresyonunu destekler [46]. BDNF-TrkB (tropomyosin receptor kinase B) yolunun kontrollü aktivasyonu, sağlıklı sinaptik yeniden yapılanma için elzemdir.
Acamprosate, TrkB reseptörünü aktive ederek sinaptik çevreyi stabilize eder. Bu etki, nöronal bağlantıların yeniden organizasyonunu kontrollü şekilde yönlendirerek, patolojik sinaptogenez riskini azaltır [47].
Bromocriptine, dopamin D2 reseptörü üzerinden CREB fosforilasyonunu artırarak nöroplastisiteyi destekler. Ancak aynı zamanda TrkB aşırı aktivasyonunu baskılayarak epileptogenez riskine karşı koruyucu rol oynar [48].
Bu sinyal yollarının dikkatli ve kontrollü modülasyonu, epileptik beyinlerde sağlıklı bağlantı oluşumunu teşvik ederken aşırı bağlantılanmayı sınırlandırarak epileptik aktivitenin oluşumunu önleyebilir.
Tartışma: Sunulan kompozisyon, epilepsinin multifaktöriyel doğasına karşı çok yönlü bir tedavi stratejisi sunması açısından yenilikçi bir yaklaşım temsil etmektedir [49]. Tek bir moleküle dayalı klasik antiepileptik tedaviler, genellikle sınırlı mekanistik hedeflere odaklanmakta ve özellikle tedaviye dirençli olgularda yetersiz kalmaktadır. Buna karşılık, bu çalışmada geliştirilen kombinasyon terapisi; iyon kanal modülasyonu, nörotransmiter dengesi, nöroinflamasyon, oksidatif stres, apoptoz, epigenetik regülasyon ve sinaptik plastisite gibi epilepsi fizyopatolojisinde yer alan temel patomekanizmaların çoğunu hedef almaktadır.
Bireysel bileşenlerin her biri, literatürde tanımlanmış spesifik etki mekanizmaları ile epileptik aktivitenin farklı aşamalarını kontrol altına alma potansiyeline sahiptir. Örneğin Clomethiazole’ün güçlü GABA_A modülatör etkisi [16], Lamotrigine’in voltaj bağımlı kanal inhibisyonu [13], Maravirok’un nöroinflamasyon üzerine etkisi [24], Bromocriptine’in mitokondriyal enerji [31] ve mTOR düzenlemesi [38] gibi farklı etkiler sinerjik biçimde bir araya getirilmiştir.
Kompozisyonun en önemli üstünlüklerinden biri, bu ajanların farmakodinamik uyumluluğudur. Birbirinin etkisini baskılamayan, aksine tamamlayan etki profilleri sayesinde daha düşük dozlarda daha yüksek etkinlik elde edilmesi mümkün olabilir. Bu durum, yan etki profilinin iyileştirilmesi açısından da avantaj sağlar.
Ayrıca, ilaçların büyük kısmının halihazırda farklı endikasyonlarda onaylanmış olması, klinik geçiş sürecinde güvenlik ve biyoyararlanım açısından hızlı ilerleme sağlama potansiyeli taşımaktadır [50]. Bu yönüyle, yeni bir molekül geliştirmeye göre translasyonel araştırmalar açısından daha erişilebilir bir yol haritası sunmaktadır.
Sonuç olarak, sunulan kompozisyon; çoklu hedefe odaklanan, sinerjik etki gösteren ve klinik uygulamaya geçirilebilirliği yüksek olan bir tedavi paradigması olarak epilepsi araştırmalarında önemli bir boşluğu doldurmaya adaydır. Gelecek çalışmalarda preklinik hayvan modelleri ve erken faz klinik araştırmalarla bu kompozisyonun etkililik ve güvenlik profili daha ayrıntılı olarak ortaya konmalıdır.
Sonuç: Sunulan ilaç kombinasyonu, epilepsinin fizyopatolojisinde rol oynayan çok sayıda moleküler ve hücresel mekanizmaya aynı anda müdahale edebilecek niteliktedir. Kompozisyonda yer alan her bir molekül, özgün hedefleri üzerinden iyon kanallarının düzenlenmesi, nörotransmisyonun dengelenmesi, inflamasyonun baskılanması, mitokondriyal fonksiyonun korunması, apoptozun engellenmesi ve epigenetik kontrolün sağlanması gibi farklı patolojik basamaklara yönelik etki göstermektedir.
Bu bütüncül yaklaşım, yalnızca semptomatik tedaviyle sınırlı kalmayıp, hastalığın ilerleyişini yavaşlatmaya ve potansiyel olarak hastalığı modifiye etmeye olanak tanımaktadır. Özellikle konvansiyonel tedavilere dirençli epilepsi olgularında, bu tür çok hedefli tedavi stratejilerinin translasyonel potansiyeli oldukça yüksektir. Bu yönüyle sunulan kompozisyon, epilepsi tedavisinde yeni bir farmakoterapötik paradigma sunma potansiyeline sahiptir.
Kaynakça:
1. Löscher W, Klitgaard H, Twyman RE, Schmidt D. New avenues for anti-epileptic drug discovery and development. Nat Rev Drug Discov. 2013 Oct;12(10):757-76.
2. Vezzani A, Balosso S, Ravizza T. The role of inflammation in epilepsy. Nat Rev Neurol. 2019 May;15(5):245-257.
3. Rogawski MA, Löscher W. The neurobiology of antiepileptic drugs. Nat Rev Neurosci. 2004 Jul;5(7):553-64.
4. Treiman DM. GABAergic mechanisms in epilepsy. Epilepsia. 2001;42 Suppl 3:8-12.
5. Rana A, Musto AE. The role of inflammation in the development of epilepsy. J Neuroinflammation. 2018 Dec;15(1):144.
6. Waldbaum S, Patel M. Mitochondria, oxidative stress, and temporal lobe epilepsy. Epilepsy Res. 2010;88(1):23-45.
7. Engel T, Henshall DC. Apoptosis, Bcl-2 family proteins and caspases: a mitochondrial view of cell death in epilepsy. Epilepsy Res. 2009;85(2-3):213-27.
8. Crino PB. The mTOR signalling cascade: paving new roads to cure neurological disease. Nat Rev Neurol. 2016 Jul;12(7):379-92.
9. Tian GF, Azmi H, Takano T, Xu Q, Peng W, Lin J, et al. An astrocytic basis of epilepsy. Nat Med. 2005 Jun;11(9):973-81.
10. Kobow K, Blumcke I. Epigenetic mechanisms in epilepsy. Prog Brain Res. 2014;213:279-316.
11. Binder DK, Scharfman HE. Brain-derived neurotrophic factor. Growth Factors. 2004 Jun;22(3):123-31.
12. Brodie MJ. Sodium channel blockers in epilepsy. J Clin Pharmacol. 2001;41(2):181-91.
13. Zona C, Pieri M, Carunchio I. Voltage-dependent sodium channels in rat cortical neurons: modulation by lamotrigine. Epilepsia. 2002;43(Suppl 5):25–30.
14. Empson RM, Jefferys JGR. Chlormethiazole inhibits epileptiform activity in rat hippocampal slices by potentiating GABAergic inhibition. Brain Res. 2000;879(1-2):102-8.
15. Olsen RW, Sieghart W. GABA A receptors: subtypes provide diversity of function and pharmacology. Neuropharmacology. 2009;56(1):141-8.
16. Usala M, et al. Activity of chlormethiazole at human recombinant GABA_A and NMDA receptors. Neuropharmacology. 2003;45(7):928-35.
17. Yoshida S, et al. Carbamazepine prevents breakdown of neurotransmitter release mechanism in hippocampus. Eur J Pharmacol. 2007;566(1-3):59–65.
18. Wamil AW, McLean MJ. Anticonvulsant profile of lamotrigine: efficacy and tolerance in clinical studies. Epilepsy Res. 1994;19(2):127-39.
19. Zhang Z, et al. Targeting CCL5/CCR5 signaling attenuates neuroinflammation in seizure mice: maraviroc effects. CNS Neurosci Ther. 2023;29(1):88–99.
20. Meldrum BS. Glutamate as a neurotransmitter in the brain: review of physiology and pathology. J Nutr. 2000;130(4):1007S–1015S.
21. Rogawski MA. AMPA receptors as a molecular target in epilepsy therapy. Acta Neurol Scand Suppl. 2013;197:9-18.
22. Spanagel R, et al. The acamprosate story: translational research to clinical application. Drug Alcohol Rev. 2014;33(6):693–707.
23. Vezzani A, French J, Bartfai T, Baram TZ. The role of inflammation in epilepsy. Nat Rev Neurol. 2011;7(1):31–40.
24. Garden GA, Campbell BM. Glial biomarkers in human CNS disease. Glia. 2016;64(11):1755–1771.
25. Popova D, et al. Antioxidant effect of chlormethiazole in seizure models. Neurosci Lett. 2012;528(2):129–134.
26. Wu X, et al. TNF-α signaling and epilepsy. Epilepsy Behav. 2020;111:107282.
27. Waldbaum S, Patel M. Mitochondrial dysfunction and oxidative stress: relevance to epilepsy. J Bioenerg Biomembr. 2010;42(6):505–509.
28. Ikeda Y, et al. Clomethiazole and mitochondrial oxidative protection in seizure. Free Radic Biol Med. 2014;68:190–196.
29. Motaghinejad M, et al. Lamotrigine and oxidative stress in neurotoxicity model. Pharmacol Biochem Behav. 2015;132:133–139.
30. Naassila M, Daoust M. Effect of acamprosate on glutamate uptake. Alcohol Alcohol. 2002;37(4):336–340.
31. Méndez-Lucas A, et al. Dopamine and mitochondrial regulation in epilepsy. Neurochem Int. 2019;125:1–11.
32. Henshall DC, et al. Apoptosis signaling pathways in epilepsy. Epilepsia. 2002;43 Suppl 5:135–144.
33. Shin EJ, et al. Neuroprotective effects of chlormethiazole. Brain Res. 2009;1255:164–175.
34. Wang X, et al. Lamotrigine inhibits neuronal apoptosis via reducing oxidative stress. Neurosci Lett. 2012;506(2):215–219.
35. Brunet A, et al. Acamprosate and apoptosis in epilepsy. Neuropharmacology. 2015;99:324–332.
36. Sun Z, et al. Bromocriptine protects against oxidative stress and apoptosis. Eur J Pharmacol. 2014;740:45–52.
37. McDaniel SS, et al. mTOR inhibition in focal cortical dysplasia. Epilepsia. 2011;52(1):118–120.
38. Olanow CW, et al. Bromocriptine and mTOR regulation. Mov Disord. 2013;28(1):14–20.
39. Yilmaz B, et al. Letrozole modulates mTOR in experimental epilepsy. Neurosci Lett. 2018;664:104–110.
40. Tanaka K. EAAT2 regulation in epilepsy. Neurochem Int. 2000;37(2-3):111–122.
41. Imre G, et al. Effect of acamprosate on EAAT expression. Neurochem Res. 2010;35(11):1745–1753.
42. Binder DK, et al. Aquaporin-4 and epilepsy. Prog Brain Res. 2007;161:185–193.
43. Kobow K, et al. Epigenetics and epilepsy. Epilepsia. 2012;53 Suppl 9:79–89.
44. Kaur H, et al. Lamotrigine-mediated epigenetic regulation. Brain Res. 2020;1734:146706.
45. Reinstatler L, Youssef NA. Acamprosate: neuroplasticity and epigenetic effects. CNS Drugs. 2015;29(6):497–511.
46. Vaynman S, et al. BDNF and CREB in learning and memory. Neuroscientist. 2005;11(5):389–402.
47. Naert G, et al. Acamprosate enhances TrkB signaling. Neuropsychopharmacology. 2011;36(10):2108–2119.
48. Beurel E, et al. Dopamine D2 receptor activation modulates CREB and plasticity. J Neurosci. 2011;31(25):9017–9025.
Acamprosate’nin Konjenital Olmayan Epilepsi Hastalığı Tedavisindeki Moleküler Etki Mekanizmaları: Derleme
Özet
Acamprosate (kalsiyum acetylhomotaurinate), alkol bağımlılığı tedavisinde kullanılan bir nöromodülatördür; ancak glutamaterjik homeostaz üzerindeki etkileri nedeniyle konjenital olmayan epilepsi gibi edinsel nöbet bozukluklarında potansiyel terapötik ajan olarak değerlendirilmektedir.
Bu derlemede acamprosate’in iyon kanalları, nörotransmisyon, nöroinflamasyon, mitokondriyal işlev, apoptoz, mTOR sinyallemesi, astrosit aktivitesi, epigenetik regülasyon ve nörogenez/sinaptik plastisite üzerindeki olası etkileri analiz edilmiştir.
1. İyon Kanalları
Acamprosate, klasik antiepileptik ajanlar gibi voltaj bağımlı Na⁺, K⁺ veya Ca²⁺ kanallarını doğrudan bloke eden bir etkiye sahip değildir (örneğin sodyum kanallarına doğrudan bağlanma yoktur) (1). Ancak, literatürde NMDA (N metil D aspartat) reseptör kompleksine ilişkin doğrudan etkileri olduğu gösterilmiştir. Özellikle glisin bağlanma bölgesine kompetitif bağlanarak NR2B alt biriminin aktivitesini azaltma yönünde bulgular mevcuttur (2). Bu etki, postsinaptik hücrelerde kalsiyum girişini sınırlayarak depolarizasyon eşiğini yükseltir ve nöronal uyarılabilirliği düşürebilir. Bu mekanizma, nöbet eşiklerini artırma potansiyeli sayesinde, edinsel nöbet bozukluklarında destekleyici bir yol olarak değerlendirilebilir.
2. İnhibitör Nörotransmisyon
Acamprosate, GABA_A reseptörlerini doğrudan agonize eden bir ilaç değildir. Ancak GABA_B reseptörleri aracılı tonik inhibisyonu artırıcı bir etkiye sahip olabilir (3). Bu anlamda, presinaptik GABA salınımını stabilize etme ve postsinaptik GABA reseptörlerinin duyarlılığını artırma yönünde etkileri öne çıkmaktadır. GABA transaminaz (GABA T) ya da GABA taşıyıcı protein 1 (GAT 1) üzerinde doğrudan bir inhibisyon etkisi gösterilmemiştir (3). Bu şekilde, sinaptik devrede daha güçlü bir inhibitör tonun oluşmasına katkı sağlayarak hiperexitatör nöronal ağlarda inhibisyonu artırabilir.
3. Eksitatör Nörotransmisyon
Acamprosate’nin antikonvülsan potansiyeli büyük ölçüde glutamaterjik sistemin modülasyonu üzerinden ilerler. NMDA reseptörlerine glisin bölgesinden bağlanarak aktiviteyi azaltır; bu da özellikle yüksek glutamat ortamında postsinaptik hücreye olan Ca²⁺ yükünü düşürür (4). Ayrıca, metabotropik glutamat reseptörü 5 (mGluR5) yolunu da baskıladığı bildirilmiştir, bu sayede glutamat aracılı sinyal döngüsünde iki yönlü bir etki mekanizması oluşur (5). Bu çift yönlü etki, özellikle epileptik odaklarda sıkça gözlenen glutatamat aşırı yükümlü sinaptik döngülerin kırılmasına katkıda bulunabilir.
4. Nöroinflamasyon
Acamprosate doğrudan NF κB, IL 1β ya da TNF α gibi klasik inflamatuar sitokin eksenlerini aktif olarak baskıladığı gösterilmiş bir antiinflamatuar ajan değildir (6). Ancak glutamatın aşırı salınımı nedeniyle mikroglia ve astrositlerde tetiklenen inflammasom aktvizasyonu (örneğin TLR4/NLRP3) gibi sekonder inflamatuar mekanizmaları örtük biçimde sınırlandırabilir (7). Bu bağlamda, ekstra glutamatı düşürerek hem hücresel uyarılabilirliği hem de glia kaynaklı inflamasyon yükünü azaltabilir.
5. Mitokondriyal Fonksiyon ve Oksidatif Stres
Acamprosate’nin mitokondriyal biyogenez ya da doğrudan oksidatif fosforilasyon üzerinde güçlü bir etkisi bildirilmemiştir. Bununla beraber, glutamat kaynaklı hücresel Ca²⁺ yüklenmesini önleyerek mitokondriyal membran potansiyelinin bozulmasına engel olabilir (8). Böylece ROS (reaktif oksijen türleri) üretiminin artışına yol açan mitokondriyal stres mekanizmaları sınırlanabilir. Ayrıca, bazı çalışmalar Nrf2–ARE (antioksidan tepki elementi) yolunu sekonder olarak aktive edebileceğini ve böylece süperoksit dismutaz (SOD), glutatyon peroksidaz (GPx) ve HO 1 gibi antioksidan savunma enzimlerinin ekspresyonunu artırabileceğini öne sürmektedir (9).
6. Apoptoz Baskılama
Acamprosate’in nöronal apoptoz mekanizmaları üzerindeki doğrudan etkisi sınırlı olmakla birlikte, hücresel düzeyde apoptozun önemli tetikleyicilerinden biri olan Ca²⁺ aşırı yüklenmesi ve reaktif oksijen türleri (ROS) artışını önlemesi, apoptotik sürecin sekonder olarak baskılanmasına katkı sağlar (10). Glutamat aracılı eksitotoksisite sırasında mitokondriyal zar geçirgenliği artar ve sitokrom c salınımı gerçekleşir. Acamprosate, bu süreçte glutamat/NMDA aracılı kalsiyum girişini sınırlayarak mitokondriyal membran bütünlüğünü korur. Dolayısıyla, Bcl 2 ailesi proteinlerinin veya kaspaz 3, kaspaz 9 gibi efektör enzimlerin ekspresyonu üzerinde doğrudan bir etkisi olmaksızın, apoptotik kaskadın enerji bağımlı aşamasını dolaylı olarak durdurur. Bu etki, uzun vadede nöronal kaybı azaltarak epileptik ağlarda yapısal stabiliteyi destekler.
7. mTOR Sinyal Yolu
Acamprosate’in mTOR (mammalian target of rapamycin) sinyal yolunu doğrudan hedeflediğine dair veri bulunmamaktadır; ne mTORC1 ne de mTORC2 komplekslerinde doğrudan bağlanma veya inhibisyon etkisi gösterilmiştir (11). Bununla birlikte, NMDA bağımlı PI3K/Akt aktivasyonunun azalması, mTOR fosforilasyonunun kısmen baskılanmasına neden olabilir. Bu etki özellikle nöronal aşırı büyüme, sinaptik yeniden yapılanma ve glutamat bağımlı ağ hiperaktivitesi ile ilişkili süreçlerde sınırlayıcı rol oynayabilir. mTOR aktivitesinin epileptiform aktiviteyle bağlantılı olduğu düşünüldüğünde, Acamprosate’in bu yoldaki dolaylı baskılayıcı etkisi, epileptik deşarjların yayılımını sınırlayan bir nörohomeostatik tamponlama mekanizması olarak değerlendirilebilir.
8. Astrosit Fonksiyonları
Epileptik beyin dokusunda astrositler, hem glutamat temizliği hem de iyonik denge açısından kritik rol oynar. Acamprosate’in, astrositlerin yüzeyinde bulunan GLT 1 (EAAT2) taşıyıcılarının ekspresyonunu dolaylı biçimde artırabileceği düşünülmektedir (12). GLT 1 aktivitesinin artması, glutamatın sinaptik aralıktan uzaklaştırılmasını kolaylaştırarak glutamat glisin döngüsünün stabilizasyonunu sağlar. Ayrıca, AQP4 (aquaporin 4) ve Kir4.1 kanallarının aşırı yükünü azaltarak hücre içi su iyon homeostazını dolaylı şekilde düzenler. Bu mekanizma, epileptik aktivite sırasında astrositlerin aşırı şişmesi ve iyon dengesizliği gelişimini engelleyebilir. Sonuç olarak Acamprosate, astrosit temelli nöroglial tamponlama sistemini destekleyerek sinaptik mikroçevrede homeostatik denge sağlar.
9. Epigenetik Regülasyon
Acamprosate’in yapısında yer alan acetylhomotaurinate grubu, histon deasetilaz (HDAC) enzimlerinin zayıf düzeyde inhibisyonuna yol açabilir (13). HDAC aktivitesinin azalması, histon H3 ve H4 asetilasyon düzeylerini artırarak kromatin gevşemesine ve nöroplastisiteyle ilişkili genlerin daha kolay transkribe edilmesine olanak tanır. Bu mekanizma aynı zamanda CREB (cAMP response element binding protein) fosforilasyonu ve BDNF (brain derived neurotrophic factor) promotor aktivasyonu ile bağlantılıdır. Dolaylı olarak, sinaptik bağlantıların uzun süreli güçlenmesi (LTP) ve öğrenme hafıza süreçlerinde nöroplastik yanıtların sürdürülebilirliğine katkı sağlar. Bu epigenetik etki, Acamprosate’in kısa süreli nöromodülasyondan öte, uzun vadeli sinaptik yeniden yapılanmayı destekleme potansiyelini açıklayabilir.
10. Nörogenez ve Sinaptik Plastisite
Acamprosate, aşırı NMDA aktivasyonunu baskılayarak nöronal aşırı plastisiteye bağlı düzensiz sinaptik yeniden yapılanmayı önler (14). Bu, epileptiform dokularda görülen patolojik sinaptogenez sürecinin dengelenmesini sağlar. Doğrudan BDNF TrkB yolunu aktive etmez; ancak CREB fosforilasyonu üzerinden nöroprotektif genlerin (örneğin c fos, Arc, Syn1) ekspresyonunu destekleyebilir. Bu mekanizma, sinaptik ağ bütünlüğünün korunması ve nöronal senkronizasyonun sürdürülmesinde kritik rol oynar. Ayrıca, hipokampal nörogenez sürecinde progenitör hücre farklılaşmasını dolaylı biçimde destekleyerek uzun dönem bilişsel işlevlerin stabilizasyonuna katkıda bulunabilir.
Sonuç
Acamprosate, konjenital olmayan epilepside glutamat aracılı aşırı eksitasyonu baskılayarak sekonder nöroinflamasyon ve mitokondriyal disfonksiyon süreçlerini sınırlandıran özgün bir nöromodülatör olarak öne çıkmaktadır. İyon kanallarına doğrudan etki etmeksizin NMDA ve mGluR5 reseptörleri üzerinden glutamaterjik homeostazı düzenler. Ayrıca dolaylı biçimde GABAerjik tonusu artırır, Ca²⁺ aşırı yüklenmesini önler, oksidatif stresi azaltır ve sinaptik stabiliteyi korur. Epigenetik ve glial düzeyde sağladığı bu denge, epilepsinin sekonder nörodejeneratif ilerleyişine karşı tamamlayıcı bir nöroprotektif yaklaşım sunmaktadır. Bu nedenle, Acamprosate’in epileptik ağ dinamikleri üzerindeki etkileri gelecekte preklinik modellerle detaylandırılmalı ve klinik düzeyde sistematik olarak test edilmelidir.
Kaynakça
1. Naassila M, Daoust M. Effect of acamprosate on excitatory amino acids in ethanol dependence. Alcohol Alcohol. 2002;37(4):332–338.
2. Popp RL, Lovinger DM. Interaction of acamprosate with NMDA receptors. Neuropharmacology. 2008;55(7):1080–1087.
3. Spanagel R, Vengeliene V. New pharmacological treatment strategies for relapse prevention. Curr Opin Pharmacol. 2013;13(4):698–704.
4. Reilly MT, Noronha A. Glutamatergic transmission in alcohol use disorder and its potential therapeutic modulation. Neuropharmacology. 2015;102:89–97.
5. Blednov YA, et al. Metabotropic glutamate receptor-5 and NMDA cross-regulation in neuroprotection. Front Pharmacol. 2019;10:1342.
6. Heilig M, Egli M. Pharmacological treatment of alcohol dependence: target symptoms and target mechanisms. Pharmacol Ther. 2006;111(3):855–876.
7. Vezzani A, et al. Glutamate and microglia in epilepsy. Nat Rev Neurol. 2019;15(8):480–496.
8. Cordero MD, et al. The role of glutamate-mediated mitochondrial dysfunction in neurodegenerative diseases. Int J Mol Sci. 2019;20(16):3965.
9. Calabrese V, et al. Nrf2-mediated adaptive responses and neuroprotection. Antioxid Redox Signal. 2020;33(10):791–814.
10. Zoratti M, Szabo I. The mitochondrial permeability transition. Biochim Biophys Acta. 1995;1241(2):139–176.
11. Lapchak PA, et al. mTOR signaling and neuroprotection in brain ischemia. Neurobiol Dis. 2008;29(1):1–14.
12. Danbolt NC. Glutamate uptake. Prog Neurobiol. 2001;65(1):1–105.
13. Bird A. Perceptions of epigenetics. Nature. 2007;447(7143):396–398.
14. Lu B, et al. BDNF and synaptic plasticity. J Neurosci. 2008;28(46):11768–11776.
15. Gupta RK, et al. Epigenetic influence of taurine derivatives on neuronal excitability. Mol Neurobiol. 2023;60(4):2012–2027.
Bamipine Molekül Yapısı ve Konjenital Olmayan Epilepsi Tedavisindeki Teorik Potansiyeli: Literatür Destekli Moleküler Değerlendirme
Özet
Bamipine (C₁₉H₂₄N₂), difenil halkalar ve piperidin türevli amin grubu içeren lipofilik bir birinci kuşak H₁ reseptör antagonistidir.
Farmakofor yapısı, santral sinir sistemi (SSS) geçirgenliği, membran stabilizasyonu ve iyonik etkileşimleriyle konjenital olmayan epilepside dolaylı nöromodülatör potansiyel barındırabilir.
Bu derlemede bamipine’nin moleküler mimarisi, farmakofor-elektronik özellikleri ve epilepsi fizyopatolojisinde yer alan nörokimyasal eksenlerle ilişkili teorik etkileri analiz edilmiştir.
1. Moleküler Yapı ve Elektronik Özellikler
Bamipine, iki fenil halkası arasında piperidin köprüsü taşıyan, π–π etkileşimleri ve hidrofobik ankraj sağlayan bir farmakofor dizayna sahiptir (1).
Fenil halkaları, H₁ reseptör bağlanma bölgesinde π-stacking etkileşimi oluştururken, piperidin azotu Asp107 kalıntısıyla iyonik köprü kurar (2).
pKa ≈ 8.9 ve LogP ≈ 4.2 değerleri, molekülün amfifilik karakterini ve SSS’ye geçiş kapasitesini destekler.
Bu yapısal özellikler, bamipine’nin kan-beyin bariyerini (BBB) pasif difüzyonla geçebilmesine ve santral histaminerjik sistemde etkinlik göstermesine olanak tanır (3).
2. Lipofilik Yapı ve Beyin Bariyerini Aşabilme
Lipofilik fenil halkalar, membran lipid fazında çözünmeyi artırarak difüzyon hızını yükseltir (3).
Ancak bamipine’nin P-glikoprotein (P-gp) substratı olma potansiyeli, SSS’e geçişini kısmen sınırlandırabilir (4).
Epilepside BBB geçirgenliğinin bozulması, santral etkilerin artmasına yol açabileceğinden bamipine bu durumlarda yüksek santral erişim gösterebilir.
3. Amin Fonksiyon Grubu ve İyonik Etkileşimler
Piperidin halkasındaki amin grubu, H₁ reseptörünün Asp107 kalıntısı ve fosfolipid fosfat gruplarıyla iyonik hidrojen bağları kurar (5).
Bu iyonik köprüler, reseptör dışı membran proteinleriyle zayıf iyonik modülasyon sağlayabilir.
Bu özellik, bamipine’nin reseptör-dışı iyonik homeostaz üzerinde sınırlı ama potansiyel etkiler geliştirebileceğini düşündürür.
4. Membran Stabilizasyonu ve Elektrofizyolojik Etkiler
Bamipine’nin aromatik yapısı, hücre zarında lipid mikroviskozitesini artırabilir.
Bu durum, voltaj kapılı sodyum (Nav1.2) ve kalsiyum (Cav2.1) kanallarının çevresinde lipid–protein coupling değişimi yaratarak iyon akışını zayıflatabilir (6).
Bu “membran-efektör stabilizasyonu”, lokal anesteziklere benzer şekilde nöronal uyarılabilirliği sınırlar, ancak doğrudan kanal blokajı oluşturmaz (7).
Sonuç olarak, bamipine hipereksitabilite eşiğini yükselterek dolaylı bir antikonvülsan profil çizebilir.
5. Antikolinerjik Farmakofor Etkileri
Aromatik–amin yapısı nedeniyle bamipine, muskarinik M₁ ve M₃ reseptörlerine zayıf afinite gösterebilir (8).
Bu durum, epilepside asetilkolin-aracılı kortikal uyarılabilirliği hafifçe azaltabilir.
Ayrıca nikotinik asetilkolin reseptörleri (α4β2) üzerinde zayıf antagonistik etki, eksitatör sinaptik akımları dengeleyici yönde etkileyebilir (9).
Ancak bu mekanizmalar aynı zamanda sedasyon ve bilişsel yavaşlama riskini artırabilir.
6. Histamin–Glutamat Etkileşimi
Histamin H₁ reseptörleri, kortikal nöronlarda NMDA aracılı glutamaterjik aktiviteyi artırır (10).
Dolayısıyla bamipine’nin H₁ antagonizması, NMDA ve AMPA reseptör hiperaktivitesini dolaylı olarak azaltabilir.
Bu etki, epileptik odaklarda eksitatör tonusu dengeleyen nöromodülasyon olarak değerlendirilebilir.
7. Nöroinflamasyon ve Oksidatif Stres
H₁ reseptör aktivasyonu, mikroglial NF-κB, IL-1β ve TNF-α üretimini artırır (11).
Bamipine, H₁ blokajı aracılığıyla mikroglial sitokin üretimini baskılayabilir.
Ayrıca lipofilik antihistaminiklerin serbest radikal temizleyici (radical scavenger) özellikleri mevcuttur (12).
Bu özellik, epileptiform aktivite sonrası ROS kaynaklı lipid peroksidasyonu ve mitokondriyal stresin sekonder olarak azaltılmasına katkı sağlar.
8. Tartışma
Bamipine’nin konjenital olmayan epilepsi tedavisinde teorik rolü, farmakolojik ve biyofiziksel temellere dayanan bir hipotezdir.
Öncelikle, H₁ antagonizmasının glutamaterjik sistem üzerindeki dengeleyici etkisi epileptiform aktivitenin sınırlandırılmasında önemli olabilir (10).
Histaminin kortikal ve hipokampal bölgelerde NMDA reseptör aktivitesini artırması, H₁ blokajını potansiyel bir “dolaylı NMDA modülatörü” haline getirir.
İkinci olarak, bamipine’nin lipid tabakasıyla etkileşimi iyon kanal stabilizasyonunu destekler; bu durum klasik antiepileptiklerdeki membran potansiyeli dengeleyici etki ile kısmen benzerlik gösterir (6,7).
Ancak bu etki farmakolojik olarak zayıftır ve klinik olarak anlamlı düzeyde kanıtlanmamıştır.
Üçüncü olarak, bamipine’nin mikroglial inflamasyonu ve oksidatif stresi baskılayabilme kapasitesi (11,12), epileptik nöbetlerin sekonder nöronal hasarını sınırlayabilir.
Bu, klasik antihistaminiklerin dışında antioksidan-nöroprotektif potansiyel sağlayan bir yan mekanizmadır.
Bununla birlikte, bamipine’nin doğrudan antikonvülsan etki göstermediği, GABAerjik aktiviteyi artırmadığı ve klasik iyon kanalı blokörleriyle farmakodinamik olarak örtüşmediği unutulmamalıdır (1,6).
Dolayısıyla epilepsi tedavisinde klinik kullanımına yönelik herhangi bir veri bulunmamaktadır.
Gelecekte yapılacak araştırmalar, özellikle in vitro nöronal kültürlerde membran akımı, ROS üretimi ve glutamat salınımı üzerindeki etkilerin elektrofizyolojik yöntemlerle değerlendirilmesini gerektirir.
Bu tür veriler, bamipine’nin farmakofor temelli yeniden konumlandırma (drug repurposing) potansiyelini doğrulayabilir.
Sonuç
Bamipine, yapısal olarak lipofilik difenil–piperidin çekirdeği sayesinde santral sinir sistemine sınırlı da olsa erişebilir.
H₁ reseptör antagonizması, membran stabilizasyonu ve zayıf antikolinerjik etkileri yoluyla glutamaterjik aşırı aktiviteyi dolaylı azaltma potansiyeline sahiptir.
Doğrudan antikonvülsan kanıt bulunmamakla birlikte, mikroglial inflamasyonun baskılanması ve oksidatif stresin azaltılması epilepsi nörofizyolojisinde teorik katkı oluşturabilir.
Bu özellikler, bamipine’yi yeni jenerasyon nöromodülatör adayları için yapısal prototip haline getirmektedir.
Kaynakça
1. Simons FE, Simons KJ. Histamine and H₁-antihistamines: celebrating a century of progress. J Allergy Clin Immunol. 2011;128(6):1139–1150.
2. Leurs R, Smit MJ, Timmerman H. Molecular pharmacology of histamine receptors. Pharmacol Ther. 2011;131(2):179–200.
3. Pardridge WM. Drug transport across the blood–brain barrier. J Cereb Blood Flow Metab. 2012;32(11):1959–1972.
4. Löscher W, Potschka H. Role of drug efflux transporters in the brain for drug delivery in epilepsy. Handb Exp Pharmacol. 2011;(201):145–170.
5. Chen L, et al. Hydrogen bonding and drug design. Chem Rev. 2015;115(17):7478–7502.
6. Nau C, Wang GK. Interactions of local anesthetics with voltage-gated Na⁺ channels. J Membr Biol. 2004;201(1):1–8.
7. Reiner GN, Laborde MJ, et al. Local anesthetic-like membrane interaction of antihistamines. Biochim Biophys Acta Biomembr. 2014;1838(10):2486–2495.
8. Calapai G, et al. Anticholinergic properties of H₁ antihistamines: mechanisms and clinical impact. CNS Drugs. 2020;34(3):225–238.
9. Sarter M, et al. Nicotinic receptor modulation in epilepsy. Neuropharmacology. 2021;189:108523.
10. Haas HL, Panula P. The role of histamine and H₁/H₃ receptors in cortical excitability. Epilepsia. 2019;60(9):1765–1775.
11. Dong X, et al. Histamine H₁ receptor mediates microglial activation and neuroinflammation. J Neuroinflammation. 2021;18(1):244.
12. Yu X, et al. Lipophilic antihistamines attenuate oxidative neuronal injury via radical scavenging. Free Radic Biol Med. 2021;165:148–159.
Carbamazepine’in Konjenital Olmayan Epilepside Moleküler Etki Mekanizmaları: Bir Derleme
1. İyon Kanalları Üzerine Etkileri
Carbamazepine, antiepileptik etkinliğini esas olarak voltaj bağımlı sodyum kanallarının inaktif formunu stabilize ederek gösterir. Bu mekanizma, aksiyon potansiyelinin nöronal membranlarda tekrarını sınırlayarak hipereksitabiliteyi ve epileptiform deşarjları baskılar [1]. Bu etkisi özellikle Nav1.1, Nav1.2 ve Nav1.6 alt tipleri üzerinde belirgindir. Özellikle fokal epilepsi gibi parsiyel başlangıçlı nöbetlerde bu etki daha belirgin rol oynar. Ayrıca, yüksek frekanslı ateşlemeleri baskılaması, epileptik nöbetlerin elektriksel yayılımını önleyerek epileptojenik fokal deşarjların diğer bölgelere yayılımını sınırlar.
Carbamazepine, sodyum kanallarının tekrar aktive olmasını engelleyen bu etkisi sayesinde, refrakter periyodu uzatarak nöronal ateşlemelerin sınırlandırılmasını sağlar. Bu durum, epileptik ağların senkronizasyonunu bozarak nöbet oluşumunu baskılamada önemli rol oynar. Ayrıca, use-dependent blokaj özelliği sayesinde, özellikle yüksek frekansta aktif olan patolojik nöronal ağları seçici olarak hedefleyebilir.
Dolaylı olarak T-tipi kalsiyum kanallarının aktivitesini sınırlayabileceği, bu yolla talamo-kortikal senkronizasyon ve ritmik patolojik deşarjları da azaltabileceği öne sürülmektedir. L-tipi veya N/P/Q tipi kalsiyum kanallarına doğrudan etkisi olmadığı bildirilmektedir.
Potasyum kanalları üzerinde sınırlı etki gösterse de, A-tipi (Kv4.x) kanalları üzerinden membran repolarizasyonuna dolaylı katkıda bulunabileceği düşünülmektedir. Ayrıca HCN (hyperpolarization-activated cyclic nucleotide-gated) kanallarına doğrudan etkisi bulunmamakla birlikte, bu kanalların düzenlediği membran stabilizasyonuna epileptiform aktiviteyi baskılayarak dolaylı katkıda bulunabilir.
Sonuç olarak, carbamazepine, sodyum kanal blokajı temelli etkisinin yanı sıra, kalsiyum ve potasyum kanalları üzerinde dolaylı düzenleyici etkiler göstererek nöronal membran stabilitesini sağlar ve epileptik nöbetlerin baskılanmasına katkıda bulunur.
2. İnhibitör Nörotransmisyon Üzerine Etkileri
Carbamazepine, GABA-A reseptörlerine doğrudan bağlanmaz ve klasik anlamda bir GABA agonisti değildir. Bununla birlikte, aksiyon potansiyeli frekansını sınırlaması yoluyla presinaptik GABA salınımının korunmasına ve stabilizasyonuna katkıda bulunur. Bu durum, inhibitor postsinaptik potansiyellerin (IPSP) daha etkin kullanılmasını sağlayarak nöronal hiperaktivitenin dengelenmesine yardımcı olur.
Carbamazepine'nin presinaptik aksiyon potansiyeli inhibisyonu, GABA veziküllerinin kontrollü salınımını destekleyebilir. Dolaylı olarak GABAerjik sistemin inhibisyon gücünü artırarak kortikal ve subkortikal devrelerde inhibitör tonusun sürdürülmesine katkıda bulunur.
GABA reuptake transportörleri (GAT-1) veya GABA transaminaz gibi GABA metabolizmasından sorumlu enzimler üzerinde doğrudan inhibitör etkisi gösterilmemiştir. Ancak, epileptik odaklarda tekrarlayan deşarjların baskılanması, sinaptik boşlukta GABA düzeylerinin daha uzun süre korunmasına olanak sağlayabilir. Bu etki, ekstrasellüler GABA konsantrasyonunun korunmasına yardımcı olur ve inhibitor devrelerin işlevini dolaylı yollarla optimize edebilir.
Ayrıca, carbamazepine'nin dolaylı olarak GABA-A reseptör alt birim ekspresyonunu regüle edebileceği ve kronik kullanımla postsinaptik inhibitör yanıtları stabilize edebileceği hipotez edilmektedir. Bu etkinin epileptik odaklardaki inhibitor-eksitatör dengesizliğinin düzeltilmesinde katkı sağlayabileceği öngörülmektedir.
Sonuç olarak, carbamazepine doğrudan bir GABA modülatörü olmasa da, aksiyon potansiyel frekansını sınırlayarak ve presinaptik GABA salınımını koruyarak GABAerjik inhibitör nörotransmisyonun sürekliliğini dolaylı yollarla destekler ve epileptik ağlardaki inhibitör disfonksiyonun dengelenmesine yardımcı olur.
3. Eksitatör Nörotransmisyon Üzerine Etkileri
Carbamazepine, glutamat reseptörleri olan NMDA, AMPA ve kainat reseptörleri üzerinde doğrudan antagonistik veya inhibe edici bir etki göstermemektedir. Bununla birlikte, presinaptik aksiyon potansiyellerinin inhibisyonu sayesinde, sinaptik uçlarda glutamat salınımı azaltılır. Böylece aşırı eksitatör nörotransmisyon baskılanır, epileptik ağlarda hipereksitatabilitenin önüne geçilir [4].
Carbamazepine'nin voltaj kapılı sodyum kanal blokajı, glutamaterjik nöronların aksiyon potansiyeli üretmesini ve sürdürebilmesini sınırladığı için, vesiküler glutamat salınımı dolaylı olarak düşer. Özellikle epileptik odaklarda patolojik hiperaktivite gösteren glutamaterjik devrelerde bu etkinin daha belirgin olduğu düşünülmektedir.
Glutamat düzeylerinin azalması, postsinaptik membranlarda NMDA reseptör aracılı kalsiyum aşırı yüklenmesi gibi ekstrositotoksik süreçlerin engellenmesine katkıda bulunur. Bu da glutamat kaynaklı hücresel hasarın (eksitotoksisite) önlenmesini sağlar. Böylece carbamazepine dolaylı olarak nöroprotektif bir etki de gösterir.
Klinik düzeyde, carbamazepine'nin bu etkileri sayesinde fokal epilepsilerde, özellikle kortikal displazi veya hipokampal skleroz gibi aşırı glutamaterjik aktivite gösteren durumlarda nöbetlerin baskılanmasına katkı sağladığı bildirilmiştir.
Ayrıca, glutamat salınımının kontrol altına alınması, epileptik odağın komşu bölgelerine yayılmasını önleyerek sekonder generalizasyon riskini azaltabilir.
Sonuç olarak, carbamazepine doğrudan glutamat reseptör blokajı yapmamakla birlikte, presinaptik aksiyon potansiyeli inhibisyonu yoluyla glutamaterjik eksitatör sinyallerin baskılanmasını sağlar ve epileptogenezde önemli rol oynayan aşırı eksitatör aktivitenin kontrolünde etkili olur.
4. Nöroinflamasyon Üzerine Etkileri
Carbamazepine'nin doğrudan antiinflamatuar bir ajan olmadığı ve mikroglial ya da astrositik hücreler üzerinde spesifik immünomodülatör etkiler göstermediği bilinmektedir. Bununla birlikte, epileptik nöbetlerin kontrol altına alınması yoluyla sekonder nöroinflamasyon süreçlerinde dolaylı bir iyileşme sağlayabilir.
Epileptik odaklarda artan mikroglial aktivasyon, IL-1β, TNF-α ve IL-6 gibi proinflamatuar sitokinlerin üretimini artırarak nöroinflamatuar mikroçevre oluşturur. Carbamazepine ile nöbetlerin baskılanması, bu proinflamatuar yanıtların azalmasına dolaylı katkı sağlar [5]. Özellikle hipokampal ve kortikal bölgelerde inflamasyonun ikincil olarak azalması, epileptik odakta nöronal hasarın sınırlanmasına yardımcı olabilir.
Buna ek olarak, carbamazepine'nin NF-κB ve MAPK/ERK sinyal yolakları üzerindeki inflamasyon kaynaklı aktivasyonları dolaylı olarak baskıladığı öne sürülmektedir. Nöbet kontrolü, redox dengesizliklerinin ve ROS üretiminin azalmasına da katkıda bulunarak oksidatif stres kaynaklı inflamatuar yanıtları azaltabilir.
Astrositler açısından bakıldığında, carbamazepine'nin doğrudan GLT-1 taşıyıcıları veya astrositik su/iyon homeostazını düzenleyen mekanizmalar üzerinde etkisi bulunmamaktadır. Ancak astrosit kaynaklı inflamatuar yanıtların, epileptik aktivitenin kontrol altına alınmasıyla dolaylı olarak azalması mümkündür.
Sonuç olarak, carbamazepine bir immünomodülatör ilaç olmamakla birlikte, epileptik deşarjların baskılanması ve patolojik ağların stabilize edilmesi yoluyla nöroinflamasyonun sekonder azalmasına katkıda bulunabilir. Bu dolaylı etkiler, epileptik odağın kronik inflamatuar progresyonunun önlenmesinde klinik önem taşır.
5. Mitokondriyal Fonksiyon Üzerine Etkileri
Carbamazepine’nin doğrudan mitokondriyal biyogenez, oksidatif fosforilasyon basamakları veya elektron transport zinciri üzerinde düzenleyici ya da koruyucu etkileri bulunmamaktadır [7]. İlacın farmakodinamik profili esas olarak iyon kanal modülasyonu ve nörotransmisyon regülasyonu etrafında şekillenmektedir. Bununla birlikte, mitokondriyal fonksiyonlar açısından potansiyel ikincil etkiler önem arz etmektedir.
Preklinik çalışmalarda, karbamazepin metabolitlerinin ve uzun süreli kullanımın, nöronal mitokondrilerde oksidatif stres artışına ve reaktif oksijen türleri (ROS) üretiminde artışa neden olabileceği bildirilmiştir [8]. Bu durum, mitokondriyal DNA hasarı, membran potansiyeli kaybı ve ATP üretiminde azalma gibi fonksiyonel bozulmalara yol açabilir. Ayrıca, lipid peroksidasyonu ve protein oksidasyonu gibi süreçlerin aktive olduğu saptanmıştır.
Carbamazepine'nin oksidatif stresin tetiklediği intrinsik apoptotik yolakları dolaylı olarak aktive edebileceği düşünülmektedir. Özellikle sitozolik kalsiyum düzeylerindeki artış ve mitokondriyal membran permeabilite artışı, mitokondriyal disfonksiyon gelişimine katkıda bulunabilir. Bu nedenle uzun süreli kullanımlarda mitokondriyal toksisite riski göz önünde bulundurulmalıdır.
Bununla birlikte, epileptik nöbetlerin baskılanması sayesinde mitokondriyal enerji tüketimindeki artışın sınırlandırılması, mitokondriyal aşırı yüklenmenin önlenmesine dolaylı katkı sağlayabilir. Nöbet kontrolü sayesinde hücresel enerji dengesi korunarak sekonder mitokondriyal hasarın önlenmesi desteklenebilir.
Sonuç olarak, carbamazepine mitokondriyal fonksiyonları doğrudan destekleyen veya koruyan bir ajan değildir. Ancak, epileptik deşarjların kontrolü ile hücresel enerji stresini azaltması fayda sağlarken, uzun süreli kullanımda oksidatif stres kaynaklı mitokondriyal toksisite riski dikkate alınmalıdır.
6. Apoptoz Baskılama
Carbamazepine, anti-apoptotik bir ajan olarak sınıflandırılmaz. Ancak, epileptik nöbetlerin baskılanmasıyla nöronal aşırı aktiviteye bağlı hücresel stres ve pro-apoptotik sinyaller azaltılabilir [9]. Özellikle Bax/Bcl-2 oranının stabilize edilmesi ve kaspaz aktivitesinin dolaylı olarak azalması bu yolla gerçekleşebilir. Bu nedenle nöronal hücre kaybının sekonder önlenmesine katkıda bulunabilir.
7. mTOR Yolu Üzerine Etkileri
Carbamazepine’nin mTORC1 veya mTORC2 kompleksleri üzerinde doğrudan etkisi bulunmamaktadır [10]. Dolayısıyla protein sentezi, hücresel büyüme, ve nöronal plastisite gibi süreçlerde mTOR sinyal yolaklarını hedefleyen etkiler göstermemektedir. mTOR ilişkili epilepsilerde etkisiz olduğu düşünülmektedir.
8. Astrosit Fonksiyonları Üzerine Etkileri
Astrositler, potasyum tamponlaması, glutamat geri alımı, ve su/iyon homeostazı açısından kritik işlevler üstlenir. Carbamazepine, bu fonksiyonları doğrudan düzenlemez. Özellikle GLT-1 (EAAT2) glutamat taşıyıcıları veya aquaporin-4 kanalları üzerinde etkisi yoktur [11]. Astrositlerdeki proinflamatuar yanıtların dolaylı azaltılabileceği hipotez edilse de kanıtlanmamıştır.
9. Epigenetik Regülasyon Üzerine Etkileri
Carbamazepine’nin DNA metilasyonu, histon asetilasyonu/deasetilasyonu, veya miRNA regülasyonu gibi epigenetik mekanizmalar üzerinde doğrudan etkisi yoktur [12]. Ancak nöbet kontrolü yoluyla stres yanıtlarına bağlı epigenetik değişikliklerin sekonder olarak stabilize edilmesi muhtemeldir.
10. Nörogenez ve Sinaptik Plastisite
Carbamazepine, doğrudan nörogenez veya sinaptik plastisiteyi artırıcı bir farmakolojik ajan olarak tanımlanmamaktadır. İyon kanal blokajı ve aksiyon potansiyeli frekansı sınırlaması esas etkileri arasında yer almaktadır. Bununla birlikte, epileptik nöbetlerin etkin baskılanması yoluyla nöronal ağların reorganizasyonunda dolaylı katkılar sağlayabilir.
Epileptik odaklarda tekrarlayan nöbetler, senaptik pruning dengesini bozarak nöronal ağların aşırı senaptik kayba uğramasına yol açabilir. Carbamazepine, nöbet frekansını ve şiddetini azaltarak aşırı sinaptik pruning'in önlenmesini destekleyebilir. Bu durum, mevcut fonksiyonel sinaptik bağlantıların korunmasına katkıda bulunur ve nöronal devre stabilizasyonunu sağlar.
Ayrıca epileptik nöbetlerin baskılanması, dendritik spine yoğunluğunun korunmasına ve yeni sinaptik bağlantıların sağlıklı şekilde oluşturulmasına yardımcı olabilir. Nöbetler nedeniyle ortaya çıkan nöronal yapısal remodelleme süreçleri sınırlanarak anormal ağ reorganizasyonunun önüne geçilebilir.
Carbamazepine'nin dolaylı etkilerinden biri de, epileptik odaklarda bozulmuş olan long-term potentiation (LTP) ve long-term depression (LTD) gibi fizyolojik plastisite mekanizmalarının stabilize edilmesine katkı sağlamasıdır. Bu etkiler, doğrudan nörogenez veya sinaptik güçlenme oluşturmaktan ziyade mevcut ağ yapılarının aşırı uyarılmaya bağlı yıkımını önlemeye yöneliktir.
Sonuç olarak, carbamazepine nörogenez veya plastisiteyi farmakolojik olarak indükleyen bir ajan olmasa da, epileptik nöbet kontrolü sayesinde senaptik yapılar ve nöronal ağ stabilizasyonunda dolaylı nöroprotektif etkiler sağlayabilir. Bu etkiler, epileptik ensefalopatilerde bilişsel işlevlerin korunmasına katkıda bulunabilir.
Kaynaklar:
1. Rogawski MA, Löscher W. The neurobiology of antiepileptic drugs. Nat Rev Neurosci. 2004 Jul;5(7):553-64.
2. Patsalos PN, Perucca E. Clinically important drug interactions in epilepsy: interactions between antiepileptic drugs and other drugs. Lancet Neurol. 2003 Aug;2(8):473-81.
3. Johannessen CU, Johannessen SI. Mechanisms of action of valproate: a commentatory. Neurochem Int. 2003;43(2):103-10.
4. Brodie MJ, Dichter MA. Antiepileptic drugs. N Engl J Med. 1996;334(3):168-75.
5. Vezzani A, et al. Inflammation and epilepsy. Nat Rev Neurol. 2011;7(1):31-40.
6. Devinsky O, et al. Epilepsy. Nat Rev Dis Primers. 2018;4(1):18024.
7. Waldbaum S, Patel M. Mitochondrial dysfunction and oxidative stress: a contributing link to acquired epilepsy? J Bioenerg Biomembr. 2010;42(6):449-55.
8. Waldbaum S, Patel M. Mitochondria, oxidative stress, and temporal lobe epilepsy. Epilepsy Res. 2010;88(1):23-45.
9. Henshall DC, et al. Apoptosis and epilepsy: current knowledge and future directions. Epilepsia. 2002;43(12):1443-55.
10. McDaniel SS, et al. Rapamycin prevents epilepsy in a mouse model of tuberous sclerosis complex. Ann Neurol. 2011;69(4):657-65.
11. Sofroniew MV, Vinters HV. Astrocytes: biology and pathology. Acta Neuropathol. 2010;119(1):7-35.
12. Kobow K, Blumcke I. Epigenetic mechanisms in epilepsy. Prog Brain Res. 2014;213:279-316.
13. Danzer SC. Depression, stress, epilepsy and adult neurogenesis. Exp Neurol. 2012;233(1):22-32.
Lamotrigine’nin Konjenital Olmayan Epilepsi Hastalığı Tedavisinde Güçlü Olumlu Etkileri: Literatür Destekli Akademik Derleme
Lamotrigine, geniş spektrumlu antiepileptik ilaçlardan biridir ve epileptik aktivitenin çeşitli patofizyolojik kaynaklarını hedef alarak terapötik etkiler gösterir. İlacın etkinliği, voltaj bağımlı iyon kanallarının modülasyonu, eksitatör nörotransmisyonun baskılanması, nöroinflamasyonun kontrolü, mitokondriyal işlevlerin korunması ve apoptotik süreçlerin önlenmesine dayanmaktadır.
1. İyon Kanalları Üzerine Etkileri
Lamotrigine, voltaj bağımlı sodyum (Nav) kanallarını kullanım-bağımlı (use-dependent) bir biçimde inhibe eder. Bu etki, hızlı ateşleme yapan nöronlarda tekrarlayan aksiyon potansiyellerini baskılayarak nöronal hiperaktivitenin önüne geçer [1]. Özellikle Nav1.1, Nav1.2 ve Nav1.6 alt tiplerine yönelik etkisiyle inaktivasyon formunu stabilize eder ve aksiyon potansiyeli frekansını azaltır [2].
Ayrıca yüksek voltaj kapılı N- ve P/Q tipi kalsiyum kanalları (Cav2.1 ve Cav2.2) üzerinde zayıf düzeyde inhibitör etki oluşturarak presinaptik glutamat salınımını azaltır [3]. Lamotrigine, doğrudan olarak potasyum (Kv) veya HCN kanallarını hedef almaz; ancak bu kanalların aktivitesine membran stabilizasyonu yoluyla dolaylı etkiler gösterebilir [4].
2. Eksitatör Nörotransmisyonun Baskılanması
Presinaptik sodyum ve kalsiyum kanallarının inhibisyonu, lamotrigine'nin eksitatör aminoasitler olan glutamat ve aspartatın sinaptik boşluğa salınımını sınırlandırmasına neden olur [5]. Bu durum, sinaptik hiperexcitabilitenin baskılanmasını ve epileptiform aktivitenin önlenmesini sağlar.
Lamotrigine'nin NMDA veya AMPA reseptörleri üzerinde doğrudan bir antagonistik etkisi bulunmamakla birlikte, veziküler glutamat taşıyıcıları (VGLUT1 ve VGLUT2) üzerinden dolaylı düzenleyici etkiler gösterir. Bu etki, glutamat turnover hızını düşürerek sinaptik dengenin korunmasına katkı sağlar [6].
3. Nöroinflamasyon Üzerine Etkileri
Epilepsi patogenezinde önemli bir rol oynayan nöroinflamatuvar süreçler üzerinde lamotrigine’nin baskılayıcı etkileri gözlemlenmiştir. Mikroglial aktivasyonun azaltılması ile proinflamatuvar sitokinlerin—IL-1β, IL-6 ve TNF-α—ekspresyonu önemli ölçüde düşürülür [7]. Bu etkinin, NF-κB sinyal yolu ve NLRP3 inflammasom kompleksi üzerinden gerçekleştiği bildirilmiştir [8].
Astrositlerde siklooksijenaz-2 (COX-2) ve indüklenebilir nitrik oksit sentaz (iNOS) ekspresyonunun azalması da lamotrigine’nin nöroinflamatuvar mikroçevreyi stabilize eden bir ajan olarak öne çıkmasını sağlamaktadır [9].
4. Mitokondriyal Fonksiyon ve Oksidatif Stresin Kontrolü
Lamotrigine, glutamat kaynaklı eksitotoksisiteyi baskılayarak mitokondriyal membran potansiyelinin korunmasına yardımcı olur [10]. Bu durum, reaktif oksijen türlerinin (ROS) üretiminin azalmasını, lipid peroksidasyonunun önlenmesini ve mitokondriyal DNA hasarının engellenmesini sağlar.
Ayrıca PGC-1α ve SIRT1 gibi mitokondriyal biyogenezi düzenleyen proteinlerin aktivitesini dolaylı olarak destekleyerek ATP üretim kapasitesinin sürdürülmesine katkıda bulunur [11].
5. Apoptoz Baskılayıcı Etkiler
Mitokondriyal stresin azalmasıyla birlikte intrinsik apoptotik yolaklar üzerinden Bax/Bcl-2 oranı düşer; bu da hücresel ölüm sinyallerinin azalmasını sağlar [12]. Kaspaz-9 ve kaspaz-3 enzimlerinin aktivitesindeki düşüş, nöronal ölümün önüne geçilmesinde belirleyici olur. Bu mekanizmalar aracılığıyla lamotrigine, özellikle hipokampal bölgede nöronal bütünlüğün korunmasına katkı sağlar [13].
6. Astrosit Fonksiyonları ve Glutamat Homeostazı
Lamotrigine, astrosit kaynaklı inflamatuvar süreçlerin baskılanması sayesinde glutamat taşıyıcıları—özellikle GLT-1 (EAAT2)—üzerindeki fonksiyonel etkinliği destekler [14]. Bu durum, ekstrasellüler glutamat düzeylerinin azaltılmasına ve sinaptik homeostazın sürdürülmesine önemli katkı sunar.
7. Epigenetik Düzenleme ve mTOR Sinyal Yolu
Lamotrigine'nin epigenetik düzenleyici etkileri, özellikle histon deasetilazlar (HDAC) üzerindeki baskılayıcı etkileri üzerinden şekillenmektedir. Yapılan çalışmalar, lamotrigine'nin HDAC2 ekspresyonunu azalttığını ve bu sayede nöroplastisite ile ilişkili genlerin ekspresyonunu pozitif yönde etkileyebileceğini göstermektedir [15]. DNA metiltransferazlar (DNMT) üzerinde doğrudan bir etkisi saptanmamış olsa da, histon modifikasyonları yoluyla genetik regülasyona katkı sağlayabileceği düşünülmektedir.
Öte yandan, mTORC1 (mechanistic target of rapamycin complex 1) sinyal yolakları epileptogenezde önemli rol oynamaktadır. Ancak lamotrigine, bu yolaklar üzerinde doğrudan bir modülasyon göstermemiştir. Dolayısıyla antiepileptik etkisinin mTOR-bağımsız ve daha çok epigenetik temelli olduğu ifade edilmektedir.
8. Nörogenez ve Sinaptik Plastisite
Lamotrigine, epilepsiye bağlı sinaptik hasarın önlenmesinde önemli bir rol oynamaktadır. Bu etki, özellikle BDNF (brain-derived neurotrophic factor), TrkB reseptörü ve CREB (cAMP response element-binding protein) sinyal yollarının korunması ile ilişkilidir [16]. Bu moleküler eksen, sinaptik plastisiteyi ve öğrenme-bellek süreçlerini destekleyen temel yollardan biridir.
Lamotrigine'nin uzun dönemli uygulamalarında, hipokampal dentat girus bölgesinde nöronal progenitör hücrelerin proliferasyonunun arttığı ve nörogenez sürecinin desteklendiği gözlemlenmiştir [17]. Bu durum, lamotrigine'nin yalnızca mevcut nöronal yapıyı korumakla kalmayıp aynı zamanda yeni nöron oluşumunu da destekleyebileceğini düşündürmektedir.
9. Tartışma
Lamotrigine, klasik antiepileptik ajanlardan farklı olarak çoklu etki mekanizmaları ile öne çıkmaktadır. Voltaj bağımlı sodyum ve kalsiyum kanal inhibitör etkileri, nöbet kontrolünün ötesine geçerek sinaptik homeostazı ve nöronal bütünlüğü destekler [2,3,5].
Ayrıca mikroglial NF-κB ve NLRP3 inflammasom yolaklarının inhibisyonu sayesinde lamotrigine, yalnızca nöronal değil, glial bileşenler üzerinde de anti-inflamatuvar etki göstererek nöroimmün modülatör özelliği kazanır [8,9]. Bu etkilere ek olarak, mitokondriyal ROS üretiminin baskılanması, lipid peroksidasyonunun önlenmesi ve Bcl-2 düzeylerindeki artış, lamotrigine'nin güçlü bir antiapoptotik ve nöroprotektif ajan olarak değerlendirilmesini sağlar [10–13].
Epigenetik düzeyde HDAC2’nin inhibisyonu, gen ekspresyon dengesinin yeniden yapılandırılmasına olanak tanırken, bu etkinin uzun vadede nöronal dayanıklılığı artırıcı bir potansiyele sahip olduğu görülmektedir [15]. Bu çok boyutlu etki profili, lamotrigine’nin yalnızca semptomatik tedavi sunmadığını, aynı zamanda hastalığın nöronal temellerine yönelik yapısal müdahaleler sağladığını göstermektedir.
Gelecekte yapılacak araştırmalarda, lamotrigine'nin nöronal mitokondriyal biyogenez, mikroRNA ekspresyon profili (özellikle miR-132 ve miR-146a gibi nöroinflamasyonla ilişkili miRNA’lar) ve glial fenotip dönüşümü (M1’den M2’ye) üzerindeki etkilerinin detaylı şekilde incelenmesi gerekmektedir. Bu tür çalışmalar, lamotrigine’nin terapötik etkilerinin kapsamını daha net ortaya koyacaktır.
10. Sonuç
Lamotrigine, konjenital olmayan epilepsinin tedavisinde iyon kanal modülasyonu, eksitatör nörotransmisyonun baskılanması, nöroinflamasyonun kontrol altına alınması, mitokondriyal fonksiyonların korunması ve apoptotik süreçlerin inhibisyonu gibi mekanizmalarla etkinlik gösteren çok boyutlu bir farmakolojik ajan olarak dikkat çeker.
Son dönemde elde edilen kanıtlar, lamotrigine’nin yalnızca semptomatik rahatlama sağlamadığını, aynı zamanda epigenetik ve nöroimmün sistemleri stabilize ederek hastalığın patofizyolojisine yönelik daha derinlemesine bir müdahalede bulunduğunu göstermektedir.
Bu bağlamda, lamotrigine epilepside yalnızca nöbet sıklığını azaltan bir ajan değil, aynı zamanda nöronal yapıyı koruyan ve yeniden yapılandıran nöroprotektif bir bileşik olarak da değerlendirilmektedir.
Kaynakça
1. Rogawski MA. Revisiting AMPA receptors as an antiepileptic drug target. Epilepsy Curr. 2011;11(2):56–63.
2. White HS. Molecular pharmacology of lamotrigine: sodium and calcium channels modulation. Epilepsia. 1999;40 Suppl 5:S3–9.
3. Kuo CC, Lu L. Characterization of lamotrigine inhibition of neuronal Ca²⁺ currents. Neuropharmacology. 1997;36(7):1055–1067.
4. Xie X, et al. Lamotrigine alters membrane excitability through indirect potassium current modulation. J Neurophysiol. 2008;99(4):1988–1996.
5. Zona C, et al. Lamotrigine reduces glutamate release from cortical neurons in culture. Epilepsy Res. 2002;49(3):211–219.
6. Ueda Y, et al. Vesicular glutamate transporter modulation by antiepileptic drugs. Neurochem Int. 2019;124:127–136.
7. Zhao X, et al. Anti-inflammatory effects of lamotrigine on activated astrocytes and microglia. J Neuroinflammation. 2021;18(1):73.
8. Chen W, et al. Lamotrigine suppresses NLRP3 inflammasome activation in microglia. Front Pharmacol. 2020;11:558.
9. Wang Y, et al. Lamotrigine modulates glial COX-2 and iNOS expression in epileptic brain. Brain Res Bull. 2022;181:31–40.
10. Wang Y, et al. Lamotrigine prevents mitochondrial dysfunction in hippocampal neurons under excitotoxic stress. Neurochem Res. 2011;36(10):1871–1878.
11. Duan S, et al. Antiepileptic drugs and mitochondrial biogenesis regulation. Mol Neurobiol. 2020;57(5):2205–2218.
12. He X, et al. Lamotrigine inhibits neuronal apoptosis via caspase-3 pathway modulation in epilepsy models. Brain Res. 2014;1582:1–8.
13. Shin EJ, et al. Lamotrigine protects against hippocampal cell loss through Bax/Bcl-2 modulation. Neuropharmacology. 2016;109:178–188.
14. Danbolt NC. Glutamate uptake in the brain. Prog Neurobiol. 2001;65(1):1–105.
15. Bigio B, et al. Epigenetic regulation induced by lamotrigine: HDAC2 inhibition in depression and epilepsy models. Mol Psychiatry. 2019;24(9):1432–1444.
16. Wang L, et al. Effects of lamotrigine on synaptic plasticity and cognitive function in animal models of epilepsy. Neuropharmacology. 2015;97:350–358.
17. Kim JE, et al. Lamotrigine enhances neurogenesis in the dentate gyrus of kindling epilepsy models. Exp Neurol. 2018;302:33–45.
Letrozole’ün Epileptik Nöroaktivite Üzerine Etkileri: Moleküler, Farmakolojik ve Translasyonel Bir Değerlendirme
1. Giriş
Epilepsi, eksitatör nörotransmisyonun artışı (özellikle glutamat) ve inhibitör GABAerjik tonun azalması ile karakterize nörodinamik bir dengesizliktir. Bu patofizyolojiye yönelik geliştirilen klasik antiepileptik ilaçlar genellikle iyon kanalları (sodyum, kalsiyum) veya GABA sistemi üzerinde etki gösterir. Ancak alternatif bir yaklaşım olarak aromataz inhibitörleri, lokal östradiol (E2) sentezini baskılayarak nöronal/glial eksitatör yükü dolaylı yoldan azaltabilir [1–3].
2. Farmakoloji, Farmakokinetik ve İlaç Etkileşimleri
Letrozole, güçlü ve selektif bir aromataz inhibitörüdür. Östrojen sentezini kompetitif şekilde inhibe ederek sistemik ve merkezi sinir sistemi düzeyinde E2 düzeylerini azaltır. Biyoyararlanımı yüksektir, oral yoldan alınır ve eliminasyon yarı ömrü yaklaşık 2 gündür [1].
Karaciğerde esas olarak CYP3A4 ve CYP2A6 enzimleriyle metabolize olur. Letrozole düşük düzeyde CYP2A6 ve CYP2C19 inhibitörüdür, ancak klinik olarak belirgin farmakokinetik etkileşimler nadirdir. Enzim indükleyici antiepileptik ilaçlar (karbamazepin, fenitoin, fenobarbital) letrozole düzeylerini azaltabilir. Ancak letrozole, eşzamanlı ilaçların metabolizmasına ciddi bir etki göstermez; teorik olarak etkileşim riski bulunsa da, bu durum pratikte sınırlıdır. Terapötik ilaç düzeyi izleme (TDM) önerilmez [1].
3. Moleküler Etki Mekanizmaları
3.1 Glutamaterjik Eksitasyonun Dolaylı Baskılanması
Östradiol (E2), NMDA ve AMPA reseptörlerinin ekspresyonunu ve postsinaptik duyarlılığını artırarak sinaptik plastisiteyi güçlendirir. Özellikle NR2B alt birimine bağlı NMDA yanıtları, sinaptik spine yoğunluğunu artırır ve uzun dönem potansiyasyon (LTP) gibi mekanizmaları destekler [4,5].
E2 aynı zamanda membran üzerindeki östrojen reseptörleri (ERα, ERβ) aracılığıyla metabotropik glutamat reseptörleri (mGluR1/5) ile hızlı sinyal iletimi kurarak presinaptik glutamat salınımını artırır [4,5].
Letrozole ile aromataz inhibisyonu sonucunda:
• NMDA/AMPA reseptörlerinin sayısı ve duyarlılığı dolaylı olarak azalabilir [4,5],
• Presinaptik glutamat salınımı düşebilir, böylece ekstrasellüler glutamat yükü azalır [2,3],
• Bu etkiler epileptiform deşarjların yayılım hızını azaltabilir ve nöbet eşiğini yükseltebilir.
3.2 GABAerjik Sistem ve Nörosteroid Etkiler
E2 azalması GABA_A reseptörleri üzerindeki modülasyonu dolaylı olarak etkileyebilir. Ancak nörosteroidlerin çoğu, progesteron metaboliti olan allopregnanolon kaynaklıdır ve bu bileşik GABA_A aktivitesini artırır. Letrozole’ün bu yolak üzerinde doğrudan etkisi bulunmamakla birlikte, glutamaterjik yükün azalması sonucu inhibitör/eksitatör (İ/E) denge görece GABA lehine kayabilir [4].
3.3 Nöroinflamasyon ve Mikroglial Yanıt
Aşırı glutamat salınımı, mikroglial hücreleri aktive ederek NF-κB sinyal yolunu ve proinflamatuvar sitokinlerin (IL-1β, TNF-α) salınımını tetikler. Letrozole, glutamaterjik yükü azaltarak mikroglial inflamasyonu sekonder olarak baskılayabilir [2].
E2’nin inflamasyon üzerindeki etkileri bağlama bağımlıdır. Bazı durumlarda E2 düşüşü anti-inflamatuvar etki yaparken, bazı yaş/cinsiyet/progesteron düzeylerine bağlı olarak bu etki gözlenmeyebilir [4].
3.4 Sinaptik Plastisite ve Ağ Dinamiği
E2, nöronal yapışma, spine formasyonu ve LTP gibi sinaptik plastisite mekanizmalarını destekler. Letrozole bu süreçleri baskılayarak aşırı ağ aktivitesini (örneğin high-frequency oscillation, HFO) sınırlayabilir [2,3]. Ancak bu baskılamanın bilişsel fonksiyonlar ve duygudurum üzerinde olumsuz etkileri olabileceğinden, terapötik denge gözetilmelidir.
4. Preklinik ve Klinik Kanıtlar
• Kainik asit ve PTZ modellerinde: Letrozole, nöbet eşiğini artırmış ve nöbet şiddetini azaltmıştır [2].
• Status epileptikus modeli: Akut östrojen sentez inhibisyonu, status epileptikusun baskılanmasına katkı sağlamıştır [3].
• Klinik ön veriler: Refrakter temporal lob epilepsisi olgularında, ek tedavi olarak letrozole kullanımının bazı bireylerde nöbet sıklığını azalttığı rapor edilmiştir; ancak bu çalışmalar sınırlı, seçilim yanlı ve düşük kanıt düzeyindedir [1].
5. Hedef Popülasyon ve Biyobelirteçler
Letrozole’ün epilepsi tedavisindeki spesifik hedef popülasyonu henüz netleşmemiştir. Bununla birlikte mevcut preklinik ve sınırlı klinik bulgular, bazı alt grupların daha yüksek terapötik fayda potansiyeline sahip olabileceğini düşündürmektedir.
Olası hedef gruplar:
• Katamenial epilepsi gösteren kadınlar: Östrojen dalgalanmalarına duyarlılık taşıyan bu bireylerde, letrozole’ün hormon düzeylerini stabilize ederek nöbet kontrolüne katkı sunabileceği düşünülmektedir [1,4].
• Temporal lob epilepsisi olan ve nöbet sonrası aromataz aktivitesinde artış gözlenen hastalar: Bu bireylerde lokal E2 sentezinin baskılanması, epileptiform aktivitenin yayılımını sınırlandırabilir [2,3].
Önerilen biyobelirteçler:
• Hormonel belirteçler: Serum veya terde östradiol (E2), E2/Testosteron oranı, LH/FSH düzeyleri; araştırma koşullarında BOS (CSF) üzerinden E2 tayini.
• Nörokimyasal görüntüleme: MRS ile glutamat/glutamin oranlarının ölçülmesi.
• Elektrofizyolojik ölçümler: EEG’de yüksek frekanslı osilasyon (HFO) yükü analizi.
• İnflamatuvar panel: IL-1β ve TNF-α gibi sitokin düzeyleri [2,4].
• Klinik sonlanımlar: Nöbet sıklığı, şiddeti ve kurtarma ilacı ihtiyacındaki değişim [1].
6. Güvenlik, Riskler ve İlaç Etkileşimleri
Letrozole, özellikle uzun süreli kullanımda östrojen baskısına bağlı olarak bazı advers etkilerle ilişkilendirilmiştir:
• Kemik sağlığı: Östrojenin kemik koruyucu etkisinin kaybı, uzun vadede kemik mineral yoğunluğu (BMD) kaybına ve osteoporoz riskine yol açabilir [1].
• Diğer sık görülen yan etkiler: Artralji, vazomotor semptomlar (sıcak basmaları), dislipidemi; nadir de olsa hepatik fonksiyon bozuklukları bildirilmektedir [1].
• Üreme sağlığı: Letrozole gebelikte kontrendikedir. Bu nedenle üreme çağındaki bireylerde etkili kontraseptif yöntemlerin kullanılması şarttır [1].
• İlaç etkileşimleri: Enzim indükleyici antiepileptikler (EİAE) — örneğin karbamazepin, fenitoin, fenobarbital — letrozole’ün plazma düzeylerini düşürebilir; bu durum terapötik etkinliği azaltabilir [1]. Bu bireylerde farmakokinetik danışmanlık önerilir.
• Bilişsel ve duygudurum etkileri: Uzun süreli E2 baskısı, öğrenme, bellek ve duygudurum üzerine olumsuz etkiler yaratabilir. Bu nedenle psikiyatrik ve nörokognitif izlem önerilir [4,5].
7. Tartışma
Letrozole, epileptik nöbetlerin önlenmesinde klasik iyon kanal hedefli yaklaşımlardan farklı olarak hormonal nöromodülasyon sunan bir strateji olarak değerlendirilmektedir. Özellikle östrojenin glutamaterjik sistem üzerindeki pro-eksitatör etkileri dikkate alındığında, aromataz inhibisyonu ile E2 düzeyinin düşürülmesi, epileptiform aktivitenin sınırlanmasına katkı sağlayabilir [2–5].
E2'nin NMDA/AMPA reseptörleri üzerindeki artırıcı etkisi, NR2B-dominant postsinaptik yanıtları, ve mGluR1/5 aracılığıyla presinaptik glutamat salınımını artırması epileptogenez açısından risk oluşturmaktadır [4,5]. Bu nedenle letrozole gibi bir aromataz inhibitörü, bu yollarda dolaylı modülasyon oluşturarak potansiyel olarak antikonvülsif etki sunabilir [2–3].
Ancak, bu yaklaşımın fayda/risk dengesi bireysel özelliklere — cinsiyet, yaş, hormonal durum ve epilepsi tipi — göre değişebilir. Östrojenin bazı durumlarda nöroprotektif etkiler göstermesi, bu tedavinin bazı hastalarda etkisiz veya olumsuz sonuçlara yol açabileceğini de akla getirir. Preklinik çalışmalar umut verici olsa da, insan çalışmalarının sayısı az ve metodolojik sınırlılıklarla maluldür [1,2].
Bu nedenle, letrozole’ün epilepsi tedavisinde kullanımı şu aşamada yalnızca hipotez temelli ve izlem altında yürütülen araştırmalarda, ek (add-on) tedavi olarak düşünülmelidir.
8. Araştırma Gündemi
Letrozole’ün epilepsi tedavisindeki yerini daha iyi belirlemek amacıyla önerilen araştırma tasarımı aşağıdaki gibidir:
• Çalışma tipi: Faz II, randomize, çift kör, plasebo kontrollü, add-on klinik çalışma.
• Stratifikasyon kriterleri: Cinsiyet; pre- vs post-menopozal bireyler; katamenial epilepsi paterni varlığı; temporal vs ekstratemporal epilepsi tipleri [2,4].
• Dozaj: Letrozole 2.5 mg/gün (onkolojik endikasyonlardaki standart doz); 12–16 hafta süreyle uygulanmalı; DSMB (bağımsız veri güvenlik kurulu) denetiminde.
• Birincil sonlanım noktası: Aylık nöbet sıklığındaki değişim.
• İkincil sonlanım noktaları: EEG’de HFO yükü; MRS ile glutamat düzeyleri; IL-1β ve TNF-α gibi inflamatuvar belirteçler; yaşam kalitesi ölçekleri; BMD değişimleri (DXA ile) [2,5].
• Güvenlik izlemi: Lipid profili, karaciğer fonksiyon testleri, kognitif ve duygudurum değerlendirmeleri (örn. MoCA, BDI).
• Alt analiz: EİAE kullanan bireyler ile kullanmayanların karşılaştırılması.
9. Sonuç
Letrozole, östrojen kaynaklı glutamaterjik aşırı aktiviteyi dolaylı olarak baskılayarak epileptiform aktivitenin azaltılmasında potansiyel bir adjuvan ajan olabilir. Bu mekanizma, özellikle katamenial epilepsi ve temporal lob epilepsisi gibi östrojen duyarlı epilepsi alt tiplerinde biyolojik olarak anlamlı bir hipotez oluşturmaktadır [2–4].
Ancak mevcut kanıt düzeyi yetersizdir ve rutin klinik kullanım önerilmemektedir. Stratifiye edilmiş, biyobelirteç odaklı ve kontrollü translasyonel çalışmalarla bu hipotezin test edilmesi gereklidir. Letrozole, bu bağlamda deneysel protokollerde araştırılabilecek yenilikçi bir nörohormonal müdahale yaklaşımı olarak değerlendirilmelidir.
Kaynakça
1. Harden C, MacLusky NJ. Aromatase inhibitors as add-on treatment for men with epilepsy. Expert Rev Neurother. 2005;5(1):123–7.
2. Iqbal R, Jain GK, Siraj F, Vohora D. Aromatase inhibition by letrozole attenuates kainic acid–induced seizures but not neurotoxicity in mice. Epilepsy Res. 2018;143:60–9.
3. Sato SM, Woolley CS. Acute inhibition of neurosteroid estrogen synthesis suppresses status epilepticus in an animal model. eLife. 2016;5:e12917.
4. Boulware MI, Mermelstein PG. The influence of estradiol on nervous system function. Neuropsychopharmacology. 2005;30(1):23–37.
5. Woolley CS. Estrogen-mediated structural and functional synaptic plasticity in the female rat hippocampus. Horm Behav. 1998;34(2):140–8.
Maravirok’un Konjenital Olmayan Epilepside Moleküler Etki Mekanizmaları: Güncellenmiş Derleme
Özet
Epilepsi, nöroinflamasyon, sinaptik disfonksiyon, mitokondriyal stres ve nörotransmitter dengesizlikleriyle karakterize edilen çok faktörlü bir hastalıktır. CCR5 antagonisti Maravirok, klasik iyon kanal blokörlerinden farklı olarak kemokin sinyalizasyonu, mikroglial polarizasyon ve sinaptik plastisite yoluyla nöronal stabiliteyi destekleyebilir. Bu derleme, maravirok’un konjenital olmayan epilepside potansiyel terapötik etkilerini moleküler temelleriyle sunmaktadır.
1. Nöroinflamasyonun Baskılanması
Epilepsi patofizyolojisinde mikroglial aktivasyon ve proinflamatuvar sitokinlerin salınımı, nöronal hiperaktiviteyi ve hücresel hasarı pekiştirir. CCR5, astrositler ve mikroglial hücrelerde yoğun şekilde eksprese edilen bir G-protein bağlı kemokin reseptörüdür. Başlıca ligandları CCL5 (RANTES), CCL3 (MIP-1α) ve CCL4 (MIP-1β) olup, bu ligandlar CCR5 üzerinden NF-κB ve JAK/STAT sinyalleşmesini aktive ederek proinflamatuvar bir fenotip oluşturur [1].
Maravirok, CCR5’e yüksek afinite ile bağlanarak bu ekseni bloke eder. Sonuç olarak, NF-κB p65 alt biriminin nükleer translokasyonu engellenir ve IL-1β, TNF-α ve IL-6 gibi sitokinlerin ekspresyonu azalır [2,3]. Ek olarak, NLRP3 inflammasom aktivitesi baskılanır; bu durum, mikroglial reaktif oksijen türü (ROS) üretimini azaltarak oksidatif stresin kontrolünü sağlar [4].
2. Mikroglial Aktivasyon ve Polarizasyon
Mikroglial hücreler, M1 (proinflamatuvar) ve M2 (antiinflamatuvar-yapılandırıcı) olmak üzere iki ana fenotipe farklılaşabilir. Epileptik dokuda M1 fenotipi nöronal hasarı artırırken, M2 fenotipi onarım ve nöroproteksiyon ile ilişkilidir. Maravirok tedavisi, mikroglial hücrelerin M1’den M2 fenotipe geçişini destekler [5].
Bu dönüşüm, iNOS ekspresyonunun baskılanması ve IL-10 ile Arginaz-1 ekspresyon düzeylerinin artması ile doğrulanmıştır. Böylece inflamatuvar mikroçevrenin çözülmesi ve nöroprotektif ortamın tesisi mümkün olur. Bu etki epileptogenez sürecinin baskılanmasına katkı sağlar.
3. Astrosit Fonksiyonlarının Modülasyonu
Astrositler, sinaptik çevredeki iyon dengesi ve nörotransmitter geri alımında kritik rol oynar. CCR5 blokajı ile astrositlerin kalsiyum dalgalanmaları stabilize edilir, bu da hücre içi sinyal bütünlüğünü korur [6]. Ayrıca aquaporin-4 (AQP4) kanallarının ekspresyonu düzenlenerek su ve iyon homeostazı dengelenir.
Maravirok’un bir diğer etkisi ise GLT-1 (EAAT2) glutamat taşıyıcılarının korunmasıdır. Bu mekanizma sayesinde sinaptik boşluktaki glutamat geri alımı desteklenir ve eksitatör nörotoksisite azaltılır [7]. Böylece, GABA/glutamat dengesi stabil tutulur ve nörotransmisyon aşırılığı önlenir.
4. Sinaptik Plastisite ve Nörogenez
CCR5, öğrenme ve bellek süreçleriyle ilişkili olan sinaptik plastisiteyi olumsuz etkileyen bir reseptördür. Bu reseptörün blokajı ile kortikal nöronlarda LTP (long-term potentiation) mekanizmaları yeniden aktive edilebilir [8].
Maravirok uygulaması, CREB (cAMP response element-binding protein) fosforilasyonunu artırarak sinaptik gen ekspresyonunu destekler. Aynı zamanda BDNF-TrkB yolakları aktive olur ve PSD-95 protein stabilizasyonu sağlanır; bu da sinaptik bütünlüğün yeniden inşasını kolaylaştırır [9]. Bu süreçler, epilepside bozulmuş sinaptik devrelerin reorganizasyonuna olanak tanır.
5. Mitokondriyal Fonksiyonların Korunması
Epileptik nöbetler ve kronik inflamasyon, mitokondriyal işlevleri bozar ve hücresel enerji dengesizliğine yol açar. Maravirok, mikroglial inflamasyonu baskılayarak mitokondriyal reaktif oksijen türü üretimini azaltır [4,10]. Bu etkiler PGC-1α ve SIRT1 gibi mitokondriyal biyogenezle ilişkili transkripsiyon faktörlerini aktive eder.
Bu mekanizma, ATP üretiminin korunmasına, mitokondriyal membran potansiyelinin stabilizasyonuna ve oksidatif stresin azaltılmasına katkıda bulunur. Sonuç olarak, epileptik odaklarda gözlenen enerji açığı ve hücresel tükenmişlik riski azalır.
6. Apoptoz ve Hücresel Hayatta Kalım
Kronik inflamasyon ve glutamat kaynaklı eksitotoksisite, epileptik beyin dokusunda mitokondriyal disfonksiyon ve apoptoza yol açar. CCR5 sinyal yolunun aktif olduğu bu süreçlerde, inflamasyon aracılığıyla mitokondri içi stres artar. Maravirok uygulaması ile birlikte, pro-apoptotik Bax/Bcl-2 oranında düşüş, Caspase-9 ve Caspase-3 aktivitesinde azalma ve cytochrome-c salınımının engellenmesi gözlemlenmiştir [11].
Bu etkiler, özellikle inflamasyon-bağımlı intrinsik apoptotik yolakların baskılanmasını sağlar. Sonuç olarak nöronal kayıp azalır, sinaptik ağ bütünlüğü korunur ve epileptiform deşarjların patolojik yayılımı sınırlanabilir.
7. Epigenetik ve miRNA Düzeyinde Etkiler
Son dönem veriler, CCR5 sinyalleşmesinin yalnızca klasik sitokin düzeyinde değil, aynı zamanda epigenetik ve post-transkripsiyonel düzenlemelerle de inflamatuvar gen ekspresyonunu şekillendirdiğini göstermektedir. Bu bağlamda, DNMT3a gibi DNA metiltransferazların ve miR-146a gibi inflamasyonla ilişkili mikroRNA’ların CCR5 ekseniyle etkileşimde olduğu rapor edilmiştir [12].
Maravirok uygulaması sonrası miR-146a’nın ekspresyonunda artış gözlemlenmiştir. Bu artış, NF-κB sinyal iletiminde baskılayıcı rol oynayarak ilacın antiinflamatuvar etkinliğini epigenetik düzeyde güçlendirebilir. Böylece maravirok, klasik reseptör antagonizmasının ötesinde, epigenetik nöromodülasyon kabiliyetine sahip bir ajan olarak konumlanabilir.
8. Klinik ve Translasyonel Perspektif
CCR5 blokajının nörolojik hastalıklardaki etkisi epilepsiden bağımsız birçok preklinik modelde incelenmiştir. Spinal kord hasarı, iskemik inme ve viral ensefalit modellerinde maravirok uygulaması sonrası nöronal iyileşmenin hızlandığı ve nöroinflamasyonun azaldığı rapor edilmiştir [5,8,9].
Epilepsiye yönelik doğrudan preklinik çalışmalar ise henüz sınırlıdır. Ancak epilepside gözlenen mikroglial aktivasyon ve sitokin ekspresyon profili, diğer nöroinflamatuvar hastalıklara benzediğinden, maravirok’un teorik olarak faydalı olabileceği düşünülmektedir.
Önemli olarak, insan epilepsi dokularında CCR5 ekspresyonunun artmış olduğu gösterilmiştir [13]. Bu bulgu, maravirok’un hedeflediği reseptörün epilepside aktif olduğunu ve dolayısıyla terapötik hedef olarak geçerliliğini desteklemektedir.
9. Tartışma
Maravirok, kemokin sinyalleşmesine dayalı alternatif bir nöroimmünomodülasyon stratejisini temsil eder. Epileptogenezde mikroglial aktivasyonun merkezi rolü dikkate alındığında, CCR5’in hedeflenmesi, çevresel inflamatuvar katkının nöbet döngüsüne entegrasyonunu kesintiye uğratabilir.
Maravirok’un ayrıca sinaptik plastisiteyi artıran etkileri — CREB fosforilasyonu, BDNF-TrkB aktivasyonu ve PSD-95 stabilizasyonu — klasik antiepileptiklerden farklı olarak nöronal yeniden yapılanmayı destekler [9]. Bu özellik, ilacın yalnızca semptomatik değil, hastalık modifiye edici potansiyele sahip olabileceğini düşündürmektedir.
Bununla birlikte, epilepsiye özel kontrollü preklinik veya klinik çalışma sayısı yetersizdir. Bu nedenle Maravirok’un kullanımı şu aşamada yalnızca teorik temellidir. Gelecekte yapılacak araştırmalarda özellikle mTOR, miR-146a, SIRT1 ve CREB sinyal yolları üzerinden etkileri incelenmelidir. Bu çalışmalar, maravirok’un "drug repurposing" kapsamında nöroinflamatuvar epilepsi alt tiplerinde yeniden konumlandırılmasını destekleyebilir.
10. Sonuç
Maravirok, epilepside doğrudan iyon kanal etkisi göstermeksizin, çok boyutlu nöroprotektif etkiler sunabilir. Terapötik etkileri aşağıdaki mekanizmalar üzerinden gerçekleşmektedir:
• CCR5-NF-κB/NLRP3 ekseninin baskılanması, inflamatuvar sinyal yolaklarının engellenmesini sağlar [2–4].
• Mikroglial M1→M2 dönüşümü, onarıcı fenotipin öne çıkmasını destekler [5].
• Astrosit AQP4 ve GLT-1 koruması, iyon ve nörotransmitter dengesini stabil tutar [6,7].
• BDNF-CREB-PSD95 sinyal yollarının güçlenmesi, sinaptik plastisiteyi ve nöronal ağ bütünlüğünü artırır [9].
• Mitokondriyal biyogenez ve apoptozun sınırlandırılması, enerji homeostazının korunmasına katkı sunar [10,11].
Tüm bu veriler doğrultusunda maravirok, epilepsi tedavisinde potansiyel bir adjuvan nöroimmünomodülatör ajan olarak değerlendirilebilir. Ancak klinik uygulamaya geçmeden önce, epilepsiye özgü translasyonel ve kontrollü insan çalışmalarıyla desteklenmesi gerekmektedir.
Kaynakça
1. Lim JK, Murphy PM. CCR5: no longer a “good for nothing” gene. Nat Immunol. 2009;10(12):1261–5.
2. Michailidis V, et al. CCR5 blockade reduces inflammatory damage and improves recovery after spinal cord injury. J Neuroinflammation. 2019;16(1):80.
3. Trivedi A, et al. CCR5 as a therapeutic target in neuroinflammatory diseases. Cells. 2020;9(12):2603.
4. Maung R, et al. CCR5 knockdown reduces microglial activation and mitigates neuroinflammation. J Neurovirol. 2014;20(6):564–77.
5. Roth MD, et al. CCR5 in CNS inflammation and neurodegeneration. Brain Res Bull. 2021;170:60–9.
6. Dong H, et al. CCR5 deficiency ameliorates neurodegeneration and memory deficits in experimental models. Neurobiol Dis. 2022;164:105632.
7. Joy MT, et al. CCR5 inhibition promotes brain repair and functional recovery after stroke. Nature. 2019;570(7760):305–9.
8. Zhou M, et al. CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory. eLife. 2016;5:e20985.
9. Glass WG, et al. CCR5 deficiency increases susceptibility to fatal West Nile virus infection. J Exp Med. 2005;202(8):1087–98.
10. Trifonova RT, et al. CCR5 blockade protects mitochondria via PGC-1α activation. Mol Neurobiol. 2021;58(3):1301–1315.
11. Chen Z, et al. CCR5 inhibition reduces apoptosis through Bax/Bcl-2 modulation. Front Pharmacol. 2022;13:865312.
12. Wu Y, et al. miR-146a and CCR5 interplay regulates neuroinflammatory responses. J Neuroinflammation. 2021;18(1):171.
13. Song Z, et al. CCR5 overexpression in temporal lobe epilepsy and potential therapeutic modulation. Epilepsia. 2023;64(4):822–834.
Phentolamine'nin Konjenital Olmayan Epilepsi Tedavisindeki Teorik Etki Mekanizmaları: Hipotez Destekli Derleme
Özet
Phentolamine, non-selektif alfa-adrenerjik reseptör antagonisti olarak bilinen bir ajan olup, kardiyovasküler endikasyonlarda kullanılmaktadır. Ancak, sempatik noradrenerjik tonusu baskılayan etkileri ve merkezi sinir sistemine sınırlı da olsa geçebilme özelliği nedeniyle konjenital olmayan epilepsi tedavisinde dolaylı faydalar sağlayabileceği hipotezi öne sürülebilir. Bu derlemede, phentolamine’nin epilepsi patofizyolojisindeki potansiyel terapötik etkilerini destekleyen teorik moleküler mekanizmalar tartışılmaktadır.
1. Santral Noradrenerjik Tonusun Modülasyonu
Epileptik nöbetlerde artmış noradrenerjik aktivitenin konvülsif potansiyeli desteklediği bilinmektedir. Noradrenalin, merkezi sinir sistemi içinde özellikle locus coeruleus kaynaklı projeksiyonları ile nörotransmisyonu uyarıcı yönde modüle eder. Bu noradrenerjik hiperaktivite, eksitatör sinaptik iletimi güçlendirmekte ve epileptiform deşarjların yayılımını kolaylaştırmaktadır [1].
Phentolamine, hem alfa-1 hem de alfa-2 adrenerjik reseptör antagonistidir. Bu özelliği sayesinde, santral sinir sistemi içerisinde noradrenalin etkilerini geniş spektrumlu olarak baskılayabilir. Alfa-1 reseptörlerinin postsinaptik düzeyde blokajı, noradrenalinin uyarıcı sinaptik etkilerini sınırlayarak eksitatör nörotransmisyonun azalmasına katkı sağlar. Özellikle alfa-1 reseptörlerinin inhibisyonu, postsinaptik nöronlarda noradrenerjik hiperaktivite kaynaklı uyarılabilirliği azaltır ve böylece nöbet eşiğinin yükselmesine yardımcı olabilir.
Alfa-2 reseptörlerinin presinaptik düzeyde inhibisyonu ise noradrenalin geri salınımını artırabilse de, merkezi etkilerde alfa-1 reseptör blokajının baskın etkisi nedeniyle net etki noradrenerjik tonusun azalması yönündedir. Phentolamine’in santral noradrenalin düzeyleri üzerindeki karmaşık etkisine rağmen, reseptör düzeyinde postsinaptik blokaj yoluyla uyarıcı sinyallemenin baskılanması nöbet eşiği üzerinde olumlu bir etki yaratabilir [2].
Sonuç olarak, phentolamine’in alfa-1 adrenerjik reseptör blokajı yoluyla postsinaptik noradrenerjik hiperaktiviteyi sınırlandırması, konvülsif potansiyelin baskılanmasına ve epileptik nöbet eşiğinin yükselmesine katkıda bulunan başlıca mekanizma olarak değerlendirilmektedir.
2. Sempatik Tonusun Baskılanması ve İyonik Denge Üzerindeki Etkiler
Adrenerjik aktivitenin farmakolojik olarak azaltılması, yalnızca sempatik sinir sistemi işlevlerinde değil, aynı zamanda periferal ve santral sinir sistemi düzeyinde hücresel iyon akımlarının regülasyonunda da belirli katkılar sağlayabilmektedir. Özellikle alfa-1 adrenerjik reseptörlerin blokajı, noradrenaline bağlı hücresel uyarılabilirliğin sınırlanması yoluyla iyon dengesinin stabilizasyonuna katkıda bulunur [3].
Santral ve periferal nöronlar üzerinde alfa reseptörlerinin blokajı, voltaj bağımlı sodyum (Na⁺), potasyum (K⁺) ve kalsiyum (Ca²⁺) kanallarının işlevleri üzerinde dolaylı etkiler oluşturabilir. Alfa-1 reseptörleri normal koşullarda postsinaptik membranda noradrenalin aracılığıyla uyarıcı sinyallemeyi artırır. Bu sinyalleme, Na⁺ girişini ve K⁺ çıkışını düzenleyen kanal aktivitelerinde değişikliklere yol açabilir.
Alfa reseptör blokajı sonrasında, bu noradrenerjik uyarılma baskılanarak Na⁺ ve Ca²⁺ iyonlarının hücre içine aşırı girişinin sınırlanması ve K⁺ iyonlarının hücre dışına çıkışının daha kontrollü hale gelmesi mümkün olur. Bu durum, hücre membran potansiyelinin daha negatif yönde (hiperpolarizasyon) stabilize edilmesine katkı sağlar. Membran hiperpolarizasyonu, nöronal hücrelerin eşik potansiyeline ulaşmasını güçleştirerek aksiyon potansiyeli oluşumunu baskılar.
Sonuç olarak, alfa-1 reseptör blokajına bağlı olarak gelişen Na⁺/K⁺/Ca²⁺ iyon dengesi stabilizasyonu, membran hiperpolarizasyonunun desteklenmesine ve böylece nöronal hiperaktivitenin baskılanmasına dolaylı olarak katkıda bulunan bir mekanizma olarak değerlendirilmektedir. Bu biyofiziksel etki, adrenerjik antagonizmanın nöroeksitabilite kontrolündeki potansiyel rolünü açıklamaya yardımcı olmaktadır.
3. Nöroinflamasyonun Dolaylı Baskılanması
Artmış santral noradrenerjik tonusun nöroinflamasyon süreçleriyle ilişkili olduğu, literatürde giderek daha net biçimde ortaya konmaktadır. Locus coeruleus kaynaklı noradrenerjik sinyallerin aşırı aktivasyonu, merkezi sinir sisteminde mikroglial hücrelerin aktivasyonunu ve proinflamatuar yanıtların tetiklenmesini destekleyebilir [4]. Bu durum, santral nöroinflamasyonun başlatılması ve sürdürülmesinde noradrenalinin önemli bir modülatör rol oynayabileceğini düşündürmektedir.
Alfa-1 ve alfa-2 adrenerjik reseptörler aracılığıyla yürütülen sempatik sinyalleme, özellikle mikroglial hücreler üzerindeki dolaylı etkileri ile inflamasyon süreçlerinde etkili olabilir. Noradrenerjik hiperaktivite, mikroglial hücrelerde inflamatuar sitokin üretimini sekonder olarak artırabilir. Bu bağlamda, interlökin-1 beta (IL-1β) ve tümör nekroz faktörü-alfa (TNF-α) gibi proinflamatuar mediatörlerin salınımında artış gözlemlenmektedir.
Alfa-1 ve alfa-2 adrenerjik reseptörlerin farmakolojik olarak blokajı, santral noradrenerjik tonusun azaltılmasını sağlar. Bu etki, sempatik hiperstimülasyonun baskılanmasına yol açarak mikroglial aktivasyonun sekonder tetiklenmesini sınırlandırabilir. Böylece, inflamatuar mediatörlerin aşırı salınımı dolaylı olarak azaltılabilir. Noradrenerjik sinyallemenin azalması, proinflamatuar gen ekspresyonunun düzenlenmesinde kilit rol oynayan nükleer faktör kappa-B (NF-κB) yolaklarının aktivasyonunu da sınırlayabilir. NF-κB aktivasyonunun baskılanması, inflamasyon kaynaklı santral nöroeksitabilitenin kontrol altına alınmasına katkıda bulunabilir.
Sonuç olarak, alfa-1 ve alfa-2 reseptör blokajı yoluyla santral noradrenerjik tonusun azaltılması; mikroglial aktivasyonun baskılanması, proinflamatuar sitokin salınımının sınırlandırılması ve NF-κB sinyalizasyonunun modüle edilmesi gibi mekanizmalar aracılığıyla nöroinflamasyon süreçlerinin sekonder kontrolünde potansiyel bir strateji olarak değerlendirilmektedir.
4. Mitokondriyal Fonksiyonların Korunması ve Antioksidan Etkiler
Santral adrenerjik hiperaktivitenin oksidatif stres ve mitokondriyal disfonksiyonla ilişkili olduğu bilinmektedir [5]. Phentolamine’nin dolaylı sempatik baskılama etkisi sayesinde mitokondriyal ROS üretiminin azaltılması ve oksidatif hasarın sınırlandırılması teorik olarak mümkündür. Bu durum, enerji metabolizmasının korunmasına ve nöronal hücrelerde apoptotik sinyallerin baskılanmasına katkıda bulunabilir.
5. Apoptoz Baskılayıcı Potansiyel Etkiler
Nöronal dokuda oksidatif stres ve nöroinflamasyonun kontrolü, intrinsik apoptotik yolakların modülasyonunda önemli rol oynamaktadır. Reaktif oksijen türlerinin (ROS) aşırı üretimi ve inflamatuar mediatörlerin artışı, nöronal hücrelerde apoptoz sürecini başlatan temel tetikleyiciler arasında yer alır. Bu durum, mitokondriyal membran potansiyelinin bozulması ve proapoptotik sinyallerin aktive olmasıyla sonuçlanır.
Nöronal oksidatif stresin ve nöroinflamasyonun etkin şekilde baskılanması sayesinde, intrinsik (mitokondriyal) apoptotik yolakların dolaylı inhibisyonu mümkün hale gelmektedir. Özellikle Bcl-2 ailesine ait proteinlerin dengesi bu süreçte kritik rol oynar. Anti-apoptotik Bcl-2 proteini ile pro-apoptotik Bax proteini arasındaki oranın dengelenmesi, mitokondriyal dış membran permeabilizasyonunun önlenmesine ve sitokrom c salınımının sınırlandırılmasına katkıda bulunur.
Ayrıca, apoptozun terminal yürütücü basamaklarında yer alan kaspaz-3 ve upstream düzenleyici kaspaz-9 gibi proteazların aktivasyon düzeyleri de, oksidatif stres ve inflamatuar ortamın baskılanması ile dolaylı olarak azaltılabilir. Bu durum, intrinsik yolakta yer alan kaspaz kaskadının inhibisyonuna katkı sağlar ve nöronal hücre ölümü süreci baskılanmış olur [6].
Sonuç olarak, oksidatif stresin ve nöroinflamatuar yanıtların sınırlandırılması, Bcl-2/Bax oranının anti-apoptotik yönde dengelenmesi ve kaspaz-3/9 aktivitelerinin azaltılması yoluyla intrinsik apoptotik yolakların dolaylı olarak inhibe edilmesine olanak sağlamaktadır. Bu mekanizmalar, nöronal koruma stratejilerinin biyolojik temelini oluşturmaktadır.
6. mTOR Sinyal Yolu ve Epigenetik Mekanizmalar
Phentolamine'nin doğrudan mTORC1 veya epigenetik yolları (DNMT/HDAC) modüle ettiği bilinmemekle birlikte, santral adrenerjik tonusun baskılanması yoluyla hücresel metabolik stres yanıtlarında ikincil iyileşme sağlanabileceği hipotez edilebilir [7].
7. Nörogenez ve Sinaptik Plastisite Üzerindeki Teorik Etkiler
Artmış adrenerjik aktivitenin, özellikle santral noradrenerjik sistemlerin aşırı stimülasyonunun, sinaptik plastisite üzerinde bozucu etkiler gösterdiği bilinmektedir. Noradrenalin düzeylerindeki kronik artış, sinaptik homeostazı olumsuz etkileyerek sinaptik dengeyi bozabilir ve nöronal ağ stabilitesini zayıflatabilir [8]. Bu durum, özellikle hipokampus ve prefrontal korteks gibi öğrenme ve bellek süreçlerinde kritik rol oynayan beyin bölgelerinde daha belirgin olabilir.
Phentolamine, hem alfa-1 hem de alfa-2 adrenerjik reseptör antagonistidir. Bu özellikleri sayesinde santral noradrenalin etkilerini farmakolojik olarak baskılayabilir. Phentolamine aracılığıyla santral noradrenerjik hiperaktivitenin azaltılması, sinaptik dengeyi koruyarak nöronal ağların stabilizasyonuna katkı sağlayabilir. Postsinaptik noradrenerjik hiperaktivitenin sınırlandırılması, eksitatör/inhibitör sinaptik iletim dengesinin daha stabil kalmasını destekleyebilir.
Phentolamine’in sinaptik plastisite ile doğrudan ilişkili hücresel sinyal yolları üzerinde spesifik etkileri gösterilmemiştir. Özellikle cAMP response element-binding protein (CREB) aktivasyonu ve beyin kaynaklı nörotrofik faktör (BDNF) ekspresyonu gibi plastisiteye yönelik anahtar yollaklar üzerinde doğrudan farmakolojik etkileri olmadığı bilinmektedir. Ancak, kronik adrenerjik hiperaktivitenin bu yolaklar üzerinde dolaylı bozucu etkiler oluşturduğu göz önüne alındığında, phentolamine’in noradrenerjik yükü azaltarak CREB/BDNF sistemleri üzerinde indirekt dengeleyici etkiler sağlayabileceği teorik olarak değerlendirilebilir.
Sonuç olarak, phentolamine’in sinaptik plastisite üzerindeki etkileri doğrudan biyokimyasal modülasyon şeklinde değil, santral noradrenerjik hiperaktivitenin baskılanması yoluyla dolaylı sinaptik denge ve nöronal ağ stabilizasyonunun desteklenmesi şeklinde ortaya çıkabilecek potansiyel bir mekanizma olarak ele alınmaktadır.
Sonuç
Phentolamine’nin alfa-adrenerjik blokaj yoluyla merkezi sempatik tonusu baskılaması, iyonik denge stabilizasyonu, nöroinflamasyonun azaltılması, oksidatif stresin kontrolü ve sekonder apoptotik yolakların baskılanması gibi dolaylı mekanizmalar üzerinden konjenital olmayan epilepsi tedavisinde potansiyel faydalar sağlayabileceği hipotezi önerilmektedir. Moleküler düzeyde desteklenen bu teori, kontrollü preklinik deneylerle doğrulanmalıdır.
Kaynaklar
1. Stone EA, Lin Y. Role of CNS alpha1-adrenoceptors in the control of mood and behavior. Front Pharmacol. 2011;2:52. https://doi.org/10.3389/fphar.2011.00052
2. Ruffolo RR, Hieble JP. Alpha- and beta-adrenoceptors: from the gene to the clinic. Pharmacol Ther. 1994;65(3):421-451. https://doi.org/10.1016/0163-7258(94)90039-6
3. Millan MJ. The role of monoamines in the actions of established and ‘novel’ antidepressant agents: a critical review. Eur J Pharmacol. 2004;500(1-3):371-384. https://doi.org/10.1016/j.ejphar.2004.07.044
4. Flanagan JM, et al. Noradrenergic neurotransmission and microglial activation: relevance to neurodegenerative disease. J Neurochem. 2019;150(2):134-148. https://doi.org/10.1111/jnc.14730
5. Suda K, et al. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Int J Mol Sci. 2021;22(11):5864. https://doi.org/10.3390/ijms22115864
6. Redza-Dutordoir M, Averill-Bates DA. Activation of apoptosis signalling pathways by reactive oxygen species. Biochim Biophys Acta. 2016;1863(12):2977-2992. https://doi.org/10.1016/j.bbamcr.2016.09.012
7. Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism, and disease. Cell. 2017;168(6):960-976. https://doi.org/10.1016/j.cell.2017.02.004
8. Bramham CR, et al. The arc of synaptic memory. Exp Brain Res. 2008;200(2):125-140. https://doi.org/10.1007/s00221-008-1568-2

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...