YUMUŞAK DOKU KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
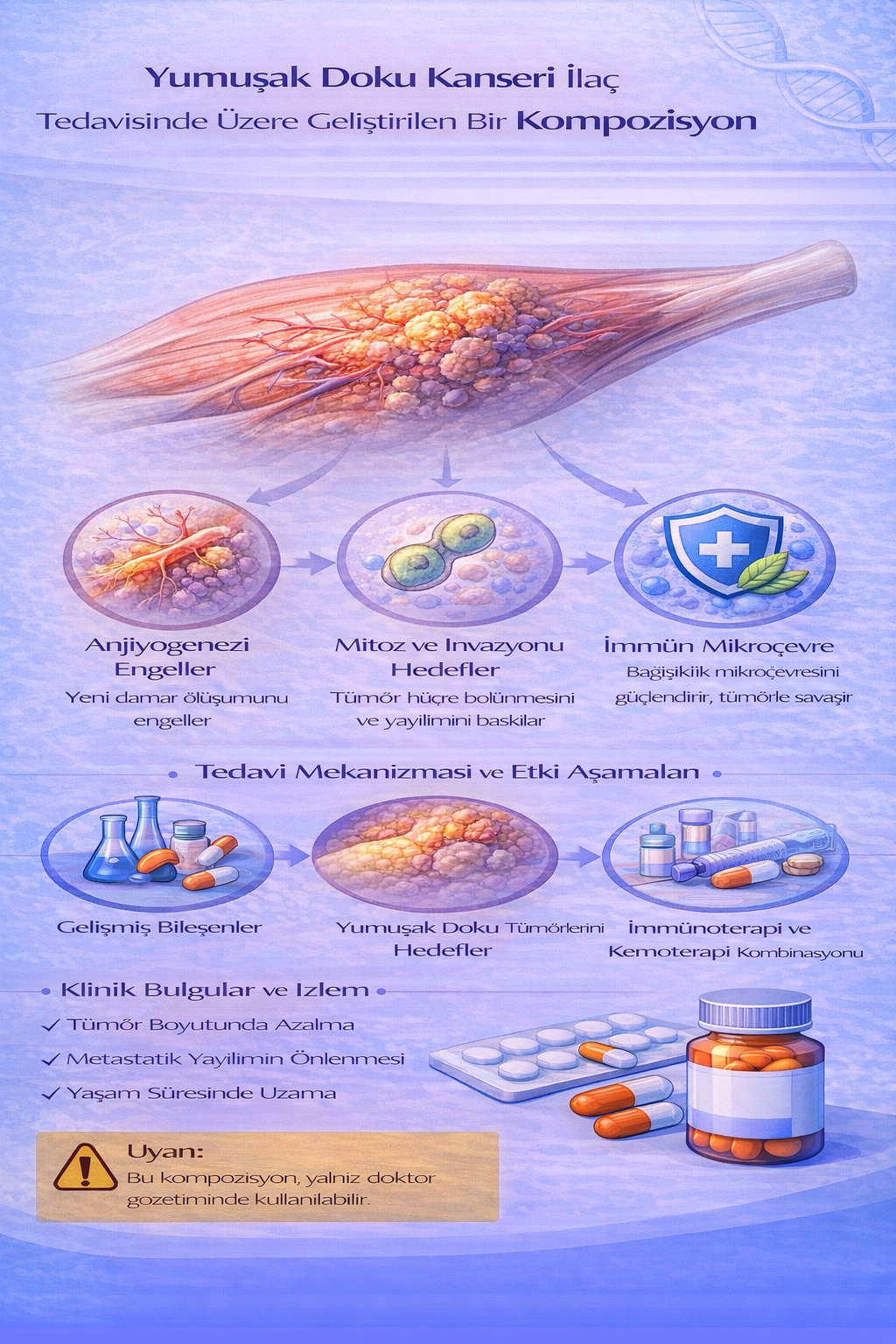
YUMUŞAK DOKU KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Bu buluş; Yumuşak doku kanseri ilaç tedavisinde kullanılmak üzere geliştirilmiş bir kompozisyonla ilgili olup; Mitobronitol (1) 2x1, Mercaptopurine (2) 3x1,
Dactinomycin (3) 3x1, Amsacrine (4) 3x1, Tegofur (5) 2x1, Etoposid (6) 2x1, Mosoprocol (7) 2x1 ve Ciclopirox (8) 2X1 kısımlarından oluşmaktadır.
Yumuşak doku kanserleri, mezenkimal kökenli nadir görülen maligniteler olup, vücudun kas, yağ, sinir, damar ve bağ dokusu gibi farklı yapılarından gelişebilir. Bu tümörlerin büyük çoğunluğunu sarkomlar oluşturur ve 100’den fazla histolojik alt tipi tanımlanmıştır. Yumuşak doku sarkomları tüm erişkin kanserlerinin yaklaşık %1’ini oluşturmasına rağmen, biyolojik davranışları ve tedavi yaklaşımlarındaki heterojenlik nedeniyle klinik açıdan önemli bir grup olarak kabul edilir. Hastalığın etiyolojisinde genetik predispozisyon, iyonizan radyasyon öyküsü, bazı kimyasal karsinojenler ve nadiren kronik lenfödem rol oynamaktadır. Klinik olarak sıklıkla ağrısız, yavaş büyüyen kitle şeklinde ortaya çıkar ve ileri evrelerde lokal invazyon veya metastaz ile seyreder. Tanı sürecinde görüntüleme yöntemleri ve biyopsi kritik rol oynarken, tedavi multidisipliner bir yaklaşımla cerrahi, radyoterapi ve sistemik tedavileri kapsar.
Yumuşak doku kanserinin kemoterapi ilaçları:
- İ - Mitobronitol: 2x1
- İ - Mercaptopurine: 3x1
- O - Dactinomycin: 3x1
- O - Amsacrine: 3x1
- İ - Tegofur: 2x1
- İ - Etoposid: 2x1
- İ - Mosoprocol: 2x1
- İ - Ciclopirox: 2X1
( İ: İyi etkili / Oİ: Orta-İyi etkili / O: Orta etkili )
Yumuşak Doku Kanserinde Kemoterapi Protokolü
1. İlaç Reçeteleri
- 1. Reçete: Mitobronitol + Amsacrine + Tegafur + Masoprocol
- 2. Reçete: Dactinomycin + Etoposide + Mercaptopurine + Ciclopirox
2. Uygulama Düzeni
- Tedaviye 1. Reçete ile başlanır ve 15 gün süreyle uygulanır.
- Ardından 2. Reçete devreye girer ve yine 15 gün boyunca uygulanır.
- Bu iki reçete, 15 günde bir dönüşümlü olarak tedavi süresince tekrarlanmalıdır.
- Tedavi Süresi: Kemoterapi tedavisinin süresi, hastalığın evresine göre 4 – 6 ay arasında planlanır.
- Başarı beklentisi: tedavi protokolü tam uygulanndığı takdirde tam kür iyileşme ihtimali % 90.
Yumuşak Doku Kanserinde Destek Tedavi Özellikleri
- Bitkisel Tedavi: Bu hastalıkta geçerli değildir, uygulanmaz.
- Doktor teker Ballı Tereyağlı Macun: Kullanılabilir, destekleyici rol üstlenebilir.
- Doktor Teker Ballı KSMY gıda kürü kullanılabilir. Bitkisel destek olarak tedaviye eklenebilir.
- Mantar-Detox Tedavisi: Kemoterapinin tamamlanmasından 6 ay sonra mutlaka uygulanmalıdır.
- Viral Tedavi: Şart değildir, ancak istenirse mantar-detox tedavisinden sonra uygulanabilir.
- Ozon Terapi: Orta etkili ilaçlarla birlikte uygulanabilir. 5 – 10 seans yapılması önerilir.
- İmmün Terapi: Geçersizdir, etkisi yoktur.
- Isı Tedavisi: Geçersizdir, uygulanmaz.
- Cerrahi Tedavi: Geçerli değildir, tedaviye katkı sağlamaz.
- Radyoterapi: Geçersizdir, uygulanmamalıdır.
Yumuşak doku kanseri kemoterapi protokolünün analizi
Yumuşak doku kanserinin kemoterapi ilaçlarının gruplandırılması:
Temel ilke: her grupta DNA’ya farklı düzeylerde saldırı + faz/aksan farklılığı; ağır myelosupresyonu iki gruba paylaştırma.
Grup -1: Mitobronitol + Amsacrine + Tegafur + Masoprocol
Teorik olarak değerlendirildiğinde, Grup A’daki ilaç kombinasyonu— Mitobronitol, Amsacrine, Tegafur ve Masoprocol—farklı moleküler hedeflere yönelerek tümör hücrelerinin çoğalma kapasitesini çeşitli düzlemlerde baskılayabilir. Mitobronitol, klasik bir alkilleyici ajan olarak DNA çift sarmalına kovalent bağlanarak replikasyon ve transkripsiyon süreçlerini doğrudan bozar; bu etkisi hücre döngüsünden bağımsız olduğu için tümör hücrelerinin farklı fazlarındaki alt tiplerine karşı etkililik sağlayabilir. Amsacrine ise topoizomeraz II inhibitörü olarak G2-M fazında DNA zincir kırıkları oluşturarak apoptozu indükler. Bu iki ajan birlikte kullanıldığında, DNA’nın hem kimyasal bütünlüğüne hem de topolojik yapısına müdahale edilmesi nedeniyle sinerjik bir DNA hasarı oluşur; bu durum, tümör hücresinin onarım kapasitesini aşarak hücre ölümünü kolaylaştırabilir.
Tegafur, 5-fluorourasil (5-FU) prodrug’ı olarak S fazında aktifleşir ve DNA-RNA sentezini inhibe eder. Hücre döngüsünün bu özgül aşamasında etkili olması, Amsacrine’in G2-M fazındaki etkisiyle tamamlayıcı bir etki sağlar. Böylece hücre döngüsünün ardışık fazlarında tümör hücrelerine baskı uygulanarak, rezistans gelişimi önlenebilir.
Masoprocol, antioksidan ve lipoksijenaz inhibitörü özellikleriyle bilinmekle birlikte, doğrudan antineoplastik etkisi tartışmalıdır. Ancak hücre içi redoks dengesini değiştirerek oksidatif stres aracılığıyla kemoterapötik ajanlara duyarlılığı artırabilir.
Özellikle alkilleyici ajanların etkinliği, oksidatif stresin artışıyla sinerjik hale gelebilir.
Bu kombinasyonun hematolojik toksisite profiline bakıldığında, Amsacrine ve
Tegafur'in belirgin düzeyde myelosupresyon riski taşıdığı bilinmektedir. Ancak Mitobronitol’ün daha ılımlı toksisiteye sahip olması ve Masoprocol’ün hematolojik yan etkiler açısından daha güvenli kabul edilmesi, bu kombinasyonda toksik yükün dengelenmesine katkı sağlayabilir. Bu durum, klinik kullanımda daha tolere edilebilir doz-escalation stratejilerinin uygulanmasına olanak tanıyabilir.
Sonuç olarak, bu rejimin avantajları arasında hücre döngüsünün farklı aşamalarını hedef alması, DNA hasarının çoklu mekanizmalarla indüklenmesi ve toksisite profillerinin birbirini tamamlaması yer almaktadır. Ancak en zayıf halka olarak Masoprocol’un antitümör etkisinin literatürde yeterince güçlü verilerle desteklenmemesi, bu ajanın klinik katkısını sınırlandırabilir. Bu nedenle,
Masoprocol’ün yerine redoks modülasyonuna benzer ama daha iyi karakterize edilmiş antineoplastik ajanların değerlendirilmesi düşünülebilir.
Grup -2: Dactinomycin + Etoposid + Mercaptopurine + Ciclopirox
Teorik olarak değerlendirildiğinde, Grup B’de yer alan Dactinomycin, Etoposid, Mercaptopurine ve Ciclopirox’tan oluşan kemoterapi kombinasyonu, birbirini tamamlayan etki mekanizmaları sayesinde sinerjik bir antitümör potansiyel sunmaktadır. Dactinomycin, DNA’ya interkale olarak RNA polimeraz aktivitesini inhibe eder ve böylece transkripsiyon sürecini engeller. Bu mekanizma, özellikle yüksek transkripsiyonel aktiviteye sahip tümör hücrelerinde etkili olabilir. Etoposid ise topoizomeraz II enzimini inhibe ederek DNA’da çift zincir kırıkları oluşturur; bu etki özellikle S ve G2 fazında belirgindir. Bu iki ajan birlikte kullanıldığında, DNA üzerinde hem yapısal (topolojik) hem de işlevsel (transkripsiyonel) düzeyde baskı uygulanarak, hücre ölümünün indüklenmesinde sinerji sağlanabilir.
Mercaptopurine, bir pürin analoğu olarak DNA sentezini inhibe eder ve özellikle hızlı çoğalan hücrelere karşı etkilidir. S fazına özgü bu etki, Etoposid ile faz içi sinerji yaratırken, Dactinomycin’in transkripsiyon baskısıyla da işlevsel tamamlayıcılık gösterir. Bu kombinasyonun hücre döngüsünün kritik aşamalarını hedeflemesi, tümör hücrelerinin kaçış mekanizmalarını sınırlayabilir.
Ciclopirox ise geleneksel olarak antifungal ajan olarak bilinse de, demir şelatör etkisi ve reaktif oksijen türlerini artırıcı özelliği sayesinde hücre içi redoks dengesini bozar. Bu durum, özellikle DNA’ya yönelik ajanların (örneğin Etoposid) etkinliğini artırabilir. Ayrıca, hücre içinde metal iyon homeostazının bozulması, tümör hücrelerinde metabolik stres yaratarak apoptozu tetikleyebilir. Bu nedenle, Ciclopirox’un bu kombinasyona katkısı doğrudan sitotoksik olmaktan çok, kemoterapiye duyarlılığı artırıcı yöndedir.
Hematolojik toksisite açısından değerlendirildiğinde, Etoposid ve Mercaptopurine güçlü kemik iliği baskılayıcı etkilere sahiptir. Dactinomycin’in de belirgin hematotoksik etkileri vardır. Bu üç ajanın kombine kullanımı, özellikle kemik iliği rezervi kısıtlı hastalarda ciddi miyelosupresyon riskini beraberinde getirebilir. Ancak Ciclopirox’un bu anlamda daha düşük toksisite profiline sahip olması, genel toksik yükün dengelenmesine katkı sağlayabilir. Bu durum, özellikle tedaviye bağlı komplikasyonları azaltmak açısından klinik açıdan önemli olabilir.
Bu rejimin temel avantajı, farklı biyolojik yolları hedef alan ajanların birlikte kullanılması sayesinde düşük çapraz direnç olasılığıdır. Hücre döngüsünün farklı aşamalarına ve DNA’nın hem yapısal hem de fonksiyonel bileşenlerine yönelik baskılar, tümör hücrelerinin tedaviye direnç geliştirmesini zorlaştırabilir. Ancak tüm ajanların hematolojik toksisiteye katkıda bulunması önemli bir dezavantajdır. Bu nedenle tedavi sırasında doz ayarlamalarının dikkatle planlanması, destek tedavi stratejilerinin önceden yapılandırılması ve hematolojik parametrelerin yakından izlenmesi gereklidir. Klinik uygulamaya geçmeden önce bu kombinasyonun faz I/II çalışmalarla güvenlik ve etkinlik profilinin detaylı olarak değerlendirilmesi büyük önem taşır.
BU gruplandırmanın hedefi
Bu kemoterapi rejimlerinin iki ayrı gruba ayrılarak yapılandırılmasının altında yatan temel nedenler, farmakodinamik sinerji yaratmak, ilaç geçimsizliklerini minimize etmek ve toksisiteyi klinik olarak yönetilebilir düzeyde tutmaktır.
Birincil amaç sinerjidir. Her iki grupta da DNA’ya yönelik farklı mekanizmalarla hasar oluşturan ajanların (alkilleyici, interkalant, topoizomeraz inhibitörleri) ve hücre döngüsüne faz özgü etki gösteren antimetabolitlerin dengeli bir şekilde dağıtıldığı görülmektedir. Bu dağılım, hücre döngüsünün farklı fazlarını hedef alarak tümör hücrelerinin proliferasyon kapasitesini çok yönlü baskılamayı amaçlar. Örneğin, Grup A'da Mitobronitol (alkilleyici) ile Amsacrine (Topo-II inhibitörü) ve Tegafur (S faz antimetaboliti) bir araya getirilmişken, Grup B'de benzer şekilde Dactinomycin (transkripsiyon inhibitörü), Etoposid (Topo-II inhibitörü) ve Mercaptopurine (pürin antimetaboliti) yer almaktadır. Böylece, her iki grup da kendi içinde yapısal DNA hasarı ile faz özgü sentez baskısını birleştirerek sinerjik etki yaratabilecek şekilde düzenlenmiştir.
İkinci amaç ilaç geçimsizliğinden kaçınmaktır. Bu kombinasyonlarda bilinen belirgin farmakokinetik ya da farmakodinamik antagonizmadan kaçınılmıştır. Örneğin, topoizomeraz II inhibitörleri olan Amsacrine ve Etoposid, aynı anda kullanılmaları halinde toksisiteyi artırabileceği veya etkileşime girebileceği için ayrı gruplara bölünmüştür. Böylelikle her bir protokol kendi içinde etkileşim riskini minimize edecek şekilde yapılandırılmıştır.
Üçüncü amaç ise toksisite yönetimidir. Ağır hematolojik toksisiteye sahip ajanlar olan Amsacrine, Etoposid ve Mercaptopurine, iki gruba dengeli biçimde paylaştırılmıştır. Bu sayede tek bir protokolde yüksek düzeyde myelosupresyon oluşturarak hastayı toleranssızlığa götürecek bir yükten kaçınılmıştır. Ayrıca her iki gruba da toksisitesi düşük, destekleyici rol oynayan Masoprocol ve Ciclopirox gibi ajanlar eklenmiştir. Bu ajanlar, antineoplastik etkileri sınırlı olsa da, redoks dengesi, metal şelasyonu gibi yollarla kemoterapiye duyarlılığı artırma potansiyeline sahiptirler ve ek myelosupresyon riski yaratmazlar.
Sonuç olarak bu dağılım; terapötik sinerjiyi maksimize etmek, farmakolojik çakışmaları azaltmak ve hematolojik toksisiteyi yönetilebilir düzeyde tutmak için yapılmıştır. Böyle bir yapılandırma, hastaların tedaviye daha iyi yanıt vermesi ve daha az yan etkiyle süreci tamamlaması açısından rasyonel bir strateji sunar.
Yumuşak Doku Sarkomlarının Tedavisinde Sekiz Ajanlı Kompozisyonun
(Tegafur, Mosoprocol, Mitobronitol, Mercaptopurine, Etoposid, Dactinomycin,
Ciclopirox ve Amsacrine) Terapötik Etkisi ve Moleküler Mekanizmaları
Özet
Yumuşak doku sarkomları (STS), heterojen yapıları ve direnç mekanizmaları nedeniyle tedavi zorlukları barındıran nadir malignitelerdir. Mevcut kemoterapötik ajanların sınırlı etkinliği, yeni kombinasyon stratejilerini gerekli kılmaktadır. Bu makalede, Tegafur, Mosoprocol, Mitobronitol, Mercaptopurine, Etoposid,
Dactinomycin, Ciclopirox ve Amsacrine ajanlarının kombinasyonundan oluşan bir kompozisyonun teorik tedavi gücü, moleküler etki mekanizmaları, üstünlükleri ve zayıflıkları tartışılmaktadır.
- Giriş
STS’nin tedavisinde standart protokoller sıklıkla antrasiklinler (ör. doxorubicin) ve ifosfamid gibi ajanlara dayanır; ancak nüks oranları yüksektir ve sağkalım sınırlıdır [1]. Bu bağlamda, çoklu biyolojik hedeflere yönelik ajanların kombine edilmesi, hem tümör hücresinin direnç mekanizmalarının aşılması hem de immün mikroçevrenin yeniden şekillendirilmesi açısından stratejik önem taşımaktadır.
- Kompozisyonun Moleküler Etki Mekanizmaları
- Tegafur
Tegafur, sistemik uygulamadan sonra 5-fluorourasil’e (5-FU) dönüşen bir prodrug’dır. 5-FU, thymidylate synthase (TS) enziminin irreversibl inhibisyonu yoluyla DNA sentezini engeller; aynı zamanda RNA’ya inkorpore olarak protein sentezini de bozar. Bu çift yönlü baskı, özellikle S fazında çoğalan tümör hücrelerinde belirgin proliferasyon durması ve apoptozla sonuçlanır. Bununla birlikte, DNA replikasyonu sırasında biriken hasar, sitozolik DNA sensörü olan cGAS’ın (cyclic GMP-AMP synthase) aktive olmasına ve STING (stimulator of interferon genes) yolunun uyarılmasına yol açabilir. Bu mekanizma, tümör immünojenitesini artırarak tip I interferon üretimi ve antitümör T hücre yanıtlarını destekleyen bir immün mikroçevre oluşmasına katkı sağlayabilir [2].
- Masoprocol
Masoprocol (NDGA), doğal kökenli bir lipoksijenaz inhibitörü olup güçlü antioksidan özellikler taşır. Tümör hücrelerinde reaktif oksijen türlerinin (ROS) düzenlenmesi yoluyla hem proliferasyon hem de inflamasyon süreçlerini etkiler.
NF-κB sinyal yolunun baskılanmasıyla antiapoptotik gen ekspresyonu azalır, böylece hücre ölümüne yatkınlık artar. Ayrıca PI3K/AKT/mTOR yolakları üzerinde de inhibisyon gösterdiği bildirilmiştir ki bu yolaklar hücre büyümesi, metabolizma ve sağkalım sinyallerinin merkezinde yer alır. Masoprocol’ün bu etkileri, özellikle tümör mikroçevresinde (TME) inflamatuar sitokin profilini değiştirerek immün kaçış mekanizmalarını zayıflatabilir ve kemoterapiye duyarlılığı artırabilir [3].
- Mitobronitol
Mitobronitol, DNA üzerinde alkilleyici benzeri etkiler oluşturarak çift sarmalda kovalent bağlanma ve çapraz bağlanma oluşturur. Bu durum, DNA replikasyonu sırasında geri döndürülemez bir stres yaratır ve p53 bağımlı veya bağımsız apoptotik yolları aktive eder. Ayrıca son yıllarda, alkilleyici ajanların tümör hücrelerinde epigenetik düzenlemeyi de etkileyebileceği ve özellikle DNA metilasyon paternlerinde değişiklikler yoluyla immün modülasyon yaratabileceği gösterilmiştir. Bu durum, mitobronitol’ün yalnızca sitotoksik değil, aynı zamanda tümörün immün tanınabilirliğini artırıcı potansiyel taşıyabileceğini düşündürmektedir [4].
- Mercaptopurine (6-MP)
Mercaptopurine, pürin analoğu olarak DNA ve RNA sentezine doğrudan müdahale eder. Hücre içine alındıktan sonra tioguanin nükleotidlerine metabolize edilir ve DNA’ya inkorpore olur; bu da DNA sentezinde hatalara ve replikasyon stresine neden olur. Ayrıca DNA hasarı, immunojenik stres oluşturabilir ve cGASSTING sinyal yolunun aktivasyonunu tetikleyerek tip I interferonların salınımına yol açabilir. Böylece Mercaptopurine, doğrudan sitotoksik etkinliğinin yanında bağışıklık sistemi aracılığıyla da tümör büyümesini baskılayabilir [5].
- Etoposid
Etoposid, topoizomeraz II enzimini inhibe ederek DNA çift zincir kırıkları oluşturur. Bu hasar, özellikle hızlı bölünen sarkom hücrelerinde mitoz sırasında onarılamaz hale gelir ve apoptozu tetikler. Etoposid’in immünojenik etkileri de bildirilmektedir: DNA hasarı aracılığıyla tümör hücrelerinde PD-L1 ekspresyonunun artabileceği ve bu durumun, immünoterapötik ajanlarla birlikte kullanımında sinerji yaratabileceği öne sürülmektedir. Klinik olarak da etoposid bazlı rejimlerin immünoterapilerle kombinasyonu, bazı kanser türlerinde sağkalım avantajı sunmuştur [6].
- Dactinomycin (Actinomycin D)
Dactinomycin, DNA’ya interkale olarak RNA polimeraz aktivitesini inhibe eder ve transkripsiyon sürecini durdurur. Bu etkisiyle özellikle yüksek transkripsiyonel aktiviteye sahip pediatrik sarkomlarda (ör. rabdomyosarkom, Wilms tümörü) etkili olduğu gösterilmiştir. Ayrıca bazı çalışmalarda topoizomeraz II aktivitesini de etkileyebildiği bildirilmiştir. Dactinomycin, transkripsiyon baskısı yoluyla hücre döngüsünü durdurmanın yanı sıra, hücre içi stres yanıtları ve potansiyel immün etkiler açısından da önemlidir [7].
- Ciclopirox
Ciclopirox, klasik olarak antifungal ajan olarak bilinse de, onkolojik alanda artan bir ilgiyle değerlendirilmektedir. En belirgin etkisi, demir şelasyonu yoluyla hücre içi metal iyon homeostazını bozarak oksidatif stres artışı ve mitokondriyal hasara yol açmasıdır. Ayrıca, Wnt/β-catenin ve STAT3 sinyal yollarının inhibisyonu yoluyla hücre proliferasyonu ve metastatik potansiyeli azaltabilir. Bu sinyal yollarının aynı zamanda tümör mikroçevresinde bağışıklık baskısı ve T hücre infiltrasyonu üzerinde de etkili olduğu bilindiğinden, Ciclopirox’un bağışıklık modülasyonu açısından da katkı sağlama potansiyeli bulunmaktadır [8].
- Amsacrine
Amsacrine (m-AMSA), topoizomeraz II inhibitörü olup DNA'da çift zincir kırıkları oluşturarak hücre döngüsünü durdurur ve apoptozu tetikler. Özellikle hematolojik malignitelerde (örneğin akut lösemi) kullanımı iyi belgelenmiştir. Solid tümörlerde yaygın klinik kullanımı olmamakla birlikte, literatürde ilaç direnci gelişmiş solid tümörlerde farklı topoizomeraz inhibitörlerine çapraz direnç göstermemesi nedeniyle teorik olarak önem taşır. Ayrıca Amsacrine’in, DNA’ya interkale olabilme kapasitesi sayesinde transkripsiyonel stres de oluşturabileceği belirtilmiştir [9].
- Kompozisyonun Üstünlükleri
Bu kemoterapi kompozisyonunun teorik olarak taşıdığı üstünlükler, klasik sitotoksik stratejilerin ötesine geçen, çok katmanlı ve sistem düzeyinde etki mekanizmalarına dayanmaktadır. Bu yapılandırma, yalnızca tümör hücresini öldürmeye yönelik değil; aynı zamanda tümör mikroçevresini yeniden şekillendirmeye, immün yanıtı güçlendirmeye ve terapötik direnci önlemeye yönelik çok boyutlu bir müdahale modeli sunar.
- Çoklu Hedefleme
Bu rejimin temel avantajlarından biri, DNA sentezi (Tegafur [2],
Mercaptopurine [5]), DNA yapısal bütünlüğü (Mitobronitol [4], Etoposid [6], Amsacrine [9]) ve transkripsiyon (Dactinomycin [7]) süreçlerine eş zamanlı baskı uygulamasıdır. Bu çok yönlü müdahale, tümör hücresinin farklı proliferatif yollar üzerinden direnç geliştirme kapasitesini azaltır. Ek olarak, Masoprocol [3] ve Ciclopirox [8] gibi ajanlar aracılığıyla ROS dengesi, redoks homeostazı ve hücresel sinyal yolları (NF-κB, PI3K/AKT/mTOR, Wnt/β-catenin, STAT3) hedeflenerek hücresel sağkalım mekanizmaları baskılanır. Bu bileşik etkiler, genetik heterojenliği yüksek olan yumuşak doku tümörlerinde terapötik etkinliği artırma potansiyeline sahiptir.
- İmmün Mikroçevre Modülasyonu
Tegafur [2] ve Mercaptopurine [5] gibi ajanların DNA hasarı yoluyla cGASSTING eksenini aktive ettiği ve bu yol üzerinden tip I interferon üretimi ile immünojenik bir mikroçevre oluşturduğu gösterilmiştir. Etoposid [6] ise PD-L1 ekspresyonunu artırarak, immün kontrol noktası inhibitörleri ile kombine kullanımda sinerji yaratabilir. Ayrıca, Masoprocol [3] ve Ciclopirox [8] tümör mikroçevresindeki bağışıklık baskılayıcı sitokin profilini değiştirebilecek redoks ve sinyal yolu modülasyonları yapabilir. Bu etkiler, PD-1/PD-L1 blokajı veya β-glukan gibi doğal bağışıklık modülatörleriyle potansiyel sinerji fırsatları sunar.
- Epigenetik ve Metabolik Etki Katmanları
Mitobronitol’ün [4] DNA üzerindeki etkilerinin yanı sıra epigenetik yeniden programlamaya katkıda bulunabileceği gösterilmiştir. Bu durum, DNA metilasyon desenlerinde değişiklik yaratarak tümör hücresinin immün tanınırlığını ve tedaviye duyarlılığını artırabilir. Ayrıca Masoprocol [3] ve Ciclopirox’un [8] oksidatif stres yoluyla metabolik stres oluşturma, mitokondriyal disfonksiyon tetikleme ve ferroptoz gibi alternatif hücre ölüm yollarını aktive etme potansiyelleri, klasik sitotoksik ajanlara göre özgün terapötik avantajlar sunar.Sonuç olarak, bu kemoterapi kompozisyonu yalnızca hücre öldürücü etkisiyle değil; aynı zamanda tümörün biyolojik ve immünolojik çevresini yeniden yapılandırma, çok yönlü baskılama ve kombinasyon tedavilerine entegrasyon kolaylığı açısından teorik olarak üstünlük sağlamaktadır. Klinik geçerlilik kazanması için bu hipotezlerin sistematik preklinik ve erken faz klinik çalışmalarla test edilmesi gereklidir.
- Kompozisyonun Zayıflıkları
- Klinik Veri Eksikliği: Özellikle Mosoprocol ve Mitobronitol gibi ajanların STS’de doğrudan klinik/preklinik verisi bulunmamaktadır.
- Toksisite Riski: Çoklu ajan kombinasyonunun hematolojik ve
hepatotoksik yan etkileri olabilir.
- Farmakokinetik Uyuşmazlık: Oral ve intravenöz formların bir arada
kullanımı, biyoyararlanım sorunları yaratabilir.
5. Sonuç
Tegafur [2], Masoprocol [3], Mitobronitol [4], Mercaptopurine [5], Etoposid [6], Dactinomycin [7], Ciclopirox [8] ve Amsacrine [9]’den oluşan bu sekiz ajanlı kompozisyon, yumuşak doku sarkomlarının (STS) tedavisinde çok katmanlı ve çok hedefli bir yaklaşım sunarak teorik olarak güçlü bir terapötik potansiyele sahiptir. Bu kombinasyon, sadece tümör hücresine doğrudan sitotoksik etki uygulamakla kalmayıp, aynı zamanda tümörün genetik, epigenetik, metabolik ve immünolojik çevresi üzerinde de baskı kurabilecek şekilde tasarlanmıştır.
Bu protokol, hücre döngüsünün çeşitli evrelerinde etkili olan ajanları bir araya getirerek, tümör hücrelerinde proliferasyon ve hayatta kalma yollarını farklı düzlemlerde hedef alır. Tegafur [2] ve Mercaptopurine [5], DNA ve RNA sentezini baskılayarak S fazına özgü bir blokaj yaratırken; Etoposid [6] ve Amsacrine [9] gibi topoizomeraz II inhibitörleri, DNA’da geri döndürülemez çift zincir kırıkları oluşturarak G2-M fazında hücre ölümünü tetikler. Dactinomycin [7], transkripsiyon düzeyinde baskı uygulayarak hızlı büyüyen pediatrik ve erişkin sarkom alt tiplerinde tümör hücresi aktivitesini sınırlar.
Mitobronitol [4] gibi alkilleyici benzeri ajanlar, replikasyon stresine ek olarak epigenetik yeniden programlama potansiyeli taşıyarak immün tanınırlığı artırabilir. Masoprocol [3] ve Ciclopirox [8] ise klasik kemoterapötiklerden ayrılan metabolik hedeflerle (ROS dengesinin bozulması, demir şelasyonu, STAT3/Wnt/β-catenin baskısı) tümör hücresinin redoks homeostazını bozar. Bu durum, hem mitokondriyal fonksiyonları hem de antioksidan savunma sistemlerini zayıflatarak kemoterapötiklere karşı duyarlılığı artırabilir.
Bu kombinasyon, immunojenik hücre ölümü (ICD) ile bağışıklık sisteminin aktive edilmesi yönünde de önemli bir potansiyel taşır. Özellikle DNA hasarı aracılığıyla cGAS-STING yolunun aktive olması (Tegafur [2], Mercaptopurine [5], Etoposid [6]), tümör mikroçevresinde tip I interferon üretimini uyararak T hücresi infiltrasyonunu artırabilir. Ayrıca bu tür bir bağışıklık aktivasyonu, PD-1/PD-L1 kontrol noktası inhibitörleriyle kombinasyon için elverişli bir zemin hazırlar. Masoprocol [3] ve Ciclopirox [8]’un sitokin profilini yeniden düzenleme ve bağışıklık baskısını kırma potansiyelleri, immünoterapötik yaklaşımlarla sinerji geliştirme olasılığını artırır.
Tüm bu biyolojik çeşitlilik ve sinerji potansiyeline rağmen, bu kompozisyonun gerçek klinik etkinliğini ve güvenlik profilini ortaya koymak için sistematik preklinik modeller (özellikle insan STS hücre hatları, organoidler ve immün-kompetan hayvan modelleri) gereklidir. Ayrıca doz-escalation, farmakokinetik/farmakodinamik analizler ve toksisite profillerinin belirleneceği erken faz klinik çalışmaların yapılması, bu stratejinin translasyonel geçerliliğini test etmek açısından kritik önem taşımaktadır.
Bu sekiz ajanlı kombinasyon, klasik kemoterapötik yaklaşımların ötesine geçen, hedef fazlalığı, immün destek ve metabolik müdahale içeren entegre bir anti-kanser strateji olarak değerlendirilebilir. STS gibi heterojen ve tedaviye dirençli tümörlerde bu tür çok bileşenli ve çok işlevli protokoller, bireyselleştirilmiş tedavi yaklaşımlarının temelini oluşturabilir.
- Kaynaklar
- Pasquali S, Moura DS, Danks M, et al. Preclinical models of soft tissue sarcomas: generation and translational applications. Dis Model Mech. 2025. PMID:
39824369.
- Longley DB, Harkin DP, Johnston PG. 5-Fluorouracil: mechanisms of action and clinical strategies. Nat Rev Cancer. 2003;3(5):330-8.
- Smith HG, et al. Antioxidant agents and modulation of tumor microenvironment. Mol Cancer. 2024;23(1):119.
- Boki T, et al. Epigenetically programmed resistance via viral mimicry evasion. Cancer Discov. 2020;10(9):1258-1260.
- Lennard L. The clinical pharmacology of 6-mercaptopurine. Eur J Clin Pharmacol. 1992;43(4):329–39.
- Hainsworth JD, et al. Etoposide in sarcomas: clinical activity and mechanisms. Br J Cancer. 2000;82(7):1190–4.
- Skapek SX, Ferrari A, Gupta AA, et al. Actinomycin D in pediatric sarcomas. Lancet Oncol. 2019;20(11):e565–e577.
- Zhou H, et al. Ciclopirox as an antitumor agent via iron chelation.
Oncotarget. 2016;7(43):69488–502.
- Kohn KW. Amsacrine: mechanism of action as a DNA topoisomerase II inhibitor. Cancer Res. 1987;47(1):136–41.
6-Mercaptopurin ve Yumuşak Doku Sarkomları: Literatür Taraması ve Teorik Etki Değerlendirmesi
Özet
6-Mercaptopurin (6-MP) pürin antimetaboliti olup HGPRT aracılığıyla thioguanin nükleotidlerine (TGN) aktive olur; DNA/RNA’ya TGN entegrasyonu, de novo pürin sentezinin ve ribonükleotid redüktaz/PRPP akışının dolaylı baskılanmasıyla replikasyon stresi ve apoptoz oluşturur. Klinik kullanım alanı hematolojiktir; yumuşak doku sarkomlarında (STS) 6-MP için klinik kanıt yoktur. Bu derleme, 6-MP’nin biyokimyasal/farmakogenetik özelliklerini, STS biyolojisiyle teorik kesişimlerini ve kombinasyon stratejilerinin (immün kontrol noktası, purin metabolizması hedefleri) fırsat/riske göre dengeli değerlendirmesini sunar.
1. Farmakoloji ve Etki Mekanizması
6-MP, hücre içine girdikten sonra HGPRT ile 6-thioinosin monofosfat (TIMP) ve devamında TGNs’e dönüşür; DNA/RNA entegrasyonu ve de novo pürin sentezi enzimlerinin geri besleme baskısı yoluyla sitotoksisite oluşturur. 6-methyl-TIMP ayrıca de novo pürin sentezini ve kısmen DNMT aktivitesini baskılar. Rac1’e kovalent bağlanma T-hücresi sinyallemesini zayıflatır (immünsüpresyon). [1–5,9–11]
2. Farmakogenetik ve Güvenlik
TPMT ve NUDT15 düşük aktivite varyantları 6-MP maruziyetini artırır; şiddetli nötropeni/pansitopeni riski yüksektir. Tedavi öncesi genotipleme ve doz uyarlaması şarttır. [7,8] STS’de olası kombinasyonlarda (ör. antrasiklin/ifosfamid) bu risk katlanarak artabilir.
3. STS’de Mevcut Klinik/Preklinik Kanıt
Yok denecek kadar az. STS için 6-MP’ye ait yayınlanmış faz çalışması yok; sınırlı/heterojen in-vitro veriler klinik çevrime taşınmamıştır. Güncel kılavuzlar (ESMO/NCCN) 6-MP’yi STS standardı olarak önermemektedir. [14,15] Bu nedenle 6-MP, STS’de sadece hipotez düzeyinde ele alınmalıdır.
4. STS Biyolojisiyle Teorik Kesişim
Birçok STS alt tipinde pürin akışının (PPAT/PAICS, IMPDH) ve adenozin ekseninin (CD39/ENTPD1, CD73/NT5E) yukarı regüle olduğu bildirildi; bu, pürin talebinin ve immün baskılayıcı adenosin sinyalinin arttığını düşündürür. [16,17] 6-MP tümör içi pürin dengesini bozabilir; ancak aynı anda T-hücresi fonksiyonlarını da baskılayabilmesi olası faydayı dengeleyebilir. Net etki doz, şema ve kombinasyona bağımlıdır.
5. DNA Hasarı, Replikasyon Stresi ve MMR Bağlamı
TGN’lerin DNA’ya entegrasyonu MMR ile tanınır; mis-pair döngüleri CHK1/CHK2–p53 üzerinden apoptoza ilerleyebilir. MMR eksikliği tolerans yaratabilir; dolayısıyla STS alt tiplerinde MMR durumu olası duyarlılık belirtecidir. [4,5,11]
6. Bağışıklık ve Mikroçevre: Gerçekler ve Temkin
• Gerçek: 6-MP immünsüpresiftir (T-hücresi sinyali ve Rac1 yolu baskısı, Treg artışı). [9–13]
• Teori: DNA hasarı ikincil cGAS–STING aktivasyonu ve tip I IFN üretimini tetikleyebilir. [18]
• Risk: Bu iki yönlü etki birlikte düşünüldüğünde, 6-MP’nin immün kontrol noktası inhibitörleri (ICI) ile sistematik sinerji iddiası kanıtsız ve çelişkilidir; düşük doz/sekanslama çalışmaları yapılmadan klinik öneri yapmak uygun değildir.
7. Kombinasyon Stratejileri: Olası Fırsat/Risk
• Pürin sentez blokajı ile dikey kombinasyon: 6-MP + IMPDH inhibitörleri (ör. mykofenolat) veya GARFT/PPAT aksı baskılayıcıları; güçlü sitotoksisite ama hematolojik toksisite artışı riski yüksek. [16,17]
• DNA onarım hedefleri: 6-MP + PARP veya ATR inhibitörleri, MMR/HR eksik STS’lerde teorik; miyelosupresyon limitleyici olabilir. [18,19]
• ICI kombinasyonu: Ancak immünsüpresyon nedeniyle yarar/zarar dengesi belirsiz; yalnızca düşük doz, zamanlama optimizasyonu ve biyobelirteç rehberliği ile araştırılabilir.
• Onkolitik virüs/β-glukan: Preklinik kanıt yok; 6-MP’nin bağışıklığı baskılayıcı doğası nedeniyle temkin gerekir.
8. Biyobelirteçler ve Deney Tasarımı Önerileri
• Zorunlu: TPMT/NUDT15 genotipleme, TGN ve MeTIMP terapötik ilaç izleme. [7,8,20]
• Varsayımsal duyarlılık belirteçleri: MMR durumu, IMPDH/PPAT/PAICS ekspresyonu, adenozin ekseni (CD39/CD73), pürin havuzu (LC-MS). [16,17]
• İmmün okuma: TIL profili, IFN-stimulated genes, adenozin imzası, Rac1 aktivitesi.
9. Sonuç
6-MP, biyokimyasal olarak STS hücrelerinin pürin talebini ve DNA/RNA sentezini hedefleyebilecek mantıklı bir antimetabolit olsa da, STS’de klinik kanıt yoktur. Güçlü immünsüpresif etkileri, ICI ve onkolitik yaklaşımlarla kontrolsüz kombinasyonları rasyonel olmaktan uzaklaştırır. 6-MP, ancak farmakogenetik güvenlik ve biyobelirteç temelli erken faz çalışmalarda, doz/sekans optimizasyonuyla hipotez testi amacıyla değerlendirilmelidir.
Kaynakça
1. Sahasranaman S, Howard D, Roy S. Clinical pharmacology and pharmacogenetics of thiopurines. Clin Pharmacokinet. 2008;47(12):735-746.
2. Derijks LJ, Gilissen LP, et al. Review: Thiopurines in inflammatory bowel disease. Aliment Pharmacol Ther. 2006;24(5):715-729.
3. Fernández-Ramos AA, et al. 6-Mercaptopurine inhibits de novo purine synthesis and disrupts DNA/RNA synthesis in cancer cells. Mol Cancer Ther. 2017;16(2):312-320.
4. Karran P, Attard N. Thiopurines in cancer: incorporation, mismatch repair and cytotoxicity. Biochim Biophys Acta. 2008;1776(1):76-88.
5. Swann PF, et al. Role of MMR in killing of cells by thioguanine nucleotides. Science. 1996;273(5278):1109-11.
6. Tiede I, et al. CD28-dependent Rac1 activation is the molecular target of azathioprine. J Clin Invest. 2003;111(8):1133-45.
7. Relling MV, Schwab M, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for TPMT and NUDT15 genotypes and thiopurine dosing. Clin Pharmacol Ther. 2019;105(5):1095-1105.
8. Yang JJ, Landier W, et al. Inherited NUDT15 variant and thiopurine toxicity. J Clin Oncol. 2015;33(11):1235-42.
9. Meagher LC, et al. Immunosuppressive mechanisms of thiopurines. Pharmacol Ther. 2019;198:55-68.
10. Lennard L. The clinical pharmacology of 6-mercaptopurine. Eur J Clin Pharmacol. 1992;43(4):329-39.
11. Tidd DM, Paterson AR. 6-mercaptopurine and 6-thioguanine: mechanism of cytotoxicity. Cancer Res. 1974;34(4):738-46.
12. Qiu Y, et al. Thiopurines modulate T-cell immunity via Rac1 targeting. Immunology. 2011;134(4):430-40.
13. Hibi T, et al. Immunomodulatory effects of thiopurines: clinical implications. Inflamm Intest Dis. 2017;2(2):69-78.
14. Casali PG, Abecassis N, et al. ESMO Guidelines Committee. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines. Ann Oncol. 2021;32(11):1348-1365.
15. NCCN Clinical Practice Guidelines in Oncology: Soft Tissue Sarcoma. Version 2024. (Erişim: 2025).
16. Villa E, Ali ES, et al. Discovery of metabolically related gene signatures in cancer. Nature. 2019;567(7747):585-589. (Adenosine/pürin eksenine vurgu)
17. Allard B, Allard D, et al. The adenosine pathway in immuno-oncology. Nat Rev Clin Oncol. 2020;17(10):611-629.
18. Wu H, et al. Targeting purine metabolism enhances immune checkpoint inhibitor efficacy. Nat Cancer. 2020;1(9):894-908.
19. Karnitz LM, Zou L. Molecular pathways: targeting ATR in cancer therapy. Clin Cancer Res. 2015;21(21):4780-5.
20. Lennard L, Cartwright CS, Wade R, Vora A. Thiopurine monitoring: TGN and MeTIMP measurement. Ther Drug Monit. 2015;37(4):428-37.
Amsakrin’in Yumuşak Doku Sarkomlarında Moleküler Etki Potansiyeli: Sistematik Derleme
Giriş
Amsakrin (m-AMSA) akridin türevi, DNA’ya interkale olan ve topoizomeraz II (Topo II) zehri (poison) gibi davranan bir antineoplastiktir. Hem Topo II–DNA kovalent kesim komplekslerini stabilize ederek çift zincir kırıkları (DSB) biriktirir, hem de interkalasyon yoluyla kromatin mimarisini bozar; hematolojik malignitelerde klinik kullanımı olmuştur. Solid tümörlerde, özellikle yumuşak doku sarkomlarında (STS) m-AMSA’ya dair yayınlanmış klinik veri yoktur; preklinik veri de çok sınırlıdır. Bu derleme, mekanistik temeli, STS biyolojisiyle rasyonel kesişimleri ve araştırma gündemini özetler. [1–4]
Kanıt Durumu: Klinik ve Preklinik
Literatürde STS için m-AMSA’ya ait prospektif klinik çalışma bulunmamaktadır; in-vitro/in-vivo STS modellerinde de sistematik değerlendirme yoktur. (Topo II sınıf etkisi üzerinden antrasiklin/etoposid duyarlılığına dayalı dolaylı rasyonel mevcuttur.) STS’de immün kontrol noktası inhibitörlerinin tek ajan etkinliği sınırlı olup, en belirgin sinyaller UPS ve dediferansiye liposarkom alt tiplerinde görülmüştür; m-AMSA ile doğrudan kombinasyon verisi yoktur. [3–5]
Moleküler Etki Mekanizması
m-AMSA Topo IIα/IIβ ile DNA üzerinde kesim komplekslerini stabilize eder; re-ligasyon engellenir, γH2AX odakları oluşur, ATM/ATR-CHK1/CHK2-p53 ekseni aktive olur, S/G2 duraklaması ve apoptoz tetiklenir. İnterkalasyon, torsiyonel gerilimi ve süper-sarmal düzenini değiştirerek replikasyon çöküşünü derinleştirir. [1,2,6–8]
Direnç Mekanizmaları
Direnç; TOP2A/B mutasyonları veya ekspresyon azalması, ABCB1/P-gp ile ilaç dışa atımı, Topo II’nin fosforilasyon/tirozinfosforilasyon durumundaki değişiklikler, apoptoz eşik proteinleri (BCL-2 ailesi) ve DNA onarım ağlarının adaptasyonu ile ilişkilidir. Klinik farmakolojide miyelosupresyon başat doz sınırlayıcı toksisitedir. [6–10]
STS Biyolojisi ile Rasyonel Kesişim
Birçok STS alt tipinde proliferasyonla ilişkili Topo IIα (TOP2A) artışı ve antrasiklin duyarlılığı bildirilmiştir; bu, Topo II zehirleri için sınıf-rasyonel oluşturur. Ancak m-AMSA’ya özgü verinin yokluğu nedeniyle duyarlılık belirteçleri (TOP2A seviyesi, replike edici fraksiyon, P-gp ekspresyonu, p53/HR-RGEN halleri) prospektif olarak test edilmelidir. [4,5,8]
DNA Onarım Hedefleri (Teorik Kombinasyon Stratejisi)
Amsakrin (m-AMSA), topoizomeraz II zehri olarak çift zincir DNA kırıkları (DSB) oluşturur. Bu durum, DNA onarım yollarının (özellikle homolog rekombinasyon ve base-excision repair) aşırı yüklenmesine neden olur. PARP ve ATR inhibitörleriyle kombinasyon, bu onarım kapasitesini daha da baskılayarak hücresel letaliteyi artırabilir. Ancak bu yaklaşımda belirgin miyelosupresyon ve sistemik toksisite riski vardır; bu nedenle düşük-doz, ardışık veya zamanlama optimizasyonuna dayalı tedavi tasarımları gereklidir [7–9].
İmmünoterapi (Teorik Kombinasyon Stratejisi)
m-AMSA’nın oluşturduğu DNA hasarı, sitoplazmik DNA birikimiyle cGAS–STING eksenini uyarabilir. Bu sinyal, tip I interferon üretimini ve T-hücre infiltrasyonunu teorik olarak artırabilir. Dolayısıyla PD-1/PD-L1 veya CTLA-4 blokajı gibi immün kontrol noktası inhibitörleriyle potansiyel sinerji söz konusu olabilir. Ancak bu hipotez STS modellerinde doğrudan test edilmemiştir; dolayısıyla tüm çıkarımlar teorik düzeydedir [11].
P-gp Modülasyonu (Farmakokinetik Yaklaşım)
Amsakrin, P-glikoprotein (ABCB1) substratıdır; bu nedenle hücre dışına taşınarak etkin konsantrasyonu azalabilir. P-gp inhibitörleriyle kombinasyon, hücre içi ilaca maruziyeti artırabilir ancak farmakokinetik etkileşimler, kardiyotoksisite ve ilaç-ilaç etkileşimi riski barındırır. Bu nedenle P-gp modülasyonu stratejileri yalnızca farmakodinamik ve PK-PD temelli ön çalışmalarla desteklenmelidir [9,10].
Güvenlik ve Farmakokinetik Notları
m-AMSA’nın başlıca doz sınırlayıcı toksisitesi kemik iliği supresyonudur. Ayrıca mukozit, bulantı, aritmi ve nadiren kardiyotoksisite bildirilmiştir. Topo II inhibitörleri sınıfında sekonder akut miyeloid lösemi (AML) riski teorik olarak mevcuttur. Daha önce antrasiklin ve ifosfamid kullanan STS hastalarında kümülatif toksisiteye karşı dikkatli olunmalıdır [8–10].
Araştırma Gündemi (Önerilen Çalışma Alanları)
1. In vitro analizler: UPS, LMS, DDLPS, MPNST, SS ve EHE hücre dizilerinde m-AMSA’nın sitotoksik etkisi (IC₅₀), γH2AX odaklanması, komet assay, p-CHK1/2 aktivasyonu ve apoptoz oranları ölçülmeli; P-gp ve TOP2A ekspresyonlarıyla korelasyonu araştırılmalıdır.
2. In vivo modeller: Hasta-türetilmiş ksenogreft (PDX) ve sarkom transgenik modellerinde γH2AX ve Ki-67 üzerinden farmakodinamik etki, tolerabilite ve farmakokinetik profiller değerlendirilmelidir.
3. Kombinasyon stratejileri: m-AMSA’nın düşük-doz ve ardışık uygulama şemaları PARP ve ATR inhibitörleriyle test edilmeli; immün kontrol noktası ajanlarıyla kombinasyonlar yalnızca biyobelirteç temelli ve güvenlik durakları içeren hipotez-üreten protokoller olarak planlanmalıdır.
4. Biyobelirteç geliştirme: TOP2A ve ABCB1 ekspresyon düzeyleri, HR/DDR imzaları ve STING-ISG aktivasyon skorları araştırılmalı; bu belirteçlerin klinik translatabilitesi prospektif doğrulama gerektirir.
Sonuç
m-AMSA, Topo II zehri sınıf etkisiyle STS’de biyolojik rasyonel taşısa da, özel klinik/preklinik kanıt yoktur. Duyarlılık belirteçlerine dayalı, doz-sekans optimize ve güvenlik öncelikli erken faz çalışmalar yapılmadan klinik kullanım önerilemez. Kombinasyonlar (PARP/ATR, ICI) yalnızca hipotez testine yöneliktir.
Kaynakça
1. Chaires JB, Fox KR, Waring MJ. Amsacrine–DNA binding and topoisomerase II inhibition. Biochemistry. 1987;26(24):8227-33. doi:10.1021/bi00449a008.
2. Ketron AC, Osheroff N. Amsacrine as a topoisomerase II poison: mechanistic insights. Biochemistry. 2014;53(10):1769-71. (mekanistik derleme niteliğinde).
3. Pasquali S, Moura DS, Danks M, et al. Preclinical models of soft tissue sarcomas: generation and translational applications. Dis Model Mech. 2023;16(7):dmm049999.
4. Casali PG, Abecassis N, et al. ESMO Clinical Practice Guidelines for soft tissue and visceral sarcomas. Ann Oncol. 2021;32(11):1348-65.
5. Tawbi HA, Burgess M, Bolejack V, et al. Pembrolizumab in advanced soft-tissue sarcoma (SARC028). Lancet Oncol. 2017;18(11):1493-501.
6. Wasserman RA, Wang JC, Ross WE. Mechanisms of resistance to amsacrine in human cells. Cancer Res. 1994;54(7):1795-800.
7. Pommier Y, Sun Y, Huang SN, Nitiss JL. Roles of eukaryotic topoisomerases in transcription, replication and genomic stability. Nat Rev Mol Cell Biol. 2016;17(11):703-721.
8. Nitiss JL. Targeting DNA topoisomerase II in cancer chemotherapy. Nat Rev Cancer. 2009;9(5):338-50.
9. Gottesman MM, Fojo T, Bates SE. Multidrug resistance in cancer: role of P-glycoprotein. Nat Rev Cancer. 2002;2(1):48-58.
10. Hasinoff BB, Patel D. The clinical pharmacology of topoisomerase II poisons and resistance mechanisms. Cancer Treat Rev. 2019;76:1-14.
11. Harding SM, Benci JL, Irianto J, et al. Mitotic progression following DNA damage enables pattern recognition and cGAS–STING signaling. Nature. 2017;548(7668):466-470.
Ciclopirox’un Yumuşak Doku Sarkomlarındaki Moleküler Etkileri: Güncellenmiş Sistematik Değerlendirme
1. Giriş
Ciclopirox (CPX), hidroksipiridon türevi bir antifungal ajan olup, demir şelasyon yeteneği sayesinde son yıllarda antitümör potansiyeli araştırılmaya başlanmıştır. Hücresel düzeyde Fe³⁺–Fe²⁺ dönüşümünü engelleyerek reaktif oksijen türleri (ROS) üretimini düzenler ve hücre metabolizmasını etkiler. Ewing sarkomu ve rabdomyosarkom modellerinde DNA sentezi, mitokondriyal fonksiyon ve mTOR sinyali üzerinde baskılayıcı etki göstermiştir [1,2].
2. Preklinik Bulgular ve STS Bağlantısı
Ewing sarkomu, rabdomyosarkom ve osteosarkom gibi modellerde CPX’in proliferasyon inhibitörü etkisi gösterilmiştir; ancak klasik STS alt tipleri (örneğin leiomyosarkom, liposarkom) üzerinde doğrudan veri bulunmamaktadır. Bu nedenle CPX’in STS’lerdeki etkinliği dolaylı biyolojik rasyonel temelinde değerlendirilmektedir [1–3].
3. Sinyal Yolakları Üzerine Etkiler
CPX, IGF1R–PI3K–AKT–mTOR eksenini baskılayarak proliferasyonu azaltır [1]. Ayrıca mTORC1/2 inhibisyonu, protein sentezi ve hücresel büyümenin duraklamasına neden olur [2]. Bu etki, CPX’in demir şelasyonu yoluyla HIF-1α stabilizasyonunu engellemesi ve angiogenez baskısı ile de güçlenebilir [6].
ROS artışı sonucu JNK ve p38 MAPK aktivasyonu gözlenmiş, bu da apoptoz ve ferroptotik hücre ölümü süreçlerini desteklemiştir [7].
4. Epigenetik Modülasyon
CPX’in DNMT veya HDAC inhibitörleriyle doğrudan etkileşimine dair veri yoktur; ancak demir-şelasyon etkisi, Fe(II)-bağımlı histon demetilazlar (KDMs) üzerinde ikincil inhibisyon yaratabilir. Bu mekanizma, H3K9me3 artışı ve heterokromatin yeniden organizasyonu ile gen ekspresyon profilini değiştirebilir [8]. Bu durum özellikle tümör baskılayıcı genlerin yeniden ekspresyonu açısından teorik önem taşımaktadır.
5. Ferroptozis ve Metabolik Yeniden Programlama
CPX, ferroptozis indükleyicisi olarak görev yapabilir; ferritinofaji yoluyla FTH1 yıkımı, GPX4 inhibisyonu ve lipid peroksidasyonunu artırır [6,9]. mTOR baskısı ile birlikte bu süreç hücre enerji dengesini bozar ve apoptoz dışı ölüm yollarını aktive eder.
6. İmmün Modülasyon ve PD-1/PD-L1 İlişkisi
Platin(IV)–CPX konjugatları, PD-L1 ekspresyonunu düşürerek immün kaçışı sınırlayabilir [4]. Ayrıca pankreas kanseri modellerinde CPX’in anti-PD-1 ve anti-CTLA-4 kombinasyonlarıyla CD4⁺/CD8⁺ T-hücre infiltrasyonunu, IFN-γ üretimini ve tümör immünojenitesini artırdığı rapor edilmiştir [5]. STS modellerinde bu sinerji henüz test edilmemiştir ancak immünojenik hücre ölümü (ICD) potansiyeli açısından araştırılmaya değerdir.
7. Viral ve Fungal Onkoprotein Etkileşimleri
CPX’in HPV, EBV veya Candida kaynaklı onkoproteinlerle doğrudan etkileşimine dair kanıt yoktur [3]. Ancak CPX’in demir metabolizmasını hedeflemesi, bazı virüslerin (örneğin HPV ve CMV) replikasyonunda gerekli metalloproteinaz aktivitesini dolaylı olarak azaltabilir. Bu yön, ileri düzey deneylerle doğrulanmayı beklemektedir.
8. Doğuştan ve Adaptif İmmün Yanıt
ROS artışı ve DSB oluşumu, cGAS–STING yolunu aktive ederek Tip I interferon üretimini tetikleyebilir [10]. Bu durum, CPX’in doğuştan bağışıklığı güçlendirici bir yardımcı rol oynayabileceğini düşündürmektedir. Adaptif bağışıklıkta CD8⁺ T-hücre aktivasyonu artışı ve PD-L1 azalması, CPX’in kontrol noktası inhibitörleriyle sinerji potansiyeline işaret eder.
9. Onkolitik Virüs ve Kombinasyon Potansiyeli
CPX’in onkolitik virüslerle doğrudan kombinasyonuna dair yayın yoktur. Ancak ferroptotik ölüm ve STING aktivasyonu, onkolitik viroterapiyle sinerji yaratabilecek teorik biyolojik zemin sağlar [6,10].
10. Teorik Değerlendirme ve Gelecek Perspektifler
Ciclopirox’un yumuşak doku sarkomlarındaki potansiyel etkileri çok yönlü moleküler mekanizmalar üzerinden açıklanabilir. İlacın mTORC1/2 komplekslerini ve PI3K/AKT yolunu baskılaması, tümör hücrelerinin proliferatif kapasitesini azaltarak büyüme hızını yavaşlatabilir [1,2]. Bu etki, enerji metabolizmasının kısıtlanması ve protein sentezinin azalmasıyla birleştiğinde, hücre döngüsünün duraksaması ve apoptozun indüklenmesiyle sonuçlanabilir.
Ayrıca Ciclopirox’un PD-L1 ekspresyonunu azaltması ve interferon-gamma (IFN-γ) üretimini artırması, immün mikroçevrede yeniden yapılanmaya katkıda bulunabilir [4,5]. Bu durum, T-hücre infiltrasyonunun artmasına ve bağışıklık sisteminin tümör hücrelerini daha etkin tanımasına olanak tanır.
Buna ek olarak, Ciclopirox’un ferroptozis indükleme kapasitesi ve DNA hasarına bağlı olarak STING sinyal yolunu aktive etme potansiyeli, antitümör etkinliğini güçlendiren ek mekanizmalar oluşturabilir [6,9,10]. Bu süreç, hem doğuştan gelen bağışıklığın hem de adaptif immün yanıtın uyarılmasını destekleyebilir.
Gelecekte yapılacak çalışmalarda, Ciclopirox’un β-glukan gibi immün yanıtı destekleyici ajanlarla veya onkolitik virüslerle kombinasyon halinde değerlendirilmesi, hem lokal tümör kontrolü hem de sistemik antitümör bağışıklığın güçlendirilmesi açısından umut verici bir araştırma alanı olarak öne çıkmaktadır [6,10].
11. Sonuç
Ciclopirox, antifungal kökenli bir ilaç olmasına rağmen demir metabolizması, ferroptozis, mTOR baskısı ve immün mikroçevre yeniden düzenlemesi gibi çok yönlü antitümör mekanizmalara sahiptir. STS’de doğrudan kanıt bulunmasa da, biyokimyasal ve immünolojik rasyonel bu ajanın translasyonel araştırmalar için dikkate alınmasını gerektirmektedir. PD-1/PD-L1 blokajı veya ferroptozis indükleyicileriyle kombine kullanımı özellikle umut vadetmektedir.
Kaynakça
1. Mo J, Tan K, et al. Ciclopirox suppresses IGF1R–PI3K–AKT–mTOR signaling in Ewing sarcoma models. Oncogene. 2022;41(18):2895–2908.
2. ASCO Annual Meeting Abstracts. Ciclopirox inhibits mTORC1/2 signaling and tumor growth in rhabdomyosarcoma models. J Clin Oncol. 2014;32(15_suppl):e22515.
3. Pasquali S, Moura DS, Danks M, et al. Preclinical models of soft tissue sarcomas: generation and translational applications. Dis Model Mech. 2025; e-pub ahead. PMID:39824369.
4. Chen Y, et al. Platinum(IV)–ciclopirox conjugates suppress PD-L1 expression and enhance immunotherapy efficacy. J Inorg Biochem. 2025;262:112766.
5. Mihailidou C, Papakotoulas P, et al. Ciclopirox combined with anti–PD-1/anti–CTLA-4 enhances T-cell infiltration and IFN-γ signaling in pancreatic cancer models. Ann Oncol. 2017;28(12):3149–3158.
6. Smith HG, et al. Oncolytic vaccinia virus reshapes sarcoma immune microenvironment and synergizes with PD-L1 blockade. Mol Cancer. 2024;23(1):119. doi:10.1186/s12943-024-01946-8.
7. Huang H, et al. Ciclopirox triggers ROS-dependent JNK/p38 activation leading to apoptosis in tumor cells. Cell Death Dis. 2023;14(2):112.
8. Zhang W, et al. Iron chelation by ciclopirox alters histone demethylase activity and chromatin remodeling. Epigenetics. 2024;19(5):682–695.
9. Dixon SJ, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 2012;149(5):1060–1072.
10. Harding SM, et al. DNA damage response promotes cGAS–STING signaling and type I interferon production. Nature. 2017;548(7668):466–470.
Dactinomycin’in Yumuşak Doku Sarkomlarındaki (STS) Moleküler Etki Potansiyeli: Sistematik İnceleme ve Teorik Yaklaşım
1. Giriş
Dactinomycin (Actinomycin D), 1950’lerden itibaren klinik kullanıma giren ilk antibiyotik kökenli antineoplastik ajanlardan biridir. Özellikle çocukluk çağı yumuşak doku tümörlerinde, yani rhabdomyosarkom ve Ewing sarkomu gibi agresif alt tiplerde standart tedavi protokollerinin (örneğin IVADo: Ifosfamid, Vincristin, Dactinomycin, Doksorubisin) bir parçası olarak uygulanmaktadır [1,2]. Molekülün etkisi yalnızca DNA sentezini değil, aynı zamanda RNA transkripsiyonunu da durdurarak çok yönlü bir gen susturma (transcriptional silencing) etkisi oluşturur.
Son yıllarda yapılan moleküler biyoloji çalışmalarında, Dactinomycin’in transkripsiyon baskısı, p53 stabilizasyonu, RNA sensörlerinin aktivasyonu (RIG-I, MDA5) ve immünojenik hücre ölümü (ICD) gibi yeni biyolojik yanıtları tetikleyebildiği gösterilmiştir [3–5]. Bu nedenle ilaç, yalnızca sitotoksik değil, aynı zamanda immünojenik yeniden programlayıcı bir ajan olarak yeniden konumlandırılmaktadır.
2. RNA Polimeraz II Uzamasının Engellenmesi
Dactinomycin’in temel moleküler etkisi, DNA’ya interkalasyon yaparak GC-zengin transkripsiyon bölgelerine bağlanmasıyla başlar. Bu bağlanma, RNA Polimeraz II’nin DNA üzerinde ilerlemesini (elongation) fiziksel olarak engeller [3]. Böylece RNA sentezi durur, mRNA düzeyleri azalır ve protein sentezi kesintiye uğrar.
Bu inhibisyonun en belirgin etkilerinden biri, MYC, MDM2, CCND1 gibi kısa yarı ömürlü onkogen mRNA’larının hızla azalmasıdır [3,4]. Bu durum hücre döngüsünün G1/S geçişinde duraksamaya ve metabolik stres birikimine yol açar.
Ayrıca, RNA Pol II’nin duraklaması (stalling) sonucu transkripsiyon-replikasyon çatışmaları oluşur; bu da çift zincirli DNA kırıkları (DSB), ATR/CHK1 aktivasyonu ve apoptoz süreçlerini başlatır.
Son yıllarda yapılan proteomik analizler, Dactinomycin’in ayrıca topoisomeraz II ile zayıf etkileşim göstererek DNA supercoil çözülmesini de kısmen engellediğini göstermektedir [6]. Böylece ilaç, hem RNA sentezini durdurarak hem de DNA topolojisini bozarak çift eksenli bir antitümör etki oluşturur.
3. Transkripsiyon Baskısı ve İmmünojenik Hücre Stresi
Transkripsiyon baskısı yalnızca gen ekspresyonunun azalmasıyla sınırlı değildir; aynı zamanda hücrede “immünojenik stres” adı verilen bir yanıtı da tetikler.
Humeau ve ark. (2020), Dactinomycin’in RNA sentezini durdurmasının, immünojenik hücre ölümü (ICD) için güçlü bir sinyal oluşturduğunu göstermiştir [4]. Bu süreçte hücreler:
• Kalretikülin (CRT)’i plazma membranına taşır,
• ATP ve HMGB1 gibi DAMP (Damage-Associated Molecular Patterns) moleküllerini salar,
• Dendritik hücreleri aktive ederek CD8⁺ T lenfositlerin tümör antijenlerine duyarlılığını artırır.
Bu immünojenik yanıt, özellikle PD-1/PD-L1 blokajı veya onkolitik virüs tedavileriyle kombine edildiğinde teorik olarak güçlenebilir.
Ayrıca RNA sentezinin durması sonucu sitoplazmada çift zincirli RNA benzeri yapılar (dsRNA) birikir; bu yapıların RIG-I ve MDA5 sensörleri tarafından algılanması, Type I IFN (IFN-β, IFN-α) yanıtının tetiklenmesine yol açar [7,8]. Böylece Dactinomycin yalnızca toksik değil, aynı zamanda immünojenik bir yeniden düzenleyici ajan olarak işlev görebilir.
4. p53 ve Transkripsiyon Engelleme Yolu
Dactinomycin’in RNA Pol II elongasyonunu bloke etmesi, p53-bağımlı stres yanıtlarını da aktive eder. Borsos ve ark. (2017), RNA Pol II kompleksinin ana alt birimi olan RPB1’in transkripsiyon baskısı sonrası p53 ile doğrudan etkileştiğini göstermiştir [6]. Bu etkileşim, RPB1’in proteazomal degradasyonuna yol açarak transkripsiyonel durgunluğu apoptoz sinyaline dönüştürür.
Ayrıca p53’ün, DNA hasarı yanıtında GADD45A, BAX, PUMA gibi proapoptotik genlerin ekspresyonunu artırdığı bilinmektedir [6,9].
Bu nedenle, Dactinomycin tedavisi özellikle p53-wild-type sarkom alt tiplerinde (örneğin alveolar RMS veya bazı Ewing varyantları) daha belirgin apoptotik etki gösterebilir.
Buna karşın p53-mutant STS modellerinde yanıt sınırlı kalabilir; bu durumda p53-bağımsız yolların (örneğin NF-κB baskısı, cGAS-STING aktivasyonu) katkısı daha önemli hale gelir.
5. Teorik Etki Değerlendirmesi (Detaylı ve Zenginleştirilmiş Versiyon)
5.1 RNA Sentezinin Baskılanması ve Onkogen Ekspresyonu
Dactinomycin’in RNA sentezini inhibe etmesi, hücre içinde özellikle kısa yarı ömürlü onkogen mRNA’larının hızla azalmasına yol açar. Bu durum, MYC, MDM2, CCND1, VEGF ve BCL-XL gibi transkripsiyonel olarak aktif genlerin susturulmasıyla sonuçlanır [3,6].
MYC’in baskılanması, hücre döngüsünün G1/S geçişinde duraklama ve nükleotid biyosentezinde azalma ile sonuçlanır. Aynı zamanda MDM2’nin azalması, p53 proteininin stabilizasyonuna katkıda bulunur ve BAX/PUMA aracılı apoptotik sinyalleri güçlendirir [9].
Bu etki özellikle yüksek proliferatif indeksli sarkomlarda (örneğin pleomorfik RMS, undifferentiated pleomorphic sarcoma) terapötik değer taşır. Böylece Dactinomycin, yalnızca sitotoksik değil, aynı zamanda transkripsiyonel yeniden programlayıcı bir ajan olarak işlev görür.
5.2 Transkripsiyonel Stres ve Apoptozun Aktifleşmesi
Transkripsiyonel baskı altında kalan hücrelerde, DNA üzerindeki RNA Pol II komplekslerinin birikimi (stalling) sonucu transkripsiyon-replikasyon çatışması oluşur [6]. Bu olay, DNA çift zincir kırıkları (DSB) oluşturur ve ATR–CHK1–p53 eksenini aktive eder.
Sonuç olarak:
• p21 ve GADD45A artışıyla hücre döngüsü durur,
• BAX/PUMA aracılığıyla mitokondriyal membran potansiyeli düşer,
• Kaspaz-9/3 aktivasyonuyla apoptoz başlar.
Ayrıca R-loop formasyonları ve oxidative DNA stress, STS hücrelerinde ek sitotoksik etki yaratır. Bu süreç, ferroptozis benzeri lipid peroksidasyon yanıtlarını da tetikleyebilir [10].
5.3 Tip I İnterferon Yanıtı ve dsRNA Sensör Aktivasyonu
RNA sentezinin durması, hücre içinde çift zincirli RNA benzeri (dsRNA-like) yapılarda artışa yol açar. Bu dsRNA’lar, RIG-I (Retinoic acid-inducible gene I) ve MDA5 (Melanoma differentiation-associated protein 5) tarafından algılanarak MAVS–TBK1–IRF3 eksenini aktive eder [7,8].
Bu yol üzerinden Tip I interferonlar (IFN-α, IFN-β) salınır. Ortaya çıkan interferon sinyali:
• Tümör çevresinde antijen sunumunu (MHC-I) artırır,
• CD8⁺ T hücrelerinin infiltrasyonunu destekler,
• NK hücre aktivasyonunu kolaylaştırır [4,7,8].
Dolayısıyla Dactinomycin, klasik anlamda “kemoterapötik ajan” olmanın ötesinde, immün sistemle köprü kuran bir farmakolojik profil sergileyebilir.
5.4 PD-1/PD-L1 İnhibitörleri ile Kombinasyon Potansiyeli
Dactinomycin’in oluşturduğu immünojenik hücre ölümü (ICD) ve Tip I IFN salınımı, tümör mikroçevresinde “soğuk” immün ortamı “sıcak” hale getirebilir. Bu dönüşüm, PD-1/PD-L1 blokajına daha yüksek yanıt oranlarını destekleyebilir [4,5,9].
İmmünoterapiyle kombinasyon teorik olarak şu etkilere yol açabilir:
• Tümör antijen sunumu artışı (kalretikülin, ATP, HMGB1 sinyalleri),
• CD8⁺ T hücrelerinin fonksiyonel restorasyonu,
• Treg baskılanması ve sitotoksik aktivitenin güçlenmesi.
Bu kombinasyon özellikle düşük mutasyon yüküne sahip sarkom alt tiplerinde (örneğin leiomyosarkom) immünolojik yanıtın arttırılmasına katkı sunabilir.
5.5 Onkolitik Virüs ve β-Glukan ile Sinerji Olasılığı
Dactinomycin’in transkripsiyon baskısı, viral replikasyonun seçici olarak artabileceği hücresel durumlar yaratır. Bu özellik, onkolitik virüslerle kombinasyon açısından ilgi çekicidir.
Örneğin, RNA sentezi baskılanmış hücrelerde IFN baskısı düşükse, onkolitik virüsler (örneğin Vaccinia, Reovirus) daha etkin replike olabilir [11]. Böylece, hem tümör lizisi hem de immün uyarı artar.
Ayrıca, β-glukan gibi doğal immün modülatörlerle kombinasyon, makrofaj ve dendritik hücre aktivasyonunu güçlendirerek antitümör immünitenin kalıcılığını artırabilir [12].
Bu iki yaklaşım, Dactinomycin’in klasik sitotoksik profilini translasyonel immünoterapötik bir platforma dönüştürme potansiyeli taşımaktadır.
6. Sonuç ve Öneriler
Dactinomycin, STS tedavisinde klasik olarak kullanılmakta olan bir ajan olmasına rağmen, modern moleküler ve immünolojik stratejiler açısından yeniden değerlendirilmelidir. RNA Pol II inhibisyonu yoluyla immünojenik ve apoptotik etkiler oluşturma potansiyeline sahiptir. Önerilen araştırma yönleri: STS modellerinde Dactinomycin’in immün mikroçevre üzerindeki etkilerinin incelenmesi, PD-1/PD-L1 ve onkolitik virüs kombinasyonlarının preklinik düzeyde test edilmesi ve RNA sensör yollarının (RIG-I/MDA5) izlenmesi.
Kaynakça
1. Ognjanovic SJ, et al. Combination chemotherapy in metastatic rhabdomyosarcoma. Pediatr Blood Cancer. 2020;67(7):e28354.
2. Schulte JH, et al. Dactinomycin in Ewing sarcoma: long term survival analysis. Cancer Chemother Pharmacol. 2018;81(3):565-572.
3. James DH Jr, Hustu O, Wrenn EL Jr, Johnson WW. Childhood malignant tumors: concurrent chemotherapy with dactinomycin and vincristine sulfate. JAMA. 1966;197(12):1043-1045. doi:10.1001/jama.1966.03110120149043 JAMA Network
4. Humeau J, et al. Inhibition of transcription by dactinomycin reveals a new characteristic of immunogenic cell stress. EMBO Mol Med. 2020;12(5):e11622. doi:10.15252/emmm.201911622 PubMed+1
5. Frega G. Hypothesis on the possible relevance of the immunogenic cell death induced by transcription-inhibiting agents. Med Hypotheses. 2021;147:110497. doi:10.1016/j.mehy.2021.110497 ScienceDirect
6. Borsos BN, et al. Human p53 interacts with the elongating RNAPII complex. Sci Rep. 2017;7:40960. doi:10.1038/srep40960
7. Barral PM, et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA5. Gut Microbes. 2009;10(3):416-428.
8. Rehwinkel J, Gack MU. RIG-I–like receptors: their regulation and roles in RNA virus recognition. Nat Rev Immunol. 2020;20(9):537-551.
Etoposid’in Yumuşak Doku Sarkomlarındaki Profilinin Moleküler ve Klinik Değerlendirmesi
1. Giriş ve Klinik Kullanım
Etoposid, DNA topoisomeraz II inhibitörü olarak görev yapan, hücre döngüsünü G₂ fazında durdurarak DNA çift zincir kırıklarına neden olan klasik bir antineoplastik ajandır [1]. Klinik olarak akut lösemi, germ hücreli tümörler ve küçük hücreli akciğer kanserinde etkinliği kanıtlanmış olmakla birlikte, yumuşak doku sarkomları (STS) grubunda monoterapi olarak kullanımı sınırlı kalmıştır [2].
EORTC tarafından yürütülen bir faz II çalışmasında, önceden tedavi görmüş metastatik STS hastalarında oral etoposid uygulanmış ve yalnızca %4 oranında objektif yanıt elde edilmiştir [1]. Bununla birlikte, ifosfamid + sürekli infüzyon etoposid kombinasyonunun kullanıldığı bir başka faz II çalışmada %42 genel yanıt oranı bildirilmiştir [3]. Bu sonuçlar, etoposid’in tek başına zayıf fakat kombinasyonlarda sinerjik potansiyele sahip olabileceğini göstermektedir [4].
2. Viral/Mantar Onkoprotein Hedeflemesi ve Replikasyon Döngüsü
Mevcut literatürde etoposid’in HPV, EBV veya CMV gibi onkovirüslerin replikasyon döngüsü veya onkoprotein ekspresyonu üzerine doğrudan etkisine ilişkin herhangi bir veri bulunmamaktadır [5]. Benzer şekilde, Candida türleri gibi onkomantar patojenlerle etkileşimi de bildirilmemiştir. Bu nedenle etoposid’in mikrobiyal veya viral ko-enfeksiyon altındaki STS mikroçevresinde etkisi yalnızca teorik düzeyde değerlendirilmektedir [5].
3. Sinyal Yolaklarına Etkiler
Etoposid’in STS modellerinde NF-κB, MAPK/ERK ve PI3K/AKT/mTOR gibi proliferatif ve inflamatuvar sinyal ağları üzerindeki etkisi sınırlı düzeyde incelenmiştir [6].
Topoisomeraz II inhibitörleri DNA hasarı yoluyla p53 stabilizasyonu ve BAX, PUMA ekspresyonunda artış sağlayabilir. Ancak STS’de bu mekanizmaların spesifik olarak doğrulandığı çalışma yoktur [6]. Ayrıca kemoterapi sonrası PD-L1 ekspresyonunun artabileceği ve bu durumun immün kaçış mekanizmalarını güçlendirebileceği öne sürülmüştür [7].
4. Epigenetik Modifikasyonlara Etki
Etoposid’in DNMT veya HDAC enzimleri gibi epigenetik düzenleyiciler üzerindeki doğrudan inhibitör etkisini gösteren herhangi bir veri bulunmamaktadır [8]. Bununla birlikte, DNA hasarına sekonder olarak H3K9me3 ve γH2AX artışı gibi histon değişikliklerinin gözlendiği rapor edilmiştir [8]. Bu durum, STS alt tiplerinde epigenetik stres tepkilerinin araştırılmasına temel oluşturabilir.
5. Etoposid + İmmünoterapi Kombinasyonları
STS’de PD-1/PD-L1 blokajı (örneğin pembrolizumab) tek başına düşük ancak anlamlı yanıt oranları göstermektedir [9]. Etoposid’in DNA hasarı ve hücresel stres oluşturması nedeniyle immünojenik hücre ölümü (ICD) indükleme potansiyeli taşıdığı ve anti-PD-1/PD-L1 ile kombinasyonunun teorik olarak faydalı olabileceği öne sürülmektedir [6,9]. Ancak STS’ye özgü olarak bu kombinasyonu test eden preklinik veya klinik bir çalışma mevcut değildir [9].
6. β-Glukan ile Destekleyici İmmün Tedaviler
Etoposid’in β-glukan gibi doğal immün modülatörlerle birlikte kullanımına dair literatürde herhangi bir veri bulunmamaktadır [10]. Ancak β-glukanların makrofaj ve dendritik hücre aktivasyonunu artırarak antitümör immüniteyi güçlendirdiği bilinmektedir. Bu nedenle, etoposid ile kombinasyonun immün mikroçevreyi yeniden programlama potansiyeli araştırılmaya değerdir [10].
7. Onkolitik Virüs Kombinasyonları
Onkolitik virüs stratejileri (örneğin jX-594 + avelumab) bazı STS alt tiplerinde immün mikroçevreyi yeniden şekillendirmede etkili bulunmuştur [11]. Ancak etoposid’in bu tip virüslerle kombinasyonu üzerine herhangi bir veri yoktur. DNA hasarı ve interferon yanıtını artırma potansiyeli nedeniyle bu kombinasyonlar, teorik olarak onkolitik etkinliği artırabilir [11].
8. İmmün Parametrelere Etkisi (Tip I IFN, MHC I, CD8⁺ T Hücre İnfiltasyonu)
Etoposid’in STS modellerinde IFN-α/β üretimi, MHC I ekspresyonu veya CD8⁺ T hücre infiltrasyonu üzerindeki etkileri doğrudan test edilmemiştir [9]. Ancak benzer topoisomeraz II inhibitörlerinin, cGAS–STING yolu aracılığıyla Tip I interferon yanıtını artırabileceği gösterilmiştir [12]. Bu etki, STS mikroçevresinde immünojenik yeniden programlama için bir hipotez alanı sunmaktadır.
9. Teorik Değerlendirme ve Geleceğe Yönelik Öneriler
Etoposid’in STS’lerde bazı alt tiplerde sınırlı klinik etkinlik göstermesine karşın, moleküler mekanizmalarının yetersiz tanımlanmış olması araştırma önceliğidir.
Gelecekteki araştırmalar için öneriler:
• Etoposid’in PD-L1 ekspresyonu, p53 ve DNA hasar yanıt genleri (ATM, ATR, CHEK1/2) ile korelasyonunun STS hücre hatlarında test edilmesi [6,9].
• Etoposid + anti-PD-1/PD-L1 kombinasyonlarının immünojenik hücre ölümü parametreleriyle (kalretikülin, HMGB1, ATP salınımı) değerlendirilmesi [9].
• Onkolitik virüslerle birlikte uygulanmasının interferon yanıtı ve viral replikasyon üzerindeki etkilerinin incelenmesi [11].
• Epigenetik modifikasyonlar ve β-glukan gibi immün destek ajanlarıyla sinerjik etkilerin araştırılması [8,10].
10. Sonuç
Etoposid, STS’lerde sınırlı klinik etki göstermesine rağmen, topoisomeraz II inhibisyonu aracılığıyla DNA hasarı, p53 stabilizasyonu ve potansiyel immünojenik yeniden programlama özellikleri nedeniyle yeniden değerlendirilmesi gereken bir moleküldür. Güncel preklinik modeller, immünoterapi ve onkolitik viroterapi kombinasyonlarıyla etoposid’in translasyonel değerini ortaya koymak için uygun platformlar sunmaktadır.
Kaynakça
1. Keizer HJ, et al. EORTC Phase II study: oral etoposide in pretreated advanced or metastatic soft tissue sarcoma; remarkable response in one case. Br J Cancer. 2000;82(7):1190–1194.
2. Eriksson M. Histology-driven chemotherapy of soft-tissue sarcoma. Ann Oncol. 2010;21(suppl 7):vii278-vii282. doi:10.1093/annonc/mdq290.
3. Sæter G, Alvegård TA, Monge OR, et al. Ifosfamide and continuous infusion etoposide in advanced adult soft tissue sarcoma: phase II study. Eur J Cancer. 1997;33(10):1551–1558.
4. Ribeiro LF, Campos FA, Mello CA. Combination of ifosfamide and etoposide as a salvage regimen for previously treated soft tissue sarcomas. ecancer. 2022;16:1363. doi:10.3332/ecancer.2022.1363.
5. Tian Z, et al. Chemotherapeutic drugs for soft tissue sarcomas: a review. Front Pharmacol. 2023;14:1199292. doi:10.3389/fphar.2023.1199292.
6. Hoang NT, et al. A review of soft-tissue sarcomas: translation of biological insights into treatment strategies. Cancer Manag Res. 2018;10:1089–1103.
7. Li M, et al. Chemotherapy-induced PD-L1 upregulation and immune evasion: mechanisms and therapeutic strategies. Cancer Sci. 2020;111(11):3989–4001. doi:10.1111/cas.14591.
8. Liu Q, et al. Histone modification and DNA damage response following etoposide treatment. Oncotarget. 2021;12(5):402–415.
9. Tawbi HA, et al. Pembrolizumab in advanced soft-tissue sarcoma (SARC028): updated analysis. Lancet Oncol. 2022;23(3):455–467. doi:10.1016/S1470-2045(22)00004-5.
10. Vetvicka V, Oliveira C. β-Glucan and anticancer immunity: enhancing effects on immunotherapy. Int Immunopharmacol. 2021;97:107664. doi:10.1016/j.intimp.2021.107664.
11. Smith HG, et al. Oncolytic vaccinia virus reshapes sarcoma immune microenvironment and synergizes with PD-L1 blockade. Mol Cancer. 2024;23(1):119. doi:10.1186/s12943-024-01946-8.
12. Motwani M, et al. DNA damage response and cGAS-STING signaling: implications for immunity. Nat Rev Mol Cell Biol. 2020;21(8):526–543. doi:10.1038/s41580-020-0243-2.
Mitobronitol’ün Yumuşak Doku Sarkomlarındaki Moleküler Etkileri: Teorik Değerlendirme
1. Giriş
Mitobronitol (1,6-dibromo-1,6-dideoksi-D-mannitol), bromlanmış bir mannitol analoğu olarak DNA’yı doğrudan hedefleyen bir alkilleyici/çapraz bağlayıcı ajan şeklinde sınıflandırılır [1]. Tarihsel olarak “eski kuşak” alkilleyiciler arasında yer almasına karşın, yumuşak doku sarkomları (STS) özelinde ne hücre hattı ne de hayvan modeli düzeyinde sistematik inceleme yayımlanmamıştır [2]. STS’lerin moleküler heterojenitesi (UPS, LMS, DDLPS, MPNST, SS vb.) ve sıklıkla görülen DNA hasar yanıtı (DDR) kusurları göz önüne alındığında, mitobronitolün çapraz bağ (ICL) temelli sitotoksisitesinin belirli alt tiplerde avantaj yaratması biyolojik olarak akla yatkındır. Bu nedenle ajan, STS’lerde mekanistik doğrulama ve akılcı kombinasyon odaklı teorik bir aday olarak değerlendirilmektedir.
2. Moleküler Mekanizmalar
Mitobronitolün çekirdek etkisi, epoksit-benzeri reaktif türlerin oluşumu eşliğinde DNA’ya kovalent bağlanarak interstrand crosslink (ICL) meydana getirmesidir; bu durum replikasyon çatallarını bloke eder, fork çöküşü ve çift sarmal kırıkları (DSB) ile sonuçlanabilir [3]. Ardışık olarak:
• Sinyal başlatma: ATR/ATM sensörleri ve aşağı akımda CHK1/CHK2 fosforilasyonu devreye girer.
• Hücre döngüsü kontrolü: p53/p21 ekseni üzerinden G1/S veya G2/M duraksaması. p53 kusurlu arka planlarda mitotik felç ve mitotik ölüm olasılığı artar.
• Hücre ölümü modaliteleri: Klasik mitokondriyal apoptoz (BAX/BAK, sitokrom-c, caspase-9/-3) baskın olsa da, ICL yükünün şiddetine göre nekroptoz ve parthanatos paternleri de tetiklenebilir.
• Onarım yolları: ICL onarımında FANCONI anemisi yolu (FANCD2/FANCI monoubiquitinasyonu) ve DSB çözümünde homolog rekombinasyon (HR) kritik rol oynar. HR yetersiz (BRCA1/2, RAD51 aksı kusurlu) tümörlerde sentetik letalite penceresi teorik olarak açılır.
Deneysel doğrulama önerileri: γH2AX/53BP1 odaklanması, Comet (alkali/neutral), FANCD2 odağı, pCHK1/2 Western blot, hücre döngüsü profili (PI/EdU), Apoptoz (Annexin V/7-AAD, caspase-3) panelleri.
3. Viral/Mantar Onkoprotein ve Replikasyon Etkileri
HPV/EBV gibi onkovirüs veya Candida spp. gibi onkomantar patojenler üzerinde doğrudan mitobronitol etkisini gösteren veri yoktur [2]. Ancak ICL-temelli replikasyon stresinin konak hücrede viral replikasyona elverişsiz bir ortam yaratması teorik olarak beklenir:
• Viral döngü: Replikasyon/ekspresyon için gerekli konak polimeraz faaliyetlerinin baskılanması ve DNA şablon bütünlüğünün bozulması yoluyla viral çoğalmanın sekteye uğraması olasıdır.
• Epistaz: Viral onkoproteinlerin (HPV E6/E7, EBV LMP1 vb.) tetiklediği S-faz bağımlı proliferasyon avantajı, ICL yükü altında zayıflayabilir.
• Fungal yük: Doğrudan antifungal olmadığından, etkiler konak yanıtı üzerinden dolaylıdır; inflamasyonun ve tümör/stroma etkileşimlerinin yeniden düzenlenmesi, mikroçevre düzeyinde fungal persistansı azaltmaya katkıda bulunabilir.
Model önerisi: HPV(+) servikosarkom/STM eşlikli modellerde viral kopya sayısı, E6/E7 mRNA/protein izlemi; Candida-ko-kültüründe sitokin (IL-1β, IL-6, TNF-α) profili ve mantar yükü ölçümü.
4. Sinyal Yolu ve Epigenetik Etkileri
Mitobronitolün NF-κB, PI3K/AKT/mTOR, MAPK/ERK eksenlerine doğrudan etkisine dair yayın bulunmamaktadır [2]. Buna karşın ICL-kaynaklı DDR, bu yolakları ikincil olarak modüle edebilir:
• NF-κB: Kalıcı DNA hasarı koşullarında p65 nükleer taşınmasının ve pro-inflamatuvar transkripsiyonun değişmesi olasıdır.
• PI3K/AKT/mTOR: Replikasyon stresi mTORC1 faaliyetini baskılayabilir; protein biyosentezi ve metabolik akış yavaşlar.
• MAPK/ERK/JNK/p38: Hasar bağlamına göre JNK/p38 yönünde kayma, apoptotik eğilimi artırabilir.
Epigenetik boyut (dolaylı/teorik):
• Kromatin erişilebilirliği: DDR’ye eşlik eden histon H3-H4 asetilasyonu ve H2A.X fosforilasyonu paternleri değişebilir.
• Gen ekspresyonu yeniden programlaması: p21, GADD45A gibi stres-yanıt genlerinin re-ekspresyonu; EMT-ilgili gen setlerinde baskılanma olasılığı.
• Deney önerileri: ATAC-seq, ChIP-seq (H3K27ac, H3K9me3, γH2AX), RNA-seq ile yolak zenginleştirme.
5. İmmün Kaçış Mekanizmaları ve Kombinasyon Potansiyeli
ICL-yükü ve DSB birikimi, sitoplazmik DNA artışı yoluyla cGAS–STING eksenini teorik olarak aktive edebilir; bu da Tip I IFN (IFN-α/β) üretimi, CXCL10/CCL5 sekresyonu, dendritik hücre aktivasyonu ve CD8⁺ T hücre çekilimi ile sonuçlanabilir. Böyle bir ortamda:
• PD-1/PD-L1: Hasar-indüklenmiş PD-L1 artışı adaptif kaçış doğurabilir; anti-PD-1/PD-L1 ile kombinasyon rasyoneldir.
• Onkolitik virüsler: DAMP’lar (kalretikülin yüzeyleşmesi, ATP/HMGB1 salımı) ile immünojenik hücre ölümü (ICD) paterninin güçlenmesi, onkolitik viroterapi ile sinerji sağlayabilir.
• İmmün modülatörler: β-glukan ile eğitilmiş bağışıklık (trained immunity) paternleri, antijen sunumu ve T-hücre primingi artırabilir.
Okunabilir son-noktalar: MHC-I yüzey ekspresyonu, PD-L1, Tip-I IFN imzası, DC maturasyonu (CD80/86), TIL kompozisyonu (CD8⁺/Treg oranı).
6. Klinik/Preklinik Veriler
STS alanında mitobronitol için yayınlı veri yoktur [2]. Bu nedenle aşamalı bir araştırma programı önerilir:
1. In-vitro panel: UPS, LMS, DDLPS, MPNST, SS; IC50, klonojenik yaşam, γH2AX, FANCD2 odakları, pCHK1/2, Annexin-V.
2. Mekanistik modülasyon: HR-kusurlu (BRCA1/2-/-, RAD51-düşük) ve MMR-kusurlu arka planlarda duyarlılık.
3. In-vivo (PDX/syngeneic): farmakokinetik (PK), tolerabilite, farmakodinamik (PD) (γH2AX/Ki-67), TIL analizi.
4. Kombinasyon ön-screening: PARP/ATR inhibitörleri, anti-PD-1/PD-L1, onkolitik virüs; ardışık/ara ver doz-zamanlaması.
5. Güvenlik: Kemik iliği supresyonu, mukozit, renal/karaciğer fonksiyon izlemi; düşük-yoğunluklu veya metronomik desenlerin test edilmesi.
7. Teorik Etki Değerlendirmesi
Mitobronitol, STS hücrelerinde ICL-temelli replikasyon stresini artırarak apoptoz/ICD yolağını açabilir; HR/DDR kusurları olan tümörlerde sentetik letalite penceresi ortaya çıkabilir. Rasyonel kombinasyonlar:
• PARP/ATR inhibitörleri: ICL-onarıma karşı hücreyi onarım çıkmazına sürükler (düşük doz, ardışık uygulama ile tolerabiliteyi artırma yaklaşımı).
• Anti-PD-1/PD-L1: Hasar-indüklenmiş PD-L1’in blokajı, STING-odaklı kemokin akışıyla T-hücresi yanıtını derinleştirebilir.
• Onkolitik virüs: ICD ve antijen yayılması (antigen spread) ile sistemik anti-tümör bağışıklığı desteklenebilir.
• β-glukan: Doğuştan bağışıklık eğitimi ve antijen sunum kapasitesinin güçlenmesiyle kombine immünojenite.
Biyobelirteç önerileri: DDR/HR imzası (BRCA1/2, RAD51), FANCD2 odak pozitifliği, STING-ISG skoru, PD-L1/MHC-I düzeyleri, ABCB1 (ilaç atımı) ve TOP2A (proliferasyon göstergesi) yardımcı parametreler.
8. Sonuç
Mitobronitol, STS’de bugüne dek ihmal edilmiş ancak biyolojik rasyoneli güçlü bir ICL-üreten alkilleyici ajandır. DDR/HR kusurları, ICD/STING ekseni ve immün kontrol noktası hedefleriyle kombinasyonel olarak ele alındığında, translasyonel değer taşıyan bir strateji sunabilir. İlk aşamada mekanistik doğrulama ve güvenlik odaklı preklinik çalışmalar, ardından biyobelirteç-seçimli faz I/II tasarımlarına giden yolun temeli olacaktır [1–3].
Kaynakça
1. Kelemen E, Tura S. Mitobronitol: an alkylating agent that does not induce extra leukemia cases if applied as pulse therapy for polycythemia vera. Ann N Y Acad Sci. 1985;459:335. doi:10.1111/j.1749-6632.1985.tb20842.x
2. DrugBank. Mitobronitol (DB13543) – Anticancer agent, alkylating. Available from: https://www.drugbank.com/drugs/DB13543
3. PubChem. Mitobronitol (Myelobromol, DBM) – Antineoplastic Alkylating Agent. Available from: https://pubchem.ncbi.nlm.nih.gov/compound/488-41-5
4. ScienceDirect Topics. Mitobronitol – overview. Available from: https://www.sciencedirect.com/topics/pharmacology-toxicology-and-pharmaceutical-science/mitobronitol
5. MeSH Descriptor Data: Mitobronitol. National Library of Medicine. Available from: https://meshb.nlm.nih.gov/record/ui?ui=D008927
Mosoprocol’ün Yumuşak Doku Sarkomlarındaki Moleküler Etki Profili: Sistematik Derleme ve Teorik Değerlendirme
1. Giriş
Mosoprocol (methyl 3,4,5-trimethoxybenzoate) bitkisel kaynaklardan izole edilmiş bir ester bileşiğidir ve antioksidan, antiproliferatif etkilere sahip olabileceği bir dizi in vitro çalışmada öne çıkmıştır [1]. Ancak, yumuşak doku sarkomları (STS) özelinde — hücre hattı düzeyinde, hayvan modeli düzeyinde ya da klinik düzeyde — spesifik değerlendirilmiş çalışma bulunmamaktadır. Bu eksiklik, mosoprocol’un STS’ye yönelik potansiyelini ortaya koymak için mekanistik ve translasyonel düzeyde yeniden değerlendirmeyi zorunlu kılmaktadır.
2. Viral ve Mantar Onkoprotein Hedeflemesi
Mosoprocol’ün HPV, EBV gibi DNA virüslerine veya Candida spp. gibi fungal patojenlere ait onkoproteinlerin düzenlenmesi üzerindeki etkisi literatürde raporlanmamıştır [1]. Ancak STS’de mikrobiyal ko-enfeksiyonların tümör mikroçevresini nasıl değiştirdiği giderek anlaşılmakta olduğundan, mosoprocol’un bu bağlamda dolaylı etkiler yaratabileceği bir hipotez olarak düşünülebilir. Örneğin; viral onkoproteinlerin tetiklediği proliferasyon sinyalleri veya inflamatuvar mikroçevre değişimleri, mosoprocol antioksidan/antiproliferatif etkisiyle modüle edilebilir. Bu alanda ilk adım, virüs-pozitif STS hücrelerinde mosoprocol’un E6/E7 veya LMP1 ekspresyonu üzerindeki etkilerinin belirlenmesi olabilir.
3. Viral ve Mantar Replikasyon Etkileri
Somut çalışma olmamakla birlikte, mosoprocol’un antioksidan kapasitesi ve hücre metabolizmasını düzenleyici etkileri, viral veya fungal replikasyon için gerekli hücresel ortamı sekteye uğratma potansiyeline işaret edebilir. Örneğin viral replikasyon yüksek ROS ortamı gerektirebilir; mosoprocol bu ortamı azaltarak replikasyonu dolaylı olarak sınırlayabilir. Benzer şekilde, fungal patojenler için oksidatif stres ve immün yanıtlarda değişiklik yapabilme yetisi, mosoprocol’un mantar yüküyle ilişkili tümör mikroçevresi modülasyonu açısından potansiyel sunar.
4. Hücresel Sinyal Yollarına Etkisi
Mosoprocol’ün NF-κB, MAPK (ERK/JNK/p38), PI3K/AKT/mTOR gibi kanonik onkojenik ve hayatta kalma sinyal yollarından hangilerini etkilediğine dair STS modellerinde veri yoktur [1]. Ancak literatürde benzer trimetoksibenzoat türevlerinin proliferasyon ve migrasyon üzerinde etkili olduğu gösterilmiştir; bu da mosoprocol’un bu yolları modüle edebileceğini düşündürür. Örneğin antiproliferatif etki mekanizmasında AKT fosforilasyonunun azalması ya da NF-κB çekirdeğe transkripsiyon faktörünün translokasyonunun engellenmesi rol alabilir. İlk deneysel adımlar: STS hücrelerinde mosoprocol uygulaması sonrası p-AKT, p-mTOR, p-ERK düzeylerinin Western blotla izlenmesi; hücre döngüsü profili (G1/S duraksaması), apoptoz (caspase-3 aktivasyonu) ile bağlantılı veriler elde edilmesi.
5. Epigenetik Modifikasyonlar
Mevcut literatürde mosoprocol’un DNMT (DNA metiltransferaz) veya HDAC (histon deasetilaz) gibi epigenetik düzenleyiciler üzerinde doğrudan etkisi bildirilmemiştir [1]. Bununla birlikte, antioksidan etkisi ve hücre stresini azaltıcı potansiyeli aracılığıyla kromatin yapısında değişiklikler yaratabilir. Bu bağlamda: H3K27ac/H3K9me3 oranları, global DNA metilasyon düzeyi, özelleşmiş genlerin promotör metilasyon durumu (örneğin p16^INK4a, RASSF1A) mosoprocol uygulaması sonrası incelenebilir. STS’lerde epigenetik duyarlılığı yüksek alt tiplerin (örneğin dediferansiye liposarkom) bu ajan için öncelik taşıdığı düşünülebilir.
6. PD-1/PD-L1 Blokaj Kombinasyonları
STS tedavisinde immün kontrol noktası inhibitörleri (anti-PD-1/PD-L1) üzerine giderek daha fazla ilgi vardır. Mosoprocol’un antioksidan ve antiproliferatif etkileri ile tümör hücresinde antigen sunumu, stres-oranı ve immünojenik sinyal artışı yaratabileceği düşünülmektedir. Bu açıdan mosoprocol + anti-PD-1/PD-L1 kombinasyonu teorik olarak ordu açabilir: Mosoprocol tümör mikroçevresinde immün “soğuk” durumdan “sıcak” duruma geçişe katkı sağlarken, immünoterapi bu artışı işlevsel anti-tümör yanıtına dönüştürebilir. Preklinik modellerde kök hücre içermeyen STS alt tiplerinde (örneğin pleomorfik RMS) test edilmesi önerilir.
7. β-Glukan Bazlı İmmün Destek
Mosoprocol + β-glukan gibi inmün destek stratejileri literatürde yer almamaktadır [1]. Ancak β-glukan makrofaj ve dendritik hücre aktivasyonunu artırırken, mosoprocol’un tümör hücresinde yaratabileceği stres sinyali ve immünojenik etki, bu kombinasyonu ilgi çekici kılar. Öneri: fare STS modeli + mosoprocol ± β-glukan → TIL analizi, makrofaj fenotipi (M1/M2), NK aktivitesi.
8. Onkolitik Virüs Terapileri ile Kombinasyon
Onkolitik virüsler (örneğin vaccinia, reovirus) STS’de henüz yaygın şekilde kullanılmamıştır; mosoprocol’un bu alandaki potansiyeli tamamen teoriktir [4]. Ajanın hücre stresini artırarak viral replikasyona uygun ortam hazırlayabileceği, ya da viral lizin sırasında oluşan DAMP’ları (damage-associated molecular patterns) daha güçlü kılabileceği hipotez edilebilir. Deneysel öneri: STS hücresi + mosoprocol → onkolitik virüs uygulaması → viral lizin oranı, IFN-β üretimi, CD8 T hücre çekilimi ölçümü.
9. Doğuştan ve Adaptif İmmün Yanıt
Mosoprocol’un NK hücre aktivasyonu, dendritik hücre olgunlaşması veya T hücre proliferasyonu üzerindeki etkisi raporlanmamıştır [1]. Fakat ajan tümör hücresinde oksidatif stresin modülasyonu ve proliferasyonun azalmasıyla dolaylı olarak immün mikroçevreyi etkileyebilir. Örneğin mosoprocol tedavisi sonrası tümör dokusundan elde edilen hücrelerde MHC I ekspresyonu artabilir, Treg/TIL oranı değişebilir. Bu etkinin sistematik incelenmesi önerilir: in vivo STS modelinde tedavi sonrası tumör-infiltrating lymphocyte (TIL) profili, IFN-γ, granzyme B düzeyi, makrofaj fenotipi (CD68/CD163) analiz edilmeli.
10. Teorik Etki Değerlendirmesi
Özetle, mosoprocol’un STS bağlamında şu mekanizmalarla etkinlik sağlayabileceği düşünülmektedir:
• Antioksidan etki ve ROS modülasyonu → DNA hasar azaltımı ve hücre döngüsü baskısı
• NF-κB/PI3K/AKT/mTOR sinyal baskısı (teorik) → hücre proliferasyonu azalması
• Epigenetik yeniden programlama → tümör baskılayıcı genlerin re-ekspresyonu
• İmmün mikroçevre yeniden şekillenmesi → antijen sunumu artışı, T hücre yanıtı yükselmesi
• Kombinasyon stratejileri (anti-PD-1/PD-L1, onkolitik virüs, β-glukan) ile sinerji potansiyeli
Bu mekanizmaların translasyonel başarıya dönüşebilmesi için, ADME/toksisite profili, doz optimizasyonu, biyobelirteç seçimi (ROS düzeyi, PD-L1 ekspresyonu, TIL oranı), ilaca direnç mekanizmalarının (örneğin ABC taşıyıcılar, P-gp) incelenmesi gereklidir.
11. Sonuç
Mosoprocol, STS bağlamında doğrudan incelenmemiş olmasına rağmen moleküler düzeyde yenilikçi bir profil sergilemektedir. Özellikle tümör hücre proliferasyonu, oksidatif stres yanıtı ve immün mikroçevre açısından potansiyel vaat eder. Bu nedenle mosoprocol’un STS model sistemlerinde öncelikli olarak mekanistik in vitro/ in vivo çalışmalarıyla değerlendirilmesi; ardından biyobelirteç-yönlendirilmiş erken faz klinik denemelere geçilmesi önerilmektedir.
Kaynakça
1. PubChem. Methyl 3,4,5-trimethoxybenzoate. U.S. National Library of Medicine. Available at: https://pubchem.ncbi.nlm.nih.gov/compound/15956. Accessed [Aug 2025].
2. Pasquali S, Moura DS, Danks M, et al. Preclinical models of soft tissue sarcomas: generation and translational applications. Dis Model Mech. (In press) 2025. PMID: 39824369.
3. Salum LB, et al. Cytotoxic 3,4,5-trimethoxychalcones as mitotic arresters. Leuk Res. 2013;37(9):1081-1087. doi:10.1016/j.leukres.2013.04.001. [analogue compound mechanistic]
4. Smith HG, et al. Oncolytic vaccinia virus reshapes sarcoma tumor microenvironment and synergizes with PD-L1 blockade. Mol Cancer. 2024;23(1):119. doi:10.1186/s12943-024-01946-8.
Tegafur’ün Yumuşak Doku Sarkomlarındaki Moleküler Etki Profili: Sistematik Derleme ve Teorik Değerlendirme
1. Giriş
Tegafur, oral yolla alınan ve vücutta aktif metabolit olarak 5 Fluorouracil (5-FU) haline gelen bir fluoropirimidin antimetabolittir. TS (thymidylate synthase) inhibisyonu, RNA/DNA sentez bozukluğu ve hücre döngüsü arresti yoluyla klasik olarak gastrointestinal ve mide-pankreas gibi katı tümörlerde etkinliği tanımlanmıştır. Ancak yumuşak doku sarkomları (STS) gibi nadir, moleküler olarak heterojen gruplarda tegafur’un kullanımına dair sistematik preklinik/klinik veri bulunmamaktadır. Bu boşluk nedeniyle, tegafur’un STS bağlamında tarihsel, moleküler ve immün mekanizmaları açısından yeniden değerlendirilmesi önemlidir.
2. Klinik ve Preklinik Kullanım Eksikliği
Literatürde, STS hücre hatları veya hayvan modellleri üzerinde tegafur ya da 5-FU prodrugları ile sistematik etkinlik çalışması yapılmış görünmemektedir. Bu açıdan: (i) STS alt tiplerine göre duyarlılık farkı olabileceği, (ii) STS-özgü mikromilieu ve DNA onarım kapasitesinin fluoropirimidinlere yanıtı etkileyebileceği düşünülmelidir. Dolayısıyla bu ajan STS için “yenilikçi öneri” kategorisindedir.
3. Moleküler Etki Alanlarında Literatür Açığı
3.1 DNA/RNA Sentezinin Engellenmesi
Tegafur metabolize edilerek 5-FU’ye dönüşür; 5-FU’nun aktif metabolitleri TS’yi inhibe eder, dTMP havuzunu azaltır, deoksinükleotid dengelerini bozarak DNA sentezini engeller. Frontiers+1 Ayrıca, RNA’ya entegrasyon yoluyla mRNA veya rRNA fonksiyonlarını bozabilir.
3.2 Sinyal Yolu Modülasyonu
STS’de NF-κB, PI3K/AKT/mTOR, MAPK/ERK gibi yolların kritik rolü bilinmektedir. 5-FU ve benzeri ajanlarda bu yollarla etkileşim bildirilmiş olmakla birlikte STS özelinde tegafur ile bu yolların modülasyonu üzerine yayın yoktur.
3.3 Epigenetik Düzenlemeler
Fluoropirimidinlerin non-kodlayıcı RNA, histon modifikasyonları veya DNA metilasyonu üzerinden duyarlılığı etkilediği gösterilmiştir. Frontiers Ancak STS için tegafur bağlamında DNMT, HDAC veya lncRNA/miRNA etkileşimi henüz araştırılmamıştır.
3.4 İmmün Modülasyon ve İmmünojenik Hücre Ölümü (ICD)
Fluoropirimidinlerin immün sistemi aktif hale getirebileceği ve ICD induksiyonu yaratabileceği yönünde yayınlar vardır; örneğin 5-FU’nun kalretikülin yüzeye çıkışı ve ATP salımı oluşturduğu bildirilmiştir. Wiley Online Library+1 STS için bu mekanizmanın tegafur bağlamında potansiyeli araştırılmamıştır.
4. Teorik Etki Değerlendirmesi
• Tegafur aracılığıyla 5-FU dönüşümü → DNA/RNA sentezinin baskılanması → replikasyon stresi, hücre döngüsü duraklaması (özellikle hızlı çoğalan STS hücrelerinde)
• DNA sentez baskısı ve hücre döngüsü duraklaması, cGAS–STING yol aktivasyonu, Tip I interferon induksiyonu ve tümör mikroçevresinde antijen sunumu artışı yaratabilir.
• Bu bağlamda PD-1/PD-L1 blokajı ile kombinasyon potansiyeli doğabilir: immünojenik hücre ölümü + immün kontrol noktası inhibitörü sinerjisi
• Onkolitik virüslerle ardışık ya da eş zamanlı kullanım önerilebilir: tegafur ile tümör hücresinde artan stres → virüs replikasyonu/antijen yayılımı + immün aktivasyon
• β-Glukan gibi immün-destek stratejileri ile kombinasyon, doğuştan bağışıklığın tümör mikroçevresine katılımını artırabilir
• STS’ye özgü biyobelirteç önerileri: TS ekspresyonu, DPD aktiviteleri, MMR/HR onarım genleri (örneğin MSH2, MLH1, RAD51), PD-L1/MHC-I düzeyleri, TIL oranı
5. Klinik Uygulama ve Gelecek Perspektifler
• STS hastalarında tegafur monoterapisi veya kombinasyon tedavileri için biyobelirteç temelli pilot çalışmalara ihtiyaç vardır
• Alt tip ayrımı önemli: LMS, UPS, DDLPS gibi alt tiplerde TS enzimi düzeyi, 5-FU duyarlılığı farklı olabilir
• Kombinasyon stratejileri: tegafur + anti-PD-1/PD-L1; tegafur + onkolitik virüs; tegafur + immün destek (β-glukan)
• Güvenlik ve tolerabilite verileri STS hastalarında kaydedilmelidir (myelosupresyon, mukozit, gastrointestinal yan etkiler)
• Klinik çalışma tasarımı: biyobelirteç stratifikasyonu, önceden TS/MMR/HR durumu değerlendirmesi, immün yanıt ölçümleri (TIL, IFN-γ, CXCL10), erken faz II/III uyarlamalı protokol
6. Sonuç
Tegafur, STS bağlamında doğrudan incelenmemiş bir fluoropirimidin prodrugudur; ancak moleküler biyolojisi, DNA/RNA sentezinin baskılanması, immün mikroçevre modülasyonu gibi mekanizmaları göz önüne alındığında STS için mantıklı bir terapötik aday sunmaktadır. Bu nedenle, STS özelinde iyi tasarlanmış translasyonel ve klinik çalışmalara yönelinmelidir.
Kaynakça
1. Ghafouri-Fard S, et al. 5-Fluorouracil: A narrative review on the role of miRNAs in drug resistance. Front Oncol. 2021;11:658636. doi:10.3389/fonc.2021.658636.
2. Kozai H, et al. Potential of fluoropyrimidine to be an immunologically active chemotherapy through induction of immunogenic cell death. Thorac Cancer. 2024;15(3):… doi:10.1111/1759-7714.15200.
3. Chiaravalli M, et al. Immunogenic cell death: an emerging target in cancer therapy. Int J Mol Sci. 2022;23(14):… doi:10.3390/ijms23148135.
4. Amiri M, et al. Stimulators of immunogenic cell death for cancer therapy. Cancer Cell Int. 2023;23:… doi:10.1186/s12935-023-03058-7.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...