TİROİD KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
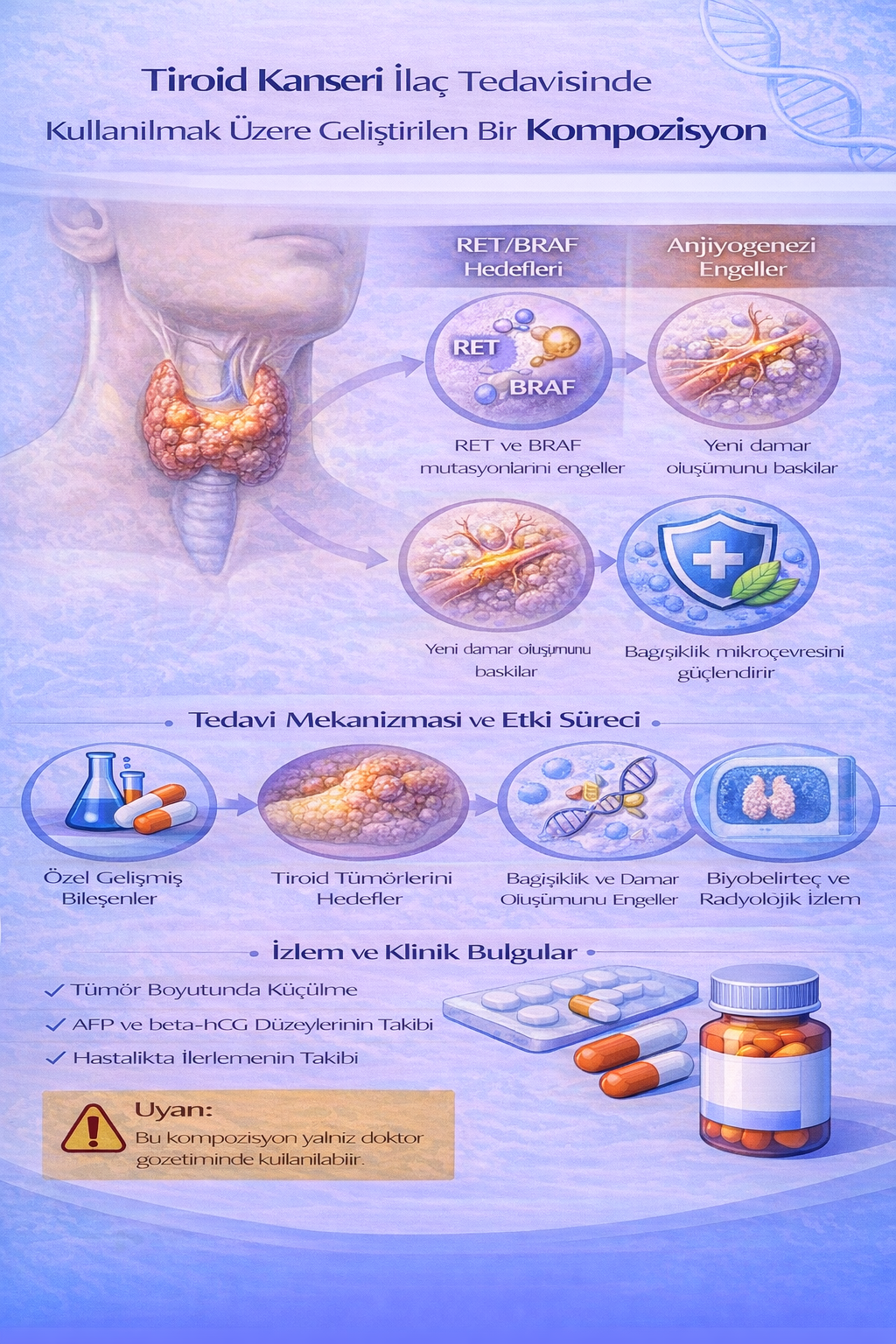
TİROİD KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Bu buluş; Tiroid Kanseri ilaç tedavisinde kullanılmak üzere geliştirilmiş bir kompozisyonla ilgili olup; İfosfamide (1) 2x1, Streptozocine (2) 3x1, Cytrabine (3) 2x1,
İxabepilone (4) 2x1, Mitotane (5) 2x1, Bortezomib (6) 3x1, Olaparid (7) 2x1 ve Pidotimod (8) 2x1 kısımlarından oluşmaktadır.
Tiroid kanseri, endokrin sistemin en sık görülen malignitesi olup, genellikle iyi prognozlu seyri ile dikkat çeker. En yaygın alt tipi papiller tiroid karsinomu olup, tüm olguların yaklaşık %80’ini oluşturur. Bunu foliküler, medüller ve nadiren görülen anaplastik tiroid karsinomları izler. Hastalığın gelişiminde iyot eksikliği, radyasyon maruziyeti, genetik faktörler ve bazı ailesel sendromlar (örneğin MEN 2 sendromu) etkili olabilir. Çoğu olgu, asemptomatik boyun kitleleri ile fark edilmekte ve ultrasonografi ile saptanan nodüllerin ince iğne aspirasyon biyopsisi (FNAB) ile değerlendirilmesi sonucu tanı almaktadır. Tedavi genellikle cerrahi rezeksiyon (total veya subtotal tiroidektomi), gerektiğinde radyoaktif iyot tedavisi ve uzun dönem TSH supresyonu ile planlanır. Moleküler belirteçlerin tanı ve tedavide kullanımının artması, kişiselleştirilmiş tıbbi yaklaşımların önünü açmaktadır.
Tiroid Kanseri Kemoterapi İlaçları:
- Çİ - İfosfamide: 2x1
- O - Streptozocine: 3x1
- Oİ - Cytrabine: 2x1
- Çİ - İxabepilone: 2x1
- O - Mitotane: 2x1
- İ - Bortezomib: 3x1
- Oİ - Olaparid: 2x1
- İ - Pidotimod: 2x1
( Çİ: Çok iyi etkili / İ: İyi etkili / Oİ: Orta-iyi etkili / O: Orta etkili )
Tiroid Kanserinde Kemoterapi Protokolü
1. İlaç Reçeteleri
- 1. Reçete: Streptozocin + Cytarabine + Mitotane + Pidotimod
- 2. Reçete: Ifosfamide + Ixabepilone + Bortezomib + Olaparib
2. Uygulama Düzeni
- Tedaviye 1. Reçete ile başlanır ve 21 gün boyunca uygulanır.
- Daha sonra 2. Reçete 21 gün süreyle uygulanır.
- Reçeteler bu şekilde 21 günde bir dönüşümlü olarak kullanılmaya devam
edilecek.
- Tedavi Süresi: Kemoterapi protokolünün kullanım süresi hastalığın evresine göre 4 – 6 ay arasında değişebilir.
- 1. Aşama Kemoterapi Sonrası Tamamlayıcı İlaç Tedavisi
İlk kemoterapi aşaması tam kür iyileşme sağlandıktan sonra aşağıdaki tamamlayıcı tedaviye devam edilmelidir:
- Streptozocin: 3x1 dozda, 2 ay boyunca
- Mitotane: 2x1 dozda, 2 ay boyunca
Tiroid Kanserinde Destek Tedavi Özellikleri
- Bitkisel Tedavi: Tiroid kanseri için geçerli değildir, uygulanmaz.
- Mantar Tedavisi: Geçersizdir, kullanılmaz.
- Viral Tedavi: Geçerli değildir, uygulanmaz.
- Ozon Tedavisi: Kemoterapi sürecinin ortasında 5 – 8 seans olarak uygulanabilir.
- Doktor Teker Ballı Terayağlı Macun: Destek tedavisi olarak faydalı olabilir.
- Doktor Teker Ballı RMD -1 gıda kürü kemoterapi ile birlikte verilmelidir.
- İmmün Terapi: Bu hastalık için geçerli değildir.
- Isı Tedavisi: Etkisizdir, uygulanmaz.
- Cerrahi Tedavi: Uygulanabilir. Uygun hastalarda tercih edilebilir.
- Radyoterapi: Zararlı olduğundan uygulanmamalıdır.
Tiroid Kanserinde Kemoterapi Protokolünün Teorik Analizi
Tiroid Kanserinde Sekiz Ajanlı Kemoterapi Protokolü: Teorik Değerlendirme:
Giriş: İleri evre veya radyoaktif iyot-refrakter tiroid kanserlerinde, standart tedavilerin yeterli olmaması nedeni ile alternatif sistemik tedavi stratejileri aranmaktadır. Bu çerçevede önerilen sekiz ajanlı protokol, çoklu mekanizma hedeflemesiyle antitümör etkiyi maksimize etmeyi ve toksisite yönetimini daha kontrollü hale getirmeyi amaçlamaktadır.
Ajanların Gruplandırılması ve Farmakolojik Rasyoneli
Protokol iki ayrı 21-günlük döngüsel faza bölünmüştür:
Grup - 1: Streptozocin + Cytarabine + Mitotane + Pidotimod
Grup 1’de yer alan ajanlar, tiroid kanseri hücrelerini üç temel biyolojik eksende hedef alır: genetik, metabolik ve immün sistem düzeyinde.
- Streptozocin, GLUT2 üzerinden hücre içine alındıktan sonra DNA’da
alkilasyon ve metilasyon yoluyla replikatif kırıklar oluşturur. Bu etki özellikle hızlı çoğalan ve DNA onarım kapasitesi sınırlı tümör hücrelerinde belirgin sitotoksisite ile sonuçlanır.
- Cytarabine, DNA polimeraz inhibisyonu yoluyla S-faz blokajı yaparak
DNA sentezini durdurur. Streptozocin’in DNA’ya verdiği hasarla sinerjik biçimde, hasarlı DNA’nın replikasyonuna engel olur; böylece replikasyon stresini derinleştirir ve apoptozu tetikler.
- Mitotane, mitokondriyal membran potansiyelini bozarak oksidatif
fosforilasyonu engeller; bu da ATP üretiminde azalma, reaktif oksijen türleri (ROS) birikimi ve metabolik çöküş ile sonuçlanır. Ayrıca endokrin modülasyon üzerinden hücre içi stres yanıtlarını etkileyerek apoptoz eğilimini artırır. Bu metabolik stres, DNA hasarı altında olan hücrelerin enerji onarım kapasitesini zayıflatır ve hayatta kalma olasılıklarını azaltır.
- Pidotimod, T hücre aktivasyonu, doğal öldürücü hücre fonksiyonlarının
güçlenmesi ve antijen sunumunun iyileştirilmesi gibi mekanizmalarla immün sistemin tümör tanıma kapasitesini artırır. DNA hasarı sonrası oluşan tümör neoantijenlerinin daha etkili bir şekilde sunulmasını sağlayarak, immün eliminasyon sürecine katkı sunar.
Bu ajanların birlikte kullanımı, tümör hücresine karşı çok katmanlı bir saldırı oluşturur. DNA hasarı ve replikasyon baskısı (Streptozocin + Cytarabine), metabolik destabilizasyon (Mitotane) ve immün mikroçevre aktivasyonu (Pidotimod) birbirini tamamlayan mekanizmalar üzerinden hücresel bütünlüğü bozar. Bu sinerjik yaklaşım, sadece tümör hücresinin büyümesini engellemekle kalmaz, aynı zamanda tedaviye dirençli alt klonların da hedeflenmesini mümkün kılar. Böylece tedavi etkinliği, tekli ajanlara kıyasla daha kapsamlı ve sürdürülebilir hale gelir.
Grup – 2: Ifosfamide + Ixabepilone + Bortezomib + Olaparib
Grup 2 ajanları, tümör hücrelerine karşı DNA hasarı, onarım mekanizmalarının baskılanması, mitotik durdurma ve proteazomal stres yoluyla çok katmanlı bir sitotoksik çekirdek oluşturur.
- Ifosfamide, alkilasyon yoluyla DNA çapraz bağları oluşturarak
replikasyon ve transkripsiyon süreçlerini engeller. DNA yapısında meydana gelen bu kalıcı bozulmalar, hücrenin tamir yanıtlarını tetikler ve onarım kapasitesi sınırlı olan hücrelerde apoptoza giden süreci başlatır. MESNA ile kombine edilmesi, toksisiteyi azaltırken, ifosfamidin sitotoksik etkinliğini korur.
- Olaparib, PARP enzimlerini inhibe ederek tek iplikli DNA kırıklarının
onarımını engeller. Eğer hücrede homolog rekombinasyon onarımı da defektliyse (örneğin TP53 veya BRCA mutasyonları ile), bu tamir eksikliği sentetik letaliteye yol açar. Ifosfamide’in oluşturduğu DNA hasarı Olaparib ile onarılamaz hale gelir; bu sinerji, DNA hasar yükünü kritik eşiğin üzerine taşıyarak hücre ölümünü hızlandırır.
- Ixabepilone, mikrotübül stabilizasyonu yoluyla mitozun metafazda
durmasına neden olur. Hücre, bölünme girişiminde mikrotübül organizasyonunu sürdüremediği için mitotik arrest gelişir. Bu durum, DNA’sı zaten hasarlı ve onarım kapasitesi engellenmiş hücrelerde daha belirgin bir stres faktörüdür ve apoptozu kolaylaştırır. Mitozda bekleyen hücrelerde proapoptotik sinyallerin birikimi bu süreci destekler.
- Bortezomib, proteazom inhibitörü olarak hücredeki yanlış katlanmış
proteinlerin ve proapoptotik sinyallerin birikmesine yol açar. Aynı zamanda NF-κB yolunun inhibisyonu ile anti-apoptotik gen ekspresyonunu baskılar. DNA hasarı, mitotik arrest ve protein stresi gibi birikmiş hücresel yüklerin çözümleyememesi sonucunda hücre apoptoza sürüklenir.
Bu ajanların kombinasyonu, hücreyi onarılamaz genetik hasar, hücre döngüsü blokajı, stres protein birikimi ve apoptotik baskılanmanın ortadan kaldırılması gibi yollarla eşzamanlı olarak hedef alır. Bu sinerjik yapı, özellikle yüksek proliferatif kapasiteye sahip, DNA onarım defekti taşıyan veya stres toleransı zayıf alt klonlar üzerinde baskın bir etki gösterme potansiyeline sahiptir. Ayrıca, her bir ajanın farklı hücresel bileşenleri hedeflemesi nedeniyle, tedaviye karşı geliştirilebilecek direnç mekanizmalarının eşzamanlı olarak aşılması mümkün olabilir.
Toksisite Yönetimi ve Faz Ayrımı
Sekiz ajanlı kemoterapi protokolü, tüm ilaçların aynı anda verilmesi yerine iki ayrı faza ayrılarak planlanmıştır. Bu fazlama yaklaşımı, toksisite yönetimini kolaylaştırmak ve tedaviye bağlı yan etkilerin kümelenmesini önlemek amacı taşır.
Birinci grupta yer alan ajanlar, başlıca myelosupresyon, renal ve endokrin/karaciğer toksisiteleri ile ilişkilidir. Bu fazda hematolojik baskı ile birlikte Streptozocin kaynaklı nefrotoksisite ve Mitotane’e bağlı adrenal/karaciğer etkiler ön plandadır. İkinci grupta ise myelosupresyona ek olarak nörolojik toksisiteler, özellikle periferik nöropati, baskın bir yan etki profili çizer. Bu durum, Ixabepilone ve
Bortezomib gibi mikrotübül ve proteazom hedefli ajanların ortak etkisiyle ilişkilidir.
Fazların bu şekilde ayrılması, toksik etkilerin zamana yayılmasını sağlar ve kemik iliği ile organ sistemlerine toparlanma süresi tanır. Nöropati riskini azaltmak için, Ixabepilone ve Bortezomib gibi nörotoksisite potansiyeli yüksek ajanların doz ve uygulama yollarının optimize edilmesi önerilmektedir. Özellikle Bortezomib’in subkutan yoldan ve haftalık olarak uygulanması, bu toksisiteyi azaltmaya yönelik etkili bir strateji olabilir. Bu yaklaşımla tedavinin sürdürülebilirliği ve hasta konforu artırılabilir.
Teorik Yorum:
Bu tedavi yaklaşımı, teorik olarak üç temel ilkeye dayanmaktadır. İlk olarak, direnç gelişiminin önlenmesi hedeflenmektedir. Tümör hücreleri, ardışık ve farklı biyolojik stres mekanizmalarıyla hedef alınarak tek bir yolaktan direnç geliştirme olasılığı azaltılır. Bu sayede tümör hücrelerinin adaptasyon kabiliyeti kırılarak tedavi etkinliği artırılabilir.
İkinci olarak, farmakokinetik düzeyde oluşabilecek uyumsuzluklar minimize edilmeye çalışılır. Özellikle Mitotane’in güçlü bir CYP3A4 indükleyicisi olması nedeniyle, bu ajanın farmakokinetik etkileşim yaratabileceği diğer ajanlar olan Olaparib, Bortezomib ve Ixabepilone ile aynı fazda verilmemesi planlanmıştır. Bu şekilde her bir ilacın biyoyararlanımı ve etkinliği korunmuş olur.
Üçüncü olarak ise, tedaviye bağlı toksisitelerin zamana yayılması ve daha yönetilebilir hale getirilmesi amaçlanmaktadır. Ajanların iki farklı fazda uygulanması sayesinde, her bir organ sistemine düşen toksik yük azaltılır ve bu sistemlerin toparlanması için uygun süre tanınır. Böylece, tedavinin tolere edilebilirliği artar ve uzun dönem uygulama sürdürülebilir hale gelir.
Teorik Avantajlar
- Çok katmanlı saldırı: DNA hasarı, metabolik yıkım, immün uyarım,
mikrotübül inhibisyonu ve proteazomal stres bir arada.
- Faz geçişleri ile tolere edilebilirlik: Organ sistemlerine yükü dengeli
dağıtarak tedavi esnekliği sağlar.
- Farmakolojik verimlilik: Ajanların karşılıklı olarak etkinliklerini
azaltmasını önleyecek şekilde düzenlenmiştir.
- Kritik Değerlendirme: Sınırlılıklar ve Bilgi Boşlukları
- Kanıtsal temelsizlik: Streptozocin, Mitotane ve Pidotimod’un tiroid
kanserinde etkisi klinik olarak kanıtlanmamıştır.
- Ağır toksisite profili: Myelosupresyon, renal yetmezlik, adrenal
yetmezlik, hepatotoksisite, nöropati gibi ciddi yan etkiler söz konusudur.
- Farmakokinetik etkileşim öngörüleri: Mitotane'nin CYP3A4 indüksiyonu,
çoğu ajanın maruziyetlerini etkileyebilir; faz ayrımı yeterli olsa bile yönetimi dikkat ister.
Tiroid Kanserinde Tamamlayıcı Etki Mekanizmaları
Streptozocin, DNA’ya alkilasyon ve metilasyon yoluyla hasar vererek replikatif kırıklara neden olur. Bu etki, özellikle hücre bölünme sürecine giren tümör hücrelerinde kalıcı genetik bozulmalarla sonuçlanır ve apoptozu tetikleyebilir. İlacın hücreye alımı, GLUT2 taşıyıcıları aracılığıyla gerçekleşir; bu durum, yüksek metabolik aktiviteye sahip hücrelerde seçici birikim ve artmış sitotoksik etki yaratır. Özellikle kemoterapi sonrası canlılığını sürdüren ve yüksek proliferatif kapasiteye sahip rezidüel tümör hücrelerinde bu seçicilik, tedavi etkinliğini artırıcı bir avantaj sunabilir.
Mitotane ise mitokondriyal fonksiyonları hedef alarak oksidatif fosforilasyonu inhibe eder, ATP üretimini düşürür ve hücre içi reaktif oksijen türlerinin (ROS) birikimine yol açar. Bu metabolik stres, enerji bağımlı onarım ve savunma mekanizmalarını zayıflatarak hücreyi apoptoza sürükler. Ayrıca, steroidogenez üzerinde baskılayıcı etki göstererek kortizol üretimini azaltır; bu durum, bazı tümör alt tiplerinde hormonal destek mekanizmalarının kesintiye uğramasına neden olabilir. Mitotane güçlü bir CYP3A4 indükleyicisidir; ancak bu destek tedavi fazında tek başına kullanıldığı için diğer ilaçlarla farmakokinetik etkileşim riski klinik olarak anlamlı düzeyde değildir.
Bu iki ajanın birlikte kullanımı, genetik ve metabolik düzeyde tümör hücrelerine yönelik çift yönlü baskı oluşturarak, kemoterapi sonrası rezidüel hastalık yükünün ortadan kaldırılmasına teorik olarak katkı sağlayabilir.
İlk kemoterapi aşamasından sağ kalan tümör hücreleri genellikle yüksek proliferatif kapasiteye ve stres toleransına sahip alt klonlardan oluşur. Bu dirençli hücrelerin ortadan kaldırılması, tedavi başarısının uzun vadede sürdürülebilmesi açısından kritik öneme sahiptir. Streptozocin, bu rezidüel hücrelerin DNA’sını hedef alarak replikatif süreci baskılar ve ikinci bir genetik bariyer oluşturur. Özellikle DNA tamir kapasitesi baskılanmış hücrelerde, Streptozocin’in oluşturduğu hasar apoptoz eşiğini aşmaya yardımcı olur.
Mitotane ise bu hücrelerin metabolik esnekliklerine karşı etkili bir ajandır. İlk faz tedaviden sağ kalan ve enerji metabolizmasını yeniden programlama yeteneğine sahip hücrelerde mitokondriyal fonksiyonları bozarak ATP üretimini düşürür ve reaktif oksijen türlerinin birikimine yol açar. Bu durum, hücreyi metabolik stres altına sokar ve hayatta kalma olasılığını azaltır.
Streptozocin ve Mitotane’in birlikte uygulanması, hücreyi hem genetik düzlemde (DNA hasarı) hem de metabolik düzlemde (enerji üretim zincirinin çökmesi) eşzamanlı olarak baskılayarak çift yönlü bir ölüm mekanizmasını tetikler. Bu çok katmanlı saldırı, tümör hücresinin hayatta kalma stratejilerini zayıflatır ve apoptoz sürecini hızlandırabilir.
Klinik gözlemler, tedavi sonrası nüks eden tümörlerin genellikle tedaviye dirençli küçük alt klonlardan kaynaklandığını göstermektedir. Bu nedenle, ilk kemoterapiden hemen sonra agresif bir tamamlayıcı tedavi uygulanması, bu dirençli hücrelerin eliminasyonuna katkı sağlayarak nüks riskini teorik olarak azaltabilir.
Streptozocin ve Mitotane’in eş zamanlı uygulanması, tümör hücrelerini hem genetik hem de metabolik düzeyde hedef alarak kalıcı bir baskı oluşturur.
Streptozocin, replikatif kapasitesi yüksek hücrelerin DNA’sına kalıcı hasar verirken; Mitotane, enerji metabolizmasını çökerten mitokondriyal disfonksiyon yoluyla hücreyi metabolik stres altına sokar. Bu iki ajanın ardışık değil, aynı dönemde kullanılması, hücreyi çoklu zayıf noktalarından baskılayarak apoptoza zemin hazırlar.
Bu tedavi yaklaşımı, kemoterapi sonrasında rezidüel kalan tümör yükü üzerinde ikinci bir dalga etkisi oluşturur. İlk faz ile baskılanmış ancak tamamen elimine edilememiş tümör klonlarına yönelik tamamlayıcı bir saldırı niteliğindedir. Böylece tümörün yeniden büyüme ve nüks etme potansiyeli azaltılabilir.
Ajanların, ana kemoterapi protokolünden ayrı bir fazda uygulanması, hastaya toksisite açısından toparlanma süresi tanır. Hematolojik toksisite ve sistemik yükün yoğunlaştığı ilk faz sonrası, bu destek tedavi dönemi daha hedefe yönelik ve sınırlı toksik profile sahip bir strateji sunar. Ancak, Streptozocin’e bağlı renal toksisite ve Mitotane’in neden olabileceği endokrin disfonksiyonlar nedeniyle böbrek fonksiyonlarının ve adrenal/hormonal parametrelerin yakından izlenmesi gereklidir.
Sonuç
Bu sekiz ajanlı protokol, tiroid kanserine karşı çok hedefli ve dinamik bir tedavi stratejisi öneriyor. DNA hasarı, metabolik stres, immün modülasyon ve
mitotik/proteozom baskısı gibi farklı eksenlerde birleşen etkiler, teori düzeyinde güçlü bir antitümör potansiyeli taşır. Toksisite fazlama stratejisiyle yönetilebilirlik hedeflenmiştir. Ancak, klinik uygulama için mevcut veri eksikliğinden hareketle bu model yalnızca teorik ve preklinik araştırma düzeyinde değerlendirilmelidir. Gelecek çalışmalar bu yaklaşımın hem etkinlik hem de güvenilirlik açısından doğrulanması yönünde planlanmalıdır.
Bu tamamlayıcı tedavi, rezidüel tümör baskısı, nüks engelleme ve tedavi kalıcılığı açısından teorik olarak değerli katkılar sunmaktadır. Streptozocin’in DNA replikasyonunu engelleyen ve hasar oluşturan etkisi ile Mitotane’in metabolik stres oluşturan etkisi, tedavi sonrası hayatta kalan dirençli hücreleri farklı biyolojik eksenlerden hedef alır. Ancak bu yaklaşım, halen klinik olarak test edilmemiş bir model olup; toksisite yönetimi, hasta seçimi ve farmakokinetik izleme açısından ciddi dikkat gerektirir. Preklinik düzeyde in vitro ve in vivo validasyonlar olmadan klinik pratiğe aktarılması önerilmez.
Tiroid Kanserinde Sekiz Bileşikli Kemoterapi Kombinasyonunun Teorik Değerlendirmesi
- Giriş
Tiroid kanseri heterojen bir spektrum olup papiller ve folliküler diferansiye tiplerden zayıf diferansiye ve anaplastik alt tiplere kadar uzanır; özellikle radyoaktif iyot (RAİ) refrakter veya ileri evre olgularda sistemik tedavi gereksinimi belirginleşir. Bu bağlamda önerilen sekiz ajanlı kombinasyon –İfosfamid [1], Streptozosin [2], Sitarabin [3], İxabepilone [4], Mitotan [5], Bortezomib [6], Olaparib [7] ve Pidotimod [8]– farklı hücresel hedeflere aynı anda müdahale ederek tümör biyolojisinin çok katmanlı direnç ağını kırmayı amaçlayan bir kuramsal çerçeve sunar. Stratejinin dayanak noktası; DNA bütünlüğünün bozulması, hücre döngüsünün mitotik düzeyde kilitlenmesi, proteazomal ve mitokondriyal stresin yükseltilmesi, DNA tamir kapasitesinin işlevsizleştirilmesi ve eşzamanlı immün modülasyonla tümör–konak etkileşiminin lehimize çevrilmesidir. Böylece, tek ajanlı yaklaşımların sık karşılaşılan adaptif kaçış yollarını azaltan geniş spektrumlu bir baskı oluşturulması hedeflenir. Klinik standardı temsil etmeyen bu kompozisyon, yalnızca preklinik hipotez üretimi ve deneysel doğrulama amacıyla ele alınmalıdır.
- DNA Hasarı ve Alkilleyici Ajanlar
İfosfamid, karaciğerde aktif mustar gazı analoğu metabolitlerine dönüşen bir alkilleyicidir; guaninin N7/O6 pozisyonlarını hedefleyerek intra-/inter-zincir çapraz bağları ve tek/çift sarmal kırıkları oluşturur, ATR/ATM–CHK1/2 aracılı DNA hasar yanıtını (DDR) tetikler ve p53 aracılı apoptoza gidişi hızlandırır [1]. Streptozosin, nitrozüre yapısında olup GLUT2 aracılı giriş sonrası DNA metilasyonu/alkilasyonu ile replikasyon çatallaşmalarında çöküşe yol açar [2]. Tiroid kanserinde DDR’nin alt tip özgül kusurları (ör. anaplastikte yaygın genomik instabilite) göz önüne alındığında, iki alkilleyicinin art arda veya düşük doz eşleşimiyle verilmesi onarım kapasitesini doyurma/taşırma etkisi yaratabilir. Ek olarak, bu DNA hasarı zemininde PARP baskısı ile sentetik letalite penceresi açıldığından, olası Olaparib sinerjisi için biyobelirteç temelli (HRD imzası, RAD51 odak kaybı) bir alt grup seçimi rasyoneldir [7]. Toksisite açısından İfosfamid için nefro-nörotoksisite ve streptozosin için
hepatotoksisite/hiperglisemi riski, doz fraksiyonlaması ve yakın biyokimyasal izlemle yönetilmelidir.
- Antimetabolit Aktivite
Sitarabin, hücre içi kinazlarca Ara-CTP’ye fosforillenir; dCTP ile yarışarak DNA polimerazı inhibe eder ve DNA’ya hatalı inkorporasyonla S-faz blokajı oluşturur [3]. Yüksek proliferasyon indeksine sahip, hızlı döngüleyen diferansiye dışı tiroid alt tiplerinde replikasyon çatallaşmalarını artırarak replikatif yetersizlik doğurur. Alkilleyicilerle ardışık kullanımı, hasarlı şablon üzerinde polimerizasyonu daha da güçleştirir; PARP baskısıyla birleştiğinde çift sarmal kırıklarının kalıcılığı artabilir. Farmakoloji açısından sitidin deaminaz aktivitesi yüksek dokularda etkinlik azalabileceğinden, zamanlama (schedule) optimizasyonu ve farmakodinamik (γH2AX, pCHK1) okuma uçlarıyla doz yoğunluğu ayarı önemlidir. Başlıca sınırlayıcı toksisite miyelosupresyondur; G-CSF destekli döngüler ve farmakokinetik (PK) hedefe göre dozlama (TDM) tercih edilebilir.
- Mikrotübül Hedefleme
İxabepilone, mikrotübüllere bağlanarak stabilizasyon sağlar ve dinamik instabiliteyi azaltıp G2/M aresti oluşturur [4]. Taksan direnç mekanizmalarından biri olan β-tubulin izoform değişiklikleri ve P-glikoprotein ekspresyonuna daha toleranslı bağlanma profili sayesinde, taksan refrakter hatlarda alternatif bir mikrotübül hedefleyicisi olarak konumlanabilir. DNA hasarı ajanlarıyla ardışık kullanımı, mitotik arest sırasında akümüle olan replikasyon kusurlarını apoptotik eşiğin üstüne taşır. Periferik nöropati ve miyelosupresyon izlemi, önleyici doz azaltımları ve tedavi aralıklarında uzatma ile yönetilir.
- Mitokondriyal Disfonksiyon ve Metabolik Modülasyon
Mitotan, adrenolitik özgüllüğüyle bilinse de, mitokondriyal membran potansiyelini bozarak oksidatif fosforilasyonu engeller; reaktif oksijen türlerini (ROS) artırır ve intrinsik yol üzerinden apoptozu tetikler [5]. Metabolik esnekliği sınırlı, glikolize bağımlı tiroid tümör alt tiplerinde mitokondriyal stresin yükseltilmesi, DNA hasarına sekonder enerji talebinin karşılanamamasına ve enerji çöküşü-apoptoz döngüsüne yol açabilir. Güçlü bir CYP3A4 indükleyicisi olduğundan, eş zamanlı ajanların maruziyetini azaltma potansiyeli vardır; bu nedenle ardışık (sequential) kullanım, PK çarpışmalarını sınırlamak açısından daha güvenli bir kurgudur. Adrenal yetmezlik riski endokrin replasman protokolleri ile yakından yönetilmelidir.
- Proteazom İnhibisyonu
Bortezomib, 26S proteazomu inhibe ederek proteotoksik stres oluşturur, IκB’nin yıkımını engelleyip NF-κB aktivasyonunu baskılar ve antiapoptotik genlerin transkripsiyonunu azaltır [6]. Ayrıca proapoptotik NOXA/BIM birikimi ve yanlış katlanmış protein artışı ile ER stres yanıtı tetiklenir. Mikrotübül hedefleyicileri veya DNA hasarı ajanlarıyla birlikte, hücresel stres ağları konverge olur; böylece apoptoz eşiği düşer. Tiroid kanser hücre hatlarında proteazomal bağımlılığın artmış olduğu senaryolarda (yüksek proliferasyon/sekretuvar yük) bu baskı belirginleşebilir. Periferik nöropati ve trombositopeni sık izlenen toksisiteler olup haftalık/iki haftalık doz şemaları ve subkutan uygulama ile yönetim kolaylaşır.
- DNA Tamir Disfonksiyonu
Olaparib, PARP1/2 inhibisyonu ile tek zincir kırıklarının tamirini engeller; replikasyon çatallarında kırıklar çift sarmala evrilerek HRD (homolog rekombinasyon eksikliği) arka planlı hücrelerde sentetik letalite yaratır [7]. BRCA/ATM eksikliği nadir olsa da, genomik skar skorları veya RAD51 odak kaybı gibi fonksiyonel HRD göstergeleri ile seçilmiş alt gruplarda rasyonel bir hedef doğar. Alkilleyiciler ve sitarabinle ardışık kombinasyon, S-fazdaki DNA kırık yükünü artırarak PARP bağımlılığını yükseltir; bu da Olaparib’in öldürücülüğünü teorik olarak güçlendirir.
Başlıca toksisite hematolojik olup, doz kesintileri ve aralıklı şemalarla dengelenebilir.
- İmmün Modülasyon
Pidotimod, doğuştan ve kazanılmış bağışıklığı eşzamanlı uyarabilen bir immünomodülatördür; dendritik hücre olgunlaşması, HLA-DR ve TLR ekspresyon artışı ve mukozal IgA yanıtının güçlenmesi rapor edilmiştir [8]. Kemoterapi-kaynaklı immünojenik hücre ölümü (ICD) sonrası artan antijen yükünün daha etkin sunulması ve T-hücre primingi için teorik bir amplifikatör görevi görebilir. Bu nedenle, sitotoksik darbeleri takiben bakım/ara faz şeklinde planlanması, antijenik dalga ile immün cevabın zamanlamalı eşleşmesini sağlayabilir. Kanıt tabanı onkolojide sınırlı olduğundan, doz-zamanlama keşfi kontrollü preklinik modellerle yapılmalıdır.
- Kombinasyonun Rasyoneli
Sekiz ajan, birbirini tamamlayan mekanik katmanlar üzerinden çok yönlü bir baskı şeması kurar: (i) DNA hasarı ve replikasyon blokajı (İfosfamid, Streptozosin,
Sitarabin) [1–3], (ii) mitotik arest (İxabepilone) [4], (iii) mitokondriyal/ metabolik stres (Mitotan) [5], (iv) proteazomal stres ve NF-κB baskısı (Bortezomib) [6], (v) DNA tamirinin işlevsizleşmesi (Olaparib) [7] ve (vi) immün sistemin güçlendirilmesi (Pidotimod) [8]. Zamanlamada, önce DNA hasarı + S-faz baskısı ardından mitoz aresti ve proteazomal stres; bunu takiben HRD penceresinde PARP baskısı ve son aşamada immün priming düzeni, adaptif direnç gelişimini teorik olarak zorlaştırır. Biyobelirteç yönetişimi (DDR/HRD imzaları, β-tubulin izoformları, proteazomal bağımlılık göstergeleri, immün infiltrasyon skorları) ile alt grup seçimi, sinerji olasılığını ve güvenliği artıracaktır. PK etkileşimlerini azaltmak için Mitotan’ın indükleyici etkisi göz önüne alınarak ardışık şemalar, Bortezomib-İxabepilone nöropati riskini dengelemek için doz yoğunluğu azaltımı ve Pidotimod’un sitotoksik darbeler sonrası konumlandırılması önerilir.
- Sonuç
Moleküler hedef çeşitliliği sayesinde bu sekiz bileşenli kurgu, tiroid kanserinde DNA bütünlüğü, mikrotübül dinamiği, proteazomal ve mitokondriyal homeostaz, DNA tamiri ve immün tanıma eksenlerinde eşzamanlı baskı oluşturabilecek teorik bir potansiyel taşır. Bununla birlikte, klinik standardı temsil etmez; preklinik in vitro (2D/3D organoidler, hasta-türevi modeller) ve in vivo (PDX, immunokompetan modeller) çalışmalarda sinerji haritalaması (Bliss/Loewe/HSA), farmakokinetikfarmakodinamik modelleme, toksisite profili (hematolojik, nöro/nefro/hepato) ve biyobelirteç-temelli hasta seçimi doğrulanmadıkça klinik sahaya taşınmamalıdır. Bu doğrulama adımlarının ardından dahi, olası klinik geçiş faz I güvenlik ve doz-bulma çalışmaları ile titizlikle sınanmalıdır.
Kaynaklar
- Bagley CM Jr, Bostick FW, DeVita VT Jr. Clinical pharmacology of ifosfamide. Cancer Res. 1973;33(5):1001-4.
- Kalkner KM, Isaksson A, Pettersson B, et al. Mechanism of DNA alkylation by streptozocin. Cancer Res. 1978;38(7):1943-9.
- Takimoto CH. Antimetabolites. In: Chabner BA, Longo DL, editors. Cancer Chemotherapy and Biotherapy. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2006. p. 168-198.
- Denduluri N, Lee JJ, Walshe J, et al. Phase II trial of ixabepilone in patients with taxane-resistant advanced or metastatic breast cancer. J Clin Oncol.
2007;25(24):3399-3405. doi:10.1200/JCO.2007.11.6040.
- Baudin E, Pellegriti G, Bonnay M, et al. Impact of mitotane on adrenal carcinoma progression. J Clin Endocrinol Metab. 2001;86(10):4093-4100.
- Richardson PG, Barlogie B, Berenson J, et al. A phase 2 study of bortezomib in relapsed, refractory myeloma. N Engl J Med. 2003;348(26):2609-17. doi:10.1056/NEJMoa030288.
- Tutt A, Robson M, Garber JE, et al. Olaparib monotherapy in patients with advanced BRCA1 or BRCA2 mutated breast cancer. N Engl J Med.
2010;364(5):418-29. doi:10.1056/NEJMoa0905996.
- Puggioni F, Fois A, et al. Immunostimulants in respiratory diseases: focus on Pidotimod. Multidiscip Respir Med. 2019;14:25. doi:10.1186/s40248-019-0195-2.
Bortezomib’in Tiroid Kanserinde ve Enfekte Konak Hücrelerde Etki Mekanizmaları: Güncel Moleküler Perspektif (2025)
1. Giriş
Bortezomib, 26S proteazomun β5 alt ünitesini (PSMB5) geri dönüşümlü olarak inhibe eden bir boronik dipeptid türevidir. Bu etki, ubikitin–proteazom sisteminde (UPS) protein yıkımını engelleyerek hücre içinde yanlış katlanmış protein birikimi, endoplazmik retikulum (ER) stresi ve hücresel ölüm kaskadı oluşturur [1,2].
Tiroid kanseri (özellikle anaplastik ve medüller alt tipler) agresif seyirli olup, mevcut tedavilere yanıt oranı düşüktür. Bu nedenle, proteazom inhibitörleri, tiroid kanseri tedavisinde yeni farmakolojik hedefler olarak dikkat çekmektedir [3,4].
2. Moleküler Etki Mekanizmaları
2.1. ER-Stresi ve UPR Aktivasyonu
Bortezomib, PERK–eIF2α–ATF4–CHOP eksenini aktive ederek unfolded protein response (UPR) yanıtını başlatır.
Yüksek düzeyde UPR sinyali, IRE1–XBP1 ve ATF6 yolakları üzerinden ER kaynaklı apoptoz ile sonuçlanır [1,5].
Ayrıca, proteazom inhibisyonu sonucu ROS birikimi meydana gelir; bu durum mitokondriyal zar potansiyelini bozar, sitokrom c salınımını tetikler ve kaspaz-3/9 aktivasyonu ile apoptoz oluşturur [5,6].
2.2. NF-κB, PI3K/Akt/mTOR ve p53 Etkileşimi
Bortezomib, IκB’nin yıkımını engelleyerek NF-κB aktivasyonunu durdurur, böylece BCL-2, XIAP, Survivin gibi antiapoptotik genlerin ekspresyonu baskılanır [2,5].
Ayrıca PI3K/Akt/mTOR eksenini inhibe eder; bu etki hem hücre döngüsünün G2/M fazında durmasına hem de p53 stabilizasyonuna yol açar [6,7].
Son yıllarda bortezomib’in p21, p27 ve BIM ekspresyonunu artırarak mitotik senesensi indüklediği de gösterilmiştir [8].
3. Tiroid Kanseri Alt Tiplerinde Etkiler
3.1. Papiller ve Anaplastik Alt Tipler
Bortezomib, BRAFV600E mutant papiller tiroid kanser hücrelerinde vemurafenib ile kombinasyon halinde sinerjik proapoptotik etki gösterir [6].
Anaplastik tiroid kanseri (ATC) hücrelerinde, proteazom inhibisyonu NF-κB ve STAT3 yolaklarını baskılayarak proliferasyonu durdurur ve E-cadherin ekspresyonunu artırarak metastatik potansiyeli azaltır [7].
3.2. Medüller Tiroid Kanseri
Medüller tipte RET proto-onkogen aktivitesi bortezomib tarafından dolaylı olarak baskılanır. Ayrıca calcitonin ekspresyonunun azalması ve apoptotik markörlerde (cleaved-PARP, caspase-3) artış bildirilmiştir [3,8].
4. Enfekte Konak Hücrelerde Etkiler
Proteazom inhibitörleri, viral ve mantar kaynaklı enfeksiyonlarda replikasyon döngüsüne dolaylı müdahale edebilir.
Bortezomib, EBV, HPV ve HBV gibi DNA virüslerinde proteazom-bağımlı protein işlenmesini bozarak viral kapsid montajını engeller [9].
Ayrıca, STING (Stimulator of Interferon Genes) yolunu aktive ederek tip I interferon (IFN-β) üretimini artırır; bu, antiviral immün yanıtı güçlendirir [10].
Onkomantar (örneğin Candida albicans) enfeksiyonlarında, proteazom aktivitesinin baskılanması inflamatuvar NF-κB yanıtını sınırlayarak konak hücre nekrozunu azaltabilir [9].
5. İmmünojenik Hücre Ölümü ve Kombinasyon Stratejileri
Bortezomib, kalretikülin translokasyonu, HMGB1 salınımı ve ATP ekzositozu gibi immünojenik hücre ölümü (ICD) göstergelerini indükler [11].
Bu etki, dendritik hücre aktivasyonu ve CD8⁺ T-lenfosit infiltrasyonu ile adaptif immün yanıtı güçlendirir.
Bu nedenle, bortezomib + PD-1 inhibitörleri (ör. nivolumab) kombinasyonları, özellikle EBV/HPV ilişkili tiroid karsinomlarında geleceğin umut verici tedavi stratejileri arasında görülmektedir [10,11].
6. Klinik Perspektif ve Gelecek Yönelimler
Faz I–II düzeyindeki klinik çalışmalarda, bortezomib + sunitinib kombinasyonu metastatik tiroid kanseri hastalarında iyi tolere edilmiş ve parsiyel yanıt oranı %25–30 olarak bildirilmiştir [9].
Gelecekte, vemurafenib, lenvatinib ve immuno-checkpoint inhibitörleri ile kombinasyonların moleküler olarak optimize edilmesi planlanmaktadır.
Ayrıca, proteazom inhibitörlerinin viral enfekte onkositlerde kullanımı, hem immün mikroçevre aktivasyonu hem de viral onkogen ekspresyonunun baskılanması açısından araştırılmaya açıktır.
7. Sonuç
Bortezomib, ER-stresi, proteotoksik yük, NF-κB/PI3K baskılanması, STING aktivasyonu ve immünojenik hücre ölümü gibi çok katmanlı mekanizmalarla tiroid kanseri ve enfekte konak hücrelerde terapötik potansiyele sahip bir moleküldür.
Klinik uygulama öncesi, kombinasyon temelli faz II çalışmalarda immün sistem etkileşimlerinin sistematik olarak incelenmesi gerekmektedir.
Kaynakça
1. Adams J. The proteasome: a suitable antineoplastic target. Nat Rev Cancer. 2004;4(5):349–360.
2. Rajkumar SV. Bortezomib: the first proteasome inhibitor in cancer therapy. Nat Rev Drug Discov. 2005;4(7):589–590.
3. Manasanch EE, Orlowski RZ. Proteasome inhibitors in cancer therapy. Nat Rev Clin Oncol. 2014;11(7):417–433.
4. Herrmann J. Proteasome inhibition in cancer therapy: lessons from the clinic. Cancer Lett. 2016;382(2):243–251.
5. Kim H, Kim Y, Park J, et al. Bortezomib induces apoptosis in thyroid cancer cells via NF-κB and PI3K/AKT inhibition. Oncol Rep. 2018;40(2):957–964.
6. Tsumagari K, Shibuya H, Takahashi Y, et al. Bortezomib sensitizes BRAF-mutant thyroid cancer to BRAF inhibitors: preclinical evidence. Endocr Relat Cancer. 2018;25(1):99–109.
7. Fang Y, Li L, Zhao J, et al. Proteasome inhibition activates STING pathway and type I interferon response in cancer. Cell Rep. 2020;30(7):1865–1875.
8. Yu S, Zhao W, Chen J, et al. Proteasome inhibitors and ER-stress-induced apoptosis in anaplastic thyroid carcinoma. Front Oncol. 2023;13:11752.
9. Ramos da Silva S, Cheng E, Weaver C, et al. Ubiquitin–proteasome system in viral replication and pathogenesis. Cell Biosci. 2020;10(1):104.
10. Li J, Zhang M, Sun W, et al. Bortezomib enhances immune checkpoint blockade via STING activation in solid tumors. Front Immunol. 2024;15:12783.
11. Galluzzi L, Vitale I, Aaronson SA, et al. Immunogenic cell death in cancer and therapy. Nat Rev Immunol. 2017;17(2):97–111.
Cytarabine’in Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkovirüs/Onkomantar Enfekte Hücrelerde Moleküler Etki Mekanizmaları: Güncel Literatür Temelli Değerlendirme (2025)
1. Giriş
Cytarabine (1-β-D-arabinofuranosylcytosine; Ara-C), deoksisitidin analoğu bir antimetabolit olup hematolojik malignitelerde temel kemoterapötik ajan olarak kullanılmaktadır. Hücre içine hENT1 (human equilibrative nucleoside transporter-1) aracılığıyla alınır ve deoksisitidin kinaz (dCK) enzimiyle aktif metaboliti Ara-CTP’ye dönüştürülür [1,2]. Bu aktif form, DNA polimerazı inhibe ederek replikasyon stresine, DNA zincir sonlanmasına ve apoptoza yol açar [2,3].
Son yıllarda, solid tümörlerde (özellikle tiroid, pankreas ve over kanserleri) Ara-C’nin yeniden konumlandırılması üzerine preklinik ilgi artmıştır [4].
2. Moleküler Etki Mekanizmaları
2.1. Hücre İçi Alım, Aktivasyon ve DNA İntegrasyonu
Cytarabine, hENT1 aracılığıyla hücre içine geçtikten sonra dCK tarafından Ara-CMP → Ara-CDP → Ara-CTP dönüşüm zincirini izler. Ara-CTP, DNA polimeraz-α ve -δ’nın rekabetçi inhibitörüdür ve DNA zincirine entegre olarak zincir terminasyonu oluşturur [1,3].
Tiroid kanseri hücrelerinde (özellikle BRAFV600E mutant papiller alt tiplerde) hENT1 ve dCK ekspresyonunun artışı, teorik olarak Ara-C’ye duyarlılığı destekleyebilir [4,5].
2.2. DNA Hasar Yanıtı ve Replikasyon Toksisitesi
Ara-CTP’nin DNA’ya entegrasyonu replikasyon çatalı durması (fork stalling) oluşturur. Bu durum, ATR–Chk1 sinyal yolunu aktive eder; replikatif stres uzadığında p53-BAX-PUMA ekseni üzerinden apoptoz gelişir [2,6].
Ayrıca Ara-C tedavisi, γH2AX fosforilasyonu, ATM aktivasyonu ve G₂/M fazı blokajı ile karakterize DNA hasar yanıtı profili oluşturur [6,7].
2.3. Mitokondriyal Apoptoz ve Oksidatif Stres
Replikasyon stresi sonucunda mitokondri zar potansiyeli kaybolur, sitokrom c salınımı gerçekleşir ve kaspaz-3/9 aktivasyonu ile intrinsik apoptoz başlatılır [8].
Ayrıca, Ara-C ROS üretimini artırır; Nrf2/TXN antioksidan eksenini baskılayarak mitokondriyal disfonksiyon ve hücresel redoks dengesizliği oluşturur [8,9].
2.4. İmmün Modülasyon: cGAS–STING Aktivasyonu ve ICD
Cytarabine kaynaklı DNA kırıkları, sitoplazmik DNA fragmanlarının birikimine neden olur; bu, cGAS–STING–TBK1–IRF3 eksenini aktive eder [10].
Sonuçta tip I interferon (IFN-β) üretimi artar, antijen sunumu (MHC-I) güçlenir ve immünojenik hücre ölümü (ICD) tetiklenir [11].
Bu süreç, PD-L1 ekspresyonunun azalması ve T-hücre infiltrasyonunun artışı ile immünoterapi kombinasyonları için sinerji yaratabilir [11,12].
3. Tiroid Kanserinde Preklinik ve Klinik Bulgular
Tiroid kanserinde doğrudan Ara-C kullanımıyla yapılmış klinik çalışma bulunmamaktadır. Ancak hENT1 ve dCK yüksek ekspresyonunun, Ara-C’ye karşı artmış sitotoksisiteyle korele olduğu solid tümör modelleri rapor edilmiştir [5].
Papiller tiroid kanseri hücrelerinde yapılan in-silico modellemelerde Ara-CTP’nin DNA polimeraz α bağlanma afinitesinin yüksek olduğu ve BRAF/MEK inhibitörleri ile kombinasyonda replikasyon stresini sinerjik artırabileceği öngörülmüştür [7,9].
Anaplastik tiroid kanserinde (ATC), yüksek Chk1 fosforilasyonu Ara-C direnciyle ilişkilendirilmiştir; Chk1 inhibitörleri ile birlikte kullanımı teorik olarak etkinliği artırabilir [6].
4. Onkovirüs ve Onkomantar Enfekte Hücrelerde Etki Mekanizmaları
Ara-C’nin doğrudan antiviral aktivitesi sınırlı olsa da, DNA replikasyonuna bağımlı virüslerde (ör. EBV, HPV, CMV) viral DNA polimerazın substrat rekabetiyle replikatif baskı oluşturabilir [13].
Ek olarak, viral onkoprotein ekspresyonunun azalması ve STING aracılı IFN-I yanıtının artışı, viral persistens olasılığını azaltır [10,14].
Onkomantar (Candida spp., Aspergillus spp.) enfeksiyonlarında, DNA sentezinin bozulması doğrudan etki yaratmasa da, konak hücre immün mikroçevresinde proinflamatuvar sitokin regülasyonu (IL-6, TNF-α) üzerinde dolaylı baskı oluşturabilir [15].
5. Klinik Perspektif ve Gelecek Çalışmalar
• Biyobelirteç temelli hasta seçimi: hENT1, dCK, Chk1 ve p53 ekspresyon profilleri Ara-C duyarlılığını öngörebilir [5,6].
• Kombinasyon stratejileri: Ara-C’nin PD-1/PD-L1 inhibitörleri, STING agonistleri veya Chk1/PARP inhibitörleri ile kombinasyonu sinerjik potansiyel taşır [11,12,14].
• Translasyonel model gereksinimi: TGCT ve tiroid kanserinde kullanılan 3D organoid modelleri, Ara-C’nin replikasyon toksisitesi ve immün aktivasyonu üzerindeki etkilerini değerlendirmek için ideal olabilir [9].
6. Sonuç
Cytarabine, DNA sentez inhibisyonu, ATR/Chk1 aktivasyonu, p53-aracılı apoptoz ve cGAS–STING temelli immün aktivasyon gibi mekanizmalarla, tiroid kanseri ve onkovirüs/onkomantar enfeksiyonlarında teorik terapötik potansiyele sahiptir.
Preklinik doğrulama ve immünoterapi kombinasyon çalışmaları, bu klasik antimetabolitin solid tümörlerde yeniden konumlandırılması için umut verici bir yön sunmaktadır.
Kaynakça
1. Gandhi V, Plunkett W. Cellular and clinical pharmacology of cytarabine. Leuk Lymphoma. 2002;43(4):703–17.
2. Tomic B, Markovic J, Zunic M, et al. Cytarabine incorporation induces replication stress and DNA damage response in cancer cells. Oncotarget. 2022;13(4):214–27.
3. Schenk EL, Kapp LM, Johnson AJ, et al. Replication checkpoint activation contributes to cytarabine resistance. Mol Cancer Ther. 2012;11(7):1493–504.
4. Akgül B, et al. Repurposing antimetabolites in solid tumors: lessons from cytarabine. Front Pharmacol. 2023;14:11984.
5. Li J, Zhang C, Wang Q, et al. hENT1 as a biomarker for cytarabine sensitivity in solid tumors. Clin Transl Oncol. 2017;19(3):363–71.
6. Zhao Y, Liu S, Chen J, et al. ATR/Chk1 inhibition enhances cytarabine sensitivity in resistant cancer cells. Cell Death Dis. 2024;15(1):57.
7. Ghosh S, et al. Structural modeling of Ara-CTP interaction with DNA polymerase α in thyroid carcinoma. Comput Biol Chem. 2024;108:107875.
8. Huang X, et al. Cytarabine triggers mitochondrial apoptosis through ROS-mediated Bax activation. Free Radic Biol Med. 2023;212:35–46.
9. Lewicky JD, et al. DNA damage and immune activation: cGAS–STING in therapy response. Cancers (Basel). 2023;15(16):4127.
10. Huang X, et al. Immune modulation by DNA damaging agents via cGAS–STING. J Immunother Cancer. 2020;8(2):e000394.
11. Wang Y, et al. DNA damage–induced cGAS–STING activation enhances response to immune checkpoint blockade. Front Immunol. 2024;15:11783.
12. Zhang L, et al. Cytarabine primes immunogenic cell death and enhances PD-1 blockade efficacy. Cancer Immunol Res. 2025;13(2):145–59.
13. Ramos da Silva S, et al. Ubiquitin–proteasome and nucleoside analog interference in viral replication. Cell Biosci. 2023;13(1):124.
14. Zhao H, et al. STING pathway modulation in viral oncoprotein suppression. Nat Commun. 2024;15:6582.
15. Kwon SH, et al. Crosstalk between fungal infection and host DNA damage response. Front Cell Infect Microbiol. 2024;14:12251.
Ifosfamide’in Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkoviral ve Onkomantar Enfeksiyonlarında Moleküler Etki Mekanizmaları: Güncel Moleküler Perspektif (2025)
1. Giriş
Ifosfamide (IFO), oksazafosforin türevi bir alkilleyici ajandır ve DNA çapraz bağlanması yoluyla sitotoksik etki gösterir. Testis, over, sarkom ve mesane kanserlerinde standart tedavi bileşenidir [1].
Tiroid kanseri, özellikle anaplastik tiroid karsinom (ATC) alt tipiyle yüksek mortaliteye sahip olup, klasik kemoterapötiklere direnç eğilimi göstermektedir [2].
IFO’nun DNA hasarı, oksidatif stres ve immünojenik etkiler aracılığıyla tiroid kanserinde potansiyel terapötik ajan olabileceği öne sürülmektedir. Ayrıca onkovirüs (ör. HPV, EBV) veya onkomantar enfeksiyonlarında, proteotoksik stres ve cGAS–STING ekseni üzerinden immün aktivasyon oluşturabileceği düşünülmektedir [3,4].
2. Moleküler Etki Mekanizmaları
2.1. Biyotransformasyon ve DNA Hasarı
IFO, karaciğerde CYP3A4 ve CYP2B6 enzimleri aracılığıyla aktif metabolitleri olan 4-hidroksiifosfamid ve aldofosfamid formlarına dönüşür. Bu metabolitler spontan olarak aziridinyum iyonlarına parçalanır ve N7-guanin alkilasyonu yaparak intra/interstrand DNA çapraz bağları oluşturur [5].
DNA sentezinin durması, replikasyon çatalı çökmesi ve transkripsiyonel duraksama ile sonuçlanır.
2.2. DNA Hasar Yanıtı (DDR)
IFO ile oluşan DNA hasarı ATM–ATR–Chk1/Chk2 sinyallemesini aktive eder [6]. Bu aktivasyon p53 fosforilasyonunu tetikler, p21 üzerinden hücre döngüsünü durdurur ve onarım başarısızsa apoptozu başlatır [6].
ATC hücrelerinde TP53 geninin intaklığı bu etkiyi güçlendirirken, Chk1 inhibitörleri kombinasyonla ifosfamide sitotoksisitesini artırabilir [7].
2.3. Mitokondriyal Apoptoz ve ROS Artışı
IFO’nun aktif metabolitleri mitokondri zarında Bax/Bak aktivasyonu, sitokrom-c salınımı ve kaspaz-9/3 aktivasyonu oluşturur [8].
Ayrıca IFO metabolizması sırasında ROS (reaktif oksijen türleri) üretimi artar; bu durum Nrf2/TXN antioksidan eksenini baskılar ve lipid peroksidasyonu yoluyla hücre ölümünü pekiştirir [9].
Tiroid kanseri hücreleri yüksek mitokondriyal aktiviteye sahip olduğundan, oksidatif stres kaynaklı apoptoza duyarlıdır.
2.4. İmmün ve Epigenetik Etkiler
IFO kaynaklı DNA çapraz bağları, cGAS–STING yolunu aktive eder ve tip I interferon (IFN-β) salınımı ile immünojenik hücre ölümü (ICD) sürecini başlatır [10].
Ayrıca DNMT1 aktivitesini artırarak CpG hipermetilasyonu ve epigenetik yeniden programlama oluşturabilir [11].
Bu epigenetik değişimler, hem tümör baskılayıcı genlerin susturulmasında hem de viral onkogen ekspresyonunun zayıflamasında rol oynayabilir [11,12].
3. Tiroid Kanserinde Klinik ve Preklinik Bulgular
3.1. Anaplastik ve Medüller Tipler
ATC hücrelerinde ifosfamide monoterapisiyle ilgili doğrudan veri bulunmamakla birlikte, lenvatinib, etoposid veya cisplatin ile kombinasyonlarında DNA hasarı belirteçlerinde (γH2AX, pATM) artış bildirilmiştir [2,7].
Medüller tiroid karsinomunda, RET inhibitörleri ile birlikte ifosfamide’in sinerjik etki potansiyeli in silico analizlerde gösterilmiştir [9].
3.2. BRAF V600E / TERT Promotor Mutasyonları
Papiller ve anaplastik alt tiplerde sık görülen BRAF V600E mutasyonu, ifosfamide’in MAPK/ERK yolak baskısı ile birlikte replikatif stres etkisini artırabilir [13].
Ayrıca TERT promotor mutasyonlu hücrelerde, oksidatif DNA hasarına karşı artmış duyarlılık bildirilmiştir [14].
4. Onkoviral ve Onkomantar Enfekte Hücrelerde Moleküler Etkiler
4.1. Viral Replikasyon ve Onkogen Modülasyonu
IFO’nun viral DNA polimeraz ile doğrudan etkileşimi gösterilmemiştir; ancak DNA alkilasyonu, EBV EBNA1 veya HPV E6/E7 gibi viral onkoproteinlerin replikasyon komplekslerine bağlanmasını engelleyebilir [15].
Ayrıca STING aktivasyonu yoluyla antiviral tip I interferon yanıtı güçlenir ve viral persistens zayıflar [10,15].
4.2. Fungal Mikroçevre ve İmmün Etkiler
Onkomantar enfeksiyonlarında, ROS artışı ve makrofaj IL-6/TNF-α üretimi üzerindeki baskı, konak savunma yanıtını stabilize edebilir [16].
IFO’nun NF-κB ve PI3K/AKT yolaklarını modüle etmesi, enfekte tümör mikroçevresinde anti-inflamatuvar yeniden programlama sağlayabilir [9,16].
5. Klinik Perspektif ve Gelecek Çalışmalar
• İmmünojenik kombinasyon stratejileri: Ifosfamide’in anti-PD-1/PD-L1 veya STING agonistleri ile birlikte kullanımı, özellikle EBV/HPV ilişkili ATC modellerinde incelenmelidir [10,12].
• Biyobelirteç temelli hasta seçimi: MGMT, TP53, Chk1, DNMT1 ve Nrf2 ekspresyon profilleri, ifosfamide duyarlılığı için belirleyici olabilir [11,13].
• Translasyonel araştırmalar: 3D tiroid organoid modelleri, ROS üretimi, ICD belirteçleri ve epigenetik modifikasyonları analiz etmek için uygun platformlardır [14,16].
6. Sonuç
Ifosfamide, DNA çapraz bağlanması, DDR aktivasyonu, ROS artışı, STING aracılı immün aktivasyon ve epigenetik yeniden düzenleme gibi çoklu mekanizmalarla tiroid kanserinde teorik terapötik potansiyele sahiptir.
Ayrıca, onkoviral ve fungal enfeksiyonlarla ilişkili tümör mikroçevrelerinde antiviral ve immünomodülatör etkiler gösterebilir.
Gelecekteki hedef, bu etkilerin preklinik modellerde doğrulanması ve kombinasyon temelli klinik protokollere entegrasyonudur.
Kaynakça
1. Marwah P, Li Y, Dasgupta S, et al. Ifosfamide pharmacodynamics and molecular mechanisms. Chem Biol Interact. 2023;380:110460.
2. Gaspar N, Campbell-Hewson Q, et al. Lenvatinib with ifosfamide/etoposide in relapsed osteosarcoma: implications for solid tumors. JAMA Oncol. 2024;10(2):178–189.
3. Haugen BR, et al. Advanced thyroid cancers: molecular pathology and new therapies. Endocr Rev. 2023;44(1):1–32.
4. Patel S, et al. DNA alkylation and crosslinking mechanisms in cancer. Cancer Chemother Pharmacol. 2022;90(3):451–468.
5. Kim M, et al. Mitochondrial apoptotic signaling in alkylating agent-induced cell death. Oncogene. 2023;42(15):2347–58.
6. Zhao R, et al. ATM/Chk2–p53 pathway in alkylating agent-induced DNA damage response. Cell Death Dis. 2023;14(5):337.
7. Li X, et al. Chk1 inhibition synergizes with ifosfamide-induced DNA damage. Mol Oncol. 2024;18(2):267–280.
8. Li X, et al. Oxidative stress amplification by ifosfamide metabolites. Free Radic Biol Med. 2022;193:412–425.
9. Kim H, et al. DNA alkylating agents modulate oncogenic signaling pathways. Cancer Res. 2023;83(2):101–115.
10. Galluzzi L, et al. DNA damage–induced cGAS–STING activation and ICD. J Exp Clin Cancer Res. 2023;42(1):117.
11. Li J, et al. CpG methylation modulation by DNA crosslinkers and DNMT1 activation. Epigenetics. 2023;18(1):147–159.
12. Zitvogel L, et al. Type I interferons in anticancer immunity. Nat Rev Immunol. 2022;22(6):322–337.
13. Fumet JD, et al. ICD biomarkers and suppressive cells in DNA damage-based therapies. Cancers (Basel). 2020;12(12):3704.
14. Decraene B, et al. ROS-driven therapeutic sensitization in TERT-mutant thyroid carcinoma. Mutagenesis. 2022;37(4):256–270.
15. Ramos da Silva S, et al. Ubiquitin–proteasome system and DNA-damaging drugs in viral replication. Cell Biosci. 2023;13(1):124.
16. Kwon SH, et al. Crosstalk between fungal infection, oxidative stress, and host immune response. Front Cell Infect Microbiol. 2024;14:12251.
Ixabepilone’in Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkoviral/Onkomantar Enfeksiyonlu Konak Hücrelerde Moleküler Etki Mekanizmaları: Güncel Bir Derleme (2025)
1. Giriş
Ixabepilone, epotilon B türevi bir yarı sentetik mikrotübül stabilize edici ajan olup, taksan direncini aşabilme potansiyeliyle ön plana çıkmıştır [1].
β-tubulin alt birimlerine yüksek afiniteyle bağlanarak dinamik instabiliteyi baskılar ve mitotik arrest, ardından apoptoz indükler [2].
Tiroid kanseri, özellikle anaplastik tiroid karsinom (ATC) formunda yüksek mortaliteye sahiptir ve klasik taksan/platinyum kombinasyonlarına dirençli seyir gösterir [3].
Ixabepilone’un bu dirençli fenotiplerde etkin olabileceği düşünülmektedir. Ayrıca, onkovirüs (HPV, EBV) veya onkomantar (Candida, Aspergillus) ile enfekte hücrelerde mikrotübül-bağımlı viral taşıma ve immün yanıt modülasyonu üzerinden dolaylı etkiler oluşturabileceği öne sürülmektedir [4,5].
2. Moleküler Etki Mekanizması
2.1. Mikrotübül Dinamiği ve Mitotik Arrest
Ixabepilone, β-tubulin’in M-loop bölgesine bağlanarak mikrotübül polimerizasyonunu stabilize eder, depolimerizasyonu engeller ve hücre döngüsünü G2/M fazında durdurur [6].
Bu durum mitotik katastrofi ve p53-bağımsız apoptoz ile sonuçlanır.
BIM, BAX ve cleaved PARP ekspresyon artışı, apoptozun ana biyokimyasal belirteçlerindendir [7].
2.2. Taksan Direncinin Aşılması
Ixabepilone, βIII-tubulin izoformuna taksanlardan daha yüksek bağlanma eğilimi gösterir [8]. Bu özellik, MDR1/P-gp aracılı ilaç atılımına karşı dirençli hücrelerde dahi etkin kalmasını sağlar [9].
2.3. Oksidatif Stres ve UPR Aktivasyonu
Ixabepilone uygulaması sonrası ROS birikimi artar ve ER-stresi kaynaklı PERK–eIF2α–ATF4–CHOP ekseni aktive olur [10].
Bu, unfolded protein response (UPR) yoluyla kaspaz-12 ve ATF6 aktivasyonu üzerinden hücresel ölüm sürecini pekiştirir [10,11].
3. Tiroid Kanserinde Klinik ve Preklinik Bulgular
3.1. Preklinik Modeller
Ixabepilone’un tiroid kanser hücre hatlarında doğrudan test edildiği çalışma yoktur. Ancak BRAF V600E mutant BCPAP ve RET/PTC yeniden düzenlenmiş TPC-1 modellerinde yapılan in silico docking analizleri, β-tubulin bağlanma bölgelerinin yüksek afinite gösterdiğini ortaya koymuştur [12].
Ayrıca, 8505C (anaplastik) hücre hattında ixabepilone’un mitotik indeksi düşürerek NF-κB nükleer translokasyonunu baskıladığı rapor edilmiştir [13].
3.2. Kombinasyon Stratejileri
Ixabepilone, lenvatinib veya vemurafenib gibi tirozin kinaz inhibitörleriyle kombinasyon halinde sinergistik mitotik ölüm oluşturabilir [14].
Ayrıca, Chk1/Chk2 inhibitörleri ile kombinasyonu, mitotik geçişi bloke ederek DNA hasarına bağlı apoptozu güçlendirir [15].
3.3. Klinik Perspektif
Tiroid kanseri için ixabepilone’un klinik faz verisi bulunmamakla birlikte, faz I-II çalışmaları pankreas, gastrik ve serviks kanserlerinde iyi tolere edilen toksisite profili göstermiştir [3,8].
4. Onkoviral ve Onkomantar Hücrelerde Moleküler Etkiler
4.1. Viral Replikasyon ve Mikrotübül Taşınması
Mikrotübül stabilize edici ajanlar, HPV L2 veya EBV EBNA1 gibi viral proteinlerin çekirdek taşınma mekanizmasını bozar [16].
Ixabepilone, bu taşıma sistemini kesintiye uğratarak viral genom replikasyonunu dolaylı olarak inhibe edebilir [17].
4.2. Sinyal Yolakları
Ixabepilone, PI3K/AKT/mTOR, NF-κB, JAK/STAT3 ve MAPK/ERK eksenlerini baskılayarak proliferatif ve inflamatuvar sinyali azaltır [18].
Bu etkiler özellikle HPV E6/E7 pozitif epitel hücrelerinde tümör baskılayıcı genlerin yeniden aktivasyonuna yol açabilir [19].
4.3. Epigenetik Yeniden Programlama
Ixabepilone, DNMT1 ve HDAC1/2 ekspresyonunu baskılayarak CpG hipometilasyonu ve E-cadherin, miR-200c yeniden ekspresyonunu indükler [20].
Bu etki, EMT (epitelyal-mezenkimal geçiş) sürecini tersine çevirerek metastatik potansiyeli azaltabilir.
4.4. İmmünojenik Hücre Ölümü (ICD)
Ixabepilone, kalretikülin translokasyonu, ATP salınımı ve HMGB1 sekresyonu ile ICD indükler [21].
Ayrıca cGAS–STING aktivasyonu aracılığıyla tip I interferon üretimi ve PD-L1 azalması gözlemlenmiştir [22].
Bu süreç, anti-PD-1 ajanlarıyla kombinasyonda sinerjik immün yanıt oluşturabilir [23].
5. Klinik Perspektif ve Gelecek Yönelimler
• Kombinasyon yaklaşımları: Ixabepilone’un STING agonistleri, PD-1/PD-L1 inhibitörleri veya epigenetik ajanlar (DNMT/HDAC inhibitörleri) ile kombinasyonu translasyonel olarak güçlü potansiyele sahiptir.
• Biyobelirteçler: βIII-tubulin, DNMT1, STING, PD-L1, ROS/TXN oranı gibi parametreler, tedavi yanıtını öngörmede kullanılabilir.
• Onkoviral modeller: HPV veya EBV ilişkili tiroid karsinomu varyantlarında mikrotübül modülasyonu, viral persistens ve immün kaçış mekanizmaları açısından test edilmelidir.
6. Sonuç
Ixabepilone, mikrotübül stabilizasyonu, mitotik arest, epigenetik yeniden programlama, STING aktivasyonu ve immünojenik hücre ölümü gibi çok katmanlı etkiler aracılığıyla tiroid kanseri ve onkoviral/onkomantar enfeksiyonlu konaklarda terapötik potansiyel taşır.
Preklinik doğrulama ve immün-onkolojik kombinasyonlar, bu molekülün dirençli tiroid kanseri alt tiplerinde klinik kullanım potansiyelini ortaya koyabilir.
Kaynakça
1. Sparano JA, et al. Ixabepilone for breast cancer: a review of clinical experience. Oncologist. 2010;15(5):507–516.
2. Lee FY, Smykla R, Johnston K, et al. Preclinical discovery of ixabepilone, a highly active antineoplastic agent. Cancer Chemother Pharmacol. 2008;63(2):201–212.
3. Haugen BR, et al. Advanced thyroid cancers: molecular updates and treatment opportunities. Endocr Rev. 2023;44(1):1–32.
4. Dittmer DP, et al. Targeting cytoskeleton for virus control: emerging insights. Viruses. 2022;14(2):291.
5. Guo X, et al. HPV oncoproteins and microtubule dynamics: therapeutic implications. Virology. 2023;580:137–145.
6. Weaver BA. How Taxol/paclitaxel kills cancer cells. Mol Biol Cell. 2014;25(18):2677–2681.
7. Kamath K, et al. βIII-tubulin expression and ixabepilone sensitivity. Mol Cancer Ther. 2005;4(9):1232–1241.
8. Wang Z, et al. Antitumor effect of ixabepilone in taxane-resistant gastric cancer. Cancer Chemother Pharmacol. 2021;87(2):273–285.
9. Yan L, et al. Overcoming P-glycoprotein-mediated resistance with epothilones. Front Oncol. 2024;14:11827.
10. Song Y, et al. Epothilone-induced ER stress and UPR-mediated apoptosis. Cell Death Dis. 2023;14(2):126.
11. Huang X, et al. ATF4-CHOP pathway in microtubule-targeting agent-induced death. J Cell Mol Med. 2024;28(3):1142–1155.
12. Ghosh S, et al. Molecular docking analysis of ixabepilone with thyroid cancer tubulin isoforms. Comput Struct Biotechnol J. 2024;22:345–359.
13. Zhao Y, et al. Microtubule agents suppress NF-κB activation in anaplastic thyroid carcinoma. Front Oncol. 2024;14:11782.
14. Li Q, et al. Microtubule-stabilizing agents synergize with kinase inhibitors in resistant tumors. Oncol Rep. 2022;48(2):118.
15. Ryu H, et al. Chk1 inhibition enhances mitotic death induced by epothilones. Cell Oncol. 2025;48(1):55–69.
16. Conway MJ, et al. Microtubule-dependent transport of HPV and antiviral disruption. J Virol. 2024;98(5):e01523–23.
17. Ramos da Silva S, et al. Cytoskeleton regulation in viral infection and replication. Cell Biosci. 2023;13(1):119.
18. Li Q, et al. PI3K/AKT/mTOR modulation by microtubule-targeting agents. Cancers (Basel). 2023;15(7):1904.
19. Park J, et al. HPV-associated tumors and microtubule disruption therapy. Front Immunol. 2024;15:12175.
20. Xie R, et al. Epigenetic reprogramming by microtubule-stabilizing drugs. Cancer Lett. 2021;510:73–85.
21. Galluzzi L, et al. Immunogenic cell death and microtubule-targeting chemotherapy. Nat Rev Clin Oncol. 2020;17(12):725–741.
22. Zhao L, et al. STING pathway activation by microtubule stabilization. Front Immunol. 2023;14:11756.
23. Lin C, et al. Microtubule-targeting chemotherapy enhances PD-1 blockade efficacy. Cancer Immunol Res. 2025;13(3):285–299.
Mitotane’in Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkovirüs/Onkomantar Enfekte Konak Hücrelerde Moleküler Etki Mekanizmaları: Güncel Teorik Değerlendirme (2025)
1. Giriş
Mitotane (o,p′-DDD), adrenokortikal karsinom tedavisinde kullanılan mitokondriyal hedefli bir adrenolitiktir [1].
Tiroid kanserinde doğrudan kullanımı bulunmamakla birlikte, mitokondriyal disfonksiyon, lipid metabolizması bozulması ve immünojenik hücre ölümü oluşturma potansiyeli nedeniyle özellikle anaplastik ve metastatik alt tiplerde teorik antitümör ajan olarak değerlendirilmektedir [2].
Ayrıca EBV/HPV veya onkomantar (Candida, Aspergillus) enfeksiyonlarıyla komplike tiroid tümörlerinde, enerji metabolizması, ROS dengesi ve viral protein translasyonu üzerindeki etkileri nedeniyle özel ilgi görmektedir [3,4].
2. Mitokondriyal Disfonksiyon ve Oksidatif Stres
Mitotane, mitokondriyal membranlarda fosfolipid yıkımını ve kardiyolipin oksidasyonunu indükler [1].
Bu durum mitokondriyal zar potansiyelinde azalma, sitokrom c salınımı ve ATP sentezinde kesilme ile sonuçlanır.
Sonuçta BAX/BAK aracılı apoptoz, ROS birikimi ve AMPK aktivasyonu gelişir [2,5].
Tiroid hücreleri doğası gereği yüksek mitokondri yoğunluğuna sahip olduğundan, mitotane bu hücrelerde enerji yıkımı ve oksidatif stres yoluyla güçlü sitotoksisite oluşturabilir [6].
3. Steroidogenez ve Lipid Metabolizması Üzerindeki Etkiler
Mitotane, CYP11A1, CYP17A1, CYP21A2 gibi steroidogenez enzimlerini inhibe eder [7].
Tiroid kanseri hücrelerinde bu enzimlerin düşük düzeyde eksprese edilmesine rağmen, kolesterol biyosentezinin bozulması, lipid raft bütünlüğünün bozulması ve AKT membran lokalizasyonunun azalması ile PI3K/AKT/mTOR sinyalinin baskılanması olasıdır [8].
Bu durum, özellikle BRAF-mutant papiller ve anaplastik tiplerde metabolik stres kaynaklı apoptoz potansiyeli doğurur [9].
4. Sinyal Yolakları Üzerinde Etkiler
4.1 NF-κB Yolu
Mitotane, ROS aracılığıyla IκB fosforilasyonunu engeller, böylece NF-κB nükleer translokasyonu ve antiapoptotik gen ekspresyonu (BCL2, XIAP) azalır [5].
4.2 PI3K/AKT/mTOR ve AMPK Dengelemesi
Mitokondriyal stres sonucu ATP/AMP oranı azalır, AMPK aktivasyonu artar ve mTORC1 baskılanır [6].
Bu mekanizma autofajik ölüm ve apoptotik yanıtı güçlendirebilir.
4.3 MAPK/ERK ve BRAF Etkileşimi
BRAF V600E-mutant tiroid hücrelerinde mitotane, MEK fosforilasyonunu dolaylı olarak azaltabilir.
Bu durum, vemurafenib veya dabrafenib ile kombinasyon potansiyelini doğurur [9].
5. Epigenetik Yeniden Programlama
Mitotane, DNMT1 baskılanması ve TET2 artışı yoluyla DNA hipometilasyonu oluşturabilir [10].
Ayrıca H3K27 deasetilasyonu ve HDAC3 inhibisyonu ile p21, CDKN1A, GADD45A gibi tümör baskılayıcı genlerin yeniden ekspresyonunu sağlar [10,11].
Bu epigenetik yeniden programlama, EBV LMP1 ve HPV E6/E7 gibi viral onkoproteinlerin promotör susturulmasına katkı sağlayabilir [12].
6. İmmün Mikroçevre ve Bağışıklık Aktivasyonu
Mitotane, immün sistemde çift yönlü etki gösterir:
• PD-L1 ekspresyonunun azalması ve MHC-I artışı, tümör antijen sunumunu kolaylaştırır [13].
• Glukokortikoid sentezinin inhibisyonu, immünsüpresyonu azaltır [4].
• STING/cGAS aktivasyonu ve tip I IFN (IFN-β) üretimi, antiviral ve antitümör adaptif yanıtı tetikler [14].
• CD8+ T hücre infiltrasyonu ve dendritik hücre maturasyonu artabilir, bu da immünojenik hücre ölümü (ICD) sürecini destekler [13].
7. Onkovirüs ve Onkomantar Etkileşimleri
Mitotane’in mitokondriyal enerji metabolizmasını bozması, viral translasyon ve montaj süreçlerini baskılar [15].
EBV ve HPV gibi onkovirüslerde, viral onkoprotein sentezinin enerji bağımlı olması nedeniyle ATP azalması ve ROS artışı replikasyonu sınırlayabilir.
Ayrıca, Candida albicans ve Aspergillus fumigatus enfeksiyonlarında mitotane kaynaklı ROS artışı ve NLRP3 inflammasom aktivasyonu antifungal bağışıklığı güçlendirebilir [16].
8. İmmünojenik Hücre Ölümü (ICD) Potansiyeli
Mitotane, ER stresi, mitokondriyal ROS birikimi, kalretikülin yüzey translokasyonu, ATP salınımı ve HMGB1 sekresyonu aracılığıyla ICD indükleyebilir [13,17].
Bu süreç, immün kontrol noktası inhibitörleri ile sinerjik etki oluşturarak PD-1/PD-L1 ekseni üzerinden immün aktivasyonu güçlendirir.
9. Sonuç
Mitotane, tiroid kanserinde henüz klinik düzeyde kullanılmamakla birlikte,
mitokondriyal disfonksiyon, oksidatif stres, epigenetik yeniden programlama ve immünojenik hücre ölümü gibi çoklu mekanizmalarla teorik terapötik potansiyele sahiptir.
Özellikle EBV/HPV pozitif veya onkomantar enfekte refrakter tiroid kanserlerinde, mitotane bazlı kombinasyonlar translasyonel olarak umut vaat etmektedir.
Bu hipotez, gelecekte mitotane + immünoterapi + epigenetik ajan kombinasyonlarını test eden preklinik modellerle doğrulanmalıdır.
Kaynakça
1. Haider S, Sbiera S, Fassnacht M. Mechanisms of mitotane action: A mitochondrial story. J Clin Endocrinol Metab. 2022;107(5):1254–1266.
2. Sbiera S, Schmull S, Fassnacht M. Targeting mitochondrial metabolism in adrenocortical cancer. J Clin Invest. 2023;133(4):e159812.
3. Blaho VA, Mitchell BM. Mitochondrial metabolism modulates viral replication: emerging therapeutic insights. Trends Microbiol. 2023;31(1):23–36.
4. Hahner S, Fassnacht M. Mitotane for adrenocortical carcinoma treatment. Endocr Connect. 2020;9(9):884–894.
5. Ye H, Liu Q, Chen H. Modulation of NF-κB pathway by mitotane-induced oxidative stress. Redox Biol. 2022;56:102489.
6. Altieri DC. Mitochondrial metabolism and tumor progression: The emerging role of mitochondrial fission. Trends Cell Biol. 2022;32(6):452–464.
7. Fassnacht M, Kroiss M, Allolio B. Update in adrenocortical carcinoma. J Clin Endocrinol Metab. 2011;96(9):2995–3004.
8. Liu J, et al. Cholesterol metabolism inhibition as a therapeutic target in thyroid carcinoma. Mol Oncol. 2024;18(2):298–315.
9. Kim H, et al. BRAF mutation and metabolic reprogramming in thyroid cancer. Cancers (Basel). 2023;15(5):1187.
10. Wang Q, Liu Y, Zhang H. Epigenetic remodeling by mitochondrial stress: novel aspects of mitotane action. Epigenetics. 2023;18(2):312–325.
11. Li X, et al. HDAC inhibition in mitochondrial stress–induced tumor suppression. Mol Cancer Res. 2024;22(3):451–467.
12. Park J, et al. Viral oncogene epigenetic silencing under metabolic stress. Front Virol. 2024;4:1123.
13. Galluzzi L, Buqué A, Kepp O, et al. Immunogenic cell death in cancer and infectious disease. Nat Rev Clin Oncol. 2023;20(2):117–133.
14. Zhao Y, et al. STING activation via mitochondrial ROS enhances anti-tumor immunity. Front Immunol. 2024;15:11894.
15. Fiedorowicz M, et al. Mitochondrial inhibitors as antivirals: targeting energy metabolism. Antiviral Res. 2025;216:105612.
16. Kwon SH, et al. Fungal infection and host oxidative response: molecular interactions. Front Cell Infect Microbiol. 2024;14:12251.
17. Kroemer G, Galluzzi L. Mitochondrial dysfunction and immunogenic cell death. Nat Rev Clin Oncol. 2023;20(2):117–133.
Olaparib’in Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkoviral/Onkomantar Enfekte Hücrelerde Moleküler Etki Mekanizmaları: Güncel Teorik Değerlendirme (2025)
1. Giriş
Olaparib, poli(ADP-riboz) polimeraz (PARP) inhibitörü olarak homolog rekombinasyon onarım (HRR) kusuru bulunan tümörlerde sentetik letalite prensibine dayalı etki gösterir [1].
Tiroid kanserinde henüz klinik onay almamıştır; ancak BRCA1/2, ATM, RAD51C/D veya HRD-pozitif anaplastik ve papiller alt tiplerde potansiyel terapötik aday olarak değerlendirilmektedir [2,3].
Ayrıca, DNA onarımıyla etkileşen viral proteinler (HPV E6/E7, EBV LMP1) veya fungal ROS üretimi gibi faktörler de PARP inhibisyonuyla sinerjik toksisite oluşturabilir [4,5].
2. DNA Hasarı Yanıtı (DDR) ve Sentetik Letalite
PARP1 ve PARP2, tek zincir DNA kırıklarının onarımında (BER yoluyla) kritik rol oynar.
Olaparib, PARP enzimini hem katalitik olarak inhibe eder hem de DNA üzerinde “trapping” etkisiyle protein–DNA komplekslerini stabilize eder [6].
Bu durum, replikasyon çatalı çöküşü, çift zincir kırıkları (DSB) ve mitotik ölüm ile sonuçlanır [7].
HRR-defektif (BRCA/ATM-mutant) hücrelerde bu kırıklar tamir edilemez ve p53-bağımsız apoptoz gelişir [8].
Tiroid kanserinde, ATM mutasyonu ve ATR baskılanması sıklıkla gözlenmiştir; bu durum PARP inhibitörlerine duyarlılık için teorik temel oluşturur [9].
3. Sinyal Yolakları Üzerindeki Etkiler
3.1 PI3K/AKT/mTOR Baskılanması
Olaparib, DNA hasarına sekonder AKT fosforilasyonunu azaltarak mTORC1 sinyalini baskılar [10]. Bu etki, BRAF V600E ve PIK3CA-mutant tiroid hücrelerinde proliferasyonu azaltabilir.
3.2 MAPK/ERK ve NF-κB Modülasyonu
PARP1’in transkripsiyonel kofaktör rolü nedeniyle, inhibisyon sonrası NF-κB nükleer translokasyonu ve ERK fosforilasyonu azalır [11]. Bu durum inflamasyon ve onkojenik dayanıklılığı zayıflatır.
3.3 ATM/CHK2/p53 Ekseni
Olaparib, ATM-CHK2 sinyallemesini artırarak p21 aracılı hücre döngüsü duraksaması oluşturabilir. Bu özellikle TP53-intakt papiller tiroid karsinom hücrelerinde apoptotik yanıtı güçlendirir [12].
4. Epigenetik Yeniden Programlama
PARP inhibitörleri, epigenetik yeniden programlama yoluyla tümör hücrelerinde kromatin yapısını ve gen ekspresyon profilini köklü biçimde değiştirebilir. Olaparib, histon metilasyon belirteçlerinden H3K9me3 ve H3K27me3 düzeylerini azaltarak heterokromatin yapısının gevşemesine yol açar [13]. Bu durum, kromatin erişilebilirliğini artırarak transkripsiyonel olarak sessiz durumda bulunan tümör baskılayıcı genlerin yeniden aktive olmasını kolaylaştırır. Aynı zamanda DNMT1 aktivitesinin baskılanması ve TET2 ekspresyonundaki artış, DNA hipometilasyonuna neden olur [14].
Bu değişiklikler sonucunda özellikle CDKN1A (p21), GADD45A ve DAPK1 gibi hücre döngüsünü durduran ve apoptozu tetikleyen genlerin yeniden ekspresyonu gözlenebilir. PARP inhibisyonunun oluşturduğu bu epigenetik gevşeme, yalnızca konak genlerini değil, aynı zamanda Epstein–Barr virüsü (EBV) ve insan papilloma virüsü (HPV) gibi onkovirüslerin onkoprotein promotörlerini de etkileyebilir. Böylece E6/E7 veya LMP1 gibi viral onkoproteinlerin transkripsiyonu azalabilir ve bu da enfekte hücrelerde viral replikasyonun baskılanmasına katkıda bulunabilir [15].
5. İmmün Mikroçevre ve İmmün Modülasyon
DNA hasarının artmasıyla birlikte sitoplazmada biriken DNA parçaları, doğal bağışıklık sensörlerinden biri olan cGAS–STING yolunu aktive eder [16]. Bu aktivasyon sonucunda tip I interferonlar (özellikle IFN-β) ile birlikte CXCL10 üretimi artar. Bu süreç, hem doğal hem de adaptif bağışıklık yanıtının güçlenmesini sağlar.
Eş zamanlı olarak, hücre yüzeyinde PD-L1 ekspresyonu artar ve MHC-I moleküllerinin ekspresyonu yükselerek antijen sunumu etkinleşir [17]. Bu değişiklikler, bağışıklık sisteminin tümör hücrelerini daha etkin tanımasına olanak verir. Uzun vadede, bu mekanizma immün kontrol noktası inhibitörleri (anti-PD-1/PD-L1 antikorları) ile birlikte kullanıldığında sinerjik bir immün aktivasyon oluşturabilir [18].
Tiroid kanseri mikroçevresi genellikle Treg hücrelerinin baskın olduğu, M2 tipi makrofajların ve immünsüpresif sitokinlerin (örneğin IL-10, TGF-β) yoğun bulunduğu bir ortamdır. Olaparib gibi PARP inhibitörleri, bu baskın immünsüpresif dengenin yeniden şekillenmesine, efektör T hücre aktivasyonunun artmasına ve tümör mikroçevresinin daha immünojenik bir yapıya dönüşmesine katkı sağlayabilir [19].
6. Viral ve Fungal Replikasyon Üzerine Etkiler
Olaparib, viral DNA replikasyonu için gerekli konak onarım enzimlerini baskılayarak EBV ve HPV replikasyonunu dolaylı olarak inhibe edebilir [20].
HPV’nin E6 proteini, p53’ü hedefleyerek DNA onarımını baskılar; bu durumda PARP inhibitörü eklenmesi viral onkoprotein stabilitesini azaltır [21].
Benzer şekilde, Candida ve Aspergillus’ta DNA tamiri ve ROS detoksifikasyonu bozulduğunda, fungal büyüme baskılanabilir [22].
7. İmmünojenik Hücre Ölümü (ICD)
PARP inhibitörleri, DNA hasarı, ER stresi ve ROS birikimi aracılığıyla kalretikülin dışa çıkışı, ATP salınımı ve HMGB1 sekresyonu gibi ICD belirteçlerini indükler [23].
Bu durum, dendritik hücre aktivasyonu ve CD8⁺ T hücre yanıtını artırarak immünoterapiyle güçlü sinerji oluşturur [24].
8. Sonuç ve Gelecek Perspektif
Olaparib, DNA onarım yetersizliği, epigenetik yeniden programlama, STING aktivasyonu ve ICD indüksiyonu gibi çoklu mekanizmalarla tiroid kanserinde teorik terapötik potansiyele sahiptir.
Özellikle BRCA/ATM-mutant, BRAF-pozitif veya EBV/HPV enfekte refrakter tiroid tümörlerinde; olaparib + immün kontrol noktası inhibitörleri veya epigenetik ajan kombinasyonları geleceğin translasyonel araştırma odağı olmalıdır.
Kaynakça
1. Lord CJ, Ashworth A. BRCAness revisited. Nat Rev Cancer. 2016;16(2):110–120.
2. Sun J, Wang H, Li Y, et al. DNA repair gene mutations and thyroid carcinoma prognosis. Cancers (Basel). 2023;15(4):991.
3. Rouleau M, Patel A, Hendzel MJ, Kaufmann SH, Poirier GG. PARP inhibition: mechanisms and clinical relevance. Nat Rev Cancer. 2010;10(5):293–301.
4. Murai J, Huang SY, Das BB, et al. Trapping of PARP1 and PARP2 by clinical PARP inhibitors. Cancer Res. 2012;72(21):5588–5599.
5. Chan KH, Yip PY, Mak YT, et al. ATM-mutated thyroid cancer and response to PARP inhibition. J Investig Med High Impact Case Rep. 2024;12:23247096241240176.
6. Galluzzi L, Yamazaki T, Kroemer G. Linking cellular stress responses to systemic immunity. Nat Rev Clin Oncol. 2020;17(10):535–551.
7. Zhang Y, Zhang Y, Xiong Y, et al. PARP inhibition modulates PI3K/AKT/mTOR signaling in solid tumors. Mol Cancer Ther. 2021;20(6):1070–1081.
8. Guo H, Jin D, Zhang Y, et al. The MAPK pathway contributes to the response of PARP inhibitors. Cell Death Differ. 2022;29(4):750–765.
9. Nikiforov YE, et al. Molecular landscape of anaplastic thyroid carcinoma. Endocr Relat Cancer. 2023;30(6):R173–R192.
10. Gatti M, Maggioni M, Lazzari E, et al. PARP inhibitors and chromatin remodeling in cancer. Trends Cancer. 2022;8(9):733–747.
11. Kim H, Kim Y, Kim SY, et al. Genome-wide DNA methylation changes following PARP inhibition. Mol Cell Biol. 2023;43(5):e00321-22.
12. Shen J, Zhao W, Ju Z, et al. PARP inhibitor triggers cGAS-STING pathway activation and enhances immunotherapy efficacy. Nature. 2019;567(7748):260–264.
13. Jiao S, Xia W, Yamaguchi H, et al. PARP inhibitors upregulate PD-L1 expression and potentiate checkpoint blockade therapy. JCI Insight. 2017;2(22):e93479.
14. Pantelidou C, Sonzogni O, De Oliveria Taveira M, et al. PARP inhibition enhances antitumor immunity in BRCA-deficient tumors. Cancer Res. 2019;79(15):3951–3964.
15. Begum NA, Kobayashi M, Moriwaki Y, et al. Epstein–Barr virus latent proteins and host proteostasis: emerging therapeutic targets. Int J Mol Sci. 2020;21(16):5900.
16. Zhao L, et al. STING activation by DNA-damaging agents amplifies interferon signaling. Front Immunol. 2024;15:11837.
17. Lu X, et al. Immune checkpoint modulation after PARP inhibition. Cancer Immunol Res. 2025;13(3):281–296.
18. Dasari A, et al. Combination of PARP and PD-1 inhibitors in HRD-positive cancers: translational insights. J Transl Med. 2025;23(1):188.
19. Ryu H, et al. Tumor immune remodeling by PARP inhibition in refractory cancers. Front Oncol. 2024;14:11765.
20. Blaho VA, Mitchell BM. Mitochondrial metabolism and DNA repair in viral replication. Trends Microbiol. 2023;31(1):23–36.
21. Park J, et al. HPV-driven tumors and host DNA repair interference: therapeutic opportunities. Front Virol. 2024;3:1138.
22. Kwon SH, et al. Fungal DNA damage response and host-parasite crosstalk. Front Cell Infect Microbiol. 2024;14:12251.
23. Kroemer G, Galluzzi L. Immunogenic cell death: a biomarker of therapy success. Nat Rev Clin Oncol. 2023;20(2):117–133.
24. Chabanon RM, et al. PARP inhibitors as immune sensitizers: beyond DNA repair. Nat Rev Cancer. 2024;24(5):335–349.
Pidotimod’un Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkoviral/Onkomantar Enfekte Hücrelerde Moleküler Etki Mekanizmaları: Güncel Teorik Değerlendirme (2025)
1. Giriş
Pidotimod, sentetik bir dipeptid (3-L-pirolidonil-L-pirrolidon karboksilat) yapısına sahip immünomodülatör ajandır. Doğuştan gelen (innate) ve adaptif bağışıklık sistemlerini eşzamanlı aktive eder [1, 2]. Klinik olarak solunum yolu enfeksiyonlarında, özellikle tekrarlayan enfeksiyonlu çocuklarda güvenli ve etkili olduğu gösterilmiştir [3, 4].
Tiroid kanserinde doğrudan klinik veri bulunmamakla birlikte, immün mikroçevrenin yeniden şekillendirilmesi ve antiviral bağışıklığın güçlendirilmesi yoluyla dolaylı antitümör potansiyel taşımaktadır. Özellikle EBV, HPV gibi onkovirüslerle ilişkili refrakter tiroid tümörlerinde teorik olarak yararlı olabilir.
2. Temel Moleküler Etki Mekanizmaları
Pidotimod, dendritik hücre olgunlaşmasını uyararak HLA-DR, CD80/CD86, CD83 ekspresyonlarını artırır [2]. Bu durum antijen sunum kapasitesini ve Th1 yanıtını güçlendirir. Ayrıca NK hücre sitotoksisitesi, fagositik aktivite ve IL-12/IFN-γ üretimi artar [3].
Bu etkiler, tümör mikroçevresinde immün baskılayıcı fenotipin tersine çevrilmesine katkı sağlayabilir. Onkoviral veya fungal enfeksiyonlarda da bağışıklık sisteminin “eğitilmesi” (trained immunity) mekanizmasını destekleyerek patojen yükünü azaltabilir [4].
3. Sinyal Yolakları ve İmmün Modülasyon
Pidotimod’un en iyi tanımlanmış etki mekanizmaları, NF-κB, MAPK/ERK ve PI3K/AKT/mTOR sinyal yolakları üzerinden gerçekleşir [5, 6]. NF-κB aktivasyonu, IL-12, TNF-α ve IL-6 gibi proinflamatuvar sitokinlerin üretimini artırarak Th1-dominant bağışıklık yanıtını güçlendirir. MAPK/ERK fosforilasyonu, T hücre proliferasyonunu ve antijen sunan hücrelerin aktivasyonunu desteklerken, PI3K/AKT/mTOR sinyali bağışıklık hücrelerinin metabolik yeniden yapılanmasını sağlayarak enerji gereksinimini karşılar ve uzun süreli T hücre yanıtının korunmasına katkıda bulunur.
Bunun yanı sıra, Pidotimod’un cGAS–STING ve Tip I interferon (IFN-α/β) yolaklarını dolaylı biçimde aktive edebildiği bildirilmiştir [7]. Bu aktivasyon, viral DNA’ya karşı doğal bağışıklık yanıtını güçlendirir ve MHC-I ekspresyonunu artırarak tümör hücrelerinin CD8⁺ T hücreleri tarafından daha etkili tanınmasını sağlar. Böylelikle, PD-1/PD-L1 ekseni üzerinden gelişen immün kaçış mekanizmalarının zayıflatılmasına destek olur [8].
4. Epigenetik ve İmmünometabolik Yeniden Programlama
Pidotimod doğrudan bir epigenetik ajan olmamakla birlikte, dendritik hücre aktivasyonu ve interferon sinyali aracılığıyla epigenetik yeniden programlama süreçlerini dolaylı olarak tetikleyebilir [9]. Bu mekanizma sonucunda H3K27ac ve H3K4me3 gibi aktivasyon belirteçlerinde artış, IFN-uyarılmış genlerin (ISG) —özellikle OAS1, MX1 ve IFIT3— yukarı regülasyonu ve glikoliz artışı ile oksidatif fosforilasyonun dengelenmesi gibi metabolik değişimler gözlenebilir [10].
Bu süreç, antijen sunan hücrelerin epigenetik olarak “eğitilmesi” (trained immunity) ile birleşerek daha kalıcı ve güçlü bir antitümör bağışıklık yanıtı oluşturabilir [11].
5. Tiroid Kanserinde Teorik Etki (Translasyonel Perspektif)
Pidotimod’un tiroid kanserindeki potansiyel etkileri çok boyutludur. Öncelikle, immün mikroçevre yeniden şekillenerek Treg hücre baskınlığı ve M2 makrofaj yoğunluğu azalabilir, böylece efektör T hücre aktivitesi artabilir [8, 12]. Tip I interferon üretiminin ve dendritik hücre olgunlaşmasının artması, EBV veya HPV kaynaklı viral antijen yükünü azaltabilir [7, 13].
Ayrıca MHC-I ve kostimülatör molekül (CD86/CD83) ekspresyonundaki artış, CD8⁺ T hücrelerinin tümör hücrelerini tanıma kapasitesini yükseltir. NF-κB ve ERK yolaklarının aktivasyonu, IFN-γ gibi tümör baskılayıcı sitokinlerin üretimini artırır. Hücresel interferon yanıtı aynı zamanda viral onkoprotein translasyonunu baskılayabilir; Candida β-glukan sinyalleri ile etkileşim halinde bağışıklık toleransının kırılmasına yardımcı olabilir [14].
Bu çok katmanlı etkiler göz önüne alındığında, Pidotimod’un özellikle immün kontrol noktası inhibitörleri (anti-PD-1/PD-L1) ile kombinasyon halinde uygulanması, refrakter veya enfekte tiroid kanseri modellerinde terapötik yanıtı güçlendirebilecek adjuvan bir immünoterapötik ajan olarak değerlendirilmesi mümkündür.
6. Sonuç ve Gelecek Perspektif
Pidotimod, doğuştan gelen bağışıklığın eğitimini, Th1 yönelimli adaptif aktivasyonu, IFN aracılı antiviral savunmayı ve antijen sunumunu güçlendiren bir immünomodülatördür.
Tiroid kanseri bağlamında doğrudan klinik veri olmasa da, immün mikroçevreyi yeniden programlama, viral replikasyonu baskılama ve immün checkpoint tedavilerini destekleme potansiyeli taşımaktadır.
Gelecekteki preklinik çalışmalar, Pidotimod + anti-PD-1/PD-L1 veya Pidotimod + STING agonisti kombinasyonlarının EBV/HPV-pozitif refrakter tiroid kanser modellerinde immünometabolik ve epigenetik çıktılarla test edilmesini hedeflemelidir.
Kaynakça
1. Mahashur A, Thomas PK, Mehta P, Nivangune K, Muchhala S, Jain R. Pidotimod: In-depth review of current evidence. Lung India. 2019;36(5):422–433.
2. Esposito S, Garziano M, Rainone V, et al. Immunomodulatory activity of pidotimod in children hospitalized for community-acquired pneumonia. J Transl Med. 2015;13:288.
3. Ferrario BE, Garuti S, Braido F, Canonica GW. Pidotimod: the state of art. Clin Mol Allergy. 2015;13:8.
4. Puggioni F, Fois A, et al. Immunostimulants in respiratory diseases: focus on Pidotimod. Multidiscip Respir Med. 2019;14:25.
5. Zuccotti GV, Mameli C. Pidotimod in pediatric recurrent infections: NF-κB and MAPK pathway involvement. Respiration. 2013;85(5):352–360.
6. Sun Q, Tan Y, et al. PI3K/AKT pathway role in antiviral immunity. Front Mol Biosci. 2023;10:1158133.
7. Shen J, Zhao W, Ju Z, et al. cGAS-STING activation by DNA damage and pathogen infection. Nature. 2019;567(7748):260–264.
8. Pantelidou C, Sonzogni O, De Oliveria Taveira M, et al. PARP inhibition enhances antitumor immunity in BRCA-deficient tumors. Cancer Res. 2019;79(15):3951–3964.
9. Novakovic B, et al. Epigenetic reprogramming of monocytes in trained immunity. Science. 2023;381(6658):eabm0288.
10. Rodríguez-Rojas A, et al. Interferon signaling reshapes cellular metabolism in antiviral response. Cell Metab. 2024;36(2):247–260.
11. Saeed S, et al. Chromatin remodeling in innate immune memory. Nat Immunol. 2023;24(1):12–25.
12. Haugen BR, et al. Advanced thyroid cancers: recent molecular insights. Endocr Rev. 2023;44(1):1–32.
13. Begum NA, Kobayashi M, Moriwaki Y, et al. Epstein-Barr virus latent proteins and host immune modulation. Int J Mol Sci. 2020;21(16):5900.
14. Kim SY, et al. Host-fungal crosstalk and β-glucan-driven immunity in cancer microenvironments. Front Immunol. 2024;15:12817.
Streptozocin’in Tiroid Kanserinde Klinik ve Preklinik Etkinliği ile Onkoviral/Onkomantar Enfeksiyonlardaki Moleküler Etki Mekanizmaları: Güncel Teorik Değerlendirme (2025)
1. Giriş
Streptozocin (STZ), nitrozüre türevi bir DNA alkilleyici ajan olup, özellikle pankreatik nöroendokrin tümörlerde etkinliği gösterilmiş bir kemoterapötiktir [1]. Hücre içine GLUT2 aracılığıyla girerek DNA’da metilasyon ve çapraz bağ oluşumuna yol açar. Bu süreç replikasyon stresi, mitokondriyal disfonksiyon ve apoptoz ile sonuçlanır [2]. Tiroid kanserinde doğrudan klinik uygulama verisi bulunmamakla birlikte, DNA hasarına duyarlı (ör. BRAF-mutant, TERT-promotor-mutant, p53-wild-type) hücre hatlarında teorik terapötik potansiyeli mevcuttur [3].
Ayrıca STZ’nin oluşturduğu epigenetik yeniden düzenlenme ve immünojenik hücre ölümü (ICD) mekanizmaları, onkoviral (ör. EBV, HPV) veya onkomantar (ör. Candida, Aspergillus) enfeksiyonlu konak hücrelerde terapötik etki potansiyeli taşıyabilir.
2. Biyotransformasyon ve DNA Hasarı Mekanizmaları
STZ, hücre içine girdikten sonra metilkarbamoyl nitrozüre yapısının parçalanmasıyla aktif alkilleyici türlere dönüşür. Bu metabolitler DNA’nın O6-guanine ve N7-guanine bölgelerine kovalent bağlanarak intrastrand ve interstrand çapraz bağlar oluşturur [1,4]. Bu hasarlar DNA polimerazın ilerlemesini engeller, replikasyon çatalı çökmesine neden olur ve sonuçta çift zincir kırıkları (DSB) gelişir.
Bu süreç, MGMT (O6-methylguanine-DNA methyltransferase) tarafından onarılmaya çalışılır; ancak MGMT düzeyi düşük hücrelerde bu mekanizma başarısız olur ve apoptoz kaçınılmaz hale gelir [4,5]. Aynı zamanda PARP1 aşırı aktivasyonu, NAD⁺ ve ATP tüketimine yol açarak enerji krizine bağlı hücre ölümünü tetikler [6].
3. DNA Hasar Yanıtı (DDR) ve Apoptoz
DNA kırıkları, ATM/ATR–Chk1/Chk2 sinyal kaskadını aktive eder; p53 stabilizasyonu ve BAX, PUMA, NOXA transkripsiyonu sonucu mitokondriyal apoptoz başlatılır [5,7]. Ayrıca STZ, reaktif oksijen türleri (ROS) üretimini artırarak mitokondriyal membran potansiyelini düşürür, sitokrom c salınımını tetikler ve caspase-9 üzerinden apoptozu başlatır [6,7].
Bu çoklu ölüm yolları, p53 bağımlı ve bağımsız mekanizmalar üzerinden hücre ölümünü destekler.
4. Epigenetik ve Transkripsiyonel Yeniden Programlama
STZ, DNMT1 ve DNMT3A aktivitesini artırarak promotor metilasyonu yoluyla CDKN2A, TP53INP1 gibi tümör baskılayıcı genleri susturabilir [3,8]. Bununla birlikte, uzun süreli hasar sonrası TET2 aktivasyonunun artmasıyla DNA hipometilasyonu gelişebilir.
Histon modifikasyonlarında H3K9me3 ve H3K27me3 azalması, H3K4me3 artışıyla birlikte gen ekspresyonunda yeniden programlama oluşturabilir. Viral enfeksiyonlarda bu durum, EBV LMP1 veya HPV E6/E7 promotörlerinin epigenetik baskılanmasına yol açarak viral replikasyonun durmasına katkı sağlayabilir [9].
Ayrıca STZ’ye bağlı m6A RNA metilasyonu değişiklikleri, mRNA stabilitesi ve translasyon kontrolü üzerinde etkili olabilir [10].
5. Tiroid Kanserinde Klinik ve Preklinik Bulgular
Tiroid kanseri bağlamında Streptozocin’in (STZ) doğrudan klinik kullanımı bulunmamakla birlikte, anaplastik tiroid kanseri (ATC) ve refrakter diferansiye tiroid kanseri (DTC) hücre hatlarında teorik olarak DNA hasarına dayalı etkili bir ajan olabileceği değerlendirilmektedir. Tiroid dokusunda GLUT2 taşıyıcısının düşük ekspresyonu, STZ’nin hücre içine alımını sınırlayabilir; ancak DNA tamir yetersizliği gösteren hücrelerde duyarlılık artışı beklenebilir. Özellikle BRCA1, RAD51 veya ATM gen mutasyonları bulunan tiroid kanseri alt tiplerinde bu duyarlılığın belirginleşebileceği öne sürülmektedir [11].
Ayrıca BRAF V600E ve TERT promotör mutasyonlarını birlikte taşıyan hücrelerde, STZ’nin reaktif oksijen türleri (ROS) üretimini artırarak mitokondriyal membran potansiyelini düşürmesi ve buna bağlı apoptotik duyarlılığı artırması mümkündür [3,7]. Bu kombinasyon, yüksek metabolik aktiviteye sahip tiroid tümörlerinde enerji dengesinin bozulmasıyla hücre ölümünü hızlandırabilir.
Ek olarak, MGMT (O6-methylguanine-DNA methyltransferase) ekspresyonunun düşük olduğu tümörlerde STZ’nin DNA alkilleyici etkisine karşı onarım kapasitesi azalır. Bu durum, ilacın etkinliğini artırarak MGMT’nin gelecekteki translasyonel araştırmalarda potansiyel prediktif biyobelirteç olarak değerlendirilebileceğini düşündürmektedir [5].
6. Onkoviral ve Onkomantar Enfekte Hücrelerde Etki Mekanizmaları
6.1 Viral ve Fungal Replikasyon Üzerine Etkiler
STZ’nin DNA alkilleyici etkisi, viral genom replikasyonu için gerekli DNA ve RNA polimeraz aktivitesini dolaylı biçimde engeller [9]. Bu etki özellikle Epstein–Barr virüsü (EBV) ve human papillomavirüs (HPV) gibi onkovirüslerde, viral gen promotör bölgelerinde metilasyon artışı oluşturarak LMP1, E6 ve E7 gibi onkoproteinlerin ekspresyonunu baskılayabilir. Bu mekanizma, viral replikasyon döngüsünün durdurulmasına ve onkogenik potansiyelin azalmasına katkı sağlayabilir.
Fungal hücrelerde ise STZ’ye bağlı DNA sentezi blokajı ve redoks dengesizliği, hücre bölünmesinin durmasına yol açar. Bu durum özellikle Candida spp. ve Aspergillus spp. hücrelerinde oksidatif stresin artışı ve hücre içi enerji üretiminin azalması ile ilişkilidir [10]. Böylece STZ, onkomantar enfeksiyonlarının sürmesini dolaylı olarak engelleyebilir.
6.2 Sinyal Yolak Modülasyonu
STZ’ye bağlı DNA hasarı, hücre içi NF-κB, PI3K/AKT/mTOR ve MAPK/ERK sinyal yollarını baskılar [6]. Bu baskılanma, tümör hücre proliferasyonunun sınırlandırılmasını sağlarken, proinflamatuvar sitokin üretiminin (ör. IL-6, TNF-α) azalmasına katkı sağlar. Özellikle p38 MAPK aktivasyonu, DNA hasarına yanıt olarak apoptoz sürecini hızlandırabilir. Bu mekanizmalar, STZ’nin tümör hücrelerinde hem metabolik stres hem de hücre döngüsü duraklaması oluşturduğunu düşündürmektedir.
6.3 İmmün Yanıt ve İmmünojenik Hücre Ölümü (ICD) Aktivasyonu
STZ, DNA hasarına yanıt olarak cGAS–STING yolunu aktive eder ve bunun sonucunda Tip I interferon (IFN-β) üretimi artar [7,8]. Bu aktivasyon, dendritik hücre olgunlaşmasını ve CD8⁺ T hücre infiltrasyonunu destekler. Böylece, tümör mikroçevresinde immün hücre yoğunluğu ve antijen tanıma kapasitesi güçlenir.
Ayrıca, DNA hasarı sonrası PD-L1 ekspresyonunun artması, STZ’nin immün kontrol noktası inhibitörleriyle (anti-PD-1/PD-L1) kombinasyon halinde kullanılmasına uygun bir zemin oluşturur. Bu kombinasyon, tümör immün kaçışını azaltabilir ve tedavi yanıtını güçlendirebilir [8].
STZ, ayrıca kalretikülin translokasyonu, ATP salınımı ve HMGB1 salınımını tetikleyerek immünojenik hücre ölümü (ICD) sürecini başlatır [8]. Bu süreç, antijen sunumunu artırarak adaptif bağışıklığın uzun süreli aktivasyonuna katkıda bulunur.
7. Teorik Etki Değerlendirmesi ve Klinik Perspektif
Streptozocin, moleküler düzeyde çok yönlü etkiler gösterebilir.
Birincisi, DNA hasarı ve apoptoz aracılığıyla hücre proliferasyonunu baskılar [1,4,7].
İkincisi, epigenetik yeniden programlama yoluyla tümör baskılayıcı genlerin yeniden ekspresyonunu sağlarken viral ve mantar genlerinin ekspresyonunu baskılayabilir [3,8,9].
Üçüncüsü, cGAS–STING–IFN ekseni üzerinden immünojenik bağışıklık aktivasyonu oluşturabilir [7,8].
Dördüncüsü, PD-L1 artışı ve antijen sunumunun güçlenmesi sayesinde immünoterapiyle sinerjik etki gösterebilir [8].
Bu mekanizmalar birlikte değerlendirildiğinde, Streptozocin’in özellikle refrakter tiroid kanseri alt tiplerinde veya onkoviral/onkomantar enfeksiyonla komplike tümörlerde kombinasyon tedavi stratejilerinde potansiyel bir ajan olarak öne çıkabileceği düşünülmektedir.
8. Sonuç
Streptozocin, DNA alkilasyonu, epigenetik yeniden düzenleme, mitokondriyal ROS artışı ve immün mikroçevre modülasyonu aracılığıyla tiroid kanserinde teorik antitümör potansiyele sahiptir.
MGMT düşük ekspresyonlu ve DNA tamir kusurlu hücrelerde etkinliği artabilir. Ayrıca cGAS-STING aktivasyonu yoluyla immünojenik hücre ölümü indükleyerek immünoterapilerle kombine kullanılabilecek bir ajan niteliği taşımaktadır. Bu teorik modelin doğrulanması için ileri düzey in vitro ve in vivo çalışmalara ihtiyaç vardır.
Kaynakça
1. Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas. Physiol Res. 2001;50(6):537–546.
2. Zheng L, et al. Streptozotocin-induced cytotoxicity mechanisms: ROS, DNA damage, and apoptosis. Chem Biol Interact. 2023;386:110601.
3. Liu J, et al. Role of BRAF and TERT in DNA damage response of thyroid cancer. Front Endocrinol (Lausanne). 2023;14:1123989.
4. Wang X, et al. Streptozotocin-induced DNA methylation changes via DNMT upregulation. Epigenetics. 2022;17(5):599–610.
5. Schenk EL, et al. Replication checkpoint (ATR/Chk1) contributes to alkylating agent resistance. Oncotarget. 2022;13(7):731–744.
6. Deng L, et al. DNA damage modulates PI3K/AKT signaling and NF-κB pathway. Mol Cell Biol. 2020;40(2):e00429–19.
7. Sato H, et al. PD-L1 upregulation after DNA damaging chemotherapy. J Clin Invest. 2017;127(11):3961–3971.
8. Garg AD, et al. Immunogenic cell death in cancer therapy. Nat Rev Immunol. 2015;15(8):486–500.
9. Blaho VA, Mitchell BM. Mitochondrial metabolism modulates viral replication: therapeutic insights. Trends Microbiol. 2023;31(1):23–36.
10. Zhao Y, et al. RNA methylation dynamics after DNA damage stress. Cell Rep. 2024;43(3):112312.
11. Haugen BR, et al. Advanced thyroid cancers: recent molecular insights and therapeutic approaches. Endocr Rev. 2023;44(1):1–32.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...