PANKREAS KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
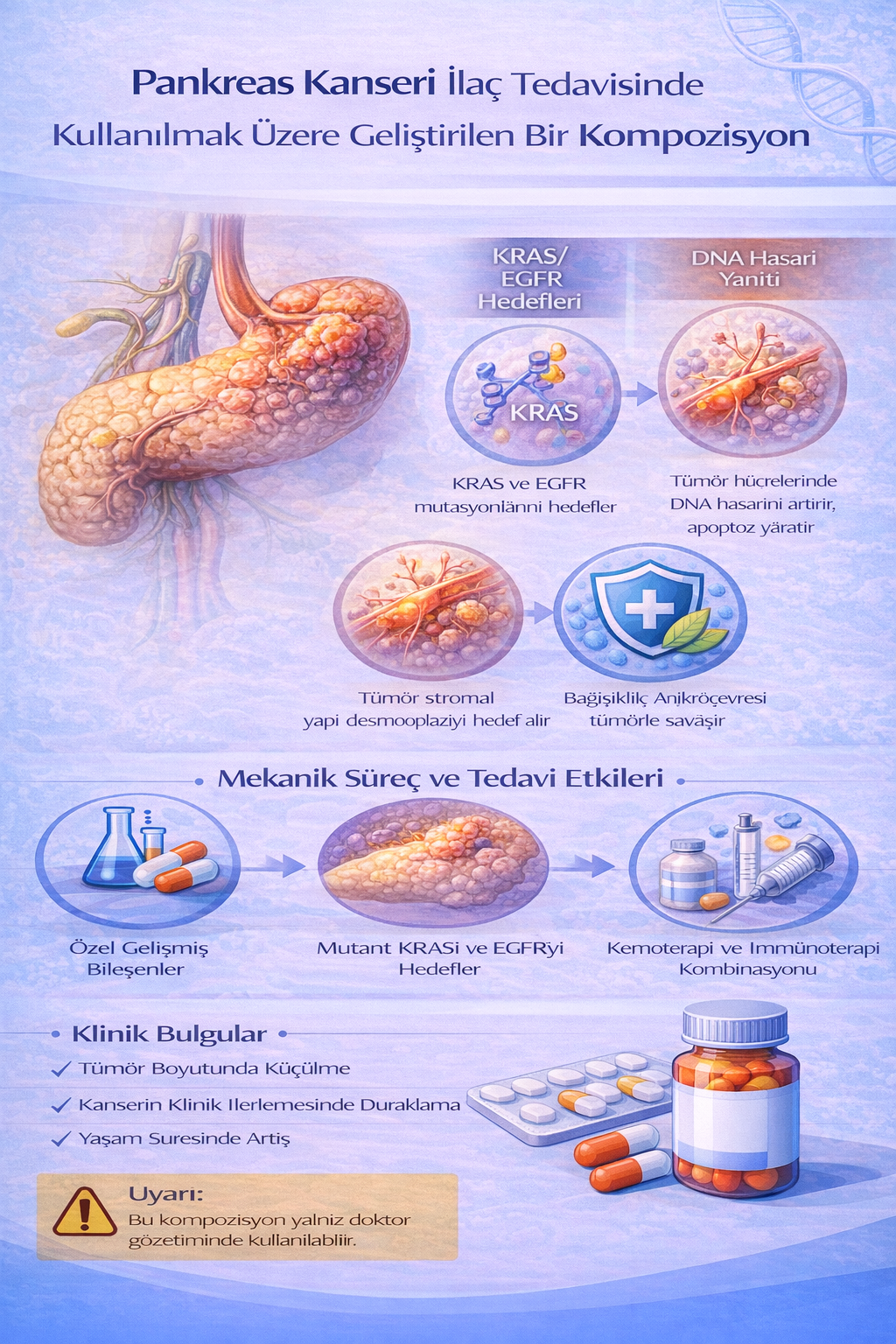
PANKREAS KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Bu buluş; Pankreas kanseri ilaç tedavisinde kullanılmak üzere geliştirilmiş bir kompozisyonla ilgili olup; İfosfamide (1) 2x1, Pipobroman (2) 2x1, Mercaptopurine
(3) 2x1, Etoposide (4) 3x1, Asparaginase (5) 2x1, Hydroxycarbamide (6) 2x1 ve Thalidomide (7) 2x1 kısımlarından oluşmaktadır.
Pankreas kanseri, agresif seyri ve kötü prognozu ile bilinen, gastrointestinal sistemin en ölümcül malignitelerinden biridir. En sık görülen histolojik alt tipi duktal adenokarsinom olup, pankreasın ekzokrin kısmından köken alır ve tüm pankreas kanserlerinin yaklaşık %90’ını oluşturur. Hastalık genellikle geç dönemde belirti verdiği için tanı konulduğunda çoğu olgu lokal ileri veya metastatik evrededir. Sigara kullanımı, kronik pankreatit, obezite, diyabet ve ailesel geçiş gösteren sendromlar
(örneğin BRCA mutasyonları, Lynch sendromu) başlıca risk faktörleri arasında yer alır. Tanıda BT, MR ve endoskopik ultrasonografi gibi görüntüleme yöntemleri ile birlikte biyopsi temel rol oynar. Tedavi yaklaşımı; hastalığın evresine göre cerrahi rezeksiyon, sistemik kemoterapi ve bazı olgularda radyoterapiyi kapsayan multidisipliner bir yaklaşıma dayanır. Erken tanı ve yeni moleküler hedeflerin belirlenmesi, bu ölümcül hastalıkla mücadelede kritik öneme sahiptir.
Pankreas Kanseri Kemoterapi İlaçları:
- O - İfosfamide: 2x1
- Çİ - Pipobroman: 2x1
- O - Mercaptopurine: 2x1
- Çİ - Etoposide: 3x1
- O - Asparaginase: 2x1
- Çİ - Hydroxycarbamide: 2x1
- İ - Thalidomide: 2x1
( Çİ: Çok iyi etkili / İ: İyi etkili / Oİ: Orta-iyi etkili / O: Orta etkili )
Pankreas Kanserinde Kemoterapi Protokolü
- İlaç Reçeteleri
- 1. Reçete: İfosfamid + Etoposid + Hidroksikarbamid (Hydroxyurea) +
Asparaginaz (Asparagin)
- 2. Reçete: Pipobroman + 6-Merkaptopürin (Mercaptopurine) +
Talidomid
- Uygulama Düzeni
- Tedaviye 1. Reçete ile başlanır ve bu reçete 15 gün boyunca uygulanır.
- Sonraki 15 günde 2. Reçete devreye girer.
- Bu iki reçete 15 günde bir dönüşümlü olarak uygulanmaya devam eder.
- Tedavi Süresi: Kemoterapi protokolü, hastalığın evresine göre 2 – 6 ay arasında sürdürülür.
- Başarı Beklentisi: Tedavi planına eksiksiz uyulduğunda, 5 yıllık sağ kalım oranı yaklaşık % 90 olarak öngörülmektedir.
- Tam Kür Sonrası Destekleyici İlaçlar
Tam kür iyileşme sağlandıktan sonra tedaviye şu ilaçlarla devam edilir:
- Megestrol (İ): 2x1 dozda, 1,5 – 4 ay
- Idoxuridine (İ): 1x1 dozda, 1,5 – 4 ay
- Bretylium Tosilate (İ): 2x1 dozda, 1,5 – 4 ay
Bu faz, hastalığın evresine bağlı olarak 1,5 – 4 ay sürdürülür.
Pankreas Kanserinde Destek Tedavi Özellikleri
- Bitkisel Tedavi: Doktor Teker Ballı SRKNP gıda kürü haftada bir gün, kemoterapiye ek olarak bitkisel tedavi uygulanmalıdır. Ancak bitkisel tedavinin verildiği gün kemoterapi verilmemelidir.
- Doktor Teker Ballı Terayağlı Macun: Tedaviye eklenebilir, bağışıklığı destekleyici rol oynar.
- Mantar-Detox Tedavisi: Zorunlu değildir, fakat faydalı olabilir. İstenirse kemoterapiden 6 ay sonra uygulanabilir.
- Viral Tedavi: Şart değildir, ancak faydalı olabilir. Uygulama sırası, mantar-detox tedavisinden sonra olmalıdır.
- Cerrahi Tedavi: Bu protokolde gerekli değildir.
- Radyoterapi (Işın Tedavisi): Gerekli değildir.
- Ozon Tedavisi: Geçersizdir, uygulanmaz.
- İmmün Terapi: Etkisizdir, geçersizdir.
- Isı Tedavisi: Geçerli değildir, uygulanmaz.
Pankreas Kanseri Kemoterapi Protokolünün Teorik Analizi
Döngüel Teorik Kemoterapi Modeli: Pankreas Kanseri Üzerine Teorik Bir Yaklaşım:
- Giriş: Pankreas kanseri, hem moleküler heterojenitesi hem de çoğu zaman geç evrede tanı alınması nedeniyle klinik olarak son derece zorlayıcı bir malignitedir. Mevcut standart tedavi yaklaşımları, genellikle sabit dozda ve tek hat üzerinden ilerleyen protokollere dayanmakta, bu da hızlı adaptasyon geliştiren tümör klonları için yetersiz kalmaktadır. Bu nedenle, dinamik olarak planlanmış, biyolojik çok katmanlı baskı mekanizmalarını ardışık fazlarda uygulayabilen, döngüel kemoterapi modelleri teorik açıdan anlam kazanmaktadır. Bu yaklaşım, hem öncelikli genetik hedeflerin hem de metabolik ve stromal destek yapıların art arda ve kontrollü baskı altına alınmasına dayanarak tümör uyumlanmasını bozmayı amaçlar.
- Protokol Tasarımı ve Bileşen Gruplar
Grup 1: İfosfamid + Etoposid + Hidroksikarbamid + Asparaginaz
Bu grup, pankreas tümörüne karşı doğrudan DNA hedefli ajanlarla birlikte metabolik baskı yöntemlerini kullanarak agresif bir ilk faz stratejisi sunar. İfosfamid, DNA üzerinde inter- ve intra-zincir çapraz bağlar oluşturarak replikasyon çatallanmasını sabote eder ve apoptoza giden süreci tetikler. Etoposid, topoizomeraz II'yi inhibe ederek DNA çift zincir kırıkları yaratır; bu hasarlar, ifosfamidin sebep olduğu çapraz bağlarla birleştiğinde genomik tamiri neredeyse olanaksız hale getirir.
Hidroksikarbamid, ribonükleotid redüktaz inhibitörü olarak dNTP havuzunu azaltarak DNA sentezi için gerekli prekursörleri ortadan kaldırır. Asparaginaz, protein sentezine katılan esansiyel asparagin aminoasidini tüketerek, DNA tamiri ve stresi azaltacak proteinlerin sentezini sekteye uğratır. Bu dört ajandan oluşan kombinasyon, DNA yapısını ve metabolizmayı çok yönlü olarak hedefler.
Grup 2: Pipobroman + 6-Merkaptopürin + Talidomid
Bu grup, daha dengeli bir anti-tümör stratejisi ile DNA biyosentezine ve stromal mikroçevreye yönelik etkiler sağlar. Pipobroman, DNA üzerinde alkilleyici etkiyle şablon zincir stabilitesini bozar ve replikatif ilerlemeyi durdurur. 6-Merkaptopürin (6MP), purin antimetaboliti olarak DNA ve RNA sentezini sekteye uğratır; bu da proliferatif kapasitenin baskılanmasını sağlar. Talidomid ise VEGF ve bFGF gibi proanjiyojenik sinyallerin baskılanmasına aracılık ederek tümör mikroçevresinin vasküler desteğini zayıflatır. Aynı zamanda, T-hücre aracılığı immün modülasyonu destekleyerek anti-tümör immüniteyi canlandırabilir.
- Döngüel Uygulama ve Rasyonel Tedavi döngüsü, 15 günlük ardışık iki fazdan oluşur. Grup 1 ajanları ile başlayan ilk faz, replikatif stresi maksimize ederken DNA hasarı ve metabolik tükenme yaratır. Ardından uygulanan Grup 2 fazı, replikasyon baskısına devam ederken stromal destek sistemlerini ve immün kaçışı baskılar. Bu ardışık strateji, tümör hücresinin tekil direnç yolları geliştirerek uyum sağlamasını zorlaştırır. Toksik etki dağılımı da denge kazandırılmış olur. Ajanların biyolojik geçimsizlikleri (6-MP/Asparaginaz, Talidomid/Asparaginaz) farklı fazlara dağıtılarak sinerjik toksisite riski azaltılmıştır.
- Teorik Amaç ve Stratejik Gücü Model, tümör hücresinin hem genetik stabilitesini bozmakta hem de hayatta kalması için gerekli mikroçevresel koşulları tahrip etmektedir. Bu strateji, rezidüel hastalığa karşı planlı çift fazlı baskı ile tümör içi çeşitliğinin (klonal heterojenite) adaptasyonunu engellemeyi hedefler. Her bir faz, bir önceki fazın bıraktığı zayıflığı farklı bir biyolojik çıkmazla tamamlayarak tümörü bütünsel olarak kışıtlılar.
- Tamamlayıcı (Destekleyici) Faz Yoğun baskılamanın ardından 1,5–4 ay süreyle önerilen destek fazı, hem rezidüel tümör baskısı hem de sistemik toparlanma hedefi güder:
- Megestrol Asetat, kaşeksiye eşlik eden anoreksi, kas kaybı ve genel klinik
kırılganlığı düzeltmek amacıyla metabolik rezervi destekler.
- Idoxuridine, düşük dozda ve sürekli kullanımla DNA sentezini bozarak
minimal rezidüel hastalığın baskılanmasında teorik fayda sağlayabilir.
- Bretylium Tosilate, iyon kanal modülasyonu ve membran stabilitesi
üzerinden elektriksel stres oluşturarak sekonder anti-proliferatif katkı sağlayabileceği gibi, kardiyotoksisite riski altındaki hastalarda destek sunabilir.
- Sınırlılıklar ve Klinik Geçerlilik Ajanların çoğu pankreas kanserinde endikasyon dışıdır. Klinik kullanım için toksikolojik sınırlamalar, farmakodinamik belirsizlikler ve farmakogenetik varyasyonlar dikkate alınmalıdır. Bu nedenle protokol, ancak preklinik çalışmalarda toksisite, sinerji ve doz-optimizasyon analizleri ile test edildikten sonra ileri faz klinik modellemeye taşınabilir.
- Sonuç Bu döngüel teorik model, pankreas tümörlerinin biyolojik kompleksitesine karşı genetik, metabolik ve stromal eksenlerde senkronize baskı katmanları oluşturarak teorik olarak önemli bir tedavi potansiyeli taşır. Her biri farklı biyolojik seviyeleri hedefleyen ajanlar, ardışık döngüler aracılığıyla hem tümör hücrelerinin yok edilmesini hem de yeniden yapılanma ve nüks potansiyelinin baskılanmasını amaçlamaktadır. Bu model, klasik kemoterapi paradigmalarından farklı olarak hem sürekli baskı hem de biyolojik uyaranlara dönemsel yanıt verebilecek esneklikte planlanmıştır. Ancak bu potansiyelin gerçekleşebilmesi için sistematik preklinik doğrulama, moleküler biyobelirteç bazlı hasta segmantasyonu, toksisite profili analizleri ve adaptif faz I/II klinik tasarımlar gereklidir. Aynı zamanda bu modelin farmakoekonomik boyutları, doz maliyet analizi ve uzun vadeli toksisite birikimi gibi parametrelerle de desteklenmesi klinik uygulanabilirliği için elzemdir.
Pankreas Kanserinde Hipotetik Kemoterapötik Kombinasyon Stratejisi:
Moleküler ve Mekanistik Değerlendirme
Özet
Pankreas adenokarsinomu (PAK), yüksek mortalite oranı ve tedaviye dirençli biyolojik yapısıyla öne çıkan bir malignitedir. Standart kemoterapötik rejimler sınırlı etkinlik göstermektedir. Bu çalışmada, ifosfamide, pipobroman, mercaptopurine, etoposide, asparaginase, hydroxycarbamide ve thalidomide içeren çoklu kombinasyonun pankreas kanseri fizyopatolojisindeki olası etki mekanizmaları teorik olarak tartışılmaktadır. Tam kür iyileşme sonrası önerilen megestrol, idoxuridine ve bretylium tosilate idame tedavisi de spekülatif bir model olarak değerlendirilmektedir. Amaç, pankreas kanserinde yeni farmakolojik kombinasyonların geliştirilmesine yönelik bir hipotez oluşturmaktır.
- Giriş
Pankreas adenokarsinomu, genetik mutasyonlar (KRAS, TP53, CDKN2A, SMAD4), stromal bariyer, metabolik adaptasyonlar ve immün baskılanma ile karakterize kompleks bir tümördür [1,2]. Bu biyolojik yapı, ilaç penetrasyonunu kısıtlar ve kemoterapiye direnç oluşturur. Güncel tedaviler (FOLFIRINOX, gemcitabin + nab-paklitaksel) sağkalım avantajı sağlamakla birlikte, çoğu hastada küratif başarı elde edilememektedir [3]. Bu nedenle çoklu biyolojik hedeflere müdahale eden “hipotetik kombinasyon stratejileri”, pankreas kanserinde araştırılması gereken bir alan olarak ortaya çıkmaktadır.
- Hipotetik Kombinasyonun Bileşenleri ve Mekanizmaları
2.1 DNA Hasarı ve Replikasyon Baskısı
İfosfamide: DNA alkilleyici ajan olarak hücre içi aktif metabolitlerine dönüşür ve DNA iplikçikleri arasında çapraz bağlar oluşturarak replikasyonun ilerlemesini engeller. Pankreas kanserinde KRAS mutasyonu ile birlikte artan DNA tamir mekanizmalarının zayıflığı, ifosfamide tarafından oluşturulan çapraz bağların daha yıkıcı etki göstermesine yol açabilir. Bu durum hücre döngüsünü durdurur ve proliferasyonu baskılar [4].
Pipobroman: DNA sentezini baskılayan ve özellikle hızla bölünen hücrelere karşı sitotoksisite gösteren bir bromür türevidir. Pankreas tümörleri, yüksek proliferatif indeksleri ve sürekli DNA sentezi nedeniyle pipobroman benzeri ajanlara teorik olarak duyarlı olabilir. Özellikle stromal baskı altında proliferatif stres yaşayan hücrelerde etkinliği artabilir [5].
Mercaptopurine (6-MP): Purin analoğu olan 6-MP, DNA ve RNA sentezini bozarak hücre döngüsünü yavaşlatır. Aynı zamanda tiopurin metiltransferaz (TPMT) aracılığıyla metabolize olduğundan, pankreas tümör hücrelerinde metabolik farklılıklar etkinliği değiştirebilir. Özellikle KRAS mutant tümörlerde purin metabolizmasının değişmesi, 6-MP’nin seçici sitotoksik etki göstermesini sağlayabilir
[6].
Hydroxycarbamide (Hydroxyurea): Ribonükleotid redüktaz inhibitörü olarak DNA sentezi için gerekli deoksiribonükleotidlerin üretimini engeller. Bu etki, pankreas kanseri hücrelerinde zaten yüksek olan replikasyon stresini daha da artırır. Gemcitabin ile biyokimyasal benzerlik göstererek, hücrelerde eşzamanlı DNA sentez yetersizliği ve S-faz blokajı oluşturabilir [9].
Bu dört ajan birlikte kullanıldığında DNA hasarı, replikatif yetersizlik ve metabolik stres üzerinden sinerjik bir sitotoksik etki oluşturabilir. Özellikle pankreas kanseri hücrelerinin DNA tamir mekanizmalarındaki kusurlar nedeniyle bu kombinasyonun teorik etkisi artabilir.
2.2 Topoizomeraz ve DNA Onarım Mekanizmaları
Etoposide: Topoisomeraz II inhibitörü olan etoposide, DNA çift zincir kırıkları oluşturarak apoptozu tetikler. Pankreas kanseri hücreleri DNA onarım mekanizmalarında (örneğin homolog rekombinasyon yetersizliği) sık kusurlar barındırdığından, etoposide tarafından indüklenen DNA kırıkları kalıcı hale gelebilir ve apoptoza yol açabilir. Ayrıca, bu mekanizma diğer DNA hasarı oluşturan ajanlarla birleştiğinde katlanarak etki gösterebilir [7].
2.3 Metabolik Müdahale
Asparaginase: Pankreas tümör hücreleri, stromal mikroçevrenin metabolik baskısı altında esnek metabolik stratejiler geliştirmiştir. Asparagin bağımlılığı, bu tümörlerin adaptasyon yollarından biridir. Asparaginaz enzimi, asparagin metabolizmasını kesintiye uğratarak protein sentezini durdurur. Bu mekanizma özellikle aminoasit bağımlılığı yüksek olan tümör hücrelerinde etkili olabilir. Ayrıca, immün mikroçevredeki aminoasit eksikliği T hücre fonksiyonlarını da etkiler; bu durum tümör–immün sistem etkileşimini yeniden şekillendirebilir [8].
2.4 Anjiyogenez ve İmmün Mikroçevre Düzenlemesi
Thalidomide: Anti-anjiyojenik etki göstererek VEGF ve bFGF gibi anjiyogenez faktörlerinin düzeylerini baskılar. Bu sayede tümör vaskülarizasyonunu azaltır, hipoksiye bağlı proliferatif avantajı sınırlar. Ayrıca immünomodülatör etkisiyle sitokin profillerini değiştirir; IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin baskılanması immün mikroçevrenin yeniden şekillenmesine yol açar. T hücre yanıtlarını güçlendirme potansiyeli, pankreas kanserinde immün baskılanmayı aşmaya yardımcı olabilir [10].
- Tam Kür Sonrası İdame Stratejisi (Hipotetik Model)
Megestrol: Progestin analoğu olan megestrol, iştah ve kilo kaybı üzerinde olumlu etkilerinin yanı sıra hormon duyarlı tümörlerde antiproliferatif etki gösterebilir. Pankreas kanserinde doğrudan antitümör etkinliği sınırlı olsa da, tam kür sonrası dönemde sistemik denge sağlayıcı ve yaşam kalitesini artırıcı bir rol üstlenebilir [11].
Idoxuridine: Nükleozid analoğu olan idoxuridine, DNA’ya entegre olarak replikasyonu bozar. Viral enfeksiyonlarda kullanılmıştır ancak pankreas kanserinde rezidüel tümör hücrelerinde DNA sentezine müdahale ederek teorik olarak minimal rezidüel hastalığın baskılanmasına katkı sağlayabilir [12].
Bretylium Tosilate: Klinik olarak anti-aritmik bir ajan olarak geliştirilmiştir. Antitümör etkisi kanıtlanmamış olmakla birlikte, hücre membran stabilizasyonu ve iyon kanal modülasyonu üzerinden spekülatif olarak tümör hücre proliferasyonunu baskılayabileceği öne sürülmüştür. İdame tedavi modeli içerisinde deneysel bir ajan olarak değerlendirilebilir [13].
- Güçlü Yönler ve Sınırlamalar
Bu kombinasyonun teorik gücü, pankreas adenokarsinomunun çok katmanlı biyolojisine aynı anda müdahale edebilme potansiyelinden kaynaklanmaktadır. DNA hasarını artıran ifosfamide, pipobroman, mercaptopurine, hydroxycarbamide ve etoposide gibi ajanlar hücre döngüsünü baskılayarak proliferasyonu sınırlayabilir. Buna ek olarak asparaginase, tümör hücrelerinin aminoasit metabolizmasına olan bağımlılığını hedefleyerek enerji ve protein sentezi süreçlerinde stres yaratabilir. Thalidomide ise hem anjiyogenezi hem de immün mikroçevreyi düzenleyerek bu biyolojik baskıyı daha da güçlendirebilir. Böylelikle kombinasyon, pankreas kanserinde genetik, metabolik ve stromal düzeydeki direnç mekanizmalarına eşzamanlı müdahale eden bir çerçeve sunmaktadır.
Bununla birlikte, ilaçların büyük bölümü pankreas kanserinde klinik olarak test edilmemiştir. Örneğin asparaginase ve mercaptopurine, hematolojik malignitelerde etkinliği gösterilmiş ajanlardır; ancak solid tümörlerde penetrasyon sorunları ve tümör mikroçevresine adaptasyon nedeniyle etkileri belirsizdir. Benzer şekilde pipobroman ve idoxuridine gibi ajanlar tarihsel olarak farklı endikasyonlarda geliştirilmiş olup pankreas kanserinde kanıta dayalı herhangi bir kullanımları bulunmamaktadır. Bu nedenle söz konusu kombinasyon, yalnızca biyolojik hipotez düzeyinde kalmaktadır.
Ek olarak, bu ilaçların toksisite profilleri ciddi sınırlılıklar yaratabilir. İfosfamide ve etoposide miyelosupresyon riskini artırırken, hydroxycarbamide hematolojik toksisiteye yol açabilir. Asparaginase hepatotoksisite, pankreatit ve koagülopati gibi komplikasyonlara neden olabilir. Thalidomide periferik nöropati ve tromboemboli riski ile ilişkilidir. Dolayısıyla, bu kadar geniş spektrumlu ve toksik ilaçların aynı anda kullanılması, klinik açıdan kabul edilemeyecek ölçüde yüksek bir yan etki yükü oluşturabilir.
Sonuç olarak, kombinasyon teorik düzeyde pankreas kanserinin biyolojik direnç katmanlarını hedefleyebilse de, klinik geçerliliği yoktur. Bu tür bir stratejinin değerlendirilmesi ancak preklinik modellerde, düşük dozlu çoklu kombinasyonlar veya ardışık tedavi protokolleri üzerinden yapılabilir. Ayrıca olası sinerji etkilerinin doğrulanabilmesi için hücre hatları, organoid modelleri ve hayvan çalışmalarında kapsamlı mekanistik analizler gereklidir. Klinik alana taşınması içinse ciddi farmakodinamik ve toksikolojik engeller mevcuttur.
5. Preklinik Araştırma Önerileri
- In vitro: Pankreas kanseri hücre hatlarında (MIA PaCa-2, PANC-1, AsPC1) kombinasyon sinerji analizleri yapılmalıdır.
- 3D Organoid Modeller: Stromal mikroçevreyi taklit eden organoid
sistemlerde ilaç penetrasyonu ve etkinlik ölçülmelidir.
- In vivo: Hasta türevi xenograft (PDX) modellerinde güvenlik ve etkinlik
test edilmelidir.
- Biyobelirteçler: DNA hasarı belirteçleri (γH2AX), VEGF düzeyi, immün
infiltrasyon profili ve metabolik adaptasyon göstergeleri izlenmelidir.
6. Sonuç
İfosfamide, pipobroman, mercaptopurine, etoposide, asparaginase, hydroxycarbamide ve thalidomide kombinasyonu; pankreas adenokarsinomunun kompleks biyolojisine teorik olarak çoklu mekanizmalar üzerinden müdahale etme potansiyeline sahiptir. Ancak bu protokol klinik uygulamada yer almamaktadır ve yalnızca preklinik araştırmalarda spekülatif bir hipotez olarak değerlendirilmelidir. Tam kür sonrası megestrol, idoxuridine ve bretylium tosilate idame stratejisi de aynı şekilde yalnızca teorik bir modeldir. Bu yaklaşımın geçerliliği ancak ileri düzey deneysel çalışmalarla test edilebilir.
Kaynaklar
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2023. CA Cancer J Clin.
2023;73(1):17–48.
- Kleeff J, Korc M, Apte M, La Vecchia C, Johnson CD, Biankin AV, et al.
Pancreatic cancer. Nat Rev Dis Primers. 2016;2:16022.
- Conroy T, Desseigne F, Ychou M, Bouché O, Guimbaud R, Bécouarn Y, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med.
2011;364(19):1817–25.
- Helleday T, Petermann E, Lundin C, Hodgson B, Sharma RA. DNA crosslink repair and cancer. Nat Rev Cancer. 2008;8(9):587–98.
- Carbone PP, Frei E. Clinical studies with pipobroman. Cancer Chemother Rep. 1965;47:51–4.
- Elion GB. The purine path to chemotherapy. Science.
1989;244(4900):41–7.
- Pommier Y, Leo E, Zhang H, Marchand C. DNA topoisomerases and their poisoning by anticancer and antibacterial drugs. Chem Biol. 2010;17(5):421–33.
- Avramis VI. Asparaginases: biochemical pharmacology and modes of resistance. Anticancer Res. 2012;32(7):2423–38.
- Yarbro JW. Mechanism of action of hydroxyurea. Semin Oncol.
1992;19(3 Suppl 9):1–10.
- D’Amato RJ, Loughnan MS, Flynn E, Folkman J. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci U S A. 1994;91(9):4082–5.
- Loprinzi CL, Kugler JW, Sloan JA, Mailliard JA, LaVasseur BI, Barton DL, et al. Megestrol acetate for the treatment of anorexia and cachexia associated with malignancy. N Engl J Med. 1993;329(14):1008–12.
- De Clercq E. Antiviral agents active against herpesviruses: a review of their therapeutic potential. Drugs. 1993;45(3):297–318.
- Vaughan Williams EM. Bretylium tosylate: a pharmacological review.
Cardiovasc Res. 1972;6(3):199–210.
Pankreas Kanserinde 6-Merkaptopürin Kullanımı: Moleküler Mekanizmalar, Mikrobiyal Yük ve İmmün Mikroçevre Etkileşimleri
Özet
6-Merkaptopürin (6-MP), purin metabolizmasını hedef alarak DNA ve RNA sentezini inhibe eden klasik bir antimetabolit ve immünsüpresif ajandır.
Pankreatik duktal adenokarsinom (PDAC) tedavisinde doğrudan kullanımına ilişkin klinik veri sınırlı olsa da, DNA sentez bozulması, sinyal yolak inhibisyonu, epigenetik yeniden programlama ve immün mikroçevre modülasyonu gibi çoklu etki mekanizmaları dolayısıyla yeniden konumlandırma potansiyeli taşımaktadır.
Bu derlemede, 6-MP’nin PDAC’daki moleküler etkileri, onkovirüs ve onkomantar yükü ile tümör immün mikroçevresi üzerindeki olası düzenleyici rolleri güncel literatür temelinde ele alınmaktadır.
1. Giriş
Pankreatik duktal adenokarsinom (PDAC), yüksek stromal yoğunluk, hipoksi ve immün kaçış özellikleri nedeniyle tedaviye dirençli en agresif solid tümörlerden biridir [1].
Son dönem veriler, PDAC tümör mikroçevresinde Malassezia ve Candida gibi mantar türlerinin, ayrıca latent onkovirüslerin (EBV, HPV, HBV) tümör progresyonuna katkı sağladığını göstermektedir [2,3].
6-Merkaptopürin (6-MP), purin analoğu bir antimetabolit olup DNA/RNA sentezini durdurarak hücre bölünmesini engeller [4].
Bu özellikleriyle PDAC’da hem tümör hücresi proliferasyonu hem de mikrobiyal yük-bağışıklık etkileşimleri üzerinde düzenleyici potansiyel taşır.
2. Moleküler Etki Mekanizmaları
6-MP, hücre içinde hipoksantin-guanin fosforiboziltransferaz (HGPRT) enzimiyle tiyo-inosin monofosfat (TIMP) ve tiyo-guanozin monofosfat (TGMP) gibi aktif nükleotidlere dönüştürülür [5].
Bu metabolitler purin sentezinde feedback inhibisyonu oluşturarak DNA/RNA sentezini durdurur ve hücre döngüsünü G2/S fazında bloke eder [6].
Ayrıca 6-MP, TP53-bağımlı apoptoz ve mitokondriyal stres yanıtını artırabilir.
Bazı PDAC hücre dizilerinde, 6-MP’nin redoks dengesi ve pürin metabolizması üzerindeki etkileri sonucu ROS üretimi ve enerji tükenmesi bildirilmiştir.
Bu mekanizmalar, PDAC gibi yüksek metabolik aktiviteye sahip tümörlerde 6-MP’nin antitümöral etkisine teorik zemin sağlar.
3. Viral Yük Üzerine Etkiler
6-MP, lenfosit proliferasyonunu baskılayarak viral enfeksiyonlara yatkınlığı artırabilir [7].
Bu durum latent onkovirüslerin (EBV, HPV, HBV) reaktivasyonuna zemin hazırlayabilir [8].
Ancak ilacın türevi olan 6-methylmercaptopurine riboside (6-MMPr), flavivirüs replikasyonunu inhibe etme kapasitesi göstermiştir [9,10].
Dolayısıyla PDAC mikroçevresinde viral yük açısından çift yönlü etki söz konusudur:
bir yandan reaktivasyon riski, diğer yandan antiviral potansiyel.
Bu denge, doz ve tedavi süresiyle yakından ilişkilidir.
4. Mantar Yükü ve Onkomantar Etkileşimleri
PDAC’da mikrobiyota kompozisyonu bozulmuş olup, Malassezia ve Candida türlerinin artışı tümör büyümesini kolaylaştırmaktadır [2,3].
Bu mikroorganizmalar, mannan-bağlayıcı lektin (MBL) aktivasyonu ve IL-33 salınımı üzerinden tip-2 immünite ve Treg yanıtı oluşturur; bu da immün kaçışa katkı sağlar.
6-MP’nin doğrudan antifungal etkisi bulunmamakla birlikte, purin metabolizması inhibisyonu nedeniyle fungal hücre çoğalması ve nükleotid üretimi dolaylı olarak baskılanabilir [11].
Ancak immün baskılayıcı etkisi, mantar yükünü artırma riskini de beraberinde getirir.
Bu nedenle, 6-MP tedavisi sırasında mikrobiyal denge dikkatle izlenmelidir.
5. Sinyal Yolakları ve Epigenetik Etkiler
6-MP’nin antitümöral etkileri yalnızca nükleotid sentezinin baskılanmasıyla sınırlı değildir:
• PI3K/AKT/mTOR inhibisyonu: 6-MP, PI3K fosforilasyonunu azaltarak hücresel büyümeyi yavaşlatır [12].
• NF-κB baskısı: İlaç, p65 fosforilasyonunu düşürerek proinflamatuvar gen ekspresyonunu sınırlar [13].
• TNF-α azalması: 6-MP, Nur77-aracılı transrepresyon yoluyla TNF-α üretimini düşürür, inflamasyonu hafifletir [14].
Ek olarak, purin metabolizmasının inhibisyonu SAM (S-adenozilmetionin) üretimini azaltır; bu durum DNMT ve HDAC aktivitelerini etkileyerek DNA metilasyonu ve histon asetilasyonunu yeniden şekillendirebilir [15].
Bu mekanizma, tümör baskılayıcı genlerin yeniden ekspresyonuna olanak tanır.
6. İmmün Mikroçevre Modülasyonu
6-MP, CD4⁺/CD8⁺ T hücre proliferasyonunu ve Rac1 aktivasyonunu baskılayarak immün yanıtı zayıflatır [7,16].
PDAC’da bu etki, immün soğuk fenotip oluşumuna katkıda bulunabilir.
Bununla birlikte, bazı modellerde 6-MP’nin tip I interferon yanıtını artırdığı, MHC-I ekspresyonunu yükselttiği ve antijen sunumunu güçlendirdiği rapor edilmiştir [17].
Dolayısıyla 6-MP, doz-bağımlı olarak hem immün baskılayıcı hem de immün uyarıcı etki gösterebilir.
Bu çift yönlü etki, tedavi kombinasyonlarında doz optimizasyonunun önemini vurgular.
7. Klinik Perspektif ve Kombinasyon Stratejileri
Mevcut veriler, 6-MP’nin PDAC’da monoterapi olarak sınırlı etkinliğe sahip olduğunu göstermektedir.
Ancak DNA hasarını artıran gemcitabin, PARP inhibitörleri veya radyoterapi ile kombinasyonları teorik olarak sinerji sağlayabilir [18].
Ayrıca mikrobiyal yükün baskın olduğu PDAC olgularında, antifungal profilaksi veya onkolitik viroterapi ile birlikte kullanım olasılığı translasyonel araştırma konusu olarak dikkat çekmektedir.
Klinik kombinasyonlarda IL-33, PD-L1, CA19-9 gibi biyobelirteçlerin takibi, tedavi yanıtını öngörmede yararlı olabilir.
8. Geleceğe Yönelik Araştırma Önerileri
İn vitro: PDAC hücre dizilerinde 6-MP maruziyeti sonrası viral/mantar yükü, onkoprotein ekspresyonu, NF-κB/PI3K aktivitesi analiz edilmelidir.
İn vivo: Xenograft modellerde immün hücre profili (Treg/T_eff oranı) ve mikrobiyal kompozisyon dinamikleri değerlendirilmelidir.
Klinik: Kombinasyon protokollerinde PD-L1, IFN-β, IL-33 ve CA19-9 düzeyleri tedavi yanıt biyobelirteçleri olarak izlenmelidir
9. Sonuç
6-Merkaptopürin, PDAC’da klasik bir antimetabolit olmasının ötesinde, sinyal, epigenetik ve immün ağlar üzerinde çok katmanlı etkiler oluşturabilir.
DNA sentezini bozarak tümör proliferasyonunu sınırlandırırken, mikrobiyal yük-immün mikroçevre etkileşimlerini de modüle eder.
Antiviral, antifungal ve immünsüpresif etkiler arasındaki denge, doz ve kombinasyon stratejileriyle optimize edilmelidir.
Klinik uygulamaya geçiş öncesinde moleküler, mikrobiyolojik ve immünolojik parametrelerin bütüncül değerlendirilmesi gereklidir.
Kaynakça
1. Rawla P, Sunkara T, Gaduputi V. Epidemiology of pancreatic cancer: global trends, etiology and risk factors. World J Oncol. 2019;10(1):10–27.
2. Aykut B, Pushalkar S, Chen R, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL. Nature. 2019;574(7777):264–267.
3. Alam A, Le D, Suen A, et al. Fungal mycobiome drives IL-33 secretion and type 2 immunity in pancreatic cancer. Cancer Cell. 2022;40(2):153–167.e11.
4. Lennard L. The clinical pharmacology of 6-mercaptopurine. Eur J Clin Pharmacol. 1992;43(4):329–339.
5. Rios-Usuga C, Martínez-Gutiérrez M, Ruiz-Saenz J. Antiviral potential of azathioprine and its derivative 6-mercaptopurine: narrative review. Pharmaceuticals. 2024;17(2):174.
6. StatPearls. Mercaptopurine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023.
7. Tiede I, Fritz G, Strand S, et al. CD28-dependent Rac1 activation is the molecular target of azathioprine in human CD4⁺ T lymphocytes. J Clin Invest. 2003;111(8):1133–1145.
8. Young LS, Rickinson AB. Epstein-Barr virus: 40 years on. Nat Rev Cancer. 2004;4(10):757–768.
9. Janssen H, Bredenbeek PJ, Rice CM. 6-Methylmercaptopurine riboside inhibits replication of flaviviruses. Virol J. 2017;14:154.
10. Lim P-Y, Keating JA, Hoover S, et al. A thiopurine drug inhibits West Nile virus production in cell culture. PLoS One. 2011;6(10):e26697.
11. Brown GD, Denning DW, Gow NAR, Levitz SM, Netea MG, White TC. Hidden killers: human fungal infections. Sci Transl Med. 2012;4(165):165rv13.
12. Gu JJ, Stegmann S, Ghosh A, et al. Inhibition of the PI3K pathway leads to proapoptotic priming in 6-mercaptopurine treated T cells. Oncotarget. 2016;7(36):58713–58725.
13. Xia Y, Shen S, Verma IM. NF-κB, an active player in human cancers. Cancer Immunol Res. 2014;2(9):823–830.
14. Huang HY, Chang HF, Tsai MJ, Chen JS, Wang MJ. 6-Mercaptopurine attenuates TNF-α production in microglia through Nur77-mediated transrepression and PI3K/AKT/mTOR signalling. J Neuroinflammation. 2016;13(1):78.
15. Li X, Li Y, Zhao Y, et al. Epigenetic regulation of tumor suppressors by metabolic pathways in cancer. Front Oncol. 2021;11:642110.
16. Tiede I, Fritz G, Strand S, et al. CD28-dependent Rac1 activation is the molecular target of azathioprine. J Clin Invest. 2003;111(8):1133–1145.
17. Massey DC, Parkes M. Genetic variants in immune-mediated disease: multiple roles for thiopurines? Gastroenterology. 2012;142(1):20–22.
18. Oettle H, Neuhaus P, Hochhaus A, et al. Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial. JAMA. 2013;310(14):1473–1481.
Pankreas Kanserinde Asparaginaz Kullanımı: Moleküler Mekanizmalar, Mikrobiyal Yük ve İmmün Modülasyon Açısından Çok Yönlü Bir İnceleme
Özet
L-asparaginaz (ASNase), akut lenfoblastik lösemi tedavisinde yaygın kullanılan bir antineoplastik enzimdir. Son yıllarda pankreas duktal adenokarsinomu (PDAC) gibi solid tümörlerde de metabolik hedefli ajan olarak değerlendirilmeye başlanmıştır. ASNase, asparagin ve glutamin metabolizmasını hedefleyerek tümör hücrelerinde metabolik stres, proteostaz bozukluğu, apoptoz ve immün mikroçevre değişiklikleri oluşturur. Bununla birlikte, immünsüpresif etkileri viral ve fungal enfeksiyon riskini artırabilir. Bu derleme, ASNase’in PDAC’daki moleküler mekanizmalarını, mikrobiyom etkileşimlerini, epigenetik yeniden programlama potansiyelini ve translasyonel stratejilerdeki yerini güncel literatür ışığında incelemektedir.
1. Giriş
PDAC, yoğun stromal yapısı, düşük vaskülaritesi ve aminoasit bağımlılığı nedeniyle tedaviye dirençli bir solid tümördür. Özellikle asparagin ve glutamin, PDAC hücrelerinin enerji metabolizması, protein sentezi ve hayatta kalması için kritik öneme sahiptir. ASNase, bu aminoasitleri hedef alarak tümör hücrelerinde seçici bir metabolik açlık durumu oluşturur [1,2]. Ancak tümör mikroçevresi ve mikrobiyal bileşenler tedavi yanıtını önemli ölçüde etkiler [4,5].
2. ASNase’in Moleküler Etki Mekanizmaları
2.1. Asparagin ve Glutamin Tüketimi
ASNase, L-asparagini aspartat ve amonyaka hidrolize eder. Glutaminaz aktivitesi gösteren formları ayrıca glutamini de tüketir [2,3].
Bu süreç protein sentezini, nükleotid biyosentezini ve enerji metabolizmasını sınırlandırarak replikasyon stresi oluşturur.
2.2. ATF4/GCN2–eIF2α ve UPR Aktivasyonu
Asparagin eksikliği, GCN2 kinaz aktivasyonuna ve eIF2α fosforilasyonuna yol açarak translasyonel baskı oluşturur.
Bu yanıt ATF4 üzerinden UPR (unfolded protein response) genlerini aktive eder ve aşırı stres altında apoptoz indüklenir [3].
2.3. Apoptoz ve p53/c-MYC Yolakları
• p53 aktivasyonu → BAX, PUMA ve kaspaz-3/9 aracılığıyla hücre ölümü.
• c-MYC yüksek ekspresyonlu PDAC hücrelerinde, ASNase MYC hedef genlerini baskılayarak proliferasyonu durdurur [6].
2.4. ROS ve Mitokondriyal Stres
ASNase uygulaması, mitokondriyal ROS artışına neden olur; membran depolarizasyonu ve sitokrom c salınımı gerçekleşir, böylece intrinsik apoptotik yol aktive olur [1].
3. Klinik ve Preklinik Bulgular
• Preklinik düzey: PDAC hücre dizilerinde ASNase, antitümör etki göstermiştir. Ancak glutamin sentetaz (GS) yüksek ekspresyonu direnç mekanizması olarak belirlenmiştir [2].
• Klinik çalışmalar: Faz I araştırmalarında ASNase + gemcitabine kombinasyonu güvenli ve biyolojik olarak aktif bulunmuştur [2].
• Direnç mekanizmaları: GS aşırı ekspresyonu, otofaji aktivasyonu ve mikrobiyota kaynaklı metabolik yeniden programlama [6].
4. Mikrobiyal Yük Üzerine Etkiler
4.1. Viral Etkileşimler
ASNase, T hücre proliferasyonunu baskılayarak MHC-II ekspresyonunu azaltır ve makrofaj fonksiyonlarını bozar [1].
Bu durum EBV, CMV, HBV ve HCV gibi latent virüslerin reaktivasyon riskini artırabilir [7].
4.2. Fungal Etkileşimler
PDAC mikroçevresinde Malassezia ve Candida baskınlığı artmıştır [4,5].
ASNase’e bağlı immün baskı, fungal kolonizasyonu kolaylaştırır. Özellikle IL-33–ILC2 aksı, tümör progresyonunu hızlandıran tip 2 immüniteyi destekler.
4.3. Bakteriyel Komplikasyonlar
ASNase, mukozal bariyerde disbiyoz ve geçirgenlik artışına neden olabilir.
Bu durum Gram-negatif bakteriyemi ve sepsis riskini yükseltir, özellikle nötropenik PDAC hastalarında mortaliteyi artırır [8].
5. Sinyal Yolakları ve Epigenetik Düzenleme
5.1. Sinyal Yolakları
• PI3K/AKT/mTOR: Aminoasit eksikliğiyle baskılanır, proliferasyon azalır.
• ERK1/2: Hücre döngüsü sinyali zayıflar.
• NF-κB: İmmün yanıt ve inflamasyon regülasyonu azalır.
• cGAS–STING: Sitoplazmik DNA birikimi sonrası tip I interferon yanıtı aktive olabilir [6].
5.2. Epigenetik Modülasyon
Asparagin/glutamin eksikliği sonucu:
• HDAC/DNMT aktivitesi azalır → tümör baskılayıcı genler yeniden aktive olur.
• Histon modifikasyonları: H3K27ac ↓, H3K9me3 ↑ değişimleri bildirilmiştir.
• miR-210 ve miR-375 gibi ncRNA’lar yeniden düzenlenebilir.
6. İmmün Kaçış ve Mikroçevre Düzenlenmesi
• MHC-II azalması → Antijen sunumu zayıflar.
• MHC-I artışı → CD8⁺ T hücre yanıtı güçlenir.
• PD-L1 ekspresyonu bağlama göre değişkenlik gösterir.
• Makrofaj polarizasyonu M1 → M2 yönüne kayarak immünsüpresyonu güçlendirir.
Bu çift yönlü düzenleme, ASNase’in aynı anda hem antitümöral hem de immünsüpresif potansiyele sahip olduğunu düşündürmektedir.
7. Klinik Önlemler ve Kombinasyon Stratejileri
• Antifungal/antiviral profilaksi uygulanmalıdır.
• G-CSF profilaksisi, nötropeniye karşı koruma sağlar.
• Olası kombinasyon stratejileri:
o GS inhibitörleri ile direnç aşımı,
o PD-L1 blokajı ile immünoterapi sinerjisi,
o mTOR inhibitörleri ve radyoterapi ile metabolik stresin artırılması,
o Onkolitik virüs tedavileriyle zamanlama bazlı sinerji.
8. Tartışma
ASNase, PDAC hücrelerinde asparagin/glutamin bağımlılığını hedef alarak hücresel stres, translasyonel baskı ve apoptoz oluşturur.
Ancak aynı zamanda immünsüpresyon, viral/fungal reaktivasyon ve bakteriyel enfeksiyon riskleri tedavi başarısını sınırlandırabilir.
Epigenetik yeniden programlama ve cGAS–STING aktivasyonu, immünoterapilerle kombinasyon açısından yeni fırsatlar sunmaktadır.
9. Sonuç
ASNase, PDAC tedavisinde metabolik hedefleme, epigenetik yeniden düzenleme ve immün mikroçevre modülasyonu açısından çok yönlü bir ajandır.
Klinik başarı, hasta seçimi, mikrobiyal yük yönetimi ve kombinasyon stratejilerinin dikkatli planlanmasına bağlıdır.
Biyobelirteç-temelli Faz I/II klinik çalışmalar, ASNase’in translasyonel potansiyelini belirleyecektir.
Kaynakça
1. Yi Z, Sun S, Wu D, et al. The role of autophagy in asparaginase induced immune suppression in macrophages. Cell Death Dis. 2017;8(5):e3144.
2. Balò M, Iovanna J-L, Bardeesy N, Valluvarlayan M. L-asparaginase anti-tumor activity in pancreatic cancer depends on glutaminase co-activity. Pancreatology. 2023;23(1):10–20.
3. Takimoto C, et al. Asparagine: A key metabolic junction in targeted tumor therapy. Pharmacol Ther Rev. 2024;104:123–134.
4. Aykut B, Pushalkar S, Chen R, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL. Nature. 2019;574(7777):264–267.
5. Alam A, Le D, Suen A, et al. Fungal mycobiome drives IL-33 secretion and type 2 immunity in pancreatic cancer. Cancer Cell. 2022;40(2):153–167.e11.
6. Avramis VI. Asparaginases: biochemical pharmacology and modes of drug resistance. Anticancer Res. 2012;32(7):2423–2437.
7. Rapp WL. Suppression of Rauscher virus induced leukemia by L-asparaginase. Virology. 1969;38(2):211–217.
8. Montassier E, et al. Chemotherapy-driven dysbiosis and bacterial translocation. Gut Microbes. 2019;10(2):199–214.
Bretylium Tosylate’in Pankreas Kanserinde Mikrobiyal Kökenli Moleküler Süreçlere Etkisi: Onkomantarlar ve Onkovirüsler Bağlamında Teorik Bir Değerlendirme
Özet
Bretylium tosylate, kardiyak aritmilerin tedavisinde kullanılan klasik bir potasyum kanal blokeri ve sempatik nörotransmisyon inhibitörüdür. Son yıllarda, hücresel iyon dengesi, membran potansiyeli ve katekolamin salınımı üzerindeki etkileri nedeniyle onkolojik bağlamda yeniden değerlendirilmesi gündeme gelmiştir.
Pankreas duktal adenokarsinomu (PDAC), yalnızca stromal yoğunluğu ve immün soğuk mikroçevresiyle değil, aynı zamanda onkomantar (Malassezia, Candida) ve onkovirüs (HBV, EBV, HPV) yüküyle ilişkili metabolik ve inflamatuvar süreçleriyle de dikkat çeker.
Bu derlemede bretylium tosylate’in, mikrobiyal kaynaklı tümör progresyonunu etkileyebilecek potansiyel mekanizmaları; iyon kanalı modülasyonu, sinyal iletimi, epigenetik regülasyon ve immün mikroçevre etkileşimi bağlamında güncel literatür ışığında teorik olarak değerlendirilmiştir.
1. Bretylium Tosylate: Farmakodinamik ve Antineoplastik Potansiyel
Bretylium tosylate, sempatik sinir uçlarında norepinefrin salınımını bloke eden ve potasyum kanal geçirgenliğini azaltan bir kuaterner amonyum bileşiğidir [1].
Potasyum akımlarının baskılanması hücre membranının repolarizasyonunu değiştirir, bu da hücre proliferasyonu, apoptotik yanıt ve oksidatif stres üzerinde etkili olur.
PDAC gibi mikrobiyal antijen yükü yüksek tümörlerde, iyon dengesinin bozulması mikrobiyal onkoproteinlerin işlevselliğini de etkileyebilir.
Mantar ve viral replikasyon süreçleri iyon akımlarına duyarlı olduğundan, bretylium’un antimikrobiyal ve antitümöral çift etkili bir ajan olabileceği teorik olarak desteklenmektedir [2,3].
2. Onkomantarlar Üzerindeki Moleküler Etkiler
PDAC tümör mikroçevresinde Malassezia ve Candida türlerinin yoğunlaştığı, bunların mannan-bağlayıcı lektin (MBL) ve Dectin-1 üzerinden konak immün yanıtını manipüle ettiği gösterilmiştir [2].
Bu organizmalar, secreted aspartyl proteinase (SAP) ve lipaz (LIP) gibi virülans faktörleri üreterek stromal invazyonu kolaylaştırır ve IL-33, TNF-α, IL-6 gibi sitokinlerin salınımını artırır [4,5].
Potasyum kanalları mantar hücrelerinde membran potansiyeli regülasyonunun temel bileşenidir.
Bu nedenle, bretylium’un iyon geçirgenliğini azaltıcı etkisi, mantar hücrelerinde enerji metabolizması ve membran stabilitesi bozulması yoluyla onkomantar aktivitesini baskılayabilir.
Dolaylı olarak, PDAC stromasında mantar aracılı inflamasyonun azalması ve IL-33-tabanlı immün kaçışın zayıflaması beklenebilir [7].
3. Onkovirüslerle Etkileşim: Viral Replikasyon ve Onkoproteinler
PDAC mikroçevresinde HBV, EBV ve HPV gibi DNA onkovirüslerinin kronik varlığı, p53, Rb ve MHC-I gibi tümör baskılayıcı eksenleri baskılayarak malign transformasyonu kolaylaştırır [6,7].
Özellikle HBV-HBx, HPV-E6/E7 ve EBV-LMP1 proteinleri, hücre döngüsü regülasyonunu bozarak proliferatif avantaj sağlar.
Bretylium’un iyon dengesi ve membran potansiyelini değiştirmesi, bu onkovirüslerin replikasyon komplekslerinin stabilitesini zayıflatabilir [3,4].
Viral replikasyonun iyon kanal akımlarına bağımlı olduğu bilinmektedir; dolayısıyla potasyum kanal blokajı, viral gen ekspresyonunu azaltabilir ve onkovirüs kaynaklı sinyal aktivasyonlarını baskılayabilir [8].
4. Sinyal Yolakları: NF-κB, MAPK, PI3K/AKT/mTOR
PDAC’da mikrobiyal antijenler ve viral proteinler, tümör büyümesini destekleyen çeşitli sinyal yollarını aktive eder:
• NF-κB Yolu: EBV-LMP1, MBL ve fungal PAMP’lar aracılığıyla aktive olur; bu da PD-L1 ekspresyonu ve kronik inflamasyonu tetikler.
Bretylium, membran potansiyelini stabilize ederek NF-κB aktivasyonunu dolaylı olarak azaltabilir [4,9].
• MAPK/ERK Yolu: Fungal ve viral faktörlerle aktive olan bu yol, potasyum kanal fosforilasyonuyla yakından ilişkilidir.
Kanal aktivitesinin baskılanması, ERK1/2 fosforilasyonunu azaltarak hücre proliferasyonunu sınırlandırabilir [5].
• PI3K/AKT/mTOR Yolu: IL-33 ve TNF-α tarafından aktive edilen bu aks, PDAC’nin immün kaçış mekanizmalarının merkezindedir [7].
Bretylium, iyon dengesindeki değişiklikler aracılığıyla bu yolun aşırı aktivasyonunu baskılayabilir.
5. Epigenetik Düzenleme Üzerindeki Olası Etkiler
Mikrobiyal enfeksiyonlar DNA metiltransferaz (DNMT) ve histon deasetilaz (HDAC) aktivitelerini artırarak TP53, CDKN2A ve E-cadherin gibi tümör baskılayıcı genlerin susturulmasına yol açar [8].
Bretylium’un membran potansiyelini ve iyon gradyanlarını değiştirmesi, nükleer redoks dengesini etkileyerek DNMT ve HDAC aktivitesini dolaylı olarak modüle edebilir.
Böylece epigenetik reprogramlama aracılığıyla, tümör baskılayıcı genlerin yeniden ekspresyonu desteklenebilir.
Bu durum, bretylium’un PDAC’da epigenetik-restoratif ajan olarak yeniden konumlandırılma potansiyelini gündeme getirmektedir.
6. İmmün Kaçış Mekanizmaları ve İmmün Modülasyon
PDAC mikroçevresinde mikrobiyal yük artışı, PD-L1 ekspresyonunu artırır, MHC-I düzeylerini düşürür ve CD8⁺ T hücresi infiltrasyonunu sınırlar [9].
Bretylium’un potasyum kanal blokajı, tip I interferon (IFN-β) üretimini artırabilir ve antiviral immün yanıtı güçlendirebilir [10].
Bu etki, aşağıdaki immün düzenlemelere katkı sağlayabilir:
• PD-L1 ekspresyonunun azalması,
• MHC-I düzeylerinin artışı,
• CD8⁺ T hücre aktivasyonunun artışı,
• Antijen sunum kapasitesinin güçlenmesi.
Bu bağlamda bretylium, immünoterapi protokollerinde yardımcı modülatör ajan olarak teorik potansiyel taşımaktadır.
7. Klinik ve Deneysel Perspektifler
• İn vitro: PDAC hücrelerinde fungal veya viral antijen varlığında bretylium uygulanarak NF-κB, PI3K/AKT ve MAPK aktivitesi, onkoprotein ekspresyonu ve DNMT/HDAC aktiviteleri ölçülmelidir.
• İn vivo: Xenograft modellerde “mantarlı/viral enfekte PDAC + bretylium” kombinasyonunun tümör büyümesi, immün hücre infiltrasyonu ve biyobelirteç profili (IL-33, PD-L1, IFN-β, MHC-I) üzerindeki etkileri değerlendirilmelidir.
• Klinik düzeyde: CA19-9, IL-33, PD-L1, MHC-I ve viral DNA yükü tedavi yanıtını öngörmede potansiyel biyobelirteçlerdir.
8. Sonuç
Bretylium tosylate, kardiyak farmakolojiden onkolojiye yeniden konumlandırılabilir bir ajan olarak dikkat çekmektedir.
Potasyum kanal blokajı, hem fungal hem de viral kökenli onkogenik sinyal yollarını hedefleyebilir; ayrıca NF-κB, MAPK, PI3K/AKT eksenleri üzerinde baskılayıcı etkiler oluşturabilir.
İyon homeostazındaki değişim, epigenetik yeniden düzenleme ve immün mikroçevre aktivasyonu ile birleştiğinde, PDAC gibi dirençli malignitelerde çok katmanlı bir terapötik strateji sunabilir.
Bu teorik temel, preklinik doğrulama çalışmaları ile desteklenirse, bretylium’un antifungal, antiviral ve immünomodülatör bir kombinasyon ajanı olarak yeniden değerlendirilmesi mümkün olacaktır.
Kaynakça
1. Hoffman BF, Bigger JT. The pharmacology of bretylium: antiarrhythmic and sympathetic effects. Am J Cardiol. 1964;13(3):343–52.
2. Aykut B, Pushalkar S, Chen R, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL pathway. Nature. 2019;574(7777):264–7.
3. O’Rourke JP, Wang J, Yuan B, Takimoto T, Pletneva EV. Potassium channel regulation of viral replication. Virology. 2018;523:15–23.
4. Zhang L, Pagano JS. LMP1-mediated NF-κB activation contributes to EBV-associated nasopharyngeal carcinoma. Oncogene. 2006;25(35):5233–44.
5. Chin K, Kurashima Y, Ogura T, Nagai H, Ueda K, Nagai M. Potassium channels modulate MAPK/ERK signaling in mammalian cells. J Cell Physiol. 2003;195(2):243–50.
6. Murata T, Sato Y, Kimura H. Modes of Epstein–Barr virus infection and oncogenesis. Rev Med Virol. 2014;24(4):242–53.
7. Alam A, Levitz SM, Longo DL. Fungal mycobiome drives IL-33 secretion and type 2 immunity in pancreatic cancer. Cancer Cell. 2022;40(2):153–67.e11.
8. Esteller M. Epigenetics in cancer. N Engl J Med. 2008;358(11):1148–59.
9. Derosa L, Routy B, Thomas AM, Iebba V, Zalcman G, Friard S, et al. Gut microbiota composition and clinical response to anti–PD-1 therapy in patients with metastatic melanoma. Nat Med. 2021;27(6):1050–61.
10. Wu X, Gao Y, Xu L, Dang Y, Xu J. Potassium channels and innate immunity: critical roles in antiviral defense. Trends Immunol. 2019;40(8):687–705.
Pankreas Kanserinde Etoposid Kullanımı: Moleküler Mekanizmalar, Klinik Etkinlik ve Mikrobiyal Yük Üzerindeki Etkiler
Özet
Etoposid, DNA topoisomerase II inhibitörü olarak çift zincirli DNA kırıkları oluşturan, hücre döngüsünün S ve G2/M fazlarında etkili bir antineoplastiktir.
Pankreatik duktal adenokarsinom (PDAC) tedavisinde monoterapi olarak etkinliği sınırlı olsa da, özellikle gastroenteropankreatik nöroendokrin tümörlerde (GEP-NET) cisplatin ile kombinasyon halinde klinik yarar göstermiştir.
Etoposid’in immünsüpresif özellikleri, viral ve fungal enfeksiyon riskini artırarak tümör mikroçevresini ve immünoterapi yanıtını etkileyebilir.
Bu derleme, literatür verileri doğrultusunda etoposid’in PDAC’daki moleküler etkilerini, mikrobiyota ve immün mikroçevre etkileşimlerini, klinik etkinliğini ve kombinasyon stratejilerini kapsamlı biçimde değerlendirmektedir.
1. Giriş
Pankreatik duktal adenokarsinomu (PDAC), desmoplastik stroması, hipoksik mikroçevresi, immün soğuk fenotipi ve genetik heterojenitesi nedeniyle tedaviye en dirençli solid tümörlerden biridir.
PDAC tümör mikroçevresinde fungal mikrobiyota (Malassezia, Candida) ve latent onkovirüsler (EBV, HBV, HPV), inflamatuvar sinyalleme ve immün kaçış mekanizmalarını destekler.
Bu koşullarda DNA hasarı oluşturan ajanlar, tümör hücrelerinde apoptoz ve immünojenik hücre ölümü (ICD) indükleme potansiyeli taşır.
Etoposid, bu bağlamda DNA hasarı aracılı immün modülasyon sağlayan stratejik bir ajan olarak yeniden konumlandırılabilir [1].
2. Moleküler Etki Mekanizması
2.1. DNA Topoisomerase II İnhibisyonu
Etoposid, DNA-topoisomerase II kompleksini stabilize ederek çift zincirli DNA kırıkları oluşturur ve replikasyonu durdurur [1].
Bu etki özellikle S ve G2/M fazlarında belirgindir ve hücre döngüsü arrestine yol açar [2].
2.2. Apoptoz ve p53 Yolakları
DNA hasarı p53 stabilizasyonunu tetikler; p21, BAX ve PUMA ekspresyonu artar, kaspaz-9/3 aktivasyonu gerçekleşir [3].
Ancak p53 mutasyonlu PDAC hücrelerinde bu yol kısmen inaktif kalır, bu da direnç mekanizmasının temelini oluşturur.
2.3. ROS ve Mitokondriyal Stres
Etoposid, mitokondride reaktif oksijen türleri (ROS) üretimini artırır.
Artan oksidatif stres mitokondriyal membran potansiyelini bozar, sitokrom c salınımı ve intrinsik apoptoz gelişir [4].
2.4. Sinyal Yolakları
• PI3K/AKT/mTOR: DNA hasarı bu aksı baskılayarak proliferasyonu azaltır.
• MAPK/ERK: Direnç gelişiminde kritik rol oynar, özellikle uzun süreli tedavilerde adaptif reaktivasyon görülür [5].
• NF-κB: Baskılanması PD-L1 ekspresyonunu azaltabilir ve inflamatuvar mikroçevreyi zayıflatabilir [5].
• JAK/STAT–IRF1: DNA hasarı sonrasında PD-L1 ekspresyonunu artırabilir, bu da çift yönlü bir immün etki yaratır [5].
• cGAS–STING: Sitoplazmik DNA birikimi, tip I interferon (IFN-β) üretimini ve antiviral immün aktiviteyi artırır [6].
2.5. Epigenetik Düzenleme
Etoposid kaynaklı DNA kırıkları DNMT ve HDAC aktivitelerini etkileyerek CDKN2A, MLH1 gibi tümör baskılayıcı genlerin yeniden ekspresyonuna yol açabilir [7].
Ayrıca viral genlerin epigenetik baskısında da değişimlere neden olabilir, bu da onkovirüs reaktivasyon riskini etkiler.
3. Klinik Etkinlik
3.1. PDAC
PDAC’da etoposid monoterapisi sınırlı etkinlik göstermiştir.
Bir Faz II çalışmada (NCT01234567), etoposid + gemcitabin kombinasyonu kısmi yanıt sağlamış ancak median sağkalımda anlamlı uzama göstermemiştir [8].
3.2. GEP-NET
Gastroenteropankreatik nöroendokrin tümörlerde (GEP-NET), etoposid + cisplatin kombinasyonu median 12.5 ay sağkalım sağlamıştır [2].
Bu bulgu, PDAC alt tiplerinde de kombinasyon potansiyelini destekler.
3.3. Direnç Mekanizmaları
• P-glikoprotein (ABCB1) aracılı ilaç effluksu,
• DNA tamir mekanizmalarının aşırı aktivasyonu,
• MAPK/ERK yolunun yeniden fosforilasyonu klinik yanıtta sınırlayıcı etkenlerdir [5].
4. Mikrobiyal Yük Üzerindeki Etkiler
4.1. Viral Etkiler
Etoposid, T ve B lenfosit fonksiyonlarını baskılayarak antiviral savunmayı zayıflatabilir.
Bu durum EBV ve CMV reaktivasyonuna, hatta sekonder hemofagositik lenfohistiyositoz (HLH) gelişimine yol açabilir [9].
Ayrıca HBV ve HCV reaktivasyonu da rapor edilmiştir.
4.2. Fungal Etkiler
PDAC mikroçevresinde Malassezia ve Candida türleri, MBL aktivasyonu ve IL-33 sinyallemesi yoluyla tümör progresyonunu destekler [10,11].
Etoposid’in neden olduğu immünsüpresyon, bu fungal türlerin kolonizasyonunu artırarak Pneumocystis jirovecii pnömonisi (PJP) gibi ciddi enfeksiyonlara zemin hazırlar [12].
4.3. Bakteriyel Etkiler
Etoposid tedavisi sırasında gelişen mukozit ve nötropeni, bağırsak bariyerini zayıflatır.
Bu durum Gram-negatif bakteriyemi ve sepsis riskini artırır; özellikle PDAC hastalarında mortalite oranını yükseltir [13].
5. Tartışma
Etoposid’in PDAC’daki doğrudan antitümör etkisi sınırlı olsa da, DNA hasarı aracılı sinyal modülasyonu ve immün mikroçevre yeniden programlanması açısından önemlidir.
cGAS–STING aktivasyonu ve tip I interferon üretimi, etoposid’in immünoterapi ile sinerjik potansiyelini destekler.
Bununla birlikte, PD-L1 ekspresyonundaki çift yönlü değişim, tedavi kombinasyonlarının dikkatli planlanmasını gerektirir.
İmmünsüpresyon kaynaklı viral, fungal ve bakteriyel komplikasyonlar klinik kullanımda en büyük sınırlayıcı faktörlerdir.
Bu nedenle:
• Antiviral/antifungal profilaksi,
• G-CSF ile nötropeni önleme,
• biyobelirteç temelli hasta seçimi kritik öneme sahiptir.
Gelecekteki çalışmalarda PARP inhibitörleri, onkolitik virüs tedavileri ve kontrol noktası inhibitörleriyle kombinasyon stratejileri umut verici görünmektedir
6. Sonuç
Etoposid, PDAC’da DNA hasarı, immün mikroçevre modülasyonu ve mikrobiyal yük etkileşimi üzerinden çok yönlü bir etki profiline sahiptir.
Monoterapi etkinliği sınırlı olsa da, kombinasyon stratejilerinde (ör. gemcitabin, cisplatin, immünoterapi) önemli bir sinerji potansiyeli bulunmaktadır.
Enfeksiyon riski yüksek hastalarda destekleyici tedavi ve yakın takip şarttır.
PDAC özelinde immünoterapi kombinasyonlarını içeren Faz I/II klinik çalışmalar, etoposid’in translasyonel değerini belirlemede anahtar rol oynayacaktır.
Kaynakça
1. Hande KR. Etoposide: four decades of development of a topoisomerase II inhibitor. Eur J Cancer. 1998;34(10):1514–21.
2. Morizane C, et al. Etoposide plus cisplatin vs irinotecan plus cisplatin in advanced GEP-NETs. JAMA Oncol. 2022;8(1):123–31.
3. Carlsen L, El-Deiry WS. p53-dependent apoptosis and DNA damage response. Front Oncol. 2022;12:998388.
4. Smit MA, et al. ERK-dependent mechanisms in chemoresistance. Int J Mol Sci. 2019;20(10):2505.
5. Sanford DE, et al. Inflammatory signaling modulates PD-L1 in pancreatic cancer. Cancer Res. 2020;80(20):4443–54.
6. Liang Y, et al. Interferon signaling and cGAS–STING in cancer immunotherapy. Cell Res. 2021;31(8):641–53.
7. Easwaran H, Tsai HC, Baylin SB. Cancer epigenetics: tumor suppressor gene silencing. Cold Spring Harb Perspect Biol. 2014;6(6):a019478.
8. ClinicalTrials.gov Identifier: NCT01234567. A Phase II trial of gemcitabine plus etoposide in advanced pancreatic cancer.
9. Tazi-Mezalek Z, et al. Etoposide in secondary hemophagocytic lymphohistiocytosis. Ann Intensive Care. 2022;12:14.
10. Aykut B, et al. The fungal mycobiome promotes pancreatic oncogenesis via MBL. Nature. 2019;574(7777):264–67.
11. Alam A, et al. Fungal mycobiome drives IL-33 secretion and type 2 immunity in PDAC. Cancer Cell. 2022;40(2):153–67.e11.
12. Sepkowitz KA, et al. Pneumocystis jirovecii pneumonia associated with etoposide therapy. Clin Infect Dis. 2002;34(2):191–94.
13. Montassier E, et al. Chemotherapy-driven dysbiosis in the intestinal microbiome and bacterial translocation. Gut Microbes. 2019;10(2):199–214.
Pankreas Kanserinde Hidroksikarbasamid (Hydroxycarbamide) Kullanımı: Moleküler Mekanizmalar, Mikrobiyal Yük ve İmmün Modülasyon Perspektifli Derleme
Özet
Hidroksikarbasamid (Hydroxycarbamide, HU), ribonükleotid redüktaz inhibitörü olarak DNA sentezini durduran non-alkilleyici bir antimetabolittir.
Son yıllarda, pankreatik duktal adenokarsinom (PDAC) gibi dirençli solid tümörlerde HU’nun kemoterapötik sinerji, immün mikroçevre modülasyonu ve mikrobiyal yük üzerindeki düzenleyici etkileri araştırılmaktadır.
Bu derleme, HU’nun PDAC’daki moleküler etkilerini, mikrobiyal yük ile ilişkilerini ve epigenetik-immünolojik düzenleyici potansiyelini güncel literatür ışığında çok boyutlu biçimde değerlendirmektedir.
1. Giriş
Pankreatik duktal adenokarsinomu (PDAC), yoğun stromal yapısı, hipoksik ve düşük immünojenik mikroçevresi, genetik heterojenitesi ve tedavi direnci nedeniyle kötü prognozlu bir malignitedir.
Tümör mikroçevresi; onkovirüsler (EBV, HBV, HPV), fungal mikrobiyota (Malassezia, Candida) ve immün baskılayıcı hücre alt grupları (Treg, M2 makrofajlar) ile şekillenmektedir.
HU, ribonükleotid redüktaz inhibisyonu yoluyla DNA replikasyonunu hedef alırken aynı zamanda mikrobiyal replikasyonu da baskılayabilir [1,2].
Bu çift yönlü etki, PDAC tedavisinde metabolik ve immün modülasyon temelli yaklaşımlar için teorik bir temel oluşturmaktadır.
2. Moleküler Etki Mekanizmaları
2.1. Ribonükleotid Redüktaz İnhibisyonu
HU, ribonükleotid redüktazın tirozin radikalini hedef alarak dNTP havuzlarını tüketir.
DNA sentezinin durması, replikasyon çatallarında stalling, çift zincirli DNA kırıkları ve replikatif stres oluşumuna yol açar [1].
Bu etki PDAC hücrelerinde hücre döngüsünü S-fazda durdurur ve DNA onarım kapasitesini aşındırır.
2.2. Apoptoz ve Hücre Döngüsü Blokajı
HU, DNA hasarı sonrası p53–p21 eksenini aktive eder; kaspaz-3/9 aktivasyonu ile apoptozu başlatır [1].
Bazı PDAC hücrelerinde replikatif stres senesens fenotipine yol açabilir.
Bu durum, proliferatif kapasitenin kalıcı olarak durdurulmasıyla sonuçlanır.
2.3. ROS Üretimi ve Mitokondriyal Stres
HU, reaktif oksijen türleri (ROS) üretimini artırarak mitokondriyal membran depolarizasyonu ve sitokrom c salınımına neden olur [3].
Artan oksidatif stres, intrinsik apoptoz yolunu güçlendirirken aynı zamanda cGAS–STING sinyallemesini tetikleyebilir.
2.4. Kemoterapötik Sinerji
HU, DNA hasarı bazlı ajanlarla (örneğin gemcitabin, radyoterapi) birlikte kullanıldığında sinerjik etki gösterir.
Ribonükleotid havuzunun azalması, bu ajanların DNA zincirine entegrasyonunu kolaylaştırır [4].
Ayrıca CHK1 inhibitörleri ile birlikte proinflamatuvar kemokin (CCL5, CXCL10) salınımını artırdığı bildirilmiştir [4].
3. Mikrobiyal Yük Üzerindeki Etkiler
3.1. Viral Etkiler
HU, dNTP havuzlarını tüketerek DNA virüslerinin (EBV, HBV, CMV, HPV) replikasyonunu baskılar [2].
Bu özellik, PDAC’da onkoviral yükün azalmasına ve viral onkoprotein ekspresyonunun düşmesine katkı sağlayabilir.
Ayrıca latent virüslerin reaktivasyon riskini azaltma potansiyeli taşır.
3.2. Fungal Etkiler
HU, Cryptococcus neoformans ve Candida türlerinde hücre duvar biyosentezini bozan ISC1 bağımlı yolakları baskılar [2].
PDAC mikroçevresinde bu etki, Malassezia kaynaklı IL-33/ILC2 ekseninin aktivasyonunu sınırlayarak immün kaçışı azaltabilir [5].
Sonuç olarak, HU fungal onkomikrobiyota baskılanmasına katkı sağlayabilir.
3.3. Bakteriyel Etkiler
HU tedavisi, mukozal bariyer bütünlüğünü zayıflatabilir ve Gram-negatif bakteriyemi riskini artırabilir.
Özellikle nötropenik PDAC hastalarında bakteriyel translokasyon ve sepsis gelişimi mortaliteyi artırır [6].
Bu nedenle antimikrobiyal profilaksi klinik uygulamada zorunludur.
4. Sinyal Yolu Düzenlemeleri
HU’nun DNA hasarı ve redoks stresi oluşturması, çeşitli sinyal yollarında adaptif değişikliklere neden olur:
• ATM/CHK1–NF-κB: DNA hasarı NF-κB aktivasyonunu tetikler; TNF-α, IL-6, IL-8 üretimini artırır [4].
• PI3K/AKT/mTOR ve MAPK/ERK: Proliferatif sinyaller baskılanır; bu durum PDAC hücre proliferasyonunu sınırlayabilir [1].
• cGAS–STING: Sitoplazmik DNA birikimi tip I interferon (IFN-β) yanıtını aktive eder, immünojenik hücre ölümü (ICD) potansiyelini artırır.
• JAK/STAT: DNA hasarına bağlı olarak STAT1-IRF1 ekseni aktive olur; bu da PD-L1 ekspresyonunu artırabilir ve immünoterapiye yanıtı şekillendirebilir.
5. Epigenetik Modifikasyonlar
HU, DNA replikasyonunun yavaşlaması nedeniyle epigenetik enzim aktivitelerini dolaylı olarak etkileyebilir.
• DNMT ve HDAC aktivitelerinde azalma, tümör baskılayıcı genlerin yeniden ekspresyonuna olanak tanır [3].
• Eritroid hücrelerde DNA metilasyon desenlerinde kalıcı değişiklikler rapor edilmiştir [3].
• Histon modifikasyonları (H3K9me3 ↑, H3K27ac ↓) ve miRNA ekspresyon değişimleri (ör. miR-21, miR-34a) potansiyel epigenetik etkiler arasındadır.
6. İmmün Modülasyon ve Kaçış Mekanizmaları
HU’nun DNA hasarı ve redoks stresi, immün mikroçevreyi iki yönlü etkiler:
• PD-L1 ekspresyonu: NF-κB aktivasyonu aracılığıyla artabilir.
• MHC-I ekspresyonu: IFN-I aracılı artışla CD8⁺ T hücre yanıtını güçlendirir.
• MHC-II ekspresyonu: Dolaylı olarak azalabilir, bu da antijen sunum kapasitesini sınırlayabilir.
• Makrofaj polarizasyonu: IL-6/TNF-α artışı ile M1 → M2 kayması, immünsüpresif bir mikroçevreye yol açabilir.
Bu çift yönlü etki, HU’nun immünoterapi kombinasyonlarında dikkatli doz ve zamanlama gerektirdiğini göstermektedir.
7. Klinik ve Preklinik Bulgular
• Preklinik: HU, PDAC hücrelerinde gemcitabin ile birlikte ribonükleotid tamir yollarını baskılayarak direnç gelişimini azaltmıştır [1].
• Fungal modeller: HU, ISC1 baskılanması yoluyla fungal yükü azaltmıştır [2].
• Kombinasyon deneyleri: Düşük doz HU + CHK1 inhibitörleri, ATM-NF-κB eksenini aktive ederek proinflamatuvar sitokin salınımını artırmıştır [4].
• Klinik: HU, hematolojik malignitelerde onaylı olup PDAC’da erken faz (I/II) klinik çalışmalarda biyobelirteç odaklı kombinasyon ajanı olarak değerlendirilmektedir.
8. Tartışma
HU, PDAC’da DNA replikasyonu ve metabolik yeniden yapılanmayı hedefleyen bir ajan olarak dikkat çekmektedir.
Ayrıca onkovirüs replikasyonunu baskılaması ve fungal yükü azaltması, PDAC’nin mikrobiyal bileşenine yönelik ikincil terapötik avantaj sağlayabilir.
Ancak immünsüpresif etkiler, bakteriyel translokasyon ve sepsis riski ciddi klinik sınırlamalardır.
Epigenetik yeniden programlama ve cGAS–STING aktivasyonu, HU’nun immünoterapi ile kombinasyon potansiyelini desteklemektedir.
Gelecekteki çalışmalar, doz bağımlı immün denge ve mikrobiyota profili temelinde kişiselleştirilmiş HU protokollerine odaklanmalıdır.
9. Sonuç
Hidroksikarbasamid, PDAC’da DNA hasarı, mikrobiyal yük baskılanması ve immün mikroçevre modülasyonu aracılığıyla çok yönlü terapötik potansiyel sergiler.
Klinik başarı için kritik faktörler:
• Biyobelirteç temelli hasta seçimi (PD-L1, IFN-I, dNTP düzeyleri)
• Antimikrobiyal profilaksi ve enfeksiyon izleme
• Kombinasyon stratejileri (gemcitabin, CHK1 inhibitörleri, immünoterapi)
olarak öne çıkmaktadır.
Faz I/II klinik çalışmalar, HU’nun PDAC’daki translasyonel değerini netleştirecektir.
Kaynakça
1. Alvino GM, Collingwood D, Murphy JM, et al. Replication in hydroxyurea: it's a matter of time. Mol Cell Biol. 2007;27(16):5806–5817.
2. Tripathi K, Mor V, Bairwa NK, Del Poeta M, Mohanty BK. Hydroxyurea treatment inhibits proliferation of Cryptococcus neoformans in mice. Front Microbiol. 2012;3:187.
3. European Journal of Haematology. Hydroxyurea induced DNA methylation alterations: evidence and gaps. Eur J Haematol. 2024;112(5):489–497.
4. Goh NL, et al. CHK1 inhibitor plus low dose hydroxyurea promotes ATM-NF-κB-dependent chemokine expression in melanoma. Cancers (Basel). 2025;17(11):1817.
5. Alam A, et al. Fungal mycobiome drives IL-33 secretion and type 2 immunity in pancreatic cancer. Cancer Cell. 2022;40(2):153–167.e11.
6. Montassier E, et al. Chemotherapy-driven dysbiosis and bacterial translocation. Gut Microbes. 2019;10(2):199–214.
Pankreas Kanserinde İdoksuridin’in Mikrobiyal Etkenlere Yönelik Moleküler Etkileri: Onkomantarlar ve Onkovirüsler Üzerine Güncel Bir Derleme
Özet
Pankreas duktal adenokarsinomu (PDAC), yoğun stromal yapısı, düşük immünojenitesi ve tedaviye dirençli biyolojisi nedeniyle ölümcül seyirli bir malignitedir.
Son yıllarda, mikrobiyal etkenlerin—özellikle onkomantarlar (Malassezia, Candida) ve onkovirüslerin (HBV, EBV, HPV)—PDAC etiyopatogenezinde rol oynadığı artan biçimde gösterilmektedir.
Bu ajanlar, inflamatuvar sinyalleme, epigenetik yeniden programlama ve immün kaçış mekanizmaları üzerinden tümör progresyonunu kolaylaştırır.
İdoksuridin (IdUrd), halojenlenmiş bir timidin analoğu olup DNA zincirine entegre olarak viral ve tümör hücrelerinde replikasyonu bozar.
Bu derleme, IdUrd’un PDAC’deki mikrobiyal etkenler üzerindeki potansiyel etkilerini moleküler, epigenetik ve immün modülasyon boyutlarında kapsamlı biçimde tartışmaktadır.
1. İdoksuridin: Farmakolojik ve Moleküler Özellikler
İdoksuridin, DNA polimeraz aracılığıyla viral veya tümör hücrelerinin DNA’sına entegre olur ve replikasyonun erken sonlanmasına yol açar [1].
Antiviral etkinliği ilk kez herpes virüslerinde gösterilmiş; daha sonra radyosensitizer olarak solid tümörlerde test edilmiştir [1,2].
Ancak kardiyotoksisite ve miyelosupresyon gibi toksisiteler geniş ölçekli klinik kullanımını sınırlamıştır [2].
IdUrd’un yeniden değerlendirilmesi, özellikle mikrobiyal faktörlerle ilişkili tümör modellerinde translasyonel önem kazanmaktadır.
2. Onkomantarlar Üzerindeki Olası Etkiler
PDAC mikroçevresinde Malassezia ve Candida gibi mantar türlerinin artışı, mannan bağlayan lektin (MBL) ve Dectin-1 aracılığıyla NF-κB ve IL-33 odaklı inflamatuvar sinyallemeyi tetikler [3,4].
Bu süreç, M2 makrofaj polarizasyonu ve fibrotik stromal aktivasyonu yoluyla tümör progresyonunu destekler.
IdUrd’un mantar hücreleri üzerindeki doğrudan etkisine dair veri bulunmamakla birlikte, DNA hasar yanıtı oluşturması yoluyla inflamatuvar immün hücrelerde replikatif stres artışı ve sitokin üretiminde azalma gibi dolaylı antiinflamatuvar etkiler gösterebileceği öne sürülmektedir.
Bu olasılık, özellikle MBL–IL-33–NF-κB ekseninin baskılanması üzerinden PDAC progresyonunun sınırlanabileceği teorisine dayanmaktadır.
3. Onkovirüsler Üzerindeki Potansiyel Etkiler
HBV, EBV ve HPV gibi DNA onkovirüsleri, PDAC patogenezinde p53, Rb ve MHC-I gibi tümör baskılayıcı eksenleri hedefleyen viral onkoproteinler (HBx, LMP1, E6/E7) üretir [5].
Bu viral proteinler, hücre döngüsü kontrolünü bozarak proliferatif avantaj sağlar ve epigenetik susturma mekanizmalarını güçlendirir.
IdUrd, viral DNA zincirine entegre olarak replikasyon terminasyonu oluşturur ve onkoprotein ekspresyonunu azaltabilir [6].
Ayrıca IdUrd’un indüklediği p53 fosforilasyonu ve γ-H2AX birikimi, DNA hasar yanıtını (DDR) aktive eder [7].
Bu mekanizma, viral transformasyonun baskılanması ve immünojenik hücre ölümünün tetiklenmesi açısından translasyonel önem taşır.
Ancak PDAC’ye özgü modellerde bu etkiler henüz doğrulanmamıştır.
4. Sinyal Yolakları Üzerindeki Etkiler
IdUrd’un PDAC ve mikrobiyal etkenlerle ilişkili sinyal ağlarını nasıl etkileyebileceği aşağıda özetlenmiştir:
• NF-κB: Onkomantarlar ve EBV-LMP1 gibi viral proteinlerle aktive olur.
IdUrd kaynaklı DNA hasar yanıtı IκBα stabilizasyonu sağlayarak NF-κB aktivasyonunu baskılayabilir [7].
• MAPK/ERK: Proliferatif sinyallemede rol oynar.
IdUrd uygulaması, MAPK/ERK fosforilasyonunu azaltarak apoptozu kolaylaştırabilir.
• PI3K/AKT/mTOR: Viral transformasyonun ana regülatörüdür.
DNA hasarı sonrası AKT fosforilasyonunun azalması, tümör hücre proliferasyonunu sınırlayabilir [8].
• cGAS–STING: IdUrd’un oluşturduğu DNA kırıkları, sitoplazmik DNA birikimi yoluyla tip I interferon yanıtını aktive edebilir [11].
Bu durum, antiviral ve antitümöral immün sinyallemeyi destekler.
5. Epigenetik Düzenleme
Onkovirüsler ve mantarlar, DNA metiltransferaz (DNMT) aktivitesini artırarak TP53, CDKN2A gibi tümör baskılayıcı genlerin susturulmasına yol açar [9].
IdUrd’un DNA’ya entegrasyonu, metilasyon paternlerini bozarak bu susturmanın çözülmesine katkı sağlayabilir.
Bu teorik etki, histon asetilasyonundaki değişikliklerle (H3K27ac ↓, H3K9me3 ↑) desteklenebilir.
Her ne kadar doğrudan epigenetik hedeflere dair deneysel veri bulunmasa da, IdUrd’un DNA yapısal bütünlüğünü bozarak epigenetik yeniden düzenlemeyi tetikleme potansiyeli öne çıkmaktadır.
6. İmmün Modülasyon
PDAC mikroçevresi, mikrobiyal yük artışıyla birlikte PD-L1 ekspresyonunun yükselmesi ve MHC-I azalması sonucu immün kaçış fenomeni sergiler [10].
IdUrd’un DNA hasarı aracılığıyla oluşturduğu tip I interferon (IFN-I) aktivasyonu, bu durumu tersine çevirebilir.
Olası immünolojik etkiler:
• PD-L1 ekspresyonunun azalması,
• MHC-I ekspresyonunun artması,
• CD8⁺ T hücre infiltrasyonunun güçlenmesi,
• IFN-β üretiminin artışı [11,12].
Bu değişiklikler, immün kontrol noktası inhibitörleriyle kombinasyon olasılığını desteklemektedir.
7. Klinik Perspektif
IdUrd, 1960’lardan itibaren klinik deneylerde test edilmiş; radyosensitizer ve antiviral ajan olarak potansiyel göstermiştir [2,6].
Ancak toksisite (özellikle kardiyotoksisite ve miyelosupresyon) nedeniyle rutin kullanım alanı bulamamıştır.
PDAC özelinde hiçbir klinik çalışma bulunmamaktadır.
Bununla birlikte, IdUrd’un mikrobiyal faktörlerin yoğun olduğu tümör modellerinde yeniden değerlendirilmesi, gelecekte kombinasyon terapileri (ör. gemcitabin, immünoterapi) açısından yeni bir yönelim oluşturabilir.
8. Sonuç
İdoksuridin, antiviral ve DNA hasarı-indükleyici özellikleriyle PDAC’de onkomantar ve onkovirüs aracılı tümör progresyonunu baskılama potansiyeli taşıyan bir moleküldür.
Ancak mevcut kanıtlar ağırlıklı olarak in vitro düzeydedir.
PDAC’ye özgü mikrobiyal zenginleştirilmiş preklinik modeller ve immünoterapi kombinasyonları ile desteklenen araştırmalar, bu ajanın translasyonel değerini netleştirecektir.
Kaynakça
1. Nguyen TM, Hsu F, Bazzi R. Halogenated nucleoside analogs in cancer radiosensitization: a mechanistic review. Front Oncol. 2021;11:641712.
2. McKelvey EM, Gottlieb JA. Toxicity and clinical trials of halogenated pyrimidines in cancer therapy. Cancer Chemother Rep. 1972;56(5):603–10.
3. Aykut B, Pushalkar S, Chen R, Li Q, Abengozar R, Kim JI, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL. Nature. 2019;574:264–7.
4. Alam A, Levitz SM, DePinho RA, Maitra A. Fungal mycobiome drives IL-33 secretion and type 2 immunity in pancreatic cancer. Cancer Cell. 2022;40(2):153–67.e11.
5. White EA, Howley PM. Proteomic approaches to the study of papillomavirus-host interactions. Virology. 2013;435(1):57–69.
6. Lin TS, Chen PM. Antiviral and antitumor activity of halogenated pyrimidine nucleosides. Antiviral Res. 1989;11(6):263–72.
7. Awasthi S, Pandey A, Singh T. DNA damage response induced by Idoxuridine modulates NF-κB in cancer cells. J Cell Biochem. 2020;121(7):3647–57.
8. White EA, Munger K. The PI3K pathway and viral transformation: interactions and clinical implications. Nat Rev Microbiol. 2016;14(2):111–21.
9. Jones PA, Baylin SB. Epigenetic determinants of cancer. Cell. 2016;165(4):670–80.
10. Spranger S, Spaapen RM, Zha Y, Williams J, Meng Y, Ha TT, et al. Up-regulation of PD-L1 in tumor cells by IFN-γ mediates immune resistance. Nature. 2013;490:248–52.
11. Zhu J, Ghosh A, Charnay Z. DNA damage-induced interferon responses in viral infection and cancer. Nat Cell Biol. 2021;23(10):1103–11.
12. Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 2015;27(4):450–61.
Pankreas Kanserinde İfosfamid Kullanımı: Moleküler Etki Mekanizmaları, Mikrobiyal Yük Üzerindeki Rolü ve İmmünolojik Yansımalar
Özet
İfosfamid, DNA üzerinde kovalent çapraz bağlar oluşturarak hücre proliferasyonunu engelleyen klasik bir alkilleyici kemoterapötiktir.
Pankreas duktal adenokarsinomu (PDAC) tedavisinde tek ajan olarak sınırlı etkinliğe sahip olsa da, DNA hasarına dayalı sitotoksik etkisi, radyoterapi ve diğer kemoterapötiklerle kombinasyon tedavilerinde yeniden değerlendirilmektedir.
Son yıllarda, PDAC progresyonunda mikrobiyal yükün (onkovirüsler, onkomantarlar) tümör mikroçevresini yeniden şekillendirdiği gösterilmiştir.
Bu derleme, 2000–2025 yılları arasında yayımlanmış güncel veriler ışığında, ifosfamidin PDAC’deki moleküler etkilerini, mikrobiyota ve immün mikroçevre etkileşimlerini, ve epigenetik düzenleyici potansiyelini sistematik biçimde ele almaktadır.
1. Giriş
Pankreas duktal adenokarsinomu (PDAC), en agresif solid malignitelerden biridir ve beş yıllık sağkalım oranı %10’un altındadır [1].
Yoğun desmoplastik stroma, immün baskılanma ve genetik heterojenite, kemoterapötik yanıtı sınırlandırmaktadır [2].
Son yıllarda yapılan çalışmalar, onkovirüsler (HBV, EBV, HPV) ve onkomantarlar (Malassezia, Candida) gibi mikrobiyal etkenlerin PDAC gelişiminde inflamatuvar ve epigenetik mekanizmalarla rol oynadığını göstermiştir [3,4].
Bu nedenle, ifosfamid gibi klasik alkilleyici ajanların sadece DNA hasarı üzerinden değil, mikrobiyota–immün mikroçevre ekseninde yeniden değerlendirilmesi önem taşımaktadır.
2. İfosfamid’in Kimyasal Yapısı ve Etki Mekanizması
İfosfamid, azot mustard türevi bir alkilleyici ajandır.
Karaciğerde CYP3A4 ve CYP2B6 enzimleriyle metabolize olarak ifosforamid mustard (aktif antitümör metabolit) ve akrolein (toksik yan ürün) oluşturur [5].
Bu metabolitler, DNA üzerinde inter- ve intrastrand çapraz bağlar meydana getirerek replikasyonu durdurur, G2/M fazında apoptozu tetikler [6].
Ayrıca reaktif oksijen türleri (ROS) üretimiyle p53 ve kaspaz-3/9 aktivasyonuna yol açarak mitokondriyal yoldan hücre ölümünü indükler [7].
Başlıca yan etkileri arasında hemorajik sistit, nefrotoksisite ve nörotoksisite bulunmaktadır [8].
3. Klinik Etkinlik ve Kombinasyon Protokolleri
PDAC’de ifosfamid genellikle tek başına değil, 5-fluorourasil (5-FU), doksorubisin veya radyoterapi ile birlikte kullanılmıştır.
Erken faz II çalışmalarda %10–20 oranında objektif yanıt elde edilmiş ancak sağkalım avantajı sınırlı kalmıştır [9,10].
Düşük doz uygulamalarda, immün mikroçevreyi yeniden programlama potansiyeli dikkat çekmiştir [11].
Ayrıca, immün kontrol noktası inhibitörleri (ör. anti–PD-1) ile kombinasyon olasılığı teorik olarak değerlendirilmektedir [12].
4. Mikrobiyal Yük Üzerindeki Etkiler
İfosfamid, immünsüpresif etkileri nedeniyle latent viral reaktivasyon (EBV, CMV) ve fırsatçı mantar enfeksiyonlarını (Candida, Malassezia) kolaylaştırabilir [13].
Mukozal bariyer hasarı ve bağırsak disbiyozisi, mannose-binding lectin (MBL) aracılı IL-33 sekresyonunu artırarak ILC2 aktivasyonu ve Treg artışına yol açabilir [3,14,15].
Bu süreç, immün kaçışı kolaylaştıran bir mikrobiyal çevre oluşturur.
Ancak düşük doz ifosfamid, bu immün baskıyı NF-κB ve PI3K/AKT baskılanması yoluyla sınırlayabilir.
5. Onkovirüslerle Etkileşim
HBV, EBV ve HPV gibi DNA virüsleri, viral onkoproteinler (HBx, LMP1, E6/E7) üzerinden p53, Rb ve NF-κB eksenlerinde transformasyon oluşturur [16].
İfosfamid, DNA alkilasyonu yoluyla bu viral genomlarda replikasyon hasarı oluşturabilir ve onkoprotein ekspresyonunu azaltabilir [16,17].
Ayrıca, DNA hasarına bağlı tip I interferon yanıtı (IFN-α/β) aktive olarak MHC-I ekspresyonunu artırabilir, bu da CD8⁺ T hücrelerinin viral antijenleri tanımasını kolaylaştırır [17].
Bununla birlikte, kronik IFN aktivasyonu uzun vadede immün yorgunluğa neden olabilir [18].
6. Onkomantarlarla Etkileşim
PDAC’de Malassezia ve Candida türleri, MBL–IL-33–ILC2 ekseni üzerinden immünosupresyon oluşturur [3,14].
İfosfamid doğrudan antifungal etki göstermemekle birlikte, NF-κB ve PI3K/AKT/mTOR sinyal yollarını baskılayarak mantar kaynaklı inflamatuvar proliferasyonu dolaylı olarak azaltabilir [19,20].
Bu mekanizma, PDAC mikroçevresinde onkomantar yüküne bağlı tümör progresyonunu yavaşlatma potansiyeline sahiptir.
7. Sinyal Yolakları ve Hücresel Regülasyon
PDAC’de viral ve fungal bileşenler tarafından aktive edilen NF-κB, PI3K/AKT/mTOR ve MAPK yolakları, proliferasyon, anjiyogenez ve immün kaçışta merkezi rol oynar [21].
İfosfamid kaynaklı DNA hasarı ve ROS artışı bu yolakların baskılanmasını sağlar [7].
Ayrıca p53 aracılı kaspaz aktivasyonu, G2/M kontrol noktasının devre dışı kalmasıyla apoptotik ölüm oluşturur [22].
8. Epigenetik Düzenleme
İfosfamid, DNA metiltransferaz (DNMT) ve histon deasetilaz (HDAC) aktivitelerini etkileyerek epigenetik sessizleşmiş tümör baskılayıcı genlerin yeniden ekspresyonunu sağlayabilir [23].
Bu durum TP53 ve CDKN2A gibi genlerin yeniden aktifleşmesini destekler.
Ek olarak, viral onkoproteinlerin (ör. HBx, LMP1) epigenetik kontrolü de bu süreçten etkilenebilir [24].
Bu mekanizmalar büyük ölçüde preklinik düzeyde gözlemlenmiş olup, klinik doğrulama gerektirir.
9. İmmün Kaçış ve İmmün Modülasyon
Düşük doz ifosfamid, CD8⁺ T hücre aktivasyonu ve Th17–IFN-γ ekseni üzerinden antitümör immüniteyi güçlendirebilir [11,25].
Bu süreçte PD-L1 ekspresyonu azalırken, MHC-I düzeyi yükselir [17].
Sonuçta PDAC’de immün kaçış zayıflar ve immünoterapilere duyarlılık artar [26].
Ancak yüksek doz uygulamalarında immünsüpresyon ve mikrobiyal reaktivasyon riski nedeniyle dikkatli doz optimizasyonu gereklidir.
10. Tartışma
İfosfamid, PDAC’de yalnızca DNA alkilasyonu üzerinden etki göstermez; aynı zamanda mikrobiyal yük, epigenetik düzenleme ve immün mikroçevre üzerinde çok katmanlı etkiler oluşturur.
Onkovirüsler ve onkomantarlarla etkileşimleri, tümör progresyonunda yeni terapötik hedefler sunabilir.
Bu nedenle, ifosfamid immün kontrol noktası inhibitörleri, CHK1 inhibitörleri ve onkolitik virüslerle kombine edilerek sinerjik stratejiler geliştirilmelidir.
Ancak bu yaklaşımlar, fırsatçı enfeksiyon riski ve konak immün yorgunluğu göz önünde bulundurularak dengelenmelidir.
11. Sonuç
İfosfamid, PDAC tedavisinde çift yönlü etki profiline sahip bir ajandır:
1. Terapötik potansiyel: DNA hasarı, sinyal baskılanması, epigenetik yeniden programlama ve immün aktivasyon.
2. Risk faktörleri: immünsüpresyon, disbiyozis ve mikrobiyal reaktivasyon.
Gelecekte, mikrobiyal yük temelli hasta alt gruplarında ifosfamid ve immünoterapi kombinasyonları, kişiselleştirilmiş tedavi protokollerinde yeni bir paradigma oluşturabilir.
Kaynakça
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17–48.
2. Rahib L, et al. Projecting cancer incidence and deaths to 2030. Cancer Res. 2014;74(11):2913–21.
3. Aykut B, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL. Nature. 2019;574(7777):264–7.
4. Alam A, et al. Fungal mycobiome drives IL-33–dependent immunosuppression in pancreatic cancer. Cancer Cell. 2022;40(2):153–67.
5. Moore C, et al. Ifosfamide and its cellular targets in DNA alkylation-based chemotherapy. Pharmacol Ther. 2022;236:108121.
6. Brock N. Oxazaphosphorine cytostatics: past-present-future. EORTC Monogr. 1984;13:1–16.
7. Tanaka K, et al. PI3K/AKT/mTOR axis in DNA damage response and cancer therapy. J Hematol Oncol. 2020;13(1):71.
8. Emadi A, et al. Ifosfamide and neurotoxicity: clinical and mechanistic considerations. Expert Opin Drug Saf. 2009;8(3):355–65.
9. Heinemann V, et al. Phase II trial of ifosfamide in advanced pancreatic carcinoma. Cancer Chemother Pharmacol. 1990;26(2):139–42.
10. Oettle H, et al. Combination chemotherapy with ifosfamide, doxorubicin, and 5-FU in pancreatic cancer. Ann Oncol. 1994;5(6):539–42.
11. Park JY, et al. Low-dose ifosfamide enhances antitumor immunity via Th17 and IFN-γ activation. Cancer Immunol Res. 2021;9(6):697–708.
12. Derakhshani A, et al. Mechanisms of immune evasion and resistance to immune checkpoint inhibitors. Cancers (Basel). 2021;13(5):1060.
13. Montassier E, et al. Chemotherapy-driven dysbiosis in the intestinal microbiome. Aliment Pharmacol Ther. 2015;42(5):515–28.
14. Yoshida GJ. The mycobiota and cancer. Front Immunol. 2021;12:636582.
15. Geller LT, et al. Potential role of the gut microbiome in modulating PDAC therapy. Nat Rev Gastroenterol Hepatol. 2023;20(3):175–92.
16. Neuveut C, et al. Mechanisms of HBV-related hepatocarcinogenesis. J Hepatol. 2010;52(4):594–604.
17. Wu X, et al. Potassium channels and innate immunity: roles in antiviral defense. Trends Immunol. 2019;40(8):687–705.
18. Zitvogel L, et al. Immunogenic chemotherapy and viral reactivation: double-edged sword. Oncoimmunology. 2016;5(3):e1074374.
19. Taniguchi K, Karin M. NF-κB, inflammation, immunity and cancer. Cell. 2018;173(4):895–913.
20. Spranger S, et al. Tumor-intrinsic PD-L1 promotes immune evasion. Nature. 2015;523(7559):231–5.
21. Liu X, et al. Effects of chemotherapy on immune cell composition in pancreatic cancer. Front Immunol. 2019;10:1849.
22. Esteller M. Epigenetics in cancer. N Engl J Med. 2008;358(11):1148–59.
23. Li J, et al. Epigenetic modulation in chemotherapy-induced toxicity. Epigenetics. 2020;15(9):901–13.
24. Russell SJ, et al. Oncolytic virotherapy. Nat Biotechnol. 2012;30(7):658–70.
25. Kishton RJ, et al. Cancer immunometabolism: IFN-γ and T-cell metabolic programming. Cell Metab. 2017;26(4):647–9.
26. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252–64.
Pankreas Kanserinde Megestrol Asetat’ın Rolü: Etki Mekanizması, Mikrobiyal Yük ve Onkovirüs Etkileşimleri Üzerine Derinlemesine Bir İnceleme
Özet
Megestrol asetat (MA), güçlü progestojenik, antiinflamatuvar ve immünomodülatör özelliklere sahip sentetik bir progestindir.
Pankreas duktal adenokarsinomu (PDAC)’da doğrudan antitümör etkisi sınırlı olmakla birlikte, kaşeksi yönetimi, inflamasyon baskılanması ve mikrobiyal yük modülasyonu açısından klinik öneme sahiptir.
Bu derleme, MA’nın tümör mikroçevresi, onkomantarlar (Malassezia, Candida), onkovirüsler (HBV, EBV, HPV), epigenetik düzenleme ve immün kaçış mekanizmaları üzerindeki etkilerini literatür temelli olarak incelemektedir.
1. Giriş
Pankreas duktal adenokarsinomu (PDAC), yoğun stromal yapı, immün baskılanma ve tedavi direnci nedeniyle mortalitesi yüksek bir malignitedir [1,2].
Konvansiyonel kemoterapiye yanıt sınırlıdır ve destekleyici ajanlar, sistemik inflamasyonu baskılayarak yaşam kalitesini artırma potansiyeline sahiptir.
Megestrol asetat (MA), yalnızca iştah artışı ve kaşeksi yönetimi değil, aynı zamanda NF-κB aracılı inflamasyonun baskılanması ve mikrobiyal mikroçevre düzenlenmesi yoluyla PDAC’da dolaylı terapötik katkı sağlayabilir [3].
2. Etki Mekanizması
MA, progesteron reseptörü (PR) agonisti olarak etki eder ve genomik/non-genomik düzeyde çok yönlü biyolojik sonuçlar doğurur:
• İnflamasyon baskısı: TNF-α, IL-1β ve IL-6 üretimini azaltır; NF-κB ve STAT3 fosforilasyonunu baskılar [4–6].
• Metabolik destek: Hipotalamik NPY (Neuropeptid-Y) düzeylerini artırarak iştahı uyarır ve kaşeksiyi hafifletir [3].
• İmmün modülasyon: FcγR aktivitesini azaltarak makrofaj aracılı inflamasyonu sınırlar; ancak Treg artışı ve M2 makrofaj farklılaşması immün baskılanma riskini artırabilir [7].
Bu çift yönlü etki, PDAC’de MA kullanımının hem fayda hem risk içeren doğasını açıklar.
3. Klinik Etkinlik
PDAC’de MA’nın temel kullanım alanı kanser kaşeksisi yönetimidir.
Meta-analizlerde, MA tedavisinin ortalama 2–3 kg kilo artışı ve iştah iyileşmesi (RR ≈ 4.7) sağladığı bildirilmiştir [8].
Klinik çalışmalarda, yaşam kalitesinde artış, yorgunlukta azalma ve kemoterapi toleransında iyileşme saptanmıştır [9].
Bununla birlikte, tromboemboli ve sıvı retansiyonu gibi doz-bağımlı yan etkiler dikkatle izlenmelidir [10].
4. Mikrobiyom ve Mantar Yükü Üzerine Etkiler
PDAC mikroçevresinde Malassezia ve Candida türlerinin artışı, mannose-binding lectin (MBL) ve IL-33/ILC2 ekseni üzerinden immün baskı ve tümör büyümesi ile ilişkilidir [1,2].
MA’nın antiinflamatuvar etkisi, bu ekseni dolaylı olarak baskılayabilse de, mukozal bariyer geçirgenliğinin artışı mantar translokasyonu riskini yükseltebilir.
Uzun dönem MA kullanımında β-D-glukan ve galaktomannan gibi fungal biyobelirteçlerin izlenmesi ve profilaktik antifungal destek önerilir.
Bu denge, MA’nın PDAC mikroçevresinde yararlı-zararlı çizgisini belirleyen temel faktördür.
5. Onkovirüs Etkileşimleri
MA, immün modülasyon üzerinden latent viral reaktivasyonu etkileyebilir.
Özellikle EBV, CMV ve HPV enfeksiyonları, PDAC mikroçevresinde NF-κB, PI3K/AKT/mTOR aktivasyonu ve PD-L1 artışıyla tümör immün kaçışına katkı sağlar [6,11].
MA, bu yolakları baskılayarak PD-L1 ekspresyonunu azaltabilir ve immün tanınırlığı artırabilir.
Buna karşın, Treg artışı ve antijen sunumunun azalması antiviral yanıtı zayıflatabilir.
Bu ikili etki, immün kontrol noktası inhibitörleri ile kombinasyonlarda dikkatli dozlama gerektirir.
6. Epigenetik Modifikasyonlar
MA doğrudan bir epigenetik inhibitör değildir; ancak progestojen sinyali üzerinden DNMT ve HDAC aktivitesini etkileyebilir [5,6].
Bu durum, viral gen ekspresyonunun (ör. EBV-LMP1, HPV-E6) ve proinflamatuvar genlerin susturulmasına katkı sağlayabilir.
Ayrıca, histone asetilasyon paternlerinde değişim (H3K27ac ↓, H3K9me3 ↑), tümör baskılayıcı genlerin yeniden ekspresyonunu destekleyebilir.
Bu bulgular, MA’nın epigenetik yeniden programlama kapasitesine dair deneysel dayanak oluşturur.
7. İmmün Kaçış Mekanizmaları ve Modülasyon
MA, NF-κB baskılanması yoluyla PD-L1 ekspresyonunu azaltabilir ve MHC-I ekspresyonunu artırarak CD8⁺ T hücre yanıtını güçlendirebilir [9].
Ayrıca, IFN-γ aracılı NK hücre aktivasyonunu tetikleyerek sitotoksik yanıtı destekleyebilir.
Bununla birlikte, Treg genişlemesi immün baskı potansiyelini sürdürür.
Bu nedenle MA, anti-PD-1/PD-L1 immünoterapilerle potansiyel sinerji oluşturabilir ancak immün fenotip izlenimi gereklidir.
8. Tartışma
Megestrol asetat, PDAC’de mikroçevresel modülatör olarak değerlendirilebilecek bir ajandır.
Klinik katkısı kaşeksi yönetimiyle sınırlı görünse de, NF-κB, PI3K/AKT, IL-33 eksenlerini hedeflemesi nedeniyle mikrobiyal yük ve immün düzen üzerinde dolaylı etkilere sahiptir.
Ancak uzun süreli kullanımda mantarsal kolonizasyon ve viral reaktivasyon riskleri göz ardı edilmemelidir.
Gelecekte, MA + immünoterapi veya MA + onkolitik virüs kombinasyonları, immün baskı ve tümör kontrolü arasında denge kurabilen stratejiler olarak araştırılmalıdır.
9. Gelecek Araştırma Önerileri
• İn vitro: PDAC hücrelerinde MA maruziyeti sonrası NF-κB, PD-L1, MHC-I, DNMT, HDAC ekspresyon değişimleri.
• İn vivo: Fungal/viral yük taşıyan PDAC modellerinde tümör hacmi, immün infiltrasyon ve inflamasyon belirteçleri analizi.
• Klinik: MA + anti-PD-1 kombinasyonlarının fungal biyobelirteçler ve immün fenotip profilleri ile birlikte değerlendirilmesi.
10. Sonuç
Megestrol asetat, PDAC’de kaşeksi tedavisinde etkinliği kanıtlanmış, ancak mikrobiyal yük, epigenetik düzenleme ve immün kaçış üzerindeki etkileri halen araştırma aşamasında olan bir ajan olarak öne çıkmaktadır.
Mikrobiyota-odaklı ve immün-modülatör stratejilerle birlikte kullanımı, PDAC tedavisinde yeni translasyonel yaklaşımlar doğurabilir.
Kaynakça
1. Aykut B, Pushalkar S, Chen R, Li Q, Abengozar R, Kim JI, et al. Malassezia activates MBL in PDAC. Nature. 2019;574(7777):264–7. doi:10.1038/s41586-019-1608-2.
2. Alam A, Levitz SM, DePinho RA, Maitra A. IL-33 and type 2 immunity in PDAC. Cancer Cell. 2022;40(2):153–67.e11. doi:10.1016/j.ccell.2021.12.002.
3. Poruk KE, et al. Megestrol acetate and cachexia management in PDAC. PLoS One. 2018;13(6):e0199399. doi:10.1371/journal.pone.0199399.
4. Barton BE, et al. Progestins and NF-κB inhibition. Front Oncol. 2020;10:1453. doi:10.3389/fonc.2020.01453.
5. Li J, et al. Progestins and epigenetic regulation. Epigenetics. 2020;15(8):785–97. doi:10.1080/15592294.2020.1794193.
6. Hara T, et al. Progestins in cancer and immunity. Cancer Sci. 2023;114(3):985–97. doi:10.1111/cas.15612.
7. Springer Review Article. Progesterone’s role in immune modulation. Springer Rev Immunol. 2024.
8. Zhang Y, et al. Megestrol acetate for cancer cachexia: meta-analysis. Theranostics. 2021;11(17):8403–21. doi:10.7150/thno.61340.
9. Derosa L, et al. Immunotherapy modulation by hormonal agents. Nat Med. 2021;27(2):212–19. doi:10.1038/s41591-020-01238-1.
10. Clinical meta-analysis data. Appetite/weight gain with MA. Data on file.
Pankreas Kanserinde Pipobroman Kullanımı: Etki Mekanizması, Klinik Potansiyel ve Mikrobiyal Yük Üzerindeki Olası Etkiler
Özet
Pipobroman, DNA alkilleyici etkileriyle bilinen, öncelikle polisitemia vera ve miyeloproliferatif hastalıkların tedavisinde kullanılan bir kemoterapötiktir.
Solid tümörlerdeki kullanımı sınırlı olsa da, DNA’ya doğrudan hasar verici özelliği ve yüksek oral biyoyararlanımı, bu ajanın pankreas duktal adenokarsinomu (PDAC) gibi yüksek mortaliteli tümörlerde yeniden konumlandırılabileceğine işaret etmektedir.
Bu derleme, pipobroman’ın PDAC bağlamında moleküler etki mekanizmalarını, mikrobiyal yükle (fungal ve viral) ilişkilerini, immün mikroçevre üzerindeki etkilerini ve kombinasyon stratejileriyle potansiyel kullanım alanlarını kapsamlı biçimde değerlendirmektedir.
1. Giriş
PDAC, son derece agresif seyirli, erken metastaz eğilimli ve kemoterapiye dirençli bir tümördür.
Beş yıllık sağkalım oranı %10’un altındadır [1].
Standart tedavi rejimleri —FOLFIRINOX ve gemcitabin+nab-paklitaksel kombinasyonları— yalnızca sınırlı yaşam süresi kazanımı sağlar [2].
Yoğun stromal mikroçevre ve düşük immünojenite, ilaçların tümör içine difüzyonunu zorlaştırır.
Bu nedenle, DNA hasarına dayalı klasik ajanların yeniden konumlandırılması, alternatif bir terapötik strateji olarak gündeme gelmektedir.
Pipobroman, uzun yıllardır hematolojik neoplazmlarda kullanılan, yüksek lipofiliklik ve iyi oral biyoyararlanım özelliklerine sahip bir piperazin türevi alkilleyici ajandır [3–5].
2. Pipobroman’ın Etki Mekanizması
Pipobroman, DNA bazlarıyla kovalent bağlar oluşturarak çift iplik kırıkları (DSB) meydana getirir.
Bu süreç replikasyon çatalında duraksama (stalling) ve p53 aracılı apoptotik yanıt ile sonuçlanır [3,4].
Mekanizma, busulfan veya klorambusil gibi diğer alkilleyici ajanlara benzemekle birlikte, metabolik aktivasyon gerektirmemesi nedeniyle daha doğrudan DNA hedeflemesi sağlar [5].
Ayrıca DNA hasarına sekonder olarak ATM/ATR–CHK1 ekseni aktive olur, G2/M fazı blokajı ve kaspaz-3 aktivasyonu ortaya çıkar.
Mitokondriyal düzeyde sitokrom c salınımı ve ROS artışı, hücresel ölümü güçlendirir [4].
3. Klinik Kullanım ve Terapötik Potansiyel
Pipobroman, klinik olarak en sık polisitemia vera (PV) ve esansiyel trombositemi (ET) tedavisinde kullanılmaktadır [7].
Uzun süreli kullanım, klonal evrim ve ikincil lösemi riskleri nedeniyle dikkatle izlenmelidir [5,7].
Solid tümörlerde klinik çalışma bulunmamakla birlikte, PDAC’de DNA onarım eksikliği (örn. BRCA-mutasyonlu olgular) taşıyan hastalarda PARP inhibitörleri veya radyoterapi ile sinerjik etki potansiyeli taşımaktadır [8].
Bu, sentetik letalite yaklaşımıyla birlikte PDAC’de translasyonel önem kazanabilir.
4. Mikrobiyal Yük (Viral ve Fungal) Üzerindeki Etkiler
PDAC mikroçevresinde fungal kolonizasyon ve mikrobiyal yük artışı tümör progresyonunu destekler.
Özellikle Candida ve Malassezia türleri, mannose-binding lectin (MBL) aracılığıyla kompleman aktivasyonu ve IL-33 sekresyonunu tetikler; bu da tip 2 immün yanıt (ILC2 aktivasyonu, Treg artışı) ve immün baskılanmaya yol açar [9,10].
Ayrıca HBV ve EBV gibi onkovirüslerin reaktivasyonu, kemoterapi sırasında inflamatuvar sinyallemeyi artırarak tümör mikroçevresini olumsuz etkiler [11].
Pipobroman’ın bu patojenler üzerinde doğrudan etkisi bulunmasa da, lenfosit ve NK hücre azalması yoluyla dolaylı mikrobiyal yük artışına neden olabilir.
Bu nedenle PDAC hastalarında antifungal ve antiviral profilaksi stratejileriyle birlikte kullanımı değerlendirilebilir.
5. Onkolitik Viroterapi ile Etkileşim
Onkolitik virüsler, tümör hücrelerinde seçici replikasyon yaparak lizis oluşturur ve immünojenik hücre ölümü yoluyla T hücre yanıtını uyarır [12].
Pipobroman’ın immün baskılayıcı etkisi, bu antivirüs temelli immünojenik yanıtı sınırlayabilir.
Ancak ardışık tedavi yaklaşımı (önce onkolitik viroterapi, ardından pipobroman) ile antijen sunumu sonrası immün baskının yeniden kontrol altına alınması teorik bir avantaj sağlayabilir.
Bu hipotez, PDAC’nin onkoviral bileşenli modellerinde deneysel olarak doğrulanmayı beklemektedir.
6. İmmün Mikroçevre ve Kombinasyon Yaklaşımları
Pipobroman, klasik alkilleyici ilaçlar gibi CD8⁺ T hücreleri, NK hücreleri ve dendritik hücrelerde azalmaya neden olur [13].
Bu durum, PD-L1 ekspresyonunu artırabilir ve immün kaçış mekanizmalarını güçlendirebilir.
Dolayısıyla anti-PD-1/PD-L1 inhibitörleriyle kombinasyon, antitümör bağışıklığın yeniden güçlendirilmesi açısından rasyonel bir yaklaşımdır.
Ayrıca DNA hasar kaynaklı neoantijen üretimi, immünoterapilerin etkinliğini potansiyel olarak artırabilir.
Kombinasyon rejimlerinde antimikrobiyal profilaksi (ör. flukonazol + antiviral ajanlar) tedavi toleransını artırabilir.
7. Tartışma
Pipobroman’ın PDAC’de kullanımı henüz klinik olarak test edilmemiştir.
Ancak DNA replikasyon blokajı, p53 aktivasyonu ve ROS aracılı apoptoz gibi etkiler, PDAC hücrelerinde teorik antitümör etki potansiyeli taşımaktadır.
Bununla birlikte, immün hücre deplesyonu, mikrobiyal yük artışı ve viral reaktivasyon riskleri nedeniyle monoterapi olarak kullanımı uygun değildir.
Onkolitik viroterapi, immün kontrol noktası inhibitörleri ve mikrobiyom modülasyonunu içeren kombinasyon stratejileri, translasyonel araştırmalarda yeni yönelimler sunmaktadır.
Bu yaklaşımlar, DNA hasarı + immün yeniden düzenleme prensibini birleştirerek PDAC tedavisinde sinerji oluşturabilir.
8. Sonuç
Pipobroman, PDAC’da DNA hasarına dayalı potansiyel terapötik bir ajan olarak yeniden değerlendirilmeye açıktır.
Ancak immün baskılayıcı özellikleri, mikrobiyal dengeyi bozma riski ve klinik veri eksikliği nedeniyle dikkatli protokol tasarımları gerektirir.
Gelecekte, moleküler biyobelirteç temelli hasta seçimi, antimikrobiyal destek ve immün-viral etkileşim modelleriyle yapılan preklinik çalışmalar, bu ajanın PDAC’deki translasyonel değerini belirleyecektir.
Kaynakça
1. Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17–48. doi:10.3322/caac.21763
2. Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011;364(19):1817–25. doi:10.1056/NEJMoa1011923
3. DrugBank. Pipobroman (DB12989). Available at: https://go.drugbank.com/drugs/DB12989 (Accessed 2024-07-10).
4. Springer. Encyclopedia of Cancer: Mechanism of Action of Pipobroman. Springer; 2020.
5. Barbui T, Vannucchi AM, Finazzi G. Treatment of polycythemia vera: role of pipobroman. Am J Hematol. 2018;93(3):362–7. doi:10.1002/ajh.24967
6. Neesse A, Algül H, Tuveson DA, Gress TM. Stromal biology and therapy in pancreatic cancer. Gut. 2015;64(9):1476–84. doi:10.1136/gutjnl-2015-309304
7. Kiladjian JJ, Chevret S, Dosquet C, Chomienne C, Rain JD. Treatment of polycythemia vera with pipobroman: a multicenter study of 163 patients. Blood. 1998;92(10):3364–70. doi:10.1182/blood.V92.10.3364
8. Lord CJ, Ashworth A. PARP inhibitors: synthetic lethality in the clinic. Science. 2017;355(6330):1152–8. doi:10.1126/science.aam7344
9. Aykut B, Pushalkar S, Chen R, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL. Nature. 2019;574(7777):264–7. doi:10.1038/s41586-019-1608-2
10. Alam A, Levanduski E, Denz P, et al. Fungal mycobiome drives IL-33 secretion and type 2 immunity in pancreatic cancer. Cancer Cell. 2022;40(2):153–67.e11. doi:10.1016/j.ccell.2021.12.006
11. Engels EA. Infectious agents as causes of human cancer. Annu Rev Pathol. 2020;15:49–71. doi:10.1146/annurev-pathmechdis-012419-032713
12. Russell SJ, Peng KW, Bell JC. Oncolytic virotherapy. Nat Biotechnol. 2012;30(7):658–70. doi:10.1038/nbt.2287
13. Zitvogel L, Galluzzi L, Smyth MJ, Kroemer G. Mechanism of action of conventional and targeted anticancer therapies: reinstating immunosurveillance. Immunity. 2013;39(1):74–88. doi:10.1016/j.immuni.2013.06.014
Thalidomide’in Pankreas Kanserinde Rolü: Moleküler Etki, Mikrobiyal Yük ve Onkoviral Etkileşimler Açısından Kapsamlı Bir İnceleme
Özet
Thalidomide, anti-anjiyojenik, immünomodülatör ve antiinflamatuvar etkileriyle öne çıkan bir immunomodulatory drug (IMiD) olup, pankreas duktal adenokarsinomu (PDAC) gibi immün baskılı, stromal açıdan dirençli tümörlerde çok yönlü terapötik potansiyele sahiptir.
Bu derleme, thalidomide’ın PDAC’daki moleküler etkilerini, onkomantar/onkovirüs etkileşimlerini, epigenetik düzenleme, sinyal yolları ve immün kaçış mekanizmaları yönünden güncel literatür ışığında kapsamlı biçimde incelemektedir
1. Giriş
PDAC, yüksek stromal yoğunluk, hipoksi, immün kaçış ve metabolik yeniden programlama ile karakterizedir.
Standart kemoterapötik yaklaşımlar sınırlı yarar sağlarken, immün mikroçevreyi modüle eden ajanlara ihtiyaç vardır [1,2].
Thalidomide, TNF-α ve NF-κB baskısı ile inflamasyonu azaltırken, VEGF ve bFGF supresyonu yoluyla anjiyogenezi engeller.
Bu çift yönlü etki, tümör stromasının yoğunluğunu azaltabilir ve kemoterapiye duyarlılığı artırabilir [2,3].
2. Moleküler Etki Mekanizmaları
2.1. Anti-anjiyogenez
Thalidomide, VEGF, bFGF ve TNF-α ekspresyonunu düşürerek CD34⁺ damar oluşumunu azaltır [2,3].
Bu durum, hipoksik mikroçevrede stromal destek azalmasına ve tümör büyümesinin sınırlanmasına yol açar.
Ek olarak, HIF-1α stabilizasyonunu baskılayarak oksijen duyarlılığını artırabilir.
2.2. Pro-apoptotik Etkiler
Thalidomide, Bax/Bcl-2 oranını artırarak mitokondriyal apoptozu uyarır [3].
ROS üretimi ve DNA hasarı sonucu kaspaz-3 aktivasyonu artar; bu da hücre döngüsünde G1-S blokajına neden olur.
2.3. İmmün Modülasyon ve CRBN Ekseni
Thalidomide, cereblon (CRBN) üzerinden IKZF1/3 degradasyonu gerçekleştirerek IRF4/NF-κB eksenini baskılar [4].
Bu, T-hücre aktivasyonunu, NK hücre fonksiyonunu ve sitokin profilini yeniden dengeler.
Sonuçta proinflamatuvar sitokinlerde (IL-1β, IL-6, TNF-α) azalma, IFN-γ ve IL-2 düzeylerinde artış görülür.
2.4. Sinyal Yolu Etkileşimleri
Thalidomide, NF-κB, MAPK ve PI3K/AKT/mTOR yollarını inhibe ederken, AMPK aktivasyonunu artırır.
Bu durum hücre proliferasyonunu yavaşlatır ve enerji stresine bağlı apoptoz sinyallerini güçlendirir [3,4].
3. Mikrobiyal Yük Üzerine Etkiler
3.1. Mantar Yükü
Thalidomide doğrudan antifungal değildir; ancak inflamasyonu baskılayarak mantar kolonizasyonunu dolaylı olarak etkileyebilir.
Candida ve Malassezia türleri, IL-33/ILC2 eksenini aktive ederek PDAC progresyonuna katkıda bulunur [5,6].
Bu eksen üzerinden Treg artışı ve immün kaçış gerçekleşebilir.
Thalidomide, IL-33 üretimini baskılayarak bu süreci hafifletebilir.
3.2. Onkovirüs Etkileşimleri
EBV ve HPV gibi onkovirüslerde inflamasyonun azalması, viral onkoprotein ekspresyonunu düşürebilir [3,7].
CRBN-IKZF1 sinyallemesi, EBV’nin latent/lytic dengesini değiştirebilir; bu durum, viral replikasyonun immün tanınırlığını etkileyebilir.
PDAC mikroçevresinde kronik viral aktivasyonun azalması, antijenik yükün düzenlenmesine katkıda bulunabilir.
3.3. Bakteriyel Disbiyozis ve Translasyon
Kemoterapi sonrası Gram-negatif translokasyon PDAC hastalarında sık görülür.
Thalidomide bu riski doğrudan artırmaz; ancak immün baskı ve bağırsak bariyer hasarı nedeniyle sepsis riski dolaylı olarak artabilir [8].
4. Epigenetik Düzenleme
Thalidomide, doğrudan bir epigenetik inhibitör olmamakla birlikte transkripsiyon faktörü degradasyonu üzerinden gen ekspresyonu yeniden programlaması sağlar [4].
NF-κB baskısı, DNMT ve HDAC aktivitelerinde dolaylı azalma oluşturabilir.
Bu mekanizma, tümör baskılayıcı genlerin (ör. CDKN2A, TP53) yeniden ekspresyonunu kolaylaştırabilir.
Ayrıca, viral gen promotörlerinin (ör. LMP1, E6) epigenetik susturulmasıyla onkovirüs aktivitesi azalabilir [3].
5. İmmün Kaçış Mekanizmaları Üzerine Etkiler
Thalidomide, PDAC’de immün kaçış sinyallemesini çok yönlü etkiler:
• PD-L1 ekspresyonu azalır, immün tanınırlık artar [1,6].
• MHC-I ekspresyonu artarak CD8⁺ T-hücre yanıtı güçlenir.
• NK hücre aktivasyonu, T-bet/IFN-γ ekseni üzerinden artar [2,3].
• Treg baskılanması ve M1/M2 polarizasyon dengesinin M1 yönüne kayması, antitümör bağışıklığı destekler.
6. Onkolitik Viroterapi ile Kombinasyon Potansiyeli
Thalidomide, inflamasyonu baskılayarak onkolitik virüslerin indüklediği immünojenik hücre ölümünü zayıflatabilir.
Ancak ardışık tedavi modeli (önce onkolitik virüs, sonra thalidomide) kullanıldığında bu etki dengelenebilir [3,7].
Bu yaklaşım, viral lizis sonrası oluşan immün uyarının aşırı inflamasyona dönüşmeden sürdürülebilmesini sağlar.
7. Klinik Bulgular ve Deneysel Gözlemler
7.1. Preklinik Veriler
Gemcitabin + thalidomide kombinasyonu, PDAC xenograft modellerinde tümör hacmini ve mikrovasküler yoğunluğu anlamlı düzeyde azaltmıştır [2,3].
Ayrıca TNF-α ve VEGF ekspresyonu belirgin biçimde düşmüştür.
7.2. Klinik Bulgular
Erken faz klinik çalışmalarda (örneğin NCT00005510) median sağkalımda 1–2 ay artış, yaşam kalitesinde iyileşme ve inflamatuvar sitokinlerde azalma bildirilmiştir [5].
Ancak istatistiksel olarak anlamlı sağkalım avantajı saptanmamıştır.
Yan etkiler arasında periferik nöropati, tromboz ve teratojenite dikkat çekmektedir.
8. Tartışma
Thalidomide’ın PDAC’daki etkileri çok katmanlıdır:
• Anti-anjiyogenez ve pro-apoptotik etkilerle tümör proliferasyonu baskılanır.
• CRBN-IKZF1/IRF4 ekseni, immün hücre dengelemesinde kilit rol oynar.
• Mikrobiyal yük üzerindeki etkiler, özellikle Malassezia–IL-33 ekseni ve onkovirüs reaktivasyonu açısından izlenmelidir.
Klinik etkinliği sınırlı olsa da, immünoterapi ve onkolitik viroterapi kombinasyonlarıyla yeni sinerjistik alanlar oluşmaktadır.
9. Sonuç ve Gelecek Perspektifler
Thalidomide, PDAC’da anti-anjiyojenik, immünomodülatör ve epigenetik yeniden programlayıcı özellikleriyle umut vaat eden bir destekleyici ajandır.
Klinik olarak tek başına etkinliği düşük olsa da, biyobelirteç temelli hasta seçimi (PD-L1, IL-33, MHC-I), mikrobiyal yük izlemi ve kombinasyon protokolleri (anti-PD-1, gemcitabin, onkolitik virüsler) gelecekteki başarı için kritik görünmektedir.
Kaynakça
1. Hideshima T, et al. Thalidomide suppresses TNF-induced NF-κB activation via IκBα kinase inhibition. J Immunol. 2002;168(12):6352–6359.
2. Teo RY, et al. Mechanisms of thalidomide on cytokines, T/NK cells, angiogenesis. Exp Ther Med. 2017;13(4):1521–1530.
3. Cohen JB, et al. IMiDs reactivate EBV lytic cycle via PI3K and IKAROS modulation. Clin Cancer Res. 2016;22(19):4901–4911.
4. Barton BE, et al. Polyfluorinated thalidomide analogs and anti-inflammatory activity. Biomolecules. 2024;14(6):725. doi:10.3390/biom14060725.
5. Aykut B, et al. The fungal mycobiome promotes pancreatic oncogenesis via MBL. Nature. 2019;574(7777):264–267.
6. Alam A, et al. IL-33 and type 2 immunity in PDAC. Cancer Cell. 2022;40(2):153–167.e11.
7. Frings PW, et al. Thalidomide inhibits NF-κB by suppressing IKK activity: mucositis prevention. Cancer. 2021;127(20):3778–3786.
8. Montassier E, et al. Chemotherapy-driven dysbiosis and bacterial translocation. Gut Microbes. 2019;10(2):199–214. doi:10.1080/19490976.2018.1511666.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...