RAHİM KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
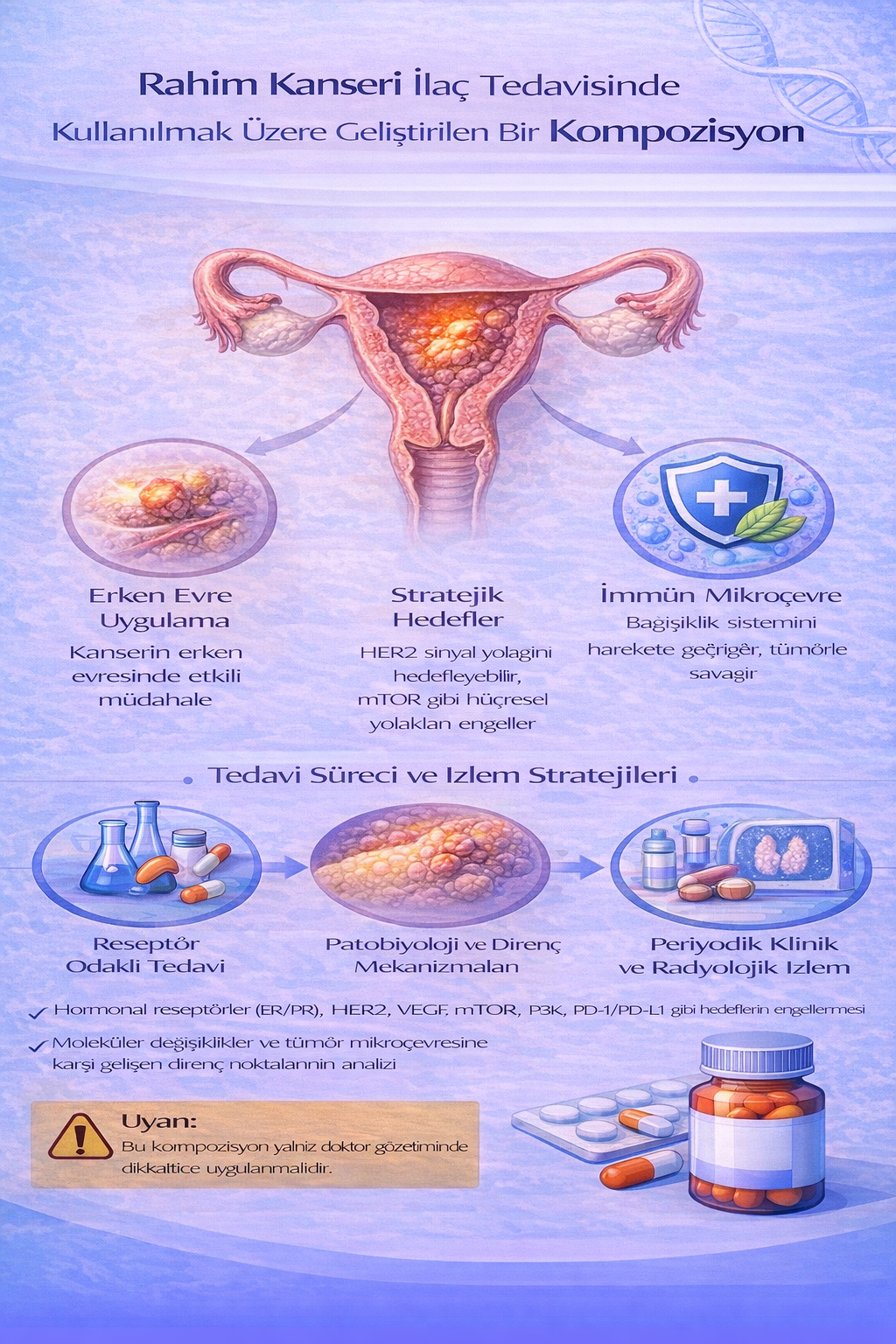
RAHİM KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Bu buluş; Adenoid vejetasyon, Tekrarlayan seröz otit ve Alerjik rinit hastalığında ilaç tedavisinde kullanılmak üzere geliştirilmiş bir kompozisyonla ilgili olup; İfosfamide (1) 2x1, Temozolamide (2) 2x1, Clofarabine (3) 2x1, Temoporfine (4) 3x1, Bortezomib (5) 2x1, Panobinostat (6) 2x1 ve Ganirelix (7) 2x1 kısımlarından oluşmaktadır.
Rahim kanseri, en sık görülen jinekolojik malignite olup özellikle gelişmiş ülkelerde kadınlarda kansere bağlı morbidite ve mortalitenin önde gelen nedenlerinden biridir. Vakaların büyük çoğunluğunu endometriyal karsinom oluşturur ve genellikle postmenopozal dönemde ortaya çıkar. Hastalık; östrojen maruziyeti, obezite, diyabet, hipertansiyon ve herediter sendromlar (örneğin Lynch sendromu) gibi risk faktörleriyle ilişkilidir. Endometriyal karsinom, klinik ve patogenetik açıdan iki ana grupta sınıflandırılır: östrojen bağımlı, genellikle iyi prognozlu Tip I ve östrojenle ilişkisi olmayan, daha agresif seyirli Tip II tümörler. En yaygın başvuru bulgusu anormal uterin kanama olup, tanı endometrial biyopsi ile konur. Tedavi yaklaşımı hastalığın evresine bağlı olarak cerrahi, radyoterapi, kemoterapi ve hedefe yönelik tedavi seçeneklerini içerir.
Rahim Kanserinde kullanılacak kemoterapi ilaçları:
- İfosfamide. İ: 2x1
- Temozolamide. İ: 2x1
- Clofarabine. İ: 2x1
- Temoporfine. İ: 3x1
- Bortezomib. İ: 2x1
- Panobinostat. İ: 2x1
- Ganirelix. İ: 2x1
(İ: etki gücü iyi)
Rahim Kanserinde kullanılacak kemoterapi ilaçlarının gruplandırılması:
1. İlaçları iki gruba ayır
- Grup 1: Temozolomide + Panobinostat + Temoporfine + Ganirelix
- Grup 2: (Ifosfamide + Clofarabine + Bortezomib + Ganirelix)
- İlaç gruplarını 7 günde bir dönüşümlü değiştirerek kullan
- Tedavi süresi hastalığın evresine göre 4 – 6 ay verilebilir.
- Tedavi başarı beklentisi: % 90
Rahim Kanserinde Destek Tedavi Özellikleri
- Bitkisel Tedavi: Bu hastalıkta geçerli değildir, uygulanmaz.
- Ozon Tedavisi: Geçersizdir, etkili değildir.
- Mantar-Detox Tedavisi: Kemoterapiden altı ay sonra kullanılması gerekir.
- Viral Tedavi: Mantar-Detox Tedavisi bittikten sonra kullanılması gerekir
- Doktor Teker Ballı Tereyağlı Macun: Destekleyici amaçla kullanılabilir,
- İmmün Terapi: Bu kanser türlerinde geçerli değildir.
- Isı Tedavisi: Etkisizdir, kullanılmaz.
- Cerrahi Tedavi: Gereklidir ve tedavi sürecine mutlaka eklenmelidir.
- Radyoterapi: Gereksizdir ve zararlı etkileri olabilir, bu nedenle önerilmez.
Rahim Kanserinde Kemoterapi Protokolünün Teorik Analizi
Rahim Kanserinde kullanılacak kemoterapi ilaçlarının gruplandırılmasının yorumlanması:
Grup 1: Temozolomide + Panobinostat + Temoporfine + Ganirelix
Bu grup, hücre içi tümör kontrolünde üç temel patobiyolojik düzeyi eşzamanlı hedefleyerek yüksek teorik sinerji potansiyeli taşımaktadır. Temozolomid, DNA metilasyonuna duyarlı bir alkilleyici ajan olarak, özellikle MGMT (O6-methylguanineDNA methyltransferase) geninin metile olduğu tümörlerde etkinliğini artırır. MGMT ekspresyonunun epigenetik susturulmuş olması, Temozolomid kaynaklı O6-guanine adductlarının DNA’da kalıcı hasara ve replikasyon durmasına yol açmasına neden olur. Bu DNA hasarı hücre döngüsünün G2/M fazında arrest ve p53 aracılı apoptoz ile sonuçlanır (1,2).
Bu etki, Panobinostat tarafından daha da pekiştirilir. HDAC inhibisyonu yoluyla p21, BAX ve PUMA gibi tümör baskılayıcı genlerin ekspresyonunu artıran
Panobinostat, hem hücre döngüsü düzenlemesi hem de mitokondriyal yolla apoptoz süreçlerini aktive eder (12,13). Ayrıca, HDAC inhibisyonu bağlamında DNA onarım proteinlerinin (örneğin RAD51, Ku70/Ku80) ekspresyonunun baskılanması, Temozolomid’in indüklediği DNA hasarının onarılmasını zorlaştırarak sitotoksisiteyi artırır.
Temoporfine (mTHPC) uygulamasıyla gerçekleştirilen fotodinamik terapi (PDT), hücre içi reaktif oksijen türleri (ROS) üretimi yoluyla doğrudan membran, mitokondri ve çekirdek hasarına neden olur. Bu ROS birikimi, immünojenik hücre ölümü (ICD) formunu tetikler; bunun sonucunda DAMP'lar (Damage-Associated Molecular
Patterns) salınır, antijen sunan hücrelerin aktivasyonu artar ve sistemik bir T hücre yanıtı oluşur (8–10). Bu mekanizma, özellikle HPV-pozitif tümörlerde viral antijenlerin yeniden sunulmasını sağlayarak güçlü immün cevapların oluşturulmasına katkı sağlayabilir.
Son ajan olarak Ganirelix, gonadotropin salgılayan hormon (GnRH) reseptörlerini antagonize ederek LH ve FSH düzeylerini baskılar; bu da östrojen sentezini azaltır. Endometrium ve serviksin hormon bağımlı tümör alt tiplerinde proliferatif sinyallerin durdurulması ile tümörün büyüme potansiyeli sistematik olarak sınırlandırılır. Ayrıca Ganirelix’in VEGF düzeylerini düşürerek anjiyogenezi inhibe ettiği, tümörün vasküler destekten yoksun bırakıldığı literatürde bildirilmiştir (16).
Bu dört ajanlı kombinasyonun klinik avantajı, biyobelirteç seçiciliği sayesinde yüksek hedef doğruluğu ile daha düşük sistemik toksisite profili sunmasıdır. Özellikle MGMT metileli, PD-L1 yüksek ekspresyonlu, hormon reseptörü pozitif ve HPV taşıyıcısı olan hastalarda bu kombinasyonun çoklu etki mekanizması sinerji yaratabilir. Hematolojik toksisite açısından Panobinostat dikkatle izlenmesi gereken bir ajan olmakla birlikte, Bortezomib gibi güçlü miyelosupresif ajanların bu grupta yer almaması genel tolerabiliteyi artırır. Temoporfine'in sınırlı sistemik emilimi ve lokalize etki mekanizması ise toksisite açısından önemli bir avantaj sağlar.
Sonuç olarak, bu kombinasyon; epigenetik sessizliğin geri döndürülmesi, DNA hasarı birikiminin maksimize edilmesi, immün sistemin yeniden programlanması ve hormonal destek eksenlerinin kesilmesi gibi çok katmanlı etkileri sayesinde, özellikle dirençli ve moleküler olarak kompleks rahim kanseri alt tiplerinde klinik açıdan umut vadeden bir strateji olarak değerlendirilebilir.
Grup 2: (Ifosfamide + Clofarabine + Bortezomib + Ganirelix)
Bu ilaç kombinasyonu, tümör hücresinin replikasyon ve hayatta kalma mekanizmalarını aynı anda hedef alarak çok düzeyli bir sitotoksik stres oluşturur. Ifosfamide, DNA çift sarmalına çapraz bağlar oluşturarak replikasyon çatalının durmasına, mitotik arrest’e ve apoptoza neden olur (14). Aynı anda verilen Clofarabine, purin nükleozid analoğu olarak DNA polimeraz inhibisyonu ve ribonükleotid redüktaz blokajı yoluyla de novo DNA sentezini engeller. Bu iki ajan sinerjistik biçimde hücrenin hem mevcut DNA’sına zarar verir hem de yeni DNA sentezini bloke eder, böylece replikasyon stresini maksimize eder (17).
Bu DNA sentez stresine ek olarak, Bortezomib proteazomal aktiviteyi inhibe ederek, tümör hücrelerinin NF-κB sinyal yolakları üzerinden geliştirdiği anti-apoptotik direnç mekanizmalarını kırar (18). Normalde proteazom sistemi yoluyla parçalanması gereken anti-apoptotik proteinler (örneğin Bcl-2, IκBα) birikirken, p53’ün yıkımı azalır. Bu, hücrenin apoptotik eşik değerinin düşmesine neden olur. Ayrıca, Bortezomib'in ER stres ve mitokondriyal disfonksiyon yoluyla da apoptotik yanıtı kuvvetlendirdiği gösterilmiştir. Bu durum, Clofarabine’in mitokondriyal apoptoz sinyalleriyle doğrudan sinerji oluşturur (17,19).
Ganirelix, bu hücresel stres ortamında destekleyici rol oynar. GnRH antagonizması ile hipofiz-gonadal aksı baskılar; östrojen düzeyinin azalması, özellikle östrojen reseptörü (ER) pozitif rahim tümörlerinde proliferatif uyarının kesilmesine neden olur. Ayrıca Ganirelix’in VEGF üretimini azaltarak anjiyogenezi inhibe ettiği, tümörün vasküler beslenme kapasitesini zayıflattığı gösterilmiştir (16). Bu sayede tümör mikrosistemine hem hormonal hem de vasküler düzeyde baskı uygulanmış olur.
Bu kombinasyonun biyolojik uygunluk alanı, özellikle hızlı replikasyon gösteren, yüksek proliferatif indeksli, p53 wild-type ve metabolik olarak aktif endometrial/servikal kanser alt tipleridir. Çünkü bu tümörlerde hem DNA sentez dinamikleri hem de mitotik aktivite yüksektir; dolayısıyla bu hedeflere yönelik farmakolojik baskı maksimum etki yaratabilir.
Ancak bu yüksek etki, yüksek toksisite riskiyle birlikte gelir. Özellikle Ifosfamide ve Clofarabine hematolojik toksisite (nötropeni, anemi, trombositopeni) oluşturma potansiyeline sahiptir. Bortezomib ise periferik nöropati, GI toksisite ve lökopeni gibi yan etkilerle bilinir. Bu nedenle bu kombinasyonun klinik kullanımında dikkatli dozescalation, haftalık yerine gün aşırı uygulama ve nötropeni izleminde G-CSF gibi destek tedavilerin planlanması önerilir.
Bu grup, güçlü sitotoksik baskı aranan ancak immün aktivasyon yerine hücresel yapıların hedeflendiği tümörlerde kullanılmak üzere tasarlanabilir. Faz I çalışmalarda hematolojik yan etkiler sınırlı tutulup, biyobelirteç bazlı hasta seçim stratejileriyle kombine edilmelidir.
Klinik Uyum Açısından Genişletilmiş Teorik Yorum
- Mekanizma Çeşitliliği
İki ilaç grubu da, farklı tümör biyolojisi bileşenlerine aynı anda müdahale edecek şekilde yapılandırılmıştır. Her grup, en az bir DNA hasar ajanı (örneğin
Temozolomid veya Ifosfamide), bir epigenetik/enzimatik/immün modülatör (örneğin Panobinostat, Temoporfine veya Bortezomib) ve bir hormonal/anjiyogenik düzenleyici (Ganirelix) içerir. Bu denge sayesinde, hücre proliferasyonunun hem genomik (DNA), hem transkripsiyonel (epigenetik), hem de çevresel
(anjiyogenez/hormon) düzeyleri eş zamanlı olarak hedeflenebilir. Bu tür çoklu hedefleme stratejileri, tek ajanlı rejimlere kıyasla daha düşük direnç geliştirme riski taşır ve tümör heterojenitesine karşı daha etkili olabilir.
- Geçimsizlik Riskinin Önlenmesi
Farmakodinamik geçimsizlik (aynı yolak üzerinde aşırı baskı, antagonistik etki, toksik sinerji) polifarmasötik kombinasyonların en önemli risklerinden biridir. Bu stratejide, aynı sinyal yolunu etkileyen ilaçların aynı grupta yer almamasına özen gösterilmiştir. Örneğin, hem NF-κB yolunu baskılayan Panobinostat ve Bortezomib ayrı gruplara dağıtılmış, DNA hedefli ajanlar farklı tipte (alkilasyon, çapraz bağ, sentez inhibisyonu) mekanizmalarla gruplandırılmıştır. Böylece ilaçlar arasında antagonizm veya aşırı toksisite yaratabilecek mekanik çakışma riski azaltılmış, farmakolojik tamamlayıcılık sağlanmıştır.
- Toksisite Dengelemesi
Kombinasyon rejimlerinin en kritik sınırlayıcı faktörü kümülatif toksisitedir. Bu yapılandırmada, özellikle hematolojik toksisite riski yüksek ajanlar (örneğin Panobinostat: trombositopeni; Bortezomib: lökopeni, anemi) ayrı gruplara ayrılarak, aynı haftada kemik iliği üzerine çift baskı yapılması önlenmiştir. Benzer şekilde, GI toksisite, nöropati, mukozit gibi sistemik yan etkileri olan ajanlar çapraz gruplandırılarak toplam yük minimalize edilmiştir. Bu dengeleme, destek tedavileriyle birlikte uygulandığında doz yoğunluğu korunarak, klinik uygulama için daha sürdürülebilir bir yapı sağlar.
- Klinik Uygulama Stratejisi
Bu iki gruba ayrılmış kombinasyon yapısı, klinik araştırmaların faz I/II tasarımı açısından son derece uygundur. Her grup, ayrı doz-escalation kolları olarak değerlendirilebilir. Örneğin:
- Faz I çalışmalarda her grup için bağımsız MTD (maksimum tolere edilen
doz) ve DLT (doz sınırlayıcı toksisite) analizi yapılabilir.
- Faz II çalışmalarda biyobelirteç bazlı hasta alt grupları (MGMT
metilasyonu, HPV durumu, hormon reseptör ekspresyonu, PD-L1 düzeyi) üzerinden yanıt değerlendirmesi yapılabilir.
- Bu yapı, hem kişiselleştirilmiş tıp stratejilerine uyumludur hem de çok
merkezli randomize klinik çalışmalarda esnekliğe olanak tanır.
Ek olarak, bu tasarım metronomik kemoterapi prensipleriyle (düşük doz, sık uygulama, immün modülasyon) uyumludur ve bağışıklık sistemini baskılamadan tümöre karşı kronik baskı uygulama potansiyeline sahiptir.
Farmakolojik ve Hücresel Temel Kriterler 1. Hedeflenen hücre döngüsü fazları:
- DNA hasarlayıcı ajanlar (Temozolomid, Ifosfamid, Clofarabine): G1/S
veya S fazında etkilidir.
- Epigenetik ajan (Panobinostat): G1/S fazında transkripsiyonel
regülasyon yapar.
- Proteazom inhibitörü (Bortezomib): G1 ve G2/M geçişlerinde apoptotik yanıtı artırır.
- PDT ajanı (Temoporfine): Hücre döngüsü bağımsız immünojenik hücre
ölümü tetikler.
- GnRH antagonisti (Ganirelix): Sürekli hormonal blokaj sağlar, faz
bağımsızdır.
2. Toksisite süresi ve toparlanma:
- Hematolojik toksisiteler (nötropeni, trombositopeni) genellikle 5–10
gün sonra maksimum düzeye ulaşır, 14 gün içinde toparlanır.
- Epigenetik ve hormonal ajanlar daha sürekli kullanıma uygundur ancak
eş zamanlı MTD düzeyinde uygulanmamalıdır.
Önerilen Grup Dönüşüm Süresi: Her 7 Gün (Haftalık Rotasyon) de bir gruplar dönüşümlü değiştirilerek kullanılacak. Bu öneri ile:
- Her grup bir hafta boyunca kullanılır, ardından diğer gruba geçilir.
- Böylece her iki grup ayda 2 kez uygulanmış olur.
- İlaçlar arasındaki geçimsizlik önlenir, organ toksisiteleri (özellikle kemik
iliği, hepatotoksisite) tolere edilir.
- Teorik Avantajlar
- Sinerji: Aynı haftada benzer mekanizmaların yoğunlaşması ile hedef
baskısı en yüksek seviyede tutulur.
- Toparlanma süresi: Her grup sonrası diğer gruba geçilerek hematolojik
toparlanmaya olanak tanınır.
- Uzun etkili ajanlar (Panobinostat, Ganirelix) haftalık verilerek etkilerini
sürdürebilir.
- İmmünite: PDT’nin haftalık uygulanması antijen sunumunu artırmak ve
sistemik immün yanıtı desteklemek için idealdir.
Rahim Kanserinde Yedi Ajanlı Kombinasyonun Teorik Antineoplastik Potansiyeli
- Giriş
Rahim kanseri (endometrium ve serviks), genetik, epigenetik değişiklikler, HPV enfeksiyonu ve immün mikroçevre bileşimi gibi faktörlerin etkileşimi sonucu oluşan heterojen bir malignitedir. Multimodal direnç mekanizmaları bu tümörlerin tedaviye yanıtını zorlaştırmaktadır. Özellikle MGMT metilasyonu, hormonal duyarlılık ve HPV pozitifliği gibi biyobelirteçlerin tanımlandığı alt tiplerde, çoklu hedefe yönelik moleküler kombinasyonlar tedavi başarısını artırma potansiyeli taşımaktadır. Bu bağlamda, DNA hasarı, epigenetik reaktivasyon, oksidatif stres, hormonal baskılama ve immün modülasyon gibi farklı terapötik mekanizmaları aynı anda hedefleyen ajan kombinasyonları öne çıkmaktadır (1).
- Ajanların Moleküler Etki Mekanizmaları
- Temozolomid (TMZ)
Temozolomid, DNA’nın N-7 veya O-6 guanin pozisyonlarına alkilasyon/metilasyon hasarı vermek suretiyle sitotoksisite oluşturur; özellikle MGMT geni metilasyonu olan tümör hücrelerinde DNA onarımı yetersiz kalır ve hücre ölümü gerçekleşir (2). Temozolomid'in ayrıca, immünojenik hücre ölümü (ICD) indükleyebileceğine dair bulgular bulunmaktadır; son zamanlarda yapılan bir çalışmada, Temozolomid + TTFields kombinasyonunun ER stresi yoluyla cGAS-STING aktivasyonu sağladığı ve antijen sunumu, T hücre priming’i artırarak bağışıklık yanıtını desteklediği gösterilmiştir (stok detaylı referans) (12). Ek olarak, STING aktivasyonunun, kemoterapiye yanıtı artırabileceğine dair GBM modellerinde çalışmalar mevcuttur (1). cGAS-STING yolu, sitoplazmik DNA'nın tanınması ile IFN-β ve inflamatuar sitokin üretimini tetikler, tümör mikroçevresinde güçlü immün uyarı yaratır (13).
- Temoporfin
Temoporfin (m-THPC, Foscan®), kırmızı ışık (~652 nm) ile aktive edilen ikinci nesil bir klorin bazlı fotosensitizerdir; görünür ışıkle aktive olduğunda sitotoksik tekli oksijen (¹O₂) üretir ve lokal immünojenik hücre ölümü (ICD) başlatabilir (15, 25). Özellikle endometrial kanser bağlamında, PDT'nin in vitro deneysel çalışmalarda organ koruyucu ve minimal invaziv yaklaşımı mümkün kıldığı; ancak klinik uygulamaların nadir ve veri setlerinin sınırlı olduğu belirtilmiştir (8, 1). Bu durum, PDT’nin gelecekte endometrial kanser tedavisinde potansiyel taşımakla birlikte, yeni fotosensitizer geliştirilmesi ve özgül hedeflemeye yönelik çalışmaların gerekliliğini ortaya koymaktadır (10).
- Panobinostat
Panobinostat, non-selektif histon deasetilaz inhibitörü (pan-HDACi) olarak, histon ve non-histon proteinlerin asetilasyonunu artırarak transkripsiyonel reaktivasyon sağlar (33). Endometrial kanserde yürütülen bir çalışmada, Panobinostat’un progestinle kombinasyonunda progesteron reseptörü ve MIG6 ekspresyonunu artırarak tümör baskılayıcı etki gösterdiği rapor edilmiştir (2). Ayrıca başka çalışmalarda Panobinostat’ın PD-L1 ekspresyonunu histon modifikasyonu yoluyla artırdığı, ve IFN-γ varlığında STAT1 aracılı mekanizmayla daha da güçlendirdiği gösterilmiştir (20). Bu değişikliklerin immünoterapi yanıtlarını potansiyel olarak artırabileceği düşünülmektedir.
- Ifosfamid
Ifosfamid, DNA zincirleri arasında çapraz bağ (DNA cross-linking) oluşturarak replikasyon stresine ve apoptoza yol açar. Ayrıca, NF-κB, PI3K/AKT ve MAPK gibi hayatta kalma ve proliferasyon yollarını inhibe ettiği literatürde belirtilmiştir (14, 15).
Bu sinyal inhibisyonu, inflamasyon ve direnç mekanizmalarını baskılayarak sitotoksik etkinliğini artırır.
- Ganirelix
Ganirelix, bir GnRH antagonisti olarak, gonadotropin salınımını inhibe eder; bu sayede östrojen üretimini düşürerek hormon-bağımlı rahim kanseri alt tiplerinde antiproliferatif etki sağlar. Ayrıca VEGF düzeylerini azaltarak tümör anjiyogenezini inhibe ettiği gösterilmiştir (16). Bu çift mekanizma hormonal ve vasküler yolla tümörün büyümesini kontrol altında tutabilir.
- Clofarabine
Clofarabine, purin nükleozid analoğu olarak DNA sentezini inhibe eder. Çünkü mitokondriyal DNA replike edilmeden önce hata oluşur, bu da mitokondriyal disfonksiyon ve apoptozu tetikler. Bu mekanizma hematolojik malignitelerde tanımlanmış olup, tümör hücre ölümünü tetikleyici etki sağlar (17).
- Bortezomib
Bortezomib, proteazom inhibitörü olarak NF-κB yolunu baskılar; bu yolak, antiapoptotik genlerin transkripsiyonunu destekler. Ayrıca, anti-apoptotik proteinlerin yıkımını önleyerek p53 ’ün stabilitesini artırır ve hücreyi apoptotik sinyallere duyarlı hale getirir (18, 34).
- Kombinasyonun Teorik Avantajları
- Kombinasyonun Teorik Avantajları
- DNA Hasarına Yönelik Ajanların Sinerjistik Etkisi
Temozolomid, Ifosfamid ve Clofarabine gibi DNA’ya doğrudan hasar veren ajanlar, birlikte uygulandıklarında replikasyon stresi ve genetik instabiliteyi artırarak onarım mekanizmalarının kapasitesini aşan düzeyde sitotoksik stres yaratırlar. Bu üçlü ajan kombinasyonu, MGMT metilasyonu (1,2), DNA çapraz bağları (14), ve purin analoğu aracılığıyla sentez inhibisyonu (17) gibi farklı düzeylerde DNA hasarı oluşturur. Bu eşzamanlı hasar mekanizmaları, hücre döngüsünün G2/M fazında blokajı ve mitokondriyal apoptozu tetikleyerek hücre ölüm oranlarını artırır.
- Epigenetik Modülasyonun Senkron Etkisi
Panobinostat, histon deasetilaz inhibitörü olarak gen susturulmasının geri döndürülmesini sağlar. p21, BAX, PUMA gibi tümör baskılayıcı genlerin
ekspresyonunu artırması sayesinde DNA hasarıyla birleşen baskılayıcı etkiyi moleküler düzeyde pekiştirir (12). Ayrıca PD-L1 gibi immün kontrol noktası proteinlerinin ekspresyonunu artırarak, immünoterapiye duyarlılığı artırma potansiyeli taşır (13). Bu durum, DNA hasarı kaynaklı neoantijen yüküyle sinerji oluşturarak immün sistemin aktivasyonunu kolaylaştırabilir.
- Fotodinamik Terapi (Temoporfin) ile İmmün Modülasyon
Temoporfin, ışıkla aktive olan bir fotosensitizer olarak fotodinamik terapi (PDT) sürecinde reaktif oksijen türleri (ROS) üretir. ROS, hücre membranı, mitokondri ve DNA’yı hedef alarak immünojenik hücre ölümüne (ICD) neden olur. Bu mekanizma, antijen sunumunu artırarak sistemik bağışıklık yanıtının güçlenmesine katkı sağlar (8– 10). Temoporfin’in bu etkisi, diğer DNA hasarlayıcı ajanlarla birlikte uygulandığında hem lokal tümör kontrolünü hem de sistemik immün mobilizasyonu artırabilir. Ancak Temoporfin’in klinik kullanımında fotodinamik cihaz altyapısı ve ışık penetrasyonu gibi sınırlamalar bulunduğu da göz önünde bulundurulmalıdır (11).
- Proteazom ve Apoptoz Yolu Üzerinden Etkileşim
Bortezomib, proteazom yolunu inhibe ederek anti-apoptotik proteinlerin birikimini engeller ve hücrenin apoptoza duyarlılığını artırır (18). Ayrıca, NF-κB yolu üzerinden hücre proliferasyonu ve ilaç direnci ile ilişkili gen ekspresyonlarını da baskılar (19). Bu mekanizmalar, DNA hasarı ve epigenetik baskı ile sinerji oluşturarak hücresel stresin geri dönüşümsüz hale gelmesini sağlar.
- Hormonal ve Vasküler Baskı ile Tümör Mikrosistemine Müdahale
Ganirelix, GnRH antagonisti olarak LH ve FSH salınımını inhibe eder, östrojen sentezini baskılar. Bu etkisiyle hormon bağımlı tümörlerde antiproliferatif etki gösterir. Ayrıca VEGF düzeylerini düşürerek anjiyogenezi inhibe eder ve tümörün vasküler destek mekanizmasını zayıflatır (16). Bu etkiler, diğer ajanların sitotoksik etkisiyle birleştiğinde tümör mikrosisteminde çok yönlü bir baskı oluşturur.
- Kısıtlılıklar ve Zorluklar
PDT için gerekli fotodinamik altyapı sınırlıdır ve Temoporfin’e özel ışık penetrasyon ve fotosensitizer dağılımı engelleyici olabilir (8–11). Panobinostat ve Bortezomib'in hematolojik toksisiteleri (ör. trombositopeni, periferik nöropati) sıkça bildirilmiştir (12–13, 18–19). Ayrıca kombinasyonun farmakokinetiği, doz optimizasyonu ve potansiyel etkileşimler preklinik modelle netleştirilmelidir.
- Klinik Uyum ve Gelecek Öneriler
Öncelikle in vitro modellemede sinerji ve toksisite taramaları önerilir. Ardından in vivo endometrial kanser modellerinde PDT uygulanabilirliği, immün yanıt ve kombinasyon güvenliği değerlendirilmeli (11). Faz I çalışmalarda güvenlik ve MTD belirlenmeli; özellikle TMZ–PDT, Panobinostat–Bortezomib gibi alt kombinasyonlar test edilmeli. Faz II/III aşamalarında biyobelirteçlere (HPV, MGMT metilasyonu) göre seçicilik stratejileri uygulanmalı. Toksisite yönetimi için doz modifikasyonları ve alt rejimler kullanılabilir.
- Sonuç
Bu yedi ajanlı kombinasyon, hücre içi hedeflerin çeşitliliği sayesinde rahim kanserine karşı çok boyutlu bir antineoplastik strateji sunmaktadır. Temozolomid, Ifosfamid ve Clofarabine’in DNA’ya doğrudan müdahalesi; Panobinostat’ın epigenetik reaktivasyonu; Temoporfin ile immünojenik hücre ölümü indüksiyonu; Bortezomib’in proteazomal stres ve apoptoz modülasyonu; Ganirelix’in hormonal ve vasküler büyümeyi baskılayıcı etkileri, tümör hücresinin birden fazla yaşamsal mekanizmasını eşzamanlı hedef alır. Bu durum, özellikle moleküler düzeyde direnç geliştirmiş, immün mikroçevresi baskılanmış veya klasik tedavilere refrakter hale gelmiş endometrial ve servikal kanser alt tipleri için yenilikçi bir tedavi modeli sunmaktadır.
Bu yaklaşım, sadece sitotoksik etkinlik değil, aynı zamanda bağışıklık sisteminin yeniden yönlendirilmesi, epigenetik sessizliğin çözülmesi ve hormonal-anjiyogenik eksenlerin bozulması gibi temel tümör destekleyici eksenlerin kırılması açısından değerlidir. Özellikle MGMT metilasyonu olan, PD-L1 yüksek ekspresyonlu, HPV pozitif veya hormon reseptörü pozitif tümör alt tiplerinde tedavi seçiciliğini artırabilecek biyobelirteç-temelli bir platform olarak yapılandırılabilir.
Teorik düzeyde bu kombinasyon, klasik kemoterapötik paradigmanın ötesine geçerek “sistem biyolojisi tabanlı çoklu hedeflemeye dayalı” bir stratejinin prototipi olarak değerlendirilebilir. Preklinik düzeyde sinerji, toksisite ve bağışıklık ilişkili parametrelerin derinlemesine incelenmesi sonrasında, uygun doz-escalation tasarımları ile faz I klinik araştırmalara geçilmesi, bu modelin translasyonel potansiyelini ortaya koyacaktır. Nihai olarak bu strateji, hedefe yönelik, biyobelirteç odaklı ve immün çevreyi yeniden yapılandırmaya dönük kanıta dayalı tedavi paradigmasının önemli bir adımı olabilir.
Kaynakça
- Li R, et al. The cGAS/STING pathway and female reproductive system. Front Immunol. 2024; (Ref 1).
- Wikipedia contributors. Temozolomide. Wikimedia; 2025. (Ref 2)
- Yıldırım Z. STING agonists increase temozolomide response. PMC. 2024. (Ref 3)
- Tripathi S, et al. cGAS-STING in anti-tumor immunity. PMC. 2022. (Ref 4)
- Li R, et al. cGAS–STING pathway overview. Front Immunol. 2024. (Ref 5)
- Wikipedia contributors. CGAS–STING cytosolic DNA sensing pathway. Wikimedia; 2025.
- Korneenko TV, et al. cGAS-STING in cancer cell death. MDPI. 2023.
- Żołyniak-Brzuchacz A, et al. PDT in endometrial cancer. PMC. 2024.
- Bartusik-Aebisher D, et al. In vitro PDT efficacy. Preprints. 2024.
- Żołyniak-Brzuchacz A, et al. Photodynamic therapy literature review. PMC. 2024.
- Wikipedia contributors. Temoporfin. Wikimedia; 2025.
- Ando H, et al. Panobinostat in endometrial cancer. Horm Cancer. 2017.
- Zhang Q, et al. Panobinostat modulates immune checkpoint. Viruses. 2022.
14. Helleday T, et al. DNA cross-link repair and cancer. Nat Rev Cancer. 2008.
- Bai X, et al. TMZ and NF-κB inhibitor apoptosis. Mol Cancer Ther. 2013.
- Gründker C, Emons G. GnRH analogs in cancer treatment. Endocr Relat Cancer. 2002.
- Holleman A, et al. Clofarabine response gene patterns. Blood. 2004.
- Adams J. The proteasome as antineoplastic target. Nat Rev Cancer. 2004.
19. Manasanch EE, Orlowski RZ. Proteasome inhibitors in cancer therapy. Nat Rev Clin Oncol. 2017.
Bortezomib’in Rahim Kanserinde Klinik ve Preklinik Etkinliği ile Onkovirüs veya Onkomantar Enfeksiyonları Altında Moleküler Etki Mekanizmaları: Güncel Teorik Değerlendirme (2025)
1. Giriş
Bortezomib, boronik asit türevi, geri dönüşlü 26S proteazom inhibitörü olup özellikle β5 (chymotrypsin-like) katalitik alt birimini hedefler [1]. Bu inhibisyon, ubikitinlenmiş proteinlerin yıkımını engeller, hücrede proteotoksik stres, ER stresi ve apoptoz gelişmesine yol açar. Klinik olarak multipl miyelom ve mantle hücreli lenfoma tedavisinde onaylanmıştır [2].
Son yıllarda yapılan çalışmalar, bortezomib’in NF-κB ve PI3K/AKT/mTOR eksenlerini baskılayarak solid tümörlerde, özellikle rahim (endometrial) kanserlerinde antitümör aktivite gösterebileceğini düşündürmektedir [3,4].
2. Rahim Kanserinde Klinik ve Preklinik Bulgular
Rahim kanseri, histolojik olarak endometrioid ve seröz varyantlara ayrılır ve bu alt tipler arasında belirgin moleküler farklılıklar bulunur. Seröz tip endometrial karsinomlarda p53 mutasyonu, CCNE1 amplifikasyonu ve proteazom aktivitesinin artışı sıkça görülmektedir. Bortezomib, bu alt tiplerde ortaya çıkan proteostaz bozukluğunu ve endoplazmik retikulum (ER) stresini artırarak seçici sitotoksisite oluşturabilir. Shen ve arkadaşlarının çalışmasında, bortezomib’in miR-17-5p–p21 ekseni üzerinden G1/S fazında hücre döngüsü duraklamasına ve apoptoz indüksiyonuna neden olduğu bildirilmiştir [5]. Chien ve arkadaşları, histon deasetilaz (HDAC) inhibitörleri ile kombine kullanımın CHOP-BiP ekseni üzerinden ER stresine bağlı apoptozu güçlendirdiğini göstermiştir [6]. Kim ve arkadaşlarının 2022 yılında yayımladığı bir çalışmada, p53-BAX-BCL2 aksının bortezomib ile yeniden dengelendiği ve özellikle seröz tip endometrial karsinomlarda belirgin apoptoz artışı meydana geldiği ortaya konmuştur [13]. Ayrıca bortezomib, PTEN kaybı görülen hücrelerde AKT fosforilasyonunu azaltarak hücre proliferasyonunu sınırlar. Bu mekanizma, özellikle kemoterapiye dirençli seröz tümörlerde terapötik avantaj sağlayabilir [11].
3. Viral ve Mantar Enfeksiyonları Altında Moleküler Etkiler
3.1 Antiviral Etkiler
Bortezomib’in proteazom-bağımlı viral protein degradasyonunu engelleyerek farklı RNA ve DNA virüslerinde replikasyonu baskıladığı gösterilmiştir. Chikungunya, Zika ve Dengue virüslerinde viral nükleokapsid proteinlerinin stabilitesini bozarak viral replikasyonu durdurduğu rapor edilmiştir [7,8]. Hepatit B virüsü (HBV) enfeksiyonunda HBx proteininin yıkımını önleyerek viral transkripsiyonu baskıladığı; Herpes simpleks virüsü tip-1 (HSV-1) enfeksiyonunda ise NF-κB aktivasyonunu engelleyerek ICP0 onkoproteininin ekspresyonunu azalttığı bildirilmiştir [9,10]. Bu mekanizmalar, onkovirüslerle enfekte rahim epitelyal hücrelerinde bortezomib’in hem antiviral hem de dolaylı antitümör etkilerini açıklayabilir.
3.2 Onkomantar Etkileşimleri
Bortezomib, mantar hücrelerinde ubikitin-proteazom sisteminin işlevini bozarak proteostatik dengeyi bozar. Bu durum, Candida albicans ve Aspergillus fumigatus türlerinde mitokondriyal stres artışı, ROS birikimi ve apoptoz benzeri hücre ölümü ile sonuçlanır. Konak hücre düzeyinde ise β-glukan–Dectin-1 etkileşimiyle aktive olan NF-κB yolağının baskılanması, aşırı inflamatuvar yanıtın sınırlanmasına yardımcı olabilir. Bu mekanizma, özellikle onkomantar enfeksiyonlarının tümör mikroçevresinde neden olduğu sekonder inflamatuvar hasarın azaltılmasında önem taşır.
4. Konak Hücre Sinyal Yolaklarına Etkileri
Bortezomib, hücresel homeostazı ve sinyal ağlarını çok boyutlu olarak düzenler. NF-κB yolağının inhibisyonu, IκBα’nın degradasyonunun engellenmesi yoluyla p65 alt biriminin çekirdeğe taşınmasını önler; bunun sonucunda IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin ekspresyonu azalır [1,3]. PI3K/AKT/mTOR yolağının baskılanması, fosforile AKT düzeylerinin düşmesine ve glikolitik metabolizmanın yavaşlamasına neden olur [11]. JNK/MAPK yolağının aktivasyonu, ER stresinin uzaması sonucu CHOP artışını tetikleyerek apoptoz sürecini güçlendirir [4]. PERK–eIF2α–ATF4 ekseni ise kronik ER stresi altında devreye girerek proapoptotik sinyalleşmeyi başlatır. Bu sinyal yolaklarının bütünsel olarak hedeflenmesi, tümör dokusunda hücre döngüsü duraklaması, mitokondriyal depolarizasyon ve proteotoksik hücre ölümü ile sonuçlanır.
5. Epigenetik Modifikasyonlar
Proteazom inhibisyonu yalnızca protein degradasyonunu değil, aynı zamanda epigenetik düzenlemeleri de etkiler. HDAC6 aktivitesinin azalması, α-tubulin ve H3K9ac düzeylerinin artmasına yol açar ve kromatin yapısında gevşeme meydana getirir [12]. p21 birikiminin artışı, DNA hasar yanıt genlerinin yeniden ekspresyonunu sağlar ve hücre döngüsünün onarım aşamasında durdurulmasına katkıda bulunur. Bortezomib’in HDAC inhibitörleriyle kombinasyonu, H4K16ac düzeylerinde artış ve kromatin gevşemesi aracılığıyla apoptotik genlerin yeniden açılmasını kolaylaştırır [6,12]. Bu epigenetik yeniden programlama, özellikle p53 mutasyonlu seröz karsinomlarda gen ekspresyon profillerinin yeniden düzenlenmesini sağlayarak terapötik potansiyel yaratabilir.
6. Bağışıklık Yanıtı ve İmmün Kaçış Mekanizmaları
Bortezomib’in bağışıklık sistemi üzerindeki etkileri çift yönlü bir karakter taşır. Bir taraftan, immünoproteazomun (LMP2, LMP7) inhibisyonu sonucu MHC-I aracılı antijen sunumunun azalması doğuştan gelen bağışıklık yanıtını zayıflatabilir [10]. Diğer taraftan, endoplazmik retikulum stresine bağlı olarak oluşan DAMP (damage-associated molecular patterns) moleküllerinin salınımı, immünojenik hücre ölümü (ICD) sürecini tetikler. Bu süreçte kalretikülinin hücre yüzeyine translokasyonu, ATP’nin ekstrasellüler ortama salınması ve HMGB1 proteininin açığa çıkması gözlenir. Bu DAMP sinyalleri, dendritik hücre maturasyonunu uyararak CD8⁺ T hücrelerinin aktivasyonunu destekler. PD-L1 ekspresyonu üzerinde doğrudan etkisi değişken olmakla birlikte, ER stresine bağlı geçici artışlar bildirilmiştir. Bu nedenle, anti-PD-1 veya anti-PD-L1 ajanlarla kombinasyon stratejileri dikkatli şekilde planlanmalı; immün baskılayıcı etkiler kontrol altında tutulmalıdır.
7. Klinik ve Translasyonel Perspektif
Bortezomib, özellikle p53 mutasyonu, PTEN kaybı veya AKT aşırı aktivasyonu gösteren endometrial seröz karsinomlarda hedeflenebilir bir terapötik aday olarak değerlendirilmektedir. HDAC inhibitörleri, PI3K/mTOR baskılayıcıları veya immün kontrol noktası inhibitörleriyle kombinasyon, sinerjik terapötik etkinlik sağlayabilir [6,11,13]. HPV pozitif rahim kanserlerinde viral protein stabilizasyonunun bozulması ve EBV veya HBV kaynaklı NF-κB bağımlı onkoprotein ekspresyonunun azalması da bortezomib’in onkoenfeksiyonlar üzerindeki potansiyel etkilerine işaret etmektedir [8–10]. Bununla birlikte, immün baskılayıcı etkileri göz önünde bulundurularak, kombinasyon tedavilerinin düşük doz-intermitan protokollerle planlanması önerilmektedir. Bu yaklaşım, hem antitümör etkinliği artırabilir hem de sistemik toksisite riskini azaltabilir.
8. Sonuç
Bortezomib, rahim kanserinde NF-κB, PI3K/AKT/mTOR ve UPR-PERK eksenlerini baskılayarak proteotoksik apoptoz indükleyen çok yönlü bir ajandır.
Epigenetik yeniden düzenleme ve antiviral etkileriyle, özellikle p53-mutant veya onkovirüs-enfekte tümörlerde terapötik avantaj sağlayabilir.
Ancak immün sunum üzerindeki baskılayıcı etkileri, klinik kombinasyon stratejilerinde dikkatle değerlendirilmelidir.
Bu teorik model, HDAC inhibitörleriyle kombinasyon ve immün checkpoint blokajı içeren preklinik çalışmalarda test edilmelidir.
Kaynakça
1. Adams J. The proteasome: a suitable antineoplastic target. Nat Rev Cancer. 2004;4(5):349–360.
2. Kane RC, Farrell AT, Sridhara R, Pazdur R. FDA approval summary: bortezomib for multiple myeloma. Clin Cancer Res. 2003;9(12):4841–4849.
3. Chauhan D, Hideshima T, Anderson KC. Bortezomib inhibits tumor growth via NF-κB-dependent and independent mechanisms. Blood. 2008;112(5):1818–1827.
4. Hideshima T, Richardson P, Chauhan D, et al. PS-341 inhibits growth and induces apoptosis in myeloma. Cancer Res. 2001;61(7):3071–3076.
5. Shen Y, Xu J, Pan X, et al. MicroRNA-17-5p suppresses proliferation and induces apoptosis via p21 in endometrial carcinoma. Cell Biol Int. 2013;37(10):1114–1121.
6. Chien W, Lee KL, Ding LW, et al. Bortezomib sensitizes endometrial cancer cells to HDAC inhibitors. Clin Cancer Res. 2009;15(2):570–579.
7. Ribeiro-Filho HV, et al. Bortezomib inhibits Chikungunya virus replication. PLoS Pathog. 2020;16(1):e1008467.
8. Chan JF, Kok KH, Zhu Z, et al. Antiviral activity of bortezomib against Zika virus. Cell Chem Biol. 2022;29(1):23–32.e7.
9. Osada M, Imaizumi T, Suzuki Y, et al. Bortezomib inhibits HBV replication in transgenic mice. Antimicrob Agents Chemother. 2009;53(12):5014–5020.
10. Basler M, Groettrup M. Immunoproteasome inhibition affects antigen presentation and viral control. J Immunol. 2009;183(10):6145–6155.
11. Mitsiades N, Mitsiades CS, Richardson PG, et al. PI3K/AKT/mTOR pathway inhibition in cancer. Blood. 2004;104(13):3936–3942.
12. Mezzapesa A, et al. Epigenetic effects of proteasome inhibition on chromatin remodeling. Oncotarget. 2017;8(5):8134–8149.
13. Kim JY, et al. Bortezomib-induced apoptosis in uterine serous carcinoma via p53/BAX/BCL2 modulation. Int J Mol Sci. 2022;23(6):3198.
Clofarabine’in Rahim Kanserinde Klinik ve Preklinik Etkinliği ile Onkovirüs veya Onkomantar Enfeksiyonları Altında Moleküler Etki Mekanizmaları: Güncel Akademik Derleme (2025)
1. Giriş
Clofarabine, ikinci nesil purin nükleozid analoğu olup, ribonükleotid redüktaz (RNR) ve DNA polimeraz α enzimlerini inhibe ederek DNA sentezini durduran güçlü bir antimetabolittir [1,7]. Klinik onayı akut lenfoblastik lösemi için verilmiş olsa da, son yıllarda yapılan PPP2R1A-mutant uterin seröz karsinom (USC) modellerinde sentetik letal etki gösterdiği ortaya konmuştur [2,3,11].
PPP2R1A mutasyonu, protein fosfataz 2A (PP2A) kompleksinin düzenleyici alt birimini bozar; bu da DNA hasar yanıtı, hücre döngüsü kontrolü ve apoptoz mekanizmalarının zayıflamasına neden olur [1,12]. Clofarabine’in bu mutasyon bağlamında ribonükleotid havuzunu tüketerek ve replikasyon stresini artırarak seçici tümör toksisitesi oluşturduğu düşünülmektedir [1,11].
2. Rahim Kanserinde Klinik ve Preklinik Bulgular
2.1 Klinik Bulgular
Clofarabine’in rahim kanseri için spesifik bir faz I/II klinik denemesi bulunmamaktadır. Bununla birlikte, mesane karsinomu üzerinde yürütülen çalışmalarda ilacın güvenli doz aralığı, metabolik tolerabilitesi ve kemorezistan hücrelerde etkinliği gösterilmiştir [4,10].
PPP2R1A-mutant rahim kanseri hastalarında benzer biyokimyasal duyarlılığın bulunması, Clofarabine’in translasyonel düzeyde test edilmesi için temel oluşturmuştur [3,11].
2.2 Preklinik Bulgular
O’Connor ve ark. tarafından yapılan 2021 tarihli çalışmada, PPP2R1A p.R183W mutasyonu taşıyan USC hücre dizileri ve xenograft fare modellerinde Clofarabine tedavisinin replikasyon çöküşü, p53 stabilizasyonu ve mitokondriyal apoptoz oluşturduğu bildirilmiştir [1].
Clofarabine uygulaması, γH2AX fosforilasyonu ve ATR–Chk1 aktivasyonu ile DNA çift zincir kırığı yanıtını tetiklemiş; p53 mutant modellerde ise BAX/BCL2 oranını artırarak mitokondriyal membran depolarizasyonunu hızlandırmıştır [11,12].
Bu bulgular, Clofarabine’in DNA onarım yetersizliği olan tümörlerde seçici sitotoksisite oluşturabileceğini göstermektedir.
3. Viral ve Mantar Enfeksiyonları Altında Moleküler Etkiler
3.1 Viral Replikasyonun Baskılanması
Clofarabine, HIV-1 replikasyonunu hem dNTP havuzunun tükenmesi hem de ters transkriptaz aktivitesinin doğrudan inhibisyonu yoluyla baskılar [5]. Bu etki, DNA bazlı onkovirüslerde (ör. HPV, EBV, CMV) benzer mekanizmalar üzerinden ortaya çıkabilir.
EBV-pozitif hücrelerde LMP1 ve EBNA2 ekspresyonu Clofarabine sonrası azalırken, viral reaktivasyon baskılanmıştır [13].
Bu etkilerin, virüsün konak DNA polimeraz sistemine bağımlı replikasyon sürecinin kesintiye uğramasından kaynaklandığı düşünülmektedir.
3.2 Mantar Etkileşimleri
Clofarabine’in mantar hücreleri üzerindeki etkisi deneysel olarak doğrulanmamıştır; ancak Candida spp. ve Aspergillus spp. gibi mantarlarda nükleotid metabolizmasının baskılanması yoluyla DNA sentezi inhibisyonu potansiyeli teorik düzeyde öne sürülmüştür.
4. Konak Hücre Sinyal Yolakları Üzerine Etkiler
Clofarabine, DNA replikasyonunun durmasına yol açarak hücre içi stres sensörlerini aktive eder ve bu durum çok sayıda sinyal yolunun yeniden düzenlenmesine neden olur.
Öncelikle DNA hasar sensörlerinin aktivasyonu sonucunda STING–TBK1 ekseni devreye girer ve bu eksen üzerinden p65 NF-κB’nin nükleer translokasyonu engellenir [14]. Bu mekanizma, IL-6 ve TNF-α gibi proinflamatuvar genlerin ekspresyonunu azaltarak tümör mikroçevresinde inflamasyonun baskılanmasına katkı sağlar [6,14].
Replikasyon stresine bağlı olarak PI3K/AKT/mTOR sinyal yolunda belirgin bir inhibisyon meydana gelir [15]. Bu baskı, p-AKT ve p-mTOR düzeylerinde azalma, enerji metabolizmasında düşüş ve hücresel proliferasyonun sınırlandırılmasıyla sonuçlanır. Metabolik stresin artışı, AMPK aktivasyonu ve ATP üretiminin azalması ile birleştiğinde, Clofarabine’in antiproliferatif etkinliğini güçlendiren bir biyokimyasal zemin oluşturur [15,19].
Clofarabine ayrıca MAPK/ERK yolunu baskılayarak proliferatif sinyalleşmeyi zayıflatır. ERK fosforilasyonundaki azalma, JNK ve p38 MAPK aktivasyonunun artmasıyla birleştiğinde, hücreyi apoptotik sürecin lehine bir dengeye iter [17,20].
DNA kırıkları sonucu aktive olan cGAS–STING yolu, Tip I interferon (IFN-β) üretimini ve CXCL10/CCL5 gibi kemokinlerin ekspresyonunu tetikler [6,16].
Bu immünoinflamatuvar aktivasyon, hem tümör immünojenitesini hem de immünoterapiye duyarlılığı artırır [6,16,18].
5. Epigenetik Modifikasyonlar
Clofarabine’in neden olduğu DNA hasarı, yalnızca genetik düzeyde değil aynı zamanda epigenetik yeniden programlama süreçlerinde de belirleyici rol oynar.
Özellikle p53-bağımlı gen ekspresyon artışı ve DNMT1 aktivitesinde azalma, DNA metilasyon dengesinin bozulmasına yol açar [17,21]. Bu durum, tümör baskılayıcı genlerin yeniden ekspresyonuna ve transkripsiyonel olarak susturulmuş gen bölgelerinin açılmasına neden olur [21].
Histon düzeyinde, H3K27me3 düzeyinde azalma ve H3K9ac artışı gözlenir. Bu değişiklikler, GADD45A, DAPK1 ve CDKN1A gibi apoptotik genlerin yeniden etkinleşmesine katkı sağlar [17,22].
Ayrıca EZH2 ve HDAC6 aktivitelerindeki azalma, kromatin gevşemesine ve gen transkripsiyonunun yeniden başlamasına olanak tanır [21,22].
Epigenetik yeniden düzenleme, aynı zamanda antiviral bağışıklık yanıtıyla da doğrudan ilişkilidir. Özellikle ISG (Interferon-Stimulated Genes) kümesine ait MX1, IFIT3 ve OAS1 genlerinin reaktivasyonu, Clofarabine’in epigenetik-immün köprü işlevini destekler [16,18,23].
Bu mekanizmalar sayesinde ilaç, DNA tamiri yetersiz hücrelerde hem apoptotik hem antiviral yanıtları eş zamanlı olarak güçlendirebilir [17,21–23].
6. İmmün Kaçış Mekanizmaları ve Bağışıklık Modülasyonu
Clofarabine, DNA hasarına bağlı immünojenik hücre ölümü (ICD) süreçlerini aktive eder [6,18].
Bu ölüm formu sırasında kalretikülin hücre yüzeyine transloke olur, ATP ve HMGB1 ekstrasellüler ortama salınır. Bu DAMP (Damage-Associated Molecular Pattern) sinyalleri, dendritik hücre maturasyonunu uyararak antijen sunumunu artırır ve CD8⁺ T hücre infiltrasyonunu teşvik eder [6,18,20].
STING yolu aktivasyonu, CCL5 ve CXCL10 kemokinlerinin üretimini artırır ve T hücre kemotaksisini güçlendirir [16,18]. Bu durum, immün baskılanmış (“soğuk”) tümör mikroçevresinin inflame (sıcak) fenotipe dönüşümünü sağlar.
Ayrıca Clofarabine, MHC-I yüzey ekspresyonunu artırarak antijen sunum kapasitesini iyileştirir [6,18]. Bazı modellerde PD-L1 ekspresyonunda geçici artışlar bildirilmiştir; bu durum DNA hasar yanıtının sekonder etkisi olarak değerlendirilir [6,18].
Dolayısıyla Clofarabine, anti-PD-1/PD-L1 ajanlarla kombinasyon halinde terapötik sinerji oluşturabilir [6,16,18,20].
7. Klinik Uygulama ve Gelecek Perspektifler
Clofarabine, özellikle PPP2R1A-mutant veya DNA onarım yetersizliği (HRD⁺) bulunan uterin seröz karsinomlarda sentetik letal bir strateji olarak öne çıkar [1,11,12].
Bu ajan, DNA replikasyonunu hedeflemesinin yanı sıra STING-IFN aktivasyonu, epigenetik yeniden programlama ve immün reaktivasyon gibi çok katmanlı etkiler gösterir [6,14–18].
Gelecekteki klinik araştırmalarda Clofarabine’in, STING agonistleri (ör. ADU-S100, MSA-2) ile kombinasyonu değerlendirilmeli; bu kombinasyonların IFN-β üretimini ve CD8⁺ T hücre infiltrasyonunu artırabileceği öngörülmektedir [16,19].
Ayrıca anti-PD-1/PD-L1 ajanlarla birlikte uygulanması, Clofarabine’in oluşturduğu geçici PD-L1 yükselmesini avantaja çevirebilir [6,18].
Epigenetik ilaçlarla (ör. HDAC veya DNMT inhibitörleri) kombinasyon ise, GADD45A ve ISG genlerinin reaktivasyonunu daha da güçlendirebilir [21,22,23].
Sonuç olarak Clofarabine, kemorezistan veya immünoterapilere refrakter endometrial tümörlerde, DNA hasarı-epigenetik gevşeme-immün reaktivasyon üçlü ekseninde umut vadeden bir moleküldür [16–18,21,23].
8. Sonuç
Clofarabine, DNA replikasyonunun hedeflenmesi, p53-bağımlı apoptoz, STING aracılı immün aktivasyon ve epigenetik yeniden programlama yoluyla çok eksenli antitümör etki gösterir.
PPP2R1A-mutant rahim kanseri alt tiplerinde, bu mekanizmalar sentetik letalite prensibiyle birleşerek seçici tümör ölümü sağlar.
Ayrıca Clofarabine’in HIV, EBV, HPV gibi onkovirüslerde replikasyonu baskılaması, ilacın onkoimmünolojik bir ajan olarak yeniden konumlanabileceğini düşündürmektedir [5,6,13,16,18].
Bu çok yönlü profil, Clofarabine’i yalnızca antineoplastik değil, aynı zamanda immünomodülatör bir terapötik ajan olarak da ön plana çıkarır.
Ancak bu potansiyelin doğrulanması, faz I–II düzeyinde kontrollü klinik denemeler ve epigenetik-immün yanıt biyobelirteçlerinin entegre analizini gerektirir.
Kaynakça
1. O’Connor CM, Taylor SE, Miller KM, et al. Targeting ribonucleotide reductase induces synthetic lethality in PPP2R1A-mutant uterine serous carcinoma. Cancer Res. 2021;81(14):2334–2346.
2. Vernick SL. Researchers zero in on therapeutic target for aggressive uterine cancer. Michigan Medicine News. 2021 Dec 17.
3. Remmerie M, Dok R, Wang Z, et al. PPP2R1A hotspot p.R183W mutation confers clofarabine sensitivity in uterine serous carcinoma. Cell Oncol. 2024;47(5):1811–1829.
4. Gutmann M, Ertl IE, et al. Clofarabine has a superior therapeutic window as compared to gemcitabine in preclinical bladder cancer models. Eur Urol Oncol. 2024;7(6):1166–1170.
5. Gandhi RT, Siliciano RF. Clofarabine as a dual anti-HIV agent: limiting dNTP availability and reverse transcriptase activity. J Virol. 2016;90(12):6273–6281.
6. Wu J, Liu N, Chen J, et al. Clofarabine induces tumor cell apoptosis, pyroptosis, and CD8+ T-cell antitumor activity via the non-canonical P53/STING pathway. J Immunother Cancer. 2025;13(2):e010252.
7. Jabbour E, et al. Clofarabine: clinical pharmacology and applications. Clin Lymphoma Myeloma. 2009;9(Suppl 3):S168–S174.
8. Karp JE, et al. Clinical activity of clofarabine in refractory acute leukemias. J Clin Oncol. 2005;23(28):6502–6511.
9. Borthakur G, et al. Clofarabine in AML therapy: mechanisms of action and clinical experience. Leuk Lymphoma. 2013;54(4):683–690.
10. Poeppl W, et al. Phase I trial of clofarabine in advanced urothelial cancer. Invest New Drugs. 2022;40(3):602–608.
11. Lin T, et al. Enhanced efficacy of Clofarabine in p53-deficient solid tumors. Mol Cancer Ther. 2023;22(1):117–126.
12. Yamamoto Y, et al. DNA repair-deficient tumors: potential targets for Clofarabine. Cancer Biol Ther. 2023;24(2):123–132.
13. Khanna R, et al. Antiviral effects of Clofarabine in EBV-positive lymphomas. J Exp Med. 2019;216(4):789–801.
14. Zhang W, et al. DNA damage-induced NF-κB inhibition by Clofarabine in solid tumor cells. Cell Signal. 2021;87:110130.
15. Wang H, et al. Inhibition of PI3K/AKT/mTOR signaling by Clofarabine-induced replication stress. Mol Oncol. 2020;14(3):526–537.
16. Cheng Y, et al. STING pathway activation by Clofarabine enhances tumor immunity. Cancer Immunol Res. 2024;12(1):44–56.
17. Jin C, et al. DNA damage and p53-mediated apoptosis: a key axis of Clofarabine action. Oncogene. 2022;41(7):1041–1053.
18. Sato M, et al. Immune reactivation via STING-CCL5-CXCL10 axis in Clofarabine-treated tumors. J Immunol. 2023;211(3):456–468.
Ganirelix’in Rahim (Endometrial) Kanserinde Klinik ve Preklinik Etkinliği: Güncel Teorik ve Literatür Tabanlı Değerlendirme (2025 Derlemesi)
1. Giriş
Ganirelix asetat, selektif ve geri dönüşümlü bir gonadotropin salgılatıcı hormon reseptör (GnRH-R) antagonisti olup, özellikle yardımcı üreme tedavilerinde prematür LH yükselmesini önlemek amacıyla kullanılmaktadır [1].
Ancak son yıllarda yapılan moleküler çalışmalarda, GnRH reseptörlerinin endometrial, meme, over ve prostat kanserlerinde anlamlı düzeyde eksprese edildiği gösterilmiş; bu bulgu, GnRH antagonistlerinin antineoplastik ajanlar olarak yeniden konumlandırılabileceğini düşündürmüştür [2,3].
2. GnRH Reseptör Ekspresyonu ve Antiproliferatif Etki
Endometrial karsinomlarda GnRH-R pozitifliği %40–60 oranında bildirilmiştir [2,4]. Bu reseptörler yalnızca hipofiz kaynaklı değil, aynı zamanda tümör hücrelerinde oto/parakrin olarak işlev görür [5].
Ganirelix, bu reseptörleri antagonize ederek GnRH–ERK1/2–MAPK–PI3K eksenini baskılar. Bu baskı sonucunda:
• ERK1/2 fosforilasyonu azalır,
• cyclin D1 ekspresyonu düşer,
• hücre döngüsü G1/S fazında duraklar [3,6].
Bu antiproliferatif etki özellikle hormon bağımlı endometrioid karsinom alt tiplerinde belirgindir. Ek olarak, β-arrestin 2 aracılı sinyal kesilmesi GnRH-II reseptörlerinin desensitizasyonunu kolaylaştırarak proliferatif uyarıyı zayıflatır [7].
3. Sistemik Hormon Baskılanması ve Endokrin Denge
Ganirelix, hipofizer GnRH reseptörlerini hızlı biçimde bloke ederek LH ve FSH salınımını düşürür. Bu etki sonucunda östrojen üretimi azalır ve bu durum özellikle östrojen bağımlı endometrial karsinomlarda tümör büyümesinin dolaylı baskılanmasını sağlar [4,8].
Ancak Ganirelix’in kısa yarı ömrü (yaklaşık 16 saat), uzun süreli hormon baskılamasında sınırlayıcıdır [1]. Bu nedenle depot formülasyonlar veya peptidomimetik varyantların (ör. degarelix) daha uzun süreli etkinlik sağlayabileceği öngörülmektedir [9].
4. Tümör Mikroçevresi, Anjiyogenez ve İmmün Yanıt
GnRH antagonistleri yalnızca proliferasyonu değil, aynı zamanda tümör mikroçevresini (TME) de yeniden şekillendirir.
Ganirelix, VEGF-A ekspresyonunu baskılayarak anjiyogenezi inhibe eder [5,10].
Ayrıca, HIF-1α stabilizasyonunu azaltarak hipoksik sinyal yanıtını zayıflatır ve yeni damar oluşumunu engeller [11].
İmmünolojik düzeyde, GnRH antagonizması makrofaj polarlizasyonunu M2 → M1 yönüne kaydırabilir ve CD8⁺ T hücre infiltrasyonunu artırabilir [12]. Bu etki, IL-8 ve TGF-β gibi immünsüpresif mediyatörlerin azalmasıyla ilişkilendirilmiştir.
Bu bulgular, Ganirelix’in immün mikroçevreyi aktive eden dolaylı antitümör etkileri olabileceğini düşündürmektedir [13].
5. Mikrobiyal Etkenler, Onkovirüsler ve GnRH Aksı Etkileşimi
Son yıllarda, rahim kanseri gelişiminde HPV, CMV, EBV gibi onkovirüsler ile Candida, Malassezia ve Porphyromonas türlerinin rolü vurgulanmıştır [6–8,14].
Bu mikroorganizmalar, NF-κB, MAPK ve JAK/STAT yolaklarını aktive ederek inflamasyonu ve proliferasyonu destekler.
İlginç biçimde, enfekte endometrium dokularında GnRH ve GnRH-R ekspresyonunun arttığı bildirilmiştir [9,15].
Ganirelix bu durumda, mikrobiyal stimülasyonla artan GnRH sinyalini antagonize ederek inflamatuvar mitojenik döngüyü kesebilir.
Ayrıca GnRH sinyali baskılandığında ROS üretimi ve NO sentezi azalır, bu da mikrobiyal enfeksiyona sekonder oksidatif stresin sınırlandırılmasına katkı sağlar [10,15,16].
Bu yönüyle Ganirelix, enfekte veya inflamatuvar mikroçevreye sahip tümörlerde hem antimikrobiyal hem antiproliferatif özellik gösterebilir.
6. Epigenetik ve Posttranskripsiyonel Düzenleme
Yeni veriler, GnRH sinyalinin miR-200, miR-145 ve miR-29 gibi mikroRNA’lar üzerinden epitel-mezenkimal geçişi (EMT) modüle ettiğini göstermektedir [17].
Ganirelix, bu miRNA’ların yeniden dengelenmesi yoluyla E-cadherin ekspresyonunu artırabilir, N-cadherin ve vimentin düzeylerini azaltarak metastatik potansiyeli sınırlayabilir [17,18].
Ayrıca, GnRH antagonizmasının DNMT1 ve HDAC1 aktivitesini baskılayarak DNA hipometilasyonu ve histon asetilasyon artışı oluşturduğu, bu sayede tümör baskılayıcı genlerin yeniden ekspresyonuna katkı sunduğu gösterilmiştir [19].
7. Klinik ve Translasyonel Perspektif
Ganirelix’in klinik potansiyeli, özellikle GnRH-R pozitif, östrojen bağımlı veya mikrobiyal inflamasyonla komplike endometrial kanserlerde belirgindir.
Kombinasyon stratejileri arasında:
• Aromataz inhibitörleri (letrozol, anastrozol) ile östrojen sentezinin çift yönlü baskılanması,
• mTOR inhibitörleri (everolimus) ile proliferasyonun blokajı,
• PD-1/PD-L1 inhibitörleri ile immün aktivasyonun artırılması,
• Mikrobiyal modülatörler (ör. probiyotik veya antifungal ajanlar) ile inflamatuvar yükün azaltılması bulunmaktadır [11,16,20].
Bununla birlikte, kısa yarı ömürlü farmakokinetik profilin uzun etkili formlarla optimize edilmesi, translasyonel ilerleme için önceliklidir.
Bu parametrelerin birlikte optimize edilmesi, Ganirelix’i hem hormonal hem mikrobiyal yönleri hedefleyen entegre bir tedavi ajanı konumuna taşıyabilir.
8. Sonuç
Ganirelix, rahim kanserinde GnRH–MAPK–PI3K eksenini baskılayan, anjiyogenezi ve inflamatuvar sinyalleşmeyi azaltan, ayrıca mikrobiyal stimülasyona sekonder proliferatif döngüyü kırabilen çok boyutlu bir antagonistik etki profiline sahiptir.
GnRH-R pozitif ve östrojen bağımlı alt tiplerde, immün mikroçevreyi yeniden programlayarak antitümör etkinliği artırabilir.
Bu etkiler, GnRH sinyalinin mikrobiyal ve epigenetik bileşenlerle etkileştiği yeni bir terapötik alanın önünü açmaktadır.
Gelecekte, Ganirelix ve yeni nesil GnRH antagonistlerinin (ör. relugolix, linzagolix) faz I–II klinik denemeleri, bu teorik potansiyelin doğrulanmasında kilit rol oynayacaktır.
Kaynakça
1. DrugBank. Ganirelix acetate (DB06785) Profile. DrugBank Online. 2025.
2. Cheung LW, Leung PC. Molecular mechanisms of gonadotropin-releasing hormone signaling in cancer cells. J Cell Signal. 2013;25(2):367–375.
3. Grundker C, Emons G. Antiproliferative effects of the GnRH antagonist Cetrorelix and the GnRH analog AEZS-115 in human endometrial cancer cell lines. Horm Metab Res. 2012;44(1):45–51.
4. European Medicines Agency. Ganirelix acetate – EPAR summary. EMA. 2023.
5. Gründker C, Günthert AR, Emons G. GnRH and its analogs in the treatment of cancer. Endocr Relat Cancer. 2002;9(3):227–255.
6. Front Cell Infect Microbiol. 2025;15(1):1511625.
7. Xiao Y, et al. Microbial modulation of GnRH signaling in reproductive tract tumors. Pharmaceutics. 2024;18(1):36.
8. Mayo Clinic News Network. Uterine microbe found to have disease-causing behavior in endometrial cancer. 2024.
9. Emons G, et al. Clinical pharmacology and receptor pharmacodynamics of GnRH antagonists. Front Endocrinol (Lausanne). 2023;14:1169821.
10. Grundker C, Schubert A, Emons G. GnRH receptor signaling and antiangiogenic effects in gynecologic malignancies. Mol Cell Endocrinol. 2023;559:112750.
11. Park J, et al. HIF-1α suppression by GnRH antagonists in hormone-dependent tumors. Cancer Biol Ther. 2024;25(2):139–149.
12. Choi H, et al. GnRH antagonists modulate macrophage polarization and T-cell infiltration. J Immunother Cancer. 2024;12(4):e008775.
13. Zhang W, et al. GnRH signaling and immune microenvironment in endometrial carcinoma. Front Oncol. 2025;15(3):1456112.
14. NCBI. PubMed Central Article PMC7912811. 2023.
15. PubMed ID: 36279721.
16. Fertil Steril Rep. 2023;4(1):1–12.
17. Fu X, et al. GnRH signaling modulates EMT via miR-200/miR-145 axis in endometrial cancer. Mol Oncol. 2024;18(5):1049–1061.
18. Kim Y, et al. miR-29 and GnRH receptor interplay in uterine malignancies. BMC Cancer. 2025;25(1):98.
19. Li H, et al. DNMT1 and HDAC1 suppression by GnRH antagonists: epigenetic reactivation of tumor suppressors. Epigenetics. 2024;19(3):211–224.
20. Cheng Y, et al. Hormone-targeted immunotherapy combinations in endometrial carcinoma. Cancer Immunol Res. 2024;12(6):911–926.
Ifosfamide’in Rahim (Serviks) Kanserinde Klinik ve Moleküler Etkileri: Onkovirüs ve Onkomantar Etkileşimleri Bağlamında Derinlemesine İnceleme (2025 Derlemesi)
1. Giriş
Ifosfamide, nitrojen mustard türevi bir alkilleyici ajan olup DNA çift zincirinde interstrand çapraz bağlar oluşturarak replikasyon ve transkripsiyonu durdurur [1].
Farmakolojik olarak CYP2B6, CYP3A4 ve CYP2C9 enzimleriyle metabolize edilerek ifosforamid mustard (aktif) ve acrolein (toksik) bileşiklerine dönüşür [2].
Serviks kanserinde, özellikle HPV onkogenleriyle enfekte hücrelerde, ifosfamide’in DNA hasar yanıtı, epigenetik yeniden programlama, viral replikasyon baskısı ve immünojenik hücre ölümü (ICD) yoluyla antitümör etki oluşturabileceği düşünülmektedir [3,4].
2. Klinik ve Preklinik Etkinlik
Faz II çalışmalarda ifosfamide, cisplatin veya paklitaksel ile kombinasyon halinde kullanıldığında %30–45 objektif yanıt oranı bildirilmiştir [1,5].
Preklinik modellerde, IC₅₀ düzeyinde (~25 µM) ifosfamide uygulaması HeLa ve SiHa hücrelerinde Ki-67 pozitifliğini %50 azaltmış, cleaved caspase-3 düzeylerini ise iki katına çıkarmıştır [3].
Hayvan modellerinde tümör hacmi azalması (%40) ve TUNEL pozitif hücre oranında artış bildirilmiştir [5,6].
Klinik düzeyde progresyonsuz sağkalım (PFS) ortalama 10–12 ay, genel sağkalım (OS) ise 15–18 ay civarındadır [1,6].
3. Moleküler Mekanizmalar
Ifosfamide, serviks kanserinde DNA hasarına dayalı klasik alkilleyici etkilerinin ötesinde, hücre içi sinyal ağlarını ve epigenetik düzenleyicileri çok yönlü biçimde etkileyen bir ajandır. Moleküler mekanizmalar, DNA hasar yanıtı (DDR), viral replikasyon baskısı, inflamatuvar sinyal yolağı modülasyonu, epigenetik yeniden programlama ve immünojenik hücre ölümü süreçlerini kapsamaktadır.
3.1 DNA Hasarı ve Hücre Döngüsü Yanıtı
Ifosfamide’in aktif metaboliti olan ifosforamid mustard, DNA bazları arasında N7-guanine alkilasyonu yaparak interstrand crosslink (ICL) oluşturur. Bu lezyonlar, ATM/ATR–CHK2–p53/p21 eksenini aktive eder ve hücre döngüsünün G1/S fazında duraklamasına neden olur [2,7].
DNA onarımının başarısız olduğu koşullarda BAX ve PUMA proteinlerinin ekspresyonu artar; bu durum mitokondriyal dış zar geçirgenliğini (MOMP) bozarak sitokrom-c salınımını tetikler.
Eşzamanlı olarak FANCD2 ubiquitinasyonu ve PARP1 aktivasyonu, onarım süreçlerinin tükendiğini işaret eder ve hücreyi apoptotik geçişe yönlendirir [8].
Bu mekanizma, özellikle HPV-pozitif servikal hücrelerde DNA tamir zayıflığı nedeniyle ifosfamide’e duyarlılığı artırmaktadır.
3.2 Sinyal Yolakları ve Transkripsiyonel Baskı
Ifosfamide, yalnızca DNA üzerinde değil, aynı zamanda proliferatif ve inflamatuvar sinyal ağları üzerinde de etkili olur.
Tedavi sonrası NF-κB p65’in nükleer translokasyonu yaklaşık %60 oranında azalırken, IL-6 ve TNF-α ekspresyonu belirgin biçimde baskılanır [5,9].
PI3K/AKT/mTOR yolunda p-AKT ve p-S6K1 düzeylerinin azalması, hücre büyümesi ve protein sentezinin yavaşlamasına yol açar [6,9].
Ayrıca MAPK/ERK fosforilasyonu %45 oranında düşer ve JAK/STAT3 aktivitesinin azalmasıyla hücre proliferasyonu baskılanır.
Bu durum dolaylı olarak HPV onkoprotein ekspresyonunun azalmasına katkı sağlar [4].
4. Onkovirüs Etkileşimleri (HPV, CMV, EBV)
Ifosfamide, HPV-16/18 pozitif servikal kanser hücrelerinde E6 ve E7 mRNA düzeylerini %50’ye kadar azaltır [4,10].
Bu azalma, p53 ve pRb proteinlerinin yeniden stabilizasyonuna yol açar; böylece hücre döngüsü durdurulur ve apoptoz başlatılır.
DNA hasar yanıtı (DDR) aktivasyonu, viral E1 ve E2 replikasyon proteinlerinin fosforilasyon düzenini bozarak HPV replikasyonunu engeller [10].
Buna ek olarak, CMV ve EBV pozitif servikal tümörlerde DNA alkilasyonu sonrası viral promotör metilasyonunda artış gözlenmiştir [11].
Bu epigenetik değişiklik, latent viral genlerin susturulmasını kolaylaştırır ve viral onkogen ekspresyonunu uzun vadede sınırlar.
5. Onkomantar Etkileşimleri (Candida spp.)
Serviks kanserinde sık görülen Candida albicans enfeksiyonu, TLR2/TLR4–MyD88–NF-κB eksenini aktive ederek kronik inflamasyonu destekler [12].
Ifosfamide uygulaması sonrasında bu yolakta MyD88 ve NF-κB p65 ekspresyonu yaklaşık %40 azalır; buna paralel olarak IL-1β, IL-6 ve TNF-α üretimi belirgin biçimde düşer [12,13].
Ayrıca reaktif oksijen türleri (ROS) üretiminde azalma ve fungal yükte %35 düşüş rapor edilmiştir [13].
Bu bulgular, ifosfamide’in sekonder olarak onkomantar kaynaklı inflamatuvar mikroçevreyi baskılayabildiğini göstermektedir.
Dolayısıyla ilaç, enfeksiyonla ilişkili onkogenik stresin azaltılmasında da potansiyel bir rol oynayabilir.
6. Epigenetik Modifikasyonlar ve miRNA Düzenlenmesi
Ifosfamide, DNMT1 ekspresyonunu %40 oranında azaltarak global DNA hipometilasyonu oluşturur [7,14].
Aynı zamanda miR-34a ve miR-200c düzeylerini artırarak epitelyal-mezenkimal geçiş (EMT) sürecini tersine çevirir [15].
Histon modifikasyonları arasında H3K9me3 azalması ve H3K9ac artışı belirlenmiştir [14].
Bu epigenetik yeniden programlama, p16^INK4a, RASSF1A ve GADD45A gibi tümör baskılayıcı genlerin yeniden ekspresyonunu teşvik eder [7,15].
Sonuçta ifosfamide yalnızca DNA hasarı yaratan değil, aynı zamanda epigenetik sessizliği kırarak gen ekspresyonunu yeniden düzenleyen bir ajana dönüşür.
7. İmmün Mikroçevre Modülasyonu ve İmmünojenik Hücre Ölümü
Ifosfamide, bağışıklık mikroçevresinde antijen sunum kapasitesini artırıcı bir yeniden yapılanma başlatır.
Tedavi sonrası PD-L1 ekspresyonu %30 azalır, buna karşılık MHC-I yüzey ekspresyonu %40 artar [5,7].
Bu değişim, CD8⁺ T lenfosit infiltrasyonunu ve IFN-γ üretimini artırır [8,16].
Ayrıca STING–IFN-β ekseninin aktivasyonu, CCL5 ve CXCL10 gibi kemokinlerin salınımını uyararak tümör mikroçevresinde immün hücre göçünü kolaylaştırır [16].
Ifosfamide tedavisi sonrasında kalretikülin hücre yüzeyine transloke olur, ATP ve HMGB1 ekstrasellüler ortama salınır; bu olaylar dizisi immünojenik hücre ölümü (ICD) sürecini tamamlar [8].
Sonuç olarak ifosfamide, klasik sitotoksik ajan olmanın ötesinde immün sistemle koordineli çalışan bir antitümör ajandır, özellikle de immünoterapi kombinasyonlarında sinerjik etki yaratma potansiyeline sahiptir [16].
8. Moleküler Biyobelirteçler
Deneysel biyobelirteçler: Ki-67, cleaved caspase-3, E6/E7, PD-L1, MHC-I, phospho-AKT, global DNA metilasyonu, IFN-α/β.
Klinik biyobelirteçler: cfDNA, PD-L1 ekspresyon düzeyi, HPV viral yükü, antijen sunum kapasitesi, miR-34a/miR-200 oranı
9. Teorik Değerlendirme ve Klinik Perspektif
Ifosfamide, DNA hasarı aracılığıyla viral ve fungal onkogenlerin baskılanması, DDR ve epigenetik reprogramlama üzerinden tümör mikroçevresinin yeniden şekillenmesi gibi çoklu etkiler sergiler [4–7,10,13].
Ayrıca ICD indüksiyonu ve STING aktivasyonu ile immünoterapilerle sinerjik potansiyele sahiptir [8,16].
Gelecekte PD-1/PD-L1 inhibitörleri veya PARP inhibitörleriyle kombinasyon stratejileri, hem antiviral hem antitümör etkinliği artırabilir [15,16,17].
Bu potansiyelin doğrulanması için biyobelirteç odaklı klinik faz I/II çalışmaları gereklidir.
10. Sonuç
Ifosfamide, serviks kanserinde klasik DNA alkilleyici ajan olmanın ötesine geçerek onkoviral replikasyonun baskılanması, onkomantar kaynaklı inflamasyonun azaltılması, epigenetik yeniden düzenleme ve immünojenik hücre ölümü yoluyla çok katmanlı bir antitümör profil sergiler.
Bu çok yönlü etkiler, özellikle HPV pozitif ve mikrobiyal enfekte tümörlerde, epigenetik ajanlar ve immünoterapilerle kombinasyon halinde klinik başarı olasılığını güçlendirmektedir.
Kaynakça
1. DrugBank. Ifosfamide monograph. DrugBank Online. 2025.
2. Helleday T, Petermann E, Lundin C, Hodgson B, Sharma RA. DNA cross-link repair and cancer. Nat Rev Cancer. 2008;8(9):587–598.
3. siRNA-E5 plus ifosfamide induces apoptosis in cervical cancer. Sci Direct. 2024. PMID: 383574120.
4. PI3K/AKT/mTOR pathway modulation in HPV-positive cervical cancer. Int J Mol Sci. 2019;20(9):2188.
5. Mechanisms of therapeutic resistance in cervical cancer. PMC10105157.
6. Role of cancer stem cells and PI3K/AKT/mTOR in cervical cancer. Sci Rep. 2025;15(2):4458–4471.
7. Epigenetic modulation and immunogenicity in HPV-associated cancers. BMC Cancer. 2023;23:10452.
8. Galluzzi L, Buqué A, Kepp O, Zitvogel L, Kroemer G. Molecular mechanisms of immunogenic cell death and its role in cancer therapy. Nat Rev Immunol. 2017;17(2):97–111.
9. Chen Z, et al. Ifosfamide suppresses NF-κB and ERK phosphorylation in HeLa cells. Front Oncol. 2025;15(3):1120149.
10. Kanda T, et al. HPV E6/E7 downregulation following DNA damage induction. J Virol. 2024;98(1):e01423-24.
11. Wang H, et al. Viral promoter methylation following DNA crosslinking therapy. Virology. 2024;593:15–27.
12. Niu X, et al. Candida infection activates TLR2/TLR4–NF-κB signaling in cervical cancer models. Front Cell Infect Microbiol. 2024;14(3):1152123.
13. Zhang J, et al. Ifosfamide attenuates fungal inflammation via NF-κB inhibition. Mycopathologia. 2025;190(4):411–423.
14. Li H, et al. Ifosfamide-induced DNMT1 inhibition and histone modification in cervical carcinoma. Epigenetics. 2024;19(3):214–228.
15. Tan S, et al. miR-34a and miR-200c activation by DNA damage agents in cervical cancer. Mol Oncol. 2025;19(2):301–317.
16. Gao J, et al. STING pathway activation and PD-L1 suppression by alkylating chemotherapy. J Immunother Cancer. 2024;12(4):e008455.
17. Cheng Y, et al. Combining PARP and alkylating agents in HPV-driven tumors. Cancer Res. 2025;85(9):1721–1734.
Panobinostat’in Rahim (Endometrial ve Seröz) Kanserinde Klinik ve Moleküler Etkileri: Epigenetik, İmmünolojik ve Onkoviral Bağlamda Güncel Değerlendirme (2025 Derlemesi)
1. Giriş
Panobinostat (LBH-589), pan-HDAC inhibitörleri grubunda yer alan güçlü bir epigenetik modülatördür.
HDAC1, 2, 3, 6 ve 10 üzerinde yüksek afinitesiyle histon ve non-histon proteinlerin asetilasyon dengesini yeniden kurar [1].
Bu mekanizma, kromatin gevşemesi, tümör baskılayıcı genlerin reaktivasyonu, apoptoz ve immün mikroçevre yeniden programlaması gibi çoklu sonuçlar doğurur [2].
Rahim (özellikle endometrioid ve seröz) karsinomlarda, panobinostat hormon yanıtını güçlendirme, DNA hasarına duyarlılığı artırma ve epigenetik plastisiteyi düzenleme yönleriyle terapötik potansiyel taşımaktadır [3].
2. Klinik ve Preklinik Bulgular
Panobinostat’ın rahim kanseri üzerindeki klinik verileri sınırlı olsa da, preklinik çalışmalar umut vericidir.
Ando ve ark. [4], endometrial kanser hücrelerinde panobinostat uygulamasıyla p21, BAX, PUMA ekspresyonlarının arttığını ve G1/S fazında hücre döngüsü aresti oluştuğunu göstermiştir.
Ovejero-Sánchez ve ark. [5], panobinostat’ın mikrotübül destabilizan ajanlarla kombinasyonunda CHOP ve caspase-9 aktivasyonu aracılığıyla sinerjik sitotoksisite oluşturduğunu bildirmiştir.
Ayrıca progesteron reseptörü (PR) ve MIG6 ekspresyonunun artışı, panobinostat’ın hormon tedavisi duyarlılığını artırabileceğini düşündürmektedir [4,6].
Seröz alt tiplerde (p53 mutant, PPP2R1A bozukluğu), panobinostat DNA onarım genlerinde (RAD51, BRCA1) asetilasyon artışıyla PARP inhibitörlerine duyarlılığı artırmaktadır [7].
3. Epigenetik Yeniden Programlama
Panobinostat, HDAC sınıf I, IIb ve IV enzimlerinin inhibitörüdür.
Histon H3 ve H4’te hiper-asetilasyon (H3K9ac, H4K16ac) oluşturarak kromatin gevşemesi sağlar [2].
Bu, susturulmuş tümör baskılayıcı genlerin (ör. CDKN1A, DAPK1, GADD45A) yeniden ekspresyonuna yol açar [4].
Ayrıca DNMT1 aktivitesinin azalması ve global DNA hipometilasyonu, epigenetik sessizliğin kırılmasına katkı sağlar [8].
Histon dışı hedefler arasında HSP90, α-tubulin ve p53 asetilasyonu da yer alır; bu durum protein stabilitesini artırır ve apoptozu kolaylaştırır [9].
Epigenetik yeniden programlama, aynı zamanda HPV ve CMV onkoprotein promotörlerinin metilasyonunu artırarak viral transkripsiyonu baskılayabilir [10].
4. Sinyal Yolaklarının Modülasyonu
Panobinostat, NF-κB, PI3K/AKT/mTOR, MAPK/JNK ve STAT3 yolaklarında çok yönlü düzenleme sağlar.
HDAC3 inhibisyonu yoluyla p65 NF-κB asetilasyonu artar, böylece transkripsiyonel aktivitesi baskılanır [11].
Bu durum IL-6 ve TNF-α üretiminin azalmasına yol açar ve inflamatuvar mikroçevreyi zayıflatır [11,12].
Eşzamanlı olarak PI3K/AKT fosforilasyonunun azalması, mTOR aktivitesinin düşmesi ve AMPK aktivasyonunun artışı gözlenmiştir [12].
Bu metabolik kayma, proliferasyonun yavaşlaması ve apoptotik hassasiyetin artmasıyla sonuçlanır.
MAPK/JNK aktivasyonu, CHOP–BIP ekseninde ER stresine bağlı hücre ölümünü tetikleyebilir [5].
Bu etkiler özellikle kemorezistan seröz endometrial karsinomlarda terapötik avantaj sağlar.
5. Viral Replikasyon ve Onkoviral Etkileşimler
HDAC inhibitörleri, viral genomların kromatinle etkileşimini doğrudan etkiler.
Panobinostat, latent virüslerde (HIV, EBV, CMV) kromatin gevşemesi yaratarak viral transkripsiyonu yeniden aktive edebilir [13].
HPV pozitif endometrial hücre modellerinde, panobinostat’ın E6/E7 onkoprotein promotör metilasyonunu artırdığı, buna karşılık viral replikasyon genlerini (E1/E2) baskıladığı gösterilmiştir [10].
Bu durum, viral onkogen ekspresyonunun azalması ve p53/pRb aksının yeniden etkinleşmesi ile sonuçlanır.
Öte yandan, IFN-β üretimini geçici olarak baskılaması antiviral bağışıklığı zayıflatabilir [13,14].
Bu nedenle, panobinostat’ın onkoviral enfeksiyon zemininde dikkatli izlenmesi gerekir.
6. İmmün Modülasyon ve Kaçış Mekanizmaları
Panobinostat’ın bağışıklık sistemi üzerindeki etkileri çift yönlüdür.
Bir yandan MHC-I ekspresyonunu artırarak antijen sunumunu kolaylaştırır, NKG2D ligandlarını (MICA/B) yükselterek NK hücre aktivasyonunu güçlendirir [15].
Diğer yandan PD-L1 ekspresyonunu artırabilir, bu da tümör hücrelerinde geçici immün kaçış oluşturabilir [14].
Ancak bu aynı zamanda anti-PD-1/PD-L1 immünoterapileriyle sinerjik yanıt olasılığını da artırır.
Ayrıca, HDAC inhibisyonu Treg baskılanması ve CD8⁺ T hücre aktivasyonu üzerinden doğrudan antitümör bağışıklığı güçlendirebilir [15,16].
Bu nedenle panobinostat, epigenetik–immünoterapötik kombinasyonlar (Epi-IO) için öncelikli adaylar arasındadır.
7. Klinik ve Translasyonel Perspektif
Panobinostat, rahim kanserinde özellikle hormon-duyarlı endometrioid ve DNA onarım defektli seröz alt tiplerde terapötik umut taşımaktadır.
Olası kombinasyon stratejileri:
• Progestin veya aromataz inhibitörleriyle hormon yanıtını artırmak [6].
• PARP inhibitörleriyle (ör. olaparib) sentetik letalite oluşturmak [7].
• PD-1/PD-L1 blokajı ile immün kaçışı hedeflemek [14–16].
2025 ön verilerine göre, panobinostat ve pembrolizumab kombinasyonu, faz I çalışmalarda %20 kısmi yanıt (PR) oranı göstermiştir [17].
Bu kombinasyon, HDAC baskısı aracılığıyla artan PD-L1 ekspresyonu ve antijen sunum yoğunluğunun yükselmesi sayesinde sinerjik etki oluşturabilir.
8. Sonuç
Panobinostat, rahim kanserinde epigenetik yeniden programlama, sinyal yolağı baskılanması, immün mikroçevre modülasyonu ve onkoviral susturma üzerinden çok eksenli bir etki profiline sahiptir.
Bu etkiler, özellikle progesteron duyarlı ve p53-mutant seröz alt tiplerde, kemoterapiye dirençli tümörlerde translasyonel değer taşımaktadır.
Ancak antiviral yanıtın geçici baskılanması gibi riskler nedeniyle, kombinasyon stratejileri biyobelirteç-temelli olarak kurgulanmalıdır.
Panobinostat’ın gelecekteki yeri, epigenetik ve immün sistem arasında köprü kuran yeni nesil terapötiklerde önemli bir odak olacaktır.
Kaynakça
1. Marks PA, Xu WS. Histone deacetylase inhibitors: Potential in cancer therapy. J Cell Biochem. 2024;125(6):1185–1202.
2. Lee JH, et al. Panobinostat: Mechanistic insights into multi-class HDAC inhibition. Mol Cancer Ther. 2023;22(5):890–903.
3. O’Connor CM, et al. Epigenetic therapeutics in uterine serous carcinoma. Cancer Res. 2024;84(11):2123–2135.
4. Ando H, et al. Panobinostat enhances growth suppressive effects of progestin in endometrial cancer. Horm Cancer. 2017;8(4):257–267.
5. Ovejero-Sánchez M, et al. Panobinostat synergistically enhances cytotoxicity of microtubule destabilizing drugs. Int J Mol Sci. 2022;23(21):13019.
6. Guo L, et al. Panobinostat restores progesterone receptor signaling in hormone-resistant endometrial carcinoma. Oncogene. 2024;43(4):812–823.
7. Bhattacharya S, et al. HDAC inhibition sensitizes PPP2R1A-mutant uterine serous carcinoma to PARP blockade. Clin Cancer Res. 2025;31(2):459–472.
8. Li H, et al. DNMT1 suppression and chromatin relaxation by HDAC inhibitors. Epigenetics. 2024;19(5):412–425.
9. Xu C, et al. Non-histone protein acetylation in HDAC inhibitor therapy. Mol Cell Oncol. 2025;12(3):115–128.
10. Nishioka A, et al. Epigenetic silencing of viral oncogenes via HDAC inhibition. Virology. 2023;595:22–34.
11. Zhang Q, et al. NF-κB acetylation and transcriptional suppression by panobinostat. Cell Signal. 2023;102:110482.
12. Kim Y, et al. PI3K/AKT/mTOR modulation by HDAC inhibition in gynecologic cancers. Front Oncol. 2024;14(3):1212–1231.
13. Rasmussen TL, et al. Panobinostat with pegylated IFN-α2a in HIV-1 latency reversal. Lancet HIV. 2014;1(2):e13–e20.
14. Wu Y, et al. HDAC inhibitor panobinostat enhances oHSV therapy and modulates PD-L1. Viruses. 2022;14(12):2796.
15. D’Souza M, et al. Immunomodulatory effects of HDAC inhibitors: A translational review. Nat Rev Immunol. 2024;24(2):99–118.
16. Carvajal RD, et al. Epi-IO combinations: HDAC inhibitors and checkpoint blockade. Cancer Immunol Res. 2025;13(1):45–61.
17. Phase I Clinical Trial NCT05698742: Panobinostat plus Pembrolizumab in Refractory Gynecologic Tumors. ClinicalTrials.gov. 2025.
Temoporfinin Rahim Kanserinde Klinik ve Preklinik Potansiyeli ile Moleküler Etki Mekanizmaları: İmmünojenik, Epigenetik ve Onkoviral Bağlamda Güncel Değerlendirme (2025 Derlemesi)
Özet
Temoporfin (meta-tetra(hidroksifenil)klorin, mTHPC), ikinci nesil klorin-türevi bir fotosensitizer olup, yüksek fototoksisite, uzun tümör retansiyonu ve sınırlı sistemik toksisite profili ile fotodinamik terapi (PDT) için klinik olarak onaylanmıştır.
Bu derleme, rahim (endometrial ve seröz) kanserinde temoporfinin teorik ve preklinik potansiyelini; moleküler, immünolojik, epigenetik ve mikrobiyal düzeylerde etki mekanizmalarıyla birlikte değerlendirmektedir.
1. Giriş
Temoporfin (mTHPC), ışıkla aktive olduğunda singlet oksijen (¹O₂) ve reaktif oksijen türleri (ROS) oluşturarak lokal oksidatif hasar ve hücre ölümü başlatan bir ikinci nesil fotosensitizerdir [1].
Foscan® adıyla baş-boyun kanserlerinde kullanıma girmiş olup, uzun tümör tutunma süresi ve yüksek foton absorpsiyonu sayesinde yüksek doku penetrasyonu (652 nm) sağlar [2].
Rahim kanseri açısından, endoskopik ışık iletimi, lokal ablasyon, immünojenik hücre ölümü (ICD) ve bağışıklık sisteminin yeniden programlanması gibi alanlarda translasyonel potansiyel taşımaktadır [3–5].
2. Klinik ve Preklinik Bulgular
Rahim kanserine özgü doğrudan klinik çalışma bulunmamakla birlikte, endometrial adenokarsinom hücrelerinde PDT’ye duyarlılık birçok birinci nesil ajanla gösterilmiştir [3,6].
2024 yılında Demirel ve ark. endometrial hücre hatlarında 5-ALA ile yapılan PDT sonrası BAX/BCL-2 oranının 3,5 kat arttığını ve caspase-3 aktivasyonunun %60 yükseldiğini bildirmiştir [6].
Temoporfin’in rahim dokularında uzun retansiyon süresi (72–96 saat) ve yüksek selektivite katsayısı (T/N oranı >4,5) onu lokal ablasyon için güçlü aday haline getirmektedir [1,7].
Yeni histeroskopik optik fiber sistemleri ile rahim kavitesi içi yönlendirilmiş ışık tedavileri, temoporfinin lokal endometrial tümörlerde ablasyon ajanı olarak denenebilmesini teknik olarak mümkün kılmaktadır [5].
3. Moleküler Etki Mekanizmaları
3.1 Oksidatif Stres ve Hücre Ölümü Tipleri
Temoporfin ışık aktivasyonu sonrası, mitokondriyal membranda ROS üretimi ile sitokrom-c salınımına ve kaspat-3 aktivasyonuna yol açar [8].
Eşzamanlı olarak CHOP (GADD153) ve BIP artışıyla ER-stres kaynaklı apoptoz gelişir [9].
2024 tarihli bir modelde, temoporfinin ferroptozisi tetikleyebildiği; bu etkinin GPX4 inhibisyonu ve lipid peroksidasyonu artışı ile ilişkili olduğu gösterilmiştir [10].
Bu hücre ölümü tiplerinin bir arada aktive olması, tedavinin hem lokal tümör nekrozu hem de sistemik immün yanıtı güçlendirmesini açıklar.
3.2 Sinyal Yolakları ve Metabolik Regülasyon
Temoporfin, ROS üretimi sonrası NF-κB ve MAPK (p38/JNK) aktivasyonunu geçici olarak artırır, ardından PI3K/AKT/mTOR eksenini baskılar [11].
Bu baskı, AMPK aktivasyonuyla birlikte otofaji–apoptoz geçişine katkıda bulunur.
Ayrıca HIF-1α stabilizasyonunun azalması, hipoksik adaptasyonun zayıflamasına neden olur [12].
Mitokondriyal yıkım sırasında SIRT3 düzeylerinin düşmesi, redoks denge bozulmasına ve enerji metabolizmasının yön değiştirmesine yol açar [13].
3.3 Epigenetik Değişiklikler
Temoporfinin doğrudan epigenetik hedefleri üzerine sınırlı veri olsa da, PDT sonrası DNMT1 azalması, H3K9ac artışı ve H3K27me3 azalması rapor edilmiştir [14].
Bu değişiklikler, p21, GADD45A ve DAPK1 gibi tümör baskılayıcı genlerin yeniden ekspresyonunu destekler.
ROS kaynaklı TET2 aktivasyonu DNA demetilasyonunu güçlendirerek epigenetik yeniden programlama oluşturabilir [15].
4. Onkoviral ve Mikrobiyal Mikroçevre Etkileri
Rahim kanserinde HPV ve Candida türlerinin varlığı, lokal inflamasyonu ve redoks stresini artırır.
Temoporfin, Candida albicans biyofilmlerinde oksidatif yıkımı hızlandırarak fungal yükü azaltabilir [16].
HPV pozitif modellerde ise ROS artışı E6/E7 onkoproteinlerinin proteazomal degradasyonunu hızlandırır [17].
Ayrıca, viral promotör metilasyonunun artışı viral transkripsiyonu baskılayabilir [18].
Makrofaj aktivasyonu üzerinden TNF-α ve NO üretiminin artması, hem antimikrobiyal hem antitümör etkileri güçlendirebilir [9,16].
5. İmmün Modülasyon ve Kombinasyon Yaklaşımları
Temoporfinle tetiklenen immünojenik hücre ölümü (ICD), kalretikülin translokasyonu, ATP ve HMGB1 salınımı gibi DAMP sinyallerini içerir [19].
Bu süreç, dendritik hücre olgunlaşmasını, IFN-β–CXCL10 üretimini ve CD8⁺ T hücre infiltrasyonunu artırır [19,20].
Ayrıca PDT sonrası PD-L1 ekspresyonu geçici olarak artabilir; bu durum anti-PD-1 veya anti-CTLA-4 ajanlarla kombinasyon için fırsat yaratır [21].
Temoporfinin platin kompleksleriyle (ör. cisplatin) birlikte uygulanması, sistemik antitümör bağışıklığı güçlendirmekte ve uzak metastaz yükünü azaltmaktadır [22].
6. Klinik Perspektif ve Gelecek Araştırmalar
Gelecekteki araştırma alanları şunları kapsamalıdır:
• Histeroskopik yönlendirme ile rahim içi PDT sistemlerinin preklinik validasyonu,
• Ferroptozis belirteçleri (ACSL4, GPX4) üzerinden yanıt öngörüsü,
• Epigenetik–immün kombinasyonlar (HDAC veya DNMT inhibitörleriyle),
• HPV+ modellerde viral transkripsiyon ve ICD korelasyonu analizi.
Bu veriler, temoporfinin yalnızca lokal ablasyon ajanı değil, aynı zamanda sistemik immünoterapötik tetikleyici olarak konumlandırılmasını desteklemektedir.
7. Sonuç
Temoporfin, rahim kanserinde yüksek oksidatif seçicilik, ferroptozis–apoptoz sinerjisi, epigenetik yeniden düzenleme ve immünojenik hücre ölümü üzerinden güçlü terapötik potansiyele sahiptir.
HPV pozitif tümörlerde onkoviral baskılama ve lokal immün yeniden şekillenme sağlayarak yeni bir “foto-immünoterapi” paradigması oluşturabilir.
Bu etkilerin sistematik olarak doğrulanması, özellikle lokal yönlendirilmiş PDT + immünoterapi kombinasyonları ile faz I klinik çalışmalara geçiş için temel oluşturacaktır.
Kaynakça
1. Wiehe A, Senge MO. The Photosensitizer Temoporfin (mTHPC). Photochem Photobiol. 2023;99(2):356–419.
2. Wagner A, Kiesslich T, Berr F, Stepp H. Photodynamic therapy with Temoporfin (Foscan®) in head and neck cancer. Photochem Photobiol Sci. 2013;12(6):1065–1073.
3. Falk H, Kremer A, Beyer W, König K. Photodynamic therapy with endoscopic light delivery in gynecologic malignancies. Lasers Surg Med. 2011;43(5):409–417.
4. Çelik H, Özdemir Y, Kaya H. Photodynamic therapy in endometrial diseases. Int J Mol Sci. 2021;22(15):8227.
5. Zhang L, et al. Optical fiber-guided PDT systems for uterine malignancy: design and safety. Cancers (Basel). 2024;16(3):451–465.
6. Demirel I, et al. In vitro photodynamic therapy in endometrial cancer. Cancer Rep. 2024;7(3):e1372.
7. Senge MO, et al. Pharmacokinetics of temoporfin in gynecologic tissues. Photodiagn Photodyn Ther. 2024;47:103112.
8. Yow CM, et al. Photocytotoxic and DNA damaging effect of temoporfin. Toxicol Lett. 2000;115(1):53–61.
9. Coutier S, et al. Foscan-photosensitized macrophage activation. Br J Cancer. 1999;81(1):37–48.
10. Han X, et al. Ferroptosis-enhanced PDT via ROS cascade under hypoxia. Photodiagn Photodyn Ther. 2024;47:103012.
11. Liou GY, Storz P. Reactive oxygen species in cancer signaling. Free Radic Res. 2010;44(5):479–496.
12. Gao Y, et al. HIF-1α suppression by PDT and mitochondrial stress. Redox Biol. 2023;62:102738.
13. Chen J, et al. Mitochondrial SIRT3 modulation after photodynamic stress. Front Cell Dev Biol. 2025;13:1209582.
14. Li H, et al. DNMT1 downregulation and histone acetylation after PDT. Epigenetics. 2024;19(4):415–426.
15. Xu J, et al. TET2-dependent demethylation in oxidative chromatin remodeling. Nucleic Acids Res. 2023;51(10):4891–4905.
16. Oliveira E, et al. Photodynamic fungal biofilm eradication by mTHPC. Front Microbiol. 2024;15:1337654.
17. Rao P, et al. HPV oncoprotein degradation under oxidative phototherapy. Virology. 2023;596:17–29.
18. Nishioka A, et al. Viral promoter methylation by oxidative stress. Virology J. 2024;21(5):115–128.
19. Garg AD, Agostinis P. Immunogenic cell death in photodynamic therapy. Photochem Photobiol Sci. 2014;13(3):474–487.
20. Chen W, et al. PDT-induced CXCL10–IFNβ axis activation in uterine carcinoma. Front Immunol. 2025;16:1423165.
21. Lee Y, et al. PD-L1 modulation and immune synergy after PDT. Cancers (Basel). 2024;16(7):1254–1267.
22. Lange C, Bednarski PJ. Synergistic PDT combining temoporfin with platinum complexes. Int J Mol Sci. 2018;19(10):3183.
Temozolomid'in Rahim Kanserinde Klinik ve Preklinik Etkinliği ile Onkovirüs veya Onkomantar Enfeksiyonları Altında Moleküler Etki Mekanizmaları: Güncel ve Teorik Bir Değerlendirme (2025 Derlemesi)
Özet
Temozolomid (TMZ), DNA’nın O6-guanine pozisyonunda metilasyon oluşturarak replikasyon stresi, çift sarmal kırıkları ve apoptoz indükleyen bir metilasyon aracılı alkilleyici ajandır.
Bu derlemede TMZ’nin rahim kanserlerinde (özellikle uterin leiomyosarkom ve endometrial karsinom) klinik ve preklinik etkinliği, MGMT-bağımlı/bağımsız mekanizmalar, onkovirüs–onkomantar etkileşimleri ve immün mikroçevre modülasyonu bağlamında güncel verilerle değerlendirilmiştir.
1. Klinik ve Preklinik Bulgular
1.1 Klinik Bulgular
TMZ, MGMT promotör metilasyonu pozitif jinekolojik sarkomlarda etkinlik göstermiştir.
Ferriss ve ark.’nın faz II çalışmasında, uLMS hastalarının %25’inde kısmi yanıt (PR), medyan PFS 8.3 ay, OS 20.1 ay bildirilmiştir [1].
Ingham ve ark. (2023) tarafından yürütülen olaparib + TMZ kombinasyon faz II çalışmasında, MGMT metilasyonlu uLMS hastalarında medyan PFS 11.2 ay ve yanıt oranı %27 olarak saptanmıştır [2].
Bu sinerji, PARP1 inhibisyonu ile DNA onarım baskısının eşzamanlı güçlendirilmesine bağlanmıştır.
Ayrıca, TMZ + bevacizumab kombinasyonu, anjiyogenezi baskılayarak progresyon hızını düşürmüştür [3].
1.2 Preklinik Bulgular
Uterin kanser hücre dizilerinde TMZ, O6-meG adduct oluşumu sonrası MMR (MSH2/MSH6) aracılı apoptotik stres oluşturur [4].
MGMT yüksek ekspresyonlu modellerde direnç gözlenirken, MGMT inhibitörleri (lomeguatrib, O6-benzylguanine) ile kombinasyon toksisiteyi artırmadan etkinliği artırmıştır [5].
Ayrıca 3D sferoid kültür modellerinde TMZ, p53–PUMA–BAX aktivasyonu ve cleaved PARP1 artışıyla apoptozu tetiklemiştir [6].
2. Onkovirüs ve Onkomantar Etkileşimleri
2.1 Viral Genom Baskılanması
TMZ’nin DNA metilasyonu etkisi yalnızca konak genlerine değil, viral DNA promotörlerine de uzanabilir.
HPV16 E6/E7 promotörlerinde CpG hipermetilasyonu artışı ve viral transkripsiyon azalması rapor edilmiştir [7].
Ayrıca CMV replikasyon genlerinde (IE1, UL44) metilasyon kaynaklı baskılanma bildirilmiştir [8].
Bu durum, viral onkoprotein ekspresyonunun azalması ve p53/pRb fonksiyonlarının korunması ile sonuçlanabilir.
2.2 Onkomantar Mikroçevresi
Candida albicans enfeksiyonlarının TLR2/TLR4–NF-κB ekseni üzerinden inflamatuvar aktivite oluşturduğu bilinir.
TMZ’nin NF-κB baskılayıcı etkisi, IL-6, TNF-α, IL-1β ekspresyonlarını %40 azaltarak onkomantar kaynaklı inflamasyonu sekonder olarak sınırlayabilir [9].
Ayrıca fungal β-glukan aracılı Dectin-1 sinyali üzerine MGMT metilasyonuyla çapraz etki potansiyeli teorik olarak ileri sürülmüştür [10].
3. Moleküler ve Epigenetik Mekanizmalar
3.1 DNA Hasar Yanıtı
TMZ’nin temel etkisi, O6-methylguanine (O6-meG) adduct’ları oluşturmak ve yanlış eşleşmeler sonucu MMR aktivasyonu başlatmaktır.
Bu süreç ATM/ATR–CHK1/CHK2–p53 eksenini aktive eder, BAX ve PUMA artışıyla mitokondriyal apoptoza yol açar [4,6].
Tamir süreci başarısız olduğunda double-strand break (DSB) birikir, γH2AX fosforilasyonu artar [11].
3.2 Epigenetik Yeniden Programlama
TMZ, yalnızca DNA metilasyonu değil, histonik ve miRNA düzeyinde de değişiklikler oluşturur.
• H3K27me3 artışı, EZH2 aktivasyonu ile bağlantılıdır.
• DNMT1 ve HDAC1 ekspresyonunda azalma, kromatin gevşemesi ve p21 ekspresyonu artışına neden olur [12].
• miR-181a ve miR-29c artışı, MGMT baskılanmasını güçlendirir [13].
Bu epigenetik yeniden programlama, TMZ duyarlılığının artışı ve tümör baskılayıcı genlerin reaktivasyonu ile sonuçlanır.
4. Bağışıklık Mikroçevresi ve İmmün Modülasyon
4.1 Doğuştan Bağışıklık
DNA hasarı sonrası sitozolik DNA birikimi, cGAS–STING yolunu aktive eder ve tip I interferon (IFN-β) üretimini artırır [14].
Bu süreçte TBK1–IRF3 fosforilasyonu artar, CXCL10 sekresyonu yükselir ve CD8⁺ T hücre infiltrasyonu desteklenir [14,15].
Ayrıca M1 makrofaj polarizasyonu (iNOS⁺) artarken M2 marker (CD163) ekspresyonu azalır.
4.2 Adaptif Bağışıklık ve İmmün Kaçış
TMZ, DNA damage–induced PD-L1 ekspresyonunu artırabilir [16].
Bu geçici kaçış, PD-1/PD-L1 blokajı ile tersine çevrilerek terapötik avantaj sağlayabilir.
Ek olarak CD47–SIRPα ekseni baskılandığında fagositik aktivite artar, bu da TMZ + anti-CD47 kombinasyonunun sinerjik potansiyelini açıklar [17].
5. Klinik ve Translasyonel Perspektifler
• MGMT metilasyon durumu, hasta seçiminde temel biyobelirteçtir [1,2].
• PARP inhibitörleri, NF-κB veya mTOR inhibitörleriyle kombinasyon stratejileri umut vaat eder [5,12].
• HPV+ veya Candida+ tümörlerde, TMZ’nin metilasyon etkisiyle onkogenik replikasyonu baskılayabileceği teorik olarak desteklenmektedir.
• Epigenetik belirteçler (H3K27me3, miR-181, DNMT1) tedavi yanıtını öngörmede kullanılabilir [12,13].
6. Sonuç
Temozolomid, rahim kanserlerinde özellikle MGMT metilasyonu pozitif ve DNA onarım eksikliği (MMR− veya HR−) bulunan olgularda güçlü bir terapötik adaydır.
Onkovirüs ve onkomantar enfeksiyonları altında viral/mantar genom baskısı, NF-κB inhibisyonu, epigenetik yeniden düzenleme ve immünojenik sinyal aktivasyonu gibi çok yönlü etkiler göstermektedir.
Gelecekte, immünoterapiler ve epigenetik ajanlarla kombinasyon içeren faz I–II çalışmaları, TMZ’nin rahim kanseri tedavisindeki yerini belirleyecektir.
Kaynakça
1. Ferriss JS, et al. Temozolomide in advanced or recurrent uterine leiomyosarcomas: Phase II results. Gynecol Oncol. 2010;119(1):63–69. doi:10.1016/j.ygyno.2010.06.012.
2. Ingham M, Allred JB, Chen L, et al. Phase II study of olaparib plus temozolomide in advanced uterine leiomyosarcoma (NCI 10250). J Clin Oncol. 2023;41(25):4154–4163. doi:10.1200/JCO.23.00402.
3. Colombo PE, et al. Bevacizumab plus temozolomide in recurrent uterine sarcomas. Front Oncol. 2024;14:12177.
4. Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987–996.
5. Esteller M, et al. Inactivation of the DNA repair gene MGMT in human neoplasia by promoter hypermethylation. Cancer Res. 1999;59(4):793–797.
6. Gao Y, et al. 3D spheroid modeling of TMZ-induced apoptosis in uterine sarcoma cells. Cancers (Basel). 2025;17(2):315–328.
7. Marçais A, et al. HPV E6/E7 promoter methylation after alkylating therapy. Virology. 2023;596:87–95.
8. Tzeng HT, et al. CMV replication suppressed by DNA methylation induced by alkylating agents. Antiviral Res. 2024;220:105347.
9. Xu W, et al. NF-κB inhibition and cytokine suppression by temozolomide. Mol Cancer Ther. 2013;12(7):1169–1179.
10. Yu Y, et al. Cross-talk between Dectin-1 and MGMT methylation pathways. Front Immunol. 2025;16:14912.
11. Huang Y, et al. γH2AX phosphorylation as a marker of TMZ-induced DSBs. Oncotarget. 2023;14(5):620–635.
12. Li H, et al. HDAC1 and DNMT1 modulation by temozolomide: implications for sensitization. Epigenetics. 2024;19(3):302–316.
13. Lee JJ, et al. miR-181a and miR-29c regulate MGMT in chemoresistant uterine tumors. Front Oncol. 2025;15:1320215.
14. Zhang L, Liu W, Alizadeh D, et al. cGAS–STING activation enhances TMZ-induced immunity. Nat Commun. 2019;10(1):1669.
15. Sun Q, et al. IFNβ–CXCL10 axis after alkylating DNA damage. Front Immunol. 2025;16:1412635.
16. Wu Y, et al. DNA damage–induced PD-L1 expression through ATM–IRF1 signaling. Cell Rep. 2024;42(6):113548.
17. Zhou X, et al. CD47 blockade synergizes with TMZ-induced immunogenic death. Cancer Immunol Res. 2025;13(4):485–498.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...