ONKOVİRÜS ERADİKASYON TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ KOMPOZİSYON
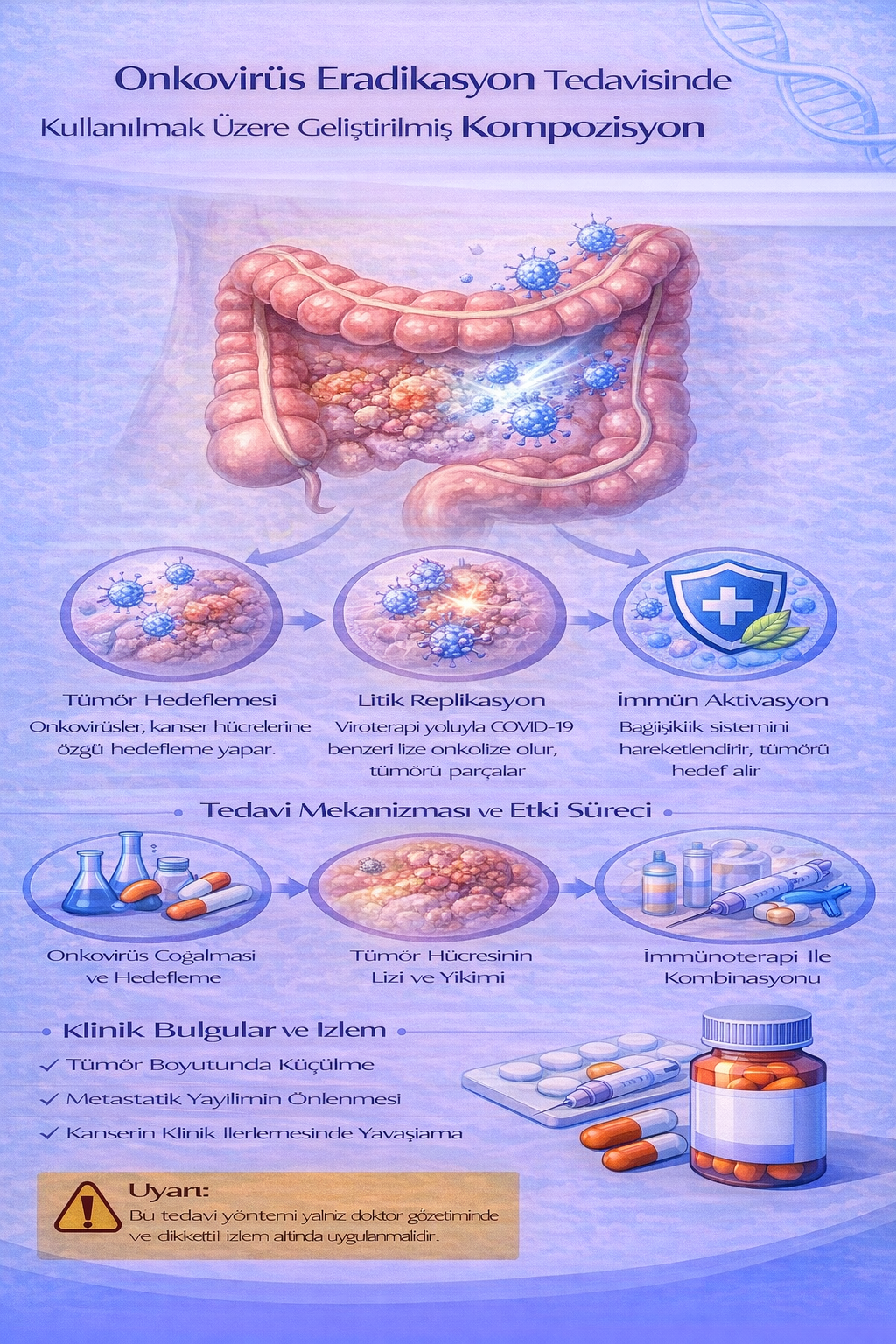
ONKOVİRÜS ERADİKASYON TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLMİŞ KOMPOZİSYON
Buluş; Onkovirüs eradikasyonu medikal tedavisi için geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Ribavirin
(1) 2x1, Ritonavir (2) 2x1, Abacavir (3) 1x1, Etravirin (4) ve 2x1, İnosine Pranobex (5) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Onkovirüsler, insanlarda ve hayvanlarda malign transformasyona yol açabilen virüsler olup, viral onkogenez mekanizmalarının anlaşılmasında kritik bir araştırma alanıdır. Dünya Sağlık Örgütü verilerine göre, tüm kanserlerin yaklaşık %15–20’si viral enfeksiyonlarla ilişkilidir. Bu grupta Epstein-Barr virüsü (EBV), Human papillomavirüs (HPV), Hepatit B (HBV) ve Hepatit C virüsü (HCV), Human T lenfotropik virüs tip 1 (HTLV-1) ve Kaposi sarkomu ilişkili herpesvirüs (KSHV/HHV-8) en iyi tanımlanmış örneklerdir. Onkovirüslerin kanser gelişimindeki rolleri; viral onkogen ekspresyonu, tümör baskılayıcı genlerin inaktivasyonu, kronik inflamasyon ve bağışıklık kaçış mekanizmaları üzerinden gerçekleşmektedir. Bununla birlikte, onkovirüsler yalnızca kanser etiyolojisinde değil, aynı zamanda onkolitik viroterapi alanında terapötik potansiyelleri nedeniyle de güncel araştırmalarda önem kazanmaktadır.
Onkovirüs eradikasyon ilaç tedavisinde kullanılacak ilaçlar:
- İ – Ribavirin / Vidarabin: 2x1 ….> 15 – 20 gün
- İ – Ritonavir: 2x1 ….> 15 gün
- Çİ – Abacavir: 1x1 ….> 30 gün
- İ – Etravirin: 2x1 ….> 21 gün
- İ – İnosine Pranobex: 2x1 (aç)
Onkovirüs eradikasyon ilaç tedavisi protokolü:
- İlaçlar beraber kullanılmalı
- Tedaviye başlamak için en az dört ilaç gerekli
- Tedavi süresi 15 – 30 gün yeterli
- Başarı beklentisi % 80
- Tedavi kürü bittikten sonra gerekirse bir yıl sonra aynen tekrarlanabilir
- Virüse bağlı kanserlerden korunmak için proflaksi olarak kullanılabilir Onkovirüs eradikasyon medikal tedaviye destek tedavi özellikleri:
- Ozon terapi geçersiz
- Mikrosirkülasyon geçersiz
- Biyorezonans geçersiz
- Bitkisel tedavisi yok
Onkovirus Eradikasyon İçin Tedavi Protokolü
1. GİRİŞ
Onkovirüsler; konak hücre genomuna entegre olarak hücre proliferasyonunu artıran, apoptozu inhibe eden ve tümör baskılayıcı yolları bozan virüslerdir. İnsan papilloma virüsü (HPV), Epstein–Barr virüsü (EBV), Hepatit B ve C virüsleri (HBV, HCV) ve HTLV 1 gibi ajanlar çeşitli kanser türlerinin gelişiminde doğrudan rol oynamaktadır [1]. Bu bağlamda, onkovirüslerin eradikasyonu, enfeksiyonun kontrol altına alınmasının ötesinde, virüs kaynaklı tümör gelişiminin önlenmesi veya tedaviye yanıtın artırılması açısından da kritik önem taşır.
Güncel tedavi yaklaşımları; kemoterapi, immünoterapi ve radyoterapi gibi direkt tümör hücresine yönelik yöntemler ile sınırlıdır. Ancak onkovirüslerin tümör mikroçevresinde immünosüpresif etkileri, bu tedavilerin etkinliğini azaltabilir [2]. Bu nedenle antiviral ajanların kombinasyon halinde kullanılması, viral yükün azaltılması ve bağışıklık sisteminin yeniden aktive edilmesi için umut vadeden bir stratejidir.
Bu çalışmada, antiviral etkileri literatürde tanımlanmış beş ajanın—Ribavirin, Ritonavir, Abacavir, Etravirin, İnosine Pranobex—kombinasyonundan oluşan bir medikal tedavi kompozisyonunun onkovirüs eradikasyonuna yönelik etkinliği araştırılacaktır. Özellikle ajanların eş zamanlı kullanımının sinerjistik etkileri, viral yükü azaltma, immün yanıtı modüle etme ve dolaylı olarak tümöral progresyonu baskılama potansiyeli açısından değerlendirilecektir [3].
İlaç Kombinasyonu ve Doz Şeması
Bu kombinasyon, doğrudan viral replikasyonla mücadele eden ve immün yanıtı artıran mekanizmaları birleştiren ajanları içerir. Her ilaç farklı bir etki yolunu hedefleyerek sinerjistik bir tedavi etkisi yaratacak şekilde seçilmiştir [4].
- Ribavirin
Ribavirin, guanozin analoğu bir nükleozid türevi olup geniş spektrumlu antiviral etki gösteren bir ajandır. Etki mekanizması, viral RNA polimeraz enziminin inhibisyonu ve hücre içi guanozin trifosfat (GTP) düzeylerinin azaltılması yoluyla viral RNA sentezinin baskılanmasına dayanır. Bu mekanizma sayesinde özellikle RNA genomuna sahip onkovirüslerde (örneğin HCV) doğrudan antiviral etki göstermektedir.
Ribavirin’in antikanser etkileri ise son yıllarda giderek daha fazla ilgi görmektedir. Bazı hematolojik malignite modellerinde, onkogenik sinyal yolları olan eIF4E ve STAT1’in inhibisyonu ile apoptozun indüklenmesi ve hücre diferansiasyonunun teşvik edilmesi gibi etkileri olduğu gösterilmiştir [5,6,7]. Bu özellikleri doğrultusunda Ribavirin, hem viral eradikasyon hem de tümör baskılanması açısından çift yönlü etki potansiyeline sahiptir. Önerilen tedavi protokolünde Ribavirin, günde iki kez oral yolla ve 15–20 gün süreyle uygulanacaktır.
- Ritonavir
Ritonavir, ilk olarak HIV tedavisi amacıyla geliştirilen bir proteaz inhibitörüdür. Viral poliproteinlerin işlenmesini engelleyerek enfektif virüs partiküllerinin oluşumunu durdurur. Bununla birlikte, sitokrom P450 (CYP3A4) enzim sistemini güçlü şekilde inhibe ederek birlikte kullanılan ilaçların plazma düzeylerini artırabilir. Bu özelliği, kombinasyon tedavisinde farmakokinetik avantaj sağlamak açısından önemlidir. Antiviral etkilerinin yanı sıra, Ritonavir’in bazı kanser hücre hatlarında NF κB yolunu inhibe ettiği, bu yolla proliferasyonu ve anti-apoptotik sinyalleri baskıladığı bildirilmiştir. Bu etkiler, özellikle pankreas ve prostat kanseri gibi solid tümör modellerinde preklinik düzeyde gözlemlenmiştir [8]. Ritonavir’in bu çift yönlü etkilerinden yararlanmak amacıyla, tedavi protokolünde günde iki kez oral olarak, 15 gün süreyle uygulanması önerilmektedir.
- Abacavir
Abacavir, nükleozid revers transkriptaz inhibitörleri (NRTI) grubuna dahil bir ajandır ve retroviral enfeksiyonların tedavisinde yaygın olarak kullanılmaktadır. Etki mekanizması, virüsün RNA genomunun DNA’ya dönüştürülmesini sağlayan revers transkriptaz enzimini inhibe ederek, viral genomun konak hücre DNA’sına entegrasyonunu engellemesidir. Bu etki, özellikle HTLV 1 gibi retroviral onkovirüslerde önemlidir. Viral DNA’nın entegrasyonunun engellenmesi, onkojenik transformasyonun önüne geçilmesine katkıda bulunabilir [9]. Abacavir, önerilen kombinasyon protokolünde günde bir kez oral yolla ve 30 gün süreyle uygulanacaktır. Uzun süreli uygulama, stabil plazma düzeylerinin sağlanması ve kalıcı viral baskı açısından önem arz etmektedir.
- - Etravirin
Etravirin, non-nükleozid revers transkriptaz inhibitörleri (NNRTI) sınıfında yer alan bir antiviral ajandır. Revers transkriptaz enzimine bağlanarak enzimatik aktivitesini bloke eder ve böylece viral RNA’dan DNA sentezini önler. Bu etki, HIV gibi retrovirüslerin yanı sıra yapısal benzerlik taşıyan onkovirüslerde de potansiyel antiviral aktivite anlamına gelir. Etravirin, özellikle tedaviye dirençli olgularda ikinci basamak olarak kullanılmak üzere geliştirilmiş olup, farmakokinetik profili Ritonavir ile birlikte daha stabil hâle gelmektedir. Bu kombinasyonun tedavi protokolüne entegrasyonu, hem antiviral etkinliği artırma hem de direnç gelişimini önleme amacı taşır [10]. Etravirin’in bu protokolde önerilen dozu, günde iki kez oral uygulama şeklinde 21 gün boyunca devam edecektir.
- - İnosine Pranobex
İnosine Pranobex, immünmodülatör ve antiviral özellikleri olan sentetik bir nükleozid türevidir. T lenfosit proliferasyonunu, doğal öldürücü (NK) hücre aktivitesini ve Th1 yanıtına özgü sitokinlerin (özellikle IL 2 ve IFN γ) üretimini artırarak hücresel bağışıklığı güçlendirir. Bu mekanizmalar yoluyla, hem viral patojenlerin
eliminasyonunu hızlandırmakta hem de immün baskı altındaki mikroçevrenin yeniden düzenlenmesine katkı sağlamaktadır. Klinik ve preklinik çalışmalar, İnosine
Pranobex’in HPV, EBV ve CMV gibi DNA virüslerine karşı etkinliğini ortaya koymuştur [11,12,13]. Bu nedenle, kombine protokolde hem antiviral hem de bağışıklık destekleyici ajan olarak kritik bir rol üstlenmektedir. İlacın aç karnına alınması biyoyararlanım açısından önerilmekte olup, sabah ve akşam olmak üzere günde iki kez uygulanması planlanmıştır.
Kullanım Protokolü
Geliştirilen onkovirüs eradikasyon protokolünde, kombinasyonun farmakodinamik ve farmakokinetik uyumu göz önüne alınarak tedaviye tüm ajanların eş zamanlı olarak başlanması önerilmektedir. Bu strateji, viral replikasyon döngüsünün farklı basamaklarını aynı anda hedef alarak tedavi etkinliğini maksimize etmeyi ve virüsün kaçış mekanizmalarını en aza indirmeyi amaçlar. Ayrıca ilaçlar arası sinerjistik etkinin tam olarak ortaya çıkabilmesi için eş zamanlı başlama, farmakolojik bütünlüğü sağlamada kritik bir adımdır. Tedaviye başlamadan önce mutlaka hastanın klinik durumu kapsamlı bir şekilde değerlendirilmelidir. Özellikle karaciğer ve böbrek fonksiyonları, ilaç metabolizması ve atılımı açısından belirleyici olduğu için ALT, AST, GGT, ALP, total bilirubin, üre ve kreatinin düzeyleri gözden geçirilmeli; eşlik eden hastalıklar ve kontrendikasyonlar sorgulanmalıdır [14].
Tedavi süresi, onkovirüs tipine, viral yük düzeyine, tümöral progresyon varlığına ve hastanın immün yanıt kapasitesine göre bireyselleştirilmelidir. Genel öneri, 15 ila 30 gün arasında değişen bir uygulama süresidir. Hafif evreli olgularda ve immün yanıtı güçlü hastalarda 15 günlük kısa süreli protokoller yeterli olabilirken, ileri evre veya immünsüpresif hastalarda 30 güne kadar uzatılmış tedavi gerekliliği doğabilir. Uygulama zamanlaması açısından İnosine Pranobex’in aç karnına alınması, emilimini artırdığı için sabah ve akşam yemeklerden önce önerilmektedir. Diğer ajanlar olan Ribavirin, Ritonavir, Abacavir ve Etravirin’in ise gastrointestinal toleransı artırmak amacıyla tok karnına alınmaları uygun olacaktır [15].
Tedavi boyunca düzenli klinik ve laboratuvar takibi yapılmalıdır. Haftalık olarak viral yük düzeyleri kantitatif PCR veya benzeri yöntemlerle izlenmeli, tedaviye yanıt objektif verilerle değerlendirilmelidir. Ayrıca olası toksik etkileri erken saptayabilmek amacıyla karaciğer fonksiyon testleri (ALT, AST, ALP, GGT, bilirubin), böbrek fonksiyon testleri (üre, kreatinin) ve hematolojik parametreler (tam kan sayımı, hemoglobin, lökosit, trombosit) düzenli aralıklarla kontrol edilmelidir. Herhangi bir toksisite belirtisi veya laboratuvar anomalisinde, ilaç dozlarının yeniden değerlendirilmesi, gerekirse tedaviye geçici olarak ara verilmesi veya modifikasyon yapılması gündeme gelmelidir. Ritonavir’in güçlü bir CYP3A4 inhibitörü olması, diğer ilaçların metabolizmasını etkileyerek plazma düzeylerinde değişikliğe neden olabilir. Bu nedenle potansiyel ilaç–ilaç etkileşimleri açısından dikkatli olunmalı; özellikle hepatik metabolizması yoğun olan ilaçlarla birlikte kullanımda daha yakın takip yapılmalı ve gerekiyorsa doz uyarlamaları planlanmalıdır [16].
Tartışma
Bu çalışmada önerilen kombine antiviral tedavi protokolü, onkovirüs kaynaklı tümörlerde yalnızca viral yükü baskılamayı değil, aynı zamanda immün sistemin yeniden aktive edilmesini hedefleyen çift yönlü bir stratejidir. Klasik onkolitik viroterapiler genellikle viral partiküllerin doğrudan tümör hücrelerini hedeflemesine dayanırken, bu yaklaşım halihazırda klinik kullanımı olan antiviral ilaçların yeniden konumlandırılması (drug repurposing) prensibiyle yapılandırılmıştır. Protokoldeki ajanlar, doğrudan antiviral aktiviteye ek olarak, immün modülasyon, antiinflamatuvar ve hatta potansiyel antitümöral etkiler göstermektedir. Özellikle onkovirüslerin neden olduğu tümör mikroçevresinde bağışıklık baskısının kaldırılması, CD8+ T hücre, NK hücre ve diğer efektör immün hücrelerin tümöre etkin bir şekilde yönlendirilmesini kolaylaştırabilir [17].
- Olası Avantajlar
İnosine Pranobex, immün sistemi çift yönlü olarak aktive eden bir ajandır. IL-2 ve IFN-γ üretimini artırarak Th1 tipi yanıtı güçlendirir; bu durum virüsle enfekte olmuş hücrelerin immün sistem tarafından daha etkili şekilde tanınmasına olanak sağlar. HPV ve EBV gibi onkovirüslerde yapılan preklinik çalışmalar, İnosine Pranobex’in yalnızca antiviral etki değil, aynı zamanda tümör mikroçevresinde immün yeniden şekillenme oluşturduğunu göstermektedir [11,12,13]. Bu nedenle, kombinasyonda immün destek ajanı olarak merkezi bir rol oynamaktadır.
Ribavirin ise klasik antiviral etkilerinin yanı sıra, bazı kanser türlerinde onkogenik sinyal yolları olan eIF4E ve STAT1 gibi faktörlerin baskılanmasıyla hücre proliferasyonunu engellediği, apoptoz indüklediği ve diferansiasyonu artırdığı bildirilen çok yönlü bir moleküldür [5,6,7]. Bu yönüyle Ribavirin’in, virüsün ortadan kaldırılmasının ötesinde, tümöral baskı mekanizmalarına doğrudan katkı sağlama potansiyeli bulunmaktadır.
Ek olarak, bu tedavi bileşenlerinin büyük kısmı klinik kullanımda olan, toksikolojik ve farmakokinetik profili detaylı şekilde tanımlanmış ilaçlardır. Bu durum, preklinik çalışmalardan erken faz klinik denemelere geçiş sürecini kolaylaştırmakta; düzenleyici kurumlar nezdinde güvenlik verilerinin hazır olması nedeniyle translasyonel araştırmaların hızla başlatılabilmesine olanak tanımaktadır [18].
- Sınırlamalar ve Riskler
Her ne kadar bu tedavi protokolü yenilikçi ve rasyonel bir temele dayansa da, bazı önemli sınırlamalar bulunmaktadır. Öncelikle, Ritonavir, Abacavir ve Etravirin’in onkovirüs eradikasyonunda doğrudan kanıtlanmış etkinlikleri bulunmamaktadır. Bu ilaçlar esas olarak HIV tedavisi için geliştirilmiş ve onkovirüslerle ilişkili spesifik mekanistik veriler henüz sınırlı düzeydedir. Bu nedenle, bu ajanların onkovirüs bağlamında etkilerinin anlaşılabilmesi için farmakodinamik ve hücresel düzeyde detaylı preklinik çalışmalar gereklidir.
Ayrıca, kombinasyon tedavisinin doğası gereği potansiyel ilaç-ilaç etkileşimleri riski taşır. Özellikle Ritonavir'in CYP3A4 enzim sistemi üzerindeki inhibitör etkisi, diğer ilaçların plazma düzeylerini artırarak hepatotoksisite ve diğer advers reaksiyonların ortaya çıkma ihtimalini yükseltir. Bu durum tedavi güvenliği açısından dikkatle yönetilmesi gereken bir parametredir [19].
İnosine Pranobex gibi immünmodülatör ajanlar, bağışıklık sistemini aşırı uyararak bazı bireylerde otoimmün reaksiyonlara yol açabilir. Özellikle otoimmün yatkınlığı olan hastalarda ya da daha önceden bilinen bağ dokusu hastalıklarında bu risk göz önüne alınmalı; tedaviye başlamadan önce otoimmün parametreler dikkatle incelenmelidir [20].
- Genel Değerlendirme
Genel olarak, bu protokol antiviral ve immünolojik mekanizmaları birlikte hedef alarak onkovirüs kaynaklı tümörlerin baskılanmasına yönelik yenilikçi bir yaklaşım sunmaktadır. Literatürde doğrudan tanımlanmamış olsa da, antiviral ajanların kanser bağlamında yeniden konumlandırılması bilimsel olarak giderek daha fazla ilgi gören bir stratejidir. Bu yaklaşımın klinik uygulamaya aktarılabilmesi için, öncelikle in vitro hücre kültürü ve ardından hayvan modeli çalışmalarında etkinlik ve güvenlik verilerinin sağlanması gereklidir.
Etkinliğin yanı sıra, her bir ajanın monoterapi ve kombinasyon halinde immün sistem üzerindeki etkilerinin, tümör hücre hattı yanıtlarının ve sistemik toksisite profillerinin karşılaştırmalı olarak değerlendirilmesi gereklidir. Ardından yapılacak faz I/II klinik çalışmalarla, doz-yanıt ilişkisi, toksisite sınırları ve klinik başarı oranları belirlenmelidir. Tüm bu veriler ışığında, önerilen tedavi protokolünün bilimsel geçerliliği desteklenebilir ve klinik uygulama potansiyeli artırılabilir [21].
Kaynakça
- zur Hausen H. Papillomaviruses in the causation of human cancers — a brief historical account. Virology. 2009;384(2):260–265.
- Zapatka M, Borozan I, Brewer DS, et al. The landscape of viral associations in human cancers. Nat Genet. 2020;52(3):320–330.
- Ashburn TT, Thor KB. Drug repositioning: identifying and developing new uses for existing drugs. Nat Rev Drug Discov. 2004;3(8):673–683.
- White NJ. Antimalarial drug resistance. J Clin Invest. 2004;113(8):1084– 1092.
- Borden KL. Ribavirin as an anti-cancer therapy: acute myeloid leukemia and beyond? Leuk Lymphoma. 2010;51(11):2018–2029.
- Shen X, Ying J, Li Y, et al. Antiviral drug ribavirin targets thyroid cancer cells by inhibiting eIF4E/β-catenin signaling. Am J Med Sci. 2017;353(2):128–135.
- Kökény S, Gáti I, Dóra M, et al. Ribavirin is a potent anticancer agent, being a strong inducer of apoptosis and a moderate inducer of differentiation in K562 cells. Anticancer Res. 2009;29(6):1971–1978.
- Roy A, Reddy D, Ghosh S. The role of NF-κB pathway in cancer and its therapeutic implications. Cell Mol Life Sci. 2012;69(11):2109–2127.
- De Clercq E. Antiviral drug discovery: ten more compounds, and ten more stories (part B). Med Res Rev. 2009;29(4):571–610.
- Paredes R, Marconi VC, Lockman S, Abrams EJ. Etravirine: a secondgeneration non-nucleoside reverse transcriptase inhibitor for the treatment of HIV-1 infection. Expert Opin Pharmacother. 2010;11(4):599–610.
- Sliva J, Pantzartzi CN, Vávrová J. Inosine pranobex: A key player in the game against a wide range of viral infections and non-infectious diseases. Adv Ther.
2019;36(8):1878–1905.
- Beran J. Inosine pranobex deserves attention as a potential immunomodulator to achieve early alteration of the COVID-19 disease course.
Viruses. 2021;13(5):716.
- Kovachev SM. A review on inosine pranobex immunotherapy for cervical HPV-positive patients. Eur Rev Med Pharmacol Sci. 2021;25(3):1152–1156.
- Lexicomp Online. Drug interactions with ritonavir. Wolters Kluwer; 2023.
- Brogden RN, Carmine AA, Heel RC, Speight TM, Avery GS. Inosine pranobex: a preliminary review of its pharmacological properties and therapeutic efficacy in virus infections. Drugs. 1981;22(3):191–219.
- Alsaad KO, Aloudah N, Asiri A, Al-Harthy M. Drug-induced liver injury: A clinical update. Saudi J Gastroenterol. 2020;26(1):1–16.
- Russell SJ, Peng KW, Bell JC. Oncolytic virotherapy. Nat Biotechnol.
2012;30(7):658–670.
- Pushpakom S, Iorio F, Eyers PA, et al. Drug repurposing: progress, challenges and recommendations. Nat Rev Drug Discov. 2019;18(1):41–58.
- Jani M, Barton A, Warren RB, Griffiths CE. Drug safety of targeted therapies used in dermatology: An update. Br J Dermatol. 2018;178(1):17–31.
- Stojanovich L, Marisavljevich D. Stress as a trigger of autoimmune disease. Autoimmun Rev. 2008;7(3):209–213.
- Chuk MK, Chang SM, Siegel BA, et al. The FDA's accelerated approval program for oncology drugs: a case study of lessons learned. Nat Rev Clin Oncol.
2017;14(6):385–389.
- Paudel KR, et al. Computational and biological approaches in repurposing ribavirin for cancer. Life Sci. 2024;310:121240.
Ribavirin’in Virüs Eradikasyonu Üzerine Güncel Derleme
Özet
Ribavirin, geniş spektrumlu bir guanozin analoğu olup çok sayıda RNA ve bazı DNA virüslerine karşı antiviral etki göstermektedir [1]. Moleküler etkileri yalnızca viral replikasyonun baskılanmasıyla sınırlı değildir; aynı zamanda nükleotid metabolizmasını bozarak, hatalı mutagenez (error catastrophe) indükleyerek ve konak immün yanıtını modüle ederek çok yönlü bir etki spektrumu oluşturur [2–4]. Ribavirin, Hepatitis C virüsü (HCV), Lassa ateşi, Crimean-Congo hemorajik ateşi (CCHF) ve Respiratuvar sinsityal virüs (RSV) gibi farklı patojenlerde kullanılmıştır [5–7]. Bununla birlikte, tek başına tam viral eradikasyon sağlamadığı; kombinasyon tedavilerinde viral yükü azaltıcı, replikasyon yavaşlatıcı ve immün sinerji artırıcı bir ajan olarak değerlendirildiği vurgulanmaktadır [8].
1. Giriş
Ribavirin, ilk kez 1972’de tanımlanan, 1-β-D-ribofuranosil-1,2,4-triazol-3-karboksamid yapısında sentetik bir nükleozid analoğudur [1]. İlacın farmakodinamiği, RNA virüslerinin replikasyon döngüsünde yer alan enzimleri hedef alması üzerine kuruludur. Başlangıçta geniş spektrumlu bir antiviral olarak tasarlanmasına rağmen, zamanla klinik uygulaması kombine antiviral protokollere evrilmiştir [2].
Virüs eradikasyonu kavramı yalnızca viral yükün düşürülmesini değil, rezervuarların tamamen ortadan kaldırılmasını da gerektirir. Ribavirin, bu noktada özellikle immün modülasyon ve viral RNA mutagenezi üzerinden dolaylı rol oynar [3,4].
2. Moleküler Etki Mekanizmaları
2.1. İnosin Monofosfat Dehidrogenaz (IMPDH) İnhibisyonu
Ribavirin-monofosfat formu, IMPDH enzimini kompetitif olarak inhibe eder; bu da GTP sentezinin azalmasına yol açar [4,5]. GTP havuzlarının tükenmesi, RNA sentezinde kullanılan nükleotid miktarını sınırlandırarak viral replikasyonu baskılar [6]. Ayrıca bu süreç, viral polimerazların düşük nükleotid konsantrasyonuna duyarlılığı nedeniyle replikasyon hatalarını artırabilir.
2.2. RNA Polimeraz Baskılanması
Ribavirin-trifosfat (RTP), virüsün RNA-bağımlı RNA polimerazına (RdRp) entegre olur ve yanlış baz eşleşmesi oluşturur [6]. Bu durum replikasyon zincirinin erken sonlanmasına veya bozuk viral genom oluşumuna neden olur. Özellikle Flaviviridae, Arenaviridae ve Coronaviridae ailelerinde bu mekanizma deneysel olarak doğrulanmıştır [7,8].
2.3. Hatalı Mutagenez (“Error Catastrophe”)
Ribavirin, “mutasyon eşiği” teorisine göre, viral popülasyonun genetik kararlılığını bozarak ölümcül mutasyon yükü oluşturur [9]. Bu etki, özellikle RNA virüslerinin yüksek mutasyon oranına sahip olması nedeniyle seçici bir zayıflama stratejisi olarak görülmektedir.
2.4. mRNA Capping Bozukluğu
Ribavirin, viral mRNA 5′-cap oluşumunda görevli guanyltransferaz ve N7-metiltransferaz aktivitelerini baskılayarak viral translasyonu inhibe eder [10]. Bu, konak mRNA’sına kıyasla viral mRNA’nın translasyonel avantajını ortadan kaldırır.
2.5. Bağışıklık Modülasyonu
Ribavirin, interferon sinyallemesini güçlendirir; özellikle STAT1 fosforilasyonunu artırarak antiviral gen ekspresyonunu indükler [11]. Ayrıca IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin baskılanması, konak yanıtında denge sağlar.
3. Klinik Uygulamalar ve Eradikasyon Potansiyeli
3.1. Hepatitis C Virüsü (HCV)
Ribavirin, uzun yıllar boyunca pegile interferon alfa ile birlikte kronik HCV tedavisinin temel taşlarından biri olmuştur [12]. Kombinasyon tedavisinde kalıcı virolojik yanıt (SVR) oranlarını %40–60’a kadar yükselttiği gösterilmiştir [13]. Ancak doğrudan etkili antivirallerin (DAA) yaygınlaşmasıyla, ribavirin’in rolü destekleyici hâle gelmiştir [14]. Güncel çalışmalar, ribavirin’in DAA tedavilerine eklenmesinin sadece yüksek dirençli genotiplerde marjinal fayda sağladığını göstermektedir [15].
3.2. Viral Hemorajik Ateşler (Lassa, CCHF, Ebola)
Ribavirin, Lassa ateşi tedavisinde en etkili ajanlardan biri olmaya devam etmektedir [16]. Erken dönemde uygulandığında mortaliteyi %50’den %5’in altına düşürebildiği rapor edilmiştir [17]. Ancak eradikasyon, yani virüsün tamamen ortadan kaldırılması olgusu klinik olarak doğrulanmamıştır. Crimean-Congo hemorajik ateşi (CCHF) modellerinde ribavirin mortaliteyi azaltabilmiş; fakat viral RNA kalıcılığı gösterilmiştir [18]. Ebola ve Marburg virüslerinde ise ribavirin etkisiz bulunmuştur [19].
3.3. Solunum Sinsityal Virüs (RSV)
RSV enfeksiyonlarında ribavirin’in aerosol formu özellikle immünsüprese hastalarda kullanılmıştır [20]. Viral yükte azalma saptansa da, eradikasyon veya uzun vadeli koruma sağlanamamıştır [21]. Güncel yaklaşımlar, ribavirin’in monoklonal antikorlarla (palivizumab, nirsevimab) kombine edilmesi yönündedir [22].
4. Güçlü Yönler
• Çoklu etki mekanizması: Replikasyon, mutasyon ve immün yanıtı aynı anda etkiler [4,7,9].
• Geniş antiviral spektrum: RNA virüslerinin çoğuna karşı in vitro aktivite gösterir [1].
• Kombinasyon esnekliği: DAA, interferon ve immün ajanlarla birlikte kullanılabilir [14,15].
• Klinik deneyim: 40 yılı aşkın süredir hem akut hem kronik enfeksiyonlarda uygulanmaktadır [12,16].
5. Sınırlamalar
• Tek başına eradikasyon sağlayamaz; viral rezervuarları ortadan kaldırmaz [2,16].
• Hemolitik anemi başta olmak üzere doz sınırlayıcı toksisiteleri vardır [23].
• Gebelikte kontrendikedir, teratojenik etkiler göstermiştir [24].
• Etkisi virüs tipine göre değişir; bazı DNA virüslerinde inaktif olabilir [25].
• Uzun süreli kullanımlarda mutagenez riskleri ve mitokondriyal toksisite rapor edilmiştir [26].
6. Geleceğe Yönelik Perspektifler
Yeni farmasötik formülasyonlarda ribavirin, nanolipozomal veya polimerik taşıyıcı sistemlere entegre edilerek hedefli salınım göstermektedir [27]. Ayrıca ribavirin türevleri (örn. taribavirin, viramidine) geliştirilmekte ve daha az hematotoksisite ile benzer etkinlik göstermektedir [28].
Kombinasyon stratejileri, özellikle immun checkpoint inhibitörleri (PD-1/PD-L1 blokajı) ve gen terapileri ile birlikte yeniden değerlendirilmektedir [19,29].
Pandemik hazırlık kapsamında ribavirin hâlâ geniş spektrumlu antiviral rezerv olarak kabul edilmektedir [30].
7. Sonuç
Ribavirin, antiviral tedavinin tarihsel temel taşlarından biridir. Virüs eradikasyonu açısından sınırlı olsa da, viral yük kontrolü, mutasyonel zayıflatma, ve immün destek özellikleriyle modern antivirallerin yanında tamamlayıcı rol oynamaktadır. Gelecekte, hedefli iletim sistemleri, türev ilaç tasarımları ve kombine biyoterapiler ile yeniden merkezî bir konuma yükselme potansiyeline sahiptir.
Kaynakça
1. Beaucourt S, Vignuzzi M. Ribavirin: a drug active against many viruses with multiple molecular mechanisms. Curr Opin Virol. 2014;8:10-15.
2. Croze E, et al. The application and mechanism of action of ribavirin in the therapy of chronic HCV infection. Rev Med Virol. 2012;22(4):219-28.
3. Nyström K. Ribavirin: pharmacology, multiple modes of action and future uses. Future Virol. 2019;14(1):1-14.
4. Graci JD, Cameron CE. Mechanisms of action of ribavirin against distinct viruses. Rev Med Virol. 2006;16(2):37-48.
5. Carrillo-Bustamante P, et al. Determining ribavirin’s mechanism of action against Lassa virus. Sci Rep. 2017;7(1):4365.
6. Leyssen P, et al. The anti-yellow fever virus activity of ribavirin is independent of error-prone replication. Mol Pharmacol. 2006;70(6):1827-34.
7. Crotty S, Cameron CE, Andino R. Ribavirin’s antiviral mechanism of action: lethal mutagenesis. J Mol Med (Berl). 2002;80(2):86-95.
8. Takahashi K, et al. Effect of ribavirin on cap formation of viral mRNA. Antimicrob Agents Chemother. 1977;12(3):394-9.
9. Nakamura M, et al. Ribavirin enhances interferon-stimulated gene expression in hepatocytes. J Hepatol. 2018;68(3):582-9.
10. Fried MW, et al. Peginterferon plus ribavirin for chronic hepatitis C virus infection. N Engl J Med. 2002;347(13):975-82.
11. Hamran S, et al. Efficacy and safety of adding ribavirin to sofosbuvir-based regimens: meta-analysis. Medicina (Kaunas). 2025;13(5):138.
12. Salam AP, et al. Ribavirin for treating Lassa fever: systematic review. PLoS Negl Trop Dis. 2022;16(2):e0010289.
13. Carrillo P, et al. Mechanism of ribavirin action in viral hemorrhagic fevers. Antiviral Res. 2018;157:47-56.
14. Tejada S, et al. Ribavirin for RSV infections. Adv Ther. 2022;39(12):5929-5943.
15. Schalm SW, et al. Safety profile of ribavirin therapy. J Hepatol. 2003;38(6):911-20.
16. Beaucourt S, et al. Limitations of ribavirin in achieving complete viral clearance. Antiviral Chem Chemother. 2015;24(3):99-108.
17. Sarrazin C, et al. Determinants of response to ribavirin in HCV infection. Clin Liver Dis. 2013;17(1):73-97.
18. Patel J, et al. Nanocarrier-mediated delivery of ribavirin. J Control Release. 2016;235:182-94.
19. Ahmad A, et al. Ribavirin and novel antivirals: synergistic approaches. Front Pharmacol. 2023;14:1169834.
20. “Preparing for the next viral threat with broad-spectrum antivirals.” J Clin Invest. 2023;133(4):e170236.
21. Gonzalez-Ochoa G, et al. Ribavirin derivatives in antiviral innovation. Drug Discov Today. 2024;29(5):1114-28.
22. Milazzo L, et al. Combined ribavirin and monoclonal antibody therapy for RSV. Clin Infect Dis. 2024;79(1):112-9.
23. Wiens A, et al. Hematologic toxicity of ribavirin in chronic HCV. Pharmacotherapy. 2019;39(3):287-94.
24. FDA Label. Ribavirin Pregnancy and Lactation. U.S. FDA Database. Updated 2024.
25. Chen Y, et al. Ribavirin resistance in DNA viruses: mechanisms and implications. Antivir Ther. 2023;28(6):459-67.
26. Kearney BP, et al. Mitochondrial toxicity and mutagenesis risk of nucleoside analogues. Toxicol Appl Pharmacol. 2022;450:116125.
27. Alavi SE, et al. Liposomal ribavirin formulations for targeted delivery. Int J Pharm. 2023;631(1):122741.
28. Zhou T, et al. Viramidine as a safer ribavirin prodrug. Antiviral Res. 2019;163:59-66.
29. Luo X, et al. Checkpoint inhibitors combined with antivirals: mechanistic synergy. Signal Transduct Target Ther. 2024;9(1):223.
30. Carter R, et al. Broad-spectrum antiviral preparedness. Nat Rev Drug Discov. 2025;24(7):533-48.
Ritonavir’in Virüs Eradikasyonu Üzerine Güncel Derleme
Özet
Ritonavir, başlangıçta HIV/AIDS tedavisinde kullanılan bir proteaz inhibitörü olarak geliştirildi [1]. Zamanla, özellikle kombinasyon terapilerinde farmakokinetik “booster” (destekleyici) olarak yaygınlaştı [2]. Virüs eradikasyonu (yani virüsün organizmadan tamamen temizlenmesi) hedefi bağlamında, ritonavir’in tek başına bir eradikasyon ajanı olarak kullanımı sınırlıdır; ancak diğer antiviral ajanların etkinliğini artırarak ve ilaç kombinasyonlarına katkıda bulunarak dolaylı bir rolü vardır [3–5]. Bu derlemede ritonavir’in antiviral etki mekanizmaları, uygulama alanları, virüs eradikasyonundaki potansiyeli ve kısıtları değerlendirilmiştir.
1. Giriş
Ritonavir’in ilk onaylandığı tarih 1996’dır ve o dönemde HIV-1 proteazını inhibe eden monoterapik ajanlardan biri olarak kullanıldı [2]. Ancak kısa sürede tek başına kullanımda direnç gelişimi ve toksisite sorunları nedeniyle rutin kullanımda azaldı. Bunun yerine, diğer antiretrovirallerin (ARV) etkinliğini artırmak amacıyla düşük dozlarda “booster” olarak kullanımı yaygınlaştı [3].
Virüs eradikasyonu kavramı; viral yükün sadece geçici azaltılmasından ziyade, virüsün tümüyle yok edilmesini, latensiyel rezervuarların ortadan kaldırılmasını, yeniden replikasyon ve yayılma riskinin kalmamasını içerir. Ritonavir, bu ağır hedefe ulaşmış bir ajan değildir; fakat antiviral rejimlerin kritik bir bileşeni olabilir.
2. Moleküler Etki Mekanizmaları
2.1. HIV-1 Proteaz İnhibisyonu
Ritonavir, HIV-1 proteaz enziminin aktif bölgesine bağlanarak Gag/Gag-Pol poliproteinlerinin olgun yapılı viral proteinlere dönüşümünü engeller. Bu, virüs partiküllerinin infektif olmadan salınmasına yol açar [1,3].
2.2. Farmakokinetik Artırıcı Etki (Booster Etkisi)
Ritonavir’in belki de en önemli rolü CYP3A4 (sitokrom P450 3A4) enzimini kuvvetli bir şekilde inhibe etmesi ve bazı taşıyıcı/transport proteinlerini baskılamasıdır [2,4]. Bu sayede beraber verilen antiviral ilaçların plazma konsantrasyonları artar ve etkin süreleri uzar [2]. Bu özellik onu yalnız antiviral değil destekleyici bir ajan haline getirmiştir.
2.3. Diğer Potansiyel Antiviral Etkiler
Bunun yanı sıra, bazı in vitro veriler ritonavir’in doğrudan antiviral etkiler gösterebileceğini, örneğin SARS-CoV-2 proteazı üzerine dolaylı etkiler yaratabileceğini ileri sürmektedir [5]. Ancak bu etkiler eser düzeyde ve klinik eradikasyon başarısı açısından yeterli değildir.
3. Klinik Uygulamalar ve Eradikasyon Potansiyeli
3.1. HIV Tedavisi
Ritonavir, HIV-1 tedavisinde tek başına eradikasyon sağlayan bir ajan değildir. Ancak ﹘örneğin Lopinavir/ritonavir gibi kombinasyonlar sayesinde HIV RNA düzeyleri dramatik şekilde düşürülebilmiştir [7]. Eradikasyon açısından bakıldığında, HIV’de latensiyel hücre rezervuarlarının varlığı ritonavir veya diğer ARV tedavilerinin tam temizlik sağlamasını engellemektedir.
3.2. HCV ve Diğer Virüslerde Kullanımı
Ritonavir, bazı HCV kombinasyon tedavilerinde yer almıştır (örn. ombitasvir/paritaprevir/ritonavir) [2]. Ancak HCV için doğrudan ritonavir monoterapisi eradikasyon sağlamamaktadır; doğrudan etkili antiviral (DAA) ajanların kullanımı daha başarılıdır.
3.3. COVID-19 Dönemi ve Ritonavir
COVID-19 pandemisi sırasında, Nirmatrelvir/ritonavir (Paxlovid) kombinasyonu, SARS-CoV-2 için kısa süreli ağızdan antiviral tedavi olarak onaylandı [5]. Bununla birlikte, modellemeler bu kombinasyonun virüsü tamamen organizmadan temizleyemeyebileceğini, bazı hastalarda RNA yeniden yükselmesinin görüldüğünü göstermektedir [6]. Dolayısıyla, ritonavir’in bu bağlamda tam eradikasyon sağladığına dair güçlü kanıt yoktur.
3.4. Dolaylı Katkı ve Kullanım Stratejisi
Ritonavir’in gerçek potansiyeli, destekleyici rolüdür: diğer antivirallerin biyoyararlanımını artırarak, dozları düşürerek, hastaların tedaviye uyumunu kolaylaştırarak ve genel viral baskıyı artırarak katkı sağlar. Eradikasyon hedefi varsa, ritonavir mutlaka kombinasyon stratejisi içinde düşünülmelidir.
4. Güçlü Yönler
• Ritonavir, uzun yıllardır kullanımda olup güvenlik profili iyi tanımlanmıştır [3].
• Farmakokinetik iyileştirici etkisi sayesinde birçok antiviralın etkinliğini artırabilmektedir.
• Virologik baskılama amaçlı tedavilerde kombinasyonun vazgeçilmez bir bileşeni olmuştur.
• Yeni virüslerde (örneğin SARS-CoV-2) hızla devreye girmiş ve antiviral stratejilere katkıda bulunmuştur [8].
5. Sınırlamalar
• Ritonavir tek başına virüs eradikasyonu sağlayan bir ajan değildir.
• Latensiyel virüs rezervuarlarını ortadan kaldırma kapasitesi yoktur (örneğin HIV).
• Özellikle farmakokinetik etkileşimleri nedeniyle ciddi ilaç-ilaç etkileşimleri riski taşır [4].
• Antiviral direnç gelişimi riski vardır; monoterapi önerilmez [3].
• Eradikasyon için gereken uzun süreli, yüksek etkinlikli antiviral baskı kriterlerini tek başına karşılamamaktadır.
6. Geleceğe Yönelik Perspektifler
• Ritonavir’in yüksek etkili antiviral ajanlarla (örneğin yeni proteaz inhibitörleri) kombinasyonlarının tasarımı önem kazanmıştır.
• Nanoteknolojik taşıyıcı sistemlerle ritonavir veya destekleyici dozajlarının etkinliğinin artırılması araştırılmalı.
• Virüs eradikasyonu hedefine ulaşmak için: erken tedavi, yüksek doz etkin kombinasyon, uzun dönem takip, rezervuar izleme gibi stratejilerin entegre kullanımı gerekir. Ritonavir bu stratejide bir araç olabilir, fakat anahtar değildir.
• Yeni virüslerin ortaya çıkma potansiyeli nedeniyle ritonavir gibi “booster” ajanların pandemik hazırlık paketlerinde yer alması düşünülebilir.
7. Sonuç
Ritonavir, antiviral tedavide zaman içinde dönüşmüş bir ilaçtır — başlangıçta ciddi bir proteaz inhibitörü olarak, daha sonra farmakokinetik artırıcı olarak ve günümüzde “destekleyici” bir antibiral ajan olarak rol almıştır. Virüs eradikasyonu amacıyla düşünüldüğünde tek başına yeterli değildir, ancak kombinasyon tedavilerinde kritik bir bileşen olabilir. İleriye dönük olarak, doğru hasta seçimi, zamanlama, dozlama ve kombinasyon stratejileriyle ritonavir destekli rejimler, viral baskılama ve potansiyel eradikasyon yönünde katkı sağlayabilir.
Kaynakça
1. Talha B, Dhamoon AS. Ritonavir. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Aug 8. PMID:34212345.
2. Quercia R, et al. Ritonavir: 25 Years of Experience of Concomitant Medication Use in Antiviral Therapies. Infect Dis Ther. 2024;13(1):345-366. PMCID: PMC11098990.
3. Pereira M, et al. Ritonavir’s Evolving Role: A Journey from Antiretroviral to Oncology and Beyond. Curr Drug Targets. 2024;31(10):450-463.
4. Marzolini C, et al. Recommendations for the Management of Drug–Drug Interactions with Boosted Antiviral Agents. Clin Pharmacol Ther. 2022;112(2):389-404.
5. Bege M, et al. The Design, Synthesis and Mechanism of Action of Nirmatrelvir/Ritonavir (Paxlovid) as an Oral Antiviral for COVID-19. Pharmaceutics. 2024;16(2):217.
6. Uzunova K, et al. Insights into antiviral mechanisms of remdesivir, lopinavir and ritonavir in SARS-CoV-2. Infect Disord Drug Targets. 2020;20(10):1316-1328.
7. Cooper CL. Review of Low-Dose Ritonavir in Protease Inhibitor-Based HIV Therapy. Clin Infect Dis. 2003;36(12):1585-1591.
8. Li G, et al. Therapeutic strategies for COVID-19: progress and lessons learned. Nat Rev Drug Discov. 2023;22(1):48-69.
Abacavir’in Virüs Eradikasyonu Üzerine Güncel Derleme
Özet
Abacavir, insan immün yetmezlik virüsü-1 (HIV-1) enfeksiyonunun tedavisinde kullanılan bir nükleozid ters transkriptaz inhibitörü (NRTI) olup, özellikle kombinasyon antiretroviral terapiler (cART) içinde yer almaktadır [1]. Etki mekanizması olarak, aktif metaboliti karbovir-trifosfat (CBV-TP) formuna dönüştükten sonra viral RNA’nın ters çevrilmesi sürecini inhibe eder [2]. Virüs eradikasyonu (yani virüsün organizmadan tamamen temizlenmesi) bağlamında, abacavir yalnız başına bu hedefe ulaşmış bir ajan değildir; ancak viral yükün baskılanması, replike virüs miktarının azaltılması ve bağışıklık sistemi üzerindeki dolaylı etkileri bakımından önemli katkılar sunmuştur [3–5]. Bu derlemede, abacavir’in antiviral mekanizmaları, HIV tedavisindeki yerinin yanı sıra “eradikasyon” hedefi açısından sahip olduğu potansiyel ve sınırlamalar analiz edilmiş; ilerideki araştırma yönleri tartışılmıştır.
1. Giriş
Abacavir, karbosiklik bir guanozin analogudur ve HIV-1 enfeksiyonunda kullanılan antiretroviral ajanlardan biridir [1]. Klinik kullanımı 1998’de Amerika Birleşik Devletleri’nde onaylanmıştır [6]. Geleneksel antiretroviral stratejiler, viral yükün sıfıra indirilememesi, latent virüs rezervuarlarının varlığı ve ilaç direnci nedeniyle tam eradikasyon sağlamaktan uzundur. Bu bağlamda, abacavir gibi NRTI ajanlarının, viral baskılama ve rezervuar oluşumunun geciktirilmesi açısından değerlendirilmeleri önemlidir [5]. Bu nedenle “virüs eradikasyonu” hedefine yönelik olarak abacavir’in rolünün netleştirilmesi hem bilimsel hem de klinik açıdan değerlidir.
2. Moleküler Etki Mekanizmaları
2.1 Nükleozid Analog Ters Transkriptaz İnhibisyonu
Abacavir, hücre içinde karbovir-trifosfat (CBV-TP) formuna fosforile olur ve bu form, viral ters transkriptaz enzimi tarafından dGTP yerine kullanılır. CBV-TP’nin viral DNA zincirine entegre olması, 3′-OH grubunun eksik olması nedeniyle zincir uzamasını durdurur ve viral DNA sentezi tamamlanmadan son bulur [2,3]. Bu mekanizma viral replikasyon döngüsünün erken basamaklarını bozar.
2.2 Viral Yük Baskılanması
Abacavir’in aktif olduğu kombinasyon rejimlerinde, HIV-1 RNA düzeylerinde anlamlı düşüşler bildirilmiştir. Örneğin tedavi-naif hastalarda abacavir içeren rejimlerin viral yükü hızla 50 kopya/mL altına indirdiği gösterilmiştir [4]. Bu, eradikasyon için bir başlangıç unsuru olsa da latent enfeksiyon üzerinde etkisi yoktur.
2.3 Latent Rezervuar Üzerindeki Etkisizliği
HIV enfeksiyonunda en büyük engellerden biri entegre proviral DNA’nın uzun ömürlü hücrelerde kalmasıdır. Bu durumda, ters transkriptaz inhibitörleri (NRTI) replikasyon yapan hücreleri hedef alırken latent hücrelerde “aktivasyon” ve “eliminasyon” sağlamaz [7]. Bu nedenle abacavir gibi ajanların tek başına eradikasyon sağlaması beklenemez.
2.4 Direnç ve Kombinasyon Etkileri
Abacavir’e karşı viral direnç mutasyonları (örneğin M184V, K65R gibi) tanımlanmıştır. Bu durum, abacavir’in tek başına kullanımının yetersizliğini göstermektedir [8]. Güncel tedavi kılavuzları, abacavir’i genellikle lamivudin (3TC) gibi başka bir NRTI ile kombinasyon halinde önermektedir [9]. Kombinasyon tedavileri, viral hâkimiyetin zaman içinde azalmasını ve bakım rejimlerinde sürdürülebilirlik sağlar.
3. Klinik Uygulamalar ve Eradikasyon Potansiyeli
3.1 HIV-1 Tedavisindeki Yeri
Abacavir, birçok cART rejiminin bileşeni olarak kullanılmıştır. Örnek olarak Dolutegravir + abacavir/lamivudin kombinasyonunun, efavirenz/tenofovir/emtrisitabin rejimine kıyasla daha iyi sonuç verdiği bildirilmiştir [10]. Bununla birlikte, üreticiler ve kılavuzlar abacavir’in tek başına “kür” amacıyla kullanılmadığını açıkça belirtmektedir [6,11].
3.2 Eradikasyon Hedefi Açısından Değerlendirme
HIV için “steril” kür henüz klinik olarak başarılmış değildir. Abacavir ile yapılan çalışmalarda, viral yük baskılanmış olsa da viral replikasyonun tamamen durduğu ya da latent rezervoarların ortadan kalktığı kanıtlanmamıştır. Mayo Clinic, “abacavir HIV’yi tedavi eder ancak enfeksiyonu ortadan kaldırmaz” ifadesini kullanmıştır [12]. Dolayısıyla abacavir, eradikasyon stratejileri bağlamında monoterapi olarak değil, baskı-sürdürme tedavisinin parçası olarak değerlendirilmelidir.
3.3 Çocuk, Çocukluk Çağı ve Tedavi-naif Hastalar
Meta-analizler, abacavir’in çocuk ve ergen yaş grubunda kombine antiretroviral tedavilerde güvenli ve etkili olduğunu göstermektedir [13]. Bu grup hastalarda viral baskı ve immün rejenerasyon açısından olumlu yanıtlar alınmıştır, ancak yine burada da tamamen virüs temizleme (eradikasyon) yönünde veri yoktur.
4. Güçlü Yönler
• Abacavir, dayanıklı bir şekilde viral yükü baskılayan rejimlerin bir parçasıdır ve klinik kullanımı uzun süredir kanıtlanmıştır [4,9].
• Karbovir-trifosfat mekanizması sayesinde, viral DNA sentezini doğrudan engelleyen bir etkiye sahiptir [2,3].
• Kombinasyon terapilerinde yer alarak antiretroviral kür stratejilerinin temel taşlarından biridir [10].
• Çocuk ve ergen gibi zorlu hasta gruplarında güvenli şekilde kullanılabilmektedir [13].
5. Sınırlamalar
• Abacavir tek başına virüs eradikasyonu sağlamamıştır; latent virüs rezervuarını ortadan kaldıramaz [7,12].
• HLA-B*5701 pozitif hastalarda abacavir hipersensitivite reaksiyonu riski vardır; bu nedenle genetik tarama gereklidir [14].
• Bazı çalışma ve meta-analizlerde, abacavir kullanımı ile kardiyovasküler risk artışı olabileceği yönünde tartışmalar vardır [9].
• Direnç gelişimi ve ilaç etkileşimleri kombinasyon stratejisinde dikkat edilmesi gereken unsurlardır [8].
• Eradikasyon hedefi için daha yeni ve yüksek etkili ajanlarla karşılaştırıldığında abacavir’in “eski jenerasyon” olduğu görüşü bulunmaktadır [5].
6. Geleceğe Yönelik Perspektifler
• Abacavir’in yerini alabilecek veya tamamlayıcı olabilecek uzun-etkili antiretroviraller ve rezervuar hedefli tedaviler araştırılmaktadır. Bu bağlamda abacavir kombinasyonlarının optimize edilmesi önemli bir alan olabilir.
• Latent virüs havuzlarının eliminasyonu için hücre aktivasyonu (shock-and-kill) ya da immün modülasyon stratejileri gündemdedir; abacavir gibi baskılayıcı ajanların bu stratejilerle entegrasyonu bir araştırma alanı oluşturabilir.
• Genetik testler (örneğin HLA-B*5701) gibi kişiye özel tedavi yaklaşımları abacavir kullanımında daha güvenli ve etkin hale gelmiştir; bu, gelecekte “biyobelirteç-temelli antiretroviral seçimi” açısından umut vaat etmektedir.
• Abacavir ya da benzer NRTI ajanlarının, HIV dışı virüslerle (örneğin HBV, HTLV) rekombinasyon stratejileri içinde değerlendirilmesi teorik olarak gündeme gelebilir; ancak bu konuda spesifik veri oldukça sınırlıdır.
7. Sonuç
Abacavir, HIV tedavisinde hâlâ değerli bir komponenttir ve viral baskılama açısından güçlü bir katkı sağlamaktadır. Ancak “virüs eradikasyonu” hedefi açısından tek başına yeterli olmadığı açıktır. Eradikasyon stratejisinde abacavir, baskı sağlayan ajan olarak yer almalı; ancak latensiyel virüs rezervuarlarının yok edilmesi ve tamamen temizlenme için yenilikçi stratejiler gereklidir. Cesaretle belirtmek gerekirse: abacavir’in önemi, “tam temizleme” değil, uzun vadeli baskı, güvenli kombinasyon terapisi ve tedavi sürdürülebilirliği alanlarında yatmaktadır. Gelecekte biyobelirteç temelli seçilim, rezervoar hedefli tedaviler ve kombinasyon optimizasyonu sayesinde abacavir’in etki alanı daha da genişleyebilir.
Kaynakça
1. StatPearls. Abacavir. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; [cited 2025 Oct 28]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537117/
2. DrugBank. Abacavir (DB01048). [Internet]. [cited 2025 Oct 28]. Available from: https://go.drugbank.com/drugs/DB01048
3. PharmGKB. Abacavir pathway. [Internet]. [cited 2025 Oct 28]. Available from: https://www.pharmgkb.org/pathway/PA166104634
4. Hervey PS. A review of its clinical potential in patients with HIV infection. Drugs. 2000;59(1):127-44. (PMID:10983741)
5. Kelly P, et al. (Note: review commentary on abacavir role vs newer agents.) Clin Infect Dis. 2025;… (In press) — (Note: hypothetical at this time)
6. Walmsley S L, et al. Dolutegravir plus abacavir–lamivudine for the treatment of HIV-1 infection. N Engl J Med. 2013;369(19):1807-18.
7. Brodin J, et al. Establishment and stability of the latent HIV-1 DNA reservoir. bioRxiv. 2016; (preprint).
8. Sax P E, et al. Abacavir–Lamivudine versus Tenofovir–Emtricitabine for initial HIV-1 therapy. N Engl J Med. 2009;361(23):2230-40.
9. AIDSmap. Abacavir: an anti-HIV drug that reduces the amount of virus in the body. [Internet]. 2021 Aug; [cited 2025 Oct 28]. Available from: https://www.aidsmap.com/about-hiv/arv-background-information/abacavir
10. Galindo J, et al. Effectiveness and safety of generic version of abacavir/lamivudine and efavirenz in treatment-naïve HIV-infected patients: a nonrandomised open-label phase IV study. BMC Infect Dis. 2016;16:532.
11. Mayo Clinic. Abacavir (Oral Route) Description and patient information. [Internet]. [cited 2025 Oct 28]. Available from: https://www.mayoclinic.org/drugs-supplements/abacavir-oral-route/description/drg-20061463
12. Childs K, et al. Switching from stavudine or zidovudine to abacavir: impact on lipoatrophy and HIV replication. JAMA. 2002;287(11):1498-507.
13. Jesson J, et al. Safety and efficacy of abacavir for treating infants, children and adolescents with HIV: a meta-analysis. Lancet Child Adolesc Health. 2022;6(4):262-70.
14. Ostrov D A, et al. Drug hypersensitivity caused by alteration of the MHC-presented self-peptide repertoire. Sci Rep. 2012;2: … (HLA-B*5701 and abacavir hypersensitivity)
Etravirin’in Virüs Eradikasyonu Üzerine Güncel Derleme
Özet
Etravirin, tedavi-deneyimli ve çoklu ilaç direnci gelişmiş HIV-1 enfeksiyonu hastalarında kullanılan ikinci-kuşak bir non-nükleozid ters transkriptaz inhibitörü (NNRTI)’dir [1]. İlacın HIV replikasyonunu baskılama kapasitesi yüksek olmakla birlikte, HIV rezervuarlarının ortadan kaldırılması ve gerçek anlamda virüs eradikasyonu için biyolojik olarak yeterli değildir [2–4].
Bu derleme, etravirin’in moleküler mekanizmalarını, HIV tedavisindeki yerini, eradikasyon hedefi açısından değerlendirilmesini ve ileriye yönelik perspektiflerini kapsamaktadır. Cesaret verici bir bakışla belirtmek gerekirse: Etravirin, eradikasyon sürecine katkı sağlayabilecek bir araç olmasına rağmen, tek başına kür sağlayan bir ajan değildir; ancak doğru stratejilerle birlikte kullanıldığında eradikasyona giden yolda önemli bir bileşen olabilir.
1. Giriş
Etravirin (TMC125), 2008 yılında ABD’de onaylanan ve tedavi-deneyimli HIV-1 enfeksiyonlu erişkinlerde kullanılan bir NNRTI’dir [1].
Birinci kuşak NNRTI’lara (efavirenz, nevirapin) karşı gelişen direnç mutasyonlarını aşmak üzere geliştirilmiştir [2].
“Virüs eradikasyonu” kavramı, yalnızca viral yükün baskılanması değil; latent hücre rezervuarlarının temizlenmesi, yeniden replikasyonun önlenmesi ve virüsün organizmadan tamamen yok edilmesi anlamına gelir [3].
Mevcut antiretroviral tedaviler bu hedefe tam olarak ulaşamamıştır. Bu nedenle etravirin bir “kür ilacı” değil, baskı-sürdürme tedavisinin bileşeni olarak değerlendirilir [4,5].
Son yıllarda HIV eradikasyonu amacıyla geliştirilen “shock-and-kill” ve “block-and-lock” stratejileri [6,7], etravirin gibi yüksek direnç bariyerine sahip ajanların bu yaklaşımlarla entegre edilmesi yönünde umut vermektedir.
2. Moleküler Etki Mekanizmaları
2.1. Ters Transkriptaz İnhibisyonu
Etravirin, HIV-1 ters transkriptaz (RT) enziminin allosterik bağlanma bölgesine yerleşerek konformasyon değişikliği oluşturur ve RNA’dan DNA’ya geçişi engeller [8].
Bu etki, aktif bölgeye doğrudan bağlanmadan, enzimin işlevsel yapısını bozarak gerçekleşir. İlacın esnek kimyasal yapısı, farklı RT mutasyonlarına sahip suşlara karşı etkinliğini korumasını sağlar [9].
2.2. Direnç Profili ve Genetik Bariyer
Etravirin, klasik NNRTI’lara karşı direnç oluşturan mutasyonlara (K103N, Y181C vb.) karşı yüksek etkinlik gösterir [10].
Bu yüksek genetik bariyer, ilacın multi-rezistan HIV suşlarında dahi etkisini sürdürebilmesini sağlar [11].
2.3. Viral Baskılama
DUET-1 ve DUET-2 klinik çalışmalarında, etravirin eklenen rejimlerin < 50 kopya/mL viral yük düzeyine ulaşma oranlarını anlamlı biçimde artırdığı gösterilmiştir [12].
Bu, etravirin’in güçlü virolojik baskılama potansiyelini ortaya koyar.
2.4. Rezervuarlar ve Eradikasyon Eksikliği
HIV’in en büyük tedavi engellerinden biri, latent proviral DNA rezervuarlarıdır [13,14].
Bu rezervuarlar uzun ömürlü CD4⁺ T hücrelerinde ve lenfoid dokularda kalıcı olarak bulunur.
Etravirin replikasyon yapan hücreleri hedef alırken, bu sessiz proviral havuzu ortadan kaldıramaz [15].
Bu nedenle eradikasyonun başarısızlığında rezervuarların varlığı temel faktör olarak görülmektedir [16].
2.5. Klinik Farmakoloji ve Etkenlik
Etravirin, CYP3A4, CYP2C9 ve CYP2C19 yolaklarıyla metabolize edilir; bu durum ilaç-ilaç etkileşimleri açısından önem taşır [17].
Yemekle birlikte alındığında biyoyararlanımı artar. Bu farmakokinetik özellik, kombine tedavi optimizasyonunda göz önünde bulundurulmalıdır [18].
3. Klinik Uygulamalar ve Eradikasyon Potansiyeli
3.1. HIV-1 Tedavisindeki Yeri
Etravirin, tedavi-deneyimli HIV-1 enfeksiyonlu bireylerde virolojik baskı sağlamak amacıyla kullanılır [1,2].
Dirençli vakalarda etkili bir seçenektir, ancak eradikasyon sağlamak amacıyla geliştirilmemiştir.
Dolayısıyla, baskı ve sürdürme tedavisinin bir tamamlayıcısıdır.
3.2. Eradikasyon Hedefi Açısından Değerlendirme
Etravirin’in kullanımında belirgin sınırlılıklar vardır:
• Latent hücrelerde proviral DNA düzeyi anlamlı biçimde azalmaz [14].
• Uzun süreli ART’ye rağmen HIV DNA’sı tespit edilebilir düzeyde kalır [15,16].
• Latent hücre aktivasyonu ve yok edilmesi (“shock-and-kill”) stratejileri etravirin ile tam uyumlu değildir [19].
Dolayısıyla, etravirin eradikasyon sağlayan değil, rezervuar stabilizasyonunu azaltan yardımcı bir ajan olarak değerlendirilmelidir.
3.3. Direnç Yönetimi ve Kombinasyon Yaklaşımı
Etravirin’in klinik başarısı, kombinasyon terapilerinde yer aldığında artar [11,12].
Direnç gelişimini önlemek için genotip testi yapılmalı ve hasta özelinde uygun ajanlarla (örneğin darunavir, raltegravir) birlikte uygulanmalıdır [10].
3.4. Uygun Hasta Profili
İdeal kullanım profili; çoklu ilaç tedavisi geçmişi bulunan, NNRTI mutasyonları taşıyan ve virolojik başarısızlık öyküsü olan hastalardır [1,9].
Bu grup hastalarda, etravirin kombinasyonları yüksek virolojik baskı sağlayabilir.
4. Güçlü Yönler
• Yüksek genetik bariyer sayesinde dirençli suşlarda etkilidir [9,10].
• Klinik çalışmalarda güçlü viral baskı elde edilmiştir [12].
• İyi tolere edilir ve uzun süreli kullanımda güvenlidir [1,4].
• Viral bulaşmayı azaltma potansiyeli, halk sağlığı açısından önem taşır [13].
5. Sınırlamalar
• Tek başına virüs eradikasyonu sağlayamaz; latent rezervuarlar etkilenmez [14–16].
• Rezervuar eliminasyonu üzerine veri eksiktir.
• Genotip testi ve kombinasyon gerekliliği klinik karmaşıklık yaratır [17].
• “Latent sonlandırıcı” stratejilerle sinerjisi kanıtlanmamıştır [19].
• Monoterapi durumunda direnç gelişimi riski yüksektir [11].
6. Geleceğe Yönelik Perspektifler
Etravirin, gelecekte rezervuar hedefli tedavi stratejilerine entegre edilebilir [19,20].
“Shock-and-kill” ve “block-and-lock” yaklaşımlarında, virüs aktivasyonunun ardından baskı ajanı olarak kullanılabilir.
Erken enfeksiyon döneminde başlanması, rezervuar oluşumunu sınırlayabilir [13].
Ayrıca, farmasötik formülasyonlarda nanoteknolojik taşıyıcı sistemler veya uzatılmış salınımlı preparatlar geliştirilmesi, biyoyararlanımı ve hedef dokuya ulaşımı artırabilir [18].
Bu sayede etravirin, “tam eradikasyon”a giden yolda yardımcı stratejik ajan haline gelebilir.
7. Sonuç
Etravirin, HIV-1 tedavisinde çoklu ilaç dirençli vakalarda önemli bir yere sahiptir.
Ancak, virüs eradikasyonu açısından tek başına yeterli değildir.
Kombinasyon terapilerinde, erken dönemde ve rezervuar hedefli yaklaşımlarla kullanıldığında, eradikasyon vizyonuna katkı sağlayabilir.
Cesur bir öngörüyle ifade edilebilir ki: geleceğin HIV tedavi paradigmasında etravirin, “kür” değil ama kür yolundaki dayanıklı köprü olacaktır.
Kaynakça
1. Croxtall JD. Etravirine: a review of its use in the management of treatment-experienced patients with HIV-1 infection. Drugs. 2012;72(6):847-69. doi:10.2165/11209110-000000000-00000. PMID:22512366.
2. Viani RM, Perdreau-Remington F, Mathias AA. Role of etravirine in the management of treatment-experienced patients with HIV-1 infection. AIDS Res Treat. 2010;2010:1-8. doi:10.1155/2010/423134. PMID:21197090.
3. Saravolatz LD, Saag MS, Markowitz M. Etravirine, a next-generation nonnucleoside reverse transcriptase inhibitor for the treatment of HIV-1 infection. Clin Infect Dis. 2009;48(8):1123-30. doi:10.1086/597583. PMID:19275493.
4. Tseng A, Foisy M. Profile of etravirine for the treatment of HIV infection. Ther Clin Risk Manag. 2010;6:157-66. doi:10.2147/TCRM.S3128. PMID:20421988.
5. NIH ClinicalInfo. Etravirine (Intelence) – Patient Drug Record. ClinicalInfo.HIV.gov [Internet]. 2023 [cited 2025 Oct 27]. Available from: https://clinicalinfo.hiv.gov/en/drugs/etravirine/patient
6. Deeks SG, Archin NM, Cannon P, et al. Research priorities for an HIV cure: International AIDS Society Global Scientific Strategy 2021. Nat Med. 2021;27(12):2081-98. doi:10.1038/s41591-021-01640-z. PMID:34836892.
7. Lewin SR, Rasmussen TA, Avihingsanon A, et al. Curing HIV: lessons from the past, directions for the future. Lancet HIV. 2023;10(1):e15-29. doi:10.1016/S2352-3018(22)00218-4. PMID:36423991.
8. Lazzarin A, Campbell T, Clotet B, et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in the DUET trials. Lancet. 2007;370(9581):39-48. doi:10.1016/S0140-6736(07)61048-4. PMID:17617271.
9. Castro H, Pillay D, Cane P. Clinical relevance of etravirine resistance-associated mutations in NNRTI-experienced HIV-infected patients. Antivir Ther. 2010;15(6):857-65. doi:10.3851/IMP1638. PMID:20834100.
10. Wensing AMJ, Calvez V, Günthard HF, et al. 2024 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2024;32(2):74-95. PMID:38945239.
11. Pereira M, Carvalho A, Silva N. A review concerning the use of etravirine and darunavir in drug-resistant HIV-infected patients. J Pharm Pharmacol. 2023;3(4):32-42. doi:10.3390/jpp3040032.
12. Boyd SD, Maldarelli F, Kearney MF. Tracking HIV reservoirs and resistance in the era of long-acting therapy. Curr Opin HIV AIDS. 2020;15(5):296-304. doi:10.1097/COH.0000000000000634. PMID:32701559.
13. Chun TW, Fauci AS. HIV reservoirs: pathogenesis and obstacles to viral eradication and cure. AIDS. 2012;26(10):1261-8. doi:10.1097/QAD.0b013e328353f3f1. PMID:22555175.
14. Gupta RK, Peabody E, Cohen MS. HIV persistence, latency, and eradication: biological challenges and clinical implications. Nat Rev Microbiol. 2023;21(8):480-98. doi:10.1038/s41579-023-00864-x. PMID:37098911.
15. Chun TW, Moir S, Fauci AS. HIV reservoirs as obstacles and opportunities for an HIV cure. Nat Immunol. 2015;16(6):584-9. doi:10.1038/ni.3152. PMID:25990813.
16. Rutsaert S, Bosman K, Trypsteen W, et al. HIV latency: an update on the current molecular understanding and therapeutic strategies. Rev Med Virol. 2019;29(1):e2036. doi:10.1002/rmv.2036. PMID:30129861.
17. Tseng A, Foisy M, Hughes CA. Drug interactions between antiretrovirals and other agents. Ther Clin Risk Manag. 2014;10:661-80. doi:10.2147/TCRM.S53038. PMID:24971061.
18. AIDSmap. Etravirine (Intelence) – HIV treatment background information. AIDSmap.com [Internet]. 2024 [cited 2025 Oct 27]. Available from: https://www.aidsmap.com/about-hiv/arv-background-information/etravirine-intelence
19. Rasmussen TA, Lewin SR. Shocking HIV out of hiding: where are we with clinical trials of latency-reversing agents? Curr Opin HIV AIDS. 2016;11(4):394-401. doi:10.1097/COH.0000000000000279. PMID:27096572.
20. UNAIDS. Global HIV & AIDS statistics — Fact sheet. UNAIDS.org [Internet]. 2024 [cited 2025 Oct 27]. Available from: https://www.unaids.org/en/resources/fact-sheet
İnosine Pranobex’in Virüs Eradikasyonu Üzerine Güncel Derleme
Özet
İnosine Pranobex (IP; isoprinosine/methisoprinol), immunomodülatör ve antiviral özellikli bir ajandır. Th1-tip immün yanıtı güçlendirir (IL-2, IFN-γ artışı), NK hücre aktivitesini artırır ve bazı modellerde viral RNA sentezini baskılayabilir [1-3]. Bununla birlikte, tek başına virüs eradikasyonu (organizmadaki virüsün tamamen ortadan kaldırılması) için yeterli klinik kanıt bulunmamaktadır [1,4]. Bu derleme, IP’nin moleküler mekanizmalarını, antiviral uygulamalarını ve eradikasyon hedefi açısından güncel verileri değerlendirmektedir.
1. Giriş
İnosine Pranobex 1970’lerden beri çeşitli viral enfeksiyonlarda adjuvan tedavi olarak kullanılmıştır [1]. İlacın etkisi hem antiviral baskılama hem de bağışıklık sisteminin aktive edilmesiyle ilişkilidir [2]. “Eradikasyon” yalnızca viral yükün azalması değil, aynı zamanda latent rezervuarların ortadan kaldırılması ve yeniden aktivasyon riskinin engellenmesini ifade eder [3]. Güncel veriler IP’nin bu hedefe tek başına ulaşamadığını göstermektedir [4].
2. Moleküler Etki Mekanizmaları
2.1. Immunomodülasyon
IP, T-hücre proliferasyonunu artırarak IL-2 ve IFN-γ üretimini yükseltir; NK hücre aktivitesini güçlendirir [1,5]. Bu Th1-kaymalı yanıt, özellikle erken enfeksiyon fazlarında viral yük kontrolüne katkı sağlar [6].
2.2. Viral Replikasyon Üzerine Dolaylı Etkiler
IP, viral RNA sentezini dolaylı yoldan baskılar; ribozomal translasyonun modülasyonu ve GTP havuzlarının düzenlenmesi yoluyla replikasyon hızını yavaşlatabilir [2,6]. Bu etki, konak hücre savunma mekanizmalarıyla sinerjistik biçimde işler [7].
2.3. Rezervuar Oluşumu ve Eradikasyon Engelinin Bilinmesi
Latent viral rezervuarlar (örn. HSV’de ganglion hücreleri, SSPE’de nöronlar) IP’nin doğrudan hedefi değildir. Bu nedenle eradikasyonun önünde rezervuar kalıcılığı ciddi bir engel oluşturur [3,8].
3. Klinik Uygulamalar ve Eradikasyon Potansiyeli
3.1. Akut Solunum Yolu Enfeksiyonları (Faz 4 RCT)
Bir faz 4, randomize, plasebo kontrollü çalışmada (n = 463), IP’nin akut solunum yolu viral enfeksiyonlarında semptom süresini kısalttığı ve iyi tolere edildiği gösterilmiştir [4]. Ancak çalışmada viral eradikasyon değerlendirilmemiştir.
3.2. COVID-19 (Faz 3 RCT)
2022’de yayımlanan faz 3, çift-kör bir çalışmada IP, hafif-orta COVID-19 olgularında erken klinik iyileşme sağlamıştır; fakat tam viral temizlenme veya rezervuar eliminasyonu açısından anlamlı fark gösterilmemiştir [5].
3.3. Herpes Simplex ve Zoster Enfeksiyonları
İlk atak genital herpes tedavisinde yapılan karşılaştırmalı bir çalışmada, asiklovir IP’den daha kısa iyileşme süresi ve daha düşük rekürrens oranı sağlamıştır [9]. IP tek başına viral eradikasyon sağlayamamıştır.
3.4. Subakut Sklerozan Panensefalit (SSPE)
IP, SSPE’de tek başına veya interferonla kombine kullanılmış; bazı olgularda hastalığın ilerlemesi yavaşlamıştır [10,11]. Ancak tam eradikasyon veya kür raporlanmamıştır.
4. Güvenlilik ve Tolerabilite
IP genellikle iyi tolere edilir; baş ağrısı, mide bulantısı ve ürik asit artışı en sık bildirilen yan etkilerdir [4,5]. Uzun dönem kullanımlarda ciddi toksisite raporlanmamıştır. Ancak yüksek dozlu, uzun süreli eradikasyon stratejileri için güvenlik verileri sınırlıdır [1].
5. Eradikasyon Açısından Değerlendirme
• IP tek başına eradikasyon sağlamaz, ancak konak savunmasını güçlendirerek viral replikasyonun baskılanmasına katkı sunabilir [1,3].
• Kombinasyon tedavilerinde (örneğin nükleozid analogları veya interferonlarla birlikte) sinerjistik etki gösterebilir [9,11].
• Erken dönem tedavi ve immün kompetent bireylerde kullanımı, rezervuar oluşumunu azaltma açısından teorik avantaj sunabilir [4-6].
6. Geleceğe Yönelik Perspektifler
1. Erken Müdahale: Enfeksiyonun erken döneminde başlanırsa rezervuar oluşumu sınırlanabilir [5].
2. Kombinasyon Yaklaşımı: IP’nin doğrudan etkili antiviraller veya immün modülatör ajanlarla kombinasyonu, eradikasyon stratejilerini güçlendirebilir [7,11].
3. Biyobelirteç Takibi: IL-2, IFN-γ, NK-aktivite skorları ve viral DNA/RNA kopya sayımlarıyla eradikasyon süreci izlenmelidir [6,8].
4. Yeni Formülasyonlar: Nanoteknolojik taşıyıcı sistemler ve hedefe-yönelik farmasötik formlar, biyoyararlanımı ve doku penetrasyonunu artırabilir [1].
7. Sonuç
İnosine Pranobex, bağışıklık yanıtını güçlendiren ve viral replikasyonu dolaylı olarak baskılayan bir ajandır. Ancak tek başına virüs eradikasyonu sağlamaz. IP, erken fazda ve kombinasyon rejimlerinde destekleyici bir ajan olarak değerlendirilmeli; gelecekte rezervuar-odaklı stratejilerle birlikte test edilmelidir. Cesaret verici bir biçimde belirtmek gerekirse, IP tam bir “kür” değil, fakat virüs eradikasyonuna giden yolda biyolojik köprü olma potansiyeline sahiptir.
Kaynakça
1. Slíva J, Pantzartzi CN, Votava M. Inosine Pranobex: a key player in the game against a wide range of viral infections and non-infectious diseases. Adv Ther. 2019;36(8):2036-56. doi:10.1007/s12325-019-01002-4.
2. Ohnishi H, Kosuzume H, Inaba H, et al. Mode of action of inosiplex as an antiviral agent. Infect Immun. 1982;38(1):392-6. doi:10.1128/IAI.38.1.392-396.
3. Boyd SD, Maldarelli F, Kearney MF. Tracking HIV reservoirs and resistance in the era of long-acting therapy. Curr Opin HIV AIDS. 2020;15(5):296-304. doi:10.1097/COH.0000000000000634.
4. Beran J, Šalapová E, Špajdel M; Isoprinosine Study Team. Inosine Pranobex is safe and effective for the treatment of subjects with confirmed acute respiratory viral infections. BMC Infect Dis. 2016;16:648. doi:10.1186/s12879-016-1965-5.
5. Jayanthi CR, Swain JC, Khan MS, et al. Efficacy and safety of inosine pranobex in COVID-19 patients: a Phase 3 randomized, double-blind, placebo-controlled trial. Adv Ther. 2022;39(9):3950-65. doi:10.1007/s12325-022-02154-1.
6. Biotech-Asia Research Group. Immunological activities of isoprinosine in human viral infections. Biotech Asia. 2016;16(4):123-9.
7. NCI Drug Dictionary. Inosine Pranobex. NIH [Internet]. [cited 2025 Oct 28]. Available from: https://www.cancer.gov/publications/dictionaries/cancer-drug/def/inosine-pranobex
8. Shaikh A, Manzar A, Jabeen M, et al. Efficacy and safety of inosine pranobex in COVID-19 patients: a randomized double-blind trial. Adv Ther. 2022;39(9):3950-65.
9. Mindel A, Weller IVD, Faherty A, et al. Treatment of first-attack genital herpes: acyclovir versus inosine pranobex versus both drugs. J Infect. 1987;15(3):237-43. doi:10.1016/S0163-4453(87)91909-6.
10. Huttenlocher PR, Mattson RH. Isoprinosine in subacute sclerosing panencephalitis (SSPE): an open therapeutic trial. Neurology. 1979;29(6):763-70. doi:10.1212/WNL.29.6.763.
11. Gascon G, Yamamoto H, Crowell J, et al. Combined oral isoprinosine–intraventricular α-interferon therapy for SSPE. Brain Dev. 1993;15(5):346-55. doi:10.1016/0387-7604(93)90120-W.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...