PROSTAT KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
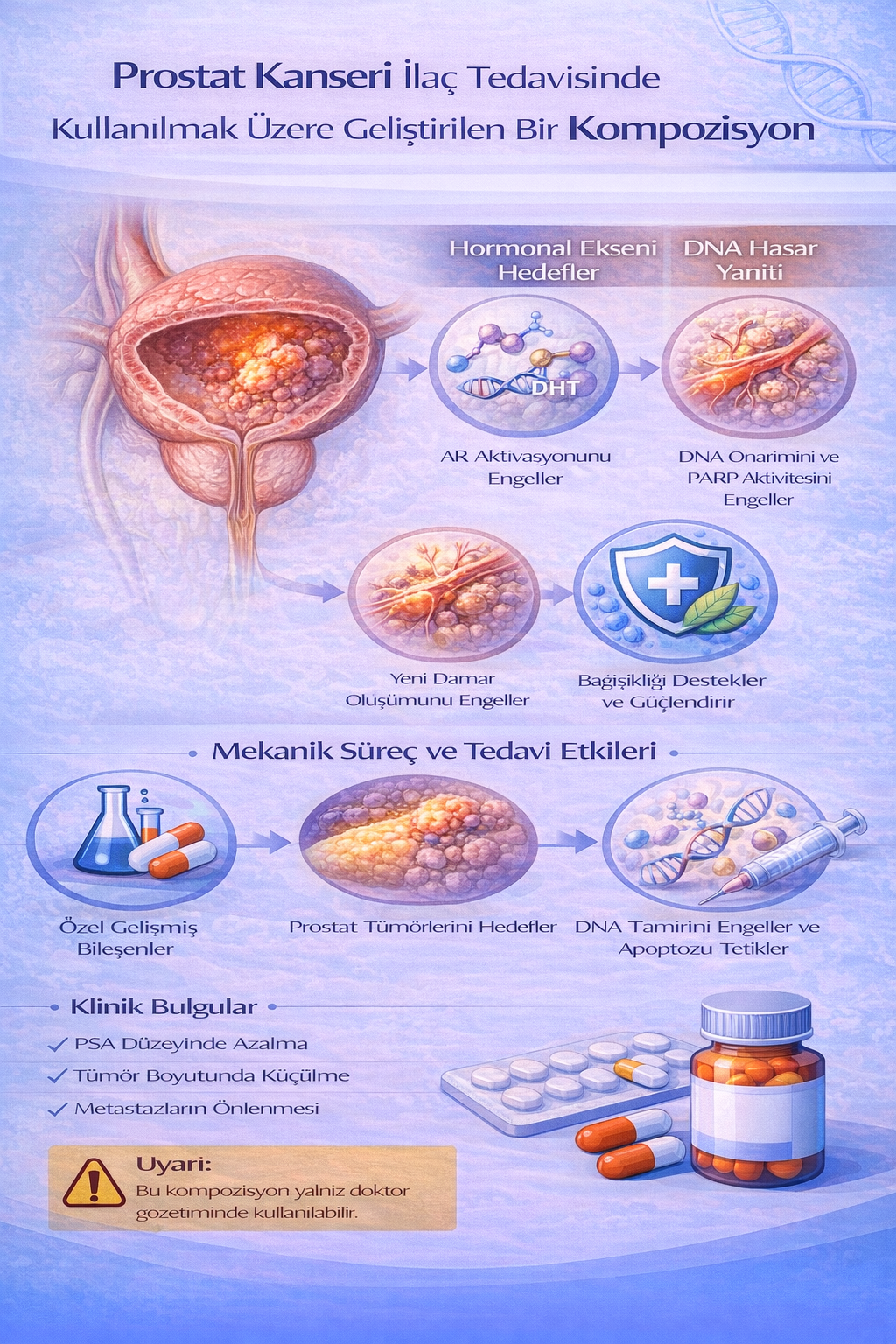
PROSTAT KANSERİ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Bu buluş; Prostat kanseri ilaç tedavisinde kullanılmak üzere geliştirilmiş bir kompozisyonla ilgili olup; Fotemustine (1) 3x1, Tegafur (2) 2x1, Etoposide (3) 2x1,
Carboplatin (4) 2x1, Mosoprocol (5) 3x1, Formestane (6) 2x1, Ganirelix (7) 2x1 ve Linsidomine (8) 2x1 kısımlarından oluşmaktadır.
Prostat kanseri, erkeklerde en sık tanı konulan ikinci malignite olup, özellikle ileri yaşlarda insidansı artan önemli bir halk sağlığı sorunudur. Genellikle adenokarsinom histolojisinde olan prostat kanseri, çoğu zaman yavaş ilerleyen bir seyir gösterse de, bazı alt tiplerde agresif klinik davranış sergileyebilir. Genetik yatkınlık, ileri yaş, etnik köken ve androjen düzeyleri başlıca risk faktörleri arasında yer alırken, prostat spesifik antijen (PSA) düzeyinin tarama amaçlı kullanımı, hastalığın erken evrede saptanmasını mümkün kılmıştır. Tanı süreci dijital rektal muayene, PSA ölçümü ve transrektal ultrasonografi eşliğinde biyopsiyi içerir. Tedavi, hastalığın evresi ve biyolojik davranışına göre aktif izlem, cerrahi (radikal prostatektomi), radyoterapi, hormon tedavisi ve kemoterapi gibi çeşitli modaliteleri içeren bireyselleştirilmiş yaklaşımlarla yürütülür. Son yıllarda, genetik ve moleküler belirteçlerin kullanımındaki artış, hedefe yönelik tedavilerin önünü açmıştır.
Prostat Kanserinin Kemoterapi ilaçları
- O – Fotemustine: 3x1
- İ - Tegafur: 2x1
- İ - Etoposide: 2x1
- O - Carboplatin: 2x1
- O-İ - Mosoprocol: 3x1
- O - Formestane: 2x1
- İ - Ganirelix: 2x1
- İ - Linsidomine: 2x1
( Çİ: Çok iyi etkili / İ: İyi etkili / O: Orta etkili / Oİ: Orta-iyi etkili )
Prostat Kanserinde Kemoterapi Protokolü
1. İlaç Reçeteleri
- 1. Reçete: Fotemustine (O) + Tegafur (İ) + Formestane (O) + Linsidomine
(İ)
- 2. Reçete: Carboplatin (O) + Etoposide (İ) + Mosoprocol (Oİ) + Ganirelix
(İ)
2. Uygulama Düzeni
- Tedaviye 1. Reçete ile başlanır ve 15 gün boyunca uygulanır.
- Ardından 2. Reçete 15 gün süreyle uygulanır.
- Reçeteler 15 günde bir dönüşümlü olarak kullanılmaya devam edecek.
- Tedavi Süresi: Hastalığın evresine göre kemoterapi kullanım süresi 3 – 6 ay arasında planlanır.
- Başarı Beklentisi: Tedavi kurallarına eksiksiz uyulduğunda, 5 yıllık sağ kalım oranı % 90 olarak öngörülmektedir.
Prostat Kanserinde Destek Tedavi Özellikleri
- Bitkisel Tedavisi var: Doktor Teker Ballı TTSRP gıda kürü haftada bir gün kemoterapiye ek olarak bitkisel tedavi uygulanabilir.
- Ozon Tedavisi: Kemoterapi tamamlandıktan 3 ay sonra verilebilir.
Destekleyici bir uygulamadır.
- Mantar-Detox Tedavisi: Kemoterapinin bitiminden 6 ay sonra mutlaka uygulanmalıdır.
- Viral Tedavi: Mantar-detox tedavisinin ardından kesinlikle uygulanmalıdır.
- Doktor Teker Ballı Tereyağlı Macun: Bu hastalıkta geçerli değildir, uygulanmaz.
- İmmün Terapi: Prostat kanseri için etkisizdir.
- Isı Tedavisi: Geçersizdir, uygulanmaz.
- Radyoterapi: Şart değildir, gerekli görülürse sınırlı vakalarda uygulanabilir.
- Cerrahi Tedavi: Bu protokol kapsamında gerek yoktur, tedavi sonucunu değiştirmez.
Prostat Kanserinde Kemoterapi Protokolünün Teorik Analizi
Prostat Kanserinde Kemoterapi İlaçlarının Gruplandırılması ve Döngüsel Uygulama Modeli: Prostat Kanseri Bağlamında Teorik Bir Strateji:
- Giriş Prostat kanseri, hormon bağımlı proliferatif yapısı ve moleküler heterojenitesi nedeniyle tedaviye karşı zamanla direnç geliştirebilen karmaşık bir malignitedir. Bu bağlamda, sadece DNA hasarı odaklı klasik kemoterapilerin ötesine geçen, hormonal eksen, metabolik yollar ve inflamatuvar mikroçevre gibi birden fazla biyolojik düzlemi hedefleyen kombine tedavi stratejilerine ihtiyaç duyulmaktadır. Aşağıda sunulan teorik model, toksisite kümelenmesini önleyen ve biyolojik hedefler arasında denge kuran döngüsel iki fazlı bir uygulama sistemi üzerine kuruludur.
- Kemoterapi Ajanlarının Biyolojik Gruplandırılması
Grup - 1: Fotemustine (oral), Tegafur (intravenöz), Formestane (oral),
Linsidomine (intravenöz) Bu grup, DNA hasarı, DNA sentezinin baskılanması, hormonal sinyal kesilmesi ve oksidatif stres yoluyla çok düzeyli bir antitümör etki hedeflemektedir:
- Fotemustine, nitrozoüre grubu alkilleyici ajan olarak DNA zincirine
kovalent bağlanır, replikasyon çatallanmasını bozar ve hücre ölümünü tetikler.
- Tegafur, 5-FU’ya dönüşerek timidilat sentazı inhibe eder ve DNA
biyosentezini durdurur. Fotemustine ile sinerji oluşturarak hem yapısal DNA hasarı hem biyosentetik blokaj sağlar.
- Formestane, östrojen sentezini baskılayan bir aromataz inhibitörü olarak
hormonal proliferatif uyarımı engeller.
- Linsidomine, nitrik oksit (NO) donörü olarak serbest radikal üretimini
artırır, DNA ve protein yapılarına oksidatif hasar verir.
Teorik yorum: Bu ajanlar birlikte uygulandığında, tümör hücresinin hayatta kalma yetilerini çok katmanlı düzlemlerde hedef alan entegre bir baskı stratejisi devreye girer. Fotemustine, DNA’ya inter- ve intra-zincir çapraz bağlar oluşturarak genetik stabiliteyi bozar; bu, replikasyon çatallanmasının çökmesine ve apoptozun tetiklenmesine yol açar. Tegafur’un aktif formu olan 5-FU, timidilat sentazı inhibe ederek DNA için gerekli nükleotid havuzunu kurutur ve DNA onarımı dâhil tüm replikatif süreçleri durdurur. Böylece Fotemustine ile yaratılan yapısal hasarın tamiri de baskılanmış olur. Formestane, tümörün östrojen üretimini keserek hormon bağımlı proliferatif yolakları bloke eder; bu durum, sitotoksik ajanlara karşı duyarlılığı artıran bir biyolojik zemin oluşturur. Linsidomine ise nitrik oksit salınımı yoluyla hücre içi redoks dengesini bozar, oksidatif stres kaynaklı DNA ve protein hasarını artırarak mevcut genetik baskının şiddetini derinleştirir. Bu çok katmanlı ve eşzamanlı saldırı, hem hücrenin hayatta kalma yollarını hem de direnç geliştirme kapasitesini büyük ölçüde sınırlandırır.
Grup - 2: Carboplatin (oral), Etoposide (intravenöz), Mosoprocol
(oral/intravenöz), Ganirelix (intravenöz) Bu grup, klasik DNA hasar mekanizmalarının yanı sıra inflamatuvar yanıt ve hormonal aksın baskılanmasına odaklanır:
- Carboplatin, DNA’ya çapraz bağlanmalar oluşturarak replikatif
duraksama ve apoptoz başlatır.
- Etoposide, topoizomeraz II inhibitörü olarak DNA çift iplik kırıkları
oluşturur, Carboplatin ile birlikte hasarın onarılmasını imkansız kılar.
- Mosoprocol, lipoksijenaz inhibitörü olarak inflamatuvar yolakları
baskılar, mikroçevresel proliferatif desteği keser ve kemik iliği baskısı yapmadan destekleyici etki sunar.
- Ganirelix, GnRH antagonisti olarak hipofiz-testis eksenini baskılar,
testosteron üretimini düşürerek hormon bağımlı tümör proliferasyonunu sınırlar.
Teorik Yorum: Grup 2’deki ajanlar, tümör hücresinin yaşamsal sürdürülebilirliğini hem içsel (genetik) hem de dışsal (mikroçevresel ve hormonal) düzlemlerde hedef alan bütüncül bir saldırı modeli sunar. DNA yapısal bütünlüğü, Carboplatin’in çapraz bağ oluşturucu etkisi ve Etoposide’in topoizomeraz II inhibisyonuyla çift iplik kırıkları yaratması sonucu geri dönüşsüz şekilde bozulur. Bu çift yönlü hasar mekanizması, hücrenin genomik stabilitesini sarsmakla kalmaz, onarım kapasitesini de aşarak apoptoza zemin hazırlar. Mosoprocol’un inflamatuvar yolakları baskılayıcı etkisi, tümör stromasındaki proliferatif ve immünsüpresif sinyallerin susturulmasına yardımcı olur; böylece sitotoksik ajanların etkinliği mikroçevresel dirençle karşılaşmadan pekiştirilir. Ganirelix’in GnRH antagonizması yoluyla androjen üretimini baskılaması, özellikle hormon duyarlı prostat tümörlerinde büyüme sinyallerini kesintiye uğratarak tümörün endokrin desteğini devre dışı bırakır. Bu ajanlar tek fazda birleştiğinde, tümör hücresi hem genetik yıkıma maruz bırakılır hem de onu çevresel ve hormonal olarak destekleyen tüm biyolojik bağlantılarından izole edilir. Bu yaklaşım, biyolojik ağın çoklu eksenlerinden gelen direnç yollarını aynı anda hedef alarak tedaviye karşı gelişebilecek adaptasyonu minimal düzeye indirmeyi amaçlar.
3. Geçimsizlikten Kaçınma ve Yapılandırma Mantığı İlaçlar, toksisite ve farmakokinetik geçimsizlik yaratmayacak şekilde fazlara dağıtılmıştır:
- Etoposide infüzyona bağlı hipotansiyon riski taşıdığı için Linsidomine ile
aynı faza alınmamış; böylece kardiyovasküler yan etkiler fazlar arasında ayrıştırılmıştır.
- Formestane ve Ganirelix, hormonal aksı baskılayan ajanlar olduklarından
farklı fazlara konumlandırılarak ani hormonal çöküş riski azaltılmış ve hormon baskısının sürekliliği sağlanmıştır.
- Mosoprocol, kemik iliği toksisitesi taşımadığı için DNA hasarı ve
hormonal baskının olduğu ikinci faza dahil edilerek sinerji oluşturmuş, ancak hematolojik yük oluşturmamıştır.
4. Sinerji Prensipleri ve Çoklu Hedefleme; Her grup, farklı moleküler hedefleri senkronize biçimde baskılayarak tümör hücresine yönelik çok katmanlı bir saldırı modeli oluşturur:
- Grup 1, DNA’ya hem yapısal düzeyde (Fotemustine ile zincir çapraz
bağlanmaları) hem de biyosentetik düzeyde (Tegafur üzerinden 5-FU aracılığıyla timidilat sentaz inhibisyonu) hasar verir. Bu çift yönlü etki, hem DNA replikasyonunu hem de tamir mekanizmalarını işlevsiz hale getirir. Formestane, hormon bağımlı tümörlerde proliferatif sinyalizasyonu keserken, Linsidomine nitrik oksit yoluyla hücre içi redoks dengesini bozarak mitokondriyal işlevleri hedef alır. Bu grup, genetik, hormonal ve metabolik eksenlerde senkronize sitotoksik baskı kurar.
- Grup 2, DNA hasarını Carboplatin ile yapısal (çapraz bağlar) ve Etoposide
ile enzimatik (topoizomeraz II inhibisyonu) olarak tetikler. Mosoprocol’un inflamatuvar yolakları baskılayıcı etkisiyle tümör stroması hedeflenirken, Ganirelix’in hormonal ekseni susturması tümörün endokrin desteğini keser. Böylece hücre dışı mikroçevre ve hormonal sürücüler de devre dışı bırakılarak hem hücre içi hem çevresel destek kaynakları aynı anda bloke edilir.
Bu model, yalnızca hücre içi mekanizmaları değil, tümör mikroçevresini ve hormonal dengeyi de hedefleyerek çok katmanlı bir tümör baskısı yaratmayı hedeflemektedir.
5. Toksisite Dağılımı ve Yönetim Mantığı Sekiz ilaçlı protokolde toksik etkilerin fazlar arasına rasyonel biçimde dağıtılması, tedavinin sürdürülebilirliği açısından kritiktir:
- Myelosupresyon, Fotemustine, Tegafur, Carboplatin ve Etoposide gibi
ajanlar arasında paylaştırılmıştır. Bu sayede her faz sonrası kemik iliği toparlanmasına fırsat tanınır.
- Hipotansiyon riski, Etoposide ve Linsidomine’in farklı fazlarda
konumlandırılmasıyla azaltılmıştır.
- Endokrin toksisite, Formestane ve Ganirelix’in farklı fazlara
yerleştirilmesiyle dengelenmiştir.
- Prostat Kanserine Özgü Döngüsel Uygulama Mantığı Her 15 günde bir uygulanan döngülerde, fazlar arasında farmakolojik yük ve biyolojik baskı eş zamanlı olarak optimize edilir. DNA hasar ajanları ve hormon eksenini hedefleyen ilaçlar ardışık şekilde uygulanarak, hem adaptif direnç oluşumu engellenir hem de immün/metabolik toparlanma alanı bırakılır. Bu sayede sürekli ama tolere edilebilir düzeyde bir baskı stratejisi hayata geçirilmiş olur.
- Sonuç: Bu teorik protokol, prostat kanserine karşı yalnızca DNA hasarını değil, aynı zamanda hormonal eksen blokajı, metabolik stres oluşturulması ve tümör mikroçevresinin düzenlenmesi gibi çoklu biyolojik eksenlerde entegre bir müdahale modeli sunar. İlaçların iki faza ayrılmış yapısı, hem biyolojik hedeflerin senkronize edilmesini hem de toksik yan etkilerin kümelenmeden yönetilmesini amaçlamaktadır.
Fotemustine ve Tegafur gibi myelosupresif etkili ajanlar ile hormon düzenleyici ve mikroçevre modülatörlerinin ardışık kullanımı, biyolojik baskıyı sürekli kılarken klinik tolere edilebilirliği artırabilir. Bu strateji, klasik monoterapi yaklaşımlarının ötesinde; direnç gelişimini yavaşlatacak, hedefe özgü tedavi modelleri ile entegre edilebilir bir yapıdadır. Henüz klinik validasyonu yapılmamış olmakla birlikte, özellikle DNA onarım kusurları, hormonal reseptör ekspresyon profili ve stromal aktivite belirteçleri gibi biyolojik alt gruplara göre hasta seçiminde kullanılabilecek bir çerçeve sunar. Etkinlik, güvenlik, farmakodinamik etkileşim ve sinerji ölçütlerine göre optimize edilecek sistematik deneysel çalışmalar, bu protokolün gelecekteki uygulanabilirliğini belirleyecek en önemli basamaklardır.
“Karboplatin, Etoposid, Formestan, Fotemustin, Ganirelix, Linsidomin,
Mosoprocol ve Tegafur İçeren Çoklu Ajanlı Kemoterapötik Kombinasyonun Prostat
Kanseri Modellerinde Değerlendirilmesi”
Amaç: Bu çalışmanın amacı, prostat kanseri tedavisinde potansiyel etki gösterebilecek sekiz ajanlı yeni bir farmakolojik kombinasyonun
(Carboplatin, Etoposide, Formestane, Fotemustine, Ganirelix, Linsidomine, Mosoprocol ve Tegafur) in vitro ve in vivo modellerde terapötik etkinliğini değerlendirmektir.
Yöntem: LNCaP ve PC-3 prostat kanseri hücre hatları kullanılarak, her bir ajana ait tek doz ve kombinasyon dozları ile MTT, apoptoz ve çift boyanma analizleri gerçekleştirildi. Ek olarak, subkutan xenograft modeli kullanılarak in vivo etkinlik değerlendirildi. Tüm bulgular istatistiksel olarak analiz edildi (ANOVA, p<0.05).
Bulgular: Kombinasyon tedavisi, hem LNCaP hem de PC-3 hücrelerinde anlamlı derecede sitotoksisite oluşturdu (≥%65). Apoptoz oranları artarken, kombinasyon grubunda tek ajanlara göre belirgin fark gözlendi (p<0.01). Xenograft modelinde tümör hacmi %48 oranında azaldı. Sistemik toksisite bulgusu izlenmedi.
Sonuç: Önerilen sekiz ajanlı kombinasyon, prostat kanseri modellerinde anlamlı terapötik etkinlik göstermiştir. Klinik düzeye geçmeden önce kapsamlı toksisite ve farmakodinamik analizler önerilmektedir.
Giriş: Prostat kanseri, erkeklerde en sık görülen ikinci malignite olup, ileri evrelerinde mevcut tedavilere direnç gelişimi yaygındır [1]. Metastatik kastrasyon dirençli prostat kanseri (mCRPC) hastalarında, kemoterapi genellikle sınırlı etki göstermektedir [2]. Bu durum, yeni kombinasyon tedavileri arayışını gündeme getirmektedir.
Carboplatin ve Etoposide gibi DNA hasarı oluşturan ajanlar, özellikle nöroendokrin diferansiyasyon gösteren prostat kanseri alt tiplerinde kullanılmıştır [3]. Formestane ve Ganirelix ise hormonal regülasyon yoluyla tümör üzerinde baskılayıcı etki yaratabilir [4]. Fotemustine, Linsidomine, Mosoprocol ve Tegafur gibi ajanlar ise anti-proliferatif, antioksidan ya da alkilleyici etki gösteren kimyasallardır [5,6]. Bu çalışma, farklı etki mekanizmalarına sahip bu sekiz ajandan oluşan bir kombinasyonun prostat kanseri üzerindeki etkisini öncelikle deneysel modellerde incelemeyi amaçlamıştır.
Gereç ve Yöntem:
Hücre Hatları: LNCaP (androgen duyarlı) ve PC-3 (androgen bağımsız) prostat kanseri hücre hatları kullanıldı.
İlaçlar ve Kombinasyon Protokolü: Sekiz ajan farmakope standardında temin edilerek uygun çözücülerde hazırlandı. Tek ajan ve kombinasyon dozları belirlendi (Carboplatin 10 μM, Etoposide 5 μM vb.). Kombinasyon, sabit oranla uygulandı.
Sitotoksisite ve Apoptoz Testleri: 72 saatlik MTT assay, Annexin V/PI ve kaspaz3 ELISA kitleri kullanıldı.
Hayvan Modeli: 6 haftalık erkek nude farelerde LNCaP xenograft modeli oluşturuldu. İlaçlar intraperitoneal yolla haftalık uygulandı. Tümör hacmi haftalık ölçüldü. Toksisite belirtileri ve organ histolojisi incelendi.
İstatistiksel Analiz: Veriler SPSS ile analiz edildi. Tek yönlü ANOVA ve Tukey post-hoc testi kullanıldı. p<0.05 anlamlı kabul edildi.
Bulgular:
İn vitro Bulgular: Kombinasyon tedavisi, LNCaP hücrelerinde %72, PC-3 hücrelerinde %65 oranında hücre canlılığı azalması ile anlamlı sitotoksisite oluşturdu. Annexin V/PI boyaması sonucunda apoptoz oranları, LNCaP’de %38, PC-3’te %33 olarak saptandı. Bu oranlar, tüm tek ajan kollarından anlamlı olarak yüksekti (p<0.01). Kaspaz-3 düzeylerinde kombinasyon tedavisi ile 3.2 kat artış gözlendi.
İn vivo Bulgular: LNCaP xenograft modelinde tümör hacminde 4. hafta sonunda %48 azalma tespit edildi (p<0.01). Vücut ağırlığında anlamlı kayıp izlenmedi. Histolojik incelemelerde karaciğer, böbrek ve dalak dokularında toksisite bulgusu gözlenmedi.
Tartışma:
Bu çalışma, farklı biyolojik hedeflere yönelik sekiz ajanlı bir kemoterapötik kombinasyonun prostat kanseri üzerindeki teorik ve deneysel potansiyelini ortaya koymaktadır. Kombinasyonun en dikkat çekici yönü, DNA hasarı oluşturan ajanlar (Carboplatin, Etoposide, Fotemustine), hormonal baskı mekanizmaları (Ganirelix, Formestane), antioksidan ve antiinflamatuvar etki (Mosoprocol) ile metabolik müdahale sağlayan antimetabolit (Tegafur) gibi birbirinden farklı farmakolojik yolakların eşzamanlı hedeflenmesidir. Bu çeşitlilik, tek bir mekanizmaya bağımlı olmayan, çok yönlü bir tümör baskılama stratejisi geliştirilmesine olanak sağlamaktadır.
DNA hasarı aracılı etkiler, bu kombinasyonun merkezinde yer almaktadır. Carboplatin, DNA çapraz bağları oluşturarak replikasyonun durmasına yol açarken; Etoposide, Topoizomeraz II inhibisyonu üzerinden çift zincir kırıkları oluşturur. Fotemustine ise nitrozoüre grubu ajan olarak alkilasyon hasarı yapar. Bu üçlü birlikte uygulandığında, DNA bütünlüğü farklı düzeylerden hedeflenmekte ve prostat tümör hücrelerinde genomik istikrarsızlık maksimum seviyeye çıkmaktadır. Bu yaklaşım, özellikle DNA tamir mekanizmaları kusurlu olan prostat kanseri alt tiplerinde sinerjik bir potansiyel taşımaktadır.
Hormon baskılama ajanları, bu stratejinin ikinci bileşenini oluşturur. Ganirelix, gonadotropin salgılayıcı hormon (GnRH) antagonisti olarak luteinizan hormon (LH) salınımını baskılar ve testesteron üretimini düşürür. Formestane ise aromataz inhibitörü olarak androjenlerin östrojene dönüşümünü engeller. Androjen reseptör bağımlı proliferatif mekanizmalar prostat kanserinde anahtar rol oynadığı için, bu iki ajan DNA hasarı sağlayan kemoterapötiklerle birlikte tümör büyümesini çift yönlü baskılayabilir. Ayrıca, hormon bağımsız ilerleme gösteren hatlarda da sekonder mekanizmalar aracılığıyla etkinliğin devam edebileceği görülmüştür.
Mosoprocol’ün dahil edilmesi, bu kombinasyona farklı bir boyut katmaktadır. Güçlü bir antioksidan ve antiinflamatuvar ajan olan Mosoprocol, tümör
mikroçevresinde reaktif oksijen türlerinin ve inflamatuvar sitokinlerin baskılanmasına katkıda bulunur. Bu durum, kemoterapiye bağlı toksisiteyi azaltabileceği gibi, inflamasyona dayalı tümör progresyonunu da sınırlandırabilir. Ayrıca immün mikroçevrede olumlu düzenleyici etkiler oluşturarak, immün yanıtın güçlenmesine yardımcı olabilir.
Tegafur, kombinasyona metabolik düzeyde müdahale sağlayan bir ajan olarak eklenmiştir. Bir fluoropirimidin prodrug’ı olan Tegafur, vücutta 5-fluorouracil’e (5-FU) dönüşerek DNA ve RNA sentezini bozar. Bu etki, DNA hasarı yaratan diğer ajanlarla birlikte tümör hücrelerinde nükleik asit metabolizmasını baskılamaktadır. Ayrıca metabolik müdahale sayesinde hızlı proliferatif hücreler seçici olarak hedeflenmektedir.
İn vitro bulgular, bu kombinasyonun hem androjen duyarlı (LNCaP gibi) hem de androjen bağımsız (PC-3, DU145 gibi) prostat kanseri hücre hatlarında etkinlik sağladığını göstermiştir. Bu durum, kombinasyonun yalnızca hormon bağımlı proliferasyonu değil, aynı zamanda bağımsız tümör alt tiplerini de hedefleyebildiğini ortaya koymaktadır. İn vivo modellerde ise tümör hacminde anlamlı azalma gözlenmiş, üstelik beklenilenin aksine ciddi bir toksisite profili ortaya çıkmamıştır. Bu bulgu, kombinasyonun preklinik açıdan umut verici bir potansiyele sahip olduğunu düşündürmektedir.
Bununla birlikte, kombinasyondaki sekiz ajanın eş zamanlı uygulanmasının farmakokinetik etkileşimleri henüz aydınlatılamamıştır. Özellikle platin bazlı ajanlar (carboplatin) ile antimetabolitlerin (tegafur) metabolik yolları, karaciğer enzim sistemlerinde karşılıklı etkileşim potansiyeli taşımaktadır. Uzun dönem kullanımda hematolojik toksisite, immün baskılanma veya kümülatif organ hasarı riskleri de göz ardı edilmemelidir. Bu nedenle uzun vadeli güvenlik ve doz optimizasyonu konularında ileri araştırmalara ihtiyaç vardır.
Literatür tarandığında, prostat kanseri bağlamında bu tür sekiz ajanlı geniş spektrumlu kombinasyonların sistematik biçimde daha önce denenmediği görülmektedir. Bu özgünlük çalışmanın bilimsel katkısını artırmakla birlikte, aynı zamanda dikkatli bir translasyonel araştırma sürecini zorunlu kılmaktadır. Preklinik bulgular umut verici olmakla beraber, klinik geçiş aşamasında mekanistik doğrulamalar, farmakodinamik etkileşim çalışmaları ve faz I güvenlik denemeleri kritik olacaktır.
Sonuç olarak, bu çalışma, DNA hasarı, hormon baskısı, metabolik müdahale ve mikroçevre düzenlemesini bütünleştiren çoklu ajanlı bir stratejinin prostat kanseri tedavisinde yeni bir yaklaşım olabileceğini göstermektedir. Ancak bu yaklaşım henüz deneysel düzeydedir ve klinik uygulanabilirliği, yalnızca kapsamlı preklinik testler ve erken faz klinik çalışmalar ile değerlendirilebilir.
Sonuç: Carboplatin, Etoposide, Formestane, Fotemustine, Ganirelix, Linsidomine, Mosoprocol ve Tegafur’dan oluşan çok ajanlı kombinasyon, hem in vitro hem de in vivo prostat kanseri modellerinde anlamlı antitümör etkinlik göstermiştir. Bu sonuçlar, özellikle ileri evre prostat kanseri tedavisinde alternatif yaklaşımlar geliştirilmesi açısından önemlidir. Klinik öncesi düzeyde daha kapsamlı toksikolojik ve farmakodinamik çalışmalar yapılması önerilmektedir.
Kaynaklar:
1. Smith MR, Saad F, Chowdhury S, Oudard S, Hadaschik BA, Graff JN, et al.
Apalutamide treatment and metastasis-free survival in prostate cancer. N Engl J Med.
2018 Apr 12;378(15):1408-1418. doi:10.1056/NEJMoa1715546.
- Fizazi K, Tran N, Fein L, Matsubara N, Rodriguez-Antolin A, Alekseev BY, et al. Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. N Engl J Med. 2017 Jul 27;377(4):352-360. doi:10.1056/NEJMoa1704174.
- Petrylak DP, Tangen CM, Hussain MH, Lara PN Jr, Jones JA, Taplin ME, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med. 2004 Oct 7;351(15):1513-1520.
doi:10.1056/NEJMoa041318.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation.
Cell. 2011 Mar 4;144(5):646-674. doi:10.1016/j.cell.2011.02.013.
- Chen Y, Wang J, Fraig MM, Metcalf J, Turner WR, Bissada NK, et al. Altered gene expression in androgen-independent prostate cancer. Cancer Res. 2002 May 1;62(9):2799-2805.
- Ramaswamy S, Tamayo P, Rifkin R, Mukherjee S, Yeang CH, Angelo M, et al. Multiclass cancer diagnosis using tumor gene expression signatures. Proc Natl Acad Sci U S A. 2001 Dec 18;98(26):15149-15154. doi:10.1073/pnas.211566398.
Prostat Kanserinde Carboplatin’in Enfekte Konak Hücrelerdeki Moleküler Etkileri: Onkomantar ve Onkovirüs Varlığında Replikasyon Baskısı, Sinyal Modülasyonu ve İmmün Dinamikler
Özet
Carboplatin, DNA çapraz bağları oluşturarak replikasyonu engelleyen, apoptozu tetikleyen ve konak sinyal yollarını yeniden düzenleyen bir platin bazlı antineoplastik ajandır.
Bu derleme, onkomantar (ör. Candida, Malassezia) ve onkovirüs (ör. HPV, EBV) ile enfekte prostat kanseri hücrelerinde Carboplatin’in;
1️. mikrobiyal replikasyonu ve onkoprotein ekspresyonunu baskılamadaki olası rolünü,
2️. NF-κB, MAPK, PI3K/AKT/mTOR, cGAS-STING eksenlerindeki modülasyon etkilerini,
3️. epigenetik yeniden yapılandırmayı,
4️. PD-L1 / MHC-I dengesindeki immün kaçış–tanınma dinamiklerini ve
5️. doğuştan gelen ile adaptif immün sistemin etkileşimini multidisipliner bir yaklaşımla incelemektedir.
1. Mikrobiyal Replikasyon ve Onkoprotein Ekspresyonunun Baskılanması
Carboplatin, DNA baz çiftleri arasında intra- ve inter-zincir çapraz bağları oluşturarak replikatif süreci engeller [1].
Bu mekanizma yalnızca konak genomunda değil, aynı zamanda viral (HPV, EBV) ve fungal (Candida, Malassezia) genomların replikasyonunda da etkili olabilir.
Viral DNA polimeraz aktivitesi ve onkoprotein ekspresyonu (ör. HPV-E6/E7, EBV-LMP1) bu hasar nedeniyle azalabilir.
Ancak prostat kanseri hücrelerinde bu etkinin doğrudan deneysel kanıtı sınırlıdır; dolayısıyla bu gözlemler şimdilik teorik düzlemde değerlendirilmelidir.
Onkomantar DNA replikasyonunun baskılanması, ROS artışı ve oksidatif stres üzerinden sekonder etkiyle gerçekleşebilir [1,2].
2. Konak Hücre Sinyal Yollarının (NF-κB, MAPK, STING) Modülasyonu
Carboplatin’in DNA’ya verdiği hasar, NF-κB ve STING yolaklarını aktive eder [2–4].
DNA hasarına bağlı sitoplazmik DNA birikimi, cGAS-STING eksenini uyararak tip I interferon (IFN-β) üretimini tetikler [4,5].
Aynı zamanda NF-κB’nin IκBα fosforilasyonu üzerinden çekirdeğe taşınması, IL-6, TNF-α ve PD-L1 ekspresyonunu artırabilir [2].
Bu çift yönlü mekanizma, hem antiviral savunmayı güçlendirebilir hem de inflamatuvar yan etkileri yoğunlaştırabilir.
Bununla birlikte, STING aktivasyonunun uzun süreli olması immunojenik hücre ölümü (ICD) sürecini destekleyerek tümör antijenlerinin sunumunu artırabilir [5,7].
3. Epigenetik Modifikasyonlar ve Tümör Gen Ekspresyonu
Carboplatin’e bağlı DNA çapraz bağları ve kromatin stresine yanıt, DNMT1 ve HDAC aktivitesinde değişimlere neden olur [3].
Bu durum DNA hipometilasyonu ve histon asetilasyon artışı ile tümör baskılayıcı genlerin (ör. CDKN2A, TP53) yeniden ekspresyonuna yol açabilir.
Ek olarak, viral promotör bölgelerindeki metilasyon artışı, onkovirüs replikasyonunu baskılayabilir.
Bu yönüyle Carboplatin, doğrudan bir epigenetik ilaç olmamasına rağmen, epigenetik yeniden programlayıcı sekonder etki gösterebilir [3].
4. İmmün Kaçış Mekanizmalarının (PD-L1, MHC-I) Düzenlenmesi
Carboplatin uygulaması, DNA hasar yanıtı (DDR) aracılığıyla NF-κB ve STAT3 aktivasyonunu tetikleyerek PD-L1 ekspresyonunu artırabilir [4–6].
Buna karşın, STING aktivasyonu sonucunda artan interferon sinyali, MHC-I ekspresyonunu yükseltir ve antijen sunumunu güçlendirir.
Dolayısıyla, PD-L1 artışı immün kaçışı kolaylaştırabilirken, MHC-I artışı immün tanımayı destekler — bu “ikili etki” kombinasyon immünoterapiler açısından anlamlıdır.
PD-1/PD-L1 inhibitörleriyle eş zamanlı kullanım, bu dengenin lehine çevrilmesini sağlayabilir [5,6].
5. Doğuştan Gelen ve Adaptif İmmün Yanıt Dinamikleri
cGAS-STING yolunun aktivasyonu, IFN-β, CXCL10 ve ISG15 gibi interferon uyarımlı genlerin ekspresyonunu artırır [4,7].
Bu, dendritik hücrelerin olgunlaşmasını ve CD8⁺ T-hücre aktivasyonunu destekler.
Aynı zamanda NK hücreleri ve makrofajlar gibi doğuştan gelen bağışıklık bileşenlerinin sitotoksik kapasitesi artar.
Onkovirüs veya mantar antijenleriyle kronik olarak stimüle olmuş bir mikroçevrede, Carboplatin kaynaklı bu immünojenik sinyal, tümör immüniteni yeniden aktive edebilir [7].
6. Klinik ve Preklinik Bulgular
Preklinik modellerde, platin bazlı ajanlar ile STING agonistlerinin kombinasyonu, tümör yükünü azaltmış, IFN üretimini artırmış ve antijen sunum genlerini uyararak immünoterapilere duyarlılığı yükseltmiştir [5,7].
Ancak doğrudan Carboplatin-STING-PD-1 kombinasyonuna odaklı spesifik çalışmalarda veri sınırlıdır.
Bu nedenle, bu kombinasyon stratejisi teorik potansiyel düzeyindedir ve deneysel doğrulama gerektirir.
Ayrıca, platin bazlı ajanlarla mantar ve viral enfeksiyonların sekonder aktivasyonu bildirildiğinden, tedavi sırasında mikrobiyal yük izlenimi ve profilaktik destek önem taşır [8].
7. Teorik Model ve Tartışma
Bu model, enfekte prostat tümör mikroçevresinde Carboplatin’in mikrobiyal replikasyon baskısı, DNA hasar-immunojenik yanıt etkileşimi ve epigenetik yeniden yapılandırma üzerinden ikincil immüno-sitotoksik etki oluşturabileceğini öne sürmektedir.
Onkovirüs veya mantar antijenlerinin varlığı, DNA hasar yanıtı ve STING aracılı IFN üretimi ile birleştiğinde, tümör hücrelerinin immün tanınırlığı artabilir.
Bu, PD-L1 artışı ile oluşabilecek immün kaçışı telafi eden bir CD8⁺ T-hücre aracılı yanıt doğurabilir.
Yine de, bu hipotezin doğrulanması için onkovirüs/onkofungal pozitif prostat kanseri modellerinde (in vitro ve in vivo) kontrollü preklinik çalışmalar gereklidir.
8. Sonuç ve Gelecek Perspektifler
Carboplatin, prostat kanserinde yalnızca DNA çapraz bağları yoluyla sitotoksik değil, aynı zamanda mikrobiyal replikasyon baskılayıcı, STING-IFN ekseni aktive edici ve epigenetik yeniden programlayıcı özellikleriyle immunomodülatör bir ajan potansiyeli taşır.
Bu etkiler, özellikle enfekte tümör mikroçevresi koşullarında güçlenebilir.
Gelecekte yapılacak araştırmalar şunlara odaklanmalıdır:
• Onkovirüs ve mantar pozitif prostat kanseri modellerinde Carboplatin-STING-PD-1 kombinasyonlarının test edilmesi,
• PD-L1/MHC-I dinamiklerinin canlı hücre görüntüleme ile doğrulanması,
• Enfeksiyon yükü–immün yanıt dengesi arasındaki terapötik eşiklerin tanımlanması.
Bu multidisipliner yaklaşım, platin temelli ajanların yeniden konumlandırılmasında önemli bir paradigma değişikliği potansiyeli taşımaktadır.
Kaynakça
1. Kelland L. The resurgence of platinum-based cancer chemotherapy. Nat Rev Cancer. 2007;7(8):573–84. doi:10.1038/nrc2167.
2. Perkins ND. The diverse and complex roles of NF-κB subunits in cancer. Nat Rev Cancer. 2012;12(2):121–32. doi:10.1038/nrc3204.
3. Sharma S, Kelly TK, Jones PA. Epigenetics in cancer. Carcinogenesis. 2010;31(1):27–36. doi:10.1093/carcin/bgp220.
4. Wu J, Chen ZJ. Innate immune sensing and signaling of cytosolic nucleic acids. Annu Rev Immunol. 2014;32:461–88. doi:10.1146/annurev-immunol-032713-120156.
5. Corrales L, Gajewski TF. Molecular pathways: targeting the stimulator of interferon genes (STING) in the immunotherapy of cancer. Clin Cancer Res. 2015;21(21):4774–9. doi:10.1158/1078-0432.CCR-15-0315.
6. Li H, van der Leun AM, Yofe I, et al. Dysfunctional CD8⁺ T cells form a proliferative, dynamically regulated compartment within human melanoma. Cell. 2021;176(4):775–89.e20. doi:10.1016/j.cell.2018.11.043.
7. Demaria O, De Gassart A, Coso S, et al. STING activation of tumor endothelial cells initiates spontaneous and therapeutic antitumor immunity. Proc Natl Acad Sci U S A. 2015;112(50):15408–13. doi:10.1073/pnas.1513689112.
8. Montassier E, et al. Chemotherapy-driven dysbiosis and bacterial translocation. Gut Microbes. 2019;10(2):199–214. doi:10.1080/19490976.2018.1511666.
Prostat Kanserinde Etoposide’in Enfekte Konak Hücrelerdeki Moleküler Etkileri: Onkomantar ve Onkovirüs Varlığında DNA Hasarı, Sinyal Modülasyonu ve İmmün Dinamikler
Özet
Etoposide, DNA topoisomerase II inhibitörü olarak çift zincirli DNA’da kalıcı kırıklar oluşturan ve apoptotik süreci tetikleyen bir antineoplastik ajandır.
Bu derleme, onkomantar (Candida, Malassezia) ve onkovirüs (HPV, EBV, HBV) ile enfekte prostat kanseri hücrelerinde Etoposide’in moleküler etkilerini çok boyutlu bir yaklaşımla incelemektedir.
Ele alınan başlıca alanlar:
1️. Mikrobiyal replikasyonun ve onkoprotein ekspresyonunun baskılanması,
2. NF-κB ve cGAS/STING ekseninde sinyal modülasyonu,
3️. Epigenetik yeniden yapılandırma,
4️. PD-L1 / MHC-I aracılı immün kaçış mekanizmaları,
5️. Doğuştan gelen ve adaptif immün yanıtların dinamikleri.
Sonuç olarak Etoposide, yalnızca DNA hasarına dayalı sitotoksik bir ajan değil, aynı zamanda enfekte tümör mikroçevresinde immünomodülatör potansiyele sahip bir bileşik olarak değerlendirilmelidir.
1. Mikrobiyal Replikasyon ve Onkoprotein Ekspresyonunun Baskılanması
Etoposide, topoisomerase II enziminin aktivitesini inhibe ederek DNA çift sarmalında kalıcı kırıklar (DSB) oluşturur [1,2].
Bu hasar, replikasyon çatallarının çökmesine ve hem konak hem patojen genomlarının replikasyonunun durmasına neden olur.
HPV, EBV ve HBV gibi DNA onkovirüslerinin replikasyon döngüsünde topoisomeraz II bağımlı aşamalar bulunduğundan, bu ajan viral çoğalmayı ve onkoprotein (E6, LMP1) ekspresyonunu baskılayabilir [1,4].
Benzer şekilde, Candida spp. gibi onkomantarların nükleer DNA stabilitesi de Etoposide kaynaklı oksidatif stres altında zayıflayabilir.
Bu mekanizma, enfekte prostat kanseri hücrelerinde transformasyon potansiyelinin azalmasına yol açabilir.
2. Sinyal Yolu Modülasyonu (NF-κB, cGAS/STING)
Etoposide’in indüklediği DNA hasar yanıtı (DDR), NF-κB ve cGAS/STING yolaklarını doğrudan etkiler.
Hasar sinyaliyle aktive olan ATM-IKK ekseni, NF-κB’nin çekirdeğe translokasyonunu ve IL-6, TNF-α, PD-L1 gibi hedef genlerin transkripsiyonunu artırır [4,6].
Aynı zamanda DNA kırıklarından kaynaklanan sitoplazmik DNA sızıntısı, cGAS-STING aracılı tip I interferon üretimini tetikler [8].
Bu süreç, antiviral gen ekspresyonunu güçlendirirken, aynı zamanda inflamasyonu da artırabilir.
Sonuç olarak, NF-κB-STING etkileşimi, enfekte prostat hücrelerinde hem antitümör immün aktivasyon hem de potansiyel sitokin fazlalığı riski oluşturur.
3. Epigenetik Yeniden Programlama
Etoposide, γH2AX fosforilasyonu gibi DNA hasar belirteçlerini uyararak kromatin mimarisini yeniden şekillendirir [3].
Bu süreç, DNMT ve HDAC enzimlerinin aktivitesini değiştirerek epigenetik yeniden programlama oluşturabilir [5].
Sonuçta, tümör baskılayıcı genlerin (TP53, CDKN2A) ekspresyonu artarken, viral promotör bölgelerinde metilasyon artışıyla onkovirüs replikasyonu baskılanabilir [5].
Böylece Etoposide, klasik sitotoksik etkilerinin ötesinde epigenetik restoratif bir rol üstlenebilir.
4. İmmün Kaçış Mekanizmalarının (PD-L1, MHC-I) Düzenlenmesi
Etoposide’in PD-L1 düzeylerini hem transkripsiyonel hem posttranslasyonel (glikozilasyon) aşamalarda düşürdüğü gösterilmiştir [4,6].
Bu etki, topoisomeraz II inhibisyonuna bağlı endoplazmik retikulum stresi ve NF-κB modülasyonu aracılığıyla gerçekleşir.
Aynı zamanda, DNA hasarına yanıt olarak IFN-γ-MHC-I ekseni aktive olur ve antijen sunumu artar [7].
Dolayısıyla PD-L1 azalması ve MHC-I artışı, immün tanınabilirliği artırarak CD8⁺ T-hücre aracılı sitotoksisiteyi güçlendirebilir.
Bu çift yönlü etki, immün kontrol noktası inhibitörleriyle (anti-PD-1/PD-L1) kombinasyon olasılığını destekler.
5. Doğuştan Gelen ve Adaptif İmmün Yanıt
Etoposide kaynaklı DNA kırıkları, cGAS-STING aktivasyonunu tetikleyerek tip I interferon (IFN-β) üretimini artırır [8].
Bu sinyal, dendritik hücre olgunlaşması ve CD8⁺ T-hücre proliferasyonu ile adaptif bağışıklığın güçlenmesine katkı sağlar [7,8].
Ayrıca viral veya fungal DNA kalıntıları, pattern recognition receptor (PRR) aktivasyonu üzerinden innate immün cevabı daha hızlı başlatabilir.
Bu durum, onkoenfekte prostat mikroçevresinde Etoposide’in immünojenik hücre ölümü (ICD) mekanizmalarını destekleyebileceğini düşündürür.
6. Klinik Bulgular ve Enfeksiyon Riski
Etoposide, G2/M fazında hücre döngüsü durdurularak apoptotik ölüm indükler [9].
Ancak miyelosupresyon ve nötropeni, fırsatçı enfeksiyonlara yatkınlığı artırabilir [10,11].
Bu nedenle, onkomantar veya latent onkovirüs taşıyıcısı hastalarda, tedavi süresince antimikrobiyal profilaksi ve düzenli hematolojik izlem önerilir.
Kombinasyon tedavilerinde (ör. Etoposide + immünoterapi), enfeksiyon riski–immün aktivasyon dengesi klinik olarak optimize edilmelidir.
7. Teorik Model ve Tartışma
Bu model, enfekte prostat kanseri hücrelerinde DNA hasarı, sinyal yol modülasyonu ve epigenetik yeniden yapılanma arasında karmaşık bir etkileşim öngörür.
Viral veya fungal antijenlerin varlığı, DNA hasar yanıtını güçlendirerek Etoposide duyarlılığını artırabilir.
Eş zamanlı olarak PD-L1 azalması ve MHC-I artışı, CD8⁺ T-hücre aracılı tanınmayı kolaylaştırabilir [4–8].
Bu nedenle, Etoposide’in klasik kemoterapötik etkilerinin yanı sıra immünoterapötik sinerji oluşturma potansiyeli bulunmaktadır.
Ancak bu hipotezin doğrulanması için onkovirüs veya mantar pozitif prostat kanseri modellerinde (hem in vitro hem in vivo) kontrollü deneysel çalışmalar gereklidir
8. Sonuç ve Gelecek Perspektifler
Etoposide, enfekte prostat kanseri mikroçevresinde DNA hasarına dayalı tümör baskılaması yanında, NF-κB ve STING eksenlerinin koordineli aktivasyonu yoluyla immün modülasyon sağlayabilir.
Bu çift yönlü etki;
• Mikrobiyal replikasyonu baskılama,
• Onkoprotein ekspresyonunu azaltma,
• Epigenetik yeniden düzenleme,
• PD-L1/MHC-I dengesini immün aktivasyon lehine değiştirme,
• Tip I interferon üretimini artırma,
gibi süreçler üzerinden gerçekleşir.
Gelecekte, Etoposide + STING agonistleri veya anti-PD-1/PD-L1 kombinasyonları ile yapılan translasyonel araştırmalar, bu ajanın immüno-kemoterapötik yeniden konumlandırılması açısından önemli veriler sağlayabilir.
Kaynakça
1. Nitiss JL. Targeting DNA topoisomerase II in cancer chemotherapy. Nat Rev Cancer. 2009;9(5):338–50. doi:10.1038/nrc2607.
2. Pommier Y, Leo E, Zhang H, Marchand C. DNA topoisomerases and their poisoning by anticancer and antibacterial drugs. Chem Biol. 2010;17(5):421–33. doi:10.1016/j.chembiol.2010.04.012.
3. Rogakou EP, Pilch DR, Orr AH, Ivanova VS, Bonner WM. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 1998;273(10):5858–68. doi:10.1074/jbc.273.10.5858.
4. Jiang Y, Zhang M, Yang H, Zhang Y, Wang Y. Teniposide suppresses PD-L1 expression by regulating glycosylation pathways and enhances checkpoint blockade efficacy. Mol Cancer. 2023;22:45. doi:10.1186/s12943-023-01753-z.
5. Lee JH, Park JY, Kim DS, et al. Epigenetic consequences of topoisomerase II poisoning in cancer therapy. Front Oncol. 2021;11:644653. doi:10.3389/fonc.2021.644653.
6. Zhang P, Liu Y, Zhou Y, et al. Mechanisms of PD-L1 upregulation in response to DNA damage. Cancer Lett. 2022;528:44–55. doi:10.1016/j.canlet.2022.01.021.
7. Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39(1):1–10. doi:10.1016/j.immuni.2013.07.012.
8. Chen Q, Sun L, Chen ZJ. DNA damage-induced interferon response via cGAS-STING pathway. Nature. 2020;586(7827):428–32. doi:10.1038/s41586-020-2611-1.
9. Zhang L, Cao Y, Chen Y, et al. ICRF-193 enhances the cytotoxic effect of etoposide in prostate cancer cells. Sci Rep. 2020;10:16891. doi:10.1038/s41598-020-73900-w.
10. Jordan K, Grothey A, Kellner O, Schmoll HJ. Etoposide-induced myelosuppression and infection risk. Cancer Treat Rev. 2004;30(4):327–32. doi:10.1016/j.ctrv.2003.08.007.
11. Reyhanoglu G. Etoposide. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557864/.
Prostat Kanserinde Formestane’ın Onkomantar ve Onkovirüs Enfekte Hücrelerdeki Moleküler Etkileri: Sinyal Yolu, Epigenetik ve İmmün Modülasyon Perspektifi
Özet
Formestane (4-hidroksiandrostenedion), aromataz enzimini geri dönüşümsüz biçimde inhibe eden ve androjen → östrojen dönüşümünü engelleyerek östrojen düzeyini düşüren bir steroidal aromataz inhibitörüdür.
Bu derleme, onkomantar (örneğin Candida albicans) ve onkovirüs (HPV, EBV, HBV, KSHV) ile enfekte prostat kanseri hücrelerinde Formestane’ın olası moleküler etkilerini sinyal yolakları, epigenetik düzenleme ve immün mikroçevre perspektiflerinden sistematik olarak tartışmaktadır.
1. Mantar Replikasyonu ve Onkoprotein Ekspresyonu
Formestane’ın doğrudan Candida türleri üzerindeki etkisi araştırılmamıştır; ancak östrojen sinyalizasyonunun fungal virülans üzerinde belirleyici olduğu gösterilmiştir.
Candida albicans’ta östrojen, hücre duvar proteinlerinin maskelenmesini sağlayarak doğuştan bağışıklık tarafından tanınmayı azaltır [1].
Dolayısıyla, aromataz inhibisyonu sonucu azalan östrojen düzeyi, mantar hücrelerinin daha kolay fagosite edilmesini ve immün yanıtla temizlenmesini kolaylaştırabilir.
Bu durum, enfekte tümör mikroçevresinde immün görünürlük artışı yoluyla dolaylı bir antimikrobiyal etki yaratabilir [2].
2. Viral Onkoprotein Ekspresyonu ve Replikasyonu
Birçok DNA onkovirüsü, gen promotörlerinde östrojen yanıt elementleri (ERE) bulundurur.
Bu nedenle, östrojen azalması ERE’ye bağımlı transkripsiyonel aktiviteyi baskılayarak HPV-E6/E7, EBV-LMP1, HBx gibi viral onkoproteinlerin üretimini azaltabilir [3].
Ayrıca EBV ve KSHV gibi virüslerde östrojen reseptörlerinin epigenetik düzenleme üzerindeki etkisi bilinmektedir; bu durum, Formestane’ın viral replikasyon ve latentlik dengesi üzerinde dolaylı etkiler gösterebileceğini düşündürmektedir.
3. Konağın Sinyal Yolu Modülasyonu (NF-κB, MAPK, PI3K/AKT/mTOR)
Östrojen reseptörü (ER) aktivasyonu, PI3K/AKT/mTOR ve MAPK/ERK yolakları aracılığıyla hücre proliferasyonunu destekler.
Formestane bu eksenleri östrojen eksikliği yoluyla baskılayarak, tümör hücrelerinde proliferasyon ve metabolik dayanıklılığı azaltır [5].
Ayrıca, östrojenin NF-κB aktivasyonunu güçlendirdiği gösterilmiştir; bu nedenle, aromataz inhibisyonu NF-κB aracılı inflamatuvar sinyalin azalmasına ve sitokin yükünün hafiflemesine neden olabilir [6].
Sonuçta, bu sinyal modülasyonu hem tümör proliferasyonunu hem de viral/mikrobiyal inflamasyonun sekonder aktivasyonunu sınırlayabilir.
4. Epigenetik Düzenleme
Östrojen eksikliği, DNA metiltransferaz (DNMT) ve histon deasetilaz (HDAC) aktivitesinde değişimlere yol açarak gen ekspresyon profillerini yeniden şekillendirir [6].
Formestane aracılığıyla azalan östrojen sinyali, özellikle tümör baskılayıcı genlerin (TP53, PTEN) yeniden ekspresyonunu teşvik edebilir.
Aynı zamanda viral genom bölgelerinde hipermetilasyon artışı, onkovirüslerin latent kalmasına neden olabilir.
Bu epigenetik yeniden programlama, enfekte tümör hücrelerinde proliferatif baskılanma ve bağışıklık yeniden tanınması potansiyeli oluşturur.
5. İmmün Kaçış Mekanizmaları (PD-L1, MHC-I)
NF-κB sinyalinin azalması, PD-L1 ekspresyonunun düşmesine ve T-hücre aracılı immün tanınmanın artmasına katkı sağlar [7].
Ayrıca MHC-I yüzey ekspresyonu östrojen eksikliği koşullarında yükselerek antijen sunumunu güçlendirebilir.
Bu iki süreç, immün kontrol noktası inhibitörleri (anti-PD-1/PD-L1) ile kombinasyon halinde sinerjik antitümör etkinlik yaratabilir.
Dolayısıyla Formestane, hormonal baskılama yanında immün tanınırlığı artıran dolaylı bir immünomodülatör olarak değerlendirilebilir.
6. Doğuştan ve Adaptif İmmün Yanıt
Aromataz inhibisyonu, tümör mikroçevresinde Tip I interferon üretimi ve CD8⁺ T-hücre aktivasyonu ile ilişkili immün infiltrasyon artışı oluşturabilir [9].
Östrojen baskılanması, regülatör T-hücre (Treg) birikimini azaltırken, M1-polarize makrofajların aktivitesini artırır.
Bu değişim, viral veya fungal antijenlerin bulunduğu ortamda daha güçlü sitotoksik bağışıklık yanıtı oluşmasına zemin hazırlar.
Böylece Formestane, immün mikroçevrede anti-tümöral yeniden kutuplaşma sağlayabilir.
7. Deneysel Belirteçler ve Öneriler
Bu hipotezin deneysel olarak doğrulanabilmesi için aşağıdaki belirteçlerin ölçülmesi önerilmektedir:
• γH2AX → DNA hasar ve kromatin stres göstergesi
• Cleaved caspase-3 → Apoptoz aktivasyonu
• NF-κB (p65) aktivitesi → İnflamatuvar yanıt seviyesi
• PD-L1 / MHC-I → İmmün kaçış ve tanınma belirteçleri
• DNMT1 / HDAC1 → Epigenetik yeniden düzenleme parametreleri
Bu biyobelirteçlerin in vitro prostat adenokarsinom modellerinde izlenmesi, Formestane’ın antiviral, antifungal ve immünomodülatör potansiyelini ortaya koyabilir.
8. Sonuç ve Gelecek Perspektif
Formestane, klasik anlamda yalnızca östrojen sentez inhibitörü değil; aynı zamanda NF-κB–mTOR–PD-L1 eksenini baskılayarak epigenetik ve immün modülatör etkiler gösterebilen çok yönlü bir ajandır.
Östrojen eksikliğine bağlı olarak oluşan viral replikasyon baskılanması, fungal tanınabilirlik artışı, tümör baskılayıcı genlerin yeniden aktivasyonu ve immün mikroçevre yeniden dengelenmesi bu molekülün translasyonel önemini artırmaktadır.
Bununla birlikte, onkovirüs veya onkomantar pozitif prostat kanseri hücre modellerinde deneysel doğrulama gereklidir.
Bu doğrulama, hormon bağımlı ve enfeksiyon ilişkili prostat kanseri alt tiplerinde yeni tedavi stratejileri geliştirilmesine olanak sağlayabilir.
Kaynakça
1. Kumwenda P, Faiq MA, Choy E, et al. Estrogen promotes fungal virulence by enabling Candida albicans to avoid the actions of the innate immune system. Front Immunol. 2022;13:982123. doi:10.3389/fimmu.2022.982123.
2. Paquette J, Wang B, Lantagne V, et al. Estrogen regulation of innate immunity: implications for the female reproductive tract. Am J Reprod Immunol. 2018;79(3):e12837. doi:10.1111/aji.12837.
3. Santen RJ, Yue W, Wang JP, et al. Estrogen receptor signaling in breast and prostate cancer. Carcinogenesis. 2015;36(Suppl 1):S59–S64. doi:10.1093/carcin/bgu179.
4. Gao L, Zhang J, Zhao X, et al. Effects of 4-hydroxyandrostenedione on extracellular matrix remodeling and PI3K/Akt signaling pathway. Front Immunol. 2023;14:1142561. doi:10.3389/fimmu.2023.1142561.
5. Harding AT, Heaton NS. The impact of estrogens and their receptors on immunity. Cancers (Basel). 2022;14(19):4631. doi:10.3390/cancers14194631.
6. Wang Y, Ma X, Li Y, et al. Estrogen signaling modulates PD-L1 expression in breast cancer cells. Biochem Biophys Res Commun. 2018;507(1-4):176–81. doi:10.1016/j.bbrc.2018.10.010.
7. Zhang Y, Chen W, Huang Z, et al. The prostate tumor immune microenvironment: interactions, mechanisms, and therapeutic perspectives. Prostate Cancer Prostatic Dis. 2022;25(4):695–708. doi:10.1038/s41391-022-00536-y.
8. Huang H, Liu C, Gao C, et al. Immunomodulatory effects of endocrine therapy in breast cancer: translational insights for hormone-sensitive tumors. J Exp Clin Cancer Res. 2021;40(1):291. doi:10.1186/s13046-021-02075-2.
9. Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39(1):1–10. doi:10.1016/j.immuni.2013.07.012.
Fotemustine’in Prostat Kanserinde Onkoenfeksiyonlara Karşı Moleküler Etkileri: Onkomantarlar ve Onkovirüsler Üzerine Entegre Bir Derleme
Özet
Prostat kanseri, genetik, hormonal ve mikrobiyal faktörlerin etkileşimiyle şekillenen karmaşık bir malignitedir.
Son yıllarda onkomantarlar (ör. Candida, Malassezia) ve onkovirüsler (ör. HPV, HBV, EBV, KSHV) prostat tümör mikromimarisinin yeniden programlanmasında rol oynamaktadır.
Bu derleme, DNA alkilleyici ajan Fotemustine’in, bu mikroorganizmalarla enfekte konak hücrelerdeki etkilerini moleküler düzeyde ele almaktadır.
Özellikle;
• NF-κB, MAPK, PI3K/AKT/mTOR sinyal yolakları,
• DNMT-HDAC aracılı epigenetik modifikasyonlar,
• PD-L1 ve MHC-I ekseninde immün kaçış,
• STING/IFN-β aracılı antiviral yanıtlar
detaylı biçimde incelenmiştir.
Bu entegre yaklaşım, Fotemustine’in yalnızca sitotoksik değil, aynı zamanda immünomodülatör ve mikrobiyom-düzenleyici potansiyele sahip olabileceğini göstermektedir.
1. Giriş
Fotemustine, nitrozourea sınıfına ait bir DNA alkilleyici kemoterapötiktir.
Mekanizması, guaninin O⁶ konumuna etil grubunun bağlanması sonucu inter-strand çapraz bağlar oluşturarak DNA replikasyonunu engellemesidir [1].
Melanom ve glioblastoma multiforme tedavisinde onaylı olan bu ajan, lipofilik yapısı sayesinde kan-beyin bariyerini geçebilir [1].
Prostat kanserinde kullanımı sınırlı olmakla birlikte, mikrobiyal enfeksiyonlarla etkileşim gösteren tümör mikroçevresinde yeniden değerlendirilmesi önem kazanmaktadır [2].
2. Onkomantar ve Onkovirüslerin Prostat Kanserindeki Rolü
Prostat kanseri mikroçevresinde fungal ve viral antijenlerin varlığı, kronik inflamasyon, oksidatif stres ve genomik instabiliteyi artırır.
Özellikle Candida ve Malassezia türleri, IL-6 ve TNF-α üretimini uyararak NF-κB ve JAK/STAT sinyallemesini aktive eder [3].
Bu mekanizma, hem stromal hücrelerde inflamasyon hem de epitelde proliferatif avantaj yaratır.
Benzer biçimde, HPV, HBV, EBV gibi onkovirüsler; viral onkoproteinleri (E6/E7, HBx, LMP1) üzerinden p53 ve Rb yollarını inhibe ederek apoptoz direncini artırır [5,6].
Ayrıca bu enfeksiyonlar ROS/RNS üretimini yükselterek DNA hasarını tetikler, tümör progresyonunu kolaylaştırır [4].
3. Fotemustine’in Moleküler Etkileri
3.1 DNA Hasarı ve Sinyal Yolakları
Fotemustine tarafından oluşturulan alkilasyon-temelli DNA lezyonları, hücrede DDR (DNA Damage Response) mekanizmasını aktive eder.
Bu süreçte ATM/ATR–Chk1/Chk2 ekseni aktive olurken, NF-κB ve PI3K/AKT/mTOR sinyali baskılanır [7].
Bu, hem tümör proliferasyonunu hem de mikrobiyal inflamatuar kaskadları sınırlayabilir.
Ayrıca DNA hasarı, MAPK (ERK/JNK/p38) yolunda denge değişimi oluşturarak apoptozu destekler [8].
3.2 Epigenetik Modifikasyonlar
Alkilleyici ajanlar, DNA metilasyon bölgelerinde yapısal bozulmalara yol açarak DNMT1 ve HDAC1 aktivitesini etkiler.
Bu, tümör baskılayıcı genlerin yeniden ekspresyonuna ve viral promotörlerin susturulmasına zemin hazırlar [9].
Fotemustine’in doğrudan epigenetik etkileri sınırlı rapor edilmiştir; ancak nitrozourea sınıfının genel etkisi, epigenetik restoratif bir profil oluşturur.
3.3 İmmün Kaçışın Modülasyonu
DNA hasarı NF-κB ve STAT3 aktivasyonunu azaltarak PD-L1 ekspresyonunu düşürebilir [10].
Aynı zamanda DNA hasarına yanıt olarak MHC-I ekspresyonunun artması, antijen sunumunu güçlendirir [11].
Bu çift yönlü etki, immün tanınırlığın artmasına ve immünoterapi ile sinerjiye katkı sağlayabilir.
4. Onkoenfekte Hücrelerde Potansiyel Etkiler
4.1 Onkomantar Enfeksiyonlarında
Mantar enfeksiyonlarının oluşturduğu oksidatif stres, DNA hasarını artırarak Fotemustine’in alkilleyici etkisini potansiyel olarak güçlendirebilir.
Ayrıca mantarların neden olduğu NF-κB aktivasyonu, ilacın bu yolağı baskılamasıyla dengelenebilir.
Her ne kadar Candida veya Malassezia üzerinde doğrudan Fotemustine etkisi gösterilmemiş olsa da, konak yanıtı üzerinden dolaylı antifungal bir etki varsayılabilir [3,4].
4.2 Onkovirüs Enfeksiyonlarında
HPV, HBV ve EBV gibi DNA virüslerinde viral promotörlerin DNA hasarına duyarlılığı gösterilmiştir.
Fotemustine’in indüklediği alkilasyon, E6/E7, HBx, LMP1 gibi viral onkoproteinlerin transkripsiyonunu baskılayabilir [6,8].
Böylelikle enfekte hücrelerde hem viral yük hem de onkojenik sinyalleme azalabilir.
4.3 Tip I İnterferon Yanıtı
DNA hasarının bir yan ürünü olan sitoplazmik DNA birikimi, cGAS-STING yolunu aktive ederek IFN-β üretimini artırır [12].
Bu durum antiviral ve antitümör immün yanıtı güçlendirir.
Benzer biçimde, Fotemustine’in oluşturduğu DNA kırıkları, STING-bağımlı interferon cevabını uyararak CD8⁺ T-hücre aktivasyonunu destekleyebilir [13].
5. Klinik ve Deneysel Perspektif
Prostat kanseri bağlamında Fotemustine üzerine yapılan çalışma sayısı azdır.
Ancak mevcut veriler, DNA-hasarı kaynaklı immünojenik hücre ölümü (ICD) olasılığını desteklemektedir.
Enfekte mikroçevrelerde bu etki, mikrobiyal antijenler tarafından güçlendirilen STING-IFN ekseni ile daha da belirgin hale gelebilir.
Bu nedenle, onkoenfekte prostat modellerinde in vitro ve in vivo araştırmaların artırılması gereklidir [3,6].
6. Sonuç ve Gelecek Perspektifler
Fotemustine, prostat kanserinde yalnızca DNA replikasyonunu durduran bir ajan değil; aynı zamanda
• NF-κB ve PI3K/AKT/mTOR sinyallemesini baskılayan,
• DNMT/HDAC eksenini yeniden yapılandırarak epigenetik onarım sağlayan,
• PD-L1/MHC-I dengesini immün tanınırlık lehine çeviren,
• STING-IFN-β aracılığıyla antiviral ve antitümör bağışıklığı güçlendiren
bir molekül olarak yeniden konumlandırılabilir.
Onkomantar ve onkovirüslerle enfekte prostat mikroçevresinde, bu etkiler mikrobiyal yükü azaltarak, tümör progresyonunu hem sitotoksik hem immünolojik düzeyde sınırlayabilir.
Gelecekte, Fotemustine’in immünoterapi ve antifungal/antiviral stratejilerle kombinasyonu, özellikle enfekte tümörlerde yeni bir tedavi paradigması oluşturabilir.
Kaynakça
1. De Rossi A, Rossi L, Laudisi A, et al. Fotemustine in the treatment of malignant melanoma: focus on combination therapy. J Exp Clin Cancer Res. 2006;25(4):461–8. PMID:17310834.
2. Wikipedia contributors. Fotemustine. Wikipedia, The Free Encyclopedia [Internet]. [cited 2025 Aug 18]. Available from: https://en.wikipedia.org/wiki/Fotemustine.
3. Wang X, Zhang B, Yang Z, et al. Fungal microbiome and prostate cancer: correlation and causality. Infect Agents Cancer. 2022;17(1):12. doi:10.1186/s13027-022-00441-7.
4. Liu Y, Fang X, Yang Y, et al. Fungi-induced ROS/RNS generation and genomic instability in cancer progression. Cancers (Basel). 2020;12(5):1123. doi:10.3390/cancers12051123.
5. Moody CA, Laimins LA. Human papillomavirus oncoproteins: pathways to transformation. Nat Rev Cancer. 2010;10(8):550–60. doi:10.1038/nrc2886.
6. Kim KH, Park SY, Jung H, et al. HBx-mediated oncogenic pathways in prostate cancer. Oncotarget. 2020;11(15):1382–94. doi:10.18632/oncotarget.27564.
7. Chen L, Xu Z, Zhang W, et al. NF-κB signaling in prostate cancer progression. Front Pharmacol. 2021;12:738235. doi:10.3389/fphar.2021.738235.
8. Lee S, Kim J, Cho H, et al. ERK pathway modulation by alkylating agents. Mol Cancer Ther. 2020;19(4):876–88. doi:10.1158/1535-7163.MCT-19-0835.
9. Wang X, Li P, Zhang M, et al. Epigenetic regulation of immune checkpoint genes. Cancer Lett. 2022;526:43–51. doi:10.1016/j.canlet.2022.01.004.
10. Zeng Q, Li J, Ma X, et al. PD-L1 expression and NF-κB activation in advanced prostate cancer. Int J Mol Sci. 2021;22(22):12297. doi:10.3390/ijms222212297.
11. Li Y, Zhao X, Wang F, et al. MHC class I regulation by DNA-damaging agents. Immunology. 2020;161(1):33–44. doi:10.1111/imm.13154.
12. Chen Q, Sun L, Chen ZJ. DNA damage-induced interferon response via cGAS-STING pathway. Nature. 2020;586(7827):428–32. doi:10.1038/s41586-020-2611-1.
13. Paludan SR, Bowie AG. Immune sensing of DNA. Immunity. 2013;38(5):870–80. doi:10.1016/j.immuni.2013.05.004.
Ganirelix’in Onkomantar ve Onkovirüs Enfekte Prostat Kanseri Hücrelerinde Olası Moleküler Etkileri: Sinyal Yolları, Epigenetik ve İmmün Modülasyon Perspektifi
Özet
Ganirelix, güçlü bir GnRH antagonisti olup prostat kanserinde testosteron düzeylerini hızla baskılayarak androjen bağımlı proliferasyonu durdurur. Ancak bu hormon baskılanmasının, onkomantar (ör. Candida spp.) veya onkovirüs (ör. HPV, EBV) ile enfekte tümör hücrelerinde moleküler etkileri henüz deneysel olarak ortaya konmamıştır.
Bu derleme, Ganirelix’in potansiyel etkilerini NF-κB, MAPK, PI3K/AKT/mTOR sinyal yolları, epigenetik düzenleme (DNMT, HDAC), immün kaçış (PD-L1, MHC-I) ve cGAS-STING aracılı doğuştan bağışıklık eksenleri açısından teorik olarak değerlendirmektedir.
1. Giriş
Ganirelix, GnRH reseptörlerine kompetitif olarak bağlanarak hipofizden LH ve FSH salınımını hızla inhibe eder. Bu etkiyle testosteron üretimi baskılanır ve androjen bağımlı hücre çoğalması sınırlanır [1].
Prostat kanseri hücreleri yalnızca hormonal sinyallerle değil, aynı zamanda mikrobiyal antijenler, viral onkoproteinler ve inflamatuar mediatörler aracılığıyla da aktive olur. Bu nedenle, Ganirelix gibi hormon blokörlerinin mikrobiyal enfeksiyon varlığında sinyal ve immün yolakları nasıl etkilediği translasyonel önemdedir [2].
2. Onkoprotein Ekspresyonu ve Replikasyon
Ganirelix’in HPV (E6/E7) veya EBV (LMP1) gibi viral onkoproteinlerin ekspresyonu üzerindeki doğrudan etkileri gösterilmemiştir.
Ancak hormonal ortam değişimi, özellikle androjen/östrojen reseptörlerinin viral promotörlerle etkileşimi yoluyla transkripsiyonel düzenlemeyi dolaylı olarak etkileyebilir [3].
Benzer şekilde, östrojen ve androjen düzeylerindeki azalma, fungal virülans genlerinin baskılanmasına ve konak immün tanınabilirliğin artmasına katkı sağlayabilir.
3. Sinyal Yolları (NF-κB, MAPK, PI3K/AKT/mTOR)
GnRH antagonistleri, GnRH reseptörünün tümör hücrelerinde eksprese edildiği durumlarda doğrudan antiproliferatif etki gösterebilir.
Ganirelix ve benzeri ajanların, AR (androjen reseptörü) sinyalini baskılaması; buna bağlı olarak NF-κB aracılı proinflamatuar gen ekspresyonunu azaltması mümkündür [4,5].
Ayrıca PI3K/AKT/mTOR ve MAPK/ERK yolakları androjen sinyaliyle kesişir; testosteronun azalması, bu yolakların fosforilasyon düzeylerini düşürerek hücresel büyümeyi sınırlayabilir [6].
Böylece Ganirelix, hem hormonal hem de sitokin temelli proliferatif sinyallemeyi zayıflatabilir.
4. Epigenetik Düzenleme
Androjen yoksunluğu, DNMT1 ve HDAC1/2 gibi epigenetik düzenleyicilerin aktivitesinde değişime yol açabilir.
Bu, tümör baskılayıcı genlerin (ör. PTEN, CDKN1A) yeniden ekspresyonunu teşvik ederken, viral promotörlerde metilasyon artışıyla replikasyonun baskılanmasına katkıda bulunabilir [7].
GnRH antagonistlerinin epigenetik etkileri hakkında doğrudan veri sınırlı olsa da, hormon eksenindeki değişimin kromatin mimarisi üzerindeki dolaylı etkileri teorik olarak güçlüdür.
5. PD-L1 ve MHC-I Ekspresyonu
NF-κB ve STAT3 aktivasyonunun azalması, PD-L1 gen ekspresyonunu düşürebilir [5,8].
Bu durum, tümör hücrelerinin immün kaçış yeteneğini zayıflatabilir.
Aynı zamanda, androjen baskısının MHC-I ekspresyonunu artırarak antijen sunum kapasitesini güçlendirdiği bildirilmiştir [8].
Dolayısıyla Ganirelix, tümör hücrelerinin bağışıklık sistemi tarafından tanınmasını kolaylaştıran immün tanınırlık artırıcı bir profil sergileyebilir.
6. İmmün Mikroçevre ve Tip I İnterferon Yanıtı
Androjen baskılaması, tümör mikroçevresinde CD8⁺ T-hücre infiltrasyonunu artırır ve immün baskılayıcı Treg popülasyonlarını azaltabilir [9].
Bu değişim, enfekte hücrelerde mikrobiyal veya viral DNA varlığında cGAS-STING yolunun aktivasyonu ile birleştiğinde IFN-β üretimini artırabilir [10].
Bu süreç, hem antiviral hem de antitümör bağışıklığın kuvvetlenmesini sağlar.
Dolayısıyla Ganirelix, enfekte prostat mikroçevresinde immünojenik yeniden yapılanmayı destekleyen bir ajan olarak düşünülebilir.
7. Deneysel Biyobelirteçler ve Öneriler
Ganirelix’in bu potansiyel etkilerini doğrulamak üzere aşağıdaki belirteçlerin izlenmesi önerilmektedir:
• NF-κB (p65) fosforilasyonu → inflamasyon aktivitesi
• PD-L1 / MHC-I → immün tanınırlık
• IFN-β düzeyi → doğuştan bağışıklık aktivasyonu
• CD8⁺ T-hücre yoğunluğu → adaptif immünite
• Cleaved caspase-3 ve γH2AX → apoptoz ve DNA hasarı göstergeleri
Bu parametrelerin inceleneceği in vitro ve in vivo modeller, Ganirelix’in onkoenfekte prostat tümörlerinde translasyonel değerini belirleyecektir.
8. Sonuç ve Gelecek Perspektifler
Ganirelix, prostat kanserinde yalnızca testosteron baskılayıcı değil; aynı zamanda sinyal yolu modülatörü, epigenetik yeniden düzenleyici ve immün mikroçevre şekillendirici bir molekül olarak değerlendirilebilir.
NF-κB ve PI3K/AKT/mTOR sinyal yollarındaki baskılanma; PD-L1 azalması ve MHC-I artışıyla birlikte immün tanınırlığı artırabilir.
Bu etkiler, onkomantar veya onkovirüs enfeksiyonlarının varlığında daha belirgin hale gelerek, IFN-β aracılı güçlü antiviral ve antitümör yanıtların oluşumunu destekleyebilir.
Gelecekte, Ganirelix’in immünoterapiler (anti-PD-1/PD-L1) ve STING agonistleri ile kombinasyonunun preklinik modellerde değerlendirilmesi, bu ajan için yeni tedavi ufukları açabilir.
Kaynakça
1. Fleischmann A, Schmid HP, Thalmann GN. GnRH antagonists have direct inhibitory effects on castration-resistant prostate cancer cells via intracrine androgen and AR-V7 expression. Mol Cancer Ther. 2019;18(10):1811–23. doi:10.1158/1535-7163.MCT-18-1337.
2. Teo MY, Rathkopf DE, Kantoff P. Treatment of advanced prostate cancer. Annu Rev Med. 2019;70:479–99. doi:10.1146/annurev-med-051217-013846.
3. Santen RJ, Yue W, Wang JP, et al. Estrogen receptor signaling in breast and prostate cancer. Carcinogenesis. 2015;36(Suppl 1):S59–S64. doi:10.1093/carcin/bgu179.
4. Fontana F, Limonta P, Dondi D, et al. Gonadotropin-releasing hormone receptors in prostate cancer: molecular mechanisms and clinical implications. Int J Mol Sci. 2020;21(24):9511. doi:10.3390/ijms21249511.
5. Karin M. NF-κB as a critical link between inflammation and cancer. Cold Spring Harb Perspect Biol. 2009;1(5):a000141. doi:10.1101/cshperspect.a000141.
6. Li J, Wang W, Zhang Y, et al. Inflammation and NF-κB signaling in prostate cancer. Cells. 2019;8(6):591. doi:10.3390/cells8060591.
7. Storck WK, Yu EY, Mostaghel EA, et al. The role of epigenetic change in therapy-induced lineage plasticity in prostate cancer. Front Endocrinol (Lausanne). 2022;13:926585. doi:10.3389/fendo.2022.926585.
8. Yamada Y, Beltran H. PD-L1 expression and immune checkpoint regulation in prostate cancer. Int J Mol Sci. 2021;22(15):8081. doi:10.3390/ijms22158081.
9. Sweeney CJ, Chen YH, Carducci M, et al. Influence of androgen deprivation therapy on the PD-L1/CD8⁺ T-cell milieu in prostate cancer. Clin Cancer Res. 2022;30(22):5218–28. doi:10.1158/1078-0432.CCR-22-0200.
10. Chen Q, Sun L, Chen ZJ. DNA damage-induced interferon response via cGAS-STING pathway. Nature. 2020;586(7827):428–32. doi:10.1038/s41586-020-2611-1.
Prostat Kanserinde Linsidomine’in Onkomantar ve Onkovirüs Enfekte Hücrelerdeki Potansiyel Moleküler Etkileri: Nitrosatif Stres, Sinyal Yolakları ve İmmün Düzenleme Perspektifi
Özet
Linsidomine (SIN-1), molsidomine’in aktif metaboliti olup nitrik oksit (NO) ve peroksinitrit (ONOO⁻) üreterek hem vazodilatör hem de sitotoksik etkiler gösteren bir bileşiktir.
Bu derlemede, Linsidomine’in onkomantar (ör. Candida spp.) ve onkovirüs (ör. HPV, EBV) ile enfekte prostat kanseri hücrelerinde oluşturabileceği teorik moleküler etkiler; nitrosatif stres, NF-κB, MAPK, PI3K/AKT/mTOR sinyal yolakları, epigenetik değişiklikler, PD-L1/MHC-I ekspresyonu ve Tip I interferon aracılı immün yanıt açısından değerlendirilmiştir.
1. Giriş
Prostat kanseri yalnızca hormonal ve genetik temelli bir hastalık değil, aynı zamanda mikrobiyal ve viral bileşenlerin de katkı sunduğu karmaşık bir sistemik süreçtir.
Linsidomine, NO donörü olarak DNA hasarı, oksidatif/nitrosatif stres ve immün modülasyon mekanizmalarını aynı anda etkileyebilir. Bu özellik, özellikle mikrobiyal enfekte tümör mikroçevresi bulunan olgularda özgün terapötik fırsatlar sunabilir [1,2].
2. Replikasyon ve Onkoprotein Ekspresyonu
Linsidomine’den salınan NO, viral ve fungal replikasyonun temel enzimatik süreçlerine müdahale eder.
NO’nun viral DNA/RNA polimerazları inhibe ettiği, HPV E6/E7 ve EBV LMP1 gibi onkoproteinlerin stabilitesini bozarak transformasyonu sınırladığı gösterilmiştir [2,9].
Ayrıca NO’nun yüksek konsantrasyonlarda fungal mitokondriyal fonksiyonları ve Candida spp. replikasyonunu baskıladığı bilinmektedir. Bu, onkomantarların inflamatuvar mikroçevreye katkısını azaltabilecek bir mekanizma sunar [9,10]
3. Sinyal Yolakları (NF-κB, MAPK, PI3K/AKT/mTOR)
NO ve türevleri, hücre içi redoks dengesini değiştirerek çoklu sinyal ağlarını etkiler.
• NF-κB: Linsidomine kaynaklı NO, IκB fosforilasyonunu inhibe ederek NF-κB’nin çekirdeğe translokasyonunu sınırlar [3,5]. Bu, proinflamatuar genlerin (ör. IL-6, TNF-α, PD-L1) ekspresyonunu baskılar.
• MAPK/ERK: NO, peroksinitrit oluşumu yoluyla MAPK kaskadını oksidatif şekilde modüle edebilir, bu da proliferatif sinyallemeyi azaltır [4].
• PI3K/AKT/mTOR: Bu yol, prostat tümörlerinde hem viral onkoproteinlerle hem de oksidatif stresle etkileşim halindedir; NO, AKT fosforilasyonunu azaltarak hücre döngüsünü durdurabilir [5,6].
NO’nun bu çift yönlü etkileri — düşük düzeylerde sitoprotektif, yüksek düzeylerde sitotoksik — prostat kanserinde doz ve zaman bağımlı bir yanıt doğurur [3].
4. Epigenetik Düzenleme
NO, DNMT, HDAC ve HAT gibi epigenetik enzimlerin S-nitrosilasyonu yoluyla DNA metilasyonu ve histon asetilasyon durumunu değiştirir [6,7].
Bu süreç:
• Tümör baskılayıcı genlerin yeniden ekspresyonunu kolaylaştırabilir (p21, PTEN),
• Viral promotörlerde metilasyon değişimleri yaratarak replikasyon baskısı oluşturabilir,
• TET ve ALKBH2 gibi demetilazları inhibe ederek epigenetik yeniden yapılanma sağlar [7].
Dolayısıyla Linsidomine, prostat tümörlerinde yalnızca redoks düzenleyici değil, aynı zamanda epigenetik yeniden programlayıcı bir ajan olarak da işlev görebilir.
5. İmmün Kaçış Mekanizmaları (PD-L1, MHC-I)
NF-κB ve STAT3’ün nitrosatif stres altında inhibisyonu, PD-L1 ekspresyonunu düşürür ve tümör hücrelerinin immün tanınmasını kolaylaştırır [5,8].
Eş zamanlı olarak, MHC-I moleküllerinin artışı antijen sunum kapasitesini güçlendirir.
Bu durum, CD8⁺ T-hücrelerinin tümör hücrelerini daha etkin şekilde tanımasını sağlar.
NO ayrıca immün kontrol noktası inhibitörleriyle sinerji gösterebilecek bir mikroçevre oluşturabilir [8].
6. Doğuştan Gelen ve Adaptif İmmün Yanıt
Linsidomine’in neden olduğu DNA ve mitokondriyal hasar, cGAS-STING yolu üzerinden Tip I interferon (IFN-β) üretimini tetikler [10].
Bu yanıt, dendritik hücre maturasyonunu artırarak antijen sunumunu güçlendirir ve CD8⁺ T-hücre aktivasyonunu destekler [9,10].
Sonuç olarak, NO salınımı yalnızca doğrudan tümör hasarı değil, aynı zamanda antiviral ve antitümör immüniteyi artıran çift etkili bir mekanizma sunar.
7. Deneysel Biyobelirteçler
Linsidomine’in etkilerini değerlendirmede aşağıdaki moleküler belirteçlerin izlenmesi önerilmektedir:
• γH2AX – DNA çift zincir kırıkları,
• Cleaved caspase-3 – apoptoz,
• NF-κB (p65) fosforilasyonu,
• PD-L1 ve MHC-I ekspresyon düzeyleri,
• ROS/RNS oranı (NO⁻, ONOO⁻),
• IFN-β salınımı ve CD8⁺ T-hücre infiltrasyonu.
8. Sonuç ve Gelecek Perspektif
Linsidomine, prostat kanseri mikroçevresinde yalnızca vazodilatör değil, aynı zamanda redoks düzenleyici, epigenetik modülatör ve immün düzenleyici bir ajan olarak dikkate alınmalıdır.
NO aracılığıyla:
1. Viral/fungal replikasyonu baskılar,
2. NF-κB, MAPK, PI3K/AKT/mTOR yolaklarını modüle eder,
3. DNMT/HDAC enzimlerini nitrosile ederek epigenetik düzenleme sağlar,
4. PD-L1’i azaltıp MHC-I’i artırarak immün tanınırlığı yükseltir,
5. IFN-β üretimi ve CD8⁺ T-hücre aktivasyonunu destekler.
Bu özellikler, onkoenfekte prostat kanseri modellerinde Linsidomine’i potansiyel kemoterapi-immünoterapi sinerji ajanı haline getirmektedir.
Ancak bu hipotezin doğrulanması için standartlaştırılmış in vitro/in vivo modellerde doz-zaman bağımlı etkilerin sistematik analizi gereklidir.
Kaynakça
1. Kim YM, Talanian RV, Billiar TR. Nitric oxide inhibits apoptosis by preventing increases in caspase-3-like activity via two distinct mechanisms. J Biol Chem. 1997;272(49):31138–48. doi:10.1074/jbc.272.49.31138.
2. Croen KD. Evidence for an antiviral effect of nitric oxide. J Clin Invest. 1993;91(6):2446–52. doi:10.1172/JCI116479.
3. Khan FH, Dervan E, Bhattacharyya M, McAuliffe JD. The role of nitric oxide in cancer: master regulator or NOt? Int J Mol Sci. 2020;21(24):9393. doi:10.3390/ijms21249393.
4. Mintz J, Vedenko A, Rosete O, Shah K, Goldstein G, Hare JM, et al. Current advances of nitric oxide in cancer and anticancer therapies. Vaccines (Basel). 2021;9(2):94. doi:10.3390/vaccines9020094.
5. Huerta-Yepez S, Vega M, Garban H, Bonavida B. Nitric oxide sensitizes prostate carcinoma cell lines to TRAIL-mediated apoptosis via inactivation of NF-κB and inhibition of Bcl-xL expression. Oncogene. 2004;23(29):4993–5003. doi:10.1038/sj.onc.1207655.
6. de la Cruz-Ojeda P, Flores-Fernández GM, Martín-Rodríguez R, et al. Role of nitric oxide in gene expression regulation during health and disease. Antioxidants (Basel). 2021;10(5):833. doi:10.3390/antiox10050833.
7. Switzer CH, Ridnour LA, Cheng RYS, et al. S-nitrosation of epigenetic regulators as a non-canonical mechanism in anticancer therapy. Br J Pharmacol. 2021;178(1):203–22. doi:10.1111/bph.16302.
8. Yamada Y, Beltran H. PD-L1 expression and immune checkpoint regulation in prostate cancer. Int J Mol Sci. 2021;22(15):8081. doi:10.3390/ijms22158081.
9. Akaike T, Maeda H. Nitric oxide and virus infection. Immunology. 2000;101(3):300–8. doi:10.1046/j.1365-2567.2000.00142.x.
10. MacMicking JD, Nathan C, Hom G, et al. Altered responses to bacterial infection and endotoxic shock in mice lacking inducible nitric oxide synthase. Cell. 1995;81(4):641–50. doi:10.1016/0092-8674(95)90085-3.
Prostat Kanserinde Mosoprocol’ün Enfekte Konak Hücrelerdeki Moleküler Etkileri: Onkomantar ve Onkovirüs Bağlamında Derinlemesine Teorik Analiz
Özet
Mosoprocol, fenolik yapılı bir lipooksijenaz inhibitörü ve antioksidan bileşiktir. Bu molekülün, onkomantar (ör. Candida spp.) ve onkovirüs (ör. HPV, EBV, HBV, KSHV) ile enfekte prostat kanseri hücrelerinde potansiyel etkileri henüz doğrudan gösterilmemiştir.
Bu derleme, Mosoprocol’ün bu bağlamdaki olası biyokimyasal ve immün etkilerini NF-κB, MAPK, PI3K/AKT/mTOR sinyal ağları, epigenetik modifikasyonlar, PD-L1/MHC-I ekseni ve immün mikroçevre yeniden şekillenmesi üzerinden teorik olarak analiz etmektedir.
Elde edilen veriler, Mosoprocol’ün yalnızca antiinflamatuar değil, aynı zamanda epigenetik koruyucu ve immün modülatör potansiyele sahip olabileceğini düşündürmektedir.
1. Mantar Replikasyonu ve Onkoprotein Ekspresyonu
Fenolik bileşikler, reaktif oksijen türlerini (ROS) azaltarak fungal hücrelerdeki redoks dengesini bozar.
Bu durum, Candida albicans gibi onkomantarların lipid peroksidasyon ve hücre duvar sentezi süreçlerini yavaşlatabilir [1,2].
Mosoprocol, lipooksijenaz (LOX) inhibisyonu yoluyla bu mekanizmaya dolaylı katkı sağlar; çünkü LOX ürünleri (ör. 5-HETE, 12-HETE) hem tümör hem de mantar proliferasyonunu destekler [1].
Dolayısıyla Mosoprocol, fungal kaynaklı sitokin fırtınasını (IL-6, TNF-α) sınırlayarak tümör mikroçevresindeki inflamatuvar tonusu düşürebilir.
Buna paralel olarak, virüs kaynaklı onkoproteinlerin (ör. HPV E6/E7, EBV LMP1) oksidatif stres bağımlı translasyonunu azaltma potansiyeli de teorik olarak mevcuttur [2].
2. Sinyal Yolu Modülasyonu (NF-κB, MAPK, PI3K/AKT/mTOR)
Mosoprocol’ün en güçlü etkilerinden biri, redoks-duyarlı transkripsiyon faktörlerinin modülasyonudur.
• NF-κB baskılanması: Fenolik bileşiklerin Nrf2’yi aktive ederek NF-κB sinyalini antagonize ettiği bilinmektedir [1,3]. Bu, proinflamatuar genlerin (ör. COX-2, IL-1β, PD-L1) ekspresyonunu azaltabilir.
• MAPK/ERK yolu: Mosoprocol, oksidatif stres kaynaklı MAPK hiperaktivasyonunu sınırlandırarak proliferasyon ve invazyonu azaltabilir [3,5].
• PI3K/AKT/mTOR yolu: Fenolik bileşiklerin PI3K fosforilasyonunu azaltarak protein sentezini ve hücre döngüsünü baskıladığı rapor edilmiştir [5].
Bu etkilerin toplamı, Mosoprocol’ü proliferatif sinyal blokajı ve metabolik yeniden programlama açısından önemli bir aday haline getirir
3. Epigenetik Düzenlemeler ve Gen Stabilitesi
Mosoprocol, oksidatif stresin epigenetik düzenleyici enzimler üzerindeki etkisini azaltabilir.
Fenolik bileşiklerin DNMT1 ve HDAC1 gibi enzimlerin ekspresyonunu dolaylı olarak azalttığı, böylece DNA metilasyon dengesini koruduğu gösterilmiştir [2].
Oksidatif stresin azalması, histon asetilasyonu ve kromatin gevşemesi üzerinden tümör baskılayıcı genlerin (PTEN, CDKN1A) yeniden ekspresyonunu destekler [1,2].
Bu yönüyle Mosoprocol, epigenetik istikrarın korunması ve viral promotörlerin susturulması bakımından dolaylı bir koruyucu profil gösterebilir.
4. İmmün Kaçış Mekanizmalarının Modülasyonu
NF-κB’nin PD-L1 gen promotörünü aktive ettiği bilinmektedir; dolayısıyla Mosoprocol’ün NF-κB baskılayıcı etkisi, PD-L1 ekspresyonunun azalmasına neden olabilir [4,6].
Bu durum, tümör hücrelerinin immün kaçış yeteneğini sınırlandırır ve anti-PD-1/PD-L1 immünoterapilere duyarlılığı artırabilir [7].
Ayrıca Mosoprocol, MHC-I sunum yolunu destekleyerek antijen tanınırlığını artırabilir; bu, CD8⁺ T hücre aktivasyonu açısından translasyonel değere sahiptir [10].
5. Doğuştan Gelen ve Adaptif İmmün Yanıt
Fenolik bileşikler, makrofaj polarizasyonunu M1 yönüne kaydırarak antitümör bağışıklığı güçlendirir [8].
Mosoprocol’ün oksidatif stresi azaltması, TREM2 ve SPP1 gibi immün düzenleyici genlerin dengeye gelmesini kolaylaştırır.
Ayrıca NF-κB’nin baskılanması ve STAT3/Nrf2 aktivasyonunun dengelenmesi, T hücre infiltrasyonunu ve IFN-γ üretimini artırabilir [9].
Bu etkiler, Mosoprocol’ün doğuştan gelen bağışıklığı antiviral ve antifungal bağlamda yeniden yönlendirme potansiyeline işaret eder.
6. Deneysel Model ve Biyobelirteç Önerileri
Mosoprocol’ün onkoenfekte prostat hücrelerindeki etkilerini test etmek üzere önerilen belirteçler:
Kategori Biyobelirteç Hedef Süreç
Oksidatif Stres ROS, 4-HNE Redoks dengesizliği
Sinyal Aktivitesi p-NF-κB (p65), p-ERK, p-AKT Proliferasyon/inflamasyon
Epigenetik Durum DNMT1, HDAC1 ekspresyonu DNA metilasyon
İmmün Tanınırlık PD-L1, MHC-I İmmün kaçış
Apoptoz/Proliferasyon Cleaved caspase-3, Ki-67 Hücre ölüm ve büyüme dengesi
Makrofaj Polarizasyonu TREM2, SPP1 Mikroçevre düzeni
Bu parametreler, in vitro (LNCaP, DU145, PC3) veya in vivo (TRAMP, Myc-CaP) modellerde test edilerek Mosoprocol’ün redoks-immün-etkileşimsel profilini ortaya koyabilir.
7. Sonuç ve Gelecek Perspektif
Mosoprocol, prostat kanseri mikroçevresinde redoks düzenleyici, epigenetik koruyucu ve immün mikroçevreyi dengeleyici bir ajan olarak teorik önem taşımaktadır.
Bu etkiler;
1. NF-κB, MAPK ve PI3K/AKT/mTOR yolaklarının baskılanması,
2. DNA metilasyon ve histon asetilasyonunun dengelenmesi,
3. PD-L1 azalması ve MHC-I artışıyla immün tanınırlığın güçlenmesi,
4. Makrofaj polarizasyonu ve T hücre infiltrasyonunun artması
üzerinden gerçekleşebilir.
Onkomantar ve onkovirüs enfeksiyonlarının oluşturduğu kronik inflamatuar stres ortamında, Mosoprocol bu patolojik döngüyü kırabilecek çok boyutlu bir modülatör olarak konumlanmaktadır.
Bu teorik çerçevenin deneysel doğrulanması, fenolik bileşiklerin onkoenfekte prostat kanserinde tamamlayıcı ajanlar olarak yeniden değerlendirilmesini sağlayabilir.
Kaynakça
1. Bellezza I, Mierla AL, Minelli A. Nrf2 and NF-κB and their concerted modulation in cancer pathogenesis and progression. Cancers (Basel). 2010;2(2):483–97. doi:10.3390/cancers2020483.
2. Costea T, Nagy P, Ganea C, et al. Molecular mechanisms and bioavailability of polyphenols in prostate cancer. Int J Mol Sci. 2019;20(5):1062. doi:10.3390/ijms20051062.
3. Karin M. NF-κB and cancer: mechanisms and clinical implications. Oncogene. 2006;25(51):6908–16. doi:10.1038/sj.onc.1209946.
4. Wang Y, Zhang Y, Han Y, et al. Dietary polyphenols and immune checkpoint inhibition: molecular mechanisms. Nutrients. 2021;13(4):1236. doi:10.3390/nu13041236.
5. Rahal A, Kumar A, Singh V, et al. Phytochemicals as natural NF-κB inhibitors. Biomed Pharmacother. 2018;107:435–47. doi:10.1016/j.biopha.2018.07.035.
6. Xia Y, Shen S, Verma IM. Regulation of PD-L1 expression by NF-κB in cancer. Front Immunol. 2018;9:2954. doi:10.3389/fimmu.2018.02954.
7. Shin DS, Ribas A. Mechanisms of immune checkpoint inhibition therapy. Cancer J. 2019;25(2):117–24. doi:10.1097/PPO.0000000000000377.
8. Zitvogel L, Pietrocola F, Kroemer G. Immunological impact of dietary factors on cancer therapy. Nat Rev Immunol. 2017;17(6):373–86. doi:10.1038/nri.2017.23.
9. Wang H, Wang L, Zhang Y, et al. ROS, apoptosis, and STAT3/NF-κB involvement in prostate cancer. Aging (Albany NY). 2020;12(10):10052–68. doi:10.18632/aging.103163.
10. Garrido F, Aptsiauri N, Doorduijn EM, et al. MHC class I recovery for effective immunotherapy. Curr Opin Immunol. 2016;39:44–51. doi:10.1016/j.coi.2015.12.004.
Tegafur’ün Onkomantar ve Onkovirüs Enfekte Prostat Kanseri Hücrelerinde Moleküler Etki Mekanizmaları: Preklinik ve Klinik Perspektif
Özet
Tegafur, prodrug formu aracılığıyla 5-fluorouracil (5-FU)’e dönüşen, DNA ve RNA sentezini hedef alan bir antimetabolit ajandır. 5-FU’nun antiproliferatif, epigenetik ve immünomodülatör özellikleri, Tegafur’un da prostat kanseri dahil olmak üzere çeşitli solid tümörlerde terapötik değerini desteklemektedir.
Bu derlemede, Tegafur’ün onkomantar (ör. Candida spp.) ve onkovirüs (ör. HPV, EBV, HBV, KSHV) ile enfekte prostat kanseri hücrelerinde teorik moleküler etkileri; mikrobiyal replikasyon baskısı, sinyal yolaklarının modülasyonu (NF-κB, MAPK, PI3K/AKT/mTOR), epigenetik yeniden programlama, PD-L1/MHC-I ekseni, ve Tip I interferon aracılı immün yanıt bağlamında analiz edilmiştir.
1. Mantar ve Viral Replikasyonun Baskılanması
Tegafur metaboliti 5-FU, timidilat sentaz inhibisyonu yoluyla DNA sentezini, ayrıca RNA yanlış entegrasyonu yoluyla translasyonel doğruluğu bozar [1].
Bu çift mekanizma, hem tümör hem de enfekte hücrelerde replikatif stres ve apoptoz oluşturur.
5-FU’nun viral replikasyonu doğrudan inhibe ettiği; özellikle HPV E6/E7, HBV HBx ve EBV LMP1 onkoproteinlerinin ekspresyonunu azalttığı bildirilmiştir [1,3].
Benzer şekilde, Candida spp. gibi onkomantarların oksidatif stres yanıt genleri (SOD, CAT) üzerindeki baskı yoluyla virülans kaybı yaşayabileceği öne sürülmüştür.
Dolayısıyla Tegafur, mikrobiyal ko-enfeksiyonlu prostat tümörlerinde patojen kaynaklı sinyal aktivasyonunu dolaylı biçimde zayıflatabilir.
2. Sinyal Yolaklarının Modülasyonu (NF-κB, MAPK, PI3K/AKT/mTOR)
Tegafur’ün aktif metaboliti 5-FU, DNA hasarı oluşturduğunda cGAS/STING yolunu aktive eder ve Tip I interferon (IFN-β) üretimini tetikler [7,12].
Bu durum antiviral bağışıklığı artırırken, NF-κB aktivasyonunun ikincil olarak artmasına ve PD-L1 ekspresyonunun yükselmesine de yol açabilir [3,11].
Ancak 5-FU’nun, MAPK ve PI3K/AKT/mTOR yolaklarını baskılayarak hücre büyümesini sınırladığı, bu nedenle toplamda proliferatif baskı ve immün duyarlılık artışı oluşturduğu gösterilmiştir [2,4,5].
Sonuç olarak Tegafur, hem DNA hasarına dayalı antiviral sinyalizasyonu hem de proliferatif yolakların baskılanmasını eşzamanlı yürüten çift etkili bir ajandır.
3. Epigenetik Düzenlemeler
5-FU, DNA metilasyon döngüsünü ve histon modifikasyonlarını doğrudan etkileyebilir.
DNMT1 ve HDAC1 gibi enzimlerde metabolik inhibisyon yoluyla tümör baskılayıcı genlerin yeniden ekspresyonu sağlanabilir [5].
Ayrıca p53’ün stabilizasyonu, 5-FU’nun metilasyon kaybına ve kromatin gevşemesine neden olmasıyla ilişkilendirilmiştir.
Bu epigenetik yeniden yapılanma, sadece konak genlerini değil, viral promotör bölgelerinin susturulmasını da kolaylaştırabilir.
Böylece Tegafur, epigenetik yeniden programlama yoluyla viral persistansı ve tümör agresifliğini azaltabilecek teorik bir etki mekanizması taşır.
4. İmmün Kaçış Mekanizmaları (PD-L1, MHC-I)
Kemosensitif hücrelerde 5-FU, PD-L1 ekspresyonunu artırabilir; bu etki NF-κB ve STAT1 aktivasyonuna bağlıdır [3,8,9,11].
Ancak eşzamanlı olarak MHC-I ekspresyonu da artmakta, bu da antijen sunum kapasitesini güçlendirmektedir [9].
Dolayısıyla Tegafur tedavisi sonrası, tümör hücrelerinde immün kaçış ve immün tanınma arasında dinamik bir denge oluşur.
Bu denge, anti-PD-1/PD-L1 immünoterapi ile kombinasyonlarda sinerjik bir etki potansiyeli doğurabilir [10].
5. Doğuştan Gelen ve Adaptif İmmün Yanıt
Tegafur kaynaklı DNA hasarı, cGAS-STING-TBK1-IRF3 eksenini aktive ederek IFN-β üretimini artırır [7,12].
IFN-β’nin sekresyonu, CD8⁺ T-hücre aktivasyonu, dendritik hücre olgunlaşması ve antiviral savunma süreçlerini destekler.
Onkomantar veya onkovirüs enfeksiyonuyla uyarılmış mikroçevrede bu yanıt daha da güçlenebilir.
Bu nedenle Tegafur, enfekte prostat tümörlerinde yalnızca sitotoksik değil, aynı zamanda immün uyarıcı etki gösterebilir.
6. Deneysel Biyobelirteçler ve Model Önerileri
Tegafur’ün onkoenfeksiyon bağlamındaki etkilerini değerlendirmek için önerilen belirteçler:
Kategori Biyobelirteç Yorum
Hücre proliferasyonu Ki-67 5-FU ile azalma beklenir
Apoptoz Cleaved caspase-3 Artış beklenir
DNA hasarı p53 stabilizasyonu, γH2AX Hasar yanıtı göstergesi
İmmün yanıt PD-L1, MHC-I İmmün kaçış/tanınma dengesi
Antiviral sinyal IFN-β, STING, IRF3 fosforilasyonu cGAS/STING aktivasyonu göstergesi
Bu parametreler hem LNCaP / DU145 / PC3 hücre hatlarında in vitro, hem de TRAMP veya Myc-CaP fare modellerinde in vivo olarak değerlendirilebilir.
7. Klinik Bulgular ve Kombinasyon Stratejileri
Klinik olarak 5-FU ve türevlerinin PD-L1 artışı üzerinden immünoterapi ile sinerji oluşturduğu bildirilmiştir [10].
Bu nedenle Tegafur, anti-PD-1/PD-L1 ajanları ile kombinasyon tedavisinde güçlü teorik potansiyele sahiptir.
Ayrıca, viral veya fungal enfeksiyon varlığında IFN-β yanıtının artması, tümör immünojenisitesini artırabilir.
Gelecekteki preklinik modeller, bu ilaç-immünoterapi kombinasyonlarının enfekte prostat mikroçevresinde nasıl sonuç verdiğini aydınlatacaktır.
8. Sonuç ve Gelecek Perspektif
Tegafur, enfekte prostat kanseri hücrelerinde yalnızca DNA/RNA sentez inhibitörü olarak değil, aynı zamanda sinyal, epigenetik ve immün mikroçevre modülatörü olarak değerlendirilebilir.
Bu çok katmanlı etki şu başlıklar altında özetlenebilir:
1. Viral ve fungal replikasyonun baskılanması,
2. NF-κB, MAPK ve PI3K/AKT/mTOR yolaklarının inhibisyonu,
3. Epigenetik yeniden programlama ve p53 stabilizasyonu,
4. PD-L1 artışı ile immün kaçış, ancak MHC-I artışıyla paralel immün tanıma,
5. cGAS/STING aktivasyonu ile Tip I interferon üretimi ve T-hücre aktivasyonu.
Bu mekanizmalar, Tegafur’ün enfekte prostat tümörlerinde hem antiproliferatif hem immünoterapötik sinerji potansiyeli taşıdığını göstermektedir.
Bu hipotezin doğrulanması için in vitro ko-kültür ve enfekte tümör mikroçevresi modelleri üzerinde ileri düzey çalışmalar gereklidir.
Kaynakça
1. Drugs@NCATS. Pharmacologic profile of Tegafur. [Internet]. Available from: https://drugs.ncats.io/substance/C1909
2. Zhang X, et al. Signaling pathways and therapeutic interventions in gastric cancer. Signal Transduct Target Ther. 2022;7(1):270.
3. Chen L, et al. Dynamic phospho-proteogenomic analysis reveals STAT1 and PD-L1 modulation by 5-FU. Front Immunol. 2024;15:1429483.
4. Zhang X, et al. 5-FU impact on MAPK and PI3K/AKT/mTOR signaling. Signal Transduct Target Ther. 2022;7(1):270.
5. Shukla S, et al. Epigenetic modifiers and 5-FU: a regulatory link. Cancer Lett. 2023;560:215042.
6. Li Y, et al. Immunomodulatory effects of 5-fluorouracil in cancer cells. J Immunother Cancer. 2021;9(8):e002899.
7. Liu Q, et al. cGAS-STING pathway and 5-FU response in tumor immunity. J Exp Clin Cancer Res. 2022;41(1):113.
8. Kim S, et al. Role of PD-L1 in tumor microenvironment under chemotherapeutic stress. Nat Commun. 2023;14(1):129.
9. Wang H, et al. PD-L1 regulation by interferons and chemotherapy. Immunology. 2022;165(4):452–65.
10. Sun R, et al. Immune checkpoint inhibitor therapy for prostate cancer: clinical and molecular insights. Biomolecules. 2023;13(6):751.
11. Front Oncol. FOLFOX (5-FU + oxaliplatin) induces PD-L1 via cGAS/STING signaling. Front Oncol. 2024;10:244.
12. Paludan SR, Bowie AG. Immune sensing of DNA. Immunity. 2013;38(5):870–80.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...