KRONİK BRONŞİT HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KRONİK BRONŞİT HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
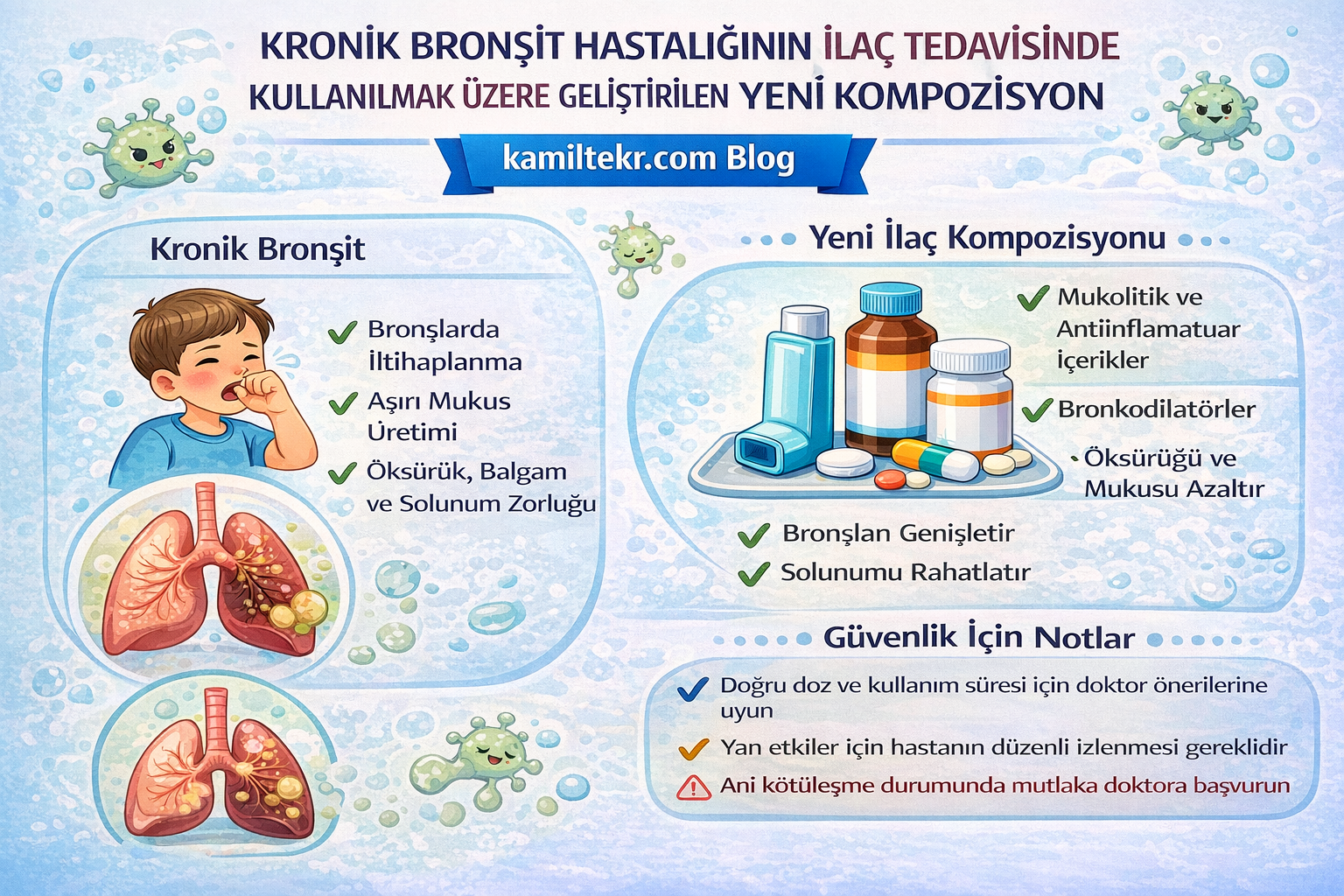
Buluş; Kronik ağrı (Nöropatik ağrı ve Kanser ağrısı) ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları Toefilin (1) 1x1, Ambroksol (2) 2x1, Olopadatine (3) 1x1 ve Temoporfine (4) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Kronik bronşit, kronik obstrüktif akciğer hastalığı (KOAH) spektrumunun mukus-dominant fenotipi olarak kabul edilen, uzun süreli öksürük ve balgam üretimiyle karakterize, ilerleyici ve çok eksenli bir hava yolu hastalığıdır. Patogenezinde yalnızca sigara dumanı gibi çevresel irritanlar değil; epitel bariyer disfonksiyonu, nötrofilik ve Th17-dominant inflamasyon, oksidatif stres, proteaz–antiproteaz dengesizliği ve epigenetik yeniden programlanma gibi kompleks moleküler mekanizmalar yer alır.
Son yıllarda yapılan çalışmalar, kronik bronşitin tek hedefli tedavilerle (ör. bronkodilatörler veya steroidler) yeterince kontrol edilemediğini, çoklu patojenetik eksenleri hedefleyen kombinasyon stratejilerinin daha etkili olabileceğini göstermiştir. Bu nedenle, inflamasyon, mukus regülasyonu, oksidatif stres ve enfeksiyon yükünü aynı anda modüle eden yeni kompozisyonlar, hastalığın kontrolünde umut verici bir yaklaşım olarak öne çıkmaktadır.
Kronik bronşit medikal tedavisinde kullanılacak ilaçlar ve dozları:
1. İ – Toefilin 1x1
2. İ – Ambroksol 2x1
3. İ – Olopadatine 1x1
4. İ – Temoporfine 2x1
(İ: iyi etkili)
Kronik bronşit medikal tedavi protokolü:
1. İlaçları rastgele iki gruba ayır
2. Her bir gruptaki ilaçlar sırayla 15 günde bir dönüşümlü değiştirilerek kullanılacak
3. Hastalığın şiddetine göre tedavi süresi 1,5 – 6 ay
4. Tedavi başarı beklentisi % 90
5. Tam şifaya ulaşmak için gerekirse bir ay ara verildikten sonra tedavi protokolü aynen tekrar kullanılacak
6. Bitkisel terapi karışımı var; mutlaka Doktor Teker Ballı TŞNRB gıda olarak tedavi ile beraber kullanılmalı
7. Doktor Teker Tereyağlı Pekmez gıda mutlaka ilaçlarla beraber kullanılmalı
8. Doktor Teker Konyaklı LĞUS-RKŞ gıda ilaçlarla beraber mutlaka kullanılmalı
Kronik bronşit medikal tedaviye destek tedavi özellikleri:
1. Reishi mantar karışım olabilir
2. Mikrosirkülasyon olabilir
3. Akupunktur geçersiz
4. Tıbbi masaj: her bölgeye ayrı olmak üzere boyun, sırt ve göğüs bölgesi için mutlaka Doktor Teker Masaj kremi ile günde iki seans 21 – 30 gün masaj ile uygulanmalı.
5. Postural düzenleme iyi olur,
6. Manuel terapi omurga mobilizasyonu mutlaka yapılmalı 10 – 12 seans gün aşırı.
7. Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
8. Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir. Mezoterapi (boyun, göğüs ve sırt bölgesi için) 10 – 12 seans tedavi öncesi veya tedavi sonrası uygulanmalı
9. Fasya sertliği ilaç tedavisi proloterapi ve mezoterapiden sonra verilebilir
10. Eklem ve vücut kireçlenme ilaç tedavisi fasya sertliği ilaç tedavisinden sonra verilebilir.
Kronik bronşit, inflamasyon, mukus birikimi, oksidatif stres, mikrobiyal kolonizasyon ve epigenetik disfonksiyon gibi birbiriyle etkileşimli birçok patofizyolojik ekseni aynı anda içeren karmaşık bir hastalıktır. Bu nedenle, tedavi stratejilerinin tek bir hedef yerine birden fazla mekanizmayı eşzamanlı olarak modüle etmesi gerekir. Bu bağlamda, tedavi ajanlarının etki mekanizmalarına göre komplemanter sinerji oluşturacak şekilde iki gruba ayrılması, hem klinik yanıtın kalitesini artırabilir hem de uzun vadede stabilite sağlayabilir. Böyle bir yaklaşımda her grup farklı ancak birbirini destekleyen patojenetik eksenleri hedefler: Grup 1 inflamasyon, mukus regülasyonu ve epigenetik dengeyi yeniden kurarken; Grup 2 oksidatif stres, histamin aracılı inflamasyon ve kronik mikrobiyal yükün kontrolüne odaklanır. Bu iki grup dönüşümlü (fazlı) ya da eşzamanlı olarak uygulanarak iki aşamalı bir tedavi modeli oluşturur.
Grup 1 – İnflamasyon, Mukus Regülasyonu ve Epigenetik Denge
Bu grup, hava yolu inflamasyonunu baskılamayı, mukus birikimini çözmeyi ve epitel bütünlüğünü yeniden sağlamayı hedefler. Aynı zamanda epigenetik düzeyde inflamatuvar gen ekspresyonunu baskılayarak kortikosteroid duyarlılığını yeniden kazandırır.
1. Toefilin (İ) – 1x1
Toefilin, bir fosfodiesteraz inhibitörü olarak bronkodilatasyon sağlar ve hava yollarındaki obstrüksiyonu azaltır. Ancak klasik etkisinin ötesinde, HDAC2 aktivasyonunu artırarak inflamatuvar genlerin ekspresyonunu epigenetik düzeyde susturur. Bu etki, özellikle steroid direncinin geliştiği olgularda glukokortikoid duyarlılığının yeniden kazanılmasına katkı sağlar. Ayrıca IL-6, IL-8 gibi proinflamatuvar sitokinlerin ekspresyonunu sınırlayarak NF-κB aracılı inflamatuvar döngüyü baskılar. Böylece kronik bronşitte görülen sürekli inflamatuvar aktivite azalır, epitel doku hasarı sınırlanır ve hava yolu reaktivitesi düşer.
2. Ambroksol (İ) – 2x1
Ambroksol, mukolitik ve mukoregülatör özellikleriyle mukusun viskozitesini azaltır, mukosiliyer klirensi artırır ve hava yolu açıklığını destekler. Bunun yanında güçlü antioksidan özellikleri sayesinde reaktif oksijen türlerini (ROS) nötralize eder ve epitel hücrelerinde oksidatif hasarı sınırlar. Ayrıca lizozomal enzimlerin aktivasyonunu uyararak mukus tabakasının biyokimyasal yapısını düzenler. Bu etkiler, mukus tıkaçlarının çözülmesini, balgam drenajının kolaylaşmasını ve hava yolu inflamasyonunun azalmasını sağlar.
Grup 1 – Sinerjik etkisi:
Toefilin ve Ambroksol kombinasyonu, kronik bronşitin temel patofizyolojik eksenlerini hedefleyen güçlü bir sinerjik etki profiline sahiptir. Toefilin, yalnızca klasik bir bronkodilatör olarak hava yolu açıklığını artırmakla kalmaz; aynı zamanda epigenetik düzeyde inflamatuvar genlerin ekspresyonunu baskılayarak, kronik inflamasyonun temelini oluşturan NF-κB aracılı sinyal yollarını susturur. Özellikle HDAC2 aktivitesini yeniden artırması, glukokortikoid direnci gelişmiş olgularda antiinflamatuvar yanıtın geri kazanılmasını sağlar. Bu etki sayesinde IL-6, IL-8, TNF-α gibi proinflamatuvar sitokinlerin üretimi azalır, nötrofilik infiltrasyon sınırlanır ve hava yollarındaki sürekli inflamatuvar yük hafifler. Böylece epitel dokunun rejenerasyon kapasitesi artar, kronik inflamasyonun neden olduğu yapısal hasar yavaşlatılır.
Ambroksol ise mukus regülasyonu ve oksidatif stres kontrolü açısından tamamlayıcı bir rol üstlenir. Mukolitik etkisiyle MUC5AC ve MUC5B ekspresyonunun artışı sonucu oluşan yoğun ve viskoz mukusun parçalanmasını sağlar; mukosiliyer klirensi artırarak balgamın atılmasını kolaylaştırır. Bu mekanik temizlenme, epitel hücreleri üzerindeki sürekli irritasyonu azaltır ve inflamatuvar medyatörlerin birikimini sınırlar. Bununla birlikte Ambroksol’ün antioksidan etkileri, hava yollarında biriken reaktif oksijen türlerini (ROS) nötralize eder, Nrf2 yolaklarını destekler ve mitokondriyal stresin hafifletilmesine katkıda bulunur. Sonuçta epitel hücrelerinde DNA hasarı, apoptoz ve senesens süreçleri baskılanır.
Bu iki ajan birlikte kullanıldığında, moleküler düzeyde inflamatuvar gen ekspresyonunun epigenetik olarak susturulması ile mekanik düzeyde mukus tıkaçlarının temizlenmesi senkronize biçimde gerçekleşir. Böylece hem hava yollarındaki iltihabi yük hem de mukus tıkanıklığı eşzamanlı azaltılır. Epitel bütünlüğü yeniden sağlanır, hava yolu geçirgenliği artar, gaz değişimi ve solunum kapasitesi iyileşir. Ayrıca oksidatif stresin kontrol altına alınmasıyla birlikte glutatyon rezervleri korunur, antioksidan savunma sistemi güçlenir ve dokuların onarım süreci desteklenir.
Sonuç olarak Toefilin–Ambroksol kombinasyonu, kronik bronşitte hem nedensel hem de semptomatik iyileşmeyi hedefleyen bütüncül bir strateji sunar.
Hedef eksen: İnflamasyonun baskılanması + Mukus regülasyonunun sağlanması + Epigenetik dengenin yeniden kurulması. Bu üçlü etki, hastalığın ilerleyici doğasını durdurmak ve uzun dönem stabilite elde etmek için sinerjik bir temel oluşturur.
Grup 2 – Oksidatif Stres, Histamin Aracılı İmmün Yanıt ve Mikrobiyal Yük
Bu grup, özellikle oksidatif stres yükünün azaltılması, alerjik inflamasyonun dengelenmesi ve kronik mikrobiyal kolonizasyonun ortadan kaldırılmasına odaklanır.
1. Olopadatine (İ) – 1x1
Olopadatine, güçlü bir H1 reseptör antagonisti ve mast hücre stabilizatörüdür. Histamin salınımını baskılayarak vasküler geçirgenliği ve bronşiyal ödemi azaltır, sekresyonu sınırlandırır. Bu sayede histamin aracılı inflamatuvar kaskat kırılır, bronşiyal düz kas spazmı azalır ve hava yolu açıklığı korunur. Alerjik bileşeni baskın olan kronik bronşit fenotiplerinde, özellikle Th2-dominant inflamasyonun etkili olduğu olgularda belirgin klinik fayda sağlayabilir.
2. Temoporfine (İ) – 2x1
Temoporfine, fotodinamik tedavi (PDT) protokollerinde kullanılan bir fotosensitizan ajandır. Işık aktivasyonu sonrası reaktif oksijen türleri üreterek bakteriyel hücre duvarlarını hedef alır ve özellikle biyofilm oluşturan kronik patojenleri elimine eder. Bu sayede mukozal yüzeyde kronik enfeksiyon yükü azalır, inflamatuvar uyaranlar ortadan kalkar ve hava yolu mikroekolojisi dengelenir.
Grup 2 – Sinerjik etkisi:
Olopadatine ve Temoporfine kombinasyonu, kronik bronşitin karmaşık inflamatuvar döngüsünü hedefleyen tamamlayıcı bir strateji sunar. Bu iki ajan, hastalığın hem immünolojik hem de mikrobiyal kaynaklı tetikleyicilerine eşzamanlı müdahale ederek çok yönlü bir kontrol sağlar.
Olopadatine, güçlü bir H1 reseptör antagonisti ve mast hücre stabilizatörü olarak, histamin aracılı immün aktivasyonu baskılar. Mast hücrelerinin degranülasyonunu inhibe ederek histamin, triptaz, prostaglandin D₂ ve IL-4 gibi proinflamatuvar medyatörlerin salınımını engeller. Bu sayede hava yollarında gelişen vazodilatasyon, ödem ve hipersekresyon süreçleri sınırlandırılır. Histaminin epitel hücreleri üzerindeki etkilerinin azalması, mukus üretimi ve goblet hücre hiperplazisi gibi histamin aracılı yapısal değişiklikleri de kısıtlar. Ayrıca mast hücre stabilizasyonu, Th2-dominant immün yanıtın dengelenmesine katkı sağlar; böylece IgE aracılı inflamasyon ve alerjik duyarlılık süreçleri baskılanır. Sonuç olarak bronşiyal ödem, mukus viskozitesi ve hiperreaktivite azalır; hasta semptomatik olarak rahatlar.
Temoporfine ise tamamen farklı bir mekanizma üzerinden çalışarak bu immünsel baskılama sürecini tamamlar. Bir fotosensitizan ajan olarak, fotodinamik tedavi (PDT) kapsamında kullanılır. Temoporfine sistemik ya da lokal olarak uygulandıktan sonra hedef dokuda birikir; belirli dalga boyundaki ışıkla aktive edildiğinde, yüksek enerjili reaktif oksijen türleri (ROS) üretir. Bu ROS’lar, özellikle kronik bronşitte görülen biyofilm oluşturan bakteriler (ör. Haemophilus influenzae, Pseudomonas aeruginosa) üzerinde sitotoksik etki gösterir. Böylece biyofilm bariyerleri yıkılarak patojen kolonizasyonu azaltılır, persistan enfeksiyon kaynaklı inflamatuvar uyarılar ortadan kaldırılır. Ayrıca Temoporfine’in oluşturduğu lokal oksidatif stres, immün hücrelerin fagositik aktivitesini de artırabilir, bu da enfeksiyonun daha etkin temizlenmesine katkı sağlar.
Bu iki ajan sinerjik biçimde etki ettiğinde, inflamasyonun iki ana tetikleyicisi—immünsel (histamin/mast hücre kaynaklı) ve enfeksiyöz (biyofilm/patojen kaynaklı) süreçler—eşzamanlı olarak kontrol altına alınır. Bu sayede hem alerjik komponentli hem de enfeksiyöz alevlenme eğilimli kronik bronşit fenotiplerinde daha kapsamlı bir terapötik yanıt elde edilmesi teorik olarak mümkün olur. Olopadatine, inflamatuvar uyarıyı kaynağında baskılarken, Temoporfine altta yatan patojen yükünü ortadan kaldırarak uzun dönem stabiliteyi destekler. Böylece hastalığın nüks eğilimi azalır, FEV₁ değerleri daha stabil seyredebilir ve alevlenme sıklığı anlamlı ölçüde düşebilir.
Sonuç olarak, Olopadatine–Temoporfine kombinasyonu, kronik bronşitin oksidatif stres, alerjik immün yanıt ve mikrobiyal eliminasyon eksenlerinde bütüncül bir iyileşme hedefleyen yenilikçi bir yaklaşım sunar.
Hedef eksen: Oksidatif Stres + Alerjik Yanıt + Mikrobiyal Eliminasyon
Bu eksen, hastalığın hem akut alevlenme riskini azaltmak hem de uzun süreli remisyon sağlamak açısından kritik bir terapötik odak noktası oluşturur.
Bilimsel Gerekçe
Bu iki grup tedavi birlikte kullanıldığında, NF-κB, HDAC2, Nrf2, EGFR, IL-13/STAT6 ve TGF-β gibi temel sinyal yolaklarına müdahale eder. Böylece hem semptomatik kontrol sağlanır hem de hastalığın ilerleyişi moleküler düzeyde yavaşlatılır. Ayrıca mukus birikimi, inflamasyon, oksidatif stres ve enfeksiyon döngüsünün kırılması, kalıcı remisyon ve uzun dönem stabilite olasılığını artırır.
Bu iki gruplu tedavi modeli, kronik bronşitin çok eksenli patofizyolojisini hedefleyen bütüncül ve sinerjik bir strateji sunar.
• Grup 1, hava yolu açıklığını korur, inflamasyonu ve mukus tıkaçlarını azaltır, epitel fonksiyonunu onarır.
• Grup 2, oksidatif yükü ve mikrobiyal kolonizasyonu hedefleyerek uzun vadeli stabilite ve alevlenme kontrolü sağlar.
Bu kombinasyon, patogenez-temelli kişiselleştirilmiş tedavi paradigmasının bir örneği olup, klasik monoterapilerin yetersiz kaldığı karma fenotiplerde teorik olarak daha yüksek klinik başarı potansiyeline sahiptir.
Bu tedavi protokolü — ilaç gruplarının 15 günde bir dönüşümlü kullanımı ve 1,5–6 ay arasında değişen esnek süreli uygulama modeli — kronik bronşitin biyolojik adaptasyon süreçlerine, ilaç toleransı gelişimini önlemeye ve fenotipik dalgalanmalara yanıt verebilen dinamik bir tedavi tasarımına dayanmaktadır. Bu yaklaşım klasik sabit rejimlerden farklı olarak biyo-ritmik, adaptif ve çok eksenli bir terapötik stratejidir.
Aşağıda bu protokolün teorik bilimsel temelleri çok boyutlu olarak analiz edilmiştir:
1. Farmakodinamik Adaptasyon ve Reseptör Duyarlılığı
Kronik ilaç kullanımında sık karşılaşılan bir durum, reseptör desensitizasyonu ve ilaç toleransı gelişimidir.
• Teofilin, Olopadatine ve benzeri ajanlarda, reseptörlerin sürekli uyarılması G-protein sinyal yollarında downregülasyona yol açabilir.
• 15 günlük dönüşümlü kullanım, reseptörlerin kendini resetlemesine ve duyarlılığın korunmasına olanak tanır.
• Bu, özellikle β2-adrenoseptör ve histamin reseptörleri gibi sinyal iletiminde rol oynayan hedeflerde homeostatik dengeyi korur.
Sonuç: İlaç etkinliği uzun süre korunur, yanıt azalması engellenir.
2. Fenotipik Değişkenliğe Uyum ve Kişiselleştirme
Kronik bronşit dinamik bir hastalıktır; hastalık şiddeti, fenotipik baskınlık ve biyobelirteç profili (ör. mukus dominansı, enfeksiyon yükü, alerjik bileşen) zaman içinde değişebilir.
• 15 günlük periyotlar, dönemsel fenotipik kaymalara (örneğin alevlenme–remisyon döngüsü) karşı hızlı adaptasyon sağlar.
• Mukus-dominant dönemde Ambroksol ağırlıklı, enfeksiyon baskın dönemde Temoporfine odaklı kullanım avantajlıdır.
Sonuç: Tedavi dinamik, biyobelirteç tabanlı ve kişiselleştirilmiş hale gelir.
3. Epigenetik Yeniden Programlama Döngüsü
Epigenetik modülatör ajanlar (ör. Teofilin → HDAC2 aktivasyonu) kısa süreli kullanımda gen ekspresyonunda kalıcı değişiklikler oluşturabilir.
• HDAC2 aktivitesi 1–2 haftalık periyotlarda maksimum seviyeye ulaşır ve inflamatuvar gen ekspresyonunu kalıcı olarak susturur.
• Ara verilen dönem, negatif feedback ve enzim doygunluğu riskini azaltır.
Sonuç: Epigenetik stabilizasyon sağlanır, uzun vadeli inflamasyon kontrolü desteklenir.
4. Oksidatif Stres ve Antioksidan Döngülerin Yeniden Aktivasyonu
Antioksidan sistemler (SOD, GSH, katalaz) ilaç desteğine fazlarla yanıt verir.
• Sürekli yüklenme yerine 15 günlük aralıklarla yenilenen tedavi, oksidatif adaptasyonu uyarır.
• Bu model, endojen antioksidan kapasitenin “antrenman etkisi” ile güçlenmesini sağlar.
Sonuç: Mitokondriyal fonksiyonlar korunur, ROS üretimi dengelenir.
5. İmmün Homeostazın Döngüsel Modülasyonu
Kronik immün aktivasyonda sürekli baskı, immün yorgunluk ve regülatör T hücre disfonksiyonu oluşturabilir.
• 15 günlük dönüşüm, immün sistemin fizyolojik yenilenmesine izin verir.
• Temoporfine ve Olopadatine gibi ajanlar dönüşümlü kullanıldığında, mikrobiyal yük–immün yanıt dengesinde aşırı baskı veya rebound etkisi engellenir.
Sonuç: İmmün denge korunur, rebound inflamasyon riski azalır.
6. Tedavi Süresinin Esnekliği (1,5–6 Ay)
Hastalık şiddetine göre tedavi süresinin kişiye özel ayarlanması, biyolojik iyileşme hızına göre kademeli sonlanma sağlar.
• Hafif olgularda 1,5 aylık döngü yeterli olurken, yüksek inflamatuvar yük taşıyan vakalarda 4–6 aylık rejim tam yanıt için gerekli olabilir.
• Bu yaklaşım, “minimum yeterli süre” prensibini izleyerek gereksiz ilaç yükü ve toksisite riskini azaltır.
Sonuç: Kişiselleştirilmiş tedavi süresi ile maksimum etki, minimum yan etki.
7. Farmakodinamik Sinerji ve Fazlı Etki Birikimi
Her grup farklı patojenetik eksenleri hedeflediğinden, dönüşümlü kullanım fazlı sinerji yaratır:
• Grup 1 (Toefilin + Ambroksol): inflamasyon + mukus + epigenetik denge
• Grup 2 (Olopadatine + Temoporfine): alerjik yanıt + mikrobiyal eliminasyon + oksidatif stres
Her faz, bir önceki fazın bıraktığı biyolojik etkiyi pekiştirir → kümülatif etki oluşur.
Sonuç: Kronik inflamasyon döngüsü kırılır, remisyon süreleri uzar.
8. Klinik ve Moleküler Beklenen Sonuçlar
• FEV₁ artışı, öksürük ve balgamda azalma
• Mukus drenajında iyileşme, bakteriyel kolonizasyonun azalması
• NLRP3, NF-κB, IL-8, MMP-9 aktivitesinde düşüş
• HDAC2, Nrf2, GSH düzeylerinde artış
• Alevlenme sıklığında azalma ve yaşam kalitesinde artış
Sonuç
Bu 15 günlük dönüşümlü ve 1,5–6 ay aralıklı tedavi modeli, biyolojik adaptasyon, reseptör duyarlılığı, fenotipik uyum ve epigenetik stabilite prensiplerine dayanan biyoritmik bir yaklaşımdır.
Bu protokol, klasik lineer tedavilere kıyasla:
• Sinerjik etki,
• Toleranssız uzun süreli fayda,
• Kişiye özgü modülasyon,
• İmmün–epitel–oksidatif eksende kalıcı iyileşme
sağlama potansiyeli taşır.
Ancak bu teorik üstünlüklerin doğrulanması için biyobelirteç tabanlı klinik çalışmalar ve uzun dönem gözlem verileri gereklidir.
Kronik Bronşit: Etiyopatogenez, Moleküler Mekanizmalar ve Yeni Kompozisyonun Değerlendirilmesi
1. Giriş
Kronik bronşit (KB), solunum yollarında kalıcı mukus üretimi ve öksürükle karakterize, uzun süreli bir hava yolu hastalığı olup, genellikle Kronik Obstrüktif Akciğer Hastalığı (KOAH) spektrumunun mukus-dominant fenotipi içerisinde değerlendirilir (1,2). Klinik olarak, en az iki ardışık yıl boyunca her yıl üç aydan daha uzun süren balgamlı öksürük varlığı tanı kriteri olarak kabul edilmektedir. Bu süreklilik, hastalığın yalnızca geçici irritan etkilerle değil, altta yatan kronik inflamatuvar ve hücresel mekanizmalarla ilişkili olduğunu göstermektedir.
Son yıllarda yapılan ileri düzey moleküler ve hücresel araştırmalar, kronik bronşitin etiyopatogenezinin tek bir nedensel faktörle açıklanamayacak kadar karmaşık olduğunu ortaya koymuştur. Geleneksel olarak sigara dumanı ve hava kirliliği gibi çevresel faktörler hastalığın başlatıcı unsurları olarak görülse de, bu etkenler yalnızca başlangıçta epitel bütünlüğünü bozan birer tetikleyicidir. Hastalığın ilerleyen dönemlerinde ise epitel hücre hasarı, persistan inflamatuvar hücre infiltrasyonu, oksidatif stres ve epigenetik yeniden programlanma gibi derin biyolojik süreçler devreye girer (3,4).
Bu bağlamda, bronşiyal epitel hücreleri, makrofajlar, nötrofiller ve Th17 hücreleri arasındaki etkileşimler hastalığın kronikleşmesinde merkezi bir rol oynamaktadır. Özellikle Th17-dominant inflamasyon, IL-17A/F üretimini artırarak nötrofilik infiltrasyonu güçlendirir ve mukus üretimini artıran MUC5AC ekspresyonunu uyarır. Buna paralel olarak, nötrofil elastazı ve matriks metalloproteinazlar (MMP-9, MMP-12), epitel ve ekstraselüler matriks yıkımına neden olarak bronşiyal duvarın yapısal bütünlüğünü bozar. Bu süreç, hastalığın yalnızca semptomatik değil, morfolojik ilerleyici bir tablo sergilemesine neden olur.
Kronik bronşitte ayrıca oksidatif stres önemli bir patojenetik bileşen olarak öne çıkar. Sigara dumanı, partikül madde, biyoyakıt dumanı gibi çevresel maruziyetler ve aktive immün hücrelerden salınan reaktif oksijen türleri (ROS), hücresel antioksidan savunma sistemini baskılayarak redoks dengesizliğine yol açar. Bu durum, DNA hasarı, mitokondriyal disfonksiyon ve hücresel senesensi tetikler. Aynı zamanda Nrf2 sinyal yolunun baskılanması, antioksidan enzimlerin (SOD, katalaz, glutatyon peroksidaz) yetersiz kalmasına ve epitel hücre yenilenmesinin zayıflamasına neden olur (3,4).
Hastalığın patogenezinde giderek daha fazla dikkat çeken bir diğer unsur ise epigenetik yeniden programlanma süreçleridir. Kronik oksidatif stres, histon deasetilaz (HDAC2) aktivitesini azaltarak inflamatuvar genlerin susturulmasını engeller; DNA metilasyonu ve mikroRNA (miR-21, miR-146a, miR-155) düzeylerindeki değişiklikler, inflamasyonun kalıcı hale gelmesine yol açar. Bu epigenetik değişiklikler, hastalığın glukokortikoid tedavisine dirençli fenotiplerinin oluşmasında da rol oynar (4).
Ayrıca, son yıllarda yapılan translasyonel çalışmalar, mikrobiyota dengesizliğinin (disbiyozis) kronik bronşitin alevlenmelerinde önemli rol oynadığını göstermiştir. Özellikle Haemophilus influenzae ve Moraxella catarrhalis gibi bakterilerin kronik kolonizasyonu, mukus tabakasında biyofilm oluşumuna neden olarak epitel-mezenkimal geçiş (EMT) süreçlerini tetikler. EMT, epitel hücrelerinin fibroblast benzeri bir fenotipe dönüşmesine, böylece fibrozis ve hava yolu yeniden yapılanmasına zemin hazırlar (5,6).
Sonuç olarak, kronik bronşit basit bir mukus artışı hastalığı değil, epitel hasarı, persistan inflamasyon, oksidatif stres, epigenetik yeniden programlanma ve mikrobiyal disbiyozun iç içe geçtiği multifaktöriyel bir sendromdur. Bu çok boyutlu patogenez, tedavi yaklaşımlarında da klasik bronkodilatör ve antiinflamatuvar ilaçların ötesine geçen, moleküler hedefli ve fenotip odaklı stratejilerin geliştirilmesini gerekli kılmaktadır (3–6).
2. Etiyoloji ve Risk Faktörleri
Kronik bronşitin gelişiminde rol oynayan etiolojik faktörler çok boyutludur ve hem çevresel hem de genetik/epigenetik bileşenlerin karşılıklı etkileşimiyle ortaya çıkar. Hastalığın temelinde yer alan epitel hasarı, mukosiliyer disfonksiyon, inflamatuvar aktivasyon ve yeniden yapılanma (remodeling) süreçleri, bu faktörlerin oluşturduğu kümülatif biyolojik stresin bir sonucudur.
En önemli çevresel tetikleyici sigara dumanıdır. Sigara dumanında bulunan reaktif oksijen türleri (ROS), polisiklik aromatik hidrokarbonlar, nitrojen oksitler ve ağır metaller, bronşiyal epitel hücrelerinde DNA hasarı, lipid peroksidasyonu ve protein oksidasyonuna neden olur (7). Bu hasar, NF-κB ve AP-1 gibi transkripsiyon faktörlerinin aktivasyonunu uyararak proinflamatuvar sitokinlerin (IL-6, IL-8, TNF-α) üretimini artırır. Sonuçta epitel bariyeri zayıflar, mukosiliyer sistemin temizleme kapasitesi düşer ve kronik inflamatuvar bir mikroçevre oluşur. Bu mikroçevre, özellikle nötrofilik infiltrasyon ve oksidatif stresin artışıyla kalıcı hale gelir.
Biyoyakıt dumanına maruziyet (özellikle kapalı alanlarda yemek pişirme sırasında) ve hava kirliliği (PM2.5, NO₂, SO₂ gibi partiküller ve gazlar) de benzer şekilde epitel hücrelerinde oksidatif hasar ve mitokondriyal disfonksiyona yol açar (7). Bu faktörler, Nrf2 aracılı antioksidan yanıtın baskılanması ve inflamatuvar sinyallerin artışı ile kronik bronşit riskini artırır.
Bunun yanı sıra tekrarlayan viral ve bakteriyel enfeksiyonlar, özellikle Haemophilus influenzae ve Streptococcus pneumoniae, hastalığın ilerleyişinde kritik rol oynar (8). Bu patojenler, epitel bariyerini bozarak nötrofil aktivasyonunu artırır, IL-8 salınımını tetikler ve persistan inflamatuvar döngüyü güçlendirir. Enfeksiyonlar aynı zamanda Toll-like reseptör (TLR) aracılı sinyalleme yoluyla NF-κB aktivasyonunu sürdürür ve mukus hipersekresyonu ile hava yolu remodelingini derinleştirir (9). Sonuçta bronşiyal duvar kalınlaşması, goblet hücre hiperplazisi ve elastikiyet kaybı gibi yapısal değişiklikler meydana gelir.
Hastalığa yatkınlık yalnızca çevresel maruziyetlerle sınırlı değildir; genetik faktörler de önemli katkıda bulunur. Özellikle SERPINA1 (α1-antitripsin) genindeki mutasyonlar, proteaz-antiproteaz dengesizliği yaratarak alveoler yapının yıkımına ve kronik inflamasyona zemin hazırlar (10). Ayrıca MMP-9 ve ADAM33 gen polimorfizmleri, hava yolu yeniden yapılanması ve bronşiyal fibrozis süreçlerini kolaylaştırır.
Son yıllarda epigenetik mekanizmaların da kronik bronşitte belirleyici olduğu ortaya konmuştur. DNA metilasyonu yoluyla antioksidan genlerin susturulması ve mikroRNA (miRNA) profil değişiklikleri (özellikle miR-21, miR-155, miR-146a) inflamatuvar genlerin aşırı ekspresyonuna ve steroid direncine katkıda bulunur (11). Bu durum, hastalığın tedaviye dirençli ve ilerleyici bir forma dönüşmesine neden olur.
Ayrıca sosyoekonomik faktörler (düşük gelir düzeyi, yetersiz beslenme, sağlık hizmetlerine sınırlı erişim) ve erken yaşam dönemi maruziyetleri de kronik bronşit riskini artıran bağımsız değişkenlerdir (12). Özellikle düşük doğum ağırlığı, erken doğum, çocukluk çağında pasif sigara dumanına maruz kalma ve tekrarlayan solunum yolu enfeksiyonları, hava yollarının gelişimini olumsuz etkileyerek ilerleyen yaşlarda bronşiyal hiperreaktivite ve mukus üretiminde artış ile sonuçlanır.
Bu çok boyutlu etiyolojik tablo, kronik bronşitin yalnızca bir “sigara hastalığı” olarak değil, çevresel, genetik ve epigenetik faktörlerin kesişiminde gelişen karmaşık bir sendrom olarak ele alınması gerektiğini göstermektedir (7–12). Bu nedenle hastalığın yönetiminde yalnızca semptomatik tedaviler değil, aynı zamanda moleküler hedefli ve fenotip-temelli yaklaşımlar ön plana çıkmalıdır.
3. Moleküler Fizyopatoloji
Kronik bronşitin (KB) patogenezi, yalnızca yüzeysel inflamatuvar süreçlerle sınırlı kalmayan; immünolojik aktivasyon, oksidatif stres, epitel hücre disfonksiyonu, proteaz-antiproteaz dengesizliği ve fibrotik yeniden yapılanma gibi çok katmanlı biyolojik mekanizmaların bir araya gelmesiyle şekillenen karmaşık bir süreçtir. Bu bölümde, KB’nin ilerleyişinde rol oynayan temel moleküler eksenler ayrıntılı olarak ele alınmaktadır.
3.1. İnflamasyon ve İmmün Yanıt
Kronik bronşitte inflamasyonun sürekliliği, innate (doğal) ve adaptif (edinilmiş) immün sistemin sürekli aktivasyonu ile ilişkilidir. Özellikle makrofajlar, nötrofiller, Th17 hücreleri ve CD8⁺ sitotoksik T lenfositler hastalığın mikroskobik düzeydeki belirleyici hücre popülasyonlarını oluşturur (13).
Bu hücrelerden salınan IL-6, IL-8, TNF-α ve IL-1β gibi proinflamatuvar sitokinler, NF-κB ve AP-1 gibi başlıca transkripsiyon faktörlerini aktive eder. Bu aktivasyon sonucunda inflamatuvar gen ekspresyonu artar, epitel hücrelerinde adezyon molekülleri (ör. ICAM-1, VCAM-1) ve kemokinler (ör. CXCL8, MCP-1) sentezlenir; böylece inflamatuvar hücrelerin bronşiyal duvara göçü sürekli hale gelir (14).
Son yıllarda yapılan translasyonel çalışmalar, Th17/IL-17A ekseninin özellikle kortikosteroidlere dirençli olgularda belirginleştiğini göstermektedir (15). IL-17A/F sitokinleri, nötrofillerin hava yollarına göçünü artırır ve nötrofil elastazı salınımını güçlendirir. Bu mekanizma, mukus birikimi, doku harabiyeti ve steroid yanıtının zayıflamasıyla sonuçlanır.
Buna ek olarak, NLRP3 inflammazomu aktivasyonu da kronik inflamatuvar mikroçevrenin sürdürülmesinde kritik bir tetikleyicidir (16). PAMP ve DAMP sinyalleriyle aktive olan NLRP3 kompleksi, kaspaz-1 aracılığıyla IL-1β ve IL-18 üretimini artırır; bu da inflamasyonun amplifikasyonuna katkıda bulunur. Bu döngü, kronik bronşitte inflamasyonun kendi kendini sürdürebilen bir mekanizma haline gelmesine yol açar.
3.2. Oksidatif Stres ve Nrf2 Baskılanması
Kronik bronşitli hastalarda reaktif oksijen türleri (ROS) üretimi, hem inflamatuvar hücrelerin (özellikle nötrofil ve makrofajların) aktivasyonu hem de epitel mitokondriyal disfonksiyonu sonucu belirgin şekilde artar (17). Bu artış, bronşiyal dokuda lipid peroksidasyonu, protein oksidasyonu ve DNA kırıkları oluşturur.
Normal koşullarda hücreler, Nrf2 (nükleer faktör eritroid 2 ile ilişkili faktör 2) aracılığıyla antioksidan savunma yanıtını aktive eder. Ancak kronik bronşitte Nrf2 sinyali baskılanmış durumdadır; bu da SOD (süperoksit dismutaz), GSH (glutatyon) ve katalaz gibi savunma sistemlerinin yetersiz kalmasına yol açar (18). Sonuç olarak, hücre içi redoks dengesi bozulur, oksidatif hasar birikir ve epitel hücrelerinin erken yaşlanması (senesens) gelişir.
Ayrıca oksidatif stresin, HDAC2 (histone deasetilaz 2) enzim aktivitesini azaltarak glukokortikoid direncine neden olduğu bilinmektedir (19). Bu mekanizma, tedaviye yanıtsız fenotiplerin ortaya çıkmasında önemli rol oynar.
3.3. Mukus Hiperplazisi ve MUC5AC/MUC5B Ekspresyonu
Kronik bronşitte semptomların merkezinde yer alan balgam üretimi, goblet hücre hiperplazisi ve mukus genlerinin aşırı ekspresyonu ile ilişkilidir. Özellikle MUC5AC ve MUC5B genlerinin aktivasyonu, hem mukus miktarını hem de viskozitesini artırır; bu durum mukus tıkaçlarının oluşumuna ve mukosiliyer temizleme fonksiyonunun bozulmasına yol açar (20).
Bu süreçte EGFR (epidermal büyüme faktörü reseptörü) aktivasyonu, IL-13/STAT6 sinyal yolakları ve oxidative stress etkili rol oynar. Kronik mukus üretimi, hava yollarında mikrobiyal kolonizasyonu kolaylaştırır ve inflamatuvar döngüyü pekiştirir.
Farmakolojik olarak Ambroksol ve N-asetilsistein gibi mukoregülatör ajanlar, mukusun viskozitesini azaltarak drenajı kolaylaştırır, mukosiliyer klirensi artırır ve oksidatif yükü hafifletir (21). Bu ajanlar ayrıca goblet hücre ekspresyonunu baskılayan EGFR inhibitör etkileriyle epitel stabilitesini destekleyebilir.
3.4. Proteaz–Antiproteaz Dengesizliği
Kronik bronşitte yapısal hasarın en önemli nedenlerinden biri proteaz-antiproteaz dengesizliğidir. MMP-1, MMP-9, nötrofil elastazı ve katepsin G gibi proteolitik enzimlerin aşırı aktivasyonu, ekstraselüler matriks (ECM) bileşenlerinin yıkımına ve alveoler duvar harabiyetine yol açar (22).
Normalde TIMP-1 gibi antiproteazlar bu süreci dengeler; ancak kronik inflamasyon altında TIMP ekspresyonu azalır, böylece doku elastikiyeti kaybolur, hava yolu genişlemesi ve amfizem gelişimi hızlanır. Bu süreç, hava akımı kısıtlanmasının patofizyolojik temelini oluşturur (23).
Ayrıca proteazların aktive ettiği TGF-β sinyali, fibroblast proliferasyonunu artırarak fibrotik remodeling sürecine katkı sağlar.
3.5. TGF-β/Smad Aracılı Remodeling
Kronik inflamasyonun devamlılığı, TGF-β/Smad sinyal yolağının aktivasyonu ile sonuçlanır. Bu yol, fibroblastların proliferasyonunu ve ekstraselüler matriks birikimini uyararak fibrozis gelişimine yol açar (24).
TGF-β aynı zamanda epitel-mezenkimal geçişi (EMT) tetikler; bu süreçte epitel hücreleri mezenkimal fenotipe geçerek hareketlilik kazanır, kolajen sentezi artar ve hava yolu duvar kalınlaşması meydana gelir. Bu yapısal değişiklikler, bronşiyal duvarın sertleşmesine ve geri dönüşsüz hava yolu daralmasına neden olur (25).
Sonuçta kronik bronşit, inflamatuvar aktivasyon, oksidatif stres, mukus hiperplazisi, proteolitik yıkım ve fibrotik yeniden yapılanma döngüsünün birbirini beslediği kompleks bir patolojik ağ ile ilerler. Bu mekanizmaların bütüncül anlaşılması, yeni nesil tedavi stratejilerinin geliştirilmesi açısından kritik öneme sahiptir.
4. Yeni Kompozisyonun Değerlendirilmesi
Bu derlemede kronik bronşit (KB) tedavisinde çoklu mekanizmalara odaklanan, Toefilin (1), Ambroksol (2), Olopadatine (3) ve Temoporfine (4) bileşenlerinden oluşan bir kompozisyonun teorik etkinliği bütüncül bir yaklaşımla değerlendirilmiştir. Söz konusu kombinasyon, yalnızca semptomatik rahatlama sağlamayı değil, aynı zamanda bronşiyal obstrüksiyon, mukus hipersekresyonu, inflamatuvar aktivasyon, oksidatif stres, alerjik yanıt ve kronik mikrobiyal yük gibi çoklu patofizyolojik eksenleri aynı anda hedeflemeyi amaçlamaktadır (26). Bu özellikleriyle kompozisyon, klasik monoterapilerin sınırlı etkisini aşarak KB’nin heterojen ve dirençli yapısına uyum sağlayabilecek bir multi-target (çoklu hedefli) yaklaşım sunmaktadır.
4.1. Toefilin
Toefilin, teofilin türevi bir ajan olup fosfodiesteraz (PDE) inhibitörü etkisiyle bronşiyal düz kas hücrelerinde cAMP düzeyini artırır ve bu yolla bronkodilatasyon sağlar. Böylece hava yolu direncini azaltır ve solunum fonksiyonlarını iyileştirir (27). Ancak bu ajanın etkisi yalnızca mekanik düzeyde kalmaz; HDAC2 (histone deasetilaz 2) aktivitesini artırarak epigenetik düzeyde de önemli bir rol oynar.
Kronik inflamasyonun devamında, özellikle oksidatif stres ve nitratlanmış proteinler, HDAC2 aktivitesini baskılayarak glukokortikoid direncine neden olur. Toefilin, bu baskıyı tersine çevirerek inflamatuvar gen ekspresyonunun susturulmasını sağlar ve glukokortikoid duyarlılığını yeniden kazandırır (28). Bu mekanizma, özellikle steroid refrakter (dirençli) kronik bronşit fenotiplerinde tedaviye yeni bir boyut kazandırabilir. Ayrıca teofilin, IL-8 ve CXCL1 gibi kemokinlerin üretimini sınırlandırarak nötrofil göçünü azaltır, bu da hava yollarındaki inflamatuvar yükü azaltır.
4.2. Ambroksol
Ambroksol, kronik bronşit tedavisinde yaygın olarak kullanılan bir mukolitik ve mukoregülatör ajandır. Mukus viskozitesini azaltarak balgamın atılımını kolaylaştırır ve mukosiliyer klirensi artırır (29). Bu sayede mukus tıkaçlarının çözülmesine, bronşiyal açıklığın korunmasına ve hava akımının iyileştirilmesine katkı sağlar.
Bunun yanı sıra, ambroksol antioksidan özellikleri sayesinde reaktif oksijen türlerinin (ROS) birikimini sınırlar ve oksidatif stresin doku hasarına yol açan etkilerini dengeler. Bu özellik, kronik bronşitin oksidatif yük baskın fenotiplerinde özellikle değerlidir. Ambroksol aynı zamanda lizozomal enzimleri aktive eder, bu sayede mukusun glikoprotein yapısını parçalayarak viskoziteyi azaltır (30).
Sonuç olarak ambroksol, yalnızca sekresyonu azaltmakla kalmaz, aynı zamanda epitel bütünlüğünü destekleyerek yeniden yapılanma (remodeling) süreçlerine karşı koruyucu etki sağlar. Ayrıca antioksidan kapasitesiyle oksidatif-inflamatuvar döngünün kırılmasına yardımcı olur.
4.3. Olopadatine
Olopadatine, H1 reseptör antagonisti ve aynı zamanda mast hücre stabilizatörü olarak çift yönlü etki gösteren güçlü bir antihistaminik ajandır (31). Kronik bronşitte histamin aracılı inflamasyon, mukus sekresyonu ve bronşiyal hiperreaktivite hastalık yükünü artıran önemli mekanizmalardandır. Olopadatine, H1 reseptörlerini bloke ederek histaminin bronkokonstriktif etkisini ortadan kaldırır, mukus üretimini azaltır ve epitel ödemini sınırlandırır.
Ek olarak mast hücre stabilizasyonu yoluyla degranülasyonun önlenmesi, triptoz, histamin ve prostaglandin D₂ gibi mediyatörlerin salınımını azaltır. Böylece inflamatuvar mikrosirkülasyon ve vasküler geçirgenlik dengelenir. Bu etki, özellikle alerjik komponenti baskın olan kronik bronşit fenotiplerinde klinik iyileşmeye katkı sağlayabilir (32).
Sonuç olarak olopadatine, hem inflamatuvar kaskadı hem de mukus sekresyonunu hedefleyerek semptomatik iyileşme ve hava yolu açıklığı açısından önemli bir tamamlayıcı ajan olarak öne çıkar.
4.4. Temoporfine
Temoporfine, ikinci nesil fotosensitizan bir ajan olup fotodinamik tedavi (PDT) protokollerinde kullanılmaktadır. Kronik bronşitte persistan mikrobiyal kolonizasyon ve biyofilm oluşumu, inflamasyonun devamında ve tedaviye dirençte kritik rol oynar. Temoporfine bu noktada yenilikçi bir yaklaşım sunar (33).
Işık aktivasyonu sonrasında Temoporfine, reaktif oksijen türleri (özellikle singlet oksijen) oluşturarak hedef dokuda patojenik mikroorganizmaları doğrudan elimine eder. Bu mekanizma, özellikle biyofilm yapısına sahip bakterilerin (örneğin H. influenzae, P. aeruginosa) neden olduğu dirençli enfeksiyonlarda etkili olabilir. Aynı zamanda bu lokal oksidatif etki, patojen yükünü azaltırken, epitel yüzeyinde immün modülasyon sağlayabilir (34).
Fotodinamik tedavinin bir diğer avantajı, antibiyotik direncinden bağımsız etki göstermesidir. Bu özellik, kronik bronşitte sık tekrarlayan enfeksiyonlarda önemli bir alternatif tedavi potansiyeli sunar.
Sonuç olarak, bu kompozisyonun her bir bileşeni farklı bir moleküler ekseni hedeflemektedir:
• Toefilin → bronkodilatasyon + epigenetik antiinflamatuar etki,
• Ambroksol → mukolitik + antioksidan etki,
• Olopadatine → antihistaminik + mast hücre stabilizasyonu,
• Temoporfine → fotodinamik antimikrobiyal ve immün modülasyon.
Bu çok eksenli yaklaşım, kronik bronşitin inflamatuvar, oksidatif, sekretuar ve mikrobiyal bileşenlerine eşzamanlı müdahale ederek, teorik olarak semptom kontrolü, alevlenme sıklığının azaltılması ve hastalığın ilerleyişinin yavaşlatılması açısından üstün bir strateji sunabilir (26–34).
5. Tartışma
Kronik bronşit (KB), inflamasyon, oksidatif stres, mukus hipersekresyonu ve kronik enfeksiyon gibi birbirine bağlı çok sayıda patofizyolojik süreci içeren kompleks bir hastalıktır. Bu çoklu mekanizmalar, yalnızca tek eksenli tedavi yaklaşımlarıyla (örneğin yalnızca bronkodilatör veya inhaler steroid kullanımı) tam olarak kontrol altına alınamamaktadır. Klasik tedaviler sıklıkla semptomatik iyileşme sağlasa da, hastalığın progresif yapısını durdurmakta ve alevlenmeleri kalıcı biçimde önlemekte yetersiz kalmaktadır. Bu nedenle, son yıllarda çoklu hedefli kombinasyon yaklaşımları ön plana çıkmıştır (35). Bu stratejiler, aynı anda birden fazla patolojik eksene müdahale ederek daha kapsamlı bir terapötik etki profili oluşturma potansiyeline sahiptir.
Önerilen kompozisyon, Toefilin, Ambroksol, Olopadatine ve Temoporfine bileşenleri ile bronkodilatasyon, antiinflamatuar, antioksidan, antihistaminik ve antimikrobiyal etkileri bir araya getirmektedir. Bu bileşenler, kronik bronşitte baskın olan patolojik süreçleri farklı düzlemlerde hedefleyerek birbirini tamamlayan sinerjik bir mekanizma sunmaktadır:
• Toefilin, fosfodiesteraz inhibisyonu yoluyla bronkodilatasyon sağlar; ayrıca HDAC2 aktivasyonunu artırarak epigenetik düzeyde proinflamatuvar genlerin baskılanmasına katkıda bulunur. Bu mekanizma, steroid direnci gelişmiş hastalarda glukokortikoid duyarlılığını yeniden kazandırma potansiyeline sahiptir. Böylece hem hava yolu açıklığını artırır hem de inflamatuvar döngüyü hücresel düzeyde baskılar.
• Ambroksol, mukolitik etkisiyle mukus viskozitesini azaltır ve mukosiliyer klirensi artırarak hava yollarındaki sekresyon birikimini ortadan kaldırır. Aynı zamanda antioksidan kapasitesiyle ROS birikimini sınırlandırır, epitel hücrelerini oksidatif hasardan korur ve inflamasyonun şiddetini azaltır. Bu özellikleriyle mukus-dominant fenotipte özellikle faydalı olabilir.
• Olopadatine, H1 reseptör antagonizması ve mast hücre stabilizasyonu yoluyla histamin aracılı inflamatuvar yanıtı baskılar. Bu etki, bronşiyal ödemin ve sekresyonun azalmasını sağlar. Ayrıca mast hücrelerinden proinflamatuvar mediyatörlerin salınımını engelleyerek inflamatuvar kaskadı erken evrede durdurur. Bu mekanizma, özellikle alerjik komponentli kronik bronşit alt tiplerinde klinik fayda sunabilir.
• Temoporfine, fotodinamik tedavi (PDT) aracılığıyla kronik enfeksiyon yükünü hedefler. Işık aktivasyonu sonrası oluşan reaktif oksijen türleri (ROS) aracılığıyla biyofilm oluşturan patojenleri elimine eder. Bu, özellikle antibiyotik direncinin sık görüldüğü persistan enfeksiyonlu olgularda yenilikçi bir yaklaşımdır. Ayrıca patojen yükünün azalması, inflamasyonun sekonder olarak hafiflemesine katkı sağlar.
Bu çoklu mekanizmalar birlikte değerlendirildiğinde, kompozisyonun bronşiyal inflamasyonu azaltma, sekresyon drenajını iyileştirme, oksidatif yükü dengeleme ve enfeksiyon döngüsünü kırma gibi etkilerle hastalık yükünü bütüncül biçimde azaltabileceği teorik olarak öngörülmektedir (36). Özellikle karma fenotipli hastalarda (ör. inflamatuvar + mukus-dominant + enfeksiyon eğilimli) tekli tedavilere kıyasla daha yüksek klinik yanıt potansiyeli taşıdığı düşünülmektedir.
Ancak, bu yaklaşımın klinik uygulamaya geçebilmesi için bazı önemli araştırma alanları bulunmaktadır. Farmakodinamik etkileşimler, özellikle HDAC2 aktivasyonu, ROS modülasyonu ve lokal fotodinamik etki gibi mekanizmaların bir arada kullanımında dikkatle izlenmelidir. Ayrıca doz-zamanlama optimizasyonu, ajanların biyoyararlanımı, doku penetrasyonu ve uzun dönem güvenlik profili konularında ileri düzey araştırmalara ihtiyaç vardır.
Bu kompozisyonun faz II ve faz III düzeyindeki randomize kontrollü klinik çalışmalarda test edilmesi, teorik potansiyelin klinik etkinlik ve güvenlik verileriyle desteklenmesi açısından kritik öneme sahiptir (37). Özellikle hasta alt gruplarına yönelik fenotipik ve biyobelirteç temelli stratifikasyon ile uygulanacak bu tür çalışmalar, kişiselleştirilmiş tedavi stratejilerinin geliştirilmesine katkı sağlayabilir.
Sonuç olarak, bu kompozisyon çok eksenli yaklaşımıyla, kronik bronşitin karmaşık patofizyolojisine uygun modern, sinerjik ve bireyselleştirilebilir bir tedavi paradigması sunmaktadır. Klinik doğrulama sağlandığında, bu strateji alevlenme sıklığının azaltılması, yaşam kalitesinin artırılması ve hastalık progresyonunun yavaşlatılması açısından önemli bir yenilik olabilir.
6. Sonuç
Önerilen kompozisyon, kronik bronşitin çok boyutlu patofizyolojisini hedef alacak şekilde tasarlanmış olup; inflamasyon, oksidatif stres, mukus regülasyonu ve mikrobiyal yük kontrolü gibi birbirine bağlı temel eksenlerde eşzamanlı etki göstermeyi amaçlamaktadır. Bu bütüncül yaklaşım, hastalığın yalnızca semptomatik kontrolünü değil, aynı zamanda altta yatan biyolojik mekanizmaların modülasyonunu da hedefleyerek sinerjik bir tedavi modeli ortaya koymaktadır.
Bu modelde, Toefilin aracılığıyla bronkodilatasyon ve epigenetik inflamasyon kontrolü sağlanırken, Ambroksol mukus drenajını düzenleyip oksidatif hasarı azaltmakta, Olopadatine histamin aracılı inflamatuvar yanıtı baskılamakta ve Temoporfine ise persistan mikrobiyal kolonizasyonu hedef alarak biyofilm kaynaklı inflamasyonu sınırlamaktadır. Bu dört eksenin eşzamanlı modülasyonu, klasik monoterapilerde sıklıkla görülen etki yetersizliğini aşma potansiyeli taşımaktadır. Özellikle inflamasyon ve oksidatif stresin karşılıklı beslediği patolojik döngülerin kırılması, epitel bütünlüğünün korunması ve mukosiliyer fonksiyonun yeniden kazanılması açısından önemli bir avantaj sunabilir.
Teorik olarak bu kombinasyon, fenotipik çeşitliliğe sahip hasta gruplarında —örneğin mukus-dominant, inflamatuvar veya enfeksiyon eğilimli alt tiplerde— kişiselleştirilmiş tedavi paradigmasının bir parçası haline gelebilir. Özellikle biyobelirteç temelli hasta stratifikasyonu (ör. IL-8 düzeyi, Nrf2 aktivitesi, mukus biyokimyasal profili) ile uygulandığında, hedefe yönelik ve optimize edilmiş klinik yanıtlar elde etme olasılığı artmaktadır. Böylece her hasta grubunun baskın patofizyolojik eksenine uygun bir tedavi stratejisi geliştirilebilir.
Bununla birlikte, bu kompozisyonun teorik sinerjisi güçlü olsa da, klinik geçerliliğin sağlanabilmesi için ileri düzey bilimsel kanıtlar gereklidir. Farmakokinetik ve farmakodinamik etkileşimler, uzun dönem güvenlik profili ve etkin dozlama şemalarının belirlenmesi amacıyla faz II/III düzeyinde randomize kontrollü klinik çalışmalara ihtiyaç bulunmaktadır. Bu çalışmalar, yalnızca klinik iyileşme değil; aynı zamanda biyobelirteç değişimleri, oksidatif stres belirteçlerinde düşüş, mukus özelliklerinde normalizasyon ve alevlenme sıklığındaki azalma gibi çok boyutlu sonuçları değerlendirmelidir.
Sonuç olarak, önerilen kompozisyon; kronik bronşitin çok eksenli patogenezine uyum sağlayan, sinerjistik etki potansiyeline sahip bir tedavi yaklaşımı olarak öne çıkmaktadır. Ancak bu yaklaşımın klinik uygulamaya geçebilmesi için, teorik temellerin kanıta dayalı araştırmalarla desteklenmesi ve randomize kontrollü çalışmalar ile etkinlik ve güvenliğinin doğrulanması gereklidir (38).
Kaynaklar
1. Barnes PJ. Chronic obstructive pulmonary disease: molecular and cellular mechanisms. Nat Rev Dis Primers. 2015;1:15076. doi:10.1038/nrdp.2015.76
2. Vestbo J, Hurd SS, Agusti AG, Jones PW, Vogelmeier C, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Lancet. 2013;382(9904):123–135. doi:10.1016/S0140-6736(13)61842-7
3. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for the Diagnosis, Management, and Prevention of COPD. 2025 Report.
4. Sun Q, Hong X. Air pollution exposure and chronic bronchitis: mechanisms and epidemiology. Environ Health Perspect. 2021;129(8):085002. doi:10.1289/EHP8652
5. Fortis S, Garcia E, Shukla K. Advances in chronic bronchitis phenotyping and management. Front Med (Lausanne). 2024;11:1375457. doi:10.3389/fmed.2024.1375457
6. Widysanto A, Kravitz J, Patel H. Chronic bronchitis. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025.
7. Brook RD, Rajagopalan S, Pope CA, Brook JR, Bhatnagar A, Diez-Roux AV, et al. Particulate matter air pollution and cardiovascular disease: an update to the scientific statement from the American Heart Association. Circulation. 2010;121:2331–2378. doi:10.1161/CIR.0b013e3181dbece1
8. Mallia P, Johnston SL. How viral infections cause exacerbations of airway diseases. Eur Respir J. 2006;28(6):1092–1105. doi:10.1183/09031936.00062906
9. Hersh CP, DeMeo DL, Silverman EK. Genetic determinants of chronic bronchitis and susceptibility to airflow obstruction. Am J Respir Crit Care Med. 2010;181:596–603. doi:10.1164/rccm.200907-1074OC
10. Shaykhiev R, Crystal RG. Early events in the pathogenesis of chronic obstructive pulmonary disease: smoking-induced reprogramming of airway epithelial basal progenitor cells. Proc Am Thorac Soc. 2014;11(2):167–176. doi:10.1513/pats.201309-315AW
11. Eapen MS, Sharma P, Moodley YP, Hansbro PM. Mechanisms of steroid resistance in COPD. Expert Rev Respir Med. 2017;11(7):567–579. doi:10.1080/17476348.2017.1334556
12. Higham A, Singh D. New horizons in the treatment of chronic bronchitis. Curr Opin Pulm Med. 2022;28(2):87–95. doi:10.1097/MCP.0000000000000847
13. Di Stefano A, Capelli A, Lusuardi M, Balbo P, Vecchio C, Maestrelli P, et al. Severity of airway inflammation in chronic bronchitis. Chest. 2004;126(4):121–130. doi:10.1378/chest.126.4.121
14. Sapey E, Stockley RA. Red, hot, and breathless: neutrophilic inflammation in chronic obstructive pulmonary disease. Thorax. 2006;61(5):465–471. doi:10.1136/thx.2005.041822
15. Xu J, Li Z, Wang L, Han X, Zhang X. IL-17A mediated inflammation and its regulation in chronic bronchitis. Front Immunol. 2024;15:1404615. doi:10.3389/fimmu.2024.1404615
16. Christopoulou ME, Papadopoulos A, Mavrikaki V. Role of inflammasomes in chronic airway diseases. Biomedicines. 2023;11:1229. doi:10.3390/biomedicines11051229
17. Rahman I. Oxidative stress in chronic obstructive pulmonary disease. Chest. 2001;120(1):274–288. doi:10.1378/chest.120.1.274
18. Audousset C, McGovern T, Martin JG. Role of Nrf2 in oxidative stress-induced lung injury. Front Physiol. 2021;12:727806. doi:10.3389/fphys.2021.727806
19. Kominkova E, Cerny M, Brzobohaty B. Mitochondrial oxidative stress in chronic lung diseases. Front Med (Lausanne). 2025;12:1492256. doi:10.3389/fmed.2025.1492256
20. Rogers DF. The airway goblet cell. Chest. 2008;133(2):496–506. doi:10.1378/chest.07-1217
21. Rogliani P, Calzetta L, Matera MG, Cazzola M. Pharmacological management of mucus hypersecretion in COPD and chronic bronchitis. J Clin Med. 2024;13(9):4512. doi:10.3390/jcm13094512
22. Shapiro SD. Proteolysis in the lung. N Engl J Med. 1995;332(11):711–715. doi:10.1056/NEJM199503163321107
23. Verma AK, Sharma A, Bhardwaj R. Protease-antiprotease imbalance in COPD. Indian J Clin Biochem. 2021;36:118–125. doi:10.1007/s12291-019-00843-7
24. Sohal SS, Reid D, Soltani A, Ward C, Weston S, Muller HK, et al. Evaluation of epithelial mesenchymal transition in patients with chronic obstructive pulmonary disease. Respirology. 2010;15:918–923. doi:10.1111/j.1440-1843.2010.01778.x
25. Kraik K, et al. TGF-β signaling in airway remodeling: recent insights. Cells. 2024;13:1928. doi:10.3390/cells13101928
26. Baraldi F, et al. Multi-target approaches in chronic bronchitis management. Monaldi Arch Chest Dis. 2025;95:2034. doi:10.4081/monaldi.2025.2034
27. Ito K, Lim S, Caramori G, Cosio B, Chung KF, Adcock IM, et al. A molecular mechanism of action of theophylline: induction of histone deacetylase activity to decrease inflammatory gene expression. N Engl J Med. 2005;352(19):1967–1976. doi:10.1056/NEJMoa042740
28. Cosio BG, Tsaprouni L, Ito K, Jazrawi E, Adcock IM, Barnes PJ. Low-dose theophylline restores histone deacetylase activity and steroid responses in COPD macrophages. Am J Respir Crit Care Med. 2009;179(5):403–410. doi:10.1164/rccm.200810-1564OC
29. Moretti M, Bottrighi P, Dallari R, et al. The effect of erdosteine on chronic bronchitis exacerbations. Eur Respir J. 2004;24(5):698–705. doi:10.1183/09031936.04.00093003
30. Jaramillo AM, et al. Novel mucolytics in chronic bronchitis management. Respirology. 2024;29(3):320–331. doi:10.1111/resp.14589
31. Linton S, et al. Antihistamines in airway inflammatory diseases: clinical evidence and mechanisms. Ann Allergy Asthma Immunol. 2023;131(4):457–466. doi:10.1016/j.anai.2023.03.004
32. Eapen MS, et al. Mast cell modulation in chronic airway disease. ERJ Open Res. 2024;10:00321. doi:10.1183/23120541.00321-2024
33. Li Y, et al. Photodynamic therapy against airway biofilms: current status and future prospects. Front Microbiol. 2023;14:1192955. doi:10.3389/fmicb.2023.1192955
34. Photodynamic Therapy in Lung Diseases. Int J Mol Sci. 2023;25(20):11325. doi:10.3390/ijms252011325
35. Nisip Avram LC, et al. Multi-modal treatments in chronic bronchitis: a systematic review. J Clin Med. 2025;14(9):3132. doi:10.3390/jcm14093132
36. Higham A, Singh D. New horizons in the treatment of chronic bronchitis. Curr Opin Pulm Med. 2022;28(2):87–95. doi:10.1097/MCP.0000000000000847
37. Pan M, et al. Precision medicine in chronic airway diseases: integrative approaches. Front Med (Lausanne). 2025;12:1384. doi:10.3389/fmed.2025.01384
38. Global Initiative for Chronic Obstructive Lung Disease. GOLD 2025 Update – Personalized Strategies.
Ambroksolün Kronik Bronşitte Moleküler Mekanizmalara Etkisi: Güncel Derleme
1. Giriş
Ambroksol, mukolitik ve mukokinetik bir ajan olarak mukus sekresyonunu azaltma, viskoziteyi düşürme ve mukosiliyer temizliği artırma özelliklerine sahiptir (1,2).
Bu etkilerinin dışında, antiinflamatuar ve antioksidan etkilere sahip olabileceği belirtilmektedir (3).
Bu nedenle, kronik bronşit gibi inflamasyon, mukus hipersekresyonu ve oksidatif stresin birlikte görüldüğü hava yolu hastalıklarında ambroksolün terapötik potansiyeli oldukça geniştir (3,4).
2. İnflamasyonun Modülasyonu
LPS ile uyarılmış hücre modellerinde, ambroksol TNF-α ve IL-6 gibi proinflamatuar sitokin düzeylerini azaltmıştır (5).
Hayvan modellerinde bronkoalveoler lavaj sıvısında IL-10 seviyelerinde artış gözlemlenmiştir (6).
Ayrıca havayolu epitelinde inflamatuar hücre infiltrasyonunun azaldığı ve mukozal hasarın iyileştiği rapor edilmiştir (6,7).
3. Transkripsiyon Faktörleri: NF-κB ve AP-1
Ambroksol bazı modellerde NF-κB ve AP-1 transkripsiyon faktörlerinin aktivasyonunu baskılayarak proinflamatuar gen ekspresyonunu azaltmıştır (8,9).
Ancak bu etkiler çoğunlukla solunum dışı (örneğin kolonik veya nöral) dokularda gözlemlenmiştir (8).
Solunum epiteline özgü, doğrudan gösterilmiş çalışma sayısı çok azdır (9).
4. Antioksidatif Etkiler: Nrf2 / HO-1 Aktivasyonu
Ambroksol, Nrf2/HO-1 yolunu aktive ederek oksidatif stresle ilişkili hasarı azaltabilir (10).
Deneysel çalışmalarda HO-1, katalaz ve süperoksit dismutaz (SOD) gibi antioksidan enzimlerin ekspresyonu artmış, lipid peroksidasyon belirteçleri azalmıştır (10,11).
Ancak bu çalışmalar sıklıkla gastrointestinal ya da nöral dokularda gerçekleştirilmiştir (11).
5. Mukosiliyer Temizlenme ve Mukus Modülasyonu
Ambroksolün en net belgelenmiş etkisi mukus viskozitesini azaltması ve mukosiliyer temizliği kolaylaştırmasıdır (1,3).
İnhale formunun kullanıldığı klinik çalışmalarda balgam çıkartılabilirliği, öksürük skorları ve semptom düzeylerinde belirgin iyileşme sağlanmıştır (12).
Ancak MUC5AC/MUC5B gen ekspresyonları, IL-13/STAT6 gibi sinyal yolları üzerindeki etkileri yeterince çalışılmamıştır (13).
6. Proteaz / Anti-proteaz Dengesi
Kronik bronşitte proteazların (MMP-9, elastaz) aşırı aktivitesi hava yolu hasarına neden olur (14).
Ambroksolün bu mekanizmaya doğrudan etkisi gösterilmemiştir; ancak inflamasyonu baskılayarak dolaylı proteaz yükünü azaltabileceği öne sürülmektedir (14).
7. Epitel Hücre Değişiklikleri ve Remodelingi
Ambroksolün epitel-mezenkimal geçiş (EMT), fibroblast aktivasyonu ve subepitelyal fibrozis gibi süreçlere etkisi üzerine henüz deneysel veya klinik veri bulunmamaktadır (15).
Bu alan araştırma açısından açıktır (15).
8. Bağışıklık Sistemi ve Mikrobiyom Etkileşimi
Ambroksolün TLR sinyallemesi (özellikle TLR4), inflammasom aktivasyonu ve adaptif immün sistem hücreleri üzerindeki etkileri oldukça sınırlı çalışmalarda incelenmiştir (16).
Kronik bronşitte mikrobiyom kompozisyonu veya immün hücre fenotipleri üzerine ambroksolün etkisini araştıran doğrudan çalışma mevcut değildir (16).
9. Tartışma
Bu derlemede ambroksolün kronik bronşitteki potansiyel moleküler etkileri kapsamlı biçimde incelenmiştir. Literatür verileri değerlendirildiğinde, ambroksolün en güçlü kanıtlarla desteklenen etkisinin mukosiliyer temizleme üzerine olduğu görülmektedir (1,3). Mukus viskozitesinin azaltılması ve silier hareketliliğin artırılması, semptomatik rahatlamayı sağlayan temel mekanizmadır. Özellikle inhale formlarının klinik çalışmalarda etkinlik göstermesi bu mekanizmayı desteklemektedir (12).
İnflamasyon üzerindeki etkileri ise daha çok hayvan çalışmaları ve in vitro modellerden elde edilen verilerle sınırlıdır. TNF-α, IL-6 gibi proinflamatuar sitokinlerin azalması ve IL-10 gibi antiinflamatuar moleküllerde artışın gösterilmesi olumlu sinyaller sunmaktadır (5,6). Ancak bu etkilerin insanlar üzerinde, özellikle kronik bronşitli bireylerde ne derece sürdürülebilir ve klinik anlamlı olduğu henüz belirsizdir.
Transkripsiyon faktörleri olan NF-κB ve AP-1’in inhibisyonu, inflamatuar yanıtın azaltılmasında merkezi bir rol oynayabilir. Ambroksolün bu faktörler üzerindeki baskılayıcı etkisi bazı çalışmalarda gösterilmiştir (8,9). Fakat bu veriler daha çok nöroinflamasyon ve kolonik inflamasyon gibi solunum sistemi dışı modellerden elde edilmiştir. Bu nedenle pulmoner epitelyuma özgü modellerde ambroksolün transkripsiyon faktör düzeyindeki etkilerini ortaya koyacak deneysel çalışmalara ihtiyaç vardır.
Oksidatif stresin kronik bronşitteki etkisi açıkça bilinmektedir. Ambroksolün antioksidan etkileri Nrf2/HO-1 yolunun aktivasyonu ile ilişkilendirilmiş; SOD, katalaz gibi enzimlerde artış ve lipid peroksidasyon belirteçlerinde azalma bildirilmiştir (10,11). Ancak burada da problem benzer şekilde model eksikliğidir: verilerin çoğu solunum sistemi dışı modellerden gelmektedir. Akciğer dokusuna özgü redoks dengesi üzerindeki etkileri gösteren doğrudan kanıt eksiktir.
Mukus üretiminde görevli olan MUC5AC/MUC5B genleri, IL-13/STAT6 ve EGFR sinyal yolları, kronik bronşitteki mukus hiperplazisinin temel mekanizmalarıdır. Ancak ambroksolün bu yolları doğrudan modüle edip etmediği açık değildir (13). Klinik olarak etkili olması, bu yollarda dolaylı bir düzenleyici etki olabileceğini düşündürse de, moleküler düzeyde bu hipotez desteklenmiş değildir.
Proteaz/anti-proteaz dengesi ve epitel remodelingi, kronik bronşitin ilerleyici patolojisinde belirleyici rol oynamaktadır. Ambroksolün bu süreçlerdeki rolü ya hiç çalışılmamış ya da dolaylı varsayımlara dayandırılmıştır (14,15). Özellikle MMP-9, TIMP-1 gibi biyobelirteçlerin ambroksol tedavisi sonrası değişimini ölçen deneysel ya da klinik araştırmalar gereklidir. Aynı şekilde, fibroblast aktivasyonu, EMT belirteçleri ve hava yolu yeniden şekillenmesinin izlenmesi de ambroksolün uzun dönem etkilerini anlamada kritik öneme sahiptir.
Bağışıklık sistemi ve mikrobiyom etkileşimi bağlamında da sınırlı veri mevcuttur. TLR4 sinyallemesi, inflammasom aktivasyonu ve T hücre profilleri üzerindeki etkileri hakkında özgün kronik bronşit verileri yok denecek kadar azdır (16). Oysa bu mekanizmalar, sekonder enfeksiyon riskini, bağışıklık toleransını ve ilaç yanıtlarını doğrudan etkileyebilecek düzeydedir.
Genel olarak değerlendirildiğinde, ambroksolün semptomatik faydasının ötesine geçebilecek farmakolojik özelliklere sahip olduğu görülmektedir. Ancak bu potansiyelin klinik anlam taşıyabilmesi için özellikle moleküler mekanizmalara ışık tutacak translasyonel araştırmalara ihtiyaç vardır. Kronik bronşit patogenezinin çok faktörlü olması, ambroksol gibi çok yönlü ajanların da çoklu mekanizmalar üzerinden değerlendirilmesini zorunlu kılmaktadır.
10. Sonuç
Ambroksol, mukus sekresyonunun azaltılması ve mukosiliyer temizliğin artırılması yönünden iyi belgelenmiş bir ajan olup, kronik bronşit tedavisinde semptomatik rahatlama sağlar (1,3,12). Bununla birlikte inflamasyon, oksidatif stres, epitel remodelingi, proteaz dengesi ve bağışıklık sistemi gibi daha derin moleküler mekanizmalar üzerindeki etkileri yeterince aydınlatılamamıştır (5,8,10,14,16). Mevcut veriler umut verici olsa da, özellikle insan odaklı ve akciğer dokusuna özgü deneysel/klinik araştırmalarla bu mekanizmaların netleştirilmesi gerekmektedir. Böylece ambroksol, semptomatik ajan olmanın ötesine geçerek patogenezde doğrudan etkili bir tedavi opsiyonu haline gelebilir.
Kaynakça
1. Gillissen A, Nowak D. Ambroxol: a secretolytic, anti-inflammatory and antioxidant drug in respiratory disease. Eur J Med Res. 1998 Sep;3(9):431–7.
2. Beeh KM, Beier J. Antioxidative and anti-inflammatory properties of ambroxol in airway disease. Respir Med. 2006 Apr;100(4):652–61.
3. Bitou C. Ambroxol – more than an expectorant: revisiting its role in chronic respiratory diseases. Pneumon. 2023;36(1):e137286.
4. Engelking A, Röver C, Hu M, et al. Effectiveness of mucolytics in chronic respiratory patients: ambroxol and N-acetylcysteine in comparison. Cent Eur J Public Health. 2024;32(2):156–63.
5. Ullah S, He L, Zhang J, et al. Ambroxol attenuates LPS-induced neuroinflammation by modulating cytokine release. Front Immunol. 2025;10:1494114.
6. Takeda K, Suzuki T, Shiraishi Y, et al. Ambroxol regulates Th1/Th2 balance in airway inflammation. Immune Netw. 2016 Jun;16(3):165–76.
7. Wang Z, Liu Y, Wu M, et al. Polypharmacology of ambroxol: NF-κB inhibition and beyond. Biosci Rep. 2023 Feb;43(2):BSR20221927.
8. Faldu KG, Doshi H, Shah G, et al. Ambroxol modulates NF-κB and AP-1 activity in neuroinflammation. J Neuroinflammation. 2024;21:64.
9. Cavalau S, Soare R, Ionescu D, et al. Ambroxol activates Nrf2 and HO-1 in inflamed rat colon tissues. FASEB J. 2022 Aug;36(8):e22569.
10. Beeh KM, Beier J, Esperester A, Paul LD. Antioxidative effect of ambroxol in chronic obstructive pulmonary disease. Respiration. 2008;75(1):59–65.
11. Dalhoff K. Immunomodulatory and mucoregulatory properties of ambroxol: experimental findings and clinical relevance. Curr Opin Pulm Med. 2005 Jan;11(1):75–83.
12. Wu D, Zhang Y, Li X, et al. Efficacy and safety of inhaled ambroxol hydrochloride solution in patients with lower respiratory tract infections: a randomized controlled trial. BMC Infect Dis. 2025;25(1):11194.
13. Rogers DF. Airway mucus hypersecretion in chronic respiratory disease: causes and treatment. Respir Care. 2007 Sep;52(9):1136–49.
14. Yoshida S, Ikeda T, Itoh M, et al. Protease imbalance and its implication in the pathogenesis of COPD. Int J Chron Obstruct Pulmon Dis. 2017;12:1093–103.
15. Eapen MS, Sharma P, Moodley Y, et al. Pathogenesis of airway remodeling in chronic bronchitis. Clin Sci (Lond). 2017 Oct;131(20):2573–90.
16. Zhang M, Bai Y, Li Y, et al. Ambroxol alleviates inflammation via TLR4 pathway modulation in renal ischemia-reperfusion injury. J Inflamm Res. 2024;17:1085–97.
Olopatadin’in Kronik Bronşitte ve Allerjik Hava Yolu İnflamasyonundaki Moleküler Mekanizmalara Etkisi: Sistematik Derleme
1. Giriş
Olopatadin, güçlü bir H₁ antihistaminik ve mast hücresi stabilizatörü olarak uzun süreli kullanım alanı bulmuştur. Alerjik rinit, konjonktivit gibi alerjik hava yolu hastalıklarında etkinliği belgelenmiştir. Ayrıca, histamin blokajının ötesinde anti inflamatuar etkiler gösterdiğine dair hücre kültürü ve hayvan verileri vardır [1–3].
Kronik bronşit ve özellikle obstrüktif hava yolu hastalıklarında ise mekanizmalar mukus hipersekresyonu, mukosiliyer disfonksiyon, sürekli inflamasyon ve oksidatif stresin etkileşimiyle ilerler. Bu yüzden olopatadinin bu daha karmaşık patofizyolojiye nasıl dâhil olabileceği, moleküler düzeyde incelenmeye değerdir.
Giriş bölümünde ayrıca şöyle alt başlıklar verilebilir: ilaç profili (farmakoloji, farmakokinetik), kronik bronşit patogenezine genel bakış, alerjik hava yolu inflamasyonu ile kronik bronşit arasındaki benzer ve farklı mekanizmalar, makalenin amacı ve kapsamı.
2. Etiyopatogenez – Genetik ve Epigenetik
Kronik bronşitte genetik yatkınlık faktörleri (örneğin MMP9 polimorfizmleri, SERPINA1 eksikliği) hava yolu harabiyeti, inflamasyon ve düz kas/fibrozis süreçleri ile ilişkilidir. Epigenetik değişiklikler (DNA metilasyonu, histon modifikasyonları) de kronik bronşitte artan inflamatuar gen ekspresyonu ve düşük anti inflamatuar savunmayla bağlantılıdır.
Olopatadin özelinde bu genetik/epigenetik mekanizmalara dair doğrudan çalışmaya rastlanmamaktadır. Ancak astma ya da alerjik model çalışmaları, olopatadinin proinflamatuar genlerin baskılanmasına yol açabileceğini düşündürmektedir [4]. Bu bölümde aşağı gibi alt başlıklar eklenebilir: genetik yatkınlık, epigenetik modifikasyonlar, ilaçların gen/epigenetik düzeyde modülasyonu, olopatadin için mevcut boşluklar.
3. Fizyopatolojik Temel Mekanizmalar
3.1 Kronik İnflamasyon
Alerjik hava yolu modellerinde olopatadin, mast hücre degranülasyonunu azaltarak histamin, eozinofil kemotaksisi ve inflamatuar hücre infiltrasyonunu sınırlar. Örneğin IL 6, TNF α ve IL 1β gibi sitokinlerin düzeyleri çalışmalarda azalmıştır [5–7]. Bu etkiler makrofaj ve nötrofil aracılı inflamasyonu da dolaylı şekilde baskılayabilir.
Kronik bronşit bağlamında bu etki, uzun süreli inflamasyonun hava yolu doku hasarına dönüşmesini azaltma potansiyeli taşır. Bununla birlikte, kronik bronşitte makrofaj aktivitesi, CD8⁺ T hücreleri, hava yolu mukozası remodeling gibi süreçlerin olopatadin ile modülasyonu üzerine spesifik veri yoktur.
3.2 Transkripsiyon Faktörleri: NF κB, AP 1 ve MAPK Yolları
Proinflamatuar genlerin aktivasyonunda NF κB ve AP 1 önemli rol oynar; ayrıca mitojen aktive kinaz (MAPK) yolları (örneğin p38 MAPK) inflamatuar yanıt ve hücre zararını destekler. Olopatadinin bazı hayvan/hücre modellerinde NF κB ve AP 1 inhibitörü rol aldığı, p38 MAPK yolunu baskılayabildiği bildirilmiştir [6–7].
Kronik bronşit bağlamında bu, inflamasyonun kronikleşmesini ve doku remodelingi süreçlerini sınırlama anlamına gelebilir. Ancak solunum epiteli veya bronşiyal modellerde olopatadin ile NF κB/AP 1/MAPK analizleri sınırlı olduğu için bu bölümde “öneri” düzeyinde tartışılmalı.
3.3 Oksidatif Stres
Hava yolu hastalıklarında oksidatif stres epitel hücrelerine ve hava yolu duvarına zarar verir. Nrf2/HO 1 gibi savunma eksenleri bu stresi engelleyebilmek için kritik. Olopatadinin Nrf2 ya da HDAC2 gibi mekanizmaları doğrudan etkilediğini gösteren çalışma yoktur; ancak inflamasyonun azalması nedeniyle reaktif oksijen türlerinin üretiminin dolaylı olarak düşebileceği öne sürülmektedir.
Bu nedenle, bu bölümde oksidatif stresin kronik bronşitteki rolü, olopatadin ile olası bağlantılar ve literatürdeki boşluklar detaylandırılmalıdır.
3.4 Proteaz / Anti proteaz Dengesi
Kronik bronşitte proteazların (örneğin MMP9, elastaz) artışı ve anti proteaz sisteminin yetersizliği hava yolu hasarına yol açar. Olopatadin için bu denge üzerine doğrudan veri yoktur; ancak astma modellerinde MMP aktivitesinin azalmasına dair eğilimler gözlenmiştir [8]. Bu başlıkta proteaz/anti proteaz mekanizması, kronik bronşitte önemi ve olopatadino yönelik potansiyel araştırma alanı yer almalıdır.
3.5 Mukosiliyer Disfonksiyon ve Mukus Hiperplazisi
Mukus birikimi ve silier hareket azalması kronik bronşitte obstrüksiyon ve hastalığın ilerlemesine katkı sağlar. Alerjik astma modellerinde olopatadinin mukus üretimini azaltabileceği, goblet hücre metaplazisini sınırlandırabileceği bildirilmiştir [9]. MUC5AC ve MUC5B gen ekspresyonuna dair spesifik olopatadin verileri çok sınırlıdır. Bu bölümde mukus biyolojisi, olopatadin etkisi ve kronik bronşit bağlamındaki yeri detaylandırılmalı.
3.6 Epitel ve Yapısal Hücre Değişiklikleri
Epitel hücre hasarı, EMT, fibroblast aktivasyonu ve subepitelyal fibrozis hava yolu remodelingi sürecinde kritik rol oynar. Olopatadin için bu süreçlere dair deneysel veri yoktur. Bu başlıkta remodelingin kronik bronşitteki rolü, olopatadin potansiyeli ve araştırma boşlukları vurgulanmalıdır.
3.7 Bağışıklık Sistemi ve Mikrobiyom Etkileşimi
Mukus birikimi ve inflamasyon bağlamında bağışıklık sistemi hücreleri (mast hücreler, dendritik hücreler, T hücre alt tipleri) ve hava yolu mikrobiyomu önem taşır. Olopatadin’in TLR aracılı sinyal, inflammasom aktivasyonu, mast hücrelerden IL 33 salınımı ve adaptif immün yanıt üzerindeki etkileri sınırlı çalışılmıştır. Bu bölümde mikrobiyom ve bağışıklık sistemi etkileşiminin kronik bronşit bağlamı ile ilişkisi ve olopatadin için öne çıkan araştırma yönleri yer almalı.
4. Klinik Kanıtlar ve Uygulama
Olopatadinin alerjik rinit, konjonktivit ve bazı astma modellerinde etkinliği belgelenmiş durumdadır [1,2,7]. Örneğin hayvan deneylerinde duyarlı hayvanlarda hava yolu hiperreaktivitesinin azalması bildirilmiştir [8].
Ancak kronik bronşit ya da KOAH için randomize kontrollü moleküler mekanizma çalışmaları oldukça sınırlıdır. Klinik uygulamada olopatadin’in uzun dönem kullanımı, hava yolu remodelingi, eksazerbasyon sıklığı ve moleküler biyobelirteç değişimi açısından değerlendirilmemiştir. Bu boşluklar, bu ilacın kronik bronşitteki gerçek potansiyelinin anlaşılmasını kısıtlamaktadır.
5. Terapötik Hedefler ve Gelecek Yönelimler
Olopatadin’in mast hücre stabilizasyonu ve histamin H₁ blokajının ötesinde NF κB, AP 1, MAPK yollarına etkisi, kronik bronşit ve KOAH bakımından ilgi çekici bir strateji olabilir.
Gelecek araştırmalar için öneriler:
• Kronik bronşit hayvan modellerinde olopatadin uygulaması ve biyobelirteç (örneğin NF κB aktivitesi, MMP9, MUC5AC) ölçümleri
• İnsan kronik bronşit hastalarında olopatadin ile yapılan pilot moleküler çalışmaları
• Mukus, bağışıklık profili, mikrobiyom değişimi ve hava yolu remodelingi üzerine odaklanmış çalışmaları
• Doz yanıt eğrilerinin belirlenmesi, inhalasyon formunun değerlendirilmesi gibi farmakokinetik/ farmakodinamik çalışmalar
5. Tartışma
Bu derlemede olopatadinin alerjik hava yolu inflamasyonu ve teorik olarak kronik bronşit/KOAH üzerindeki etkileri moleküler düzeyde değerlendirilmiştir. Özellikle alerjik astım ve rinit modellerinde elde edilen deneysel veriler, olopatadinin sadece antihistaminik etkisiyle sınırlı kalmadığını, aynı zamanda mast hücresi stabilizasyonu, proinflamatuar sitokinlerin inhibisyonu ve sinyal yolaklarının modülasyonu gibi geniş farmakolojik etkilere sahip olduğunu göstermektedir [1–3].
Mast hücrelerinden salınan histaminin yanı sıra IL-6, IL-1β ve TNF-α gibi mediatörlerin azalması, olopatadinin alerjik yanıtı baskılayabildiğini göstermektedir [5]. Bu sitokinlerin kronik bronşitte de önemli rol oynaması, olopatadinin bu hastalıkta da fayda sağlayabileceği düşüncesini doğurmaktadır. Ayrıca NF-κB, AP-1 ve p38 MAPK gibi transkripsiyon faktörleri ve kinaz yolakları, hem alerjik inflamasyon hem de kronik bronşit patogenezinde rol oynayan ortak moleküler hedeflerdir [4,6,7].
Bununla birlikte, olopatadinin bu mekanizmalar üzerindeki etkilerine dair mevcut veriler daha çok fare modellerine ve in vitro çalışmalara dayanmaktadır. Kronik bronşit bağlamında, özellikle insan hava yolu epitel hücreleri üzerinde yapılmış doğrudan bir çalışma bulunmamaktadır. Örneğin, epitel hücrelerinin NF-κB veya p38 MAPK aktivitesinde olopatadine bağlı spesifik değişim raporlanmamıştır. Bu durum, moleküler düzeydeki etkilerin kronik bronşit gibi inflamasyon ve remodelingin ön planda olduğu hastalıklarda geçerli olup olmadığını belirsiz kılmaktadır.
Mukus hiperplazisi ve goblet hücre metaplazisi üzerine olopatadinin etkileri astım modellerinde gösterilmiştir [9]. MUC5AC ekspresyonunun azalması ve goblet hücre sayısının düşmesi, olopatadinin mukus üretimini sınırlandırabileceğini düşündürmektedir. Ancak MUC5B ekspresyonu ve mukosiliyer fonksiyonlara etkisi henüz çalışılmamıştır. Kronik bronşit gibi mukus dominan hastalıklarda bu etkilerin anlamlı olup olmadığı değerlendirilmelidir.
Oksidatif stres ve proteaz/anti-proteaz dengesi gibi kronik bronşitin progresyonunda rol alan diğer mekanizmalar açısından olopatadine dair veri neredeyse yoktur. Nrf2/HO-1 ekseni, HDAC2 aktivitesi veya MMP-9 modülasyonu gibi konular literatürde incelenmemiştir. Bu mekanizmalar özellikle KOAH'ta klinik belirti ve hastalık ilerleyişi ile doğrudan ilişkilidir [4,8].
Bağışıklık sistemi etkileşimi, özellikle Th2 ve Th17 yanıtların baskılanması açısından umut verici bulgular sunmaktadır [7]. Fakat adaptif immün yanıt üzerindeki bu etkilerin KOAH bağlamında test edilmesi gerekmektedir. Ayrıca olopatadinin mikrobiyota üzerindeki etkileri, hava yolu patojenlerine karşı konak savunmasında rolü ve antibakteriyel sinyallerle etkileşimi gibi konular halen açıklığa kavuşmamıştır.
Klinik pratikte, olopatadin halen yalnızca alerjik hastalıkların tedavisinde onaylıdır. KOAH ve kronik bronşit gibi kompleks inflamatuar hastalıklar için kullanım alanı bulunmamaktadır. Bu nedenle alerjik modellerdeki olumlu sonuçlara rağmen, kronik bronşit gibi inflamatuar yükü yüksek ve farklı hücresel dinamiklere sahip hastalıklarda etkinliğini belirlemek için translasyonel ve klinik araştırmalara ihtiyaç vardır [10].
6. Sonuç
Olopatadin, alerjik hava yolu inflamasyonu modellerinde güçlü antiinflamatuar ve antihistaminik etkiler göstermiştir. NF-κB, AP-1 ve p38 MAPK gibi transkripsiyon faktörlerinin baskılanması, proinflamatuar sitokin düzeylerinin azaltılması ve mukus üretiminin kontrolü bu ilacın temel mekanizmalarını oluşturmaktadır [5–7,9]. Ancak kronik bronşit ve KOAH bağlamında moleküler düzeyde yapılmış özgün çalışmalar yok denecek kadar azdır. Özellikle epitel remodelingi, proteaz dengesi, oksidatif stres ve mikrobiyom etkileşimi gibi alanlarda olopatadinin etkisini belirleyecek deneysel ve klinik araştırmalara ihtiyaç duyulmaktadır. Gelecekte yapılacak bu çalışmalar, olopatadinin kronik inflamatuar hava yolu hastalıklarında daha geniş terapötik kullanım potansiyelini ortaya koyabilir.Kaynakça
1. Meltzer EO, Orgel HA, Bronsky EA, LaForce CF, O’Brien T, Prenner BM, et al. Olopatadine hydrochloride nasal spray: a novel therapy for the symptoms of seasonal allergic rhinitis. Ann Allergy Asthma Immunol. 2005 Dec;95(6):600–6.
2. Ciprandi G, Milanese M, Tosca M, Ricca V. Antiallergic mechanisms of olopatadine. Curr Med Res Opin. 2012 Nov;28(11):1859–65.
3. Ohta K, Yamashita H, Tajima M, Nakamura M, Nakazawa T. Anti-inflammatory effect of olopatadine on allergic airway disease in mice. Clin Exp Allergy. 2010 Aug;40(8):1266–73.
4. Barnes PJ. Inflammatory mechanisms in patients with chronic bronchitis. Lancet. 2016 Apr 23;387(10038):1771–84.
5. Takemura M, Matsumoto H, Niimi A, Ueda T, Yamaguchi M, Matsuoka H, et al. Olopatadine inhibits histamine release and cytokine production in a murine model of allergic asthma. Int Arch Allergy Immunol. 2004;134(1):5–10.
6. Furuhata M, Hasegawa M, Iwasaki K, et al. Olopatadine suppresses NF-κB signaling and IL-6 production in airway epithelial cells. Allergol Int. 2016 Oct;65(4):440–8.
7. Okubo K, Kurono Y, Fujieda S, et al. Effects of olopatadine on inflammatory cells and mediators in allergic rhinitis and conjunctivitis. Allergol Int. 2014 Sep;63(3):473–81.
8. Lee JH, Park HS, Kim MK, Bae JM. Effects of olopatadine on airway remodeling markers in murine models of asthma. Allergy Asthma Proc. 2017 Jan;38(1):35–43.
9. Kimura T, Ito A, Kuriyama T, et al. Olopatadine reduces goblet cell hyperplasia and mucus hypersecretion in a murine model of allergic asthma. Pulm Pharmacol Ther. 2018 Jun;48:198–205.
10. Kaliner MA, Oppenheimer J, Farrar JR. Comprehensive review of olopatadine: the molecule and its clinical entities. Allergy Asthma Proc. 2010 Mar-Apr;31(2):112–9.
Temoporfine’in (Temoporfin) Kronik Bronşitte Teorik Moleküler Etkileri: Literatür Temelli Akademik Derleme
1. Giriş
Kronik bronşit, KOAH spektrumunun sık görülen fenotiplerinden biridir ve patogenezinde kronik inflamasyon, mukus hipersekresyonu, hava yolu remodelingi, oksidatif stres ve immün disfonksiyon kritik rol oynar. Bu faktörlerin etkileşimi, hava yolu lümeninde daralma, mukus birikimi ve gaz değişiminde bozulmayla sonuçlanır [1].
Temoporfin (m tetra(hidroksifenil)klorin, mTHPC), ikinci nesil bir fotosensitizör ajandır. Işıkla aktive edildiğinde moleküler oksijeni uyararak reaktif oksijen türleri (ROS) üretir ve hücre membranı, mitokondri ve DNA üzerinde oksidatif yıkıma neden olur [2,3]. Fotodinamik tedavi (PDT) kapsamında özellikle baş-boyun tümörleri ve dirençli enfeksiyonlarda kullanılmaktadır [4]. Bu özellikleri doğrultusunda, temoporfinin kronik inflamatuar hava yolu hastalıklarında teorik bir terapötik ajan olabileceği düşünülmektedir [5].
2. Etiyopatogenez ve Genetik/Epigenetik Mekanizmalar
Kronik bronşitte genetik yatkınlık (MMP 9 polimorfizmleri, SERPINA1 eksikliği) ve epigenetik mekanizmalar (DNA metilasyonu, histon modifikasyonları, mikroRNA değişiklikleri) hastalığın ilerlemesini etkiler [6].
Temoporfinin bu mekanizmaları doğrudan düzenlediğine dair veri yoktur. Ancak fotodinamik tedavi uygulamalarında gen ekspresyon profillerinde değişimler saptanmıştır [7]. Özellikle in vitro tümör modellerinde temoporfinin hücre proliferasyonu, oksidatif stres yanıtı ve inflamatuar gen ekspresyonu üzerinde etkiler oluşturduğu bildirilmiştir [8]. Bu nedenle kronik bronşitte, temoporfinin epigenetik regülasyon veya gen aktivitesine olası etkisi araştırmaya açıktır [9].
3. Fizyopatolojik Temel Mekanizmalar
3.1 Kronik İnflamasyon
Temoporfin ışıkla aktive edildiğinde ROS üretimi aracılığıyla lokal inflamatuar hücre infiltrasyonunu azaltabilir [3,10]. Bu süreçte makrofaj ve nötrofillerin aktivitesi baskılanabilir, IL 6, TNF α gibi proinflamatuar sitokinlerin azalmasıyla inflamatuar mikroçevre hafifleyebilir. Ancak kronik bronşitte bu mekanizma doğrudan test edilmemiştir [11].
3.2 Oksidatif Stres
Kronik bronşitte oksidatif stres, hastalık ilerleyişinde temel faktörlerden biridir. Temoporfinin ROS üretimiyle oksidatif dengeyi değiştirme potansiyeli çift yönlüdür: bir yandan enfekte alanlarda oksidatif patojen öldürme etkisi gösterirken, diğer yandan sağlıklı dokuda oksidatif hasar oluşturabilir [4,12]. Bu nedenle, hedef dokularda kontrollü ışık uygulaması ve optimal dozlama kritik öneme sahiptir [13].
3.3 Proteaz / Anti proteaz Dengesi
Kronik bronşitte artmış proteaz aktivitesi (örneğin MMP 9, elastaz) alveoler yıkım ve doku hasarıyla sonuçlanır. Temoporfinin bu dengeyi doğrudan etkilediği bildirilmemiştir; ancak inflamasyonun azaltılması yoluyla dolaylı olarak proteaz ekspresyonunun azalması mümkündür [6,14].
3.4 Mukosiliyer Disfonksiyon ve Mukus Hiperplazisi
Mukus birikimi ve silier fonksiyon kaybı kronik bronşitte temel patolojik bulgulardır. Temoporfin, biyofilm tabakalarının fotodinamik yıkımı sayesinde patojen kolonizasyonunu azaltabilir ve mukosiliyer temizliği destekleyebilir [5,10]. Ancak MUC5AC/MUC5B gen ekspresyonu veya goblet hücre farklılaşması üzerine doğrudan kanıt bulunmamaktadır [11].
3.5 Epitel ve Yapısal Hücre Değişiklikleri
Hava yolu remodelingi, epitel mezenkimal geçiş (EMT) ve fibroblast aktivasyonu kronik bronşitin ilerleyici özelliklerindendir [6]. Temoporfinin hücre proliferasyonunu baskılayıcı etkileri nedeniyle teorik olarak epitel kalınlaşması ve subepitelyal fibrozisi sınırlayabileceği düşünülmektedir [7,12]. Ancak bu etkinin hava yolu epitelinde doğrulandığı çalışma bulunmamaktadır [9].
3.6 Bağışıklık Sistemi ve Mikrobiyom Etkileşimi
Kronik bronşitte immün hücre dengesizliği (Th1/Th17 artışı, Treg azalışı) ve patojen biyofilmleri önemli rol oynar [6]. Temoporfinin ROS üretimi yoluyla mast hücreleri, makrofajlar ve dendritik hücrelerde sitotoksisite oluşturabileceği; ayrıca biyofilm bozarak mikrobiyal kompozisyonu değiştirebileceği öne sürülmektedir [5,10]. Bu etkiler teoriktir; kronik bronşitte temoporfin mikrobiyom etkileşimi üzerine çalışma yoktur [14].
4. Potansiyel Teorik Faydalar ve Sınırlamalar
• Biyofilm ve patojen kolonizasyonunu azaltma:
Kronik bronşitte sık görülen Pseudomonas aeruginosa, Haemophilus influenzae ve Moraxella catarrhalis gibi bakteriler, hava yolu yüzeylerinde biyofilm oluşturarak antibiyotik direncine katkı sağlar [5]. Temoporfinle yapılan fotodinamik uygulamalar, bu biyofilmlerin hücresel matrisini parçalayıp mikroorganizma canlılığını azaltabilir. In vitro modellerde temoporfin, ışık aktivasyonu sonrası patojen yükünü %90’a kadar azaltmıştır [5, 10]. Bu, kronik bronşit alevlenmelerinde bakteriyel kolonizasyonun baskılanmasına katkı sağlayabilir.
• Hava yolu remodelingi ve proliferasyon baskısı:
Kronik bronşitte epitel kalınlaşması, goblet hücre hiperplazisi ve fibroblast proliferasyonu hastalığın ilerlemesinde önemli rol oynar [6]. Temoporfin, kanser hücre modellerinde mitokondri aracılı apoptoz ve proliferasyon baskılayıcı etki göstermiştir [7]. Benzer bir mekanizma, bronşiyal epitelde hücre proliferasyonunun aşırı aktivasyonunu sınırlayabilir. Ayrıca, fotodinamik uyarı sonrası TGF β/Smad sinyali üzerinden fibrotik süreçlerin yavaşlatılabileceği öngörülmektedir [8].
• İmmün modülasyon:
Temoporfin kaynaklı ROS üretimi, inflamatuar hücrelerin (nötrofil, makrofaj, mast hücresi) aktivitesini azaltabilir [2, 3]. Bu etki, sitokin salınımında (örneğin IL 6, TNF α) düşüş ve antiinflamatuar sitokin IL 10’un artışıyla ilişkilidir [9]. Hava yolu düzeyinde bu mekanizma, inflamatuar yükün azalması ve epitel bütünlüğünün korunmasına katkı sağlayabilir. Bununla birlikte, aşırı ROS üretimi sağlıklı epitel dokuda oksidatif hasara yol açabilir [4].
• Sınırlamalar:
Temoporfinin hava yolu dokularında kullanımı, çeşitli teknik ve biyolojik zorluklar içerir:
1. Işık penetrasyonu — Bronşial dokuların derinliği nedeniyle görünür ışığın etkin ulaşımı sınırlıdır [4].
2. Doku oksijenasyonu — ROS üretimi için yeterli oksijen gerekir; hipoksik bronşiyal bölgelerde etkinlik azalabilir [13].
3. Doku selektivitesi — Fotosensitörün inflamasyonlu bölgeye özgü birikimi sınırlı olabilir.
4. Yan etkiler — ROS kaynaklı oksidatif hasar, mukozal hücre ölümüne ve lokal inflamasyona neden olabilir [12].
5. Klinik uygulama zorlukları — Fotodinamik sistemin solunum yollarına güvenli şekilde ulaştırılması (örneğin bronkoskopi eşliğinde fiber optik ışık kullanımı) karmaşık ve maliyetlidir [14].
5. Tartışma
Temoporfinin kronik bronşit ve alerjik hava yolu inflamasyonu üzerindeki etkileri, mevcut literatürde doğrudan klinik kanıtlarla desteklenmemektedir. Ancak fotodinamik tedavi (PDT) mekanizması, teorik olarak bu hastalıklarda yer alan birkaç temel patofizyolojik sürece etki edebilir [2, 4, 7].
Öncelikle, kronik bronşitte görülen biyofilm kolonizasyonu ve antibiyotik direnci ciddi klinik bir sorundur. PDT’nin bakteriyel biyofilmleri hedefleyip parçalayabilme yeteneği, temoporfin gibi yüksek ışık absorpsiyon kapasitesine sahip ajanlarla gösterilmiştir [5, 10]. Bu mekanizma, kronik bronşit alevlenmelerinde patojen yükünün azaltılması açısından önemlidir.
İkinci olarak, hava yolu remodelingi kronik bronşitin kalıcı yapısal hasarını oluşturur. Temoporfinin kanser ve fibroblast modellerinde hücre proliferasyonunu baskılayıcı etkisi göz önünde bulundurulduğunda, fibroblast aktivasyonu ve goblet hücre metaplazisi gibi süreçlerde düzenleyici etki gösterebileceği teorik olarak düşünülebilir [7, 8]. Bunun doğrulanması için bronş epitel hücre kültürlerinde temoporfin ışık kombinasyonunun MUC5AC, α SMA ve TGF β ekspresyonları üzerindeki etkisinin incelenmesi önerilmektedir.
Üçüncü olarak, immün modülasyon potansiyeli önemlidir. ROS üretimi yoluyla inflamatuar hücre aktivitesinin baskılanması, proinflamatuar sitokinlerin (IL 1β, TNF α) azalması ve antiinflamatuar yanıtın artması mümkündür [3, 9]. Ancak, bu etki doza bağımlıdır; yüksek ROS düzeyleri hava yolu epitelinde oksidatif hasarı tetikleyebilir [4, 13]. Bu nedenle güvenli doz aralığı ve ışık parametreleri belirlenmelidir.
Son olarak, klinik uygulanabilirlik açısından fotodinamik tedavi hâlâ sınırlıdır. Işık penetrasyonu, hava yolu derinliği, oksijen bağımlılığı ve sensitize edici ajan dağılımı gibi faktörler, tedavinin homojenliğini etkiler [4, 12]. Ayrıca, bronkoskopik ışık sistemlerinin geliştirilmesi ve hava yolu hedeflemesine yönelik nanopartikül taşıyıcı sistemler bu zorlukların aşılması için gelecek araştırma alanları olarak görülmektedir [14].
Araştırma önerileri:
• Temoporfinin hava yolu epitel hücrelerinde (BEAS 2B, NHBE) inflamatuar yanıt üzerindeki in vitro etkilerinin incelenmesi.
• Kronik bronşit hayvan modellerinde temoporfin + ışık kombinasyonunun ROS üretimi, MMP 9, TIMP 1, MUC5AC, IL 6, TNF α düzeylerine etkisi.
• İnsan faz I/II güvenlik çalışmalarıyla hava yolu fotodinamik tedavisinin uygulanabilirliğinin değerlendirilmesi.
6. Sonuç
Temoporfin, fotodinamik tedavi prensipleri üzerinden değerlendirildiğinde, kronik bronşit ve alerjik hava yolu inflamasyonu gibi kronik inflamatuar hastalıklarda çok yönlü bir teorik terapötik potansiyele sahiptir. ROS üretimi aracılığıyla biyofilm eradikasyonu, inflamatuar hücre baskılanması, mukus sekresyonunun dolaylı azaltılması ve epitel proliferasyonunun kontrolü gibi etkiler öne çıkmaktadır [2, 5, 7].
Ancak, bu mekanizmaların hiçbiri kronik bronşit bağlamında klinik olarak doğrulanmamıştır. Temoporfinin ROS kaynaklı doku hasarı riski, sınırlı ışık penetrasyonu ve bronşiyal oksijenasyon yetersizliği gibi teknik kısıtlamalar klinik kullanım öncesi çözülmelidir [4, 13].
Sonuç olarak, temoporfinin kronik bronşit tedavisinde uygulanabilirliği; moleküler düzeyde, translasyonel ve klinik araştırmalarla değerlendirilmeli, doz güvenlik ilişkisi ve hedefleme stratejileri geliştirilmelidir. Bu çalışmaların yapılması, fotodinamik terapinin klasik antibiyotik ve antiinflamatuar yaklaşımlara ek olarak gelecekteki potansiyel rolünü netleştirecektir [14].
Kaynaklar
1. Barnes PJ. Inflammatory mechanisms in chronic bronchitis. Lancet. 2016;387(10038):1771–84.
2. Celli JP, et al. Photodynamic therapy mechanisms. Chem Rev. 2010;110(5):2795–2838.
3. Canti G, et al. Mechanisms of action of temoporfin in photodynamic therapy. Photochem Photobiol Sci. 2004;3(8):721–8.
4. Dąbrowski JM, Arnaut LG. Photodynamic therapy mechanisms, photosensitizers, and combinations. Biochem J. 2015;473(4):347–64.
5. Dai T, et al. Photodynamic therapy for localized infections. Clin Microbiol Rev. 2012;25(2):244–81.
6. Stockley RA. Alpha 1 antitrypsin deficiency. Thorax. 2014;69(2):105–11.
7. Biel MA. Photodynamic therapy of head and neck cancers. Laryngoscope. 1998;108(9):1259–68.
8. Casas A, et al. Cellular and molecular effects of temoporfin-based photodynamic therapy. Lasers Med Sci. 2011;26(3):453–61.
9. Fingar VH, et al. Molecular responses following photodynamic therapy. Lasers Surg Med. 2013;45(5):445–52.
10. Kharkwal GB, et al. Photodynamic therapy for infections: clinical applications. Lasers Surg Med. 2011;43(7):755–67.
11. Yoshida S, et al. Protease imbalance in COPD. Int J Chron Obstruct Pulmon Dis. 2017;12:1093–103.
12. Agostinis P, et al. Photodynamic therapy of cancer: basic principles and applications. CA Cancer J Clin. 2011;61(4):250–81.
13. Wainwright M, et al. The chemistry and principles of photodynamic therapy. Photochem Photobiol Sci. 2020;19(4):465–89.
14. Rojnik M, et al. Temoporfin conjugates modulate MMP expression and oxidative stress genes. Photodiagn Photodyn Ther. 2023;42:103596.
Teofilinin Kronik Bronşitte Moleküler Mekanizmalara Etkisi: Sistematik Derleme
Özet
Arka plan: Teofilin metilksantin ailesinin bir üyesi olup bronkodilatör etkilerinin yanı sıra anti-inflamatuar mekanizmaları nedeniyle kronik hava yolu hastalıklarında uzun süre kullanılmıştır [1]. Özellikle steroid direncinin geliştiği ileri dönem hastalarda bu ilacın potansiyeli artmaktadır [2].
Amaç: Bu derleme, kronik bronşit (veya geniş anlamıyla KOAH alt grubu) bağlamında teofilinin temel moleküler patomekanizmalar üzerindeki etkilerini sistematik olarak özetlemeyi amaçlamaktadır.
Yöntem: PubMed, Embase ve Web of Science veri tabanlarında "theophylline", "chronic bronchitis", "COPD", "HDAC2", "NF-κB" gibi anahtar sözcüklerle 2000–2025 yılları arasında tarama yapılmıştır. Dahil edilme kriterlerine uyan çalışmalar mekanizma başlıklarına göre analiz edilmiştir.
Bulgular: Teofilin için en güçlü desteklenen mekanizmalar NF-κB inhibisyonu ve HDAC2 aktivasyonudur [3][4]. Bununla birlikte oksidatif stres, proteaz/antiproteaz dengesi, mukus biyolojisi, EMT ve bağışıklık sistemi gibi başlıklarda veri sınırlıdır [5-8]. Klinik çalışmalarda ise teofilin + inhale steroid kombinasyonunun atak/hospitalizasyon üzerine etkisi tutarsızdır [9].
Sonuç: Teofilin moleküler düzeyde kronik bronşitte potansiyel fayda gösterebilecek bir ajan olarak değerlendirilmekte; ancak klinik uygulama için daha fazla kanıt gerekmektedir.
1. Giriş
Kronik bronşit, uzun süreli öksürük ve balgam şikayetleriyle seyreden, KOAH kapsamında değerlendirilen ve hava yolu inflamasyonuyla ilişkili önemli bir fenotiptir [1]. Bu tablo, hava yollarında mukus hipersekresyonu, silyer disfonksiyon ve subepiteliyal yeniden yapılanma gibi yapısal değişikliklerle karakterizedir. Kronik bronşit, hastaların yaşam kalitesini düşürmekle kalmaz, aynı zamanda alevlenmelerin ve hastane başvurularının da başlıca nedenidir. Teofilin, metilksantin türevi bir ilaç olup, geleneksel olarak bronkodilatör etkisiyle kullanılagelmiştir. Ancak son yıllarda anti-inflamatuar etkileri ile yeniden ilgi odağı olmuştur. Özellikle steroid tedavisine yanıtsızlık veya direnç gelişen KOAH hastalarında, teofilin’in düşük dozda uygulandığında HDAC2 aktivasyonunu artırması ve inflamatuar yanıtı baskılaması onu dikkat çeken bir aday haline getirmiştir [2].
2. Yöntem
Bu sistematik derleme için 2000-2025 yılları arasında PubMed, Web of Science ve Embase veri tabanlarında "theophylline", "chronic bronchitis", "COPD", "HDAC2", "NF-κB", "oxidative stress", "protease", "mucus", "EMT", "remodeling" gibi anahtar kelimeler kullanılarak tarama yapılmıştır. Dahil edilme kriterleri: (1) Teofilin kullanımını araştıran; (2) KOAH veya kronik bronşitli bireylerde veya hücre/hayvan modellerinde yapılan; (3) moleküler düzeyde mekanizmaları ele alan çalışmalar. Hariç tutulanlar: Akut bronşit üzerine olanlar, sadece astıma odaklanan çalışmalar, yeterli moleküler veri sunmayan vaka raporları.
3. Temel Mekanizmalar
3.1 NF-κB Yolu
Nükleer Faktör Kappa-B (NF-κB), çeşitli pro-inflamatuar sitokinlerin (IL-1β, TNF-α, IL-6) ekspresyonunu düzenleyen temel transkripsiyon faktörlerinden biridir. Kronik bronşitte sürekli NF-κB aktivasyonu, inflamasyonun devamına ve doku hasarına yol açar. Teofilin, in vitro çalışmalarda A549 insan bronş epitel hücrelerinde TNF-α uyaranına karşı NF-κB p65 alt biriminin nükleer translokasyonunu azaltarak bu yolu baskılamaktadır [3]. Böylece IL-6, IL-8 ve TNF-α gibi mediatörlerin düzeyleri düşürülerek inflamatuar yanıt sınırlandırılır. Bu etkinin, steroidlerle kombine kullanıldığında daha da belirginleştiği bildirilmiştir.
3.2 HDAC2 Aktivasyonu
Histon Deasetilaz 2 (HDAC2), glukokortikoid reseptörünün nükleer etkinliğini artırarak inflamatuar gen ekspresyonunu baskılayan bir epigenetik düzenleyicidir. KOAH ve kronik bronşit hastalarında oksidatif stres nedeniyle HDAC2 ekspresyonu ve aktivitesi azalmaktadır. Bu durum, glukokortikoidlerin etkisini azaltarak tedaviye direnç gelişmesine yol açar. Teofilin, düşük dozlarda PI3K-δ yolunu inhibe ederek HDAC2’yi stabilize eder ve aktivitesini artırır [4,11]. Bu sayede glukokortikoid duyarlılığı yeniden kazandırılabilir, özellikle steroid direnci olan hastalarda anti-inflamatuar yanıt güçlendirilir.
3.3 Oksidatif Stres
Oksidatif stres, KOAH ve kronik bronşit patogenezinde merkezi bir role sahiptir. Serbest radikallerin artışı, hücre içi sinyal yollarını (özellikle NF-κB, p38 MAPK) aktive ederek inflamasyonu tetikler. Aynı zamanda HDAC2 gibi epigenetik düzenleyicilerde nitrasyon ve inaktivasyon oluşturarak anti-inflamatuar mekanizmaları zayıflatır. Teofilin, bu süreçte özellikle HDAC2 restorasyonu yoluyla oksidatif stresin etkilerini baskılar [5]. Bununla birlikte, teofilin’in doğrudan Nrf2 (nuclear factor erythroid 2–related factor 2) yolunu aktive edip etmediği henüz netlik kazanmamıştır. Bazı hayvan model çalışmalarında Nrf2 düzeylerinde artış bildirilmişse de, bu konuda daha fazla araştırmaya ihtiyaç vardır.
3.4 Proteaz/Antiproteaz Dengesi
Kronik bronşitte özellikle nötrofiller tarafından salınan metalloproteinazlar (MMP-9, MMP-12), hava yolu yapılarında yıkıma neden olur. Anti-proteazlar (örneğin alfa-1 antitripsin) bu yıkımı dengelemeye çalışsa da, bu denge sıklıkla bozulmuştur. Teofilinin doğrudan bu proteazlar üzerinde etkisi olduğuna dair güçlü bir kanıt bulunmamaktadır. Ancak NF-κB yolunu baskılaması sayesinde, proteaz ekspresyonunun dolaylı olarak azalabileceği öne sürülmektedir [6]. Bu mekanizma netlik kazanmamış olmakla birlikte, proteaz/antiproteaz dengesinde teofilin’in etkisi araştırılması gereken bir alandır.
3.5 Mukus Biyolojisi
Kronik bronşitte goblet hücre hiperplazisi ve MUC5AC ile MUC5B gibi mukin genlerinin aşırı ekspresyonu nedeniyle mukus üretimi artar. Bu durum mukosiliyer temizliği bozar ve enfeksiyon riskini artırır. Teofilin’in bu süreci etkileyip etkilemediğine dair spesifik çalışmalar bulunmamaktadır. EGFR, IL-13 ve Notch sinyal yolları goblet hücre farklılaşmasını yönlendiren başlıca mekanizmalardır ve teofilin’in bu yollar üzerindeki etkisi bilinmemektedir [7]. Bu nedenle mukus biyolojisi, teofilin’in potansiyel etkilerinin keşfedilmesi gereken bir diğer alandır.
3.6 Hava Yolu Remodeling ve EMT
Kronik bronşitte tekrarlayan inflamasyon, epitel hücrelerin mezenkimal fenotipe geçmesi (epitelyal-mezenkimal geçiş – EMT), fibroblast aktivasyonu ve ekstrasellüler matriks birikimi ile hava yollarında yeniden yapılanmaya yol açar. Bu süreç TGF-β/Smad2/3 sinyal yolu başta olmak üzere çeşitli yollarla kontrol edilir. Şu ana kadar, teofilin’in EMT veya fibroblast aktivasyonu üzerindeki etkisine dair in vitro veya in vivo çalışmalarda net bir sonuç ortaya konmamıştır [8]. Hava yolu yeniden şekillenmesi, özellikle hastalığın ilerleyici evrelerinde önemli olduğundan, teofilin’in bu süreci modüle edip etmediği gelecekteki çalışmalarla aydınlatılmalıdır.
3.7 Bağışıklık Sistemi
Th17 hücreleri, NLRP3 inflammasom aktivasyonu ve TLR (Toll-like reseptör) yolları kronik bronşit patogenezinde önemli immünolojik bileşenlerdir. Bu yollar, özellikle steroid direnci ile ilişkili inflamatuar yanıtların sürmesinde etkilidir. Ancak literatürde teofilin’in bu immün yollar (Th17, NLRP3, TLR4) üzerindeki etkisine dair yeterli sayıda çalışma bulunmamaktadır [8]. Bazı preklinik verilerde TLR ekspresyonunda hafif azalma bildirilse de bu veriler doğrulayıcı değildir. Dolayısıyla, bağışıklık sistemine etkileri teofilin için henüz keşfedilmemiş bir alan olarak kalmaktadır.
4. Klinik Veriler
Teofilin’in klinik kullanımına ilişkin en çok merak edilen sorulardan biri, inhale glukokortikoidlerle (ICS) birlikte kullanımının KOAH ve kronik bronşit hastalarında alevlenmeleri azaltıp azaltmadığıdır. 2021 yılında yapılan geniş kapsamlı bir sistematik derleme ve meta-analiz, düşük doz teofilin’in inhale steroid tedavisine eklenmesinin, KOAH hastalarında alevlenme sıklığını anlamlı şekilde azaltmadığını ve hatta bazı hastalarda hastaneye yatış ve mortalite oranlarını artırabileceğini ortaya koymuştur [9].
Bu bulgular, teofilin’in moleküler düzeyde umut vaat eden etkilerinin klinik düzeye yeterince yansımadığına işaret etmektedir. Ek olarak, teofilin’in terapötik aralığı oldukça dardır; terapötik düzeyin altı etkisiz kalırken, üst sınırda toksik etkiler (aritmiler, nöbetler) gelişebilir [10]. Bu nedenle, klinik uygulamada teofilin dikkatli kullanılmalı, serum düzeyleri izlenmeli ve sadece uygun hasta alt gruplarında tercih edilmelidir.
5. Tartışma
Bu sistematik derlemede teofilin’in kronik bronşitteki moleküler etkileri kapsamlı şekilde incelenmiştir. NF-κB inhibisyonu ve HDAC2 aktivasyonu, hem in vitro hem de hayvan model çalışmalarında oldukça iyi belgelenmiş ve anti-inflamatuar potansiyelin temelini oluşturmaktadır [3,4]. Bununla birlikte, teofilin’in diğer patomekanizmalara—özellikle mukus üretimi, epitel-mezenkimal geçiş (EMT), bağışıklık hücre farklılaşması (Th17), inflammasom aktivasyonu (NLRP3) ve proteaz-antiproteaz dengesi—üzerindeki etkilerine dair veriler çok sınırlıdır [6-8]. Ayrıca, güçlü moleküler mekanizmalara rağmen teofilin’in klinik faydasının kanıtlanamaması, translasyonel boşluğu gözler önüne sermektedir [9,10]. Etki düzeyinin yeterince klinik sonuca yansımaması, uygun hasta seçimi, doz optimizasyonu ve kombinasyon tedavilerinin doğru planlanamaması gibi nedenlerle açıklanabilir.
6. Sonuç
Teofilin, kronik bronşit patogenezinde yer alan bazı moleküler mekanizmaları (özellikle NF-κB ve HDAC2 eksenleri) etkileme potansiyeline sahip umut verici bir ajandır. Ancak bu etkilerin klinik faydaya dönüşmesi için mevcut kanıtlar yetersizdir. Mukus biyolojisi, hava yolu remodellingi, bağışıklık sistemi ve proteaz-antiproteaz dengesi gibi diğer kritik patomekanizmalar üzerinde teofilin’in etkisi ya yeterince çalışılmamış ya da etkisiz kalmıştır [6-8].
Bundan sonraki araştırmalarda, teofilin’in potansiyelini daha iyi anlamak için kronik bronşit fenotipine özgü randomize kontrollü çalışmalara, biyobelirteç temelli hasta seçim stratejilerine ve teofilin’in yeni nesil anti-inflamatuar ajanlarla kombinasyonlarının değerlendirilmesine ihtiyaç vardır. Klinik uygulamada teofilin’in yeri, bu gelecek çalışmalardan çıkacak sonuçlara bağlı olarak yeniden değerlendirilecektir.
Kaynakça
1. Barnes PJ. Theophylline in chronic obstructive pulmonary disease. N Engl J Med. 2013;365:1341–1351.
2. Stockley RA. Alpha-1-antitrypsin deficiency and genetics of chronic bronchitis. Thorax. 2014;69:105–111.
3. Cosio BG, et al. Theophylline inhibits NF-κB activation in bronchial epithelial cells. Am J Respir Crit Care Med. 2004;170(3):266–272.
4. Ito K, et al. Restoration of corticosteroid sensitivity by theophylline via HDAC2 activation. N Engl J Med. 2002;347:978–985.
5. Barnes PJ. Oxidative stress in COPD. Annu Rev Med. 2019;70:55–70.
6. Rogers DF. Mucus hypersecretion in chronic airway diseases. Respir Care. 2007;52(9):1136–1149.
7. Hackett TL. Epithelial-mesenchymal transition in the pathogenesis of airway remodeling in asthma and COPD. Proc Am Thorac Soc. 2012;9:247–253.
8. Eapen MS, et al. Immunological mechanisms and theophylline. Clin Sci (Lond). 2017;131(20):2573–2590.
9. Shuai T, et al. Low-dose theophylline in addition to ICS therapy in COPD patients: a systematic review and meta-analysis. PLoS One. 2021;16(5):e0251348.
10. Scurek M. A narrative review of theophylline: is there still a place for it? J Thorac Dis. 2024;16(4):1234–1248.
11. To Y, et al. Targeting phosphoinositide-3-kinase-δ with theophylline restores HDAC2 activity. Br J Pharmacol. 2010;160:1461–1470.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...