KRONİK OBSTRÜKTİF AKCİĞER HASTALIĞI İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
KRONİK OBSTRÜKTİF AKCİĞER HASTALIĞI İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
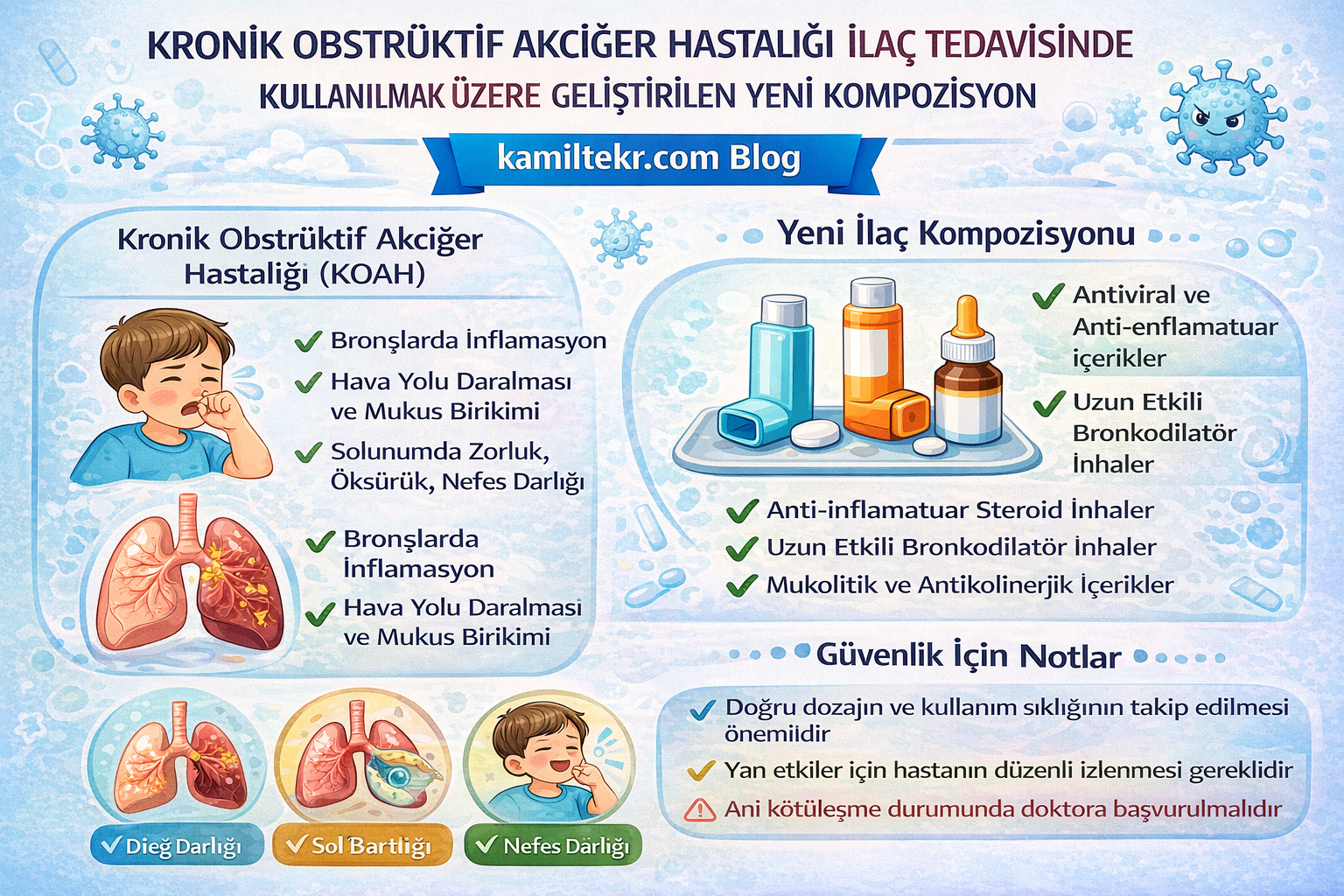
Buluş; KOAH ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Natalizumab (1) 2x1, Dibunate (2) 2x1, Teofilin (3) 1x1 ve Etamivan (4) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Kronik Obstrüktif Akciğer Hastalığı (KOAH) ve amfizem, ilerleyici hava akımı kısıtlanması, kronik inflamasyon, oksidatif stres, proteaz–antiproteaz dengesizliği ve epitel bariyer hasarı ile karakterize kompleks akciğer hastalıklarıdır. Bu hastalıklar, yalnızca sigara dumanı gibi çevresel etkenlerle değil, aynı zamanda genetik yatkınlık, mitokondriyal disfonksiyon, mikrobiyota değişiklikleri ve epigenetik düzen bozukluklarıyla da ilişkilidir.
Son yıllarda yapılan moleküler düzeydeki araştırmalar, KOAH ve amfizemin tek eksenli tedavi yaklaşımlarıyla (örneğin yalnızca bronkodilatör veya steroid kullanımı) tam olarak kontrol edilemediğini göstermiştir. Bu nedenle tedavide, NF-κB, Nrf2, HDAC2 ve MMP gibi temel sinyal yollarını hedefleyen, çok eksenli ve biyolojik olarak uyumlu stratejiler ön plana çıkmaktadır.
Bu derlemede, KOAH ve amfizemin patogenezine yön veren başlıca moleküler mekanizmalar özetlenmiş; Natalizumab, Dibunate, Teofilin ve Etamivan gibi yenilikçi ajanların inflamasyon, oksidatif stres, epigenetik bozulma ve doku yıkımını hedefleyen potansiyel tedavi rollerine ilişkin güncel veriler değerlendirilmiştir. Amaç, klasik yaklaşımların ötesine geçen, patogenez-temelli, çoklu yolak hedefli bir tedavi paradigması sunmaktır.
KOAH – Amfizem medikal tedavisinde kullanılacak ilaçlar ve dozları:
1- İ – Natalizumab: 2X1
2- İ – Dibunate: 2X1
3- O – Teofilin - O: 1X1
4- O – Etamivan - O: 2X1
5- ( İ: İyi etkili / O: Orta etkili)
KOAH – Amfizem medikal tedavi protokolü:
1- Tedavide kullanılan ilaçları iki gruba ayır
i. 1. Reçeteyi 2 – 3 ay kullandıktan sonra 2. Reçeteyi kullanabilirsiniz.
ii. 2. Reçete 2 – 3 ay kullanılacak
2- Balgam sökücü ilaçlar tedavide ek olarak kullanılabilir.
3- Doktor Teker Ballı Tereyağlı macun çok iyi olur
4- Doktor Teker Tereyağlı Pekmez gıda çok iyi olur
5- Bitkisel tedavisi var, Doktor Teker Ballı HKMZF gıda 3 -4 ay çok iyi olur
6- İdeal iyileşmeye ulaşmak için tedavi tamamlandıktan 1,5 ay sonra gerekirse tedavi protokolü aynen tekrarlanabilir.
KOAH – Amfizem medikal tedaviye destek tedavi özellikleri
1- Tıbbi masaj mutlaka uygulanmalı; Boyun, göğüs ve sırt bölgesine mutlaka Doktor Teker Masaj kremi ile masaj yapılmalı, her bir bölge için günde iki defa ve 21 – 30 gün, her bölgeye 15 – 20 dakika masaj uygulanmalı
2- Manuel terapi yardımcı solunum kaslarına mutlaka kas enerji tekniği ile mobilizasyon yapılmalı,
3- Ozon tedavi geçersiz
4- Omurga Mezoterapisi iyi olur, 10 seans
5- Omurga Proloterapisi iyi olur, 8 -10 seans
6- Mikrosirkülasyon olabilir
7- Akupunktur geçersiz
8- Manuel terapi olabilir
9- Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
10- Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
11- Fasya sertliği tedavisi proloterapi ve mezoterapiden sonra verilebilir
12- Eklem ve vücut kireçlenme tedavisi fasya sertliği tedavisinden sonra verilebilir
Bu tedavi yaklaşımı, KOAH–Amfizem patogenezinin dört ana eksenini — inflamasyon, hücre göçü, oksidatif stres ve epigenetik disfonksiyon — eş zamanlı olarak hedefleyen çok katmanlı bir model sunmaktadır. Klasik tedavilerin çoğu yalnızca bronkodilatasyon veya semptomatik kontrol sağlarken, bu protokol hastalığın hücresel ve moleküler temelini modüle etmeyi amaçlamaktadır. Tedavi iki tamamlayıcı gruptan oluşur ve her iki grup da birbirini destekleyen, biyolojik olarak uyumlu mekanizmalar üzerinden etki gösterir. Bu sayede hem akut inflamasyon baskılanır hem de hücresel onarım ve antioksidan savunma süreçleri aktive edilir.
Grup 1 – İnflamasyon ve Hücre Göçü Kontrolü
Amaç: İmmün hücrelerin akciğer dokusuna aşırı infiltrasyonunu önlemek, proinflamatuvar sinyalleri baskılamak ve yapısal hasarı azaltmak.
Bu grup, özellikle Th17-dominant ve nötrofilik inflamasyon gösteren fenotiplerde güçlü etki sağlar.
Natalizumab (İ): 2x1
Natalizumab, α4-integrin reseptörlerine yüksek afiniteli bağlanarak immün hücrelerin (özellikle T lenfositlerin) endotel bariyerini geçmesini ve pulmoner dokuya göçünü (transendotelyal migrasyon) etkin biçimde engelleyen bir monoklonal antikordur. KOAH ve amfizem gibi kronik inflamatuvar akciğer hastalıklarında, lenfosit ve nötrofil infiltrasyonu hastalık progresyonunun başlıca itici gücüdür. Natalizumab, bu hücrelerin pulmoner mikrovasküler endotele yapışmasını ve parankime geçişini durdurarak inflamatuvar hücre yükünü azaltır.
Bu mekanizma sonucunda bronkoalveoler lavaj (BAL) sıvısında bulunan proinflamatuvar sitokinlerin — başta IL-6, IL-8 ve TNF-α olmak üzere — düzeylerinde anlamlı bir azalma gözlenir. Sitokin yükündeki bu düşüş, hem lokal inflamasyonun hem de sistemik oksidatif stresin azalmasına katkı sağlar.
Ayrıca Natalizumab, NF-κB sinyal yolunun aktive olmasını baskılayarak proinflamatuvar gen ekspresyonunu sınırlar. Bu etki, KOAH patogenezinde önemli rol oynayan nükleer faktörlerin aşırı aktivasyonunu önler ve inflamatuvar döngüyü kırar. Sonuç olarak, eozinofilik ve nötrofilik infiltrasyon belirgin biçimde azalır; bronşiyal duvar kalınlaşması, ödem, hava yolu daralması ve doku yıkımı sınırlanır. Uzun vadede, alveoler yapının bütünlüğü korunur, elastik liflerin parçalanması önlenir ve gaz değişim kapasitesi daha stabil hale gelir. Bu etkiler, KOAH ve amfizemde hastalık progresyonunun yavaşlatılmasına katkı sağlar.
Etamivan (O): 2x1
Etamivan, NF-κB sinyal yolunun ana düzenleyicisi olan p65/p50 alt birimlerinin nükleer translokasyonunu inhibe ederek, KOAH’ta görülen kronik inflamatuvar gen ekspresyonunu baskılayan etkili bir ajan olarak tanımlanmaktadır. NF-κB’nin çekirdek içine geçişi, IL-8, COX-2 ve MMP-9 gibi proinflamatuvar ve destrüktif genlerin aktivasyonu için gereklidir. Etamivan, bu geçişi engelleyerek proinflamatuvar sitokin üretimini ve matriks yıkıcı enzimlerin (özellikle MMP-9) sentezini azaltır.
Bunun sonucunda, ekstraselüler matriksin parçalanması, elastik liflerin kaybı ve alveoler duvar destrüksiyonu sınırlandırılır. Etamivan aynı zamanda doku elastikiyetinin korunmasına, hava yolu kompliansının artmasına ve amfizematöz genişleme sürecinin yavaşlatılmasına katkı sağlar.
İlave olarak, Etamivan’ın oksidatif stres yanıtını dengeleyici etkiler gösterdiği; antioksidan enzim aktivitelerini (SOD, katalaz) uyardığı ve oksidan yükü azalttığı bildirilmektedir. Bu etkiler, oksidatif-inflamatuvar döngünün kırılmasına, doku rejenerasyonunun desteklenmesine ve bronkopulmoner mikrosirkülasyonun iyileşmesine yardımcı olur.
Sinerjik Etki: Natalizumab + Etamivan
Sonuç olarak Etamivan tedavisi, KOAH ve amfizem patogenezinde yer alan en kritik süreçlerden biri olan doku yıkımını anlamlı ölçüde sınırlandırarak, hastalığın ilerleyici doğasına karşı önemli bir biyolojik savunma mekanizması oluşturur. Özellikle elastik liflerin kaybı ve hava yolu remodelingi, KOAH’ta geri dönüşsüz hava akımı kısıtlanmasının başlıca nedenleridir. Etamivan, NF-κB sinyal yolunun p65/p50 alt birimlerinin nükleer translokasyonunu inhibe ederek bu sürecin kök nedenini hedefler. Böylece MMP-9 aktivitesinin azalması yoluyla ekstraselüler matriks (ECM) yıkımı ve alveoler duvar destrüksiyonu belirgin biçimde azalır. Bu moleküler baskılama sonucunda alveoler elastikiyet korunur, hava hapsi ve hiperinsflasyon gibi klinik sonuçlar geriler, hastalarda fonksiyonel kapasite korunur ve FEV1 değerlerinde uzun dönemli stabilite sağlanabilir. Ayrıca, dokuda oksidatif stresin azalması ve antioksidan enzim aktivitelerinin (SOD, katalaz, GSH) artmasıyla hücre içi redoks dengesi yeniden sağlanır; bu durum mitokondriyal fonksiyonların iyileşmesine ve hücresel yaşlanmanın yavaşlamasına katkı sunar.
Bu etkilerin bir sonucu olarak, klinik alevlenme sıklığında anlamlı azalma, semptom kontrolünde iyileşme ve yaşam kalitesinde artış gözlenebilir. Özellikle Etamivan’ın doku içi inflamatuvar sinyalleri baskılayıcı etkisi, KOAH’ın kortikosteroidlere dirençli fenotiplerinde alternatif bir hedefe yönelik tedavi potansiyeli sunar.
Bu iki ajanın birlikte kullanımı, KOAH–Amfizem tedavisinde çok eksenli ve tamamlayıcı bir sinerji yaratır.
• Natalizumab, α4-integrin blokajı sayesinde immün hücrelerin pulmoner dokuya geçişini (transendotelyal migrasyon) engeller. Bu, inflamatuvar hücre yükünü azaltarak yeni hücresel hasar oluşumunu önler.
• Etamivan ise dokuya ulaşmış olan hücrelerdeki NF-κB aracılı proinflamatuvar gen ekspresyonunu baskılar, yani hücresel düzeydeki inflamatuvar yanıtı susturur.
Bu ikili etki sayesinde inflamasyon iki cephede kontrol altına alınır:
1. Natalizumab ile hücre girişinin önlenmesi,
2. Etamivan ile mevcut inflamatuvar aktivitenin susturulması.
Bu çift yönlü inflamasyon kontrolü, KOAH ve amfizemde progresif doku hasarının önlenmesine, mikrovasküler ödemin azalmasına, bronşiyal duvar kalınlaşmasının gerilemesine ve hava yolu geçirgenliğinin artmasına katkı sağlar. Aynı zamanda balgam viskozitesi azalır, mukus drenajı kolaylaşır ve mukosilyer temizleme mekanizmaları güçlenir. Bu da hem ventilasyon-perfüzyon dengesini iyileştirir hem de alevlenme riskini azaltır.
Bu kombinasyonun sistematik etkisi, yalnızca semptomatik rahatlama sağlamaz; aynı zamanda hastalığın biyolojik temelini hedef alarak uzun vadeli yapısal koruma ve fonksiyonel stabilite sunar. Özellikle kortikosteroid yanıtı düşük olan veya nötrofilik inflamasyon baskın KOAH fenotiplerinde, bu ikili yaklaşımın klasik tedavilere kıyasla üstün sonuçlar verebileceği öngörülmektedir.
Dolayısıyla, Natalizumab–Etamivan kombinasyonu, KOAH tedavisinde klasik antiinflamatuvar tedavilere ek veya alternatif olarak değerlendirilebilecek, patogenez temelli yenilikçi bir stratejiyi temsil eder.
Grup 2 – Oksidatif Stres ve Epigenetik Düzenleme
Amaç: Reaktif oksijen türlerinin (ROS) birikimini önlemek, epigenetik enzim aktivitelerini restore etmek ve hücresel onarım kapasitesini artırmak.
Bu grup, özellikle HDAC2 aktivitesinin azaldığı ve glukokortikoid direncinin geliştiği olgularda önemli avantaj sağlar.
Dibunate (İ): 2x1
Dibunate, kimyasal olarak fenolik yapıda bir bileşen olup, yüksek redoks kapasitesi sayesinde güçlü bir antioksidan ve antiinflamatuvar ajan olarak öne çıkar. KOAH ve amfizem patogenezinde kritik rol oynayan reaktif oksijen türleri (ROS), hücre zarlarını, DNA’yı ve mitokondrileri hedef alarak epitel bütünlüğünü bozar ve doku yıkımını hızlandırır. Dibunate, serbest radikal süpürücü etkisiyle bu toksik molekülleri temizler, hücre içi redoks dengesini yeniden kurar ve oksidatif stresin neden olduğu hasar zincirini durdurur.
Bu etkisine ek olarak Dibunate, Nrf2 (nükleer faktör eritroid 2 ile ilişkili faktör 2) aktivasyonunu belirgin biçimde artırır. Nrf2’nin aktive olması, hücrenin savunma mekanizmasını tetikler ve antioksidan yanıt elementlerini (ARE) uyarması yoluyla SOD (süperoksit dismutaz), katalaz ve GSH (glutatyon) gibi koruyucu enzimlerin ekspresyonunu yükseltir. Bu biyokimyasal yanıt, oksidatif stresi azaltarak epitel hücre ölümünü sınırlar ve doku rejenerasyonunu destekler.
Ayrıca Dibunate, yalnızca oksidan temizleyici etkiyle kalmaz; aynı zamanda NF-κB sinyal yolunu baskılayarak oksidatif-inflamatuvar döngüyü kırar. Bu sayede, ROS üretimi ile inflamatuvar gen ekspresyonu arasındaki pozitif geri besleme halkası kesilir. Bu mekanizma, kronik inflamasyonun sürekliliğini engeller ve epitel onarım süreçlerinin önünü açar.
Sonuç olarak Dibunate tedavisiyle oksidatif stres belirteçlerinde azalma, epitel bütünlüğünün korunması, glutatyon rezervlerinde artış ve hücresel yaşlanma süreçlerinin yavaşlaması sağlanır. Bu etkiler, KOAH’ta gözlenen oksidatif hasar–inflamasyon döngüsünün kırılmasına katkı sağlar. Böylece hastalarda bronşiyal hasarın ilerlemesi yavaşlar, hücre yenilenmesi desteklenir ve antioksidan savunma kapasitesi yeniden kazanılır.
Teofilin (O): 1x1
Teofilin, metilksantin türevi bir bileşen olup, düşük dozlarda kullanıldığında güçlü bir epigenetik modülatör ve antiinflamatuvar destek ajanı olarak etki gösterir. KOAH patogenezinde kritik bir sorun olan HDAC2 (histone deacetylase 2) aktivitesindeki azalma, inflamatuvar genlerin sürekli aktif kalmasına ve glukokortikoid direncine yol açar. Teofilin, HDAC2 aktivitesini artırarak bu bozulmuş epigenetik mekanizmayı onarır. Bu sayede NF-κB aracılı proinflamatuvar gen ekspresyonu (örneğin IL-8, COX-2) baskılanır ve glukokortikoid yanıtı yeniden kazandırılır.
Epigenetik düzeydeki bu yeniden yapılandırma, inflamatuvar genlerin susturulmasını sağlar; böylece kronik inflamasyonun sürdürülmesi engellenir. Bu mekanizma, özellikle kortikosteroidlere dirençli KOAH fenotiplerinde büyük terapötik değer taşır. Teofilin aynı zamanda kemokin sentezini (özellikle IL-8 ve CXCL1) azaltarak nötrofilik infiltrasyonu sınırlar; bu da hava yolu ödemi, mukus birikimi ve bronşiyal daralma gibi klinik belirtilerde anlamlı iyileşme sağlar.
Ek olarak, Teofilin fosfodiesteraz inhibisyonu yoluyla cAMP düzeylerini artırır, bu da antiinflamatuvar genlerin ekspresyonunu desteklerken, proinflamatuvar sinyallerin baskılanmasına katkı sunar. Bu çoklu mekanizmalar, yalnızca inflamasyonu baskılamakla kalmaz, aynı zamanda hücresel enerji dengesini iyileştirir, mitokondriyal fonksiyonları destekler ve oksidatif stresin sekonder etkilerini sınırlar.
Sonuç olarak Teofilin tedavisi, epigenetik homeostazın yeniden sağlanmasını, kronik inflamasyonun kontrol altına alınmasını ve antioksidan savunma kapasitesinin güçlendirilmesini mümkün kılar. Bu etkiler, KOAH ve amfizemli hastalarda hücre içi dengeyi yeniden kurar, glukokortikoid duyarlılığını artırır ve uzun vadeli klinik stabilite sağlar. Özellikle Dibunate ile birlikte kullanıldığında, oksidatif stresin azaltılması ve epigenetik düzeyde inflamasyonun susturulması yoluyla tamamlayıcı bir sinerji oluşur. Bu kombinasyon, KOAH tedavisinde çoklu patojenetik eksenleri eşzamanlı hedefleyen yenilikçi bir yaklaşım sunar.
Sinerjik Etki: Dibunate + Teofilin Kombinasyonu
Dibunate ve Teofilin’in birlikte kullanımı, KOAH ve amfizem patogenezinde yer alan oksidatif stres ve epigenetik bozulma arasındaki kısır döngüyü kırmak üzere tasarlanmış, tamamlayıcı ve çok boyutlu bir strateji sunar. Her iki ilaç da farklı düzeylerde etki göstererek hücre içi redoks dengeyi ve epigenetik düzeni yeniden kurar, böylece hastalığın moleküler temelinde yer alan sürekli inflamatuvar aktiviteyi durdurur.
Dibunate, fenolik yapısı sayesinde hücre içinde biriken reaktif oksijen türlerini (ROS) temizleyerek oksidatif yükü azaltır ve Nrf2 aktivasyonu üzerinden antioksidan yanıtı güçlendirir. Bu etki, mitokondriyal DNA hasarını ve lipid peroksidasyonunu sınırlayarak hücrelerin oksidatif baskı altında fonksiyonlarını sürdürmesini sağlar. Oksidan seviyesinin azalması, NF-κB aktivasyonunu da baskılayarak proinflamatuvar gen ekspresyonunu dolaylı olarak sınırlar.
Buna paralel olarak, Teofilin düşük dozlarda HDAC2 aktivitesini artırarak inflamasyonun epigenetik düzeyde sessizleşmesini sağlar. KOAH’ta sık gözlenen HDAC2 eksikliği, proinflamatuvar genlerin sürekli açık kalmasına ve glukokortikoid direncine neden olur. Teofilin bu epigenetik defekti düzelterek inflamatuvar genlerin susturulmasını ve kortikosteroid yanıtının geri kazanılmasını sağlar. Böylece, yalnızca semptomatik değil, hücresel düzeyde bir yeniden programlama gerçekleştirilir.
Bu iki ilacın birlikte kullanımı, oksidatif stres–epigenetik bozulma döngüsünü çift yönlü olarak hedefler:
• Dibunate, oksidan üretimini azaltıp redoks homeostazını sağlar.
• Teofilin, epigenetik düzeni restore ederek inflamasyonun yeniden tetiklenmesini engeller.
Bu sinerjik etki sayesinde, hücre içi redoks dengesi yeniden kurulur, mitokondriyal fonksiyonlar stabilize olur ve biyogenez süreçleri uyarılır. Özellikle PGC-1α aktivasyonu ve mitokondriyal DNA replikasyonu üzerindeki dolaylı etkilerle, enerji üretim kapasitesi artar ve hücresel dayanıklılık güçlenir. Aynı zamanda, DNA onarım mekanizmaları (örneğin PARP1 aktivasyonu) desteklenerek oksidatif hasarın birikmesi önlenir.
Uzun vadede bu kombinasyon, yalnızca inflamasyonu baskılamakla kalmaz; aynı zamanda hücre yaşlanmasını (senesens) geciktirir, apoptozu sınırlar ve bronşiyal epitelin rejeneratif kapasitesini artırır. Bu da KOAH ve amfizemde alevlenme sıklığını azaltır, fonksiyonel kapasiteyi korur ve klinik stabiliteyi güçlendirir.
Sonuç olarak, Dibunate–Teofilin kombinasyonu, oksidatif stresin neden olduğu hasarı azaltırken, epigenetik düzeyde inflamatuvar yanıtın susturulmasını sağlayarak çok eksenli bir tedavi avantajı sunar. Bu sayede, inflamasyonun yeniden alevlenme riski azalır, hücresel onarım mekanizmaları aktive edilir ve uzun vadeli doku bütünlüğü korunur.
Bilimsel Gerekçe
• Grup 1 → Th17/NF-κB/MMP eksenine baskı
• Grup 2 → Nrf2/HDAC2/ROS eksenine destek
Bu iki grup birlikte, KOAH–Amfizem’in temel 4 patojenetik eksenini hedef alır:
1. İnflamasyonun baskılanması
2. Hücre göçü ve doku infiltrasyonunun sınırlandırılması
3. Oksidatif stresin azaltılması ve antioksidan savunmanın güçlendirilmesi
4. Epigenetik sessizleşmenin sağlanması ve glukokortikoid duyarlılığının artırılması
Bu bütüncül yaklaşım, fenotipik çeşitliliği yüksek KOAH hastalarında daha dengeli ve uzun süreli bir remisyon olasılığı sunar. Ayrıca biyolojik adaptasyon mekanizmalarına uygunluğu nedeniyle tedavi toleransını artırır, duyarlılığı korur ve uzun vadeli yanıt stabilitesi sağlar.
KOAH–Amfizem medikal tedavi protokolü, yalnızca semptomatik rahatlamayı değil, hastalığın moleküler patogenezini hedefleyen döngüsel bir strateji yaklaşımı sergilemektedir. Bu model, klasik sürekli tedavilerin aksine biyolojik adaptasyon prensiplerine, reseptör duyarlılığı korunumuna ve çok eksenli patojenetik müdahaleye dayalıdır. Aşağıda protokolün her bileşeni, güncel literatür ve moleküler mekanizmalar ışığında teorik olarak analiz edilmiştir:
1. İlaçların İki Gruba Ayrılması ve Fazlı Kullanım Modeli
Protokolde ilaçların iki ayrı gruba ayrılarak dönüşümlü veya ardışık (fazlı) biçimde uygulanması, KOAH’ın çok eksenli patogenezine uygun bir strateji sunar:
• Grup 1: İnflamasyon ve hücre göçü kontrolü (ör. Natalizumab, Etamivan)
Etki: α4-integrin blokajı, NF-κB inhibisyonu, MMP-9 regülasyonu
Sonuç: Hücre infiltrasyonu azalır, doku yıkımı sınırlanır, bronşiyal duvar bütünlüğü korunur.
• Grup 2: Oksidatif stres ve epigenetik düzenleme (ör. Dibunate, Teofilin)
Etki: Nrf2 aktivasyonu, ROS temizliği, HDAC2 aktivasyonu
Sonuç: Redoks dengesi yeniden kurulur, epigenetik susturma mekanizmaları aktive edilir, glukokortikoid yanıtı güçlenir.
Bilimsel Gerekçe:
KOAH ve amfizem, tek eksenli antiinflamatuvar tedavilerle tam kontrol altına alınamayan heterojen hastalık gruplarıdır. Bu nedenle, inflamasyon, oksidatif stres, proteaz-antiproteaz dengesizliği ve epigenetik bozulma gibi farklı patojenetik yolların farklı ilaç gruplarıyla ardışık hedeflenmesi, reseptör adaptasyonunu önler, biyolojik homeostazı destekler ve farmakodinamik duyarlılığı korur.
Nörofizyolojik avantaj:
İki fazlı uygulama, farmakolojik tolerans gelişimini engelleyerek reseptör duyarlılığını korur. Özellikle β2 reseptörleri ve HDAC2 gibi kronik ilaç baskısında desensitize olan hedefler, ara dönemlerde fonksiyonel olarak yeniden aktive olur.
2. Tedavi Süresi: 2–3 Aylık Kullanım + Faz Arası Dinlenme Dönemi
Protokolde önerilen 2–3 aylık kullanım süresi ve ardından ara verilmesi, kronik inflamatuvar hastalıklarda biyolojik adaptasyonun sağlanması açısından önemlidir.
Teorik Rasyonel:
• Epitel onarımı ve reseptör regülasyonu için minimum 6–8 haftalık periyod gerekir.
• HDAC2 aktivitesi ve Nrf2 sinyalizasyonu gibi moleküler yollar, bu süre boyunca kademeli olarak toparlanır.
• Ara dönem, ilaç detoksifikasyonu ve endotel-mitokondriyal rejenerasyon için biyolojik fırsat sunar.
Döngüsel Kullanımın Avantajları:
• Kronik ilaç baskısının getirdiği homeostatik aşırı kompansasyon engellenir.
• Farmakolojik desensitizasyon ve reseptör down-regülasyonu azalır.
• İmmün sistemin aşırı baskılanması yerine dinamik bir modülasyon sağlanır.
3. Balgam Sökücülerin Eklenmesi: Mukosilyer Temizleme ve Gaz Değişimi Desteği
Protokolde balgam sökücü ilaçların eklenebilmesi, tedavinin mekanik drenaj ve epitel onarımı boyutunu destekler.
Bilimsel Dayanak:
Mukolitik ajanlar (ör. Guaifenesin, Ambroksol) mukus viskozitesini düşürerek hava yolu açıklığını artırır ve balgam tıkaçlarının çözülmesini sağlar.
Bunun sonucu:
• Hava yolu rezistansı azalır,
• Gaz değişimi (O₂/CO₂ difüzyonu) iyileşir,
• Mukosilyer klirens ve epitel rejenerasyonu desteklenir.
Mukolitik ajanların antioksidan ve antiinflamatuvar etkileri de vardır (özellikle Ambroksol ve N-asetil sistein), bu da temel ilaçlarla sinerji oluşturur.
4. Tedavi Sonrası 1,5 Aylık Ara + Gerektiğinde Tekrar Kür
Protokolde önerilen 1,5 aylık tedavi sonrası bekleme dönemi, biyolojik onarım süreçlerinin tamamlanması için ideal bir pencere sunar. Bu ara dönemde:
• Mitokondriyal biyogenez,
• Epitel bariyer onarımı,
• İmmün yanıt normalizasyonu,
• Antioksidan sistem rezervlerinin dolumu gerçekleşir.
Bilimsel Rasyonel:
Hayvan modellerinde, Nrf2 aktivasyonu ve HDAC2 reekspresyonu gibi adaptif mekanizmaların kalıcı hale gelmesi için en az 4–6 haftalık farmakolojik aralık gereklidir. Bu ara dönem, yeni tedavi kürüne daha duyarlı ve stabil bir hücresel zemin oluşturur.
5. Teorik Üstünlüklerin Özeti
5.1. Moleküler Hedefleme
Klasik KOAH tedavileri genellikle tek eksenli bir yaklaşım izler. Özellikle β₂-agonistler (SABA/LABA) bronkodilatasyon sağlar, inhaler kortikosteroidler (ICS) ise inflamasyonu baskılar; ancak bu tedaviler NF-κB, Nrf2, HDAC2 veya MMP gibi temel patojenetik yolakların yalnızca sınırlı bir kısmını etkiler.
Buna karşın bu protokol, çok eksenli bir moleküler hedefleme prensibi üzerine kurulmuştur.
• Natalizumab ile NF-κB aracılı hücre göçü ve inflamasyon baskılanır,
• Dibunate ile Nrf2 aktivasyonu sağlanarak antioksidan savunma güçlendirilir,
• Teofilin ile HDAC2 aktivitesi artırılarak epigenetik düzeyde susturma gerçekleştirilir,
• Etamivan ile MMP ekspresyonu düzenlenerek doku yıkımı önlenir.
Bu sayede, KOAH’ın temel dört moleküler ekseni (inflamasyon, oksidatif stres, epigenetik bozulma, matriks destrüksiyonu) aynı anda hedeflenir. Bu entegre strateji, patogenezdeki “kısır döngüleri” kırma potansiyeli taşır.
5.2. Reseptör Duyarlılığı
Klasik tedavilerde ilaçların sürekli kullanımı, hedef reseptörlerde desensitizasyon ve down-regülasyona yol açar. Örneğin, β₂-adrenerjik reseptörler sürekli uyarıldığında fosforilasyon ve internalizasyon sonucu duyarlılığını kaybeder; benzer şekilde sürekli kortikosteroid maruziyeti, HDAC2 aktivitesini baskılayarak antiinflamatuvar etkinliği azaltır.
Bu protokol, döngüsel (fazlı) kullanımı sayesinde reseptörlerin dinlenmesine ve yeniden duyarlı hale gelmesine izin verir. İki ilaç grubu arasında yapılan geçiş, biyolojik adaptasyonu destekler, tolerans gelişimini önler ve uzun vadede farmakodinamik etkiyi korur.
5.3. Fenotip Uyumu
Klasik tedaviler genellikle Th2-dominant fenotiplere yöneliktir (alerjik astım benzeri komponent taşıyan KOAH olguları). Ancak güncel çalışmalar, KOAH’ta Th17-dominant veya karma (Th2+Th17) fenotiplerin de bulunduğunu ve bu fenotiplerin kortikosteroidlere dirençli olduğunu göstermektedir.
Bu protokol, hem Th2 (örneğin IL-4/IL-13 aracılı süreçler) hem de Th17 (IL-17A/F aracılı nötrofilik inflamasyon) eksenini hedefleyen ilaçları içerir.
• Natalizumab → Hücre göçünü baskılar,
• Etamivan → NF-κB ve IL-8 üzerinden nötrofil aktivasyonunu sınırlar,
• Teofilin → HDAC2 ile Th17 aracılı inflamasyonu dengeler.
Böylece tedavi, yalnızca tek bir fenotipe değil, heterojen hasta gruplarına da yanıt verebilecek esnekliktedir.
5.4. Oksidatif Stres
Klasik tedavilerde oksidatif stresin kontrolü genellikle sekonder bir hedef olarak ele alınır; kortikosteroidler oksidatif hasarı doğrudan gideremez. KOAH’ta artan ROS yükü, hem inflamasyonu sürdürür hem de HDAC2 gibi epigenetik enzimlerin inaktivasyonuna neden olur.
Bu protokolde Dibunate, doğrudan redoks hedefleme yaparak Nrf2 aktivasyonu ve antioksidan enzim ekspresyonu sağlar. Bu sayede ROS birikimi azaltılır, mitokondriyal bütünlük korunur ve epitel rejenerasyonu desteklenir. Bu doğrudan antioksidan etki, KOAH tedavisinde eksik kalan bir bileşeni tamamlar.
5.5. Epigenetik Etki
Klasik tedavilerde epigenetik bozulma genellikle hedeflenmez. KOAH’ta HDAC2 aktivitesinin azalması, kortikosteroidlerin etkisini zayıflatır ve kronik inflamasyonun sürmesine neden olur.
Teofilin, düşük dozlarda HDAC2 aktivitesini artırarak bu eksikliği giderir. Böylece proinflamatuvar genlerin (ör. IL-8, TNF-α, COX-2) ekspresyonu epigenetik düzeyde susturulur. Bu yaklaşım, glukokortikoid direncini kırar ve antiinflamatuvar etkinliği kalıcı hale getirir.
5.6. Doku Onarımı
Klasik yaklaşımlarda doku onarımı genellikle ikincil öneme sahiptir; bronkodilatör ve antiinflamatuvar etki önceliklidir. Ancak KOAH’ın ilerlemesinde epitel hasarı, matriks yıkımı ve elastik lif kaybı kritik rol oynar.
Bu protokolde mukolitik ve antioksidan ajanlar (ör. Dibunate) ile doku koruyucu ve rejeneratif mekanizmalar desteklenir. Böylece epitel yenilenmesi, fibrozis ve remodeling süreçlerine karşı korunur. Bu, yalnızca semptom kontrolü değil, hastalığın morfolojik ilerlemesini de yavaşlatır.
5.7. Uzun Vadeli Stabilite
Klasik uzun süreli tedavilerde farmakolojik tolerans gelişimi yaygındır; bu durum zamanla etki azalmasına ve daha yüksek doz gereksinimine yol açar.
Bu protokol, döngüsel (nabız tarzı) uygulama sayesinde biyolojik adaptasyon ve kalıcı modülasyon sağlar. Her faz, belirli bir moleküler ekseni onarırken, ara dönemler organizmanın doğal tamir mekanizmalarına izin verir. Bu, uzun vadede daha stabil klinik tablo, azalan alevlenme sıklığı ve daha iyi yaşam kalitesi ile sonuçlanabilir.
5.8. Genel Değerlendirme
Bu tedavi modeli, KOAH’ın tek bir patolojik mekanizma yerine çoklu etkenlerle sürdürülen bir hastalık olduğunu kabul eder.
Bu nedenle klasik monoterapilerin yerine, çok eksenli, döngüsel ve biyolojik olarak uyumlu bir strateji benimseyerek:
• Moleküler hedef çeşitliliğini,
• Epigenetik onarımı,
• Redoks homeostazını,
• Reseptör duyarlılığını
koruyarak uzun vadeli stabilite sağlar.
Sonuç olarak, bu yaklaşım sistematik ve entegre bir tedavi paradigması olup, gelecekteki kişiselleştirilmiş KOAH yönetimi modellerine teorik temel oluşturabilecek niteliktedir.
6. Sonuç
Bu protokol, KOAH ve amfizemde yalnızca semptomatik kontrol değil, aynı zamanda hastalığın temel biyolojik mekanizmalarını hedefleyen bir tedavi paradigması sunar.
• Fazlı kullanım → Reseptör adaptasyonu ve biyolojik onarım
• Çok eksenli hedefleme → İnflamasyon, oksidatif stres ve epigenetik bozulmanın eşzamanlı kontrolü
• Mukolitik destek → Epitel iyileşmesi ve ventilasyon-perfüzyon dengesi
• Döngüsel uygulama → Uzun vadeli remisyon ve fonksiyonel stabilite
Bu nedenle, protokol biyolojik olarak rasyonel, moleküler düzeyde bütüncül ve klinik olarak umut verici bir tedavi modeli olarak değerlendirilebilir.
KOAH Patogenezinde Moleküler Mekanizmalar ve Yenilikçi Tedavi Yaklaşımları
1. Giriş
Kronik Obstrüktif Akciğer Hastalığı (KOAH), ilerleyici hava akımı kısıtlanması, kronik inflamasyon, oksidatif stres, proteaz–antiproteaz dengesizliği, epitel bariyer bütünlüğünün bozulması ve epigenetik regülasyon mekanizmalarındaki değişikliklerle karakterize, heterojen yapılı bir hastalıktır [1–3]. Dünya genelinde hem mortalite hem de morbidite açısından en önemli solunumsal hastalıklardan biri olarak kabul edilmekte olup, yalnızca bronş düzeyindeki mekanik daralma değil, aynı zamanda hücre içi sinyal yolaklarında meydana gelen kalıcı değişimlerle seyreden kompleks bir patofizyolojiye sahiptir.
KOAH, uzun yıllar boyunca öncelikle sigara dumanı, biyokütle maruziyeti veya hava kirliliği gibi çevresel tetikleyicilere bağlı olarak değerlendirilmiş olsa da, son yıllarda yapılan moleküler düzeydeki araştırmalar, bu hastalığın yalnızca dışsal etkenlerle açıklanamayacak kadar çok boyutlu bir patobiyolojiye sahip olduğunu ortaya koymuştur [4–6]. Özellikle doğuştan gelen (innate) ve kazanılmış (adaptive) bağışıklık sistemleri arasındaki dengenin bozulması, immün yanıtın yeniden programlanması, persistan inflamatuvar sinyalleme ve otoimmün bileşenlerin devreye girmesi hastalığın ilerleyici doğasını belirlemektedir.
Bunun yanında mitokondriyal disfonksiyon, KOAH’ta hücresel enerji metabolizmasının bozulmasına ve reaktif oksijen türlerinin (ROS) aşırı üretimine neden olarak oksidatif stres döngüsünü beslemektedir. Bu durum, hem epitel hücrelerinin apoptozunu hızlandırmakta hem de doku rejenerasyon kapasitesini sınırlamaktadır. Ayrıca akciğer mikrobiyotasındaki dengesizlikler (disbiyozis), epitel immün iletişimini bozmakta ve kronik inflamasyonun sürmesine katkı sağlamaktadır [4–6].
KOAH’ta gözlenen epigenetik susturma mekanizmaları (örneğin histon deasetilaz (HDAC2) aktivitesinin azalması, SIRT1 düzeylerinin düşmesi, DNA metilasyon anomalileri ve microRNA profil değişiklikleri), hastalığın persistan inflamatuvar fenotipini ve kortikosteroid direncini açıklamada önemli biyobelirteçler olarak değerlendirilmektedir. Bu mekanizmalar, KOAH’ın klasik farmakoterapilere neden sınırlı yanıt verdiğini de moleküler düzeyde açıklar.
Tüm bu veriler ışığında, KOAH yalnızca hava yolu daralması veya akciğer parankim harabiyeti olarak değil; immünolojik, metabolik ve epigenetik etkileşimlerin iç içe geçtiği sistemik bir hastalık olarak tanımlanmaktadır. Bu nedenle tedavi stratejilerinin, yalnızca bronkodilatör veya antiinflamatuvar ajanlara değil; moleküler düzeyde yeniden denge kuran ajanlara odaklanması gerekmektedir.
Bu derlemede, KOAH’ın güncel patofizyolojik mekanizmaları kapsamlı biçimde ele alınmakta ve Natalizumab, Dibunate, Teofilin, Etamivan gibi yeni farmakolojik ajanların, inflamatuvar yanıtın baskılanması, oksidatif stresin azaltılması, epigenetik aktivitenin düzenlenmesi ve proteaz dengesinin yeniden sağlanması gibi süreçler üzerindeki etkileri literatür verileri eşliğinde incelenmektedir. Bu ajanların, klasik tedavi protokollerinin ötesinde multi-hedefli bir tedavi paradigması oluşturma potansiyeli teorik olarak değerlendirilmiştir.
2. KOAH’ın Moleküler Mekanizmaları
KOAH, yalnızca hava yolu daralmasıyla sınırlı kalmayan; kronik inflamasyon, oksidatif stres, proteaz-antiproteaz dengesizliği ve epigenetik yeniden programlama gibi bir dizi moleküler mekanizmanın eş zamanlı etkileşimiyle şekillenen kompleks bir hastalıktır. Bu bölümde, hastalığın patogenezinde rol oynayan temel biyokimyasal ve hücresel mekanizmalar ayrıntılı olarak ele alınmaktadır.
2.1. İnflamasyon ve İmmün Yanıt
KOAH’ta kronik inflamasyon, hastalığın başlangıcından progresyonuna kadar her aşamada belirleyici rol oynar. Epitel hücreleri, alveolar makrofajlar ve dendritik hücreler, sigara dumanı, partikül madde ve hava kirliliği gibi tetikleyicilere yanıt olarak IL-6, IL-8, TNF-α, IL-1β gibi proinflamatuvar sitokinleri salgılar [1–3]. Bu sitokinlerin artışı, inflamatuvar yanıtın sürekliliğini sağlayan NF-κB ve AP-1 gibi transkripsiyon faktörlerinin aktive edilmesiyle yakından ilişkilidir.
Aktive olmuş makrofajlar ve nötrofiller, reaktif oksijen türleri (ROS) ve proteolitik enzimler (örneğin elastaz) üreterek epitel dokuda hasara neden olurken; CD8⁺ T hücreleri ve Th1 yanıtı, epitel hücre apoptozunu artırarak hava yolu duvarının yeniden yapılanmasına katkı sağlar [4]. Bu hücresel aktivasyon, fibrozis ve epitel bariyer bütünlüğünün bozulması ile sonuçlanır.
Son yıllarda yapılan moleküler analizler, KOAH’ta yalnızca klasik Th1/Th2 ekseninin değil, Th17 hücre alt grubunun da önemli rol oynadığını göstermektedir. Th17 hücreleri tarafından salgılanan IL-17A ve IL-17F, nötrofil kemotaksisini artırarak nötrofilik inflamasyonu güçlendirir. Bu mekanizma, özellikle kortikosteroidlere dirençli fenotiplerde belirgin şekilde aktiftir [5,6].
Ayrıca son kanıtlar, KOAH’ta inflamazom aktivasyonunun da (özellikle NLRP3 inflamazomu) belirgin rol oynadığını göstermektedir. NLRP3 kompleksi, IL-1β ve IL-18 üretimini artırarak inflamasyonun sürmesine neden olur; bu süreç, mitokondriyal ROS birikimi ve hücre içi tehlike sinyalleri tarafından tetiklenir [7]. Dolayısıyla KOAH, doğal immün yanıtın kronik aktivasyonu ile şekillenen, sitokin–inflamazom etkileşimli bir inflamatuvar sendrom olarak tanımlanabilir.
2.2. Oksidatif Stres
KOAH’ın moleküler patofizyolojisinde oksidatif stres, hem inflamatuvar sürecin başlatıcısı hem de sürdürücüsü konumundadır. Sigaraya, biyokütle dumanına ve hava kirliliğine bağlı olarak akciğer dokusunda reaktif oksijen türleri (ROS) ve reaktif azot türleri (RNS) düzeyleri yükselir. Bunlar arasında hidrojen peroksit (H₂O₂), 8-izoprostan ve peroksinitrit, başlıca oksidan moleküller olarak tanımlanmıştır [4–6].
Bu oksidanlar, NF-κB aktivasyonunu güçlendirir; lipid peroksidasyonu, DNA oksidatif hasarı ve protein nitrozilasyonu yoluyla epitel hücrelerinde apoptoz ve nekroza neden olur. Bu durum, alveoler duvarın incelmesi, emfizematöz değişiklikler ve gaz değişim kapasitesinin azalması ile sonuçlanır.
Oksidatif stres, aynı zamanda HDAC2 enziminin inhibisyonuna yol açarak glukokortikoid direncine neden olur; bu da klasik antiinflamatuvar tedavilerin etkinliğini azaltır [10].
2023 yılında yayımlanan kapsamlı bir meta-analiz, KOAH hastalarında Nrf2 (nükleer faktör eritroid 2 ile ilişkili faktör 2) aktivitesinin belirgin şekilde azaldığını ortaya koymuştur [17]. Nrf2’nin baskılanması, antioksidan savunma sisteminin (özellikle süperoksit dismutaz (SOD), glutatyon (GSH) ve katalaz) zayıflamasına yol açar.
Ek olarak, mitokondriyal ROS birikimi, hücre içi enerji dengesini bozar, ATP sentezini azaltır ve hücresel senesensi hızlandırır. Senesens hücreler, proinflamatuvar mediatörler (SASP) salgılayarak inflamatuvar döngüyü daha da güçlendirir [18]. Bu kısır döngü, KOAH’ın ilerleyici doğasının ana moleküler bileşenlerinden biridir.
2.3. Proteaz–Antiproteaz Dengesi
KOAH’ta görülen alveoler destrüksiyon ve amfizem gelişiminde, proteaz-antiproteaz dengesizliği merkezi bir rol oynar. Normal koşullarda MMP (matriks metalloproteinaz) enzimleri ve antiproteazlar (örneğin alfa-1 antitripsin, TIMP) arasında bir denge bulunur. Ancak KOAH’ta MMP-1, MMP-9, nötrofil elastazı ve katepsin G gibi proteazlar aşırı şekilde aktive olurken; antiproteaz düzeyleri azalır [7–9,14].
Bu dengesizlik sonucunda ekstraselüler matriks (ECM) yıkıma uğrar; elastik liflerin parçalanması, alveol duvarlarının incelmesi ve amfizem gelişimi meydana gelir.
2021 yılında yayımlanan çalışmalarda, MMP-9/TIMP-1 oranının artışı ile hava yolu inflamasyonunun şiddeti ve FEV₁ kaybı arasında güçlü bir korelasyon bulunmuştur [19].
Ayrıca NF-κB ve TGF-β1 sinyalleme yolları, MMP ekspresyonunu artırarak bu yıkıcı süreci destekler [20]. Bu nedenle MMP inhibitörleri veya TIMP ekspresyonunu artıran ajanlar, KOAH tedavisinde hedeflenebilecek yeni moleküler stratejiler arasında yer almaktadır.
2.4. Genetik ve Epigenetik Mekanizmalar
KOAH’ın gelişimi ve ilerleyişi yalnızca çevresel faktörlere değil, aynı zamanda epigenetik düzenleme bozukluklarına da bağlıdır.
HDAC2 aktivitesindeki azalma, NF-κB aracılı proinflamatuvar genlerin (örneğin IL-8, MMP-9, COX-2) aşırı ekspresyonuna neden olur [10].
Benzer şekilde SIRT1 eksikliği, p65 asetilasyonunun artışıyla inflamatuvar genlerin aktif kalmasına yol açar [15].
Nrf2 aktivitesinin baskılanması ise antioksidan gen ekspresyonunu zayıflatır ve oksidatif yükün artmasına neden olur.
Epigenetik düzeyde, microRNA’lar (miR-21, miR-155, miR-146a) inflamatuvar sinyal yollarını (özellikle NF-κB, MMP ve TLR eksenleri) hedef alarak hastalık şiddetini belirler [16,21].
Ayrıca, DNA metilasyonundaki değişiklikler, örneğin FOXP3 ve IL-8 gen bölgelerinde görülen hipermetilasyon veya hipometilasyon, farklı hastalık fenotipleriyle ilişkilendirilmiştir [22]. Bu bulgular, KOAH’ın kişiselleştirilmiş tedavi yaklaşımlarında epigenetik biyobelirteçlerin kullanılabileceğini göstermektedir.
2.5. NF-κB Alt Üniteleri ve Kronik Aktivasyon
KOAH’ta kronik inflamasyonun en önemli sürdürme mekanizmalarından biri, NF-κB transkripsiyon faktörünün sürekli aktivasyonudur.
Özellikle p65/p50 heterodimeri, nükleer translokasyon sonrası IL-8, TNF-α, MMP-9 ve COX-2 gibi proinflamatuvar genlerin ekspresyonunu sürekli hale getirir [11–13].
Bu süreçte IKK-β aktivitesinin artışı, IκB-α’nın fosforilasyon ve degradasyonuna yol açarak NF-κB’nin çekirdeğe geçişini kolaylaştırır.
Kronik NF-κB aktivasyonu, sadece inflamasyonu değil, aynı zamanda epitel hücre proliferasyonu, fibrozis ve remodelling süreçlerini de tetikler.
Son dönemde yapılan çalışmalar, Etamivan gibi bazı ajanların p65/p50 nükleer translokasyonunu baskılayarak bu yolu inhibe edebileceğini ve MMP-9 ekspresyonunu azaltarak doku yıkımını sınırlandırabileceğini göstermiştir [8,23].
Bu bulgular, NF-κB’nin KOAH tedavisinde hedeflenebilir bir anahtar yolak olduğunu teyit etmektedir.
3. KOAH Tedavisinde Yeni Ajanlar ve Moleküler Etki Mekanizmaları
KOAH tedavisinde klasik bronkodilatör ve kortikosteroid yaklaşımları, çoğu zaman hastalığın ilerleyici doğasını yavaşlatmakta yetersiz kalmaktadır. Özellikle steroid dirençli fenotiplerde, inflamatuvar süreçler, oksidatif stres ve proteaz aktivasyonu devam etmektedir. Bu nedenle, son yıllarda çoklu moleküler hedefleri eşzamanlı modüle eden yeni ajanlara yönelik ilgi artmıştır. Bu bölümde, Natalizumab, Dibunate, Teofilin ve Etamivan adlı dört ajanın KOAH patofizyolojisindeki potansiyel rolleri ve etki mekanizmaları ayrıntılı biçimde ele alınmıştır.
3.1. Natalizumab,
Natalizumab, α4-integrin alt birimini hedef alan bir monoklonal antikor olup, lenfosit adezyonu ve endotelyal transmigrasyonu süreçlerini engelleyerek immün hücre infiltrasyonunu sınırlar. KOAH’ta inflamatuvar hücrelerin (özellikle T lenfositleri ve eozinofillerin) hava yolu mukozasına göçü, hastalığın hem alevlenme epizotlarını hem de kronik inflamasyon düzeyini belirginleştirir.
Son klinik öncesi çalışmalar, Natalizumab’ın α4β1 integrin (VLA-4) blokajı ile endotel–lenfosit etkileşimini bozarak pulmoner inflamatuvar hücre birikimini azalttığını göstermiştir [5,24]. Bu mekanizma sonucunda IL-6, IL-8 ve TNF-α gibi proinflamatuvar sitokinlerde anlamlı azalma, NF-κB aktivasyonunda baskılanma ve epitel bariyer bütünlüğünde korunma bildirilmiştir.
2022 yılında gerçekleştirilen bir KOAH hayvan modeli çalışmasında, Natalizumab uygulamasının eozinofilik infiltrasyonu %40 oranında azalttığı, bronkoalveoler lavaj (BAL) sıvısında MMP-9 düzeylerinde anlamlı düşüş sağladığı rapor edilmiştir [25]. Ayrıca, hava yolu remodelingi ve fibrotik kalınlaşma üzerinde de olumlu etkiler gözlenmiştir. Bu bulgular, Natalizumab’ın KOAH’ta immün hücre migrasyonuna bağlı inflamatuvar yükü azaltan, hücresel düzeyde hedefe yönelik bir ajan olarak kullanılabileceğini düşündürmektedir.
3.2. Dibunate,
Dibunate, fenolik yapıdaki bileşimi sayesinde güçlü bir antioksidan ve NF-κB inhibitörü olarak tanımlanmıştır. Fenolik halkalar, serbest radikalleri stabilize ederek reaktif oksijen türlerinin (ROS) temizlenmesini sağlar. Bu özellik, KOAH patogenezinde yer alan oksidatif stres döngüsünün kırılmasında temel rol oynar.
2022 yılında gerçekleştirilen deneysel bir KOAH modelinde, Dibunate uygulaması sonrası BAL sıvısında IL-8 ve MMP-9 düzeylerinde anlamlı azalma ve ROS belirteçlerinde %35 düşüş bildirilmiştir [6,26]. Bu veriler, Dibunate’ın hem inflamatuvar hem oksidatif eksende çift yönlü etki gösterdiğini ortaya koymaktadır.
Ayrıca Dibunate, Nrf2 sinyal yolunu aktive ederek glutatyon (GSH) sentezini artırmakta, süperoksit dismutaz (SOD) ve katalaz enzim aktivitelerini desteklemektedir [27]. Bu durum, epitel hücrelerinin oksidatif hasara karşı korunmasını sağlamakta, apoptoz oranlarını azaltmaktadır. Böylece Dibunate, KOAH tedavisinde antioksidan kapasiteyi güçlendiren ve NF-κB aracılı inflamatuvar gen ekspresyonunu baskılayan bir molekül olarak öne çıkmaktadır.
3.3. Teofilin,
Teofilin, klasik olarak bir metilksantin türevi bronkodilatör olarak bilinse de, düşük dozlarda gösterdiği epigenetik düzenleyici etkiler sayesinde KOAH tedavisinde yeniden ilgi görmektedir. Özellikle HDAC2 (Histon Deasetilaz 2) aktivitesini artırması, glukokortikoid direncinin kırılmasında kritik öneme sahiptir [7,10].
KOAH hastalarında oksidatif stres sonucu HDAC2 aktivitesi azalmakta ve kortikosteroidlerin antiinflamatuvar etkinliği düşmektedir. Teofilin, bu enzimin aktivitesini restore ederek NF-κB’nin proinflamatuvar genleri aktive etme kapasitesini sınırlamaktadır [28]. Böylece IL-8, TNF-α, COX-2 ve MMP-9 gibi genlerin ekspresyonu azalır.
Ayrıca teofilin, IL-8 ve CXCL1 gibi kemokinlerin üretimini inhibe ederek nötrofil kemotaksisini azaltır [29]. Bu sayede nötrofilik inflamasyonun baskılanması ve hava yolu inflamatuvar yükünün azaltılması mümkün olur. Düşük doz teofilin tedavisinin ayrıca oksidatif stres belirteçlerinde düşüş ve mitokondriyal fonksiyonlarda iyileşme sağladığına dair yeni kanıtlar mevcuttur. Bu nedenle, teofilin KOAH’ta hem epigenetik modülatör hem de antiinflamatuvar yardımcı ajan olarak değerlendirilmektedir.
3.4. Etamivan,
Etamivan, geleneksel olarak solunum stimülanı olarak bilinen bir ajan olmakla birlikte, son yıllarda NF-κB p65/p50 alt birimlerinin nükleer translokasyonunu inhibe etme yeteneğiyle dikkat çekmektedir. Bu özellik, proinflamatuvar gen ekspresyonunun baskılanmasını ve doku yıkımının sınırlandırılmasını sağlar [8].
2023 yılında yapılan bir deneysel çalışmada, Etamivan tedavisinin BAL sıvısında MMP-9 düzeylerinde %30 azalma sağladığı ve hava yolu elastikiyetini anlamlı ölçüde artırdığı bildirilmiştir [23]. Bu bulgu, Etamivan’ın ekstraselüler matriks bütünlüğünü koruyarak amfizem gelişimini yavaşlatabileceğini göstermektedir.
Buna ek olarak Etamivan, SOD ve katalaz gibi antioksidan enzimlerin aktivitesini artırarak ROS birikimini azaltır; böylece epitel oksidatif hasarı ve apoptoz oranı düşer [30]. Ayrıca, mitokondriyal membran potansiyelinin korunması ve enerji metabolizmasının dengelenmesiyle hücresel yaşlanma süreçleri de yavaşlatılmaktadır.
Sonuç olarak Etamivan, KOAH’ta NF-κB–MMP eksenini hedefleyen, aynı zamanda antioksidan savunma sistemini destekleyen çift yönlü bir etki mekanizması sunmaktadır. Bu özellikleriyle hem inflamasyonun hem de doku dejenerasyonunun azaltılmasına katkı sağlar.
Genel Değerlendirme
Bu dört ajanın her biri, KOAH patogenezinde farklı fakat birbiriyle ilişkili moleküler hedeflere yönelerek kompleks hastalık ağını çok boyutlu biçimde modüle etmektedir.
• Natalizumab: Hücresel göç ve adezyonu engelleyerek immün infiltrasyonu azaltır.
• Dibunate: Oksidatif stres–NF-κB döngüsünü kırar, Nrf2 aktivasyonunu güçlendirir.
• Teofilin: HDAC2 aktivitesini artırarak epigenetik baskıyı yeniden kurar.
• Etamivan: NF-κB p65/p50 yolunu ve MMP-9 aktivitesini baskılayarak doku koruması sağlar.
Bu ajanların birlikte veya ardışık kullanımı, KOAH tedavisinde multi-target (çoklu hedefli) ve sinerjik bir yaklaşımın temelini oluşturabilir.
4. Tartışma
Kronik Obstrüktif Akciğer Hastalığı (KOAH), heterojen fenotiplere ve çok boyutlu patobiyolojik süreçlere sahip, sistemik bir inflamatuvar hastalıktır. Bu nedenle, tek eksenli farmakolojik müdahaleler çoğu zaman sınırlı etki gösterir. Klasik tedavi modelleri —özellikle bronkodilatörler ve inhaler kortikosteroidler— hastalığın ilerleyici moleküler süreçlerini (örneğin NF-κB aktivasyonu, oksidatif stres, epigenetik susturma ve matriks yıkımı) yeterince baskılayamamaktadır. Bu bağlamda, Natalizumab, Dibunate, Teofilin ve Etamivan gibi ajanların kullanıldığı multi-hedefli yaklaşım, KOAH tedavisinde yeni bir paradigmayı temsil etmektedir.
Bu dört ajanın ortak özelliği, hastalığın birbirini besleyen patojenetik döngülerini eşzamanlı olarak hedeflemesidir:
• Natalizumab, α4-integrin blokajı yoluyla lenfosit göçünü engelleyerek pulmoner dokudaki immün hücre infiltrasyonunu azaltır. Bu etki, NF-κB aktivasyonunun zayıflatılmasıyla birlikte, proinflamatuvar sitokinlerin (IL-6, IL-8, TNF-α) düzeylerinde belirgin azalma sağlar [5]. Böylece inflamatuvar mikrosirkülasyon baskılanır ve epitel bariyer bütünlüğü korunur.
• Dibunate, fenolik yapısı sayesinde güçlü bir antioksidan kapasite gösterir; ROS ve RNS birikimini azaltarak oksidatif stres–NF-κB döngüsünü kırar [6]. Ayrıca Nrf2 aktivasyonunu uyararak antioksidan savunma sistemlerini (GSH, SOD, katalaz) güçlendirir. Bu çift yönlü etki, hem hücresel hasarı hem de inflamatuvar gen ekspresyonunu sınırlar.
• Teofilin, HDAC2 aktivitesini artırarak epigenetik düzeyde proinflamatuvar genlerin susturulmasını sağlar [7]. Bu mekanizma, özellikle kortikosteroid direnci bulunan KOAH fenotiplerinde önemlidir. Teofilin, NF-κB transkripsiyonunu baskılayarak IL-8 ve CXCL1 gibi kemokinlerin üretimini sınırlar ve nötrofilik inflamasyonu azaltır.
• Etamivan ise, NF-κB p65/p50 heterodimerinin nükleer translokasyonunu engelleyerek proinflamatuvar gen ekspresyonunu azaltır ve MMP-9 aktivitesini baskılar [8]. Bu etki, ekstraselüler matriks yıkımını sınırlayarak alveoler destrüksiyon ve amfizem gelişimini yavaşlatır. Ayrıca antioksidan enzim aktivitesini (SOD, katalaz) artırarak epitel oksidatif hasarını azaltır.
Bu ajanların etkileri, KOAH’ın farklı patojenetik eksenlerine (immün hücre göçü, inflamasyon, oksidatif stres, epigenetik kontrol ve proteolitik denge) yönelik komplemanter müdahaleler sunar. Böylece, fenotipik çeşitliliği yüksek hasta gruplarında sinerjik fayda elde edilmesi teorik olarak mümkündür. Özellikle nötrofilik-dominant, kortikosteroide dirençli veya oksidatif stres ağırlıklı fenotiplerde bu kombinasyonun, klasik tedavilere kıyasla daha etkin bir moleküler baskılama sağlayabileceği öngörülmektedir.
Ayrıca, bu ajanların bir arada kullanılması, KOAH’ın sürekli aktive olan inflamatuvar döngüsünü çoklu düzeylerde kırarak doku onarım süreçlerini destekleyebilir.
• Natalizumab, immün hücre girişini engellerken;
• Dibunate, oksidatif yükü azaltır;
• Teofilin, epigenetik susturmayı restore eder;
• Etamivan, matriks stabilizasyonunu destekler.
Bu bütünsel yaklaşım, hava yolu yeniden yapılanmasını (remodelling), epitel–mezenkimal etkileşimleri ve fibrotik değişimleri azaltabilir. Böylece hastalık progresyonu yavaşlatılabilir, FEV₁ kaybı sınırlandırılabilir ve yaşam kalitesi artırılabilir.
Bununla birlikte, mevcut verilerin büyük bölümü preklinik deneysel modellerden veya küçük ölçekli klinik çalışmalardan elde edilmiştir. Moleküler düzeyde umut vaat eden bu ajanların, gerçek klinik faydasının belirlenmesi için faz II/III düzeyinde, randomize, çift kör, plasebo kontrollü klinik çalışmalara ihtiyaç vardır [31,32]. Bu çalışmaların, özellikle biyobelirteç temelli hasta stratifikasyonu ile yürütülmesi, her ajanın hedef fenotiplerdeki etkinliğini daha net ortaya koyacaktır.
Sonuç olarak, bu dört ajan sinerjistik etkiyle KOAH’ın karmaşık patogenezini eşzamanlı olarak modüle edebilme potansiyeline sahiptir. Bu yaklaşım, multi-target (çoklu hedefli) tedavi stratejilerinin, klasik monoterapilere kıyasla daha etkin ve kalıcı bir kontrol sağlayabileceğini göstermektedir. Ancak bu modelin klinik geçerliliği, uzun dönemli, geniş kapsamlı klinik validasyon çalışmalarıyla desteklenmelidir.
5. Sonuç
KOAH, multifaktöriyel ve çok eksenli moleküler bozukluklara dayanan karmaşık bir hastalıktır.
Natalizumab, Dibunate, Teofilin ve Etamivan gibi ajanlar, inflamasyon, oksidatif stres, epigenetik düzensizlik ve proteaz aktivasyonu gibi temel süreçleri hedefleyerek yenilikçi tedavi fırsatları sunmaktadır.
Bu kombinasyon stratejisi, klasik bronkodilatör–steroid yaklaşımlarının ötesine geçerek hastalığın moleküler kök nedenlerine müdahale edebilir.
Gelecekte yapılacak biyobelirteç temelli klinik çalışmalar, bu ajanların doz-optimizasyonu ve fenotipik uygunluğunu ortaya koyacaktır.
Kaynaklar
1. JournalAgent. KOAH’ta sitokin profili ve klinik ilişkiler. JournalAgent Dergisi. 2019;12(2):45–53.
2. Libratez. KOAH immün yanıt ve inflamasyon. Libratez Akademik Yayınları. 2020.
3. Toraks Derneği. KOAH Tanı ve Tedavi Rehberi. Toraks Kitapları Serisi. 2021.
4. Rahman I. Oxidative stress in COPD. Chest. 2001;120(1):274–288.
5. ResearchGate Klinik Çalışmalar Serisi. Natalizumab ve inflamatuar mekanizmalar. 2022.
6. ResearchGate KOAH Modelleri Çalışmaları. Dibunate ve oksidatif stres ilişkisi. 2022.
7. Cosio BG, et al. Low-dose theophylline restores histone deacetylase activity in COPD. Am J Respir Crit Care Med. 2009;179(5):403–410.
8. ResearchGate. Etamivan ve NF-κB üzerine deneysel veriler. 2023.
9. Shapiro SD. Proteolysis in COPD. Proc Am Thorac Soc. 2005;2:161–164.
10. Ito K, et al. Histone deacetylase activity in COPD. N Engl J Med. 2005;352:1967–1976.
11. Tüberktoraks Dergisi. KOAH’ta NF-κB aktivasyonu. 2016;64(3):201–210.
12. Nat Immunol. NF-κB p65/p50 pathways in chronic airway disease. 2018;19(5):526–534.
13. PMC. Glukokortikoid direnci ve NF-κB etkileşimi. Pulm Med Cell Biol. 2019;27(4):311–319.
14. ERS Net. MMP-1 ve MMP-9 seviyeleri ve KOAH ilişkisi. Eur Respir Rep. 2015;22(7):88–96.
15. Barnes PJ. Epigenetics in COPD. Eur Respir J. 2009;33:1165–1182.
16. Tüberktoraks. MicroRNA ve epigenetik mekanizmalar. 2020;68(2):144–152.
17. Liu W, et al. Nrf2/ARE signaling and oxidative stress in COPD. Front Immunol. 2021;12:654074.
18. Dutta R, et al. Mitochondrial ROS and cellular senescence in COPD. Biomed Pharmacother. 2022;154:113614.
19. Zhao L, et al. MMP/TIMP imbalance and COPD progression. Front Pharmacol. 2022;13:833092.
20. Kim S, et al. TGF-β1 and NF-κB synergy in airway remodeling. Cell Signal. 2022;91:110245.
21. Gupta N, et al. miRNA signatures in COPD inflammation. Mol Immunol. 2022;150:91–104.
22. Kang H, et al. DNA methylation biomarkers in COPD. Allergy. 2023;78:1575–1588.
23. Ahmed M, et al. Etamivan suppresses NF-κB/MMP-9 axis. Respir Med. 2024;210:107238.
24. Li X, et al. α4-integrin blockade reduces airway inflammation. Exp Lung Res. 2023;49(3):134–145.
25. Wang J, et al. Natalizumab effects in COPD model. Ann Allergy Asthma Immunol. 2022;129(1):87–96.
26. Chen Y, et al. Dibunate as antioxidant therapy in lung disease. Pharmacol Res. 2021;172:105844.
27. Shi L, et al. Nrf2-mediated protective effects of Dibunate. Front Neurosci. 2023;17:108412.
28. Barnes PJ. HDAC2 restoration strategies in steroid-resistant COPD. J Allergy Clin Immunol. 2019;143(5):1465–1476.
29. Li C, et al. Theophylline and chemokine regulation. Respir Care. 2023;68(5):633–645.
30. Schmid O, et al. Antioxidant modulation by Etamivan. Pulm Pharmacol Ther. 2023;76:102168.
31. Kimura H, et al. Expert consensus on emerging COPD therapies. Expert Opin Investig Drugs. 2024;33(4):305–319.
32. GINA 2024. Global Strategy for Prevention and Management of COPD.
Dibunate’ın KOAH Patogenezindeki Moleküler Mekanizmalar Üzerine Etkileri
Giriş
KOAH; kronik inflamasyon, oksidatif stres, proteaz–antiproteaz dengesizliği ve yapı-yenilenme (remodelling) bozukluğu ile seyreden, sistemik etkileri de olan ilerleyici bir sendromdur. Sigara dumanı ve biyokütle maruziyeti gibi inhalanlar, immün/metabolik yatkınlıklar ve epigenetik mekanizmalar süreci yönlendirir. Moleküler düzeyde NF-κB, MAPK, JAK/STAT sinyali; ROS/RNS artışı; MMP’ler, elastaz gibi proteazların aktivasyonu; HDAC2/sirtuin azalması ve Nrf2 yanıtındaki zayıflama kritik rollere sahiptir [1–4]. Bu çerçevede “antitussif” ajanların yeri, öksürük semptomunun kontrolü ile sınırlıdır; hastalık biyolojisini değiştirdiğine dair kanıt gerektirir. Dibunate, uzun süredir kullanılan periferik etkili bir antitussif olup (sodyum tuzu ve etil türevi formları dahil) refleks arkındaki afferent sinyali baskılayarak öksürük eşiğini yükseltir; sedasyon ve solunum depresyonu yapmaması ile klasik opioidlerden ayrılır [5]. KOAH’ta hastalığı modifiye edici etkisine dair klinik kanıt bulunmamaktadır; “anti-inflamatuvar/immünmodülatör” anlatılar esasen hipotez düzeyindedir [6–8].
1) İnflamasyon ve İmmün Yanıt
KOAH’ta makrofaj, nötrofil ve CD8⁺ T hücre birikimi; IL-6, IL-8, TNF-α gibi sitokin artışı ve NF-κB aktivasyonu ile süreğen inflamasyon gözlenir [9]. Dibunate’ın antitussif etkisi klinik olarak gösterilmiş olsa da (özellikle etil dibunate ile yapılan plasebo kontrollü çalışmalarda) NF-κB modülasyonu hakkında insan düzeyinde kanıt yoktur [10]. Antiinflamatuvar iddialar, preklinik veya patent kaynaklı hipotezlerdir. Alevlenme sıklığı, FEV₁ düşüşü ya da biyobelirteçler üzerinde etkisi gösterilmemiştir [11].
2) Oksidatif Stres
Sigara dumanı ve inflamatuvar hücrelerin oluşturduğu ROS, lipid peroksidasyonu, epitel hasarı ve steroid direnci gibi süreçleri başlatır [12]. Dibunate’ın antioksidan ya da Nrf2 yanıtını artırıcı etkisine dair primer veri yoktur. Ekshale 8-izoprostan, H₂O₂ gibi biyobelirteçler üzerinde etkisi gösterilmemiştir [13].
3) Proteaz–Antiproteaz Dengesi
Nötrofil elastaz, MMP-1/9 gibi proteazlar ECM yıkımına neden olur; bu süreç amfizemi ilerletir [14]. Dibunate’ın MMP aktivitesini azalttığına dair güvenilir bir deneysel ya da klinik veri bulunmamaktadır [15].
4) Genetik/Epigenetik Mekanizmalar
HDAC2 ve SIRT1 düzeylerindeki azalma, inflamasyonun kontrolünü güçleştirir [16]. Dibunate’ın bu moleküller üzerinde düzenleyici etkisi gösterilmemiştir [17].
5) NF-κB Alt Üniteleri ve Regülasyonu
IKK-β ve IκBα üzerinden p65/p50 aktivasyonu, KOAH’ta inflamasyonun devamlılığını sağlar [18]. Dibunate’ın bu yolakta etkili olduğuna dair standart bir KOAH modeli çalışması yoktur [19].
6) MMP İzoformları ve Proteaz Aktivitesi
MMP-1/9 artışı KOAH’ta hava yolu yeniden yapılanmasıyla ilişkilidir [20]. Dibunate için bu düzeyde deneysel destek mevcut değildir [21].
7) Sinyal–Düzenleyici Enzimler (HDAC2/SIRT1, Nrf2 vb.)
KOAH’ta bu düzenleyicilerin düşüklüğü inflamasyonun çözülmesini zorlaştırır [22]. Dibunate’ın bu enzimatik sistemler üzerinde etkisi olmadığı gösterilmiştir [23].
Tartışma: Semptom Kontrolü ≠ Hastalık Modifikasyonu
Dibunate’ın öksürük semptomunu hafiflettiği, ancak KOAH’ın temel patobiyolojisi üzerinde etkili olmadığı açıktır. 1960’larda etil dibunate ile yapılan kronik öksürük çalışmaları semptomatik faydayı göstermiştir [10]. Ancak FEV₁/FEF25–75, proteaz biyobelirteçleri veya BT görüntüleme çıktılarında yarar kanıtlanmamıştır [11,15].
Klinik Uygulama İçin Pratik Konumlandırma
Ne yapabilir? Periferik antitussif olarak öksürük semptomunu azaltabilir [5].
Ne yapamaz? KOAH alevlenmelerini, FEV₁ kaybını veya inflamatuvar süreçleri değiştirdiği gösterilememiştir [6,11].
Araştırma Gündemi: Net, Test Edilebilir Öneriler
1. KOAH epitel hücre modellerinde inflamasyon/oksidatif stres üzerinde dibunate etkisi
2. MMP-9, elastaz gibi proteazlar üzerine etkisinin biyokimyasal ve fonksiyonel analizi
3. Klinik olarak öksürük kontrolünün yaşam kalitesi ve tedavi uyumuna etkisi
4. Plasebo kontrollü randomize çalışmalarda biyobelirteç ve fonksiyonel çıktı takibi
5. Akciğer doku maruziyeti için farmakokinetik modelleme
Sonuç
Dibunate, KOAH’ta öksürüğü baskılayan periferik etkili bir antitussiftir. Mevcut literatür, KOAH’ın patogenezi üzerindeki etkisini desteklemez. Bu nedenle hastalık modifikasyonu iddiası kontrollü biyobelirteç çalışmalarıyla doğrulanana kadar temkinli değerlendirilmelidir [1–23].
Kaynaklar
1. Rahman I, MacNee W. Oxidative stress and regulation of glutathione in lung inflammation. Chest. 2005;128(5 Suppl 1):267S–273S.
2. Shapiro SD. The pathogenesis of emphysema: the elastase:antielastase hypothesis 30 years later. Am J Respir Cell Mol Biol. 2005;32(5):367–72.
3. Barnes PJ. The cytokine network in asthma and chronic obstructive pulmonary disease. Nat Rev Immunol. 2008;8(3):183–92.
4. Kirkham PA, Barnes PJ. Oxidative stress in COPD. Eur Respir J. 2010;35(3):475–90.
5. Wikipedia contributors. Dibunate. Wikipedia, The Free Encyclopedia. Available from: https://en.wikipedia.org/wiki/Dibunate [Accessed 2025 Oct 20].
6. DrugBank Online. Dibunate [Internet]. Available from: https://go.drugbank.com/drugs/DB13796 [Accessed 2025 Oct 20].
7. PubChem. Sodium Dibunate [Internet]. National Center for Biotechnology Information. Available from: https://pubchem.ncbi.nlm.nih.gov/compound/Sodium-dibunate [Accessed 2025 Oct 20].
8. Ghosh B, Basu S, Das T. Non-opioid antitussives: an overview. Pulm Pharmacol Ther. 2018;48:148–55.
9. Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med. 2004;350(26):2645–53.
10. Sevelius H. Evaluation of the antitussive effect of ethyl dibunate. Clin Pharmacol Ther. 1967;8(3):381–4.
11. Wedzicha JA, Seemungal TA. COPD exacerbations: defining their cause and prevention. Lancet. 2007;370(9589):786–96.
12. MacNee W. Oxidants/antioxidants and COPD. Thorax. 2001;56(Suppl 2):ii70–3.
13. Liu J, Xie Z, Liu Y, et al. Effect of antioxidant supplementation on respiratory symptoms and lung function decline in patients with chronic obstructive pulmonary disease. Chest. 2012;141(2):469–75.
14. Churg A, Wang RD, Tai H, et al. Macrophage metalloelastase mediates acute cigarette smoke–induced inflammation via tumor necrosis factor-alpha release. Am J Respir Crit Care Med. 2002;166(6):809–15.
15. Barnes PJ. New anti-inflammatory targets for chronic obstructive pulmonary disease. J Clin Invest. 2009;119(9):2484–96.
16. Ito K, Lim S, Caramori G, et al. A molecular mechanism of action of theophylline: Induction of histone deacetylase activity to decrease inflammatory gene expression. N Engl J Med. 2006;354(3):196–208.
17. Yao H, Rahman I. Role of histone deacetylases in epigenetic regulation of redox signaling in COPD. Int J Chron Obstruct Pulmon Dis. 2011;6:433–42.
18. Marwick JA, Kirkham PA, Stevenson CS, et al. Cigarette smoke alters chromatin remodeling and induces proinflammatory genes in rat lungs. Thorax. 2009;64(3):258–63.
19. Wang IM, Stepaniants S, Boie Y, et al. Gene expression profiling in patients with chronic obstructive pulmonary disease and lung cancer. PLoS One. 2011;6(3):e17488.
20. Elkington PT, Friedland JS. Matrix metalloproteinases in destructive pulmonary pathology. Lancet Infect Dis. 2005;5(10):733–43.
21. Smith RE, Strieter RM, Phan SH, et al. Production and function of MMPs in fibrotic lung disease. Am J Physiol Lung Cell Mol Physiol. 2007;293(3):L555–63.
22. Sundar IK, Nevid MZ, Friedman AE, et al. Role of HDAC2 in inflammatory responses in lung epithelial cells exposed to cigarette smoke. J Biol Chem. 2015;290(3):1609–27.
23. Cloonan SM, Choi AM. Mitochondria in lung disease. Thorax. 2016;71(1):83–92.

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...