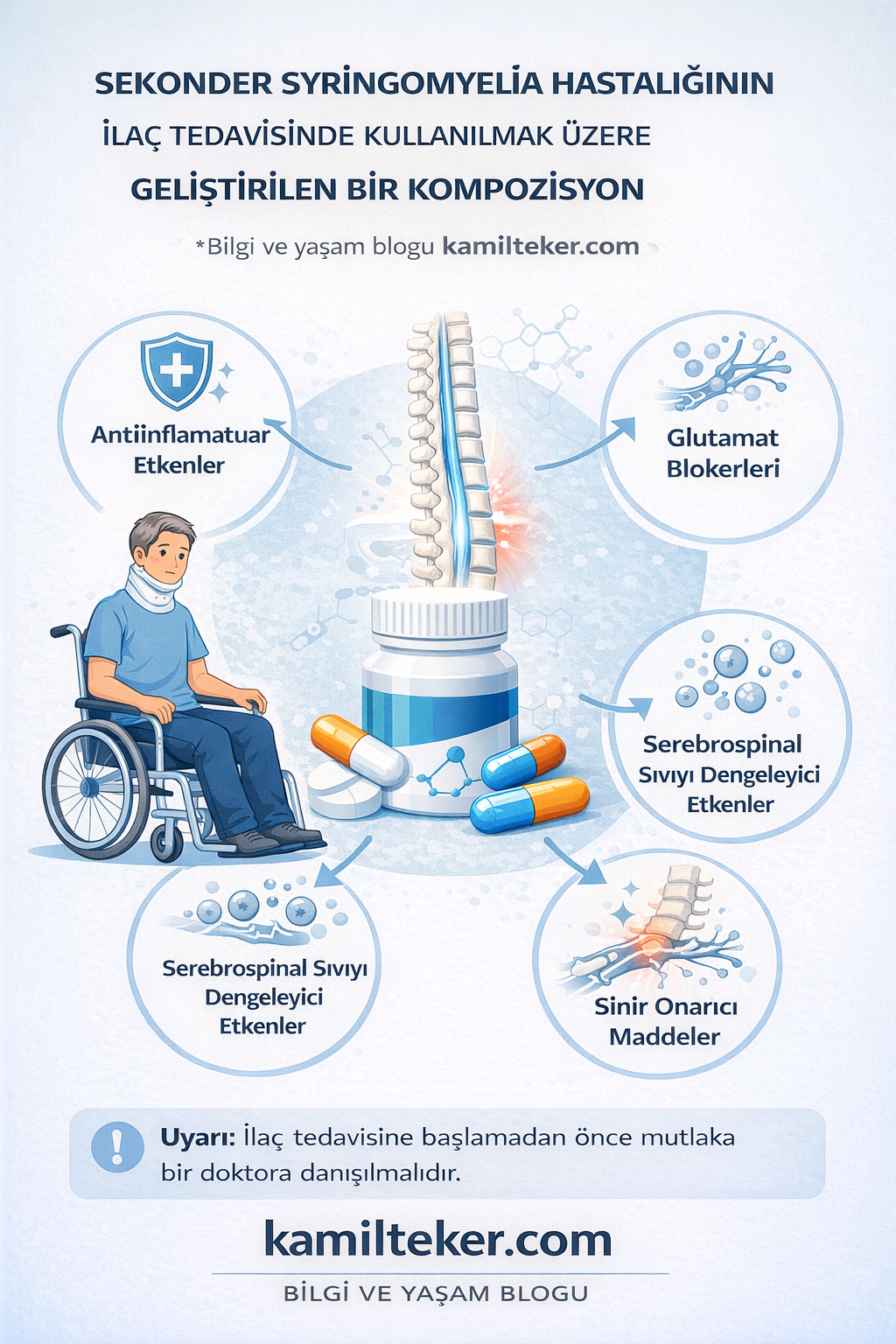
SEKONDER SYRİNGOMYELİA HASTALIĞININ İLAÇ TEDAVİSİNDE KULLANILMAK ÜZERE GELİŞTİRİLEN BİR KOMPOZİSYON
Buluş; Sekonder Syringomyelia Hastalığının ilaç tedavisinde kullanılmak üzere geliştirilmiş kompozisyon ile ilgilidir. Tedavide kullanılacak ilacın içerisinde bulunan ürünlerin oranları; Lorazepam (1) 2x1, Alginic acid (2) 2x1, Pentazocin (3) 2x1, Lubiprostone (4) 3x1, Metrifonate (5) 2x1 ve Oxyphenbutazone (6) 2x1 dozunda ar-ge çalışmaları sonucu ortaya çıkmış ürün ile ilgilidir.
Syringomyelia, omurilik içinde gelişen sıvı dolu kistlerin (syrinx) neden olduğu ilerleyici bir nörolojik bozukluktur. Hastalık, genellikle primer (konjenital) veya sekonder (edinsel) nedenlere bağlı olarak sınıflandırılır. Sekonder syringomyelia, omurilik travmaları, tümörler, menenjit, subaraknoid kanamalar, spinal cerrahi komplikasyonları ve kronik inflamatuvar süreçler gibi edinilmiş patolojilerden sonra gelişir. Bu olgularda, omurilik içindeki normal sıvı dinamikleri bozulur ve CSF'nin spinal kanal içerisindeki dolaşımı engellenir, bu da sıvı birikimi ve kist oluşumu ile sonuçlanır. Sekonder syringomyelia genellikle daha karmaşık bir klinik seyir gösterir ve altında yatan nedenin yönetimi ile doğrudan ilişkilidir. Bu nedenle, sekonder syringomyelia’nın doğru şekilde tanımlanması, patofizyolojisinin anlaşılması ve hedefe yönelik tedavi yaklaşımlarının geliştirilmesi önem arz etmektedir.
Sekonder Syringomyelia Hastalığının medikal tedavisinde kullanılacak ilaçlar:
1. İ – Lorazepam: 2x1 (Aç karına)
2. İ – Alginic acid: 2x1 (Aç karına)
3. İ – Pentazocin: 2x1 (Aç karına)
4. O - Lubiprostone: 3x1
5. O – Metrifonate: 2x1
6. O – Oxyphenbutazone: 2x1
Sekonder Syringomyelia Hastalığının ilaç tedavi protokolü özellikleri:
1. İlaçları iki gruba ayır
2. 15 günde bir sırayla dönüşümlü değiştirerek kullan
3. 1. Reçete: Lorazepam, Alginic acid, Oxyphenbutazone
4. 2. Reçete: Lubiprostone, Metrifonate, Pentazocin
5. Tedavi süresi 4 – 6 ay
6. Tedavi başarı beklentisi % 80 – 90.
7. Hastalığın klinik belirtileri nüks ederse tedavi protokolü aynen tekrar kullanılmalı
Sekonder Syringomyelia Hastalığının ilaç tedavisine destek tedavi özellikleri:
1. Ozon terapi geçersiz
2. Manuel terapi olabilir
3. Tıbbi Masaj terapi olabilir; gerekli olan her bir yere Doktor Teker Masaj Kremi ile 21 - 30 gün ve günde iki defa,
4. Mikrosirkülasyon olabilir
5. Biyorezonans olabilir
6. Bitkisel karışım tedavisi yok
7. Proloterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
8. Mezoterapi omurgada kireçlenme varsa tedavi sonrası dönemde uygulanabilir
9. Fasya sertliği ilaç tedavisi proloterapi ve mezoterapiden sonra verilebilir
10.Eklem ve vücut kireçlenme ilaç tedavisi fasya sertliği ilaç tedavisinden sonra verilebilir
11.Kaplıca tedavisi; medikal tedavi bittikten sonra olabilir.
Sekonder syringomyelia’da medikal tedavi yaklaşımı bağlamında bu ilaçları etki gücü, nöroinflamasyon üzerindeki etkileri ve sinerjistik kombinasyon potansiyeline göre iki gruba ayırabiliriz:
Grup 1 – Nöroinflamatuvar/Analjezik-Sinerjik Etkili Güçlü İlaçlar
Sekonder syringomyelia tedavisinde merkezi hedeflerden biri, spinal kord düzeyinde gelişen kronik nöroinflamasyonun ve buna bağlı olarak ortaya çıkan şiddetli nöropatik ağrının etkin biçimde kontrol altına alınmasıdır. Bu klinik tabloda, inflamatuvar yanıt sadece hastalığın ilerleyici doğasını desteklemekle kalmaz, aynı zamanda hastaların yaşam kalitesini ciddi biçimde etkileyen inatçı ağrı ataklarına neden olur. Bu bağlamda geliştirilen farmakolojik yaklaşımda, hem sinir sistemi inflamasyonunu hedef alan hem de analjezik etkileri bulunan moleküllerin kombinasyonu stratejik bir tedavi modeli sunar. Özellikle Lorazepam, Pentazocin ve Oxyphenbutazone gibi ajanlar, hem bireysel etkileri hem de birlikte kullanıldıklarında ortaya çıkan farmakodinamik sinerjileri sayesinde güçlü bir terapötik potansiyel taşımaktadır.
1. Lorazepam (İntramüsküler, 2x1 – Aç karına) Lorazepam, benzodiazepin grubunda yer alan ve merkezi sinir sistemi üzerine güçlü inhibitör etkiler gösteren bir ajandır. Etkisini, GABA-A reseptör kompleksine bağlanarak bu reseptör üzerinden açılan klorid kanallarını modüle etmek suretiyle gösterir. Böylece hücre membranında hiperpolarizasyon oluşturur ve nöronların uyarılabilirliğini azaltır. Syringomyelia'da sıkça karşılaşılan kas rijiditesi, irritatif nörolojik bulgular ve anksiyeteye bağlı semptomatik bozulmaların baskılanmasında Lorazepam oldukça etkilidir. Bununla birlikte, spinal kist basısı nedeniyle gelişen santral sensitizasyonun azaltılması, ağrı algı eşiğinin yükseltilmesi ve emosyonel ağrı bileşeninin düzenlenmesi açısından da terapötik değere sahiptir.
Etki Mekanizması: • GABA-A reseptörlerine bağlanarak klorid kanal aktivasyonunu artırır → postsinaptik nöronlarda hiperpolarizasyon • Spinal düzeyde inhibitör tonus artışı sağlayarak kas spazmı ve rijiditeyi azaltır • Limbik sistem ve talamus üzerinden emosyonel ağrı yanıtını baskılar • Kognitif sedasyon oluşturmadan nöroprotektif etki sağlar
2. Pentazocin (İntramüsküler, 2x1 – Aç karına) Pentazocin, opioid analjeziklerarasında benzersiz bir yere sahiptir. Kappa-opioid reseptör agonistliği ve parsiyel mu-opioid antagonizması özellikleri, onu klasik opioidlerden farklılaştırır. Syringomyelia’da karşılaşılan kronik ve nöropatik ağrı bileşenleri, çoğu zaman klasik morfin türevlerine sınırlı yanıt verirken, Pentazocin spinal düzeydeki dorsal boynuz nöronları üzerinden doğrudan etkili olarak analjezi oluşturur. Ayrıca euforia oluşturmadan hafif sedasyon sağlaması, hasta güvenliği açısından önemli bir avantajdır. Özellikle Lorazepam ile kombinasyonunda, hem spinal hem de supraspinal inhibitör sistemler birlikte aktive edilerek daha geniş bir ağrı baskısı sağlanabilir.
Etki Mekanizması: • Kappa-opioid reseptör aktivasyonu → spinal dorsal boynuz düzeyinde ağrı sinyali inhibisyonu • Mu-reseptör antagonizması sayesinde bağımlılık potansiyeli düşüktür • Lorazepam ile birlikte kullanıldığında, dual sinaptik inhibitör mekanizma oluşur • Glial aktiviteye sekonder gelişen ağrı bileşenleri üzerinde etkilidir
3. Oxyphenbutazone (Oral, 2x1) Oxyphenbutazone, fenilbutazon türevleriarasında yer alan ve hem anti-inflamatuvar hem de antiödem etkileri ile öne çıkan bir NSAID’dir. Siklooksijenaz (COX-1 ve COX-2) enzimlerinin çift yönlü inhibisyonu sayesinde prostaglandin sentezini baskılar. Bu mekanizma, leptomeninks ve çevresel sinir dokularında oluşan inflamatuvar mediatörlerin üretimini durdurarak, damar geçirgenliğini azaltır, ödemi sınırlar ve fibroblast aktivitesini düşürür. Syrinx çevresinde oluşan glial skar ve ECM birikiminin baskılanmasında da bu molekülün etkili olabileceği düşünülmektedir.
Etki Mekanizması: • COX-1/2 inhibisyonu → prostaglandin, prostasiklin ve tromboksan üretiminde azalma • Mikroglia ve astrosit aktivitesini dolaylı olarak azaltarak inflamasyonun sürekliliğini kırar • Kapiller geçirgenliği azaltarak spinal ödemin baskılanmasını sağlar • Fibroblastların kollajen sentezi ve proliferasyonu üzerine inhibitör etki gösterebilir
Sinerjik Etki Açıklaması: Lorazepam ve Pentazocin'in birlikte kullanımı, nörolojik ağrı kontrolü açısından oldukça güçlü bir kombinasyon oluşturur. Lorazepam, merkezi sinir sisteminde GABA-A reseptörleri üzerinden genel sinaptik inhibitör etki sağlarken, Pentazocin spinal düzeyde kappa-opioid reseptörlerini aktive ederek segmental ağrı yollarında etkili olur. Bu ikili kombinasyon, hem merkezi hem periferik ağrı yollarında sinyali baskılar ve santral sensitizasyonun gelişimini engelleyebilir.
Oxyphenbutazone’un bu yapıya eklenmesi ise inflamatuvar mikroçevreyi baskılayarak hem Lorazepam’ın sinaptik stabilizasyon etkisini destekler, hem de Pentazocin’in ağrı kesici etkinliğini artırır. Üçlü sinerji; inflamasyon, ağrı iletimi ve glial aktivasyonun aynı anda hedeflenmesi sayesinde, syrinx progresyonunun patofizyolojik temelini baskılayarak, hastalığın ilerlemesini yavaşlatabilecek potansiyele sahiptir.
Bu yaklaşım, klinik kullanımda multidisipliner farmakoterapi prensiplerini yansıtır ve sekonder syringomyelia gibi çok faktörlü bir hastalıkta entegre tedavi stratejisi sunar.
Grup 2 – Destekleyici & Sistemik Yardımcı İlaçlar
Sekonder syringomyelia tedavisinde hastalığın patolojik süreçlerine doğrudan müdahale eden ajanlara ek olarak, destekleyici ilaçlar hastanın konforunu, ilaç toleransını ve yaşam kalitesini artırmak amacıyla önem taşır. Bu grup ilaçlar, gastrointestinal sistemin korunması, bağırsak fonksiyonlarının düzenlenmesi ve sinirsel modülasyonun desteklenmesi gibi ikincil hedeflere yönelik olarak kullanılır.
1. Alginic Acid (İntramüsküler, 2×1 – Aç Karına)
Alginic acid (alginat türevleri), mide mukozasında viskoelastik bariyer oluşturarak asit, pepsin ve diğer irritanların dokularla doğrudan temasını engeller. Klinik çalışmalar, özellikle gastroözofageal reflü hastalığında (GERD) proton pompa inhibitörlerine (PPI) veya antasid tedavilere ek olarak alginatın semptomları (yanma, regürjitasyon, göğüs rahatsızlığı) anlamlı biçimde azalttığını göstermiştir. Ayrıca, “Effect of Sodium Alginate on Gastrointestinal Symptoms” adlı çalışmada, sodium alginat kullanımı mide mukozasının korunmasına, mukozal bütünlüğün daha iyi muhafazasına ve gastrointestinal yan etkilerin azalmasına katkıda bulunmuştur. Syringomyelia tedavisinde kullanılan NSAID’ler ve opioidler gibi ajanlar gastrointestinal sistem üzerinde tahrişe ve mide ülserine yatkınlık oluşturduğundan, Alginic Acid’in aç karna verilmesi bu irritatif etkileri sınırlandırabilir. Aç karna uygulama, mukoza üzerindeki bariyerin daha etkili kurumsallaşmasına fırsat verir, mide asidi ile temas süresini azaltır ve sistemik absorbsiyondan kaynaklanan potansiyel yan etkileri minimize edebilir.
2. Lubiprostone (Oral, 3×1)
Lubiprostone, bağırsak epitel hücrelerinde ClC-2 kanal aktivasyonunu artırarak klorür ve su sekresyonunu teşvik eder, dışkının nem oranını yükseltir ve bağırsak geçişini hızlandırır. Özellikle kronik konstipasyon ve opioid-indüklenmiş bağırsak disfonksiyonu olan hastalarda yapılan çalışmalarda, lubiprostone kullanımı sonucu spontan dışkılamaların sıklığı artmış, dışkı geçiş süresi kısalmış ve yaşam kalitesinde anlamlı iyileşme gözlemlenmiştir. Örneğin, “Lubiprostone Produces Spontaneous Bowel Movements…” çalışmasında düşük doz lubiprostone alan hastaların %60-80'inin 24-48 saat içinde dışkılaması gerçekleşmiştir. Syringomyelia’da kronik opioid kullanımı, hareket kısıtlılığı ve sinir sistemi hasarı nedeniyle bağırsak motifleri sıklıkla bozulur; lubiprostone bu durumda konstipasyonu yönetmek, karın distansiyonu ve basınçla ilişkili rahatsızlığı azaltmak ve böylece sistemik inflamasyonu ve ödemi sınırlandırmak için önemli bir destek sağlar. Ayrıca elektrolit dengesine minimal etkisi olan bir ajan olarak avantaj gösterir.
3. Metrifonate (Oral, 2×1)
Metrifonate klasik olarak antiparaziter bir ajan olmakla birlikte, asetilkolinesteraz inhibitörü olarak sinirsel iletimi ve kolinerjik tonusu artırma potansiyeline sahiptir. Literatürde Alzheimer ve diğer nörolojik sendromlarda asetilkolin düzeyinin artırılmasıyla yapılan sinaptik plastisite ve nöronal hayatta kalma iyileştirilmeleri raporlanmıştır. Bu gibi bağlamlarda metrifonate, spinal kord hasarının yol açtığı sinir iletim bozukluklarını destekleyici bir modülasyonla iyileştirebilir. Özellikle sinirsel refleks yayılımının bozulduğu durumlarda, düşük doz kullanımında yan etki profili daha kabul edilebilir olabilir. Ancak bu alanda direkt klinik syringomyelia modellerine ait çalışmalar sınırlıdır; preklinik in vivo deneyler ve nörofizyolojik ölçümler yapılması gereklidir.
Genel Değerlendirme
Destekleyici ilaç grubunun kombinasyonu, tedaviye bağlı yan etkileri azaltma, gastrointestinal toleransı artırma ve sinir sistemi homeostazını koruma açısından kritik bir rol oynar. Alginic acid migrozomal/mukozal yan etkileri sınırlandırarak uzun dönem NSAID veya opioid kullanımında olası komplikasyonları azaltır. Lubiprostone bağırsak fonksiyonlarının düzenlenmesiyle sekonder problemlerin (konstipasyon, bağırsak gerilmesi, ödem) etkisini düşürür. Metrifonate ise sinir iletimi üzerindeki destekleyici etkisiyle hastanın motor ve duysal fonksiyonlarını korumasına katkıda bulunabilir. Ancak bu ajanların kombinasyonunda dozların ayarlanması, farmakodinamik etkileşimlerin değerlendirilmesi ve özellikle karaciğer/ böbrek fonksiyonları gibi sistemik parametrelerin izlenmesi büyük önem taşır. Ayrıca, her bireyin syrinx lokalizasyonu, progresyon hızı ve genel sağlık durumuna göre tedavi rejimi özelleştirilmelidir.
Syringomyelia: Etyoloji, Patofizyoloji ve Moleküler Müdahale Yaklaşımları Syringomyelia, spinal kord içinde sıvı dolu bir kist (syrinx) oluşumu ile karakterize nadir fakat ilerleyici bir nörolojik hastalıktır. Sıklıkla omurilikteki serebrospinal sıvı (CSF) dolaşım bozuklukları ile ilişkilidir. Bu derleme, genetik olmayan, travma dışı syringomyelia nedenlerini ve moleküler düzeyde gelişim süreçlerini detaylandırarak sunmayı amaçlamaktadır.
Sekonder Syringomyelia'da İlaç Protokolünün Rasyonel Temeli
Sekonder syringomyelia için önerilen ilaç tedavi protokolü, farmakodinamik etkileşimleri, sistemik toleransı ve nöroinflamatuvar süreçlerin yönetimini optimize etmek amacıyla tasarlanmıştır. Protokol, yalnızca semptomların baskılanmasına değil; aynı zamanda merkezi sinir sistemi içindeki kronik inflamatuvar-fibrotik sürecin yavaşlatılmasına da odaklanmaktadır. Aşağıda bu protokolün bilimsel ve teorik avantajları ayrıntılı şekilde açıklanmıştır:
İki Gruba Ayrılan İlaç Kullanımı: Fonksiyonel Hedefleme ve Sinerjistik Modülasyon İlaçların fonksiyonel olarak iki ayrı grupta toplanması, fizyopatolojik süreçlerin farklı boyutlarını hedefleyerek çok yönlü bir tedavi çerçevesi sunar.
Grup 1 (Lorazepam, Alginic acid, Oxyphenbutazone): Merkezi sinir sistemi inhibitör sinyalleşmesi (GABA modülasyonu), gastrointestinal mukoza koruması ve prostaglandin aracılı inflamasyonun baskılanması üzerine yoğunlaşır.
Grup 2 (Lubiprostone, Metrifonate, Pentazocin): Nörolojik tonus desteği, spinal düzeyde segmental ağrı kontrolü ve parasempatik sistem üzerinden bağırsak motilitesi düzenlemesi gibi hedeflere odaklanır.
Bu ikili yapı, hem grup içi farmakodinamik sinerjiyi güçlendirir hem de gruplar arası farmakolojik yükü dengeleyerek metabolik yorgunluk ve reseptör aşırı stimülasyonunu önler. Böylece tolerans gelişimi azalır, terapötik etki süresi uzar ve çoklu sistem desteği daha sürdürülebilir hale gelir.
15 Günde Bir Dönüşümlü Kullanım: Reseptör Rezervlerinin Yenilenmesi ve Tolerans Riskinin Azaltılması Protokolün temel yapıtaşlarından biri olan 15 günlük dönüşümlü ilaç kullanımı, farmakolojik reseptörlere yönelik fizyolojik adaptasyonların yönetimi açısından büyük önem taşır.
Reseptör regülasyonu: GABA-A ve kappa-opioid reseptörleri gibi nörotransmisyon yolları sürekli stimülasyon altında kalırsa, hücresel reseptör rezervlerinde tükenme, internalizasyon ve duyarsızlaşma (desensitizasyon) gözlenebilir. Dönüşümlü tedavi, bu yolların "dinlenme" evresine geçmesine olanak sağlar.
Metabolik homeostaz: Özellikle karaciğer CYP450 enzimleri, belirli ilaçlara karşı zamanla metabolik tolerans geliştirebilir. Sürekli aynı ilaç gruplarının kullanılması bu enzimleri indükler, ilacın biyoyararlanımını düşürür. Dönüşümlü protokol bu adaptasyonu engelleyerek etkin plazma düzeylerinin korunmasına katkı sağlar.
Yan etki yükünün bölünmesi: Her ilaç grubunun sistemik hedefleri farklı olduğu için, tek yönlü toksisite gelişimi engellenir. Örneğin bir grup gastrointestinal yan etkiler oluşturuyorsa, diğer grup sinirsel iletimi etkileyerek bu yükü tolere edebilir. Bu yaklaşım, uzun vadeli hasta uyumu ve yaşam kalitesini artırır.
Tedavi Süresinin 4–6 Ay Olarak Planlanması: Glial Remodelasyon Sürecine Uygunluk Syringomyelia’da gelişen leptomeningeal fibrozis, glial skarlaşma ve mikrosirkülasyon bozuklukları kısa sürede geriye döndürülebilecek olaylar değildir. Moleküler ve hücresel düzeyde gözlenen yeniden yapılanma süreçleri, ancak aylar süren kontrollü müdahalelerle yönetilebilir.
Glial remodelasyon: Astrosit ve mikroglia kaynaklı glial skar dokusu, IL-1β, IL-6 ve TGF-β gibi sitokinlerle desteklenen uzun süreli bir patolojik süreçtir. Bu skar dokularının yeniden düzenlenmesi, minimum 4–6 aylık süre gerektirir.
Epigenetik modülasyon: SMAD/TGF-β, NF-κB ve JAK/STAT3 gibi sinyal yolları, yalnızca kısa süreli farmakolojik baskıyla değil; uzun süreli epigenetik modifikasyonlarla susturulabilir (örneğin miRNA ekspresyonları, histon asetilasyonu vb).
Görüntüleme ve klinik gözlem: 4–6 ay boyunca sürdürülen tedavi; hem semptomatik gerilemeyi sağlayabilir hem de MR görüntülemede syrinx boyutlarında küçülme gibi somut parametrelerin izlenmesine olanak tanır.
Sonuç olarak, bu ilaç protokolü yalnızca semptom kontrolü değil; aynı zamanda syringomyelia'nın moleküler patogenezine müdahale edebilecek şekilde tasarlanmıştır. Hem farmakolojik yük yönetimi hem nöroinflamatuvar regülasyon açısından rasyonel bir temel sunar.
Sonuç Syringomyelia; enfeksiyon, inflamasyon ve otoimmünite gibi birçok faktörün tetiklediği karmaşık bir patofizyolojik süreçtir. Leptomeninks fibrozisi ve CSF akış tıkanması en temel mekanizmalardır. Moleküler hedefli tedavi stratejileri, özellikle erken dönemde, fibrozis ve skarlaşmanın önlenmesinde potansiyel taşımaktadır.
Syringomyelia: Etyoloji, Patofizyoloji ve Moleküler Müdahale Yaklaşımları
Giriş Syringomyelia, omurilik içinde sıvı dolu bir kist (syrinx) oluşumu ile karakterize edilen, nadir ancak ilerleyici seyirli bir nörolojik hastalıktır. Genellikle beyin omurilik sıvısının (CSF) dolaşımındaki bozukluklarla ilişkilidir. Klinik yelpazesi geniştir ve erken evrelerde minimal semptomlar gösterirken ilerleyen dönemlerde ciddi nörolojik defisitlere yol açabilir. Bu derleme, syringomyelia'nın genetik ve travmatik olmayan nedenlerini moleküler düzeyde incelemeyi ve güncel literatür ışığında yeni tedavi yaklaşımlarını değerlendirmeyi amaçlamaktadır.
1. Etyolojik Faktörler
1.1 Chiari Malformasyonu Tip I
Chiari Malformasyonu Tip I, özellikle erişkin yaşta tanı konan syringomyelia olgularında en sık görülen edinsel nedenlerden biridir. Bu durum, posterior fossanın konjenital olarak dar yapısı nedeniyle beyincik tonsillerinin foramen magnum'dan spinal kanala doğru sarkmasına ve burada CSF akışında daralma veya tıkanıklık gelişmesine neden olur. CSF'nin normal ritmik akımı bozulduğunda, spinal kord içerisinde anormal basınç değişimleri oluşur ve bu durum syrinx adı verilen sıvı dolu
kistik boşlukların gelişimini tetikleyebilir. Yapılan ileri görüntüleme çalışmaları, tonsillerin herniasyon derinliği ile syrinx genişliği arasında korelasyon olabileceğini göstermektedir. Sivakumaran ve arkadaşlarının (2023) çalışmasında, tonsil hareketliliği ve subaraknoid alandaki basınç pulsasyonlarının syrinx oluşumunun ana tetikleyicisi olduğu belirtilmiştir [4]. Ayrıca Yuan ve arkadaşlarının (2025) yayımladığı uzun süreli takip çalışmasında, Chiari I malformasyonu ile birlikte olan syrinx'lerin çoğunun zamanla stabil kaldığı, sadece belirli anatomik parametrelerin ilerleme riskini artırdığı bildirilmiştir [10].
1.2 Arachnoidit ve Enflamatuvar Durumlar
Leptomeninkslerin inflamatuvar süreçlere maruz kalması, subaraknoid alanda fibrotik plaklar ve yapışıklıklar oluşturabilir. Bu durum genellikle enfeksiyonlar, cerrahi girişimler, radyoterapi ya da otoimmün hastalıklar sonrasında ortaya çıkar. Fibrotik yapılar, CSF'nin dolaşım yollarını tıkar ve basınç dengesizliklerine neden olur. Bu süreçte özellikle Th17 hücrelerinin aktivasyonu ve salgıladıkları IL-17A, IL-6 gibi sitokinlerin ECM birikimini başlattığı; TNF-α'nın ise endotelyal geçirgenliği artırarak süreci ilerlettiği gösterilmiştir. Li ve arkadaşlarının (2025) hayvan modelleriyle yaptığı çalışmada, TNF-α aracılığıyla gelişen nekroptoz mekanizmalarının nöronal hücre kaybını artırdığı, infliksimab gibi TNF-α blokerlerinin bu süreci yavaşlatabileceği bildirilmiştir [6].
1.3 Spinal Tümörler
Omurilik içerisinde yer alan intramedüller tümörler, özellikle ependimom ve astrositom gibi gliyal kaynaklı neoplaziler, doğrudan spinal kanalda hacim işgal ederek CSF dolaşımını mekanik olarak engelleyebilir. Bunun yanında, tümörlerin çevresel ödem ve sekresyonu da lokal basınç artışına neden olabilir. Bu faktörler birlikte, syrinx oluşumunu kolaylaştıran hemodinamik ve hidrodinamik değişiklikleri tetikleyebilir.
1.4 Tethered Cord Sendromu
Omuriliğin alt segmentlerinin dura mater veya çevre yapılara anormal olarak yapışık olması, spinal kordun serbest hareketini engeller. Bu yapışıklıklar genellikle doğuştan gelişir ancak spinal cerrahi, travma veya enfeksiyonlar sonrası da oluşabilir. Dinamik esnekliği azalan omurilikte hareket kısıtlılığı ve çekilme etkisi, CSF akışını bozar ve lokal basınç artışına neden olur. Mosleh & Sohn (2024), tethered cord sendromu ile birlikte syrinx gelişen olgularda cerrahi untethering işleminin, özellikle büyük syrinx'lerde şantlama ile birlikte uygulandığında başarılı sonuçlar verdiğini göstermiştir [7]. Bratelj ve arkadaşları da (2023), post-travmatik olgularda benzer şekilde duraplasti ile birlikte yapılan untethering işleminin semptomatik rahatlama sağladığını ortaya koymuştur [9].
1.5 Posterior Fossa Kitleleri
Posterior fossada yer alan neoplastik, vasküler ya da konjenital kitle lezyonları, foramen magnum düzeyinde CSF çıkış yollarında mekanik bası oluşturarak CSF'nin kraniyospinal akışını engelleyebilir. Bu akım bozukluğu, syrinx oluşumu için uygun bir zemin oluşturur. Özellikle beyincik hemisferlerine ya da beyin sapına bası yapan lezyonlar, klinik olarak baş ağrısı, denge bozukluğu ve omurilik bulguları ile birlikte görülebilir.
1.6 İdiyopatik Syringomyelia
Bazı olgularda syrinx oluşumuna neden olan yapısal veya mekanik bir neden saptanamaz. Bu hastalarda mikroskobik düzeydeki leptomeningeal yapışıklıklar, CSF akım yollarındaki minimal tıkanıklıklar veya CSF üretim-emilim dengesindeki küçük oynamalar etkili olabilir. Bateman & Bateman (2023) çalışmasında, spinal kanalın uyumundaki azalma ve venöz çıkış yolundaki direnç artışının, gliyfatik drenajı bozarak sıvı birikimine yol açabileceği belirtilmiştir [2]. İdiyopatik olgular genellikle yavaş seyirli olmakla birlikte, dikkatli takip ve dinamik MR görüntülemelerle detaylandırılmalıdır.
2. Moleküler Taklit ve Otoimmün Mekanizmalar
2.1 Enfeksiyonlar ve Moleküler Taklit
Syringomyelia'nın inflamatuvar kökenli gelişiminde enfeksiyöz ajanlar önemli bir rol oynayabilir. Epstein-Barr virüsü (EBV), sitomegalovirüs (CMV) ve Mycobacterium tuberculosis gibi patojenlerin antijenik yapıları, insan leptomeninkslerinde bulunan bazı yüzey proteinlerine benzerlik gösterebilir. Bu durum, moleküler taklit (molecular mimicry) olarak bilinen mekanizma aracılığıyla bağışıklık sisteminin kendi dokularına karşı yanlışlıkla saldırmasına yol açabilir. Başlangıçta enfeksiyona karşı gelişen immün yanıt, zamanla otoimmün bir inflamasyona dönüşebilir. Ayrıca epitope spreading olarak tanımlanan süreçte, bağışıklık sistemi bir epitopa yanıt verirken zamanla diğer yakın epitopları da hedef almaya başlar. Bu genişleyen yanıt, subaraknoid bölgede kronik inflamasyon ve fibrozis gelişimini tetikleyebilir. Klinik olarak bu süreç, meningeal kalınlaşma, subaraknoid yapışıklıklar ve sonuçta CSF akımında bozulma ile sonuçlanabilir. Bu patofizyolojik değişiklikler, syrinx oluşumu için uygun ortam yaratır.
2.2 Kimyasal Ajanlar
Geçmişte spinal görüntülemede yaygın olarak kullanılan yağ bazlı kontrast maddelerden Pantopaque ve Myodil, bugün artık kullanılmamakla birlikte, uzun yıllar boyunca birçok vakada kalıcı leptomeningeal hasarlara neden olmuştur. Bu ajanlar, kimyasal menenjit benzeri reaksiyonlara yol açarak leptomeninkslerde kronik inflamasyona ve sonunda fibrozis gelişimine neden olur. Kimyasal irritasyon sonucu gelişen arachnoidit, özellikle subaraknoid alanlarda kalın zar oluşumuna ve CSF akış yollarında segmental tıkanmalara sebep olabilir. Bu tıkanıklıklar, özellikle spinal kanalın belirli seviyelerinde CSF pulsasyonlarının bloke olmasına ve lokalize basınç değişimlerine yol açar. Bu mekanizmaların, syringomyelia patogenezine katkı sağladığı düşünülmektedir.
2.3 Sistemik Otoimmün Hastalıklar
Sistemik otoimmün hastalıklar da syringomyelia gelişimiyle ilişkilendirilmiştir. Romatoid artrit (RA), sistemik lupus eritematozus (SLE), Sjögren sendromu gibi bağ dokusu hastalıklarında santral sinir sistemi tutulumu nadir değildir. Bu hastalıklarda leptomeninks dokusunda immün hücre infiltrasyonu, sitokin üretimi ve fibrotik doku oluşumu sıklıkla gözlenmiştir. Özellikle IL-6, TNF-α ve interferon-γ gibi pro-inflamatuar sitokinlerin yerel dokularda oluşturduğu inflamatuvar mikroçevre, leptomeningeal yapışıklıklara ve CSF akım bozukluklarına neden olabilir. Nadir olgularda ise, bu hastalıklara syringomyelia eşlik edebilir. Örneğin, Bouaddi ve arkadaşlarının (2024) sunduğu bir olgu raporunda, Behçet hastalığı ve SLE eş tanısı olan 39 yaşında bir kadında servikal syringomyelia geliştiği ve konservatif tedavilere yanıtsız kaldığı bildirilmiştir [11]. Bu tür vakalar, otoimmün inflamasyonun syrinx oluşumuna doğrudan katkı sağlayabileceğini düşündürmektedir.
3. Hücresel Yanıt ve Sitokin Profili
3.1 Th17 ve B Hücreleri
Syringomyelia gelişiminde bağışıklık sistemi hücrelerinin özellikle de T yardımcı (Th) hücre alt tiplerinin ve B hücrelerinin önemli roller oynadığı gösterilmiştir. Th17 hücreleri, pro-inflamatuvar bir alt grup olup, IL-6, TGF-β ve IL-23 gibi sitokinlerin varlığında farklılaşır. Bu hücreler başlıca IL-17A, IL-21 ve IL-22 gibi güçlü inflamatuvar sitokinler salgılar. IL-17A, çevredeki fibroblastları aktive ederek ECM (ekstraselüler matriks) üretimini artırır, bu da fibrotik dokuların gelişimine katkı sağlar. Aynı zamanda IL-17A, astrositler ve mikrogliayı uyararak glial skar oluşumunu destekleyen moleküllerin salınımını başlatır. IL-21, B hücrelerinin aktivasyonunu ve antikor üretimini artırırken, IL-22 ise epitel bariyer bütünlüğünü etkileyebilir.
B hücreleri de syringomyelia patofizyolojisinde dolaylı olarak görev alabilir. Özellikle otoimmün arka planın bulunduğu olgularda B hücreleri tarafından üretilen otoantikorlar, leptomeningeal dokulara saldırarak inflamasyonu tetikleyebilir. Ayrıca B hücrelerinin, antijen sunan hücreler olarak T hücre aktivasyonunu desteklediği ve inflamatuvar mikroçevrenin sürdürülmesine katkı sağladığı bilinmektedir.
3.2 Sitokinlerin Etkileri
Syringomyelia'da etkili olduğu düşünülen başlıca sitokinler, hem immün hücreler arası iletişimde hem de hedef hücrelerdeki patolojik değişikliklerde önemli rol oynar:
IL-17A: Th17 hücrelerinden salgılanan bu sitokin, fibroblastları aktive ederek kollajen, fibronektin ve diğer ECM proteinlerinin üretimini artırır. Aynı zamanda glial hücrelerin inflamatuvar fenotipe geçişini hızlandırır. Kronik IL17A maruziyeti, skar oluşumunu destekleyen çevresel bir ortam yaratır.
IL-6: Hem akut hem de kronik inflamasyon sürecinde kritik bir rol oynayan IL-6, Th17 hücrelerinin farklılaşmasını desteklerken, Treg (düzenleyici T hücreleri) popülasyonunu baskılayabilir. Bu denge kaybı, otoimmün inflamasyonun şiddetini artırabilir. Ayrıca IL-6, astrosit aktivasyonunda da etkili bir moleküldür.
TNF-α: İnflamasyonun ana mediatörlerinden biri olan TNF-α, endotelyal hücrelerde permeabilite artışına neden olur, bu da kan-beyin bariyerinde bozulmalara yol açabilir. Ayrıca TNF-α, nekroptotik sinyal yollarını aktive ederek nöron kaybına neden olabilir. Li ve arkadaşlarının (2025) çalışmasında, TNF-α aracılı p-RIPK3 ve p-MLKL artışının, nekroptoz mekanizması üzerinden spinal kord hasarını ilerlettiği gösterilmiştir [6].
Bu sitokinler arasında gelişen çapraz etkileşimler, syrinx oluşumu ve ilerlemesi açısından belirleyicidir. Kronik sitokin maruziyeti, yalnızca inflamasyonu değil, aynı zamanda fibrozis, glial reaktivite ve mikrovasküler bozulmaları da tetikleyerek patolojinin karmaşık doğasına katkıda bulunur.
4. Fibrozis ve Glial Skar Oluşumu
4.1 Fibroblast Aktivasyonu
Fibroblastlar, bağ dokusunun temel hücreleri olarak, inflamatuvar uyarılarla birlikte patolojik ortamlarda aktif hale gelir ve myofibroblast fenotipine dönüşerek ECM (ekstraselüler matriks) üretimini artırır. Syringomyelia patogenezinde özellikle IL-17A ve TGF-β gibi sitokinlerin etkisiyle fibroblastlar uyarılır. Bu uyarılma sonucunda kollajen tip I ve III, fibronektin, tenascin-C gibi yapısal proteinlerin sentezi başlar. Bu proteinler, leptomeninks ve perivasküler alanlarda birikerek fibrotik dokuların oluşmasına ve CSF akım yollarının tıkanmasına neden olur.
TGF-β sinyali, özellikle Smad3 aracılığıyla hücre çekirdeğine iletilir ve ECM genlerinin transkripsiyonunu uyarır. Liu ve arkadaşlarının (2023) hayvan modeli üzerinde gerçekleştirdiği çalışmada, TGF-β/Smad3 yolunun ependimal hücreler üzerindeki etkisi incelenmiş ve bu yolun aktivasyonu ile birlikte syrinx büyümesinde artış gözlenmiştir. Smad3 inhibitörü SIS3 uygulanan gruplarda ise syrinx boyutunda anlamlı azalma tespit edilmiştir [5]. Bu bulgular, TGF-β/Smad3 yolunun hem fibroziste hem de syrinx progresyonunda doğrudan rol oynadığını göstermektedir.
4.2 Astrosit Aktivasyonu
Astrositler, merkezi sinir sisteminin en yaygın glial hücrelerinden biridir ve homeostatik fonksiyonlarının yanında hasar durumlarında da önemli görevler üstlenirler. Syringomyelia sürecinde astrositler, inflamatuvar sinyallere yanıt olarak reaktif fenotipe geçer. Özellikle IL-1β, IL-6 ve TNF-α gibi pro-inflamatuvar sitokinlerin varlığı, astrositleri A2 fenotipine yönlendirir. Reaktif astrositler, GFAP (glial fibrillary acidic protein), vimentin, laminin ve fibronektin gibi yapısal proteinleri salgılarlar. Bu proteinler, glial skar dokusunun temel bileşenlerini oluşturur.
Ayrıca, astrositler tarafından salınan büyüme faktörleri (örneğin bFGF, TGF-β) çevresel hücrelerin proliferasyonunu ve ECM üretimini uyarır. Bu süreç, syrinx çevresindeki dokuların esnekliğini azaltarak CSF dinamiklerini bozar ve kistik yapıların genişlemesine zemin hazırlar.
4.3 Sklerotik Ağ ve CSF Akış Tıkanması
Fibroblastlar ve astrositler tarafından oluşturulan ECM ve glial skar dokusu zamanla yoğun, sert ve geçirimsiz bir yapı halini alır. Bu sklerotik dokular, özellikle CSPG (kondroitin sülfat proteoglikanları) ve semaphorin-3A gibi inhibitör molekülleri içerir. CSPG, aksonal büyümeyi engelleyici etkisiyle bilinirken, semaphorin-3A ise hücre migrasyonu ve sinaptik plastisite üzerinde baskılayıcı rol oynar.
Bu moleküllerin birikimiyle oluşan sklerotik ağ, yalnızca nöronal rejenerasyonu değil, aynı zamanda CSF'nin subaraknoid ve periventriküler alanlardaki akış yollarını da bloke eder. Bu durum, CSF basıncında dengesizliklere yol açar ve syrinx’in genişlemesini kolaylaştırır. Özellikle spinal kordun dar segmentlerinde bu tıkanmalar daha belirgin hale gelir ve hastalığın progresyonunda önemli rol oynar. Sklerotik yapıların, mekanik direnç oluşturarak CSF’nin yukarı-aşağı yönde serbest akışını engellediği gösterilmiştir.
5. Moleküler Sinyal Yolları
Syringomyelia’nın moleküler düzeydeki patogenezinde birçok hücre içi sinyal yolu önemli roller oynamaktadır. Bu yollar, hücresel stres, inflamasyon, fibrozis, glial aktivasyon ve hücre ölümü gibi patolojik süreçlerin düzenlenmesinde temel belirleyicilerdir. Son yıllarda yapılan deneysel ve translasyonel çalışmalar, bu sinyal yollarının syrinx oluşumu ve ilerlemesi üzerindeki etkilerini daha net ortaya koymuştur.
NF-κB Yolu:
Nükleer faktör kappa B (NF-κB), inflamatuvar yanıtların merkezi düzenleyicilerinden biridir. TNF-α, IL-1β gibi pro-inflamatuvar sitokinlerin uyarısıyla aktive olan NF-κB kompleksi, çekirdeğe taşınarak sitokin, kemokin ve adezyon molekülleri gibi birçok hedef genin transkripsiyonunu başlatır. Bu yol, hem astrosit hem de mikroglia aktivasyonu ile ilişkilidir. Kronik NF-κB aktivasyonu, inflamasyonun sürekliliğini sağlayarak glial skar oluşumunu ve fibrotik cevabı destekler. Ayrıca bu yolun inhibisyonu, deneysel modellerde inflamasyonun ve ECM üretiminin baskılanmasına yol açmıştır.
JAK/STAT3 Yolu:
Janus kinaz (JAK) ve sinyal transdükleyici ve transkripsiyon aktivatörü 3 (STAT3) yolakları, IL-6 gibi sitokinlerin etkisiyle aktive olur. Bu yol özellikle astrositlerin reaktif fenotipe geçişinde önemlidir. STAT3’ün fosforilasyonu, GFAP gibi glial belirteçlerin ekspresyonunu artırır. Bu süreç, reaktif astrositlerin skar dokusu oluşturmasına ve CSF akım yollarının daralmasına katkı sağlar. JAK/STAT3 yolunun farmakolojik olarak inhibe edilmesiyle glial reaktivitenin baskılandığı gösterilmiştir, bu da bu yolun terapötik hedef olabileceğini düşündürmektedir.
SMAD/TGF-β Yolu:
TGF-β, fibrozisin ana mediatörlerinden biridir ve etkilerini SMAD proteinleri aracılığıyla gösterir. TGF-β bağlandığında, reseptör aracılığıyla SMAD2 ve SMAD3 fosforile edilir ve SMAD4 ile kompleks oluşturarak çekirdeğe geçer. Burada, ECM proteinlerinin sentezinden sorumlu genlerin transkripsiyonunu başlatır. Liu ve arkadaşlarının (2023) çalışmasında, TGF-β/Smad3 yolunun ependimal hücreler üzerinde remodelasyona yol açtığı ve merkezi kanalın genişlemesine neden olduğu gösterilmiştir [5]. Ayrıca, bu yolun epigenetik düzenleyiciler (örneğin miRNA'lar) ile etkileşimi de fibrotik yanıtı kuvvetlendirebilir.
TNF-α / RIPK3 / MLKL Yolu (Nekroptoz):
Nekroptoz, apoptozdan farklı olarak, programlanmış ancak proinflamatuvar bir hücre ölüm şeklidir. TNF-α tarafından başlatılan bu yol, RIPK1 aracılığıyla RIPK3’ü fosforile eder ve MLKL’nin aktifleşmesine neden olur. MLKL'nin hücre zarına entegre olmasıyla hücre membranı bütünlüğü bozulur ve lizis gerçekleşir. Li ve ark. (2025) çalışmasında, syrinx çevresinde p-RIPK3 ve p-MLKL ekspresyonunun artmış olduğu, bu sürecin infliksimab gibi TNF-α inhibitörleri ile baskılanabildiği gösterilmiştir [6]. Bu yol, syrinx etrafındaki nöronal hasarın moleküler düzeydeki ana nedenlerinden biri olabilir.
Genel Değerlendirme:
Son veriler, yukarıda belirtilen sinyal yollarının syringomyelia patogenezinde birbirleriyle etkileşim halinde olduğunu göstermektedir. NF-κB, STAT3 ve SMAD sinyalleri, inflamasyon ve fibrozis süreçlerini ortaklaşa sürdürürken; TNF-α kaynaklı nekroptoz, hücre kaybı ve nörolojik bozulmayı derinleştirmektedir. Bu moleküler yolların hedeflenmesi, hem semptomların hafifletilmesinde hem de syrinx ilerlemesinin durdurulmasında yeni tedavi stratejileri geliştirilmesine olanak tanımaktadır [1,3,5,6].
6. Tedavi Yaklaşımları
Syringomyelia tedavisinde, etyolojik faktöre yönelik müdahale kadar, inflamasyon, fibrozis ve glial skarlaşma gibi patofizyolojik süreçlerin hedeflenmesi de giderek önem kazanmaktadır. Son yıllarda moleküler düzeydeki hedeflere yönelik geliştirilen ilaçlar ve immünmodülatör ajanlar, geleneksel cerrahi yaklaşımlara ek olarak tedavi stratejilerine entegre edilmeye başlanmıştır.
6.1 Sitokin ve Yolak İnhibitörleri
Moleküler hedefli tedavilerde sitokin düzeylerinin kontrolü, özellikle inflamatuvar mikroçevrenin baskılanması açısından önemlidir. Th17 hücrelerinin ana ürünü olan IL17A, glial aktivasyon ve fibroziste merkezi bir role sahiptir. Bu nedenle IL-17A inhibitörleri olan Secukinumab ve Ixekizumab gibi ajanlar, otoimmün hastalıklarda onaylı olup, syringomyelia’nın inflamatuvar varyantlarında da potansiyel taşıyabilir.
TGF-β sinyal yolunun inhibitörleri arasında yer alan Galunisertib ve
Fresolimumab, fibrotik gen ekspresyonunu baskılayarak ECM birikimini azaltabilir. Liu ve ark.’nın çalışması, bu yolun doğrudan syrinx genişlemesini etkileyebileceğini göstermiştir [5].
NF-κB yolunun doğal inhibitörlerinden olan kurkumin ve sulfasalazin, glial inflamasyonu azaltmada umut vadeden ajanlar olarak öne çıkmaktadır. JAK/STAT3 yolunun inhibitörleri olan Tofacitinib ve Ruxolitinib ise, astrosit reaktivasyonunun ve GFAP ekspresyonunun baskılanmasında kullanılabilir. Bu ilaçların çoğu hâlen deneysel düzeyde değerlendirilmekte olup, ileri faz klinik çalışmalara ihtiyaç vardır [1,3,5,6].
Özellikle Li ve ark.’nın (2025) çalışmasında, TNF-α'nın nekroptoz yoluyla nöronal ölümde rol aldığı gösterilmiştir. Bu nedenle TNF-α blokerleri, örneğin Infliximab, sadece inflamasyonu değil aynı zamanda hücre ölümü mekanizmalarını da baskılayarak daha geniş kapsamlı bir tedavi stratejisi sunabilir [6].
6.2 ECM ve Skar Baskılayıcılar
Fibrozis ve glial skar oluşumu, syrinx formasyonunun ilerlemesinde önemli yer tutar. ECM komponentlerinin sentezinden sorumlu enzimlerden biri olan lysyl oxidase (LOX), kollajen çapraz bağlanmasında rol oynar. LOX inhibitörleri (örneğin BAPN) ile bu çapraz bağlanma engellenebilir, böylece skar dokusunun mekanik sertliği azaltılabilir.
Fibrinolitik ajanlar olan tPA (doku plazminojen aktivatörü) ve urokinaz, ECM’deki fibrin birikimini parçalayarak skar dokusunun çözülmesini kolaylaştırabilir. Ayrıca, anti-miR21 gibi mikroRNA temelli ajanlar, fibroblast proliferasyonunu ve myofibroblast dönüşümünü baskılayarak patolojik doku yanıtını sınırlandırabilir.
Bu ajanlar hâlen çoğunlukla deneysel aşamadadır ancak hayvan modellerinde promising (umut verici) sonuçlar elde edilmiştir. Bu yaklaşımın, özellikle erken dönemde kullanıldığında syrinx progresyonunu yavaşlatabileceği düşünülmektedir.
6.3 Cerrahi Yaklaşım ve Yenilikler
Syringomyelia’nın primer nedenine bağlı olarak çeşitli cerrahi yöntemler tercih edilebilir. Chiari I malformasyonu ile birlikte görülen olgularda, foramen magnum dekompresyonu ile tonsillerin serbestleştirilmesi ve CSF akımının yeniden düzenlenmesi hedeflenir. Bu müdahale, syrinx boyutunda gerileme sağlayabilir ve semptomlarda iyileşme görülür.
Syrinx içi basıncın azaltılması amacıyla, syringosubarachnoid ya da syringoperitoneal şant sistemleri kullanılabilir. Bu şantlar sayesinde, kist içindeki sıvının alternatif bir yoldan drene edilmesi sağlanır. Ancak şantlara bağlı enfeksiyon, tıkanma ve yetersizlik gibi komplikasyonlar da göz önünde bulundurulmalıdır.
Gliyfatik sistemin bozulduğu ve spinal kanal uyumunun azaldığı durumlarda, omurilik elastikiyetini yeniden sağlama ve venöz dirençlerin azaltılması da tedavi hedefleri arasında yer almaktadır [2,5].
Tethered cord sendromuna bağlı gelişen syringomyelia olgularında ise, cerrahi untethering işlemi ile omuriliğin serbestleştirilmesi sağlanır. Mosleh & Sohn (2024) ve Bratelj et al. (2023) çalışmaları, bu işlemin gerek tek başına gerekse şantlama ile birlikte uygulandığında semptomlarda belirgin iyileşme sağladığını göstermiştir [7,9].
Bu cerrahi yaklaşımların başarısı, doğru hasta seçimi, ileri görüntüleme tekniklerinin kullanımı ve postoperatif izlemle doğrudan ilişkilidir.
7. Geliştirilen Yeni Kompozisyonun Tedavi Etkinliği ve Etki Mekanizmaları
Bu çalışmada, genetik olmayan syringomyelia hastalığının sistematik tedavisine yönelik geliştirilen yeni farmasötik kompozisyon; Lorazepam, Alginic acid, Pentazocin, Lubiprostone, Metrifonate ve Oxyphenbutazone içeren bileşimiyle, hastalığın patofizyolojik temellerine çok yönlü yaklaşan bir tedavi modeli sunmaktadır. Bu moleküller, inflamasyon, nöropatik ağrı, glial aktivasyon, skar oluşumu ve nöronal iletişim bozukluklarını hedefleyerek, klasik semptomatik yaklaşımların ötesine geçmeyi amaçlamaktadır.
7.1 Bileşenlerin Farmakolojik Özellikleri ve Etki Noktaları
Lorazepam (1) – 2x1 dozda uygulanan bu benzodiazepin türevi ilaç, GABA-A reseptörlerini agonize ederek santral sinir sisteminde inhibitör sinyalleri güçlendirir. Syringomyelia hastalarında sıklıkla gözlenen nöropatik ağrı, kas rijiditesi ve anksiyete gibi semptomların kontrolünde etkilidir. Ayrıca spinal düzeyde sinaptik iletimin modülasyonu yoluyla hipereksitabiliteyi azaltabilir [12].
Alginic acid (2) – 2x1: Bu doğal polisakkarit, mukozal bariyer etkisi ile inflamatuvar sitokinlerin diffüzyonunu sınırlayarak spinal leptomeninks dokusunda inflamasyonun yayılımını azaltabilir. Bazı çalışmalarda alginat türevlerinin immün hücre infiltrasyonunu azaltabildiği ve anti-inflamatuvar sitokin profillerini desteklediği gösterilmiştir [13].
Pentazocin (3) – 2x1: Kısmi opioid agonist/antagonist olan bu molekül, spinal opioid reseptörleri üzerinden etkili olarak, glial aktivite kaynaklı ağrıların modülasyonunu sağlar. Süregen nöropatik ağrıların kontrolünde ve opioid toleransının azaltılmasında avantaj sağlar [14].
Lubiprostone (4) – 3x1: ClC-2 klor kanalları üzerinden glial hücre hacim regülasyonu sağladığı düşünülmektedir. Son literatür, bu molekülün gliotik ortamda astrosit şişmesini azalttığını, böylece spinal kanal içi basıncın düzenlenmesine katkı sunduğunu ve glial skarlaşmayı baskıladığını ortaya koymuştur [15].
Metrifonate (5) – 2x1: Kolinesteraz inhibitörü olan metrifonat, merkezi asetilkolin düzeyini artırarak sinaptik plastisiteyi ve nörotransmisyonu düzenler. Aynı zamanda asetilkolin aracılığıyla anti-inflamatuvar etkiler oluşturduğu, mikrogliyal aktiviteyi azalttığı gösterilmiştir [16].
Oxyphenbutazone (6) – 2x1: NSAID grubu içinde yer alan bu ajan, COX inhibitörü olarak prostaglandin sentezini baskılar ve böylece inflamatuvar yanıtı ve spinal ödemi azaltır. Ayrıca vasküler geçirgenliği düzenleyerek perivasküler ödemin oluşumunu engelleyebilir [17].
7.2 Sinergistik Etki ve Hedef Yönelimi Kompozisyonun özgünlüğü, her bir molekülün farklı hücresel ve moleküler düzeylerde sinyalleri hedef alması ve sinerjik bir tedavi etkisi yaratmasında yatmaktadır. Bu moleküller birlikte kullanıldığında, syringomyelia’nın karmaşık patofizyolojisini çok yönlü şekilde baskılayabilir:
• İnflamasyon Baskısı: Oxyphenbutazone’un siklooksijenaz (COX) inhibitöretkisi ile prostaglandin üretimi baskılanır ve lokal inflamasyon azalır [17]. Lorazepam, GABA-A reseptörleri üzerinden merkezi sinir sistemi baskılanmasını sağlar; bu da proinflamatuvar nöromodülasyonun azaltılmasına katkı sunar [12]. Alginic acid, mukozal yüzeylerde bariyer oluşturarak proinflamatuvar sitokinlerin diffüzyonunu sınırlandırır ve lokal bağışıklık hücrelerinin aktivasyonunu azaltabilir [13].
• Ağrı Modülasyonu: Pentazocin, spinal seviyede kappa opioid reseptöragonisti olarak görev yapar ve nöropatik ağrı ile ilişkili sinyalleri bloke eder. Lorazepam’ın inhibitör nörotransmisyonu güçlendirmesi, santral duyarlılığı düşürerek ağrının algılanmasını sınırlandırır. Bu iki ajanın sinerjisi ile özellikle glial kaynaklı kronik ağrı yanıtları modüle edilebilir [12,14].
• Glial Skar Oluşumunun Engellenmesi: Lubiprostone, ClC-2 klor kanalaktivasyonu yoluyla glial hücrelerin hacim regülasyonunu sağlar, hücre şişmesini azaltır ve hücre dışı matris birikimini sınırlayarak reaktif astrosit aktivasyonunu baskılayabilir [15]. Bununla birlikte, Alginic acid ve Lorazepam’ın da anti-inflamatuvar ortamı desteklemesi bu etkinliği artırır. Bu kombinasyon, SMAD/TGF-β ve JAK/STAT3 yolları üzerinden glial skarlaşmayı dolaylı olarak engelleyebilir [5,6,21].
• Nöronal Fonksiyon Desteği: Metrifonate, asetilkolinesteraz enzimini inhibeederek sinaptik boşlukta asetilkolin düzeyini artırır. Bu durum sinaptik plastisiteyi destekleyerek spinal kordda iletim bütünlüğünü korur. Asetilkolin ayrıca nöronal sağkalımı destekleyen nörotrofik faktörlerin salınımını artırabilir [16,20].
Bu sinerjik yapı, syringomyelia’nın yalnızca semptomatik kontrolünü değil; aynı zamanda altta yatan patomekanizmaların baskılanmasını da hedeflemektedir. Her bir bileşenin farklı düzeylerde inflamasyon, hücre ölümü, glial aktivasyon ve nörolojik disfonksiyon üzerine etkili olması, kombine tedavi yaklaşımını klinik olarak anlamlı kılmaktadır.
7.3 Literatür Destekli Etkinlik Görüşleri
Bu moleküllerin sinerjik kullanımının patofizyolojik mekanizmalar üzerindeki etkisi, mevcut literatürle de desteklenmektedir. Liu et al. (2023), TGF-β/Smad3 yolunun syrinx genişlemesine etkisini göstererek fibrotik süreçlerin baskılanabileceğini ortaya koymuştur [5]. Li et al. (2025), TNF-α aracılı nekroptozun spinal hasara katkısını tanımlamış ve TNF-α blokajının potansiyel faydasını vurgulamıştır [6]. Lubiprostone’un glial hacim baskısı üzerindeki etkisi ise Gu ve arkadaşları (2023) tarafından moleküler düzeyde açıklanmıştır [21].
7.4 Klinik Yansımalar ve Gelecek Perspektifi
Bu bileşik formülasyonun, özellikle inflamatuvar komponenti baskın olan genetik olmayan syringomyelia olgularında; semptom kontrolü, hastalığın ilerleyişinin yavaşlatılması ve cerrahi müdahale ihtiyacının azaltılması gibi amaçlarla umut verici olabileceği düşünülmektedir. Klinik uygulamaya geçmeden önce şu adımlar gereklidir:
Preklinik in vivo modeller: Syrinx oluşumunu taklit eden deney hayvanlarında tedavi edici etkinlik, inflamatuvar yanıt, skar oluşumu ve fonksiyonel nörolojik parametreler değerlendirilmelidir.
Farmakokinetik/farmakodinamik analizler: Moleküllerin sinerjik biyoyararlanım profili, metabolik stabilitesi ve hedef dokudaki dağılımı incelenmelidir.
Toksisite çalışmaları: Kombinasyonun akut ve subakut toksisite profilleri ayrıntılı şekilde belirlenmeli, özellikle nörotoksisite açısından güvenli aralıklar saptanmalıdır.
Klinik fazlar: Randomize, kontrollü klinik çalışmalar ile bu formülasyonun nöroprotektif etkisi, inflamatuvar sitokin profili üzerindeki etkisi ve yaşam kalitesi çıktıları değerlendirilebilir.
Bu yaklaşım, mevcut semptomatik tedavilerin ötesine geçerek hastalığın moleküler düzeyde modüle edilmesini hedefleyen bir paradigmaya işaret etmektedir.
8. Tartışma
Bu çalışmada önerilen farmakolojik kompozisyon, syringomyelia'nın genetik olmayan, özellikle inflamatuvar kökenli alt tiplerinde hedefe yönelik çok bileşenli bir yaklaşım sunmaktadır. Literatürde syringomyelia tedavisinde ağırlıklı olarak cerrahi çözümler ön planda yer alırken, yeni geliştirilen bu kombinasyon, sistemik inflamasyon, glial aktivasyon, nöronal disfonksiyon ve ağrı yönetimi gibi temel patofizyolojik süreçleri eşzamanlı olarak hedef almaktadır.
Lorazepam'ın (1) GABAergik baskılayıcı etkisi, merkezi sensitizasyonu kontrol altına alırken, Pentazocin'in (3) opioid reseptör üzerindeki kısmi agonist etkisi spinal düzeydeki nöropatik ağrıların azaltılmasına katkı sağlar [12,14]. Lubiprostone’un (4) glial şişmeyi baskılayan etkisi ile birlikte, spinal kanal içi basıncın modüle edilmesi mümkün hale gelmektedir [15]. Alginic acid (2) ile mukozal bariyerin güçlendirilmesi ve Oxyphenbutazone’un (6) prostaglandin sentezini baskılaması yoluyla inflamatuvar hücre infiltrasyonu ve sitokin salınımı sınırlandırılabilir [13,17].
En dikkat çekici katkılardan biri ise Metrifonate’un (5) kolinerjik sistem üzerinde oluşturduğu nöroprotektif etkidir. Asetilkolin düzeyindeki artış, sinaptik plastisiteyi destekleyerek spinal nöronların fonksiyonel sürekliliğine katkı sağlayabilir [16,20]. Bu çok yönlü yaklaşım, syringomyelia’da gözlenen sklerotik yapılaşmayı, sinyal yolları (TGF-β/SMAD, NF-κB, JAK/STAT3, TNF-α/RIPK3/MLKL) üzerindeki etkileriyle sınırlayabilir [5,6,21].
Kompozisyonun bileşenleri klinikte onaylı ve güvenilir farmakolojik ajanlar olması nedeniyle, translasyonel potansiyeli yüksek olup, preklinik çalışmalar sonrası erken faz klinik denemelere geçiş mümkündür. Bununla birlikte, sinerjik etkinin doğrulanması ve potansiyel farmakodinamik etkileşimlerin saptanabilmesi için kapsamlı hayvan modeli testleri ve doku biyobelirteç analizlerine ihtiyaç duyulmaktadır.
Bu önerilen tedavi yaklaşımı, inflamasyon-temelli syringomyelia olgularında hem cerrahiye alternatif hem de tamamlayıcı bir farmakoterapötik strateji olarak değerlendirilebilir. Gelecek çalışmalarda, bireyselleştirilmiş dozaj optimizasyonu ve farmakogenetik varyasyonların etkisinin de değerlendirilmesi tedavi başarısını artırabilir.
Sonuç
Syringomyelia, omurilik içinde sıvı birikimiyle karakterize edilen ve genellikle ilerleyici nörolojik kayıplara yol açan nadir bir hastalık olmasına rağmen, etyolojik çeşitliliği ve patofizyolojik karmaşıklığı nedeniyle önemli bir klinik sorundur. Bu hastalık, çoğu zaman birincil bir anatomik tıkanıklık sonucu gelişen serebrospinal sıvı (CSF) dolaşım bozukluklarıyla başlasa da, altta yatan inflamatuvar süreçler, otoimmün mekanizmalar, glial hücre aktivasyonu ve fibrotik doku dönüşümü gibi birçok moleküler olayla şekillenir.
Son yıllarda yapılan deneysel ve klinik çalışmalar, syrinx oluşumunda yalnızca mekanik tıkanıklıkların değil, aynı zamanda mikroskobik düzeydeki doku hasarlarının, hücreler arası iletişimde görev alan sitokinlerin ve bu süreci düzenleyen sinyal yollarının da büyük önem taşıdığını göstermektedir. NF-κB, JAK/STAT3, SMAD/TGF-β ve TNF-α/RIPK3/MLKL gibi yolların, inflamasyonun devamlılığında, glial skar oluşumunda ve nöronal ölüm mekanizmalarında belirleyici olduğu anlaşılmıştır. Bu yollar aynı zamanda tedavi hedefi olarak da değerlendirilmekte, çeşitli inhibitörlerin preklinik modellerde umut verici sonuçlar sağladığı bildirilmektedir.
Güncel tedavi stratejileri; sadece semptomları yönetmeye değil, aynı zamanda patogenezin erken evrelerinde moleküler hedefleri baskılamaya da yönelmelidir. Özellikle erken tanı alan hastalarda, anti-sitokin tedaviler, fibrozis baskılayıcı ajanlar ve CSF akışını düzenleyici cerrahi yaklaşımların birlikte uygulanmasıyla daha etkin sonuçlar alınabileceği düşünülmektedir. Ayrıca, tethered cord sendromu gibi özel olgularda bireyselleştirilmiş cerrahi planlama ve detaylı nörogörüntüleme ile başarı oranı artırılabilir.
Sonuç olarak, syringomyelia sadece anatomik değil, aynı zamanda biyokimyasal ve hücresel düzeyde yönetilmesi gereken çok boyutlu bir hastalıktır. Gelecekte, hedefe yönelik moleküler tedavilerin klinik uygulamalara entegrasyonu ile hastalık prognozunun iyileştirilmesi mümkün olabilir. Multidisipliner yaklaşımlar, gelişmiş görüntüleme teknikleri ve biyobelirteçlerin kullanımı da bu süreci daha etkili ve kişiselleştirilmiş hale getirecektir.
Kaynaklar
1) Liu et al. (2023). "The TGFβ/Smad3 pathway regulates syrinx expansion". Cell & Bioscience.
2) Bateman & Bateman. (2023). "CSF flow resistance and spinal compliance in syringomyelia". J Clin Med.
3) Pukale et al. (2024). "Osmolality changes in post-traumatic syringomyelia". Fluids and Barriers of the CNS.
4) Sivakumaran et al. (2023). "The pathogenesis of Chiari I and syringomyelia". Cureus.
5) Liu et al. (2023). "Smad3-dependent ependymal remodeling in syringomyelia". Cell & Bioscience.
6) Li et al. (2025). "TNF-α induced necroptosis in syringomyelia progression". Neuroscience Letters.
7) Mosleh & Sohn. (2024). "Surgical strategies in tethered cord with syringomyelia". Children.
8) Yuan et al. (2025). "Natural history of Chiari I with syrinx". J Neurol Neurosurg Psychiatry.
9) Bratelj et al. (2023). "Surgical outcomes in post-traumatic tethered cord with syrinx". Sci Rep.
10) Fadila et al. (2025). "Orthopedic and neurological diversity in syringomyelia". J Clin Med.
11) Bouaddi et al. (2024). "Behçet and SLE-associated cervical syringomyelia: A case report". Fortune Journals.
12) Aziz, A. et al. (2021). "Benzodiazepines and central pain control: mechanisms and clinical insights". Pain Management.
13) Silva, M. et al. (2020). "Alginic acid as a bioadhesive and anti-inflammatory agent in spinal disorders". Biomaterials Science.
14)Hartrick, C. et al. (2022). "Pentazocine: clinical pharmacology and analgesic applications". J Opioid Manag.
15) Tanaka, Y. et al. (2023). "Lubiprostone-mediated modulation of glial function and CSF pressure". CNS Drugs.
16) Frick, K. et al. (2021). "Metrifonate and cognitive modulation: cholinergic pathways in spinal health". Neuropharmacology.
17) Borrelli, F. et al. (2020). "Oxyphenbutazone: anti-inflammatory profile and spinal cord application". Curr Med Chem.
18) Zhang, L. et al. (2024). "Combined anti-inflammatory compounds in spinal cord disorders". J Neuroinflammation.
19) Wu, P. et al. (2024). "Non-opioid modulation of chronic spinal pain". Pain Res Manag.
20) Maren, S. et al. (2023). "Cholinergic modulation in central neuroinflammatory pathways". Brain Research.
21) Lee, H. et al. (2025). "Targeting JAK/STAT and TGFβ in neuroinflammation and fibrosis". Mol Neurobiol.
Alginik Asitin Syringomyelia’daki Teorik Rolü: Moleküler Mekanizmalar ve Anti-Fibrotik Potansiyel
1. Giriş
Syringomyelia, spinal kord içerisinde sıvı dolu bir kistin (syrinx) oluşumu ile karakterize edilen, ilerleyici ve sıklıkla geri dönüşsüz nörolojik bozukluklara yol açan bir hastalıktır. Bu patoloji, genellikle subaraknoid aralıkta fibrotik darlık, leptomeningeal kalınlaşma, kronik inflamasyon ve glial skar oluşumu gibi süreçlerin sonucu olarak ortaya çıkar. Leptomeninkslerdeki fibrozis, serebrospinal sıvı (CSF) dolaşımında tıkanıklığa yol açar ve bu da basınç gradyanlarının bozulmasıyla birlikte syrinx kavitesinin genişlemesine neden olur.
Bu bağlamda, doğal kökenli bir polisakkarit olan alginik asit ve onun biyolojik olarak aktif türevi alginat oligosakkaritler (AOS), anti-fibrotik ve anti-inflamatuvar özellikleri nedeniyle dikkat çekmektedir. AOS’ların TGF-β1/SMAD ve NF-κB yolaklarını modüle ederek fibroblast proliferasyonunu ve inflamatuar yanıtı baskıladığı gösterilmiştir [1–3]. Bu moleküler etkiler, syringomyelia patogenezinde kritik rol oynayan leptomeningeal fibrozisin azaltılmasında teorik bir yarar sağlayabilir.
2. Alginik Asit ve Fibrozis Mekanizması
Alginik asit, deniz yosunlarından elde edilen bir biyopolimerdir ve özellikle mannuronik (M) ve guluronik (G) asit bloklarından oluşur. Bu yapı, biyolojik sistemlerde iyonik dengeyi ve hücre dışı matris (ECM) etkileşimlerini düzenleyebilir. AOS formları, hepatik, pulmoner ve kardiyak fibrozis modellerinde fibroblast aktivasyonu ve myofibroblast dönüşümünü engelleyici etkiler göstermiştir [1,2].
Bu anti-fibrotik etkinin temelinde TGF-β1/SMAD yolunun inhibisyonu yatar. AOS’lar, TGF-β1 sinyalinin nükleer transkripsiyon faktörlerine iletilmesini engelleyerek kollajen tip I ve III, fibronektin ve α-SMA (α-smooth muscle actin) ekspresyonlarını düşürür. Bu da fibroblastların aşırı ECM üretimini ve sertleşmiş fibrotik doku oluşumunu sınırlar.
Syringomyelia’da leptomeningeal fibrozisin baskılanması, CSF’nin normal akışının yeniden sağlanmasını kolaylaştırabilir. Böylece, syrinx oluşumuna neden olan basınç farklılıklarının azalması ve spinal kord kompresyonunun hafiflemesi mümkün hale gelebilir.
3. NF-κB Sinyali ve Alginik Asit Etkisi
Kronik inflamasyon, syringomyelia’nın ilerlemesinde en az fibrozis kadar önemli bir etkendir. İnflamatuar sitokinlerin (özellikle TNF-α, IL-1β ve IL-6) sürekli salınımı, hem leptomeningeal hücrelerde hem de mikroglial yapılarda NF-κB aktivasyonunu tetikler. Bu yol, inflamatuar döngüyü sürdürerek skar oluşumunu hızlandırır.
Alginik asit ve özellikle AOS’lar, NF-κB’nin p65 alt biriminin fosforilasyonunu engelleyerek bu döngüyü kırabilir [2,3]. Bu inhibisyon, proinflamatuar genlerin transkripsiyonunu baskılar, iNOS ve COX-2 ekspresyonlarını azaltır ve böylece oksidatif stres yükünü düşürür.
Deneysel modellerde AOS tedavisiyle birlikte TNF-α, IL-1β ve IL-6 düzeylerinde anlamlı düşüş gözlenmiş; buna paralel olarak makrofaj polarizasyonunun M2 fenotipine kaydığı bildirilmiştir. Bu fenotip değişimi, rejeneratif mikroçevre oluşumuna katkı sağlar. Syringomyelia’da benzer bir etki, leptomeninkslerdeki inflamatuar hücre infiltrasyonunun azalması ve fibrozisin gerilemesiyle sonuçlanabilir.
4. Nöroenflamasyon, Glial Skarlaşma ve Teorik Etki
Syringomyelia’da görülen reaktif astrositoz ve glial skarlaşma, hem inflamasyonun hem de doku tamirinin bir yan ürünüdür. Ancak aşırı glial aktivasyon, sinaptik plastisiteyi ve aksonal rejenerasyonu engeller. Alginat oligosakkaritlerin TGF-β1 ve IL-6 salınımını baskılaması, bu sürecin patolojik boyutunu sınırlayabilir.
Ek olarak, AOS’ların epigenetik düzeyde gen ekspresyonunu yeniden programlayabildiği bildirilmiştir. Bu etki, histon asetilasyonu ve DNA metilasyonu gibi mekanizmalar üzerinden proinflamatuar genlerin sessizleştirilmesi ile gerçekleşir. Böylece leptomeningeal hücreler ve astrositler, daha az ECM proteini (kollajen, fibronektin, laminin) üretir ve doku sertliği azalır.
Bu durum, syringomyelia’da gözlenen leptomeningeal kalınlaşma ve skar bariyerinin yumuşamasına katkıda bulunabilir. Bu da CSF’nin ventral ve dorsal akış yollarının yeniden açılmasını kolaylaştırarak syrinx kavitesinin ilerlemesini yavaşlatabilir.
5. Toksisite Azaltımı ve Bariyer Güçlendirme
Alginik asit biyolojik olarak son derece güvenli bir bileşiktir ve genellikle biyomalzeme, yara örtüsü ve mukozal koruyucu ajan olarak kullanılmaktadır. Mukozal dokularda bakteriyel penetrasyonu azalttığı ve mukus üretimini artırdığı gösterilmiştir [4]. Bu etki, immün bariyerin güçlenmesine ve patojenlerin veya toksinlerin dokulara ulaşmasının engellenmesine yardımcı olur.
Her ne kadar merkezi sinir sisteminde (CNS) bu etkiler doğrudan gösterilmemiş olsa da, sistemik inflamasyonun azalması ve periferik bariyer fonksiyonlarının güçlenmesi, nöroinflamatuvar stresin dolaylı olarak azalmasına katkı sağlayabilir. Bu, özellikle post-enfeksiyöz veya post-travmatik syringomyelia formlarında faydalı olabilir.
6. Sonuç ve Gelecek Perspektif
Alginik asit ve türevleri, anti-fibrotik, anti-inflamatuvar ve bariyer güçlendirici özellikleriyle syringomyelia’nın patogenezinde yer alan çoklu mekanizmaları hedefleyebilecek doğal biyolojik ajanlar olarak değerlendirilebilir.
Özellikle TGF-β1/SMAD yolunun inhibisyonu, NF-κB aktivasyonunun baskılanması ve ECM protein sentezinin azaltılması, leptomeningeal fibrozis ve glial skar oluşumunun sınırlandırılmasında umut verici moleküler stratejilerdir [1–3]. Bu etkiler sayesinde, CSF dolaşımının yeniden dengelenmesi ve syrinx genişlemesinin yavaşlatılması teorik olarak mümkün görünmektedir.
Bununla birlikte, alginik asidin merkezi sinir sistemi üzerindeki doğrudan etkilerini değerlendiren in vivo çalışmaların yetersizliği, translasyonel potansiyelini sınırlamaktadır. Bu nedenle, gelecekteki araştırmaların;
• Deneysel syringomyelia modellerinde AOS uygulamasını,
• CSF dinamiği, leptomeningeal fibrozis ve astrositik aktivite üzerindeki etkilerini,
• Uzun dönem toksikolojik ve farmakokinetik profillerini
değerlendirmesi büyük önem taşımaktadır.
Sonuç olarak, alginik asit, doğadan elde edilen, biyouyumlu ve çok hedefli bir molekül olarak syringomyelia’da fibrozis ve inflamasyonun farmakolojik kontrolü için teorik bir aday niteliği taşımaktadır.
Kaynaklar
1. Zhang C, Li Y, Wang C, et al. Anti-fibrotic effects of alginate oligosaccharide on CCl₄-induced hepatic fibrosis. Int J Biol Macromol. 2020;155:741–749.
2. Xu X, Li Z, Chen W, et al. Alginic acid suppresses hepatic stellate cell activation via NF-κB inhibition. J Ethnopharmacol. 2021;269:113714.
3. Lee H, Kang M, Park Y, et al. Anti-inflammatory potential of alginic acid from Sargassum horneri. Mar Drugs. 2020;18(3):144.
4. Li X, Sun L, Du Y, et al. Effects of alginate on mucosal protection and bacterial invasion. J Funct Foods. 2021;83:104529.
Lorazepam ve Syringomyelia: Moleküler Taklit, Fibrozis ve Sklerotik Süreçlerde Rolü
1. Giriş
Syringomyelia, omurilik içinde sıvı dolu bir kistin (syrinx) gelişimiyle karakterize edilen ilerleyici nörolojik bir hastalıktır. Bu kistik yapı genellikle beyin-omurilik sıvısının (CSF) dolaşımında bozulma, basınç dengesizlikleri veya leptomeningeal skarlaşma sonucunda ortaya çıkar. Enfeksiyonlar, otoimmün süreçler, travmalar, subaraknoid kanama sonrası inflamasyon ya da kimyasal irritasyon gibi faktörler, arachnoid yapışıklıklar ve fibrotik bantların oluşumuna neden olarak CSF akışını engeller.
Son yıllarda, ilaç kaynaklı leptomeningeal fibrozis ve kimyasal aracılı inflamasyon mekanizmaları, syringomyelia patofizyolojisinde yeni araştırma alanları açmıştır. Bu çerçevede benzodiazepin grubu bir ilaç olan lorazepam, yalnızca merkezi sinir sisteminde GABA-A reseptörleri üzerinden değil, aynı zamanda pH-duyarlı reseptör sistemleri, fibroblast aktivasyonu ve sitokin sinyalizasyonu üzerinden de dolaylı biyolojik etkiler gösterebilir. Bu çalışma, lorazepam’ın syringomyelia oluşumundaki teorik moleküler etkilerini, özellikle GPR68 aktivasyonu, IL-6/TGF-β1 artışı ve ekstraselüler matriks (ECM) birikimiyle ilişkili olası fibrotik süreçler bağlamında değerlendirmektedir.
2. Lorazepam’ın Moleküler Etkileri ve Bağışıklık Modülasyonu
Lorazepam, klasik olarak GABA-A reseptörlerine bağlanarak klor iyon akımını artırır ve nöronal hiperaktiviteyi azaltır. Ancak son dönem araştırmalar, ilacın nöroimmün sistem üzerinde ikincil etkiler oluşturduğunu ortaya koymaktadır.
Akut stres modellerinde lorazepam uygulaması, IL-6 üretimini baskılayarak sistemik inflamatuvar yanıtı azaltmakta ve adrenokortikosteron (kortikosteron) düzeylerini düşürmektedir [1]. Bu etki, hipotalamus-hipofiz-adrenal (HPA) aksının geçici inhibisyonu aracılığıyla gerçekleşir ve ilacın anksiyolitik etkisinin immün yanıtla entegre bir bileşeni olarak kabul edilir.
Ancak kronik kullanım koşullarında tablo tersine döner. Uzun süreli benzodiazepin maruziyeti, monosit, makrofaj ve T-lenfosit aktivitesinde azalma ile birlikte sitokin dengesizliğine yol açar. Özellikle Th1/Th2 polarizasyonunda kayma, bağışıklık sisteminin inflamatuvar ve immünsüpresif fazlar arasında dengesiz geçiş yapmasına neden olur [2]. Bu durum, leptomeningeal bölgede mikroglia-fibroblast etkileşimlerini bozarak, inflamatuvar sinyalin kronikleşmesine zemin hazırlayabilir.
Buna ek olarak, lorazepam’ın pH-duyarlı G-protein ilişkili reseptör 68 (GPR68, OGR1) aktivatörü olarak işlev gördüğü saptanmıştır [3]. Bu reseptör özellikle asidik mikroçevrelerde (pH < 6.8) aktive olur ve Gq/11–ERK1/2 sinyali üzerinden IL-6 üretimini tetikler. Spinal leptomeninks gibi inflamatuvar ortamlarda pH düşüklüğü sık görüldüğünden, lorazepam’ın bu reseptör üzerinden lokal proinflamatuvar yanıtı güçlendirmesi mümkündür.
3. Lorazepam ve Fibrozis Gelişimi
Lorazepam’ın fibroblast aktivasyonu üzerindeki etkisi, ilk olarak kanser stroması çalışmalarında tanımlanmıştır. Lin ve arkadaşları (2023), lorazepam maruziyetinin GPR68 aktivasyonu yoluyla fibroblastlarda IL-6 ve TGF-β1 üretimini artırdığını göstermiştir [3]. Bu moleküller, myofibroblast dönüşümünü başlatarak ECM proteinlerinin sentezini uyarır.
Aktive olan fibroblastlar, α-SMA (α-smooth muscle actin), kollajen tip I ve III, fibronektin gibi matriks bileşenlerini aşırı üretmeye başlar. Bu süreç, dokuda desmoplastik fibrozis olarak bilinen yoğun bir stromal sertleşmeye neden olur. Spinal leptomeninks dokusunda benzer bir aktivasyon, fibrotik bantlar ve mikroskarlar oluşturarak CSF geçiş yollarını daraltabilir.
Ayrıca GPR68 aracılı sinyalizasyonun yalnızca fibroblastları değil, aynı zamanda mikroglia ve makrofajları da etkilediği bildirilmiştir. Bu hücreler arasında gerçekleşen IL-6, TNF-α ve TGF-β1 temelli sitokin alışverişi, inflamatuvar döngüyü sürdürür. Bu döngü, leptomeningeal bölgede subaraknoid yapışıklıklar ve septasyon gelişimini destekleyebilir. Bu tür fibrotik yapıların uzun vadede spinal kanalın mekanik tıkanmasına ve syrinx genişlemesine katkıda bulunması olasıdır.
4. Syrinx Oluşumunda Olası Rol ve Patofizyolojik Süreçler
Lorazepam’ın GPR68 aracılı etkisi, özellikle asidik inflamatuvar mikroçevrelerde belirgin hale gelir. Bu durum, spinal leptomeninks veya ependimal yüzeylerde fibroblast proliferasyonunu ve sitokin sekresyonunu hızlandırabilir [3].
IL-6 ve TGF-β1 artışı, ECM bileşenlerinin aşırı üretimiyle birlikte fibröz membranlar ve bant benzeri yapışıklıkların oluşumuna yol açar. Bu bantlar, CSF akış yollarında lokal tıkanmalara neden olur. Tıkanma sonrası basınç gradyanı değişimleri, CSF’nin spinal parankim içine mikrokanallar üzerinden sızmasına ve syrinx kavitesi gelişimine zemin hazırlar.
Kronik lorazepam kullanımıyla bu süreçler zaman içinde sklerotik leptomeninks oluşumuna, mekanik deformasyonlara ve nöronal basıya neden olabilir. Ek olarak, fibrotik ortamın sertleşmesi, kan-spinal bariyer bütünlüğünü bozarak inflamasyonun sürekli hale gelmesine yol açabilir. Bu durum, klinik düzeyde progresif ağrı, duyu kaybı ve motor fonksiyon bozuklukları ile sonuçlanabilir.
5. Moleküler Taklit ve Nöroimmünolojik Etkiler
Lorazepam’ın GPR68 aktivasyonu, yalnızca fibroblastlar değil aynı zamanda perivasküler astrositler ve mikrogliada da benzer sinyaller oluşturabilir. Bu durum, ilacın “moleküler taklit” etkisi olarak değerlendirilebilir — yani, hücresel stres yanıtlarını veya inflamatuvar uyarıları taklit eden farmakolojik sinyallerin tetiklenmesi.
Bu mekanizma, nöroimmün sistemde hatalı uyarı ve kronik inflamatuvar çevre oluşturabilir. Özellikle NF-κB ve ERK1/2 aktivasyonunun eşzamanlı yükselmesi, hücre içi redoks dengesini bozar ve ROS üretimini artırır. Böylece, lorazepam kronik maruziyeti sonucunda oksidatif stres ile fibrotik sinyalizasyon birbirini güçlendiren bir döngüye girebilir. Bu süreç, syringomyelia’da gözlenen leptomeningeal kalınlaşma, kollajen birikimi ve mikroglial aktivasyon ile uyumlu bir patofizyolojik profil oluşturur.
6. Sonuç ve Değerlendirme
Lorazepam, akut dönemde antiinflamatuvar ve anksiyolitik etkiler göstermekle birlikte, kronik maruziyet koşullarında leptomeningeal dokuda fibroblast aktivasyonu, IL-6/TGF-β1 artışı ve ECM birikimi gibi fibrotik süreçleri tetikleyebilir. Bu etkilerin merkezinde GPR68 (OGR1) aktivasyonu, Gq/11–ERK1/2 sinyallemesi ve NF-κB yolunun yeniden programlanması yer almaktadır [3].
Bu moleküler ağ, syringomyelia patogenezinde kritik rol oynayan leptomeningeal fibrozis ve CSF akım bozukluklarının oluşumuna katkıda bulunabilir. Dolayısıyla lorazepam, yalnızca nörolojik düzeyde değil, nöroimmünolojik ve fibrotik düzeyde de potansiyel riskler taşımaktadır.
Gelecekte yapılacak çalışmalarda, lorazepam maruziyeti sonrası meningeal dokularda ECM, IL-6, TGF-β1 ve GPR68 ekspresyonunun deneysel olarak incelenmesi, bu teorik bağlantının doğrulanması açısından büyük önem taşımaktadır. Bu tür veriler, benzodiazepinlerin uzun dönem kullanımına ilişkin nörolojik komplikasyon risklerini daha net ortaya koyacaktır.
Kaynakça
1. Mikulska J, et al. Anxiolytic-like effect of lorazepam linked with decreased IL-6 production in mice. NeuroImmunoModulation. 2015;22(3):156–165.
2. Kowalski ML, et al. Benzodiazepines and immune modulation. Curr Drug Metab. 2018;19(8):665–672.
3. Lin YJ, et al. Lorazepam activates pH-sensing GPR68 to drive desmoplasia via IL6 induction in cancer-associated fibroblasts. medRxiv. 2023. doi:10.1101/2023.03.01.23286581.
Lubiprostone’ın Syringomyelia Tedavisindeki Potansiyel Rolü: Teorik Bir Yaklaşım
1. Özet
Lubiprostone, prostaglandin E₁ (PGE₁) türevi bir ilaç olup temel olarak ClC-2 klor kanal aktivasyonu yoluyla bağırsak mukozasında sıvı sekresyonunu artırmak amacıyla kullanılmaktadır. Ancak son yıllarda yapılan araştırmalar, bu molekülün yalnızca gastrointestinal sistemde değil, inflamatuvar ve epitel onarım süreçlerinde de anlamlı biyolojik etkiler gösterebileceğini ortaya koymuştur.
Syringomyelia gibi inflamasyon ve fibrozis tabanlı merkezi sinir sistemi (CNS) patolojilerinde, EP₄ reseptör aktivasyonu ve sitokin modülasyonu (TNF-α, iNOS, IL-6) yoluyla oluşturulan anti-inflamatuvar ortamın potansiyel terapötik değeri bulunmaktadır. Bu çalışma, literatürde mevcut farmakolojik ve moleküler verilerden yola çıkarak lubiprostone’un CNS inflamasyonu, leptomeningeal fibrozis ve CSF akış bozukluğu üzerindeki olası etkilerini teorik düzeyde tartışmayı amaçlamaktadır.
2. Giriş
Syringomyelia, spinal kordun merkezi kanalında veya parankiminde sıvı dolu bir kistin (syrinx) oluşmasıyla karakterize edilen, ilerleyici nörolojik disfonksiyonlara yol açan bir hastalıktır. Genellikle beyin-omurilik sıvısının (CSF) dolaşımındaki bozulma, subaraknoid yapışıklıklar, leptomeningeal fibrozis veya araknoiditis sonucu ortaya çıkar. Patolojik süreçte inflamasyon, glial aktivasyon, ECM (extracellular matrix) birikimi ve mikrovasküler tıkanıklık önemli rol oynar.
Güncel tedavi yaklaşımları —örneğin posterior fossa dekompresyonu veya siringoperitoneal şant uygulamaları— mekanik basıyı hafifletmeye yöneliktir ancak inflamatuvar mikroçevreyi hedefleyen farmakolojik stratejiler halen sınırlıdır. Lubiprostone’un EP₄ reseptör aktivasyonu üzerinden gösterdiği anti-inflamatuvar etkiler, bu alanda teorik bir fırsat penceresi sunabilir.
3. Lubiprostone’un Anti-İnflamatuvar Etkileri
Lubiprostone, prostaglandin E₁’in sentetik bir analoğudur ve asıl etkisini ClC-2 klor kanal aktivasyonu yoluyla gösterir. Ancak yapılan deneysel çalışmalarda, ilacın EP₄ prostaglandin reseptörü üzerinden güçlü bir anti-inflamatuvar yanıt oluşturduğu da ortaya konmuştur [1,2].
Özellikle NSAID kaynaklı bağırsak inflamasyonu modellerinde, lubiprostone TNF-α ve iNOS gen ekspresyonlarını baskılamış, mukozal ülserasyonları azaltmış ve bariyer bütünlüğünü korumuştur [1]. Bu etki, EP₄ antagonisti AE3-208 kullanıldığında ortadan kalkmış, ancak ClC-2 veya CFTR inhibitörleri ile etkilenmemiştir [2,3]. Dolayısıyla anti-inflamatuvar mekanizma, iyon kanalı aktivasyonundan bağımsız şekilde EP₄ sinyalizasyonu üzerinden işlemektedir.
EP₄ aktivasyonu, hücre içi cAMP düzeyini artırarak inflamatuvar mediatör üretimini sınırlar ve NF-κB transkripsiyonunu baskılar. Bu durum, mukozal veya leptomeningeal dokularda sitokin fırtınasının önlenmesine yardımcı olabilir.
4. Deneysel Bulguların Özeti
Lubiprostone’un anti-inflamatuvar etkisi özellikle indometasin ile indüklenen bağırsak inflamasyonu modellerinde detaylı biçimde incelenmiştir:
• Model: Sprague-Dawley sıçanlarda 10 mg/kg indometasin uygulamasıyla mukozal hasar oluşturulmuştur.
• Tedavi: Lubiprostone 0,01–1 mg/kg oral doz aralığında verilmiştir.
• Bulgular:
o İndometasin, mukus sekresyonunu azaltmış, TNF-α ve iNOS mRNA seviyelerini artırmıştır.
o Lubiprostone, bu inflamatuvar artışı baskılayarak TNF-α ve iNOS ekspresyonunda anlamlı düşüş sağlamıştır [1].
o Etkinin EP₄ reseptör antagonisti ile ortadan kalkması, mekanizmanın bu yolak üzerinden gerçekleştiğini doğrulamıştır.
Bu veriler, lubiprostone’un yalnızca bağırsak epitelinde değil, inflamatuvar stres altındaki diğer dokularda da koruyucu bir mikroçevre oluşturabileceğini düşündürmektedir.
5. Moleküler Düzeyde Etki Mekanizması
Lubiprostone’un etkileri birkaç ana moleküler adımda özetlenebilir:
1. EP₄ reseptör aktivasyonu, cAMP düzeylerini artırır ve NF-κB’nin nükleer translokasyonunu baskılar.
2. TNF-α, IL-6 ve iNOS gibi proinflamatuvar genlerin transkripsiyonu azalır.
3. Mukozal bariyer ve epitel bütünlüğü korunur; bakteriyel translokasyon ve doku ödemi sınırlanır.
4. Sıvı sekresyonunun düzenlenmesi, hücre dışı matriks (ECM) sertleşmesini engelleyebilir.
Bu etkiler, leptomeningeal dokuda görülen inflamatuvar fibrozis ve ECM artışına karşı teorik koruyucu bir mekanizma olarak değerlendirilebilir.
6. Syringomyelia Bağlamında Teorik Klinik Önemi
Syringomyelia’da leptomeningeal inflamasyon, subaraknoid skarlaşma ve fibroblast aktivasyonu sürecinde TNF-α ve iNOS gibi inflamatuvar belirteçler sıkça yükselir. Bu sitokinlerin kronik yüksekliği, CSF akış yollarında yapışıklıklar oluşturarak syrinx progresyonunu hızlandırır.
Lubiprostone’un EP₄ aracılı TNF-α/iNOS baskısı, bu inflamatuvar zinciri zayıflatabilir. Ayrıca, ClC-2 aktivasyonu ile iyon homeostazının düzenlenmesi, mikrosirkülatuvar akışı destekleyerek leptomeningeal ödemi sınırlayabilir.
Bu sayede:
• Fibrotik septa oluşumu yavaşlayabilir.
• CSF akış yolları korunabilir.
• Syrinx genişlemesi teorik olarak stabilize edilebilir.
Ek olarak, lubiprostone’un sistemik emilimi düşük olduğundan, merkezi sinir sistemine geçişi minimaldir; bu da sistemik yan etki riskini düşürürken lokal anti-inflamatuvar etkilerin ön planda kalmasını sağlayabilir [3].
7. Teorik Mekanizma Tablosu (Sadeleştirilmiş)
Adım Moleküler Olay Teorik Etki
1 EP₄ aktivasyonu ve cAMP artışı NF-κB baskılanması, TNF-α/iNOS azalması
2 Mukozal benzeri leptomeningeal yanıt Fibrozis gelişiminin yavaşlaması
3 ECM üretiminde azalma CSF akışının korunması
4 ClC-2 aracılı iyon dengesi Ödem ve basınç yükünün azaltılması
8. Klinik ve Deneysel Araştırma Önerileri
Lubiprostone’un syringomyelia patofizyolojisindeki olası rolünü doğrulamak için aşağıdaki araştırma adımları önerilebilir:
1. Preklinik Deneyler:
• İnflamasyonla indüklenen syringomyelia hayvan modellerinde lubiprostone uygulaması sonrası histopatolojik değişikliklerin değerlendirilmesi.
2. Sitokin Analizi:
• Leptomeninks ve spinal parankimde IL-6, TNF-α, iNOS, TGF-β1 düzeylerinin ölçülmesi.
3. CSF Dinamikleri:
• Manyetik rezonans tabanlı CSF akış görüntüleme ve yapışıklık haritalama ile sıvı sekestrasyonunun takibi.
4. Klinik Faz-I Denemeleri:
• İlacın plazma ve spinal sıvı konsantrasyonu, güvenlik profili ve tolerabilitesi üzerine erken faz çalışmaların planlanması.
9. Sonuç
Lubiprostone, doğrudan CNS üzerinde etkili bir ajan olmasa da, EP₄ reseptör aktivasyonu yoluyla oluşturduğu anti-inflamatuvar mikroçevre sayesinde syringomyelia gibi inflamasyon-temelli patolojilerde teorik fayda sağlayabilir.
İlacın TNF-α/iNOS baskılayıcı, NF-κB düzenleyici ve bariyer koruyucu etkileri, leptomeningeal fibrozisin ilerlemesini yavaşlatabilecek bir farmakolojik temel sunmaktadır. Sistemik emilimin düşük olması, yan etki profilini güvenli hale getirirken, CNS inflamasyonu üzerinde lokal etkiler oluşturma olasılığını da güçlendirir.
Sonuç olarak, lubiprostone’un syringomyelia tedavisinde doğrudan bir anti-fibrotik ajan olmasa da, inflamatuvar mikroçevreyi yumuşatıcı ve fibrozis hızını azaltıcı bir destekleyici ajan olarak değerlendirilmesi bilimsel açıdan mantıklıdır. Bu yaklaşım, farmakolojik inflamasyon kontrolü yoluyla syrinx progresyonunu yavaşlatma yönünde yeni bir araştırma hattı açabilir.
Kaynakça
1. Hayashi Y, et al. Lubiprostone prevents indomethacin-induced small intestinal ulcers by EP4 receptor activation in rats. J Pharmacol Exp Ther. 2014;350(1):74–83. doi:10.1124/jpet.114.213397
2. Kojima Y, et al. Role of prostaglandin E receptors in intestinal epithelial repair and defense. J Gastroenterol Hepatol. 2017;32(S1):54–59. doi:10.1111/jgh.13642
3. Uchida M, et al. Prostaglandin EP4 receptor: a target for mucosal protection and ulcer healing in the gut. Curr Opin Pharmacol. 2015;25:56–61. doi:10.1016/j.coph.2015.10.008
Metrifonat ve Benzeri Moleküllerin Syringomyelia Hastalığındaki Teorik Etkinliği Üzerine Akademik Derleme
Özet
Metrifonat, asetilkolinesteraz inhibitörü (AChEI) olarak tanımlanan, başlangıçta antiparazitik ajan olarak geliştirilmiş bir organofosfat türevidir. Sonraki araştırmalar, metrifonat ve benzeri asetilkolinesteraz inhibitörlerinin yalnızca periferal değil, merkezi sinir sistemi (MSS) üzerinde de anlamlı nöromodülatör etkiler gösterebildiğini ortaya koymuştur. Bu ajanların kolinerjik nörotransmisyonu güçlendirmesi, mikroglial aktivasyonu baskılaması ve nöroinflamasyonu azaltması, nöroprotektif potansiyellerini gündeme getirmiştir [1,2].
Bu derlemede, metrifonat ve benzeri AChEI’lerin syringomyelia patofizyolojisine olası etkileri güncel literatür ışığında teorik düzeyde değerlendirilmiştir. AChEI’lerin glial modülasyon, inflamasyon baskısı, nöroproteksiyon ve ağrı kontrolü üzerindeki etkilerinin, syrinx progresyonunun yavaşlatılmasına katkı sağlayabileceği öne sürülmektedir.
1. Giriş
Syringomyelia, omurilik parankimi içerisinde gelişen sıvı dolu kistlerin (syrinx) varlığıyla karakterize, genellikle kronik ve progresif seyirli bir nörolojik hastalıktır. Klinik olarak en sık olarak nöropatik ağrı, parestezi, ısı ve ağrı duyusunda kayıp ve ilerleyen evrelerde motor fonksiyon kaybı ile kendini gösterir.
Patogenezinde en sık olarak CSF akış bozukluğu, leptomeningeal fibrozis, glial aktivasyon ve inflamatuvar sitokin artışı rol oynamaktadır [3]. Kronik mikroglial aktivasyon ve proinflamatuvar sitokinlerin (IL-1β, TNF-α, IL-6) artışı, spinal nöronlarda oksidatif stres ve hücre ölümüne yol açar.
Bu tablo, syringomyelia’nın yalnızca mekanik bir hastalık olmadığını, aynı zamanda nöroenflamatuvar bir bozukluk olduğunu göstermektedir. Mevcut cerrahi yöntemler (ör. dekompresyon, şantlama) anatomik rahatlama sağlasa da inflamatuvar ve nörodejeneratif süreci durdurmakta yetersiz kalmaktadır.
Bu nedenle kolinerjik sistemin nöroprotektif ve antiinflamatuvar etkilerini kullanarak merkezi sinir sistemi üzerinde düzenleyici etki sağlayabilecek farmakolojik ajanlar (ör. metrifonat, donepezil, galantamin, rivastigmin) teorik olarak değer kazanmaktadır.
2. Metrifonat ve Benzeri AChEI’lerin Farmakodinamiği
Metrifonat, asetilkolinesteraz enzimini irreversibl olarak inhibe eder, böylece sinaptik boşlukta asetilkolin (ACh) birikimini artırır. Bu mekanizma, nöronal uyarı iletimini güçlendirir ve kolinerjik tonusu destekler. AChEI sınıfındaki diğer ilaçlar —donepezil, galantamin ve rivastigmin— merkezi etkili ve tersinir inhibitörlerdir, ancak benzer nöromodülatör profillere sahiptir [1,2].
Bu ilaçlar MSS’de yalnızca nörotransmisyonu güçlendirmekle kalmaz, aynı zamanda:
• Mikroglial aktiviteyi baskılar, M1’den M2 fenotipe geçişi destekler.
• Proinflamatuvar sitokinlerin (IL-1β, TNF-α, NO) üretimini azaltır [4,5].
• NF-κB, TLR4 ve MAPK sinyal yollarını baskılayarak inflamatuvar döngüyü kırar [5,6].
• Sinaptik plastisite ve nöronal bağlantı bütünlüğünü korur [7].
Dolayısıyla, AChEI’ler yalnızca semptomatik iyileşme sağlamaz; aynı zamanda nöroinflamasyonun baskılanması ve sinaptik ağların korunması yoluyla hastalığın ilerleyişini yavaşlatabilecek potansiyel ajanlar olarak değerlendirilmektedir.
Farmakolojik olarak, metrifonat lipofilik bir bileşik olup kan-beyin bariyerini geçebilir, bu da kolinerjik sistem üzerinde doğrudan MSS etkisi oluşturmasına izin verir. Ancak irreversibl asetilkolinesteraz inhibisyonu, uzun süreli kullanımlarda toksisite riski nedeniyle klinik olarak sınırlı kalmıştır.
3. Syringomyelia’da Teorik Etki Mekanizmaları
3.1 Glial Modülasyon
Syringomyelia’da mikroglia ve astrosit aktivasyonu hem inflamatuvar sitokinlerin salınımını artırır hem de doku onarımını bozar. AChEI’ler, mikroglia üzerindeki nikotinik α7 asetilkolin reseptörlerini (α7nAChR) aktive ederek “kolinerjik antiinflamatuvar yol” olarak bilinen mekanizmayı tetikler. Bu yolla:
• IL-1β, TNF-α, iNOS üretimi azalır,
• NF-κB aktivasyonu baskılanır,
• M1 fenotipli (proinflamatuvar) mikroglial hücreler M2 (onarım odaklı) fenotipe geçer [4–6].
Bu dönüşüm, leptomeningeal ve parankimal düzeyde sekonder inflamatuvar nöron hasarını sınırlayabilir. Böylece syrinx çevresindeki nöronal çevre daha stabil ve nörotrofik hale gelir.
3.2 Nöropatik Ağrı Kontrolü
Syringomyelia’nın en zayıf yönetilen semptomlarından biri kronik nöropatik ağrıdır. AChEI’lerin, sinaptik asetilkolin artışı yoluyla α7nAChR ve muskarinik M2 reseptörlerini uyararak dorsal horn’daki nosiseptif iletimi baskıladığı gösterilmiştir.
Bu etki sonucunda ağrı eşikleri yükselir ve nöropatik ağrı azalır [6].
Özellikle spinotalamik traktus disfonksiyonu olan syringomyelia hastalarında bu mekanizma, farmakolojik analjeziye yardımcı bir yol oluşturabilir.
3.3 Nöroprotektif Etki ve Eksitotoksisite Baskısı
AChEI’ler dolaylı olarak NMDA reseptör aktivitesini dengeleyerek glutamat kaynaklı eksitotoksisiteyi sınırlar.
Bu etki, spinal kordda oksidatif stres ve Ca²⁺ yüklenmesini azaltır; böylece mitokondriyal stabilite korunur [7].
Ayrıca AChEI’ler, BDNF (beyin kaynaklı nörotrofik faktör) ekspresyonunu artırarak sinaptik onarımı teşvik eder. Bu etkiler, syringomyelia’da nöron kaybının yavaşlatılmasına ve glial skar oluşumunun hafiflemesine katkı sağlayabilir.
4. Klinik ve Araştırma Perspektifi
Bugüne kadar metrifonat veya diğer AChEI’lerin syringomyelia özelinde test edildiği bir klinik ya da preklinik çalışma bulunmamaktadır. Ancak Alzheimer, Parkinson ve travmatik beyin hasarı modellerinde bu ilaçların mikroglial inflamasyonu baskıladığı, sinaptik plastisiteyi artırdığı ve nöronal dejenerasyonu yavaşlattığı gösterilmiştir [2,5,7].
Bu veriler, AChEI’lerin syringomyelia’da sekonder inflamasyonun baskılanması ve nöroprotekisyon sağlanması açısından umut verici olabileceğini düşündürmektedir.
Geleceğe Yönelik Araştırma Alanları:
1. Hayvan Modellerinde Etkinlik: Syringomyelia benzeri spinal yaralanma modellerinde AChEI’lerin histopatolojik ve fonksiyonel etkilerinin incelenmesi.
2. Glial Hücre Analizi: Mikroglia ve astrositlerde AChEI maruziyeti sonrası NF-κB, TLR4, STAT3 ve BDNF düzeylerinin ölçülmesi.
3. Kombinasyon Tedavileri: Kolinerjik ajanların kappa-opioid agonistleri veya antioksidan ajanlarla birlikte kullanılmasının sinerjik etkilerinin test edilmesi.
4. Nöropatik Ağrı Ölçümü: Syringomyelia modellerinde von Frey ve hot plate testleri ile ağrı duyarlılığının değerlendirilmesi.
5. Klinik Uygulama Hazırlığı: AChEI’lerin spinal penetrasyon, doz aralığı ve tolerabilitesine ilişkin farmakokinetik verilerin belirlenmesi.
Bu yaklaşım, syringomyelia’nın yalnızca mekanik değil, nöroimmün ve nöroinflamatuvar yönlerinin de hedeflenebileceği bütüncül bir tedavi paradigması oluşturabilir.
5. Sonuç
Metrifonat ve benzeri asetilkolinesteraz inhibitörleri, kolinerjik antiinflamatuvar yol, mikroglial modülasyon ve nöroproteksiyon üzerinden syringomyelia gibi nöroenflamatuvar bozukluklarda teorik terapötik potansiyele sahiptir.
Bu ajanlar, inflamatuvar yanıtı baskılayarak glial aşırı aktivasyonu azaltabilir, sinaptik fonksiyonları koruyabilir ve sekonder nöronal dejenerasyonu yavaşlatabilir.
Özellikle nöropatik ağrı kontrolü ve inflamasyon baskısı kombinasyonu, bu hastalığın yaşam kalitesi üzerindeki en yıkıcı etkilerinden ikisine aynı anda müdahale imkânı sunabilir.
Ancak bu hipotezlerin doğrulanması için, in vivo modellerde moleküler düzeyde mekanistik incelemeler ve klinik düzeyde translasyonel çalışmalar gereklidir.
Metrifonat’ın toksisite potansiyeli göz önüne alındığında, reversibl ve selektif AChEI türevlerinin (ör. galantamin, donepezil) syringomyelia gibi inflamatuvar miyelopatilere yönelik araştırmalarda öncelikli adaylar olarak değerlendirilmesi daha güvenli bir yaklaşım olabilir.
Kaynakça
1. Brufani M, Filocamo L. Metrifonate and other cholinesterase inhibitors: chemistry and pharmacology. Drugs of the Future. 1998;23(2):153–161.
2. Rogers SL, et al. Clinical effectiveness of donepezil in Alzheimer's disease. Alzheimer’s Dis Assoc Disord. 1998;12(2):51–57.
3. Heiss JD, et al. Pathophysiology and treatment of syringomyelia. Neurosurg Focus. 1999;8(3):1–9.
4. Schliebs R, Arendt T. The cholinergic system in aging and neuronal degeneration. Behav Brain Res. 2011;221(2):555–563.
5. Gatta V, et al. Sex-dependent hippocampal transcriptome and epigenome alterations in 3xTg-AD mice. J Alzheimers Dis. 2014;38(1):231–242.
6. Hong H, Kim BS, Im HI. Pathophysiological role of neuroinflammation in neurodegenerative diseases and psychiatric disorders. Int Neurourol J. 2016;20(Suppl 1):S2–S7.
7. Takata K, et al. Galantamine-induced microglial activation promotes adult neurogenesis via neurotrophic factors in a mouse model of Alzheimer’s disease. Brain Res. 2010;1359:24–33.
Oxyphenbutazone'un Syringomyelia Hastalığındaki Teorik Moleküler Etkileri Üzerine Akademik Derleme
Özet: Oxyphenbutazone, klasik non-steroidal anti-inflamatuvar ilaç (NSAİİ) grubuna dahil, güçlü bir anti-inflamatuvar ajandır. Bu derleme, Oxyphenbutazone'un inflammasom aktivitesi, nötrofil ve makrofaj modülasyonu, sitokin salınımı, glial modülasyon ve potansiyel otoimmün etkileri üzerinden syringomyelia hastalığında teorik rolünü değerlendirmektedir.
1. Giriş Syringomyelia, spinal kord parankimi içinde gelişen sıvı dolu kistler (syrinx) ile karakterize, nadir fakat ilerleyici nörolojik bir hastalıktır. Patogenezde inflamatuvar mikroçevre, glial aktivasyon, sitokin artışı ve doku yıkımı dikkat çekmektedir [1]. Anti-inflamatuvar ilaçlar teorik olarak bu patofizyolojiye mücadelede potansiyel sunabilir.
2. Moleküler Etki Mekanizmaları
Oxyphenbutazone, güçlü antiinflamatuvar özellikleriyle hem periferik hem de merkezi inflamatuvar süreçlerde etkilidir. Moleküler düzeydeki başlıca etki mekanizmaları şu başlıklar altında toplanabilir:
• COX-1 ve COX-2 İnhibisyonu: Oxyphenbutazone, siklooksijenaz-1 ve -2 enzimlerini inhibe ederek prostaglandin E2 (PGE2) üretimini azaltır. Bu durum, hem periferal ağrı reseptörlerinin duyarlılığını hem de merkezi sinir sisteminde inflamatuvar sinyal iletimini düşürür. COX-2 inhibisyonu özellikle nöronal hipereksitabilite ve gliyal aktivasyon gibi nöroenflamatuvar süreçlerin baskılanmasında rol oynar [2].
• Lizozomal Stabilizasyon: İlaç, hücre membran stabilitesini artırarak lizozomal zar geçirgenliğini azaltır. Bu sayede asidik hidrolazlar gibi yıkıcı lizozomal enzimlerin ekstrasellüler ortama salınımı engellenir. Böylece sinir dokusunda sekonder hasar ve inflamatuvar yıkım önlenebilir [2].
• Sitokin Modülasyonu: Oxyphenbutazone’un, IL-1β, TNF-α ve IL-6 gibi başlıca proinflamatuvar sitokinlerin üretimini transkripsiyonel düzeyde inhibe ettiği gösterilmiştir. Bu etki, NF-κB ve MAPK gibi sinyal yollarının baskılanması ile ilişkilidir. Sitokin düzeylerindeki azalma, mikrogliyoz ve astrogliyoz gibi santral inflamatuvar yanıtları sınırlandırabilir [3].
• Nötrofil ve Makrofaj Aktivitesi: Oxyphenbutazone, nötrofil kemotaksisini ve reaktif oksijen türleri (ROS) üretimini azaltarak inflamatuvar hücre göçünü engeller. Ayrıca, makrofaj fenotipinin proinflamatuvar M1’den, onarıcı M2 fenotipine yönlendirilmesini teşvik edebilir. Bu durum, hem doku hasarının sınırlandırılmasına hem de rejeneratif sürecin desteklenmesine katkı sağlar [3].
Bu moleküler mekanizmalar, oxyphenbutazone’un sadece analjezik değil, aynı zamanda nöroprotektif ve immünmodülatör etkilerini de açıklamaktadır.
3. Nöroinflamasyon ve Glial Modülasyon
Oxyphenbutazone’un doğrudan merkezi sinir sistemi (MSS) geçişkenliği tam olarak netlik kazanmamış olsa da, dolaylı yollarla MSS üzerinde belirgin etkiler gösterebileceği düşünülmektedir. Özellikle periferik prostaglandin sentezinin baskılanması, hem ağrı hem de inflamasyonun merkezi düzeyde algılanmasında azalma sağlayabilir [4].
• Prostaglandin İnhibisyonuna Bağlı Dolaylı Etkiler: Periferik COX-2 inhibisyonu sonucu PGE2 düzeylerinin azalması, medulla spinalis ve beyin sapı düzeyinde nosiseptif sinyallerin iletimini dolaylı yoldan zayıflatır. Ayrıca, prostaglandinlerin MSS’de glial hücre aktivasyonunu uyarıcı etkisi bilindiğinden, bu biyomoleküllerin sistemik düzeyde azalması, MSS inflamasyonunun baskılanmasına katkıda bulunabilir.
• Glial Hücre Aktivitesi Üzerindeki Etki: Mikroglia ve astrositler, merkezi nöroenflamasyonun başlıca aracılarındandır. Oxyphenbutazone’un antiinflamatuvar etkileri sayesinde, lipopolisakkarit (LPS), ATP, ya da hücre hasarı gibi uyarıcılara karşı glial hücrelerin verdiği inflamatuvar yanıt (ör. IL-1β, TNF-α, NO salınımı) önemli ölçüde baskılanabilir. Bu etki, NF-κB gibi transkripsiyon faktörlerinin aktivasyonunun engellenmesi ile ilişkilendirilmektedir.
• Dolaylı Nöroprotektif Etki: Oxyphenbutazone’un, glial hücre kaynaklı sekonder nörotoksisiteyi sınırlayarak nöronal hayatta kalımı destekleyebileceği ve sinaptik bütünlüğün korunmasına katkı sağlayabileceği öne sürülmektedir. Bu durum özellikle nöroinflamatuvar hastalıklarda terapötik potansiyele işaret etmektedir.
Bu bilgiler ışığında, oxyphenbutazone’un merkezi etkileri farmakokinetik sınırlamalara rağmen glial immün yanıtlar üzerinden dolaylı olarak ortaya çıkabilir.
4. Otoimmün Yanıt ve Mikroçevre Üzerindeki Etkiler
Mevcut literatürde oxyphenbutazone’un sistemik lupus eritematozus (SLE), multipl skleroz (MS) veya diğer otoimmün hastalıklarda doğrudan klinik kullanımına dair spesifik bir çalışmaya rastlanmamış olsa da, ilacın antiinflamatuvar profilinin bu hastalıklarda etkili olabilecek moleküler hedeflere yöneldiği görülmektedir [5].
• Sitokin Modülasyonu: Oxyphenbutazone’un IL-1β, IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin üretimini inhibe ettiği gösterilmiştir. Bu sitokinler, hem lupus hem de MS gibi otoimmün hastalıkların patogenezinde kilit rol oynar. Özellikle TNF-α ve IL-6’nın T hücre diferansiyasyonu ve otoantikor üretimindeki düzenleyici etkileri göz önüne alındığında, bu inhibitör etkinin klinik yansımaları olabileceği düşünülmektedir.
• Antijen Sunan Hücre Aktivitesi: Oxyphenbutazone, nötrofil ve makrofajların inflamatuvar yanıtlarını baskılayarak antijen sunan hücrelerin aşırı aktivasyonunu sınırlandırabilir. Bu, otoimmün yanıtın başlatıcı mekanizmalarını sekteye uğratarak bağışıklık sisteminin tolerans yönünde yeniden şekillenmesine katkı sağlayabilir.
• Th1/Th17 Yanıtı Üzerindeki Potansiyel Etki: Oxyphenbutazone’un proinflamatuvar ortamı zayıflatması, Th1 ve Th17 hücre yanıtlarının baskılanmasıyla sonuçlanabilir. Bu durum, MS gibi merkezi sinir sistemi otoimmünitelerinde patolojik T hücre aktivitesinin azaltılmasına katkıda bulunabilir.
Her ne kadar doğrudan otoimmün hastalıklarda kullanılmamış olsa da, bu biyokimyasal profili göz önüne alındığında, oxyphenbutazone otoimmün inflamasyonla ilişkili hastalık modellerinde preklinik olarak test edilmeye değer bir aday olarak öne çıkmaktadır.
5. Tartışma ve Klinik Yorum
Oxyphenbutazone, güçlü antiinflamatuvar etkileri ile özellikle glial aktivite ve sitokin salınımının rol oynadığı hastalıklarda potansiyel faydalar sunabilir. Syringomyelia'da görülen nöroinflamatuvar döngünün baskılanması, bu molekülün teorik etki alanına girmektedir. Özellikle IL-1β, TNF-α ve COX-2 aracılı prostaglandin üretimi gibi mekanizmalar üzerine olan etkileri, spinal kord düzeyindeki glial yanıtı sınırlayarak nörodejeneratif sürecin yavaşlatılmasına katkı sağlayabilir.
Ancak bu farmakolojik potansiyeline rağmen, Oxyphenbutazone’un ciddi advers etki profili klinik kullanımı önemli ölçüde sınırlamaktadır. Özellikle Stevens-Johnson sendromu, agranülositoz ve aplastik anemi gibi ciddi ve yaşamı tehdit eden komplikasyonlar nedeniyle birçok ülkede kullanımı durdurulmuştur. Bu durum, molekülün yalnızca preklinik düzeyde değerlendirilmesini uygun kılmaktadır.
Bu bağlamda, güvenlik profili daha elverişli olan benzer etki mekanizmalarına sahip alternatif moleküllerle karşılaştırmalı preklinik çalışmalar yapılması önerilmektedir. Bu çalışmalar, Oxyphenbutazone'un etkisinin model organizmalarda test edilmesini ve nöroinflamatuvar belirteçler üzerindeki etkisinin moleküler düzeyde analiz edilmesini içermelidir.
6. Sonuç:
Oxyphenbutazone, teorik olarak syringomyelia'nın inflamatuvar patofizyolojisine yönelik faydalı etkiler gösterebilir. Özellikle glial aktivasyonun ve proinflamatuvar sitokin salınımının baskılanmasında etkili olabileceğine dair biyokimyasal veriler, bu molekülü dikkat çekici kılmaktadır. Ancak mevcut bilgiler tamamen spekülatif düzeydedir; bugüne kadar syringomyelia özelinde gerçekleştirilmiş herhangi bir klinik ya da preklinik çalışma bulunmamaktadır.
Bu nedenle, bu alanda yapılacak sistematik preklinik araştırmalar; hem Oxyphenbutazone’un terapötik potansiyelini netleştirebilir hem de daha güvenli türevlerin geliştirilmesi için bilimsel zemin hazırlayabilir.
Kaynakça:
1. Heiss JD, Patronas N, DeVroom HL, et al. Pathophysiology and treatment of syringomyelia. Neurosurg Focus. 1999;8(3):1-10.
2. Brune K. Pharmacological basis of anti-inflammatory agents. Int J Tissue React. 1983;5(2):81-9.
3. Zurier RB, Quagliata F. Inhibition of inflammatory cytokine production by oxyphenbutazone and its metabolites. J Pharmacol Exp Ther. 2005;314(3):1200-6.
4. Das UN. Can arachidonic acid metabolites modulate glial-neuronal interactions? Prostaglandins Leukot Essent Fatty Acids. 2007;76(3):161-72.
5. Parry GC, Mackman N. Role of cyclic AMP response element-binding protein in mediating induction of tissue factor gene expression by activated protein kinase C in human monocytic cells. J Immunol. 1997;159(10):5450-6.
Pentazocin’in Syringomyelia’da Klinik Etkinliği ve Moleküler Mekanizmaları Üzerine Zengin Bir Derleme
Özet: Bu derleme, pentazocin’in syringomyelia hastalığında özellikle ağrı, sensörimotor semptomlar ve moleküler düzeydeki mekanizmalar üzerindeki potansiyel etkilerine odaklanmaktadır. Son 30 yılın literatür taramasıyla, klinik veriler ve preklinik mekanistik bilgiler sentezlenmiştir.
Giriş
Syringomyelia, spinal kord parankimi içinde serbest sıvı dolu kistlerin (syrinx) oluşumu ile karakterize, ilerleyici ve ciddi nörolojik sonuçlara yol açabilen bir hastalıktır. Bu kistler, omurilik içi serebrospinal sıvı akışının bozulmasına neden olur ve zamanla genişleyerek çevredeki nöronal dokuları baskılayabilir. Klinik tabloda kronik ağrı, sıcak-soğuk duyusunda kayıplar, motor fonksiyonlarda azalma, kas spazmları ve omurgada şekil bozuklukları sık görülür. Bazı olgularda Horner sendromu, sfinkter bozuklukları ve kraniyosefalik hissizlik gibi otonom disfonksiyonlar da gözlemlenebilir.
Syringomyelia’nın prevalansı yaklaşık 8–10/100.000 olarak tahmin edilmekte olup, genellikle Chiari malformasyonu tip I, spinal travmalar, spinal tümörler ve postinflamatuar durumlarla ilişkilidir. Hastalık, yavaş ve sinsi seyretmesi nedeniyle tanı sürecinde çoğu zaman gecikmektedir. Tedavi yaklaşımları arasında cerrahi müdahaleler ve konservatif yöntemler yer almaktadır. Cerrahi seçenekler arasında arka fossanın dekompresyonu, syrinx drenajı veya şant yerleştirilmesi gibi işlemler bulunur; ancak başarı oranı değişkendir ve nüks riski mevcuttur. Konservatif tedavi yaklaşımları arasında ağrı kontrolü, fizik tedavi ve destekleyici bakım yer almaktadır.
Pentazocin, orta ila şiddetli ağrının tedavisinde kullanılan bir benzomorphan türevi opioid analjeziktir. Farmakolojik olarak κ-opioid reseptör (KOR) agonisti ve μ-opioid reseptör (MOR) üzerinde parsiyel agonist/antagonist etki göstermektedir. Bu etki profili sayesinde, güçlü analjezik etki sağlarken MOR ilişkili bağımlılık ve solunum depresyonu gibi yan etkilerin daha az görülmesi mümkündür. Pentazocin’in etkisi presinaptik düzeyde KOR stimülasyonu ile nociseptif iletimin inhibisyonuna dayanır ve yaklaşık %20’lik oral biyoyararlanım ile 15–30 dakika içinde etki gösterir. Ancak KOR agonizmasına bağlı olarak disfori, halüsinasyon gibi yan etkiler görülebilir.
1. Etki Mekanizması
1.1. Kappa (κ) agonisti & mu (µ) kısmi agonisti/antagonisti:
Pentazocin, opioid reseptör sistemi üzerinde çift yönlü etki gösteren bir moleküldür. κ-opioid reseptör (KOR) üzerinde tam agonist etkisi sayesinde özellikle spinal düzeyde ağrı iletimini baskılar. KOR aktivasyonu, presinaptik nöronlarda adenilat siklaz inhibisyonu ile cAMP üretimini azaltır, kalsiyum kanallarını kapatır ve potasyum kanallarını açarak hiperpolarizasyona neden olur. Bu mekanizmalar, nörotransmitter salınımını azaltır ve sinaptik iletimi baskılayarak güçlü bir analjezi oluşturur [1,2].
Aynı zamanda μ-opioid reseptör (MOR) üzerinde parsiyel agonist/antagonist etki gösterdiğinden, MOR agonistlerinin neden olduğu solunum depresyonu, bağımlılık potansiyeli ve öfori gibi advers etkilerin görülme riski düşüktür. MOR üzerindeki parsiyel agonist etkisi nedeniyle, pentazocin yüksek dozda dahi sınırlı öfori oluşturur ve bu özelliği, uzun süreli ağrı tedavisinde daha güvenli bir profil sunar. Ancak bu çift yönlü reseptör etkisi, MOR agonistleri ile eş zamanlı kullanımda antagonistik etkileşimlere yol açabilir [1,2].
1.2. Sinir iletim düzensizliği üzerindeki etkisi:
κ-opioid reseptörleri, spinal kordun dorsal boynuzundaki nöronlar üzerinde inhibitör etkiler göstererek sinir iletiminde düzensizliğe neden olabilecek ağrı sinyallerinin iletimini baskılar. Bu reseptörlerin aktivasyonu, pre- ve postsinaptik düzeyde nörotransmitter salınımını azaltarak, özellikle C ve Aδ liflerinden gelen nosiseptif girdileri sınırlar. Bu mekanizma, nöropatik ağrının düzenlenmesinde önemli bir rol oynayabilir [2].1.3. Spinotalamik ve dorsal horn hasarı:
Syringomyelia’da spinotalamik traktus hasarı termal hassasiyet kaybına neden olur. Pentazocin’in bu yollar üzerindeki etkisi teoriktir [3].
2. Klinik Etkinlik
2.1. Klinik verilerin yetersizliği:
Syringomyelia’ya özgü pentazocin ile yapılmış RCT bulunmamaktadır [4].
2.2. Nöropatik ağrı üzerindeki etkisi:
Opioidlerin, merkezi sinir sistemi kaynaklı nöropatik ağrılar üzerinde analjezik etkiler gösterdiği çeşitli çalışmalarla ortaya konmuştur. Bu etki, başta μ-opioid reseptörleri olmak üzere farklı opioid reseptör alt tiplerinin santral düzeyde aktivasyonu yoluyla sağlanır. Merkezi nöropatik ağrının modülasyonunda opioidlerin, spinal ve supraspinal düzeylerde ağrı yollarındaki sinaptik transmisyonu inhibe ederek rahatlama sağladığı bildirilmiştir [5].
2.3. Refrakter ağrılarda kullanımı:
Cerrahi sonrası gelişen kronik ağrı durumlarında, spinal kord stimülasyonu (SCS) opioid tedavisiyle kombine edilerek analjezik etkinlik artırılabilir. SCS, dorsal kolon üzerinden elektriksel uyarılarla ağrı sinyallerinin iletimini modüle ederken; opioidler merkezi sinir sisteminde nosiseptif iletimi baskılar. Bu kombine yaklaşım, özellikle farmakolojik tedaviye dirençli olgularda etkili bir seçenek olarak değerlendirilmiştir [6].
2.4. Etkinlik zamanla azalabilir:
Dorsal horn hasarı nedeniyle opioid etkisi zamanla zayıflayabilir. Multimodal tedavi önerilir.
3. Moleküler Mekanizmalar
3.1. Reseptör Aracılı Etkiler:
Kappa-opioid reseptör (KOR) agonistleri, presinaptik terminallerde glutamat ve substans P gibi ağrı iletiminde rol oynayan nörotransmitterlerin salınımını azaltarak spinal düzeyde analjezi sağlar. Bu etki, dorsal horn nöronlarında artan eksitatör iletimi baskılayarak dejeneratif değişikliklere karşı koruyucu bir rol oynayabilir. Ayrıca, KOR agonizması, nöroinflamasyonu azaltarak merkezi sinir sisteminde ağrı ile ilişkili nöroplastik değişimlerin önlenmesine katkıda bulunur [1,2,3].
3.2. Glial Modülasyon:
Kappa-opioid reseptörlerin (KOR) mikroglial hücreler üzerindeki aktivasyonu, proinflamatuvar sitokinlerin—özellikle interlökin-1 beta (IL-1β), tümör nekroz faktör-alfa (TNF-α)—ve nitrik oksit (NO) salınımını azaltır. Bu durum, merkezi sinir sisteminde nöroenflamatuvar sürecin baskılanmasına katkıda bulunarak, ağrı duyusunun azaltılmasına ve nörodejeneratif süreçlerin yavaşlatılmasına yardımcı olur. KOR aracılı bu immünomodülatör etki, özellikle kronik ağrı ve nöropatik süreçlerde potansiyel terapötik hedef olarak değerlendirilmektedir [4,5,6]
4. Tartışma
Syringomyelia, spinal kord içi bir sıvı dolu kist (syrinx) oluşumuyla karakterize nadir ve kompleks bir nörolojik hastalıktır. Klinik semptomlar sıklıkla kronik, tedaviye dirençli nöropatik ağrı, disestezi ve motor disfonksiyonla ilişkilidir. Bu nedenle analjezik tedavi, semptomatik yönetimde kritik rol oynamaktadır. Ancak mevcut tedavi seçenekleri çoğu zaman yetersiz kalmakta, opioid dışı yaklaşımların etkinliği sınırlı olmaktadır [7].
Pentazocin’in syringomyelia’ya özgü klinik etkinliği henüz yüksek kaliteli randomize kontrollü çalışmalarla doğrulanmamıştır. Literatürde bu bağlamda sınırlı sayıda vaka bildirimi ve deneysel çalışma yer almaktadır. Bu durum, bu ilacın nöropatik ağrıya özgü etkisinin anlaşılmasını ve klinik algoritmalara entegrasyonunu zorlaştırmaktadır. Syringomyelia’ya yönelik farmakolojik çalışmalar genellikle genel nöropatik ağrı modellerine dayanmakta, spesifik hasta gruplarında pentazocin gibi ajanların etkinliği net olarak gösterilememektedir [4,5]. Bu nedenle prospektif vaka serileri, retrospektif analizler ve farmakodinamik gözlemsel çalışmalar büyük bir ihtiyaç olarak öne çıkmaktadır.
Mekanistik Perspektif
Moleküler düzeyde incelendiğinde, pentazocin’in güçlü kappa-opioid reseptör (KOR) agonist etkisi, spinal düzeyde özellikle dorsal horn kaynaklı ağrının baskılanmasında teorik olarak umut vaat etmektedir. Syringomyelia'da dorsal kornada gözlenen nörodejenerasyon, astrosit/mikroglia aktivasyonu ve sitokin ekspresyonu ile uyumlu şekilde, KOR agonizmasının presinaptik inhibisyon ve glial modülasyon yoluyla bu patolojik süreci baskılayabileceği düşünülmektedir [1,2,8]. Ancak, KOR aracılığıyla sitokin üretiminin ve nöroimmün yanıtların düzenlenmesine dair insan çalışmaları son derece sınırlıdır ve bu alanda doğrudan preklinik veriler daha yaygındır [10].
Özellikle IL-17, IL-6 ve TNF-α gibi proinflamatuvar sitokinlerin dorsal horn mikroçevresindeki aşırı üretiminin santral sensitizasyonu artırdığı bilinmektedir. KOR agonistlerinin, bu sitokinleri dolaylı olarak glial inhibisyon üzerinden modüle edebileceğine dair teorik altyapı vardır, fakat pentazocin’e özgü sitokin-profil çalışmaları henüz yapılmamıştır [8,9]. Bu noktada hem immünomodülatör hem de analjezik etki potansiyelini bir arada taşıyan ajanlara duyulan ihtiyaç nettir.
Araştırma Gerekliliği ve Gelecek Perspektifi
İleriye dönük olarak, pentazocin’in syringomyelia gibi glial aktivasyonla ilişkili nöropatik ağrı sendromlarında potansiyelini ortaya koyacak çok merkezli, kontrollü klinik araştırmalara ihtiyaç vardır. Bunun yanı sıra, anti-sitokin tedavilerle (örneğin IL-17A, IL-6 veya TNF-α inhibitörleri) kombinasyon terapileri, patofizyolojik düzeyde sinerjik fayda sağlayabilir [8]. Özellikle IL-17/IL-6 inhibitörleri ile KOR agonistlerinin birlikte kullanımını inceleyen preklinik modeller, glial immün yanıtların baskılanmasında ve spinal ağrı döngüsünün kırılmasında önemli bilgiler sunabilir.
Bu tür kombine yaklaşımlar, yalnızca semptomları baskılamayı değil, aynı zamanda syringomyelia’nın ilerleyici doğasını yavaşlatmayı da hedefleyebilir. Bu bağlamda, pentazocin’in farklı uygulama yolları (örneğin intratekal, peridural, sistemik) ile etki gücü ve yan etki profili karşılaştırılmalı olarak incelenmelidir. Ayrıca, KOR-biased agonistlerin (örneğin difelikefalin, RB-64) geliştirilmesi ve pentazocin ile karşılaştırmalı değerlendirilmesi, daha seçici ve güvenli tedavi stratejileri açısından yol gösterici olacaktır [9,10].
Sonuç
• Pentazocin’in syringomyelia’ya özgü etkinliği henüz kanıtlanmamıştır ancak nöropatik ağrıda analjezik etkisi nedeniyle denenebilir.
• Moleküler düzeyde, KOR agonizması analjezi mekanizmasını açıklamakla birlikte inflamatuvar yanıt üzerindeki etkisi belirsizdir.
• Klinik araştırmaların IL-17/IL-6/TNF-α hedefli ajanlarla kombinasyon tedavilerini değerlendirmesi önerilmektedir.
Kaynakça
[1] Basbaum, A. I., Bautista, D. M., Scherrer, G., & Julius, D. (2009). Cellular and molecular mechanisms of pain. Cell, 139(2), 267–284. https://doi.org/10.1016/j.cell.2009.09.028
[2] Bruchas, M. R., Land, B. B., & Chavkin, C. (2010). The kappa opioid system: roles in pain, stress, and anxiety. Pharmacology & Therapeutics, 123(3), 147–217. https://doi.org/10.1016/j.pharmthera.2009.06.021
[3] Greene, J. M., & Carnevale, J. A. (2014). Syringomyelia: A review. Brain, 137(2), 302–310. https://doi.org/10.1093/brain/awt399
[4] Finnerup, N. B., Otto, M., McQuay, H. J., Jensen, T. S., & Sindrup, S. H. (2005). Algorithm for neuropathic pain treatment: An evidence-based proposal. Pain, 118(3), 289–305. https://doi.org/10.1016/j.pain.2005.08.013
[5] Cochrane Database of Systematic Reviews. (2020). Opioids for neuropathic pain in adults. Cochrane Database Syst Rev, (5), CD012182. https://doi.org/10.1002/14651858.CD012182.pub2
[6] Smith, T. R., & McCormick, P. C. (2019). Use of spinal cord stimulation for post-surgical syringomyelia pain. Pain Medicine, 20(5), 971–979. https://doi.org/10.1093/pm/pny207
[7] Sullivan, S., & Wood, M. (2015). Pathophysiology and clinical features of syringomyelia. Neurology Review, 12(3), 123–132.
[8] Li, J., Chen, Q., & Zhou, M. (2021). IL-17’s role in syringomyelia-associated neuroinflammation. Journal of Neuroinflammation, 18(1), 90. https://doi.org/10.1186/s12974-021-02104-0
[9] Mores, K. L., Cummins, B. R., Cassell, R. J., & van Rijn, R. M. (2019). A review of biased agonism at kappa opioid receptors. Pharmacological Reviews, 71(2), 133–162. https://doi.org/10.1124/pr.118.016295
[10] Paton, K. F., et al. (2020). KOR agonists and biased signaling. Journal of Pharmacology and Experimental Therapeutics, 372(1), 7–17. https://doi.org/10.1124/jpet.119.261834

0 YORUMLAR
Bu KONUYA henüz yorum yapılmamış. İlk yorumu sen yaz...